PCV2和PRRSV自然混合感染病猪的免疫组织化学诊断
(完整版)猪圆环病毒2型(PCV-2)及相关疾病

5、猪呼吸道病综合征(Porcine respiratory disease complex ,PRDC)
6、猪增生性和坏死性肺炎(Porcine proliferative and necrotizing pneumonia,PNP)
• PCV-2相关疾病包括:
1、断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome ,PMWS)
2、猪皮炎肾炎综合征(Porcine dermatitis and nephropathy syndrome,PDNS)
3、繁殖障碍(Reproductive failure)
具体预防程序为:
1、 母猪于产前和产后各7天用支原净加强力霉 素拌料。
2、3、7、21日龄各注射0.5~1ml得米先。 3、3天补铁及10天硒。 4、 10日龄注射PRRS苗(兰耳苗) 5、15日龄注射自家苗(个别过敏)。 6、25日龄猪瘟免疫3~4头份。 7、42日龄注射PR苗(伪狂犬基因缺失苗) 8、断奶后拌料用药20天阿奇霉素、氟苯尼考
及黄芪多糖;黄芪多糖、替米考星。
9、育肥期每月初用支原净加强力霉素拌料7天, 月末用氟苯尼考拌料4~5天。
特别观注:目前还没有真正效果良好的商品化疫 苗用于PCV-2的免疫接种。其主要原因是现有 条件下体外培养PCV-2的最佳条件还没找到, 人工培养时PCV-2含量不高,难以达到制作疫 苗的要求。临床上可选用病变最为严重的猪送 到实验室制作自家苗,这是目前全国通用的方 法。
猪圆环病毒2型(PCV-2)及相关疾病
猪圆环病毒2型(PCV-2)是目前已知的最小的动 物病毒之一,近几年来对养猪业造成了巨大的经济损 失,就连美国一些养殖场也因此而垂头丧气。我国近 年来随着养猪的大发展及猪群的大规模调动,各地均 的发生,为了进一步预防和控制本病,现就PCV-2及 其相关猪病进行探讨,以期帮助养殖场正确对待本病, 提高经济效益,减少不必要的损失。
PRRSV+CSFV+PCV2+HPS 混感病例的病理学研究

PRRSV+CSFV+PCV2+HPS 混感病例的病理学研究摘要:从pcr鉴定为“prrsv+csfv+pcv-2+hps”混合感染的7份猪只病例中选取病变较典型脾、肺、肝以及淋巴结等组织,肉眼观察其剖检病变之后,制成病理切片,在显微镜下观察其病理变化,并将观察结果与pcr鉴定结果相对照。
结果显示:“prrsv+csfv+pcv-2+hps”混合感染的7份病例无论是在剖检还是在镜下都具有相似的病变并且与pcr鉴定基本相符;7份病例的病变与其他猪呼吸道疾病引起的病变有很大的共性。
可见病理学研究,为我们诊断猪群疫病提供了诊断方向和必不可少的依据,但却不是唯一的依据,更多的时候还要通过临床诊断和实验室诊断。
关键词:“prrsv+csfv+pcv2+hps”;混感病例;病理学中图分类号:s85828文献标识码:a随着养猪业的不断发展,猪场的疫病也变得日渐多元化和复杂化,而猪繁殖与呼吸综合征(prrs)、猪瘟(csf)以及猪圆环病毒病依然是危害猪场最为严重的几类疫病之一。
prrs是由猪繁殖与呼吸综合征病毒(prrsv)所致的猪的种病毒性传染病,以妊娠母猪的繁殖障碍及各种年龄猪特别是仔猪的呼吸道疾病为特征[1],近年来已成为危害我国养猪业最严重的疾病,且疫情有逐年增长的趋势[2]。
猪圆环病毒病是由猪圆环病毒2型(pcv2)引起的以断奶仔猪多系统衰竭综合征和猪皮炎肾病综合征为代表的多种疾病的总称。
这两类疾病在猪场中广泛存在,给养猪业带来巨大的经济损失[3]。
csf是由猪瘟病毒(csfv)引起猪的一种急性、发热性、接触性传染病,其特征为发病急、高热稽留和毛细血管带变性,传染性强、病死率高[4]。
临床上prrsv与pcv2共感染普遍存在,共感染率高达83%[5],且病症远较单感染严重。
与此同时,副猪嗜血杆菌作为猪呼吸道综合征(porcine respiramry disease comprex,prdc)主要的继发性感染的细菌病原,近年来引起的发病率越来越高[6],特别是在prrsv和pcv2感染后,几乎总是伴随着副猪嗜血杆菌(hps)的感染[7,8]。
应用IIF和PCR方法对病猪肺泡巨噬细胞PRRSV、PCV2的检测

轻 轻 吹打 , 其 细 胞 团 及 粘 液 块 分 散 , 单层 无 菌 10目不 使 用 0 锈钢 筛 过 滤 , 集 全 部 灌 洗 液 , 0 / n离 心 5mi, 收 15 0rmi n 留沉
w s n n rme P at gs do , MWS 的 病 原 之 一 l 。 该 病 的 主要 症 状 i y ) 6 ] 为呼吸困难 、 疸 、 进性 消瘦 , 检可见淋 巴组织水肿 、 黄 渐 剖 问
mi,.1mo/ H 7 4的 P S洗 涤 3次 , n 00 l p . L B 自然 晾 干 ,一 O 2 ℃
淀 ; O 0 l H 7 4的 P S重 悬 细 胞 , 5 0 rmi 用 . 1mo/ p . L B 1 0 / n离
在 呼 吸 道疾 病 发 生 过 程 中作 用 日益 增 强 【 。 1 ] PR R S于 18 9 7年 在 美 国 首 次 报道 【 , 后 迅 速 蔓 延 至 全 3随 J 球 各 养猪 业 发 达 国 家 。 19 9 1年 由 荷 兰 学 者 在 L l t e s d用 猪 ya 肺 泡 巨 噬细 胞 分 离 到该 病 的 病 原 , 定 为 P R V【5。该 病 确 R S 4] . 以妊 娠 母 猪繁 殖 障 碍 、 猪 及 育 肥 猪 呼 吸 困难 , 乳 仔 猪 发 仔 哺 病 率 和死 亡 率 高 为特 征 , 养猪 业 造 成 了严 重 的 经 济 损 失 。 给
PRRSV与PCV2双重感染引发副猪嗜血杆菌感染病例的诊断
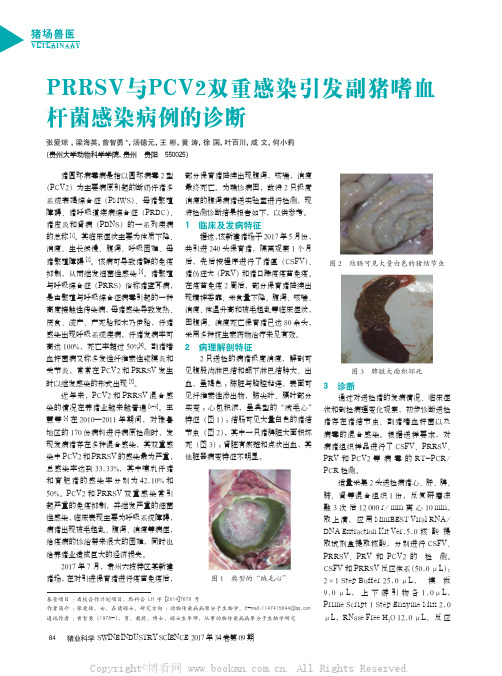
84猪业科学 SWINE INDUSTRY SCIENCE 2017年34卷第09期猪场兽医VETERINARYPRRSV与PCV2双重感染引发副猪嗜血杆菌感染病例的诊断张爱琼 ,梁海英,曾智勇*,汤德元,王 彬,黄 涛,徐 国,叶百川,咸 文,何小莉(贵州大学动物科学学院,贵州 贵阳 550025)猪圆环病毒病是指以圆环病毒2型(PCV2)为主要病原引起的断奶仔猪多系统衰竭综合征(PMWS)、母猪繁殖障碍、猪呼吸道疾病综合征(PRDC)、猪皮炎和肾病(PDNS)的一系列疾病的总称[1]。
其临床症状主要为体质下降、消瘦、生长缓慢、腹泻、呼吸困难、母猪繁殖障碍[2]。
该病可导致猪群的免疫抑制,从而继发细菌性感染[3]。
猪繁殖与呼吸综合征(PRRS)俗称猪蓝耳病,是由繁殖与呼吸综合征病毒引起的一种高度接触性传染病,母猪感染导致发热、厌食、流产、产死胎和木乃伊胎,仔猪感染出现呼吸系统疾病,仔猪发病率可高达100%,死亡率超过50%[4]。
副猪嗜血杆菌病又称多发性纤维素性浆膜炎和关节炎,常常在PCV2和PRRSV 发生时以继发感染的形式出现[5]。
近年来,PCV2和PRRSV 混合感染的情况在养猪业越来越普遍[6-8]。
王慧等[9]在2010—2011年期间,对豫鲁地区的170份病料进行病原检测时,发现发病猪存在多种混合感染,其双重感染中PCV2和PRRSV 的感染最为严重,总感染率达到33.33%,其中哺乳仔猪和育肥猪的感染率分别为42.10%和50%。
PCV2和PRRSV 双重感染常引起严重的免疫抑制,并继发严重的细菌性感染,临床表现主要为呼吸系统障碍,病猪出现被毛粗乱、腹泻、消瘦等病症,给疫病的诊治带来很大的困难,同时也给养猪业造成巨大的经济损失。
2017年7月,贵州六枝特区某新建猪场,在对引进保育猪进行疫苗免疫后,基金项目 :省校合作计划项目,黔科合 LH 字 [2014]7670 号作者简介 :张爱琼,女,在读硕士,研究方向 :动物传染病病原分子生物学。
猪圆环病毒1型、2型、3型SYBR_GreenⅠ实时荧光定量PCR鉴别方法的建立及应用

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:猪圆环病毒(PCV )包括猪圆环病毒1型(PCV1)、猪圆环病毒2型(PCV2)、猪圆环病毒3型(PCV3)。
近些年来,PCV1、PCV2、PCV3基因型之间存在共感染,因此建立一种快捷、特异、敏感的PCV1、PCV2、PCV3的SYBR Green Ι实时荧光定量PCR 鉴别检测方法显得尤为必要。
本试验通过特异性引物筛选,各项反应条件优化,建立了实时荧光定量PCR 鉴别方法。
结果表明:PCV1、PCV2、PCV3检测下限分别为40.3、25.2、22.4 copies/μL 。
与猪瘟病毒(CSFV )、猪繁殖与呼吸综合征病毒(PRRSV )、猪伪狂犬病病毒(PRV )、猪细小病毒(PPV )均无交叉反应。
批内及批间变异系数均小于1%。
对98份PCV 疑似阳性病料检测结果表明,PCV1、PCV2、PCV3感染率分别为10.2%、65.3%、53.1%,共感染率为7.1%。
该方法具有良好的特异性、敏感性和稳定性,为PCV1、PCV2、PCV3的早期检测、定量检测及后期研究提供了技术手段。
关键词:猪圆环病毒;特异性;敏感性;SYBR Green Ι实时荧光定量PCR 中图分类号:S852.65文献标志码:A文章编号:1674-6422(2023)06-0085-07D evelopment and Application of a SYBR Green Real-Time Quantitative PCR Method for Differentiation of Porcine Circoviruses 1, 2 and 3收稿日期:2021-05-24基金项目:山东省重大科技创新工程项目(2023CXGC010705);山东省现代农业产业技术体系项目(SDAIT-08-06);山东省自然基金(ZR2022MC011);济南市“新高校20条”资助项目(202228112);山东省科技型中小企业创新能力提升工程(2023TSGC0734);山东省农业科学院创新工程(CXGC2018E10, CXGC2023G03, CXGC2023E02, CXGC2023A21)作者简介:田瑶,女,硕士,主要从事动物病毒学与免疫学研究通信作者:李俊,E-mail:***************;韩先杰,E-mail:**********************猪圆环病毒1型、2型、3型 SYBR Green Ⅰ实时荧光定量PCR 鉴别方法的建立及应用田 瑶1,2,时建立2,彭 喆2,李 琛2,徐绍建2,吴晓燕2,3,李佳昕1,2,杨 莹2,3,王 硕2,刘 畅2,韩 红2,李 俊1,2,3,韩先杰1(1.青岛农业大学动物医学院,青岛266109;2.山东省农业科学院畜牧兽医研究所,济南250100;3.山东师范大学生命科学院,济南250100)2023,31(6):85-93Abstract: Porcine circovirus (PCV) includes three genotypes: Porcine circovirus 1 (PCV1), Porcine circovirus 2 (PCV2) and Porcine circovirus 3 (PCV3). In recent years, there have been co-infections among these 3 genotypes. Therefore, it is particularly necessary to develop a fast, specifi c and sensitive SYBR Green I real-time quantitative PCR method for differentiation of PCV1, PCV2 and PCV3. In this experiment, a real-time fl uorescent quantitative PCR method was developed by using specifi c primers and optimizing various reaction conditions. The results showed that the lower limits of detection were 40.3 copies/μL for PCV1, 25.2 copies/μL for PCV2 andTIAN Yao 1,2, SHI Jianli 2, PENG Zhe 2, LI Chen 2, XU Shaojian 2, WU Xiaoyan 2,3, LI Jiaxin 1,2,YANG Ying 2,3, WANG Shuo 2, LIU Chang 2, HAN Hong 2, LI Jun 1,2,3, HAN Xianjie 1(1. College of Veterinary Medicine, Qingdao Agricultural University, Qingdao 266109, China; 2. Institute of Animal Science and Veterinary Medicine , Shandong Academy of Agricultural Sciences, Jinan 250100, China; 3. College of Life Sciences, Shandong Normal University,Jinan 250100, China)· 86 ·中国动物传染病学报2023年12月猪圆环病毒(Porcine circovirus, PCV)是圆环病毒科圆环病毒属的一种无囊膜环状单链 DNA 病毒,也是迄今为止发现的具有自主复制能力的最小的动物病毒[1-2]。
PRRSV与PCV2混合感染的临床检测试验

G T T C G 3。 期扩增 长度 A A A T 一 预
为 2 4 p 6b。
出现 散发 性黄疸等 临床症状 。 感
P R V 上 游 引 物 : C G R S 5一 T
GATYGACGACAGRCACA 一3 !
TAGGGCTGTGGCCTT一 . 3 PCV2
下 游 引 物 各 05 L 灭 菌 水 . ,
1 . L D A 产 物 3 L 将 上 62 5 ,N 。
PV C 2基 因组 D A。具体操 作 方 N
法按试 剂盒 说 明书进 行。 将提取
后 的 D A产 物 置 一 0c N 2 c下保 存 备用。 1 病 料 中 P R V R A 的提 . 4 R S N 取 无 菌 采 取 送 检 的 肺 、淋 巴
维普资讯
P R V与 P V R S C 2混合感 染 的 临床检 测试 验
金苗苗, 张 敏, 栾慎 顺 , 国顺 沈 ( 阳农 业大学 畜牧兽 医学院 , 宁 沈 阳 10 6 ) 沈 辽 1 1 1
中图分 类号 :8 26 92 ¥5. . 5
1 P . 6 RRS 的 RT P R 检 测 V —C
述物 质 混合 均 匀 ,进 行 P R扩 C
增。P R反 应条件 是 :4c变性 C 9 c
3 mi 9 c 0 S 5 c 0 S n, 4 c 3 、 4 c 3 、
7 5 ,共 3 2c 4 c S 0个 循 环 ;2 c 7 c 延伸 1 mi。 1 L P R扩增 0 n取 0 C 产物 进行 凝胶 电泳 检测 。
送 检的发 病猪 的肺 、 巴结 、 。 淋 脾
免疫与未免疫猪圆环病毒疫苗对猪只抗体水平及生长性能的影响

992023年40卷第10期 SWINE INDUSTRY SCIENCE 猪业科学猪群保健H E A L T H猪圆环病毒病主要是猪圆环病毒2型(Porcine Circovirus 2,PCV-2)感染而引起的多种传染性疾病的总称,对于猪只有严重的免疫抑制作用,引起猪圆环病毒2型系统性疾病(PCV2-SD )、猪圆环病毒2型繁殖性疾病(PCV2-RD )、猪免疫缺陷综合征、猪皮炎与肾病综合征(PDNS )、断奶仔猪多系统衰竭综合征(PMWS )、猪腹泻综合征等,还常引发猪伪狂犬病、猪支原体肺炎、猪蓝耳病等多种并发病,给养猪业造成了严重的经济损失。
目前对于该病的主要预防措施是疫苗免疫,这也是最高效的手段。
同时科学的饲养与管理、生物安全、栏舍设计、疫苗接种时间、饲养方式等都能够改变 PCV-2 相关疾病的发生与传染。
因此,本试验主要是探究在猪场较好的饲养管理、严格的生物安全制度下,21日龄仔猪免疫与未免疫猪圆环病毒疫苗对其抗体水平及生长性能的影响,为当前形势下降本增效、疫苗使用等提供理论依据。
1 材料与方法1.1 试验材料试验分为2个组,A 组(免疫免疫与未免疫猪圆环病毒疫苗对猪只抗体水平及生长性能的影响王勤华 *,吴丽艳,杨雪松(佳和农牧股份有限公司,湖南 长沙 410000)*通信作者:王勤华(1990—),女,研究生学历,农学硕士,E-mail :****************,为本文第一作者疫苗组)使用疫苗为某厂家猪圆环病毒灭活疫苗,B 组(未免疫组)断奶仔猪不注射任何圆环疫苗。
1.2 试验设计与分组选择某规模猪场21日龄健康、体重相近、品种一致的断奶仔猪104头随机分成2组,每组52头,分4个重复(栏),每个重复13头;育肥阶段从上阶段组内挑选56日龄的健康、体重相近仔猪64头,组内随机分组 ,每组32头,分4个重复(栏)。
试验猪全程只有A 组(免疫疫苗组)在21日龄时注射某厂家的猪圆环病毒疫苗。
PRRSV、PCV2、PRV、CSFV 疫苗间的相互干扰作用

70猪业科学 SWINE INDUSTRY SCIENCE 2016年33卷第6期猪场兽医VETERINARY相关研究表明,猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)会引起猪的繁殖障碍性疾病或呼吸道疾病。
这些疾病对养猪业危害极大,我国是养猪大国,疾病防控便显得尤为重要,而研究疾病及其相关疫苗又是防控疾病必不可少的。
免疫过程中免疫程序的安排是影响免疫效果的重要因素,因此我们需要了解疫苗间的相互作用,避免免疫失败。
1 猪瘟及其疫苗1.1 猪瘟与猪瘟病毒猪瘟(CSF)是由猪瘟病毒(CSFV)引起的猪的一种急性或慢性、热性和高度接触性传染病,可引起各种年龄阶段的猪发病。
猪瘟病毒属于黄病毒科瘟病毒属,为单股正链RNA 病毒。
猪瘟主要发生于亚洲大部分国家和地区、中美及南美、非洲及欧洲部分国家。
世界动物卫生组织(OIE)将猪瘟列为A 类传染病,中国农业部将其列为一类传染病,是我国目前猪强制免疫的主要传染病之一。
CSF 可以感染任何一个生长阶段的摘 要:近年来,我国猪病毒病疫情越来越复杂,其中猪繁殖和呼吸综合征(PRRS)、猪圆环病毒病(PCVD)、猪伪狂犬病(PR)以及猪瘟(CSF)是公认的影响全球养猪业的重大疾病。
为了防控疫情,控制猪场传染病迫在眉睫,其关键在于疫苗免疫接种。
当疫苗进入动物体后诱导机体产生特异性免疫应答,从而达到免疫预防作用。
同时,一种疫苗诱导产生的免疫应答反应又可能对另一种疫苗免疫产生影响,能够增强疫苗免疫效果或干扰疫苗免疫,因此研究疫苗间的相互作用是十分重要的。
近年研究发现,CSFV 与PRRSV 疫苗同时免疫时的免疫效果不如单独免疫;在PCV2阳性猪场免疫PCV 疫苗能够显著增强CSFV 疫苗的免疫效果,降低疾病风险;同时对母猪免疫CSFV 疫苗和PRV 疫苗可以有较好的免疫反应,2种疫苗在生产实践中并无干扰作用;其他疫苗之间的相互作用还有待进一步研究。
猪圆环病毒病及防控措施

猪圆环病毒病及防控措施刘本权 /辽宁省丹东市东港农业综合行政执法队 118300刘成军/辽宁省盖州市梁屯动物卫生监督所 115205摘 要:感染猪圆环病毒(PCV)会引发猪系统功能障碍性等疾病,临床上以仔猪先天震颤(CT)、断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)以及呼吸、繁殖障碍等为主要表现形式。
PCV在我国猪群中具有阳性率高、传播面广且常伴随其它病毒和细菌的混合感染的特点,给养猪业经常造成严重的经济损失。
自发现猪圆环病毒(PCV)以来,专家学者们一直针对该病毒从各个方面进行深入研究,尽可能降低其对养猪业造成的危害。
本文对PCV病原、流行特点、发病特点等进行简要介绍,以及对相关防控措施进行分析阐述,为PCV的防控等提供技术参考。
关键词:猪圆环病毒;防控措施猪圆环病毒(PCV)属于圆环病毒科圆环病毒属,为闭环单股负链DNA病毒,无囊膜,是世界迄今为止已知的最小的动物病毒之一。
截至目前,已发现4种猪圆环病毒,分别为猪圆环病毒1型(PCV1)、猪圆环病毒2型(PCV2)、猪圆环病毒3型(PCV3)、猪圆环病毒4型(PCV4)。
1 猪圆环病毒1.1 PCV1 PCV1最早发现于1974年,普遍存在于猪体内,但对猪无明显的致病性。
但相关文献报道,PCV1全基因组中大多数核苷酸序列与PCV2全基因组核苷酸序列具有高度一致性,且PCV1可能具有潜在致病性或影响猪只感染疫病后病情的发展。
1.2 PCV2 我国于2000年首次报道PCV2感染,目前在养猪业中,PVC2的感染已呈全球性流行,给养猪业造成严重的经济损失,且几乎不可能实现净化。
PCV2传播方式多样,通过消化道、呼吸道、胎盘、精液均可传播,对不同年龄、品种的猪均可实现感染,是引起猪群免疫抑制性疾病的主要病原之一。
在我国猪群中也具有感染率高、流行时间长、污染面广,与其他病原如猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、细小病毒(PPV)、以及副猪嗜血杆菌链球菌、放线杆菌等多种细菌混合感染较严重等流行特点。
广西猪细小病毒与PRRSV、CSFV、PCV2、PRV混合感染的检测

广西猪细小病毒与PRRSV、CSFV、PCV2、PRV混合感染的检测黄 夏1,陈义祥2,何 丹2,蒙雪琼1,陈芳芳2,胡丽萍2,赵国明2,磨龙春2(1.广西大学动物科学技术学院,广西南宁530005;2.广西兽医防疫检疫站,广西南宁530001)中图分类号:S858.285.3 文献标识码:A 文章编号:1002-5235(2007)02-0054-03摘要:应用PCR技术,对广西南宁、玉林、贵港、柳州、钦州和桂林6个市的10个规模化猪场送检的141份病猪组织样品进行猪细小病毒(P PV)的检测;同时,对鉴定为P PV阳性的样品进行了猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CS2 FV)、猪圆环病毒2型(PCV2)和猪伪狂犬病毒(PRV)的检测,以确定猪群中PPV与其它病毒混和感染情况。
结果,所有样品诸病毒的阳性检出率达17173%(25/141);流产胎儿PPV阳性率为19157%(9/46),繁殖障碍母猪扁桃体的PPV阳性率为17174%(11/62),发病断奶仔猪组织病料的P PV阳性率为15115%(5/33),P PV与PR RSV、CSFV、PCV2和/或PRV4种病毒均有混合感染现象,混合感染样品占PPV阳性样品的48100%(12/25)。
关键词:猪细小病毒(P PV);混合感染;检测猪细小病毒(Porci ne parvovi rus,PPV)是引起猪繁殖障碍的重要病原体之一,主要表现为母猪流产、不孕、产死胎、木乃伊胎及弱仔等特征,不表现其它临床症状,其它猪感染后也无明显的临床症状[1]。
从20世纪60年代中期,相继从欧洲、美洲、亚洲的许多国家分离到病毒或检出抗体,我国已先后在北京,上海、吉林、黑龙江、四川和浙江等地分离到了PPV,该病在世界各地猪场广泛存在[2]。
PPV通过病猪和带毒猪,可水平传染又可垂直传染,消化道、交配和胎盘感染是最常发生的传染途径。
一旦传入猪场,会在短期内感染全群,加之病毒抵抗力强,使本病难以控制和根除[3]。
亚临床症状猪群中PRRSV和PCV2的感染情况

亚临床症状猪群中PRRSV和PCV2的感染情况蔡汝健;蒋智勇;张乐宜;宋长绪【摘要】[目的]了解亚临床症状猪群中PRRSV和PCV2的感染情况.[方法]选择7个有PRRSV和PCV2感染史且有亚临床症状的猪群,通过ELISA和PCR的相结合方法检测其PRRSV和PCV2的感染情况.[结果]ELISA检测结果表明,所有猪场12周龄仔猪PRRSV和PCV2抗体能观察到血清抗体转化.PCR结果表明约3/7的猪场8周龄仔猪PRRSV呈阳性,12和20周龄仔猪PRRSV呈阴性;8~20周龄有不同比例仔猪PCV2呈阳性.[结论]在亚临床症状猪群中PRRSV的感染主要在8~ 12周龄,而PCV2在8~20周龄都有感染.【期刊名称】《安徽农业科学》【年(卷),期】2015(000)009【总页数】3页(P99-101)【关键词】猪群;亚临床症状;PRRSV;PCV2;感染【作者】蔡汝健;蒋智勇;张乐宜;宋长绪【作者单位】广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广东广州510640;广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广东广州510640;广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广东广州510640;广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,广东省畜禽疫病防治研究重点实验室,广东广州510640【正文语种】中文【中图分类】S852.65+1猪繁殖与呼吸综合征病毒(PRRSV)和猪圆环病毒2型(PCV2)是影响世界各地养猪业的重要病毒[1-2],并给养猪户造成巨大的经济损失[3-4]。
调查发现,猪群中通常存在PRRSV 和PCV2 的混合感染的情况[5]。
与单一的病原感染相比,混合感染能引起明显的临床症状,造成更大的经济损失,但在有感染历史而现阶段为亚临床症状的猪场PRRSV和PCV2的感染情况鲜有报道。
猪的疾病 猪圆环病毒2型感染 的知识和防治

猪的疾病猪圆环病毒2型感染的知识和防治一、概述:猪圆环病毒2型感染(Porcine circovirus type 2 infection)是由猪圆环病毒2型所引起的一系列疾病的总称,包括猪断奶后多系统衰竭综合征(PMWS)、猪皮炎-肾病综合征(PDNS)、繁殖障碍、肺炎、肠炎、先天性震颤等。
1991年加拿大首次爆发该病,随后世界上许多国家和地区都有该病的报道。
在我国,2000年通过血清学调查证实了北京、河北、天津、江苏、上海等地的猪群中存在PCV2感染抗体。
2001年,与PCV2感染相关的猪断奶后多系统衰竭综合征开始在南方地区流行,2002年全国各地规模化猪场暴发猪断奶后多系统衰竭综合征,给我国养猪业造成了相当大的经济损失。
目前,本病已经遍及世界各养猪国家,已成为养猪生产中突出的问题之一。
近期研究表明,PCV2与猪皮炎与肾病综合征(PDNS)、猪的流产和繁殖障碍、猪增生性坏死性肺炎(PNP)和猪先天性脑震颤(CT)等的发生密切相关。
PCV2常与猪呼吸与繁殖综合征病毒(PRRSV)或猪细小病毒(PPV)并发感染或继发细菌感染,使患病猪病情加重,死亡率升高。
二、病原:猪圆环病毒2型(PCV2)属圆环病毒科(Circoviridae)圆环病毒属(Circovirus)。
是一种小而无囊膜、二十面体、共价闭合、环状的单股DNA病毒,病毒粒子直径平均为17nm,分子量为0.58×106Da。
PCV2在氯化铯中浮密度为1.37g/cm3,蔗糖梯度离心的沉降系数为52S,对pH 3的酸性环境、氯仿作用或高温环境(70℃)有较强的抵抗力。
不凝集牛、羊、猪、鸡等多种动物和人的红细胞。
PCV2完整的基因组大小多数为1768bp,少数为1767bp。
各分离株之间核苷酸序列的同源性大于96%,而与PCV1分离株之间的核苷酸序列的同源性小于80%。
PCV1和 PCV2的ORF1的核苷酸和推导氨基酸序列的同源性分别为83%和86%,而ORF2的仅为67%和65%。
猪圆环病毒2_型和3_型检测方法建立及初步应用

·研究论文·摘 要:为快速检测并鉴别猪圆环病毒2型(PCV2)和猪圆环病毒3型(PCV3)病毒。
本文研究参考GenBank 中PCV2和PCV3高度保守片段分别设计了探针引物,成功建立了一种双重TaqMan 荧光定量检测方法。
结果显示:该方法特异性好,可鉴别 PCV2、PCV3与其他猪病病毒;PCV2最低检测下限为1.00×101 copies/µL ,PCV3最低检测下限为1.00×100 copies/µL ;重复性高,批内、批间的变异系数分别为0.01%~0.02%和0.02%~0.05%;本研究采用建立的方法与商品试剂盒同步检测猪只样品440份,PCV2样品符合率为97.47%,PCV3样品符合率为96.85%;测序结果显示,PCV2均为2d 亚型,PCV3均为3c 亚型。
结果表明,建立的双重TaqMan 荧光定量检测方法具有良好的特异性、敏感性且快速、准确,节约成本,可为PCV2和PCV3的监测与防控提供技术支撑。
关键词:PCV2;PCV3;双重TaqMan qPCR 方法建立;混合感染中图分类号:S852.651 文献标志码:A 文章编号:1674-6422(2024)02-0151-09Establishment and preliminary application of detection methods forPCV2 and PCV3LI Tong, ZHAO Runze, LI Botian, LI Chunqi, WANG Yan, GUO Liwei, YANG Xiaolin, LIU Gouping(Y angtze University, Jingzhou 434000, China)收稿日期:2023-10-16基金项目:荆州市2022年度自然科学研究专项(202254-07CC);石首市先行县“先进技术集成示范基地建设与定向攻关”揭榜项目(SS202311);生猪健康养殖省部共建协同创新中心创新平台项目(2019H2209)作者简介:李桐,女,硕士研究生,预防兽医学专业通信作者:刘国平,E-mail:******************猪圆环病毒2型和3型检测方法建立及初步应用李 桐,赵润泽,李博天,李春琪,王 妍,郭利伟,杨小林,刘国平(长江大学,荆州434000)Abstract: Rapid detection and identification of PCV2 and PCV3. In this paper, probe primers were designed with reference to highly conserved fragments of PCV2 and PCV3 in GenBank, and a dual TaqMan fluorescence quantitative detection method was successfully established. The results show that this method has good specifi city and can distinguish porcine circovirus type 2 and porcine circovirus type 3 from other porcine disease viruses. The minimum detection limit of PCV2 is 1.00×101 copies/µL, and that of PCV3 is 1.00×100 copies/µL; The repeatability is high, and the coefficient of variation between batches is 0.01% ~ 0.02% and 0.02% ~ 0.05%, respectively. In this study, 440 pig samples with clinical symptoms such as reproductive disorder, panting, emaciation and pallor, skin infl ammation were collected from large-scale pig farms in Hubei Province, and the established method and commercial kit were used for synchronous detection. The coincidence rate of PCV2 and PCV3 were 97.47% and 96.85%, respectively. The sequencing results showed that PCV2 was subtype 2d, and PVC3 was subtype 3c. The dual TaqMan fl uorescence quantitative detection method was characterized by good specifi city, sensitivity, rapidity, accuracy and cost saving. It can provide technical support for monitoring and prevention of PCV2 and PCV3.Key words: PCV2; PCV3; Establishment of dual TaqMan qPCR; mixed infectionChinese Journal of Animal Infectious Diseases中国动物传染病学报2024,32(2):151-159· 152 ·中国动物传染病学报2024年4月猪圆环病毒(Porcine circovirus,PCVs)是目前已知最小的动物病毒,为圆形、无包膜、单股负链DNA,属于圆环病毒科(Circoviridae)圆环病毒属[1]。
宜宾市PRRSV和PCV2感染的流行病学调查

C 2疫苗免疫 的断奶 仔猪 随机 抽样 经 P R 和 P V RS C 2疫苗免疫的仔猪 。 由 于 猪 繁 殖 与 呼 吸 道 综 合 征 P V 的方 式 进 行 。 2 结 果 (R S 引起猪只严重 的免疫抑制 , PR) 常 . 继发或 伴发细菌和病毒性感染 , 已成 1 12 调查方式 :采取流 行病学调 2 1 流行病学调查结果 .. 为当前危 害养猪 业最严 重 的传 染病 查和血清 学检验 的方式进行 。 近 几年 以来这 些猪场 都不 同程 度存 在着母 猪流产 、 死产 、 乃伊胎 木 之 一 ; PV 感 染 是 近 年 来 继 P R 12 血 清 学 检 测 而 C2 RS . 初生仔猪断奶后 出现皮肤苍 之 后的又一 严重危 害养 猪业 的病毒 均 采 用 酶 联 免 疫 吸 附 试 验 ( 的现象 , 白、 染 、 黄 或皮肤 表面有 红色或 紫色 性传染病 , 引起 P w 是 M S的原发病原 。 E I A 方 法 进 行 。 LS ) 的 小 丘 疹 、 巴结 肿 大 , 血 、 淋 充 出血 , 近 年 来 ,该 病 的 发 生 呈现 上 升趋 势 , 1 2 1 E IA检测方法: 1 .. LS ()检 测方 部分猪场保育猪 出现过 并 且 与 P RV混 合 感 染 病 例 增 多 , RS 给 法 : 使 用 蓝 耳 病 及 圆 环 病 毒 2型 肾脏 土黄色 ; LS 抗 由深 圳 绿 诗 耳 、 肢 、 部 发 绀 呈 蓝 紫 色 症 状 , 四 脐 死 我 国养 猪 业 造 成 了相 当 大 的 经 济 损 E IA 体 检 测 试 剂 盒 ( 这些猪场均 已 。生产批 亡率和淘汰率均较高 。 失,严重威胁着养猪业 的健康发 展, 源 生物技术有限公司提供) 口蹄疫 、 伪狂 犬病等 疫 已成为猪 群 的又一重 要免疫 抑制 性 号为 2 0 0 , 0 9 2 按试 剂盒说 明书操作程 免疫过猪 瘟 、 但免疫效果并不很理想 。 疾病 。 序 进行检 测 ; 2 检测 蓝耳 病 时, () 以 苗 , . LS 为 了对这 两种病 在 宜宾市 的流 空 白对照调零 , 在酶标 仪上测各孔 的 2 2 血清 学 E IA检 测 结 果 经 E IA检测 ,2个适度规模猪 LS 1 行情况有一个 比较全面 的了解 , 为制 0 6 0 D 3 值,试验成立 的条件是阳性对 D3 RS 39 定综合 防制措施奠 定基础 ,0 8年 1 照 孔 平 均 0 6 0值 大 于 或 者 等 于 场 P RV血清 抗体 阳性 率较 高 ,2 20 RS血清抗体 0 6 阴 性 对 照 孔 平 均 0 6 0 必 须 份受检样 品中,检 出 P R ., D3 值 月至 20 09年 8月我 们对 宜 宾市 1 2 0份 总 18 , . 圆环病 毒 为 02 。样 品 阳性数 17 , 阳性率为 3 .% 各 .) 个适 度规模 猪场 的 3 9份未 经 两种 小 于 0 1 ( 2 疫苗免疫的猪血清进行 了调查, 现将 06 0值 大 于 03 ( 环 病 毒 为 猪 场 之 间 阳 性 率 波 动 范 围 为 0 ~ 13 ) .2 圆 % 6 5 。检 出 PV C 2血清 抗体 阳性 数 结果报告如下。 04 ) 判 为阳性 , 品 0 60值 小于 8 . % .2 , 样 D3 0 总 86 , 1 材 料 和方 法 03 ( .2 圆环病毒为 0 3 ) .8 判为阴性 , 检 12份, 阳性率 为 2 .% 各猪场之 间血清抗体 阳性率波 动范围为 0 ~ % 1 1 流行病学调查 . 测 圆环 病 毒 时 样 品 06 0值 介 于 D3 8.% 3 8 ,两种病双血清抗体阳性数 7 2 1 11 调 查范 围 :宜 宾市 1 .. 2个适 0 3 ~O4 . 8 .2之间, 判为可疑 。 .. 共 2 分 双 19 。结 果 见表 1 。 度规模猪场 , 养殖母猪规模 在 i0 0 头 12 2 血 样 : 计 39份 血 清 , 别 份 , 阳 性 率 2 .% 2 以上 。调 查采 取 对 未 经 过 P R R S及 采 自宜 宾市 1 个适度规模 养猪场未 3 小结与讨论
猪圆环病毒致病机理

猪圆环病毒的致病机理第一是PCV2引起的免疫抑制和多系统衰竭这是最先发现的一个PCV2的致病手段。
最早报道的PCV2造成的疾病就是仔猪断奶后多系统衰竭综合症(PMWS)。
PMWS最典型的病变在于淋巴组织,全身淋巴结肿大,在显微镜下(观察病理组织学切片),淋巴组织当中的淋巴细胞显著减少,而巨嗜细胞则明显增多,占据了原来淋巴细胞的位置。
这样不难想象,淋巴细胞的衰竭减少导致了免疫抑制。
但是另一点应该注意到的是,增生的巨嗜细胞在干什么呢?一方面当然巨嗜细胞吞噬PCV2的抗原,但是另一方面他们却释放很多细胞因子。
06年一篇韩国的研究就证明了在患有PMWS的猪的血液里面,肿瘤坏死因子(一种细胞因子,并非只有在肿瘤的情况下产生)的含量明显高于正常猪。
各种细胞因子能调节体内的各种炎症反应以及身体的各种代谢(这种调节不一定都是往好的方向调节的,具体机理非常复杂,这里不说明了),而过多的细胞因子分泌则会导致身体正常生理平衡的失调,被认为是导致多系统衰竭的一个因素(可能不是唯一因素)。
第二就是PCV2引起的超敏反应何谓超敏反应?说浅显了就是机体要来对付外来病原或异物的一些免疫反应,但是在某些情况下免疫反应过度了,在消除病原和异物的同时伤害了自己的身体。
与PCV2相关的第二种疾病就是皮炎肾病综合症(PDNS)。
PDNS一般发生的日龄要比PMWS晚一点,在北美不会与PMWS同时出现在一个猪身上,但是在欧洲却发现这样的情况。
PDNS的病变在皮肤和肾脏。
皮肤是斑块状的红色至褐黑色的变化,在病理组织学切片上面可以看到这些变化是由于皮下的小血管炎症引起的,由于小血管炎症造成出血和血管的栓塞,而受血管供应的皮肤组织则因为血管栓塞而造成的缺血缺氧发生坏死(梗死),这些坏死和出血就造成了临床上面看到的皮肤红色到黑色的斑块状变化。
肾脏的病变跟猪瘟的肾脏有点相像,都是出血点的变化,但是不一样的是PDNS的肾脏出血点似乎更加广泛,分布也相对规则(这个是需要一点经验去判断的)。
应用PCR 方法对一起疑似感染猪瘟病毒的检测

91 2014年 第3期 SWINE INDUSTRY SCIENCE 猪业科学猪群保健H E A L T H参考文献[1] Pijpers A,van Nieuwstadt A P, Terpstra C,et al.Porcine epidemic diarrhea virus as a cause of persistent diarrhea in a herd of breeding and finishing pigs[J].Vet Rec 1993,132:129-131.[2] Pensaert M B, Debouck P. A new coronavirus-like particle associated with diarrhea in swine[J]. Arch Virol,1978,58(3):243-247.[3] 上海市农科院畜牧兽医研究所猪传染性胃肠炎课题组.鉴定“猪 传染性胃肠炎”华株病毒为猪流行性腹泻病毒[J].中国兽医科技,1983(7):8-15.[4] 宣华,刑德坤,王殿浪,等.应用猪胎肠单层细胞培养猪流行性腹泻病毒的研究[J].中国人民解放军兽医大学学报,1984,4(3):202-208.[5] 田小艳,孙华,邓雨修,等.3种致猪腹泻病毒的多重RT-PCR 检测[J].动物医学进展.2009,30(9):54-57.[6] 陈强,曾丽莉,俞伏松,等.规模化猪场仔猪腹泻4种病原的感染情况调查[J].福建农业学报,2010,25(1):8-13.[7] 甘海霞,梁晟,韦显凯,等.2011年广西猪群猪流行性腹泻和猪传染性胃肠炎调查[J].动物医学进展,2012,33(10):125-127.[8] Li Z L, Zhu L, Ma J Y,et al. Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China[J].Virus Genes,2012:1-5.[9] 肖博仁.湖南地区猪流行性腹泻病毒的分子流行病学和血清流行病学调查[D].长沙:湖南农业大学,2012.[10] 郑逢梅,霍金耀,赵军,等.2010—2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J].病毒学报,2013,29(2):197-205.[11] 霍金耀,陈陆,赵军,等.2010—2012年华中地区猪流行性腹泻病毒流行毒遗传进化分析[C]//中国畜牧兽医学会动物传染病学分会第12次人兽共患病学术研讨会暨第6届第14次教学专业委员会论文集.2012:314-320.[12] 刘孝珍,刘胜旺,冯力.2011年中国猪流行性腹泻病毒分子流行病学初步调查[D].哈尔滨:东北农业大学,2012.(收稿日期:2013-11-21)2013年12月,贵州省某猪场10日龄左右的仔猪发生体温升高、下痢、皮肤发红、极度消瘦为特征的急性传染病,并导致仔猪大量死亡,临床诊断初步怀疑是猪瘟病毒(CFSV)感染。
PCV和PRRSV、沙门氏菌混合感染

猪沙门氏菌病在患有PMWS并发感染PRRSV的猪只中情况摘要:对来自4个爆发了沙门氏菌病的农场的14头病猪进行了调查研究。
这些病猪的肿大的淋巴结可以看到淋巴细胞缺失的肉芽肿炎症。
通过PCR反应可以发现DNA病毒,在损害的组织中PCV2抗原可以被标记。
此外,蓝耳病病毒抗原可以在在肺部被免疫标记,猪肺疫沙门氏菌在感染的猪只中被分离出来。
在感染了沙门氏菌的猪只中,5只(55.6%)有沙门氏菌病和PMWS的猪同时感染了PRRSV,比单独感染沙门氏菌和PMWS(22.2%)或单独感染沙门氏菌并和PRRSV(22.2%)的要高很多。
关键词:PMWS PRRSV 沙门氏菌病近些年,PMWS被认作是引起全球性猪养殖业巨大损失的最重要的原因之一。
在感染的猪只中,PMWS可以早曾淋巴细胞减少和淋巴组织的严重损伤,从而造成继发性免疫缺陷。
并发性传染性病毒,例如PPV,ADV,PRRSV,都从感染了PMWS的猪只中分离了出来。
人们知道实验性的同时感染了PCV2和PRRSV或者PPV的猪只中,只表现出PMWS损伤或者临床症状。
近些年来,除了PMWS之外,猪沙门氏菌病,特别是在沙门氏菌病大面积爆发后的猪肺疫,有了让人担忧的增长。
PRRSV加重了这些病猪的临床症状。
但是,目前为止,这些严重的临床疾病发生的原因,还没有被充分的讨论过。
在目前的研究中,我们报告了四个经历了高死亡率的猪肺疫和PMWS混合感染的猪场,来确定PMWS的发生与增长的原因之间是否有一些联系。
在1999年与2002年之间,在日本千叶的4个大规模养猪场中,约为40-90日龄的断奶仔猪表现出几个月的渐行性的体重减轻,厌食,严重的呼吸困难,耳廓两边发绀,发热。
腹泻并不是常见的临床症状。
来自A和B农场的病猪在疾病暴发后的几个月送到了我们的实验室。
来自D农场的猪只在爆发期间送到实验室。
来自C农场的猪只中,有4头在爆发期间送了过来,有2头在4个月之后送了过来。
当病猪第一次被送来的时候,4个农场的猪只死亡率分别是A:4.2%,B:11.0%,C: 25%,D:33.3%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PCV2和PRRSV自然混合感染病猪的免疫组织化学诊断摘要:对7例疑似为PCV2-PRRSV自然混合感染病猪的组织样本采用常规HE 染色和免疫组织化学SABC法染色进行了病理学观察及组织内两种病毒的检测,并利用NIS-Elements高清晰度彩色图文分析系统记录观察结果。
HE染色结果显示组织病理变化主要表现为增生性坏死性肺炎、坏死性淋巴结炎、卡他性肠炎、淋巴结内包涵体形成及肝脏肝窦单核巨噬细胞增生。
免疫组织化学SABC法染色结果显示3例为PCV2-PRRSV抗原阳性,2例为PCV2抗原阳性。
在自然感染状态下,PCV2-PRRSV混合感染是比较常见的,其组织病理变化与单独感染时区别不显著。
关键词:猪;PCV2;PRRSV;混合感染;HE;IHCAbstract:Pathology observation and two kinds of viruses detection in tissues were carried out on 7 swine tissue samples suspected to be natural PCV2-PRRSV coinfection. The embedded tissue was sliced continuously for HE and immunohistochemical SABC staining. The observation was recorded by using NIS-Elements high-resolution colour graphic analysis system. The histopathological changes mainly were proliferative necrotizing pneumonia,necrotic lymphadenitis,mucoenteritis,body in lymph node,and hepatic sinus mononuclear phagocyte proliferation. PCV2-PRRSV mixed infection(3 cases)and PCV2 infection(2 cases)were shown in the result of immunohistochemical SABC staining. In the natural infection,PCV2-PRRSV coinfection was more common. The histopathological changes of coinfection with separate infection had no significant difference.Key words:swime;PCV2;PRRSV;coinfection;HE;IHC猪圆环病毒病和猪繁殖与呼吸综合征是严重阻碍养猪业发展的传染病之一,其病原分别为猪2型圆环病毒(PCV2)和猪繁殖与呼吸综合征病毒(PRRSV)。
PCV2和PRRSV对养猪业真正的危害并不表现在其单独感染时,而是由于其免疫抑制作用而导致的混合感染或继发感染。
在自然感染病例中,最为常见的是PCV2-PRRSV混合感染,PCV2-PRRSV混合感染引起的临床症状和病理变化与其他病原体引起的呼吸系统疾病和免疫抑制病极为相似,很难表现出典型的特征[2]。
仅仅根据流行病学、临床症状和病理变化很难对PCV2-PRRSV混合感染作出诊断,需要结合实验室诊断方法作出综合诊断[1,2]。
该试验应用免疫组织化学SABC法检测了PCV2和PRRSV在7例疑似PCV2-PRRSV自然混合感染病猪组织中的分布,并结合组织的病理变化特征对混合感染病例作出诊断,了解PCV2和PRRSV混合感染的致病特点,为PCV2-PRRSV自然混合感染的研究提供一定的参考。
1 材料与方法1.1 材料1.1.1 组织材料1份已知未感染PCV2和PRRSV的肠组织石蜡蜡块,1份人工感染PCV2、1份人工感染PRRSV和1份人工PCV2-PRRSV混合感染的共4份肠组织石蜡蜡块,以及来自于7头疑似为PCV2-PRRSV混合感染病猪的组织石蜡蜡块均为华中农业大学动物医学院病理实验室保存。
1.1.2 试剂抗PCV2单克隆抗体(工作浓度为1∶600)、抗PRRSV单克隆抗体(工作浓度为1∶600)均由华中农业大学何启盖教授惠赠,多聚赖氨酸和即用型SABC试剂盒购自武汉博士德生物工程有限公司。
1.2 方法将保存的组织蜡块作连续切片(厚4 μm),一份备作常规HE染色,一份备作免疫组化染色(SABC法),染色后光学显微镜观察,应用NIS-Elements高清晰度彩色图文分析系统采集图片,进行组织病理学结果分析。
2 结果与分析2.1 HE染色结果肺组织可见间质性肺炎,肺泡壁增厚,肺泡上皮细胞增生,肺泡腔内有坏死脱落的细胞及巨噬细胞(图1A,B)。
淋巴结组织可见多个坏死灶,皮质部淋巴细胞缺失,局部有成团的中性粒细胞,小梁上有中性粒细胞浸润。
淋巴小结内可见大量的巨噬细胞,细胞质内有圆形均质碱性的包涵体(图2A,B)。
肠道组织可见肠绒毛脱落,肠腺上皮细胞杯状细胞化,黏膜血管扩张,黏膜上皮脱落,固有膜内有浆细胞、淋巴细胞浸润,淋巴小结增多,淋巴小结内淋巴细胞缺失(图3A,B)。
脾脏组织白髓内淋巴细胞减少,可见吞噬异物的巨噬细胞。
肝脏组织肝窦明显增宽,巨噬细胞明显增多。
2.2 免疫组化SABC法染色结果在7头疑似PCV2-PRRSV混合感染病猪中,经检测,3头猪的组织样本为PCV2-PRRSV混合感染(42.86%),2头猪的组织样本为PCV2单独感染(28.57%),2头猪的组织样本没有检测到病毒(28.57%),检测到阳性信号的组织器官主要是肺、淋巴结、肠道、脾脏和肝脏。
肺组织中,PCV2强阳性信号出现在肺巨噬细胞细胞质内(图1C),支气管黏膜上皮也可见阳性信号,有些核也被着染为黄色;PRRSV阳性信号出现在Ⅱ型肺泡上皮细胞和肺巨噬细胞细胞质内,可见肺泡腔内坏死脱落的肺泡上皮细胞和巨噬细胞内强阳性信号(图1D)。
淋巴结中,巨噬细胞细胞质内可见PCV2强阳性信号的包涵体(图2C);PRRSV强阳性信号出现于巨噬细胞细胞质内(图2D),偶见核着染。
肠道组织中,浆细胞、肠腺杯状细胞细胞质和黏膜上皮内PCV2强阳性信号,淋巴小结内巨噬细胞细胞质可见阳性信号(图3C);浆细胞、肠腺潘氏细胞和黏膜上皮内可见PRRSV强阳性信号,淋巴小结巨噬细胞细胞质内可见阳性信号(图3D)。
脾脏组织中,脾小体淋巴细胞和巨噬细胞细胞质内可见PCV2弱阳性信号。
肝脏组织中,肝窦内皮细胞和巨噬细胞细胞质内可见PCV2强阳性信号。
3 小结与讨论该试验中感染病猪的组织病理学检查显示出现了PCV2-PRRSV混合感染的组织病理变化,主要表现为增生性坏死性肺炎、坏死性淋巴结炎、坏死性肠炎、脾脏脾小体淋巴细胞缺失和肝脏肝窦增宽、巨噬细胞增多,并且在淋巴结巨噬细胞内有均质碱性包涵体,这些病变是PCV2-PRRSV混合感染病例的病理变化特征[3,4],而且在PCV2-PRRSV抗原检测均呈阳性的病猪与PCV2抗原检测呈阳性的病猪之间没有明显区别。
免疫组织化学SABC法检测到PCV2抗原主要出现在肺、淋巴结、肠道、脾脏和肝脏,但是并没有在肾脏组织中检测到PCV2抗原;检测到PRRSV抗原主要出现在肺、淋巴结和肠道,但是在脾脏中未检测到PRRSV抗原。
该试验检测到PCV2和PRRSV均在感染细胞的细胞质内,主要的感染细胞是单核细胞和巨噬细胞,但是不在同一个细胞内,PCV2在淋巴结形成包涵体的巨噬细胞内,而PRRSV出现在另一些巨噬细胞内。
肺组织内,PRRSV阳性信号主要出现在巨噬细胞和Ⅱ型肺泡上皮细胞细胞质内。
分析认为PCV2和PRRSV侵入猪体,分别进入不同的巨噬细胞内定居增殖,由于大量的巨噬细胞受侵害,致使机体免疫系统功能下降不能形成有效的保护机制,导致机体免疫抑制的产生[5-8]。
参考文献[3] 温永俊,吴国军,蔡雪辉,等.猪圆环病毒和猪繁殖与呼吸综合征病毒混合感染对仔猪致病性的评估[J].中国预防兽医学报,2007,29(5):336-340.[4] FENAUX M,HALBUR P G,HAQSHENAS G,et al. Cloned genomic DNA of type 2 porcine circovirus is infectious when injected directly into the liver and lymph nodes of pigs:characterization of clinical disease,virus distribution ,and pathologic lesions[J]. J Virol,2002,76(2):541-551.[5] HARMS P A,SORDEN S D,HALBUR P G,et al. Experimental reproduction of severe disease in CD/CD pigs concurrently infected with type 2 porcine circovirus and porcine reproductive and respiratory syndrome virus[J]. Vet Pathol,2001,38(5):528-539.[6] 李燕华,郭鑫,杨汉春,等.猪繁殖与呼吸综合征病毒与猪圆环病毒2型共感染猪组织中猪繁殖与呼吸综合征病毒抗原的分布[J].中国兽医杂志,2009,45(1):9-12.[7] 吕艳丽,杨汉春,郭鑫,等.猪圆环病毒2型的分离与鉴定[J].中国兽医杂志,2004,40(2):14-18.[8] MORANDI F,OSTANELLO F,FUSARO L,et al. Immunohistochemical detection of aetiological agents of proliferative and necrotizing pneumonia in Italian pigs[J]. J Comp Path,2010,142(1):74-78.。
