pGEX-4T-1
抗PLA2G13多克隆和单克隆抗体的制备与鉴定

抗PLA2G13多克隆和单克隆抗体的制备与鉴定(作者:___________单位: ___________邮编: ___________)作者:李淑珍, 刘莹, 陈苗, 柳晓兰, 唐小波, 高建恩, 朱大岭, 孙启鸿【摘要】目的: 制备分泌型的磷脂酶A2 G13(group XIII secreted phospholipase A2, PLA2G13)的多克隆抗体(pAb)和单克隆抗体(mAb), 并对抗体进行特性鉴定。
方法: 以人正常肝cDNA 文库为模板, 构建重组表达质粒pGEX-4T-1-PLA2G13(即PLA2G13-GST)和pET-32a-PLA2G13(即PLA2G13-His)。
PLA2G13-GST融合蛋白作为免疫原制备兔pAb和鼠mAb。
采用Western blot鉴定兔抗人PLA2G13 pAb的特异性。
采用Western blot 和Immunohistochemistry鉴定鼠抗人PLA2G13 mAb的特异性。
结果: PLA2G13-GST和PLA2G13-His融合蛋白在均大肠杆菌中以包涵体形式大量表达。
Western blot鉴定表明, 兔抗人PLA2G13 pAb 可特异地识别HepG2细胞系中相对分子质量(Mr)约19700的蛋白, 与文献报道中PLA2G13的实际Mr相符。
通过筛选共获得8株可稳定分泌抗PLA2G13的杂交瘤细胞株, Western blot鉴定表明6株可识别重组人PLA2G13蛋白, 免疫组织化学鉴定显示2株可特异性识别正常肝组织中的PLA2G13蛋白。
结论: 成功地制备了抗人PLA2G13兔pAb和鼠mAb, 为进一步研究PLA2G13的功能提供了特异性检测工具。
【关键词】PLA2G13 原核表达融合蛋白抗体制备分泌型的磷脂酶A2 G13(group XIII secreted phospholipase A2, PLA2G13)是分泌型磷脂酶家族的成员之一, 基因定位于10q22.1, 包含195个氨基酸, 相对分子质量(Mr)约21400, 主要存在于细胞外基质, 成熟型PLA2G13 Mr约19700, 其结构特征类似于磷脂酶家族另一个成员PLA2G12, 但二者的组织分布呈现很大差别[1]。
大鼠CaM(nNOS)-pGEX-4T-1原核表达载体构建及蛋白表达

大鼠CaM(nNOS)-pGEX-4T-1原核表达载体构建及蛋白表
达
孟利;杜彩萍
【期刊名称】《中国科技纵横》
【年(卷),期】2022()24
【摘要】构建CaM(nNOS)-pGEX-4T-1原核表达载体,转化于大肠杆菌BL-21细胞,并诱导蛋白的表达。
以全长nNOS-pME18S重组体为模板,采用PCR扩增目的基因,克隆入原核表达载体pGEX-4T-1;将重组成功的重组子CaM(nNOS)-pGEX-4T-1转化入BL-21细胞,加入诱导剂IPTG诱导CaM(nNOS)蛋白的表达,用SDS-PAGE及免疫印迹方法鉴定CaM(nNOS)的表达。
CaM(nNOS)-pGEX-4T-1表达载体成功构建。
在诱导温度为16℃,IPTG为0.5mmol/L条件下,诱导时间为20h,可在大肠杆菌中大量表达CaM。
重组CaM(nNOS)-pGEX-4T-1原核表达载体成功构建,蛋白表达成功。
【总页数】3页(P123-125)
【作者】孟利;杜彩萍
【作者单位】徐州医科大学
【正文语种】中文
【中图分类】R916
【相关文献】
1.大鼠热休克因子结合蛋白1原核表达载体的构建及表达
2.大肠杆菌γ-ggt原核表达载体pGEX-4T-1/γ-ggt的构建及其蛋白表达
3.原核表达载体pGEX-4T-
1/Snapin的构建和表达鉴定4.大鼠D-双功能蛋白基因原核表达载体的构建及表达5.pGEX-4T-1/Tα1-TP5原核表达载体的构建及表达
因版权原因,仅展示原文概要,查看原文内容请购买。
玉米磷酸丙糖异构酶基因的克隆及原核表达

玉米磷酸丙糖异构酶基因的克隆及原核表达马芳芳;苏彦冰;张彬;李红英;韩渊怀【摘要】为克隆玉米(Zea mays L .)磷酸丙糖异构酶基因 ZmT PI ,并进行序列分析和原核表达研究,根据玉米 T PI 基因的 cDNA 全长序列设计特异引物,以玉米叶片总 RNA 为模板,采用RT‐PCR 方法扩增得到了约750 bp 的基因编码区cDNA 片段,T /A 克隆后进行了序列测定及序列分析,随后将克隆到的该基因片段构建到原核表达载体PGEX‐4T‐1上,得到的重组表达质粒GST‐ZmTPI 转化Bl21进行融合蛋白的诱导表达及纯化。
结果显示,玉米 ZmT PI (GenBank :EU959275)cDNA 全长1216 bp ,753 bp 开放阅读框编码250个氨基酸,推测分子量26.7205 kDa ,理论等电点为5.12;该蛋白具有高度保守的 TIM 结构域,与其它高等植物的同源蛋白有很高的相似性;进化树分析表明,玉米 TPI 与甘蔗亲缘关系最近,处于同一进化支;SDS‐PAGE 检测结果显示,成功诱导表达并且纯化了与预期大小一致的融合蛋白。
玉米 ZmTPI 蛋白的基因克隆和原核表达及纯化的成功,为进一步研究目的蛋白的酶活性质及生物学功能奠定了基础。
%ZmT PI gene cloned from Zea mays was expressed in E .coli Bl21. In this work ,based on the full‐length cD‐NA sequences of maize T PI gene ,a cDNA coding region fragment about 750 bp was amplified using RT‐PCR method from total RNA of maize leaves and cloned into the prokaryotic expression vector PGEX ‐4T‐1 ,resulting the recombi‐nant plasmid of GST‐ZmTPI .The resulting construct GST‐ZmTPI was then transformed intoE .coli Bl21 for further analysis .Results showed that the ZmT PI (GenBank :EU959275) cDNA sequence is 1 216 bp in length and has an open reading frame (ORF) of 753 nucleotides ,encoding a protein of 250amino acids with a predicted molecular mass of approximately 26.7205 kDa polypeptide and an isoelectric point of 5.12 ;The ZmTPI protein has highly conserved TIM domain ,and was highly similar with its homologous proteins in other plants ;phylogenetic analysis showed that the de‐duced amino acid sequence of ZmTPI was most similar to that of Saccharum o f f icinarum ,indicating that they belong to the same evolutionarybranch ;SDS‐PAGE assay showed that the fusion protein was successfully expressed and puri‐fied with the expected size .The ZmT PI gene was cloned and successfully expressed and purified in E .coli Bl21. This study will provide a foundation for further research on biological function of this protein .【期刊名称】《山西农业大学学报(自然科学版)》【年(卷),期】2016(036)006【总页数】7页(P381-386,438)【关键词】玉米;磷酸丙糖异构酶;基因克隆;原核表达【作者】马芳芳;苏彦冰;张彬;李红英;韩渊怀【作者单位】山西农业大学农学院,山西太谷 030801; 农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031;山西农业大学农学院,山西太谷030801; 农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031;山西农业大学农学院,山西太谷 030801; 农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031;山西农业大学农学院,山西太谷 030801; 农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031;山西农业大学农学院,山西太谷 030801; 农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031【正文语种】中文【中图分类】S513;Q78磷酸丙糖异构酶(Triosephosphate isomerase,TPI)能够催化二羟丙酮磷酸(DHAP)和D型甘油醛-3-磷酸(GAP)这两种丙糖磷酸异构体之间的可逆转换[1,2],作为糖酵解及糖异生途径中的关键酶,TPI被发现几乎存在于所有的生物体当中[3,4]。
pGEX序列载体的区别

PlasmidpGEX-3XNameSource/Vendor AmershamPlasmid Size 4952Notes thrombin or factor Xa protease sites to cleave protein from fusion.pGEX-1lambdaT, pGEX-4T-1, pGEX-5X-1 accept cDNA from lambdagt11 libs. Hosts: E.coli. Related vectors: p4.5, pS, pGEX-1, pGEX-2T.(Information source: VectorDB.)Link /vectordb/vector_descrip/PGEX3X.html View SequencePlasmidSequencepGEX-6P-1Vendor:AmershamVector Type: BacterialViral/Non-viral: NonviralStable/Transient: TransientConstitutive/Inducible: ConstitutivePromoter: tacExpression Level: High (activate with IPTG)Backbone size: 4900Sequencing Primer: pGEX FwdSequencing Primer Sequence: 5'd[GGGCTGGCAAGCCACGTTTGGTG]3'Tag: GST (Nterm)Bacteria Resistance: AmpicillinMammalian Selection: N/aCatalog Number: 27-4597-01Comments:PreScission� cleavage site allows cleavage at low temps; can directly insert cDNA from lambda gt11 libraries1 多克隆位点(MCS)酶切点不同;2 GST和MCS之间均含有凝血酶或者Xa因子的切割位点.选择GE的表达载体原因很简单,爱屋及乌,使用他们的载体可以方便下一步的纯化。
大肠杆菌_ggt原核表达载体pGEX_4T_1_ggt的构建及其蛋白表达

大肠杆菌γ2ggt原核表达载体pGEX24T21/γ2ggt的构建及其蛋白表达胥俊峰,单建华,赵宁伟,殷志敏 (南京师范大学生命科学学院,江苏南京210046)摘要 构建大肠杆菌γ2谷氨酰转肽酶原核表达载体pG EX24T21/γ2ggt及表达与鉴定目的蛋白,为进一步利用该酶催化合成茶氨酸等目的产物奠定了基础。
以大肠杆菌DH5α总DNA为模板,用PCR法在γ2ggt编码序列上下游引入酶切位点并扩增出γ2谷氨酰转肽酶基因;将γ2ggt编码序列克隆入原核表达载体pG EX24T21的相应酶切位点;用PCR鉴定重组质粒pG EX24T21/γ2ggt,并对插入基因片断测序;重组质粒pG EX24T21/γ2ggt转化大肠杆菌B L21(DE3),经乳糖诱导后用S DS2PAG E分析表达产物,并经W estern blot鉴定。
获得大肠杆菌γ2谷氨酰转肽酶基因,并成功构建到原核表达载体pG EX24T21上,转化有pG EX24T21/γ2ggt工程菌B L21(DE3)经1g/L乳糖诱导1h后即开始表达目的蛋白,在诱导6h后表达蛋白量达到最高,随着时间的延长,目的蛋白没有被降解,此蛋白主要以包涵体形式存在,W estern blot鉴定了此目的蛋白。
成功构建了大肠杆菌γ2谷氨酰转肽酶原核表达载体pG EX24T21/γ2ggt,并进行了目的蛋白的鉴定。
关键词 γ2谷氨酰转肽酶;克隆;表达中图分类号 Q936 文献标识码 A 文章编号 0517-6611(2007)30-09467-03Construction and Ch aracterization of R ecombinant P rok aryotic V ector pGEX24T21/γ2ggtXU Jun2feng et al (C ollege of Life Science,Nanjing N orm al University,Nanjing,Jiangsu210046)Abstract T o design and construct an prokary otic ex pression vector pG EX24T21/γ2ggt,and to ex press Escherichia coliγ2glutam yl transpeptidase,the Bgl Ⅱand X h oⅠsites were incorporated into theγ2ggt encoding fragm ent by PCR.A fter digesting w ith BglⅡand X h oⅠ,theγ2ggt encoding fragm ent was cloned into the prokary otic ex pression vector pG EX24T21at the corresponding BamHⅠand X h oⅠsites.T he positive clones selected w ith PCR were sequenced and the ex2 pression ofγ2ggt in E.coli B L21(DE3)was analyzed w ith S DS2PAG E after induced by1g/L lactose for1to9h ours.Recombinant B L21(DE3)harb oring pG EX24T21/γ2ggt began to ex press theγ2glutam yl transpeptidase after1h our induction and kept producing it until6h our after induction when the target protein reached a m aximum.N o degradation of produced protein was observed in the E.coli cells.T heγ2glutam yl transpeptidase was ex pressed m ostly in in2 clusive b odies and identified by W estern blotting.T he E.coliγ2ggt encoding fragm ent was correctly inserted into the prokary otic ex pression vector pG EX2 4T21and this was con firm ed by PCR and sequencing.W estern blotting analysis indicated that the target protein was success fully ex pressed in E.coli.It w ill lay a foundation for further study on biosynthesis functions ofγ2glutam yl transpeptidase.K ey w ords γ2glutam yl transpeptidase;C lone;Prokary otic ex pression 茶氨酸是天然茶叶中的一种特殊氨基酸,不仅可作为一种新型的食品添加剂来改善食品风味,还具有降血压、增强抗癌药物的疗效、提高免疫力、松弛神经紧张等药理作用[1]。
带GST标签的人MIIP原核表达载体构建与鉴定-肿瘤学论文-临床医学论文-医学论文

带GST标签的人MIIP原核表达载体构建与鉴定-肿瘤学论文-临床医学论文-医学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——近年来研究表明,迁移侵袭抑制蛋白(migra-tion and invasion inhibitor protein,MIIP)在肿瘤的侵袭和转移过程中发挥一定作用,能在体外抑制某些肿瘤细胞的迁移和侵袭能力。
2003 年Song等首次发现,MIIP 能与胰岛素样生长因子结合蛋白-2(insulin like growth factor binding protein -2,IGFBP - 2)特异性结合,抑制神经胶质母细胞瘤细胞的侵袭能力.但对MIIP 抗肿瘤侵袭转移能力的研究较少,其发挥作用的分子机制还不甚明确。
本研究利用重组DNA 技术构建了带有GST 标签的人MIIP 原核表达载体,并对其进行导表达及纯化,为进一步研究MIIP 在肿瘤发生发展中的作用和机制提供实验基础。
1 材料与方法1. 1 材料1. 1. 1 菌株和质粒大肠杆菌DH5 感受态和BL21 感受态为本实验室制备;pGEX - 4T - 1 质粒由大学肿瘤防治研究所生化与分子生物学研究室寿成超教授惠赠。
1. 1. 2 主要试剂质粒小量提取试剂盒、DNA凝胶回收试剂盒购自天根公司;限制性内切酶Xho I 和EcoR I 及T4 DNA 连接酶购自PRO-MEGA 公司;1kb DNA 分子量标准、蛋白分子量标准购自天根公司;DNA 分子量标准(DL15000)购自TaKaRa 公司。
Pfu 高保真DNA 聚合酶购自NEB 公司;Peasy - T1 载体为全式金生物公司产品;异丙基硫代-- D 半乳糖苷(isopropyl -- D -thiogalactoside,IPTG)、溶菌酶和PMSF 购自Amresco 公司;Glutathione Agarose 为Invitrogen公司产品,Anti -GST 抗体购自Proteintech 公司,羊抗小鼠IgG - HRP 购自中杉金桥生物公司。
pGEX—4T—1—Neurexin 1β原核表达载体构建及表达条件的优化

pGEX—4T—1—Neurexin 1β原核表达载体构建及表达条件的优化作者:徐岩王梦林侯筱宇来源:《中国科技纵横》2015年第24期【摘要】目的:构建Neurexin 1β(Nrx 1β)原核表达重组体。
方法:以pcDNA3.1-Myc-Nrx 1β真核表达载体为模板,经PCR扩增Nrx 1β目的基因,然后将其亚克隆入pGEX-4T-1载体,构建其原核表达载体,转化入宿主菌BL21,选用IPTG进行诱导表达,优化表达条件,SDS-PAGE检测Nrx 1β的蛋白表达。
结果:N rx 1β目的基因扩增成功,经克隆后成功连接至pGEX-4T-1,重组体酶切结果及测序结果与预期结果一致。
转化入BL21后在IPTG的作用下成功表达,且在24°C时, IPTG浓度为0.2 mmol/L诱导12 h后Nrx 1β的蛋白表达量最高。
结论:该研究成功构建了pGEX-4T-1-Nrx 1β原核表达载体,并优化了Nrx 1β的蛋白表达条件,为下一步研究该蛋白质的功能奠定基础。
【关键词】Neurexin 1β 原核表达载体表达条件【Abstract】Objective: To construct the prokaryotic expressing plasmid recombinant for Neurexin 1β (Nrx 1β). Method:Nrx 1β cDNA was obtained by PCR from pcDNA3.1-Myc-Nrx 1β eukaryotic expression vector, and cloned into the pGEX-4T-1 vector. The positive prokaryotic expressi on vector was transformed into Escherichia coli BL21. The expression of Nrx 1β was induced by IPTG with optical condition and was detected by SDS-PAGE. Result:Gene of Nrx 1β was successfully amplified, and the PCR product was ligated into pGEX-4T-1. Results of restriction enzyme digestion and sequencing were consistent with expectations. After transforming into BL21,the protein expression was successfully induced by IPTG. Conclusion:The study constructed Nrx 1β prokaryotic expressing plasmid recombinant successfully, and optimized the protein expression of Nrx 1β,which provide the foundation for studying the role of Nrx 1β in nervous system.【Key words】Neurexin 1β; prokaryotic expressing vector; expression condition1 引言Neurexin(Nrx)是一种突触前膜蛋白,他们大多定位于突触前膜并含有一个跨膜结构域。
【国家自然科学基金】_pgex-4t-1_基金支持热词逐年推荐_【万方软件创新助手】_20140801
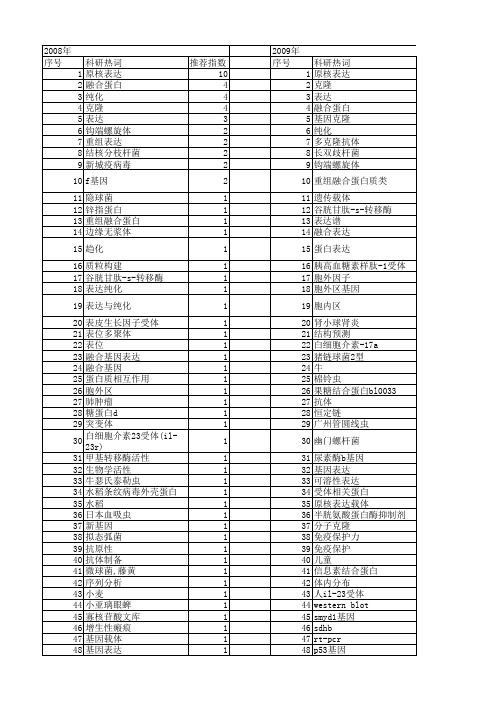
科研热词 推荐指数 原核表达 10 融合蛋白 4 纯化 4 克隆 4 表达 3 钩端螺旋体 2 重组表达 2 结核分枝杆菌 2 新城疫病毒 2 f基因 2 隐球菌 1 锌指蛋白 1 重组融合蛋白 1 边缘无浆体 1 趋化 1 质粒构建 1 谷胱甘肽-s-转移酶 1 表达纯化 1 表达与纯化 1 表皮生长因子受体 1 表位多聚体 1 表位 1 融合基因表达 1 融合基因 1 蛋白质相互作用 1 胞外区 1 肺肿瘤 1 糖蛋白d 1 突变体 1 白细胞介素23受体(il-23r) 1 甲基转移酶活性 1 生物学活性 1 牛瑟氏泰勒虫 1 水稻条纹病毒外壳蛋白 1 水稻 1 日本血吸虫 1 新基因 1 拟态弧菌 1 抗原性 1 抗体制备 1 微球菌,藤黄 1 序列分析表达 1 基因 1 原核蛋白表达 1 单纯疱疹病毒属 1 包涵体 1
53 cxcr4基因 54 aspp2
推荐指数 6 5 3 3 3 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
科研热词 原核表达 多克隆抗体 融合蛋白 克隆 pgex-4t-1 表达 次要衣壳蛋白 斑马鱼 人乳头瘤病毒 交叉反应 骨代谢 长双歧杆菌ncc2705 镉 铅 重金属 重组质粒 重组表达 重组 遗传 表达纯化 蛋白间相互作用 蛋白纯化 蛋白相互作用 草莓 肺肿瘤 羊布鲁菌 结合效应 细菌素 纯化 疱疹病毒4型 犬s100β 牛瑟氏泰勒虫 潜伏膜蛋白2a 植物乳酸杆菌 抗血清 截短突变体 基因克隆 同源性 免疫抑制蛋白 传染性腔上囊病病毒 人维生素d受体 人类tudor-sn蛋白 人 亚洲璃眼蜱 vp2基因 tnc tle1 syntrophin rt-pcr rmnd5a plc-β 3 omp25d蛋白
质粒DNA的提取与检测

质粒DNA 的提取与电泳检测22100934 程雅楠摘要:将培养的细菌菌种,即含R-pGEX-4T-1质粒的大肠杆菌,通过碱裂解法提取大肠杆菌中的质粒DNA ,并利用琼脂糖凝胶电泳法来检测所提取到的质粒DNA ,通过整个实验流程,初步掌握常用LB 液体/固体培养基和质粒提取试剂的配制方法和技术、碱裂解法提取质粒的技术以及琼脂糖凝胶电泳检测DNA 的方法和技术。
关键词:质粒DNA ,碱裂解,琼脂糖凝胶电泳人们使用碱与SDS 裂解法从.E.coli 中分离制备质粒DNA 已经有20 多年的历史。
质粒是细菌染色体外能自身独立复制的双股环状DNA 。
带有遗传信息,可赋予细菌某些新的表型。
将质粒指纹图谱分析方法、质粒DNA 探针技术及检测质粒的PCR 技术用于临床感染性疾病的诊断和流行病学调查已成为现实。
质粒作为载体在基因工程中起着重要的作用。
琼脂糖凝胶电泳技术是分离、鉴定和提纯DNA 的片断的有效方法。
琼脂糖凝胶可分辩0.1-6.0kb 的双链DNA 的片段。
琼脂糖凝胶电泳是一个电场作用。
它首先利用琼脂糖的分子筛效应,此外,在弱碱性条件下,DNA 分子带负电荷,从负极向正极移动。
根据DNA 分子大小、结构及所带电荷的不同,它们以不同的速率通过介质运动而相互分离。
借助溴化乙锭(EB)能与双链DNA 结合的作用,利用EB 染色,并通过紫外线激发即可观察被分离DNA 的片段的位置。
1.材料和方法1.1实验仪器与用具电子天平、pH 酸度计、磁力搅拌器、TOMY SS-325/245自动蒸汽灭菌锅(用于LB 液体/固体培养基和质粒提取试剂的配制);恒温培养箱、恒温摇床、台式离心机、高压灭菌锅、移液枪(用于碱裂解法提取质粒DNA ); 微波炉、琼脂糖凝胶电泳系统、紫外线透射仪(检测质粒DNA )。
凝胶电泳系统 pH 酸度计凝胶电泳槽1.2实验试剂与培养基1.2.1 培养基的配制•LB液体/固体培养基LB液体培养基:将10g胰蛋白胨(typtone)、5g酵母提取物(yeast extract)、10g氯化钠完全溶解在950mL去离子水中,用NaOH调节pH至7.0,加入去离子水至总体积为1L,121℃湿热灭菌20min。
基因工程实验报告

基因工程实验技术实验报告百度ID:龍吟EX炫1 材料和方法1.1 实验材料1.1.1 实验对象实验室提供的小鼠;含pGEX 4T-1质粒的大肠杆菌BL21 (DE3),大肠杆菌Top10。
1.1.2 试剂LB液体培养基,LB固体培养基,0.1% DEPC水,无水乙醇,氯仿,异丙醇,Trizol,Olig(dT)18,反转录缓冲液,dNTP,M-MULV反转录酶,RNA抑制剂,2×PCR Mix,Olig(dT)18引物,表达引物EB3、EB4,5×TBE缓冲液,10×Loading buffer,核酸染料Super Gel Red,琼脂糖,Bam H I,Sal I,Bam H I buffer,10×ligation缓冲液,T4 DNA连接酶,ddH2O,氨苄青霉素,IPTG,30%丙烯酰胺,1.5mol/L和0.5mol/L Tris-HCl,10% SDS,10%过硫酸铵溶液,染色液,脱色液,TEMED,Tween-20,DAB工作液、显色液,TIANGEN胶回收试剂盒,TIANGEN质粒提取试剂盒。
1.1.3 仪器高速冷冻离心机,核酸电泳设备,PCR扩增仪,恒温水浴锅,凝胶成像系统,蓝光切胶仪,无菌操作台,恒温摇床,蛋白电泳设备,电转移设备,移液枪1.2 方法1.2.1 实验材料的处理对小鼠进行处死,解剖并取出肝脏组织,备用。
1.2.2 Trizol法提取总RNA将组织剪成小块在液氮中磨成粉末,取50~100mg加入已盛有1ml Trizol离心管中,轻轻混合以排除气体,再充分混匀;室温放置5min,然后加入200μl氯仿,盖紧离心管,并剧烈摇荡15秒钟;12,000rpm离心10min,取上层水相到新的离心管中,加入500μl异丙醇,温和颠倒混匀。
室温放置10min后12,000rpm离心10min;小心地弃去上清液,加入1ml DEPC水配制的75%乙醇,颠倒混匀,12,000rpm离心5min,再重复一次上述操作;弃去上清液,室温或真空干燥3~5min,后用30μl DEPC水溶解RNA。
胸腺素α1-胸腺五肽在大肠杆菌中的表达及表达条件优化

胸腺素α1-胸腺五肽在大肠杆菌中的表达及表达条件优化谢琦;李娟;王凤山【摘要】目的:探讨胸腺素α1-胸腺五肽(Tα1-TP5)在大肠杆茵中的表达及表达条件优化.方法:将化学合成的Tα1-TP5基因与原核表达栽体pGEX-4T-1融合并转化至E.coli BL21(DE3),异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达.利用SDS-PAGE电泳和AlphaEase凝胶电泳图像分析系统研究培养基组成、诱导时机、诱导温度、诱导剂浓度及诱导时间等条件对融合蛋白表达量的影响.融合蛋白经GST琼脂糖珠亲和色谱纯化及重组肠激酶切割后,电喷雾质谱鉴定Tα1-TP5.结果:选用TB培养基,在菌体对数生长中后期加入终浓度为0.05mmol/L的IPTG,37℃诱导5h,GST融合蛋白的表达量最高,占菌体总蛋白的35.8%,且主要以可溶形式表迭.Tα1-TP5的分子质量与理论值相似.结论:Tα1-TP5成功在E.coli中表达,并确定了最佳表达务件.%Purpose To investigate the expression of Tα1-TP5 fusion peptide and optimization of the expression conditions.Methods The chemically synthesized Tα1-TP5 gene was fused with prokaryotic expression vector pGEX-4T-1 and transformed into E.coli BL21 ( DE3 ), subsequently induced by IPTG.SDS-PAGE electrophoresis and AlphaEase gel electrophoresis image analysis system were used to analyze the influence of culture medium, induction starting time, induction temperature,inducer concentration and induction time on the expression level of target protein.GST fusion protein was purified by GST sepharose and cut by recombinant enterokinase.Tα1-TP5 was identified by ESI-MS.Results When using TB as the medium and adding final concentration of 0.05 mmol/L of IPTG into the middle and late logarithmic phase of bacteria to induce for 5h at 37 ℃, the expression of GST fusion protein was the highest, accounting for 35.8% of the bacterial total protein,and mainly in a soluble form.Identified by ESI-MS,the molecular weight of Tα1-TP5 was identical with theoretical value.Conclusion Tα1-TP5 has been successfully expressed in E.coli and the expression conditions of the GST fusion protein were optimized.【期刊名称】《中国生化药物杂志》【年(卷),期】2011(032)004【总页数】4页(P265-268)【关键词】胸腺素α1-胸腺五肽;胸腺融合肽;GST融合蛋白;大肠杆菌;表达条件【作者】谢琦;李娟;王凤山【作者单位】桂林医学院生物技术学院,广西桂林,541004;山东大学药学院生化与生物技术药物研究所,山东济南,250012;山东大学药学院生化与生物技术药物研究所,山东济南,250012;山东大学药学院生化与生物技术药物研究所,山东济南,250012【正文语种】中文【中图分类】Q78胸腺素α1(Thymosin α1,Tα1)是胸腺组分 5(Thymosin fraction 5)中分离出来的由28个氨基酸组成的多肽,是一种针对T细胞的免疫增强剂,目前被广泛应用于重度感染、肝炎和肿瘤的免疫治疗[1-2]。
鸡PLA2基因的克隆与原核表达及PLA2蛋白卵黄抗体的制备

鸡PLA2基因的克隆与原核表达及PLA2蛋白卵黄抗体的制备杨涵江;辛颖;麻丽霞;张智英【摘要】【目的】克隆并原核表达鸡PLA2基因,小量制备鸡PLA2卵黄抗体,为大规模制备PLA2卵黄抗体作为饲料添加剂提供参考。
【方法】提取鸡胰脏总RNA,利用RT-PCR方法获得鸡PLA2基因,将其克隆至pGEX-4T-1原核表达载体中,构建表达载体pGEX-4T-1-PLA2,转入大肠杆菌BL21(DE3),IPTG诱导表达GST-PLA2融合蛋白。
将GST-PLA2融合蛋白免疫青年蛋鸡,每次0.3mg/只,共免疫4次,收集鸡蛋,提取卵黄抗体,采用West-ern Blotting检测抗体的特异性。
【结果】成功克隆出了鸡PLA2基因,构建了pGEX-4T-1-PLA2原核表达载体,并诱导表达了分子质量为44.59ku的GST-PLA2融合蛋白。
GST-PLA2融合蛋白免疫蛋鸡后获得了卵黄抗体,经West-ern Blotting检查,制备的卵黄抗体具有很好的特异性。
【结论】构建了表达鸡PLA2基因的表达系统,并成功的制备了抗鸡PLA2的卵黄抗体。
%【Objective】 The research prepared the high titer and specific hen egg yolk immunoglobulin(IgY) against chicken PLA2.【Method】Gallus gallus phospholipase A2 gene was amplified by RT-PCR,inserted into vector pGEX-4T-1,and expressed in recombinant E.coli strain BL21(DE3).The GST-PLA2 fusion protein was isolated from the bacteria cells and inj ected into hens at 300 μg dose four times.Western blotting was performed to detect antibodies in egg yolk.【Result】 The chicken PLA2 gene was cloned and inserted into expression vector pGEX-4T-1.The fusion protein GST-PLA2 was expressed in E.coli,and relative molecular mass of fusion protein was 44.59 ku.After injecting fusion protein into hen,wecollected eggs and extracted IgY.Western blotting was used to show that the IgY was specific.【Conclusion】 The expression system pGEX-4T-1-PLA2 could express recombinant protein GST-PLA2,and the prepared IgY had a good immunized specificity.【期刊名称】《西北农林科技大学学报(自然科学版)》【年(卷),期】2011(039)011【总页数】5页(P48-52)【关键词】鸡;PLA2基因;原核表达;卵黄抗体【作者】杨涵江;辛颖;麻丽霞;张智英【作者单位】西北农林科技大学动物科技学院,陕西杨凌712100;西北农林科技大学动物科技学院,陕西杨凌712100;西北农林科技大学动物科技学院,陕西杨凌712100;西北农林科技大学动物科技学院,陕西杨凌712100【正文语种】中文【中图分类】S816.75;S852.43磷脂酶 A2(Phospholipase A2,PLA2,EC3. 1.1.4)是一种脂解酶,可特异水解糖磷脂2位酰基部位,产生自由脂肪酸和溶血磷脂2种代谢物[1-2]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Version 03302011 pGEX-4T-1 Vectors
pGEX-4T-1 载体
Cat. No. CW2198
保存:-20℃
组分说明
Cat. No. CW2198
pGEX4T-1 Vectors 20 μl(100 ng/μl)
产品简介
pGEX-4T-1载体是一种常用的原核表达载体,具有Amp抗性,质粒大小为4.9 kb。
该载体多克隆位点区域含有多个常用的内切酶位点序列,便于不同基因的克隆;且全序列中含有tac启动子、GST标签序列,是一种高效的蛋白表达载体。
Tac 启动子在没有诱导物存在的情况下,质粒上携带的lacI q基因产物可以有效抑制tac启动子的转录。
可在BL21、Rosstea等表达菌株中高表达融合有GST标签的蛋白,且用凝血酶可将目的蛋白的GST标签切掉,便于下游蛋白纯化。
载体图谱及多克隆位点
附表 标记序列位点
标记序列 位点
AmpR_promotor1307-1335 Orf2 3441-4400 Orf2 258-977 pGEX_5_primer 869-891 GST 258-977 tac_promotor 184-212 Orf2 1377-2237 lacI 3309-4400 lac_promotor 4449-4478 M13_forward20_primer4559-4543 lacZ_a 4540-4695 M13_reverse_primer4513-4531 M13_pUC_fwd_primer 4574-4552 M13_pUC_rev_primer 224-246 Ampicilin 1377-2237 pGEX_3_primer 1041-1019 Pbr322_origin 2392-3011 M13_pUC_rev_primer 4492-4514。
