高三有机化学中有机物间相互转化关系图word版本
有机化学官能团相互转化

有机化学官能团相互转化5-fH 3O +Hg 2+ / CH 3CN (aq)C=C-OR C=C-SROCH 3OH 3O+SCH 3OHg 2+3OH 3O Hg 2+3H 3O +OO O SSS SSRSR O O OR OR 5-gHg 2+ / H 3O +H 3O + / solv (aq)H 3O + / solv (aq)Hg 2+ / H 3O +OR OROH OHH 3O + / solv (aq)a very common protecting group, deprotect back to ketoneHC OEt OEt OEtRMgX / H 3O +HC OEt OEt OEtRMgXRCHON H+2Cr 2O 7-2N HCl.CrO 3Ag 2O:1. a mild oxidizing agent2. must be freshly prepared: NaOH into AgNO 3 (aq)3. may involve surface change, react with CO 2, lightSwern oxidation: (DMSO, oxalyl chloride, Et 3N)drawback: react at low T Collins reagent: (CrO 3 - 2 Py)1. drawback: use 6 equivalent, a messy reaction 2. must be very dry, fire easily; purify by CaH 23. an old oxidizing material, isolated by Collin.i. PCCii. PDCix. K 2R C OHO aldehyde1st alcohol2nd alcohol1st alcoholR C OHOR C ROR C HO 5-h i. PCC ii. PDCJOC, 1985, 50, 1332.N OCH 3OHPDC (pyridinium dichormate)(H 2Cr 2O 7 + 2 Py)PCC (pyridinium chlorochromate) (Py-HCl-CrO 3)most widely used use 1 - 1.2 eq.Pfitzner-Moffatt oxidationOO BrDMSOO OOH360 %Synth. Commun., 1986, 16, 1343.JOC, 1977, 42, 1991.Synthesis, 1981, 165.O I OOAcAcOpH 6: weak acid buffer, avoid interfere with ketal groupMcMurray reactioni. Corey approach: subtituted-quinone // H 3O +ii. Watt approacha. PhCHO // MCPBA // H 3O +b. ArPhO // MCPBA // H 3O +c. NBS // KOH // H 3O +PhOPh PhOPhNH 2Ph PhNH 2NC O H // H 3O +O O5-i.15-i.2i. Et 3N // H 3O +Nef reactionii. TiCl 3 / pH 1 or 6iii. SiO 2 / NaOH // H 3O + JACS, 1977, 99, 3861.iv. LDA / MoO 5-Py -v. NaOH // CH 3O OH 3O +vi. KMnO 4 / KOHChem. Rev. 1955, 55, 137.5-k IOOOH O(3 eq.)JACS, 2001, 123, 3183.CH 3CHO2. DDQ / TFA.Synthesis, 1979, 537.JCS, 1932, 1875.Ph-F / DMSO 3.1. SeO 2a select oxidantindrect: change to RC-OH followed by oxidation direct:1. DMAPO / DBU / CH 3CN i. DMSO / AgBF 4RBr DMSO / AgBF 4- Me 2SBull Soc. Jpn., 1981, 54, 2221.THL, 1974, 917.2. NaIO 4 / DMFO Br84 %oNaIO 4 / DMF a new method 3. DMSO reagents:ii. DMSO / ZnSRCHBrMeRC(O)MeDMSO BrOH OOH JACS, 2003, 68, 2480.ROAgBFTHL, 1975, 4467.C C R CHOHRR C C HC C R R'R C C HR C C ArR C C HC C R PhR C C Hsteric base, prevent Nu attack n -BuLi: not MeLi, or t -BuLi,fire easily RX: R-Br, R-TOS, RCHO, RC(O)Rn -BuLi / R'CHO // Ac 2O // KO t BuClOMeN Liiii.ii. (Ph 3P)2PdCl 2, CuI, Et 2NH / PhIi. n-BuLi / RX6-b6-a b c d e g 6-aC CC CC Csulfonic acid: PhSO 3H; sulfinic acid: PhSO 2H; sulfenic acid: PhSOHiv. CuI, NaI, Na 2CO 3, RC C CH 2ClR C C HCl CH 2CC R'RCCCH 2CCR'Synthesis, 2000, 691.RCH 2-SO 2Ph RC CHh f iRCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXin fact: convert to C=C firstlyii. protect - deprotecti. move to terminal 6-cNH 2NHKuse: KAPAuse: Co (CO)8 // Fe(NO 3)3, EtOHJACS, 1975, 97, 891.6-duse: i. Br 2 / CCl 4 // KO t Bu6-euse: Pb(OAc)4, LiCl // KO t Bu // Br 2/CCl 4 // KO t Fe(NO 3)3: weak oxidizing agentii. Br 2 // KOHJA CS, 1941, 63, 1180.PhPhPhPh6-fi. NaBH 4, H 3O +, Br 2, KOtBuii. NH 2OH, NaNO 2 / H 2SO 4 // Ac 2O / DMAPiii. LDA, ClPO(OEt)2ON NODMAP:4-N,N-D i m ethyl a minop y ridinemixture ofAc 2O / DMAP:N NC CH 3O6-guse: TsNHNH 2 / EtOH, heatTHL, 1967, 3943.OHO3(l)O(MVK)CH 3CH CH 2Robinson Annulation German invention, as acylating agent LDA: Li N(iPr)2, ignored a long time, re-introduced by Michigan State U. became famous, appeared every week HORLiNH 2 / NH 3 (l)RXuse: LiNH 2 / NH 3 (l) / R-XO Cl6-h6-i.JA CS, 1958, 80, 4599.JA CS, 1955, 77, 3293.Me PhHOSO 2CF 3Me C C PhMe CPhJOC, 1978, 43, 364.ArAr'H Br Ar C C Ar'NaOEtvia:Ar Ar'Br i. NaOEt (when X = Br)ii. BuLi (when X = -OSO 2CF 3)heatRCH=CH 2:PBu RCH 2CH 2-O-PBu 3RCH 2CH 2-OHPh-Se-PBu 3Ph-Se-CNmechanism:MCPBA OAc CO 2MeOAcMeO MeO 2CNO 2SeNOAcCO 2MeOAc MeOMeO 2Cminorapplied for reactions: without rearrangement; no regiosiomerC (CO 2H)2 / benzeneOH PhPhOO Cl ClClClOCl Cl NC NCO iii. Pd-C; or Ni; Pt, Rhii. chloronaili. DDQ use base: DBNi. CH 3I / Ag 2ii. HCHO / HCO 222use: heatuse: heatb 7-i. p-TSOH.H 2O or CSA ii. weak acid: HOAc; HCO 2H; H 2C 2O 4use:C C HIC C H NH 2C C H OC(S)SMe C C H OAc C C H OMs C C H OH a7-i h gCCX C C C CC CHC O C Cf e dc b a 7--C(O)-CH 3CH-CH CH-CX C-OHjCX-CYNaI / Zn (Cu)i. Zn / acetonei. CSCl 2/C COMs OMs C C BrBrCCOH OHc7-CCOH Iii. CSCl 2 / P(OMe)3P NNPhPOCl 3 / py // Snvia:C C IIapplication: i. protect alkene: via Br 2 // Zn CCCCC 36 o C CCCC=C 31 o C CCCC C Cl Cl 148 o CS OR ORC C BrOAcZn / HOAcOAcO AcOAcOBrOAcZn OOAc OAcOAcJOC, 1978, 43, 364.HOAc/doc/e915102442.html,, 1998, 2113.ii. In / MeOH ii. purify compoundd7-e7-i. WCl 6 / RLi ii. LiPPh 2 / CH 3I product retention product inversionNa R C HC HCH 2CH 2CH 2OH OClRiii. Na(special structure):7-d.7-d.S R 1R 2R 1R 2(EtO)3Puse: (EtO)3PSynthesis , 1977, 1134.via : betaine, oxaphosphetane (NMR)Onot good for Ph 3P=CH 2function as base:expensivedifficult to prepareOEtCNPPh 3CNPPh 3H OPPh 3O CO 2Me+notPh 3P CH EtH C OCO 2Me notPh 3P CH CO 2MeEtH O++++stable ylid gives trans (E)unstable ylid gives cis (Z)water soluble, removed by extraction(comparison: O=PPh 3 highly soluble in organic solvent)use:LiPh SON MeCH 2// Al (Hg)Me 3SiCHR -Li +Ph 3SiCH 2-Li + === Ph 3SiCH 2Br + n-BuLi (exchange)Me 3SiC -H-MgBr === Me 3SiCH 2Cl + Mg (metal reduction) Ph 3SiC -HCH 2Ph === Ph 3SiCH=CH 2 + PhLi (addition to vinylsilane)Me 3SiC -HCO 2Et === Me 3SiCH 2CO 2Et + Li (metalation)Me 3SiCH=PPh 3 === Me 3SiCH 2PPh 3+ X - + KH RO = MeO-, EtO-use: (RO)2PO-CHR'use: Ph 3P-CHR'vi. Sulfoximide (Johnson C.)iii. Silyl Wittig Reaction (Peterson Reaction)ii. Phosphonate Wittig Reaction (Horner-Emmons Modification)i. Wittig Reaction 7-f7-f.Synthesis, 1984, 384.THL, 1981, 2751.JOC, 1968, 33, 780.iv. CH 2(ZnI)2Chem. Lett, 1995, 259.Synlett, 1988, 12, 1369.2CH 2(ZnI)2v. CH 2CHBr 2, Sm, SnI 2 / CrCl 3, THFRO Rvii. Grignard reagent:1. TMSCH MgCluse: TMSCH 2MgClTHL, 1973, 3497.THL, 1988, 4339. 2. NaOAc, AcOHmethylenationOC RR'H advantages over the Wittig:1. by-products are more easily removed,2. reaction suffers less from steric effects.via:(olefination reaction)1953 discover7-f.2not for Wittig, ylid unstableJOC, 1978, 43, 3253.JACS, 1974, 96, 4706.Chem. Lett, 1973, 1041.TiCl 3-LiAlH 4 / THF TiCl 3 / Mg TiCl4 / Zn TiCl 4 / K ii. McMurry Couplingi. use: N 2H 4 / H 2S / Pb(OAc)4BASF, 1973, 2147.via:Zn-CuP(OEt)1. H 2S2. Pb(OAc)431. H 2S2. Pb(OAc)4OON SN N N OSN NSON ON NNN NON NO OSO ON NOO OO OTiCl 3N 2H 4。
高三化学复习有机化学--结构与性质的关系

高三化学复习有机化学----结构与性质一、掌握各类有机物的官能团及性质㈠烃类有机物的性质1.烷烃:⑴饱和烃---特征反应为与X2发生取代反应,条件光照,得到各种卤代烃的混合物。
⑵氧化反应---燃烧(单不能被高锰酸钾酸性溶液氧化)。
⑶高温分解(如甲烷高温分解得到碳黑和氢气,其它烷烃可以发生裂解反应)。
2.烯烃:官能团为 --- C═C⑴不饱和烃---特征反应是与(H2、X2、HX、H2O)等的加成反应。
⑵氧化反应---燃烧、被高锰酸钾酸性溶液氧化。
⑶聚合反应---加成聚合反应。
3.炔烃:官能团为 --- C≡C⑴不饱和烃---特征反应是与(H2、X2、HX、H2O)等的加成反应。
注意加成时与烯烃比较。
⑵氧化反应---燃烧(与乙烯燃烧的比较)、被高锰酸钾酸性溶液氧化。
4.芳香烃:以苯为例。
⑴取代反应---卤代反应、硝化反应、磺化反应。
⑵加成反应---与氢气在催化剂、加热的条件下加成得到环己烷。
⑶氧化反应---燃烧。
㈡烃的衍生物的性质1.卤代烃:以一溴乙烷为例(CH3CH2Br)官能团为 ---卤原子─X。
⑴水解反应---与NaOH的水溶液共热,是取代反应。
⑵消去反应---与NaOH的醇溶液共热,是消去反应。
规律略。
2.醇:以乙醇为例(C2H5OH)官能团为---羟基─OH⑴与活泼金属的反应(如K、Na、Ca等)⑵与氢卤酸的反应---取代反应⑶催化氧化反应---条件、反应规律、断键位置等⑷分子间脱水反应---条件、取代反应、断键位置⑸分子内脱水反应---条件、消去反应、断键位置、反应规律⑹酯化反应---条件、取代反应、断键位置、酯的种类、书写、名称等3.酚:以苯酚为例,官能团---酚羟基─OH⑴酸性(与氢氧化钠溶液、碳酸钠溶液的反应)俗名石炭酸⑵苯环上的取代反应(比苯容易,由于羟基的影响)与浓溴水反应产生白色沉淀(应用)⑶与铁盐的显色反应—用于检验苯酚(─CHO)4.醛和酮:官能团:羰基、醛基⑴醛、酮与氢气的加成反应⑵银镜反应(检验醛基的反应、氧化反应、银氨溶液的制备方法)⑶与新制的氢氧化铜悬浊液的反应5.羧酸和酯:羧酸的官能团是羧基─COOH⑴酸性(有酸的通性,弱酸,比碳酸的酸性强⑵酯化反应(条件、断键位置、酯的命名、酯化反应是高考的热点要很好的掌握)⑶酯的水解反应(条件、反应类型)㈢糖类化合物—从结构上看,糖类是多羟基醛或多羟基酮,以及能够水解生成它们的物质⑴单糖---葡萄糖(多官能团化合物,具有醇和醛的双重性)果糖。
重要有机物之间的相互转化

脂肪与脂肪酸之间的相互转化
01
脂肪酸合成
02
β-氧化
脂肪由甘油和脂肪酸合成,其中甘油部分来自糖酵解,脂肪酸部分来 自乙酰CoA。
脂肪在β-氧化过程中被分解为甘油和脂肪酸,其中甘油部分进入糖异 生途径合成糖,脂肪酸部分进一步被分解为乙酰CoA供能。
03
氨基酸之间的相互转化
通过脱氨基作用实现的氨基酸转化
04
重要有机物之间的相互转 化总结
糖类、脂肪、脂肪酸、氨基酸之间的相互转化关系
01
糖类和脂肪的相互转化
糖类在体内经过一系列反应可以转化为脂肪,脂肪经过β-氧化也可以产
生糖类。这种相互转化主要发生在碳水化合物代谢和脂肪代谢的过程中
。
02
糖类和氨基酸的相互转化
糖类可以经过氨基化作用转化为氨基酸,氨基酸也可以经过脱氨基作用
脂肪酸分解过程中的物质变化
脂肪酸的活化
脂肪酸在胞质中通过脂酰CoA合成酶的催化被活化为脂酰 CoA。
β-氧化
脂酰CoA进入线粒体中,通过β-氧化过程逐步被分解为乙 酰CoA和比原来少两个碳原子的脂酰CoA。
产物利用
乙酰CoA进入三羧酸循环被利用,脂酰CoA在β-羧化酶和 脱水酶的作用下生成烯醇式羧基酯,并进一步裂解生成不 饱和脂肪酸。
转化为糖类。这种相互转化主要发生在碳水化合物代谢和蛋白质代谢的
过程中。
03
脂肪酸和氨基酸的相互转化
脂肪酸可以经过β-氧化转化为氨基酸,氨基酸也可以经过合成作用转化
为脂肪酸。这种相互转化主要发生在脂肪酸代谢和蛋白质代谢的过程中
。
有机物相互转化过程中的能量变化
有机物相互转化过程中能量的储存和释放
有机物相互转化过程中,能量的储存和释放是密切相关的。在糖类转化为脂肪的过程中,能量以脂肪的形式储存 起来;在脂肪酸氧化产生能量的过程中,能量以ATP的形式释放出来。
高中化学有机化学 PPT

例4、若萘分子中有两个氢原子分别被溴原子取
代后所形成的化合物的数目有( )种?
A.5
B.7
C.8
D.10
• [方法总结] 对于二元取代物的同分异构体的判 断,可固定一个取代基位置,再移动另一取代基 位置以确定同分异构体数目
二、几种基本分子的结构模型(共线共面问题)
任意三个原子共 平面,所有原子 不可能共平面, 单键可旋转
什么样的醇不能发生消去? (无相邻C 或邻C上无H)
(二)常见有机物之间的转化关系
CH3CH3 + H2 CH2=CH2 + H2 CH≡CH
水解
C2H5Br
HBr
消 去
H2O
CH3CH2OH
O2
O2 加H2
H2O CH3CHO
CH3COOC2H5
C2H5OH 水解
O2
CH3COOH
Na C2H5ONa
分子间脱水
C2H5—O—C2H5
+ Cl2 FeCl3
—Cl 水解
—OH + NaOH
CO2 或 强酸
• 七、有机计算
一、同分异构体
(1) 判断同分异构体、同系物的方法: 根据概念判断(考点)
同系物
同分异构体
(2) 同分异构体类型及书写方法: 碳链异构:
位置异构: 类型:
异类异构:(官能团异构)
烯烃顺反异构:
• 官能团异构的种类
① CnH2n(n≥3) 单烯烃与环烷烃 ② CnH2n-2(n≥3) 单炔烃、二烯烃 ③ CnH2n-6(n≥6) 苯及其同系物与多烯 ④ CnH2n+2O(n≥2) 饱和一元醇和醚 ⑤ CnH2nO(n≥3) 饱和一元醛、酮和烯醇 ⑥ CnH2nO2(n≥2) 饱和一元羧酸、酯、羟基醛 ⑦ CnH2n-6O(n>6) 一元酚、芳香醇、芳香醚 ⑧ CnH2n+1NO2, 氨基酸和一硝基化合物 ⑨ C6H12O6, 葡萄糖和果糖, ⑩ C12H22O11, 蔗糖和麦芽糖
2019-2020学年高中化学鲁科版必修2习题3.4 塑料 橡胶 纤维 Word版含解析

第4节塑料橡胶纤维课后篇巩固探究A组1.(2017全国Ⅰ)下列生活用品中主要由合成纤维制造的是()A.尼龙绳B.宣纸C.羊绒衫D.棉衬衣解析:宣纸和棉衬衣的主要成分是纤维素,羊绒衫是由羊毛制造的,纤维素和羊毛都属于天然纤维;只有尼龙绳是由合成纤维制造的。
答案:A2.下列物质中不属于高分子化合物的是()A.(C6H10O5)nB.C.CH2—CH2D.解析:根据相对分子质量的大小来判断是否是高分子化合物,故D项不是高分子化合物。
答案:D3.下列原料或制成的产品中,若出现破损不可以进行热修补的是()A.聚氯乙烯凉鞋B.电木插座C.聚丙烯材料D.聚乙烯塑料膜解析:聚氯乙烯、聚丙烯、聚乙烯均为线型分子,具有热塑性,可进行加热熔化再加工;电木具有热固性,不能进行热修补。
答案:B4.下列对有机高分子化合物的认识中,不正确的是()A.有机高分子化合物称为高分子或聚合物,因为它们大部分由小分子通过聚合反应制得B.高分子材料可分为天然高分子材料和合成高分子材料两大类C.对于一块高分子材料而言,它的相对分子质量是不确定的D.有机高分子化合物的相对分子质量很大,因而结构繁杂且无规律子材料来讲,不同的分子,n值也不同,所以它是混合物,没有确定的相对分子质量D项(×)有机高分子化合物虽然相对分子质量很大,但结构简单答案:D5.下列对乙烯和聚乙烯的描述不正确的是()A.乙烯是纯净物,聚乙烯是混合物B.乙烯的性质与聚乙烯相同C.常温下,乙烯是气体,聚乙烯是固体D.等质量的乙烯和聚乙烯完全燃烧后生成CO2和H2O的物质的量相等解析:聚乙烯由乙烯加聚而得,由于聚合度不同,所以聚乙烯是混合物,它们的碳、氢质量分数相等。
故取二者等质量完全燃烧后生成CO2和H2O的质量(或物质的量)相等。
聚乙烯的相对分子质量很大,常温下为固体。
答案:B6.下列对于废弃塑料制品的处理方法中,最为恰当的是()A.将废弃物切成碎片,混在垃圾中填埋于土壤中B.将废弃物焚烧C.将废弃物倾倒于海洋中D.将废弃物用化学方法加工成防水涂料或汽油解析:把废弃物深埋或倾入海洋并没有彻底消除污染。
有机化学基础

有机化学基础有机化学基础一、知识梳理:六部分第一部分有机基本概念第二部分有机反应的基本类型第三部分有机物的结构和性质第四部分有机物之间的转化和衍生关系第五部分生产和生活中的有机物第六部分知识规律的总结归纳第一部分有机基本概念多对比,多辨析,多小结,多举例,真正理解概念的内涵,并注意其外延和变化:1、基本概念--有机物定义:含碳元素的化合物(除CO、CO2、碳酸及其盐、氰化物及金属碳化物等)尿素: CO(NH2)2 碳酸: CO(OH)2 史实:维勒用无机物合成了有机物--尿素NH4CNO === △== CO(NH2)2结构特点:碳原子有四个价电子,和碳原子或其他的原子形四个共价键;可能为单、双或三键,可能成链或成环;相同的分子式可能存在多种结构 --有机物种类繁多的原因性质特点:多为分子晶体,多为非电解质,多为弱极性或非极性分子(同中存异)①溶解性(小分子的醇、酸、醛可溶于水)②耐热性(CCl4可以作为电器着火的灭火剂)③电离性(导电塑料已经在工业上广泛应用)④化学反应:复杂、缓慢、副反应多(原因)2、基本概念--同系物:判断依据①结构相似:官能团的种类、数目及连接方式相同(即组成元素、通式相同)②若干系差(CH2):分子式必不相同,同系物间的相对分子质量相差14n举例辨析:CH4和C3H8、C2H4和C3H6、葡萄糖和核糖是否互为同系物性质规律①化学性质相似②同系物随碳原子数增加,相对分子质量增大,分子间作用力增大,物质的熔沸点逐渐升高(分子晶体的熔沸点规律)3、基本概念--同分异构体:种类:碳链异构:位置异构:CH2=CHCH2CH3和CH3-CH=CH-CH3官能团异构:官能团异构的种类(重视常见)① CnH2n(n≥3),单烯烃与环烷烃② CnH2n-2(n≥3),单炔烃、二烯烃、环单烯烃③ CnH2n-6(n≥6),苯及其同系物与多烯④ CnH2n+2O(n≥2),饱和一元醇和醚⑤ CnH2nO(n≥3),饱和一元醛、酮和烯醇⑥ CnH2nO2(n≥2),饱和一元羧酸、酯、羟基醛⑦ CnH2n-6O(n>6),一元酚、芳香醇、芳香醚⑧ CnH2n+1NO2,氨基酸和一硝基化合物⑨ C6H12O6,葡萄糖和果糖,⑩C12H22O11,蔗糖和麦芽糖书写顺序: 碳链异构→位置异构→官能团异构即判类别、定碳链、移官位、氢饱和。
有机物间的相互转化

例2:用化合物A和乙醇可制备某种新型材料W,W的表示式为:
下列是有关的各步转化关系(其中所有的无机产物已略去):
回答下列问题: (1)化合物D与H中含有的官能团是_______________(写名称)。
③卤代烃的水解(碱性) C2H5Br+NaOH ④酯的水解 CH3COOC2H5 + H2O
C2H5OH + NaBr CH3COOH+C2H5OH
△
⑷引入醛基或羰基
①醇催化氧化 2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
②烯烃与O2反应
③炔烃与水加成
催化剂 2CH2=CH2+O2 △
CH3COOCH2CH3 + H2O
转化方法之—官能团性质
官能团性质
具有酸性
官能团
—COOH、酚羟基
C=C
—C C—
官能团性质
与新制
Cu(OH)2反应
官能团
—CHO —COOH —CHO —OH —COOH
—X、 —COO—、 —COOH、酚羟基
能发生加成 反应
能发生消去 反应 能发生水解 反应 KMnO4(H ) 溶液褪色 溴水褪色
有机化合物之间的转 化关系
CH3CH3 加成 CH2=CH2 加成
取代
CH3CH2Br
消去 水解 取代 氧化 氧化
加成
消去
CH3CH2OH
加成
CH3CHO
酯化
CH3COOH
还原
CH≡CH
CH3COOCH2CH3
一张图搞定有机化学推断题

IUPAC 有机物命名法是一种有系统命名有机化合物的方法。该命名法是由国际纯粹与应用化学联合会 (IUPAC)规定的,最近一次修订是在 1993 年。其前身是 1892 年日内瓦国际化学会的“系统命名法”。最理想 的情况是,每一种有清楚的结构式的有机化合物都可以用一个确定的名称来描述它。它其实并不是严格的系统命 名法,因为它同时接受一些物质和基团的惯用普通命名。
C10H22
174.0
-29.7
0.7298
C11H24
195.8
-25.6
0.7404
C12H26
216.3
-9.6
0.7493
C13H28
(230)
-6
0.7568
C14H30
251
5.5
0.7636
C15H32
268
10
0.7688
C16H34
280
18.1
0.7749
C17H36
303
22.0
68.7(80.7) -94.0(6.6)
Hale Waihona Puke 0.6594(0.7786)C7H16(C7H14)
98.4(118.5) -90.5(-12.0)
0.6837(0.8098)
C8H18(C8H16) 125.6(150) -56.8(14.3)
0.7028(0.8349)
C9H20
150.7
-53.7
0.7179
CH4+Cl2→(光照)CH3Cl(气体)+HCl CH3Cl+Cl2→(光照)CH2Cl2(油状物)+HCl CH2Cl2+Cl2→(光照)CHCl3(油状物)+HCl CHCl3+Cl2→(光照)CCl4(油状物)+HCl 试管中液面上升,食盐水中白色晶体析出,这是反应中生成的氯化氢溶于水的缘故。因为氯化氢极易溶于水, 溶于水后增加了水中氯离子的浓度,使氯化钠晶体析出。用大拇指按住试管管口,提出液面,管口向上,向试管 中滴入紫色石蕊试液或锌粒,可验证它是稀盐酸。 如果控制氯的用量,用大量甲烷,主要得到氯甲烷;如用大量氯气,主要得到四氯化碳。工业上通过精馏, 使混合物一一分开。以上几个氯化产物,均是重要的溶剂与试剂。 特点:①在室温暗处不发生反应;②髙于 250℃发生反应;③在室温有光作用下能发生反应;④用光引发反 应,吸收一个光子就能产生几千个氯甲烷分子; 实验室制法 无水醋酸钠(CH3COONa)和碱石灰(NaOH 和 CaO 做干燥剂) 反应方程式:CH3 COONa+NaOH===Na2CO3+CH4↑ 收集:排水法 特点与注意事项: 必须用无水醋酸钠跟干燥的碱石灰反应来制取甲烷,若用醋酸钠晶体或石灰不干燥则均几乎不能产生甲烷气 体。 该实验的操作注意事项与收集方法与氧气的完全相同。
高中化学必修二讲义专题3第三单元人工合成有机化合物Word版含答案

第三单元人工合成有机化合物 [课标要求]1.通过乙酸乙酯合成路线的分析,学会简单有机合成的基本方法思路。
2.会分析、评价、选择有机物合成的最佳路线及合成过程中反应类型的判断。
3.知道常见的有机高分子化合物和三大合成材料。
4.熟知加聚反应的原理,会书写加聚反应的化学方程式,会判断加聚反应的单体。
1.常见有机反应类型:取代反应、加成反应和聚合反应。
2.由乙烯合成乙酸乙酯的反应流程:3.加聚反应的条件和特点:(1)条件:单体必有碳碳双键或碳碳叁键等不饱和键; (2)特点:产物只有高聚物; (3)实例:n CH 2===CH 2―→CH 2—CH 2,4.CH 2CH 2中单体是CH 2===CH 2,链节是,聚合度是n 。
简单有机物的合成1.有机合成有机合成是利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物的过程。
如利用石油化工产品乙烯可合成下列有机物,写出反应的化学方程式。
(1)乙烯水合法制乙醇:。
OH 2CH 3CH ――→催化剂O 2+H 2=CH ==2CH(2)乙烯氧化制乙醛:2CH 2===CH 2+O 2――→催化剂2CH 3CHO 。
(3)乙烯氧化制乙酸:。
COOH 3CH ――→催化剂2+O 2=CH ==2CH2.以乙烯为原料合成乙酸乙酯若合成路线如下,请在方框内填写相应物质的名称。
写出反应的化学方程式,并注明反应类型。
;反应加成,OH 2CH 3CH ――→催化剂O 2+H 2=CH ==2CH ① 反应;氧化,O 2CHO +2H 32CH ――→催化剂△2OH +O 2CH 32CH ②反应;氧化,COOH 32CH ――→催化剂2CHO +O 32CH ③反应。
酯化,O 2+H 5H 2COOC 3CH 错误!OH 5H 2COOH +C 3CH ④ 3.乙酸乙酯的合成途径(1)合成路线一(2)合成路线二(3)合成路线三1.制取氯乙烷有以下两种方案:方案一:乙烷与Cl 2光照下发生取代反应生成CH 3CH 2Cl 。
高中化学《有机化学》总复习课件

CH3CH3 + H2 CH2=CH2 + H2 CH≡CH
水解
C2H5Br
HBr
消 去
H2O
CH3CH2OH
O2
O2 加H2
H2O CH3CHO
CH3COOC2H5
C2H5OH 水解
O2
CH3COOH
Na C2H5ONa
分子间脱水
C2H5—O—C2H5
延伸转化关系举例
CH H2 CH2 Br2 CH2Br 水解 CH2OH 脱H2 CHO O2 COOH
类 别 结构特点
烷烃 单键(C-C)
双键(C=C) 烯烃 二烯烃
(-C=C-C=C-)
主要性质
1.稳定:通常情况下不与强酸、 强碱、强氧化剂反应 2.取代反应(卤代) 3.氧化反应(燃烧) 4.加热分解 1.加成反应;与H2、X2、H X、H2O 2.氧化反应(燃烧;被KMnO4[H+] 氧化) 3.加聚反应 (加成时有1,4加成和1,2加成)
有机物:含碳元素的化合物 (除CO、CO2、碳酸盐、氰化物及金
属碳化物等)。
烃:仅含碳和氢两种元素的有机物称为碳氢 化合物.
烷烃:碳原子之间都以碳碳单键结合成链状 烃叫烷烃,也叫做饱和烃 .
烯烃 分子中含有碳碳双键的一类链烃叫做烯烃.
炔烃 分子里含有碳碳三键的一类链烃叫做炔烃.
芳香烃 分子里含有苯环的一类烃叫做芳香烃.
△
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
醛
羧酸
有机反应类型——还原反应
还原反应:有机物分子里“加氢”或“去氧”的
反应其中加氢反应又属加成反应
有机化学转化与有机化学合成0.

(1) C H3C H2O H
分析:
C H2C H2O H C H3 HO
α β
CH2CH2O H C H3
=
C H2C O O H
O
+ C H3
BrC H2C O O Et
C H3 β - 羟基酸
=
O
C H3C O C H 2 C H2 C H3 C H3C O C H 2
C H3C O C HC O O Et C H2 C H3C O C HC O O Et C H3C O C H 2C O O Et
OH C H3C H2C H C HC H(O C 2H5)2 C H3
KMnO4 / H+
C H3
H3O
+
C H3C H2 C C HC HO C H3
(2) C H2 =C HC H 2C H O C H2 C H C H2 O C H3
分析:
① ② C H2 =C HC H C H2 2C H O C H2 C H O C H3
Br
=O
(1) CH3MgBr (2) H3O+
H+, H2O
C H3 ROOR C O O Na
HB r
C H3
Mg / 醚
(1) CO2 (2) H3O+
CO O H C H3 C O O Na C H3 + CO Cl C H3
NaOH
C H3 O O
=
C H3
C O C H3C
(2)
C H3
法引入官能团。
2. 以剖析为依据,写出合成方案。
例1.完成下列转化 。
(1) CH CCH 2CH2Br CH 3COCH 2CH 2CH2CH2OH
专题4烃的衍生物第三单元醛羧酸4重要有机物质间的相互转化1课时

(引入)我们已经学习了烃、卤代烃、醇、酚、醛、酮、羧酸和酯等有机化合 物的性质,发现它们之间有相互转化关系。 (教学设计)根据教学过程学生说出典型有机物之间的单向转化线路。 烷烃(CH3CH3) → 卤代烃(CH3CH2Br) 教 ↑ ↓ 烯烃 (CH2=CH2) 醇 (CH3CH2OH) 醛 (CH3CHO) →羧酸 (CH3COOH) ↑ 烯烃(CH≡CH) 酯(CH3COOCH2CH3) (交流讨论)写出各类物之间转化的化学方程式。 ①烷烃 卤代烃 ②烯烃 卤代烃 ③炔烃 卤代烃 ④醇 卤代烃 ⑤烯烃 烷烃 ⑥炔烃 烷烃 ⑦醇 烯烃 ⑧醛 醇 ⑨醇 酯 羧酸 典型有机物之间转化的意义:有机化合物的转化关系可以让我们更全面地把握 官能团的性质,对我们学习和运用有机化学知识有很大的帮助。 例 1.有 A、B、C、D、E、F 六种有机化合物,存在下图所示转化关系:
1
F.CH3COOCH2CH3
例 2.请以乙醇为原料设计合成
的方案。写出合成方案中所涉及
反应的化学方程式。 [参考答案]方案:CH3CH2OH 消去得 CH2=CH2,与溴水加成得 CH2BrCH2Br, 取代得 CH2OHCH2OH;两分子乙二醇脱两分子水得目标产物。有关的化学方 程式:
例 3.有机物 C6H12O2 能发生水解反应生成 A 和 B,B 能氧化生成 C。 (1)如果 A、C 都能发生银镜反应,则 C6H12O2 可能的结构简式为: (2)如果 A 能发生银镜反应,C 不能,则 C6H12O2 可能的结构简式为: (3) 如果 A 不能发生银镜反应, 氧化可得 A, C6H12O2 可能的结构简式为: c 则 [参考答案]
板 书 设 计
附:讲义
教 后 感
2
学
过
高中化学学习细节(人教版)之合成高分子化合物的基本方法:合成有机高分子化合物在高考中的地位 Word版含

在高考有机合成中,合成有机高分子化合物往往是最后一步,是有机合成的终极产物,答题时要注意每一步的反应条件,发生了何种反应类型,正确推导。
一. 加聚反应合成有机高分子化合物1.(2015课标Ⅰ)A(C2H2)是基本有机化工原料。
由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:回答下列问题:(1)A的名称是,B含有的官能团是。
(2)①的反应类型是,⑦的反应类型是。
(3)C和D的结构简式分别为、。
(4)异戊二烯分子中最多有个原子共平面,顺式聚异戊二烯的结构简式为。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线。
【答案】(1)乙炔;碳碳双键和酯基(2)加成反应;消去反应;(3);CH3CH2CH2CHO。
(4)11;(5)(6)(1)A的名称是乙炔,B含有的官能团是碳碳双键和酯基。
(2)反应①是加成反应,反应⑦是消去反应。
(3)C为,D为CH3CH2CH2CHO。
(4)异戊二烯中共面原子最多有十一个,请不要忽略2位碳上的甲基有一个氢原子可以旋转后进入分子平面。
聚异戊二烯是1,4—加成反应,四碳链中间有一个双键,按照顺反异构的知识写出顺式结构即可(5)注意到异戊二烯有五个碳原子,有两个不饱和度。
它的炔类同分异构体有三种:图中箭头代表碳链中碳碳三键的位置,按碳四价原理写好结构简式即可。
(6)问是对图中异戊二烯合成的一个简单模仿,分析从略。
【考点定位】有机物分子结构;有机化学基本反应类型;简单有机合成路线设计。
试题难度为较难等级。
【名师点睛】进行物质的性质判断,要从基本概念和物质的结构及含有的官能团进行分析。
要掌握典型的各类物质的代表物的空间构型进行判断物质的分子中原子是共平面的问题。
根据物质的相互转化关系,结合已知条件对物质进行推理。
掌握各类化学反应类型的特点及规律,进行有机物的合成与转化。
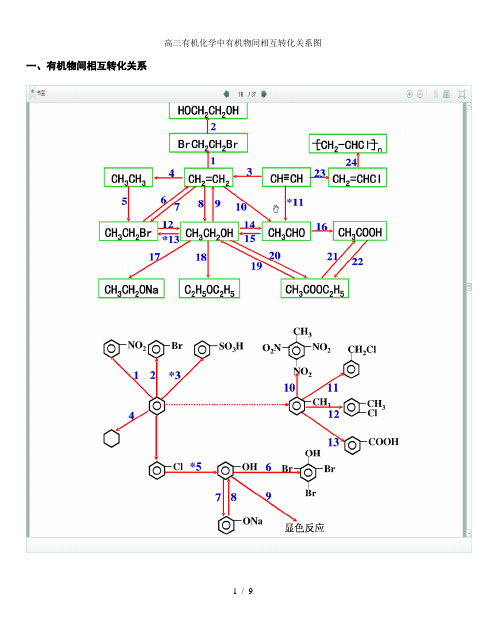
高三有机化学中有机物间相互转化关系图
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的64 + 32 = 22(4)3 + 2362 + 32 = 43 + 2322 + 32 = 23 + 2I 2⑷ 、等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ 等强碱、23和3等盐 2 + H 2O = +2 + 23 = 2 + 2↑+ H 2O + 23 = + 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(4、氯仿、溴苯等)、2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 + 2 2 (其中亦有与、与的反应) △2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的(亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:22;代表物:4B) 结构特点:键角为109°28′,空间正四面体分子。
化学知识结构框图(超详细)!

word 教育资料第一部分 基本理论 基本概念word 教育资料晶体结构晶体熔沸点比较表word教育资料【元素周期律】【化学反应速率与化学平衡】word教育资料word 教育资料word教育资料..【胶体】..word 教育资料【电解质溶液】word教育资料word教育资料【氧化还原反应电化学】word教育资料【各种化学反应的关系】word教育资料word教育资料【化学反应规律】word教育资料word【物质的量】nVV n m =→nm M =Vn C =nN N A =第二部分元素及其化合物【元素化合物概述】【非金属元素】word教育资料【卤族元素】word教育资料PbSword教育资料word教育资料..word教育资料【金属元素】【铝及其化合物】word教育资料word教育资料【化工生产】word教育资料..word教育资料第三部分有机物【有机物导学】[有机物推断]浓H 2SO 4加热 苯的硝化 醇分子内、间脱水 酯 化 稀H 2SO 4加热 酯的水解 糖类水解 NaOH 水溶液加热酯的水解卤代烃的水解NaOH 醇溶液加热—卤代烃消去Cu 、加热—醇的氧化脱水醇的消去、羟基间脱水 羧基间脱水 羟基与羧基间脱链酯 环酯 光照——烷基卤代 [官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n22HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分化学计算。
2020届高考化学一轮复习有机化合物的检验和鉴别作业Word版含答案

有机化合物的检验和鉴别一.选择题(共15小题)1.能用来鉴别乙醇、苯和己烯的试剂是()A.金属钠B.溴水C.硫酸铜溶液D.氢氧化钠溶液2.鉴别乙酸、乙醛不能选用的试剂是()A.银氨溶液B.碳酸氢钠C.新制氢氧化铜D.酚酞试液3.下列试剂中,能鉴别乙醇、乙醛和乙酸的是()A.氢氧化钠溶液B.石蕊试液C.新制氢氧化铜D.碳酸钠溶液4.不能鉴别黄色的溴水和碘水的物质是()A.CCl4B.淀粉溶液C.苯D.NaOH溶液5.下列说法错误的是()A.水可以用来鉴别苯和溴苯B.C4H9C1有四种同分异构体C.2﹣甲基丙烷与异丁烷互为同系物D.等物质的量的乙烯和乙醇完全燃烧的耗氧量相等6.有机物X、Y、Z、W的转化关系如图所示。
下列说法不正确的是()A.满足上述反应的X有五种B.Y含有两种官能团C.Z 能发生水解反应D.W 一定能使Br2/CCl4溶液褪色7.由X、Y和Z合成缓释药物M,下列说法不正确的是()A.M在体内能缓慢发生水解反应B.X可以由乙烯通过加成反应和取代反应制备C.1mol Y与NaOH溶液反应,最多能消耗3mol NaOHD.Z由加聚反应制得,其单体的结构简式是CH3CH=CHCOOH8.乙醇、A、B都是重要的有机化工原料,其中A、B是常见的不饱和烃,B分子中含碳量最高,各物质的转化关系图如图,则下列说法不正确的是()A.由题目推出:A是乙烯,B是乙炔B.反应①、②、③的反应类型相同C.A、B、D、E均能使酸性KMnO4溶液褪色D.有机物F中所有原子一定在同一平面上9.如图表示有机物M转化为X、Y、Z、W的四个不同反应。
下列叙述正确的是()A.与X官能团相同的X的同分异构体有9种B.反应②一定属于加成反应C.W分子中含有两种官能团D.Z的分子式为C3H2O10.已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是()A.A分子中所有原子均在同一平面内B.C4H8O2含酯基的同分异构体有4种C.C的水溶液又称福尔马林,具有杀菌、防腐性能D.等物质的量的B、D与足量钠反应生成气体的量相等11.有机物W在工业上常用作溶剂和香料,其合成方法如下:下列说法不正确的是()A.M、N、W均能发生加成反应和取代反应B.N、W组成上相差一个CH2原子团,所以互为同系物C.1molM与1molw完全燃烧消耗O2的物质的量相同D.M苯环上的二氯代物有6种12.由物质a为原料,制备物质d(金刚烷)的合成路线如图所示。
高三有机化学知识系统复习与归纳

高三有机化学知识系统复习与归纳中图分类号:g63 文献标识码:a 文章编号:1002-7661(2011)05-0064-02摘要:在高三有机化学的第二轮的总复习中,教师应侧重帮助学生把化学知识系统化、条理化,以点带面,让学生第一轮的基础复习更加牢固,提高解题能力,战胜高考。
关键词:高三有机化学系统有机化学是中学化学中非常重要的内容,其知识系统庞大,不好记忆,在有机化学的第二轮的总复习中,应注重帮助学生对已基本掌握的零碎的知识进行归类、整理、加工,使之规律化、网络化。
为便于同学们理解掌握,笔者把一些常用的有机物知识进行归类,供同学们参考。
一、有机物的空间结构1、四类平面结构2、丁基同分异构体的四类应用一氯丁烷的同类同分异构体、一丁醇的同类同分异构体、戊醛的同类同分异构体、戊酸的同类同分异构体均与丁基的同分异构体数目相同(四种)。
分析近几年的高考试题,会发现其中的一个热点是关于有机物分子结构、同分异构体的考题,应该熟练掌握。
3、烃和烃的衍生物的相互转化关系网络图二、有机物的物理性质1、四类常温下为气态的有机物碳原子数为4个以下的烃(包括4个碳原子的烷烃、烯烃、炔烃)、新戊烷[c(ch3)4 ]、一氯甲烷[ch3cl ]、甲醛(hcho).2、四类不溶于水的有机物烃类、卤代烃、酚类、酯类.3、四类能溶于水的有机物低级醇类、低级醛类、低级羧酸类、单糖及低聚糖。
三、有机物的化学性质1、四类取代反应卤代反应(烷烃与氯气在光照的条件下、芳香烃与液溴在铁粉作催化剂的条件下、醇与氢溴酸在加热的条件下、酚与浓溴水在常温下),硝化反应(含苯环的有机物在浓硝酸、浓硫酸加热的条件下)、酯化反应(醇与羧酸或无机含氧酸在浓硫酸加热的的条件下)、水解反应(卤代烃的水解、酯的水解等).2、四类分了中引入烃基的反应类型卤代烃的水解酒旨的水解、烯烃水化、醛类(或酮类)加氢。
3、四类与金属钠反应产生氢气的有机物醇、羧酸、酚类、氨基酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三有机化学中有机物间相互转化关系图一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯) 2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;变色Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃(烯烃、炔烃、二烯烃等)⑵不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶石油产品(裂化气、裂解气、裂化汽油等)⑷醇类物质(乙醇等)⑸含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑹天然橡胶(聚异戊二烯)⑺苯的同系物2、无机物:⑴氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物)⑵ + 2价的Fe(亚铁盐及氢氧化亚铁)⑶-2价的S(硫化氢及硫化物)⑷ + 4价的S(二氧化硫、亚硫酸及亚硫酸盐)⑸双氧水(H2O2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键 也都如此。
C) 化学性质:①取代反应(与卤素单质、在光照条件下) , ,……。
②燃烧③热裂解(2)烯烃:A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C) 化学性质:①加成反应(与X 2、H 2、HX 、H 2O 等)②加聚反应(与自身、其他烯烃) ③燃烧 CH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl光CH 4 + 2O 2CO 2 + 2H 2O点CH 4 C + 2H 2高温 隔绝空气 C=CCH 2=CH 2 + HX CH 3CH 2X催化剂 CH 2=CH 2 + 3O 22CO 2 +2H 2O点燃 n CH 2=CH 2 CH 2—CH 2 n 催化剂 CH 2=CH 2 + H 2O CH 3CH 2OH催化剂 加热、加压CH 2=CH 2 + Br 2BrCH 2CH 2Br CCl 4(3)炔烃:A) 官能团:—C≡C— ;通式:C n H 2n —2(n ≥2);代表物:HC≡CHB) 结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
C) 化学性质:(略) (4)苯及苯的同系物:A) 通式:C n H 2n —6(n ≥6);代表物:B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C 原子和6个H 原子共平面。
C)化学性质:①取代反应(与液溴、HNO 3、H 2SO 4等)②加成反应(与H 2、Cl 2(5)醇类:A) 官能团:—OH (醇羟基); 代表物: CH 3CH 2OH 、HOCH 2CH 2OH+ Br 2 + HBr —Br Fe 或+ HNO 3+ H 2O—浓60℃+ 3H 2Ni △紫外线ClClClClB) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
结构与相应的烃类似。
C) 化学性质:①羟基氢原子被活泼金属置换的反应②跟氢卤酸的反应③催化氧化(α—H )(与官能团直接相连的碳原子称为α碳原子,与α碳原子相邻的碳原子称为β碳原子,依次类推。
与α碳原子、β碳原子、……相连的氢原子分别称为α氢原子、β氢原子、……) ④酯化反应(跟羧酸或含氧无机酸)(6)醛酮 A) 官能团: (或—CHO)、 ( 或—CO —) ;代表物:CH 3CHO 、HCHO 、 B) 结构特点:醛基或羰基碳原子伸出的各键所成键角为120°,该碳原子跟其相连接的各原子在同一平面上。
2CH 3CH 2OH + 2Na 2CH 3CH 2ONaHOCH 2CH 2OH + 2Na NaOCH 2CH 2ONa +H ↑CH 3CH 2OH + HBr CH 3CH 2Br +H 2O △ 2CH 3CH 2OH + O 22CH 3CHO +2H 2O△ Cu 或Ag HOCH 3CH 2OH + O 2OHC —CHO+△Cu 或Ag2CH 3CHCH 3 + O 22CH 3CCH 3 +2H 2O OH△ Cu 或Ag CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O △浓H 2SO 4O —C —H O—C —O CH 3—C —C) 化学性质:① 加成反应(加氢、氢化或还原反应)②氧化反应(醛的还原性)(7)羧酸A) 官能团: (或—COOH);代表物:CH 3COOHB) 结构特点:羧基上碳原子伸出的三个键所成键角为120°,该碳原子跟其相连接的各原子在同一平面上。
C) 化学性质:①具有无机酸的通性 ②酯化反应 (8)酯类CH 3CHO + H 2CH 3CH 2OH△催化剂 + H 2CH 3CHCH 3OH OCH 3—C —CH 3 △催化剂 2CH 3CHO + 5O 24CO 2 + 4H 2O 点燃 CH 3CHO + 2[Ag(NH 3)2OH]CH 3COONH 4 + 2Ag ↓ + 3NH 3 + H 2O (银镜△ CH 3CHO + 2Cu(OH)2CH 3COOH + Cu 2O ↓ + H 2O (费林反△2CH 3CHO + O 22CH 3COOH催化O H —C —H + 4[Ag(NH 3)2OH](NH 4)2CO 3 + 4Ag ↓ + 6NH 3 +△O—C —2CH 3COOH + Na 2CO 32CH 3COONa + H 2O +CO ↑△浓H 2SO 4 CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O (酸脱羟基,醇脱O —C —O —A) 官能团: (或—COOR )(R 为烃基); 代表物: CH 3COOCH 2CH 3 B) 结构特点:成键情况与羧基碳原子类似C) 化学性质:水解反应(酸性或碱性条件下)(9)氨基酸A) 官能团:—NH 2、—COOH ; 代表物:B) 化学性质: 因为同时具有碱性基团—NH 2和酸性基团—COOH ,所以氨基酸具有酸性和碱性,是两性化合物。
六、常见糖类、蛋白质和油脂的结构和性质(1)单糖A) 代表物:葡萄糖、果糖(C 6H 12O 6)B) 结构特点:葡萄糖为多羟基醛、果糖为多羟基酮C) 化学性质:①葡萄糖类似醛类,能发生银镜反应、费林反应等;②具有多元醇的化学性质。
△稀H 2SO 4 CH 3COOCH 2CH 3 + H 2O CH 3COOH + CH 3CH 2OHCH 3COOCH 2CH 3 + NaOH CH 3COONa +CH 3CH 2OH△CH 2COOH NH 2(2)二糖A) 代表物:蔗糖、麦芽糖(C 12H 22O 11)B) 结构特点:蔗糖含有一个葡萄糖单元和一个果糖单元,没有醛基;麦芽糖含有两个葡萄糖单元,有醛基。
C) 化学性质:①蔗糖没有还原性;麦芽糖有还原性。
②水解反应(3)多糖A) 代表物:淀粉、纤维素 [ (C 6H 10O 5)n ]B) 结构特点:由多个葡萄糖单元构成的天然高分子化合物。
淀粉所含的葡萄糖单元比纤维素的少。
C) 化学性质:①淀粉遇碘变蓝。
②水解反应(最终产物均为葡萄糖) (4)蛋白质A) 结构特点:由多种不同的氨基酸缩聚而成的高分子化合物。
结构中含有羧基和氨基。
B) 化学性质:C 12H 22O 11 + H 2O C 6H 12O 6 +H +蔗糖 葡萄果糖C 12H 22O 11 + H 2O 2C 6H 12O 6H + 麦芽葡萄(C 6H 10O 5)n + n H 2O n C 6H 12O 6H 2SO 4淀粉 葡萄△①两性:分子中存在氨基和羧基,所以具有两性。
②盐析:蛋白质溶液具有胶体的性质,加入铵盐或轻金属盐浓溶液能发生盐析。
盐析是可逆的,采用多次盐析可分离和提纯蛋白质(胶体的性质)③变性:蛋白质在热、酸、碱、重金属盐、酒精、甲醛、紫外线等作用下会发生性质改变而凝结,称为变性。
变性是不可逆的,高温消毒、灭菌、重金属盐中毒都属变性。
④颜色反应:蛋白质遇到浓硝酸时呈黄色。
⑤灼烧产生烧焦羽毛气味。
⑥在酸、碱或酶的作用下水解最终生成多种α—氨基酸。
(5)油脂A)组成:油脂是高级脂肪酸和甘油生成的酯。
常温下呈液态的称为油,呈固态的称为脂,统称油脂。
天然油脂属于混合物,不属于高分子化合物。
B) 代表物: 油酸甘油酯: 硬脂酸甘油酯:C) 结构特点:油脂属于酯类。
天然油脂多为混甘油酯。
分子结构为: R 表示饱和或不饱和链烃基。
R 1、R 2、R 3可相同也可不同,相同时为单甘油酯,不同时为混甘油酯。
C 17H 33COOCC 17H 33COOCH C 17H 33COOC C 17H 35COO C 17H 35COO CHC 17H 35COO R 1—COOCH 2R 2—COOCH R 3—COOCH 2D) 化学性质:①氢化:油脂分子中不饱和烃基上加氢。
如油酸甘油酯氢化可得到硬脂酸甘油酯。
②水解:类似酯类水解。
酸性水解可用于制取高级脂肪酸和甘油。
