钠元素的性质
关于钠的化学所有知识点

关于钠的化学所有知识点化学钠的知识点1.钠的物理性质:(1)白:银白色、有金属光泽的固体;(2)轻:密度小,ρ(Na)=0.97g/cm3,比水的密度小;(3)低:熔点和沸点低,熔点97.81℃,沸点882.9℃;(4)小:硬度小,可以用小刀切割;(5)导:钠是热和电的良导体。
2.钠的化学性质:(1)钠与水的反应:2Na+2H2O==2NaOH+H2↑(2)钠与氧气的反应:钠在空气中缓慢氧化:4Na+O2==2Na2O(白色固体)钠在空气中加热或点燃:2Na+O2 Na2O2(淡黄色固体)3.钠的保存及用途(1)钠的保存:钠很容易跟空气中的氧气和水起反应,因此,在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。
(2)钠的用途:①钠钾合金(室温下呈液态),用作原子反应堆的导热剂。
②制备Na2O2。
③作为强还原剂制备某些稀有金属。
氧化钠与过氧化钠的性质比较名称氧化钠过氧化钠化学式Na2ONa2O2颜色状态白色固体淡黄色固体与H2O反应Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2↑与CO2反应Na2O+CO2==Na2CO32Na2O2+2CO2==2Na2CO3+O2生成条件在常温时,钠与O2反应燃烧或加热时,钠与O2反应用途——呼吸面罩、潜水艇的供氧剂,漂白剂化学钠及其化合物的方程式1. 钠在空气中缓慢氧化:4Na+O2==2Na2O2. 钠在空气中燃烧:2Na+O2点燃====Na2O23. 钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O26. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO39. 氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O10. 铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl311. 制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O12. 氯气与水的反应:Cl2+H2O=HClO+HCl13. 次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO14. 次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO化学易错知识点1、同种元素组成的物质不一定是单质,同种元素组成的物质也不一定是纯净物。
钠的性质及应用教案

钠的性质及应用教案钠是一种常见的金属元素,具有一系列独特的性质和广泛的应用。
以下是钠的性质及其应用的详细介绍。
一、钠的性质:1. 物理性质:钠是一种银白色的金属,在常温下呈固态。
它的密度为0.97克/立方厘米,熔点为97.8摄氏度。
钠具有良好的延展性和塑性,可以被轻松地切割成薄片。
2. 化学性质:钠具有较强的活性,容易与氧气、水等物质发生反应。
在空气中暴露一段时间后,钠会与氧气反应生成氧化钠。
当钠与水反应时,会产生氢气和氢氧化钠。
3. 电化学性质:钠是一种良好的电导体,具有较低的电阻率。
因此,在电解质溶液中,钠离子能轻易地从一极向另一极迁移,产生电流。
二、钠的应用:1. 化学合成:钠在化学合成中有着重要的应用。
例如,钠可以用作还原剂,用于还原金属离子、有机化合物和无机化合物。
此外,钠也可作为催化剂参与许多有机合成反应。
2. 行业用途:由于钠对水的反应产生大量的氢气,因此常被用于制取氢气。
此外,钠在冶金和制造业中也有广泛的应用,用于生产钠离子和钠合金。
3. 发电:钠可以用作一种高效的热交换媒介,被广泛应用于发电站中的热力循环系统。
通过钠的循环流动可以将余热转化为电能,提高能源利用效率。
4. 防腐剂:由于钠具有较强的还原性,可以与氧气和水蒸气中的氧发生反应,并形成氧化钠,从而防止金属的腐蚀。
因此,钠被广泛应用于防腐剂的制备中,保护金属的表面。
5. 医药应用:钠离子在人体内起着重要的作用,参与细胞内外的酸碱平衡和电位维持。
因此,钠盐被广泛用作补充身体所需的钠元素。
此外,钠也常被用作生理盐水的配制,用于补充体液和治疗脱水等疾病。
6. 核工业应用:钠在核工业中有重要作用。
例如,在钠冷却反应堆中,钠被用作冷却剂和传热媒质。
钠极好的导电性和冷却性能使其成为一种理想的选择。
三、钠的安全性及环境影响:尽管钠具有广泛的应用,但它的活性和化学性质也使其存在一些安全隐患。
钠与水反应时会产生氢气,可能引发火灾或爆炸。
钠还会与空气中的氧气反应,形成氧化钠,进一步加剧火灾风险。
高中钠性质及应用

高中钠性质及应用钠是一种常见的金属元素,它的原子序数为11,在周期表中位于第3周期第一主族。
钠的化学性质活泼,属于典型的碱金属,具有许多独特的性质和广泛的应用。
首先,钠具有非常活泼的金属性质。
在常温常压下,钠呈银白色固体,可以通过切割、压榨和锤击进行加工成形。
它的结构属于面心立方,晶体具有良好的电导率和热导率。
除了是良好的导电体和导热体外,钠还能很容易地与其他非金属元素发生反应,特别是与氧气、水、酸和碱等物质。
其次,钠具有与水剧烈反应的性质。
当钠与水接触时,会迅速地放出氢气并产生碱性溶液。
反应方程式是:2Na + 2H2O →2NaOH + H2。
这是一种剧烈的放热反应,甚至可能引起火灾或爆炸。
因此,钠在常规的实验室条件下需要小心处理。
在日常生活中,钠离子起着重要的作用。
人体内细胞与体液中存在着钠离子的浓度梯度,这是维持正常细胞功能的关键之一。
通过细胞膜上的离子泵,细胞可以调节钠离子的浓度,并通过运输蛋白质将其输送进、输送出细胞。
这对于维持神经传导、肌肉收缩、血液酸碱平衡等生物体的正常功能至关重要。
此外,钠离子还在农业、食品加工和制药等多个领域中起着重要的作用。
例如,在农业中,可以使用氯化钠作为化肥和杀菌剂,以提高农作物的产量和质量。
食品加工中使用的食盐就是氯化钠,它不仅能提供食物所需的风味,还可以用于保鲜和杀菌。
同样,钠离子在制药中的应用也很广泛,可以作为药物和药物助剂的重要成分。
钠还有几个其他重要的应用。
例如,钠在制备有机合成反应中常用作还原剂,可以还原许多有机化合物,产生氢气。
此外,由于它的活泼性,钠也可以用于去除废水中的重金属离子,从而净化废水。
另外,由于钠的电导率和热导率优良,它也可以作为冷却剂在核反应堆中使用。
总之,钠是一种具有非常活泼的金属性质的元素。
它可以与许多物质发生剧烈反应,具有良好的导电性和导热性。
在生物体内,钠离子对于维持正常细胞功能至关重要。
此外,钠还广泛应用于农业、食品加工、制药和化学工业等领域,发挥着重要的作用。
钠的性质

2Na2O+O2=高温=2Na2O2 稳定性:Na2O2>Na2O
钠在氯气中燃烧产生大量的白 烟 钠还可பைடு நூலகம்和一些非金 属单质,Cl2,P,S,Br2 直接化合。
钠焰色反应产生的黄色火 焰
2Na+H2O=2NaOH+H2 实质:钠与水中的氢离子反应
实验现象与分析
钠浮于水面上;(钠的密度比水小) 钠熔化成一个闪亮的小火球;(钠 与水反应是放热反应,且熔点低。) 钠在水中游动;(反应生成了气体) 滴入的酚酞变红;(反应生成了碱 性物质)
钠的化学性质
由于钠原子的最外层只有一个电 子,极易失去,性质很活泼,表现 出很强的还原性,能与许多无机化 合物(如H2O,NH3),无机非金属单质 (如Cl2,O2,P,S),及部分有机物(如 醇,羧酸)反应。
常温下: 4Na+O2 =2Na2O(白色 固体)
高温下:2Na+O2=Na2O2(淡黄 色固体)
钠与酸反应:由于酸的氢离子浓度 比较大,所以钠优先与酸反应,再 与水反应。 请写出HCl与Na反应的化学方程式: 2Na+2HCl=NaCl+H2
思考:把钠放入硫酸铜溶液中有何现 象呢?会有铜析出吗???请写出相 关的方程式。 Na+H2O=NaOH+H2
2NaOH+CuSO4=Cu(OH)2+Na2SO4
钠与盐反应:先与水反应,生成的 氢氧化钠再与可生成气体或沉淀的 盐反应。
钠与硫酸铜反应
钠的制备:由于钠具有很强 的还原性,一般采取电解熔 融钠盐的方法。 2NaCl(熔融)=2Na+Cl2 2NaOH(熔融)=2Na+H2+O2 可以电解NaOH溶液及NaCl溶 液来制备Na吗???
钠元素高考知识点总结

钠元素高考知识点总结钠元素是化学中的一种重要元素,我们在日常生活中经常能够接触到它的存在。
它是第11个元素,符号为Na,属于碱金属。
在这篇文章中,我们将对钠元素的性质、应用以及与其他元素的反应等知识进行总结。
一、钠元素的基本性质钠元素是一种银白色的金属,具有良好的延展性和导电性。
它的熔点相对较低,约为97.8℃,而沸点则为883℃。
钠在常温常压下比较稳定,但与氧气或者水等物质接触时容易发生反应。
二、钠元素的化学性质1. 钠的氧化性钠是一种高度活泼的金属,容易与氧气反应形成钠氧化物。
当钠与氧气直接接触时,会产生明亮的火焰并且放出大量的热量。
2. 钠与水的反应钠与水的反应也非常剧烈,形成氢气和氢氧化钠。
当钠与水接触时,会迅速溶解,并放出氢气。
这一反应是非常剧烈的,会伴随着火花和火焰的产生。
3. 钠与卤素的反应钠与卤素(氯、溴、碘)之间也会发生反应。
例如,钠与氯气反应会形成氯化钠,同时放出大量的热量。
这一反应可以用来制备食盐。
4. 钠与硫的反应钠与硫的反应也是非常剧烈的,会释放出大量的热量。
它们可以生成硫化钠。
三、钠元素的应用钠元素在工业生产中有广泛的应用。
首先,钠是制备金属钠、有机钠等化合物的重要原料。
其次,它还被广泛用于铸造、制铝、制皂、制玻璃等行业。
另外,钠还在日常生活中被广泛应用,如工业盐、食用盐等。
四、钠元素的生态环境问题钠元素在自然界中的主要补给源是岩石和土壤中的钠盐矿,而钠的浓度较高则会对生态环境造成影响。
例如,在农业生产中,如果土壤中的钠含量过高,会对植物的生长和发育带来不利影响。
因此,在农业中需要注意对土壤进行合理管理和调整,以确保钠元素含量的适宜。
综上所述,钠元素是一种重要的化学元素,在化学中具有广泛的应用。
我们需要了解钠元素的性质和反应特点,以便更好地理解化学反应和相关现象。
同时,我们也要注意保护环境,合理利用钠元素的资源,为可持续发展做出贡献。
高中化学关于钠的所有知识点

高中化学关于钠的所有知识点钠是一种金属元素,在周期表中位于第3周期、第IA族,高中生在复习化学的时候一定要掌握好钠的知识点。
下面是店铺为你收集整理的高中化学钠的所有知识点,一起来看看吧。
高中化学钠的知识点1.钠的物理性质:(1)白:银白色、有金属光泽的固体;(2)轻:密度小,ρ(Na)=0.97g/cm3,比水的密度小;(3)低:熔点和沸点低,熔点97.81℃,沸点882.9℃;(4)小:硬度小,可以用小刀切割;(5)导:钠是热和电的良导体。
2.钠的化学性质:(1)钠与水的反应:2Na+2H2O==2NaOH+H2↑(2)钠与氧气的反应:钠在空气中缓慢氧化:4Na+O2==2Na2O(白色固体)钠在空气中加热或点燃:2Na+O2 Na2O2(淡黄色固体)3.钠的保存及用途(1)钠的保存:钠很容易跟空气中的氧气和水起反应,因此,在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。
(2)钠的用途:①钠钾合金(室温下呈液态),用作原子反应堆的导热剂。
②制备Na2O2。
③作为强还原剂制备某些稀有金属。
氧化钠与过氧化钠的性质比较名称氧化钠过氧化钠化学式Na2ONa2O2颜色状态白色固体淡黄色固体与H2O反应Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2↑与CO2反应Na2O+CO2==Na2CO32Na2O2+2CO2==2Na2CO3+O2 生成条件在常温时,钠与O2反应燃烧或加热时,钠与O2反应用途——呼吸面罩、潜水艇的供氧剂,漂白剂高中化学钠及其化合物的方程式1. 钠在空气中缓慢氧化:4Na+O2==2Na2O2. 钠在空气中燃烧:2Na+O2点燃====Na2O23. 钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O26. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO39. 氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O10. 铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl311. 制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O12. 氯气与水的反应:Cl2+H2O=HClO+HCl13. 次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO14. 次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO高中化学易错知识点1。
钠的性质及应用物理性质

钠的性质及应用物理性质钠(Na)是一种常见的金属元素,位于周期表的第三周期、1A族。
下面将介绍钠的性质及其在应用中的物理性质。
钠是一种银白色的金属,具有良好的延展性和塑性。
它的密度相对较低,约为0.97 g/cm³,且熔点较低,为97.8C。
钠的熔点低使得它在室温下常以液态形式存在。
钠的沸点为883C,其蒸汽呈蓝色,故常用于制造钠灯等照明装置。
此外,钠在高温下还具有较高的蒸汽压,使得它能够广泛地应用于气体增压和真空技术。
钠是一种活泼的金属,与氧气(O₂)和水(H₂O)反应剧烈,形成氧化钠(Na ₂O)和氢氧化钠(NaOH)。
这种活泼性是由于钠原子外层只有一个电子,容易失去形成正离子。
与氧气反应产生的氧化钠广泛用作玻璃、洗涤剂和肥皂的原料。
钠与水反应生成的氢氧化钠是一种碱性溶液,具有强腐蚀性。
由于这个性质,氢氧化钠在工业上被用于制造肥皂和纸浆加工等。
钠是一种良好的导电材料,具有较高的电导率。
钠的电导率比普通金属如铁和铜要高得多,因为钠原子的外层电子相对来说较松散,容易进行电子传导。
这使得钠可以应用于制造电池、电线和其他电器设备中。
另外,钠还具有较好的热导性能,因为它的晶格结构有利于热传导。
这使得钠在制造热交换器、冷却设备和热管等方面有广泛的应用。
在核物理中,钠也扮演着重要的角色。
钠常被用作反应堆冷却剂,在核电站中起到冷却和传热的作用。
钠能够快速地吸收中子,并将热量传递给水或冷却剂,以保持反应堆的稳定工作温度。
总结起来,钠是一种具有较低密度和较高热导性能的金属。
它具有较低的熔点和较高的蒸汽压,使其在照明、气体增压和真空技术中有广泛应用。
钠与氧气反应形成氧化钠,可用于制造玻璃和洗涤剂。
钠与水反应形成氢氧化钠,可用作碱性溶液。
钠具有良好的导电性和热导性,因此在电子设备和热交换器中有广泛应用。
此外,钠还被用作核物理中的冷却剂。
以上是钠的性质及在物理应用中的部分介绍。
高中化学钠的性质及应用

高中化学钠的性质及应用钠是一种常见的碱金属元素,其化学性质十分活泼。
下面将从物理性质、化学性质和应用三个方面来详细介绍钠的性质及其应用。
一、物理性质:1. 外观:钠是一种银白色的金属,具有很强的金属光泽。
2. 密度:钠的密度相对较低,约为0.97 g/cm³,属于轻金属。
3. 熔点和沸点:钠的熔点较低,为97.8,而沸点则较高,为883。
4. 导电性:钠是良好的导电体,具有很高的导电性能,可用于制造导线和电池等。
二、化学性质:1. 活泼性:钠是一种极活泼的金属,能够与氧、水和氯等物质迅速反应,释放大量的热量。
2. 与氧的反应:钠可以与氧气反应生成氧化钠(Na2O)和过氧化钠(Na2O2)。
其中,钠与氧气反应形成氧化钠的反应是钠的常见氧化反应之一,而钠与过氧化氢反应形成过氧化钠的反应是一种还原反应。
3. 与水的反应:钠与水反应会放出氢气,并生成氢氧化钠(NaOH)。
该反应是剧烈的放热反应,钠在水中剧烈燃烧,并在水中迅速溶解产生碱性溶液。
4. 与氯的反应:钠与氯反应会形成氯化钠(NaCl)。
该反应是一种离子键形成的反应,而氯化钠是世界上最常见的盐之一。
三、应用:1. 钠在冶金工业中广泛用于制备其他金属,如铝和镁等。
钠可以与一些金属氧化物反应,从而与金属氧化物中的金属离子置换,制备金属。
2. 钠在化学工业中用作还原剂,能够将许多金属离子还原为金属。
此外,钠还可以用于生产合成橡胶、有机化学品等。
3. 钠可以用于制备钠合金,如钠铅合金和钠汞合金等。
这些合金具有较低的熔点和较高的导电性能,被广泛应用于电池和其他电器设备中。
4. 氢氧化钠是一种强碱,广泛用于工业和日常生活中。
氢氧化钠可以用于制备肥皂、合成染料和纺织品等。
5. 氯化钠是一种重要的食盐,被广泛应用于食品加工、调味品制备等领域。
总结:综上所述,钠是一种活泼的金属,具有很多特殊的物理和化学性质。
它在冶金、化学、电池和食盐等业界应用广泛,对于工业生产和日常生活都具有重要意义。
钠的性质总结

钠的性质总结引言钠是一种常见的碱金属元素,在自然界中以化合物的形式广泛存在。
它具有一系列独特的物理和化学性质,这些性质使钠成为许多领域中不可或缺的元素。
本文将概述钠的主要性质,包括物理性质、化学性质和应用。
1. 物理性质钠是一种银白色的金属,在常温常压下呈固态。
它的原子序数为11,原子量为22.99g/mol。
钠具有良好的导电性和热导性,是一种良好的热和电的导体。
此外,钠具有低密度和低熔点的特点,熔点为97.79°C,沸点为882.94°C。
钠在室温下具有柔软的质地,可以轻易被切割和锻打成各种形状。
2. 化学性质2.1 反应性钠具有高度的反应性,特别是与水反应。
当钠与水反应时,会发生剧烈的化学反应,产生氢气和钠氢氧化物。
反应方程式如下所示:2Na + 2H2O → 2NaOH + H2钠还可以与非金属元素如氢、氮、氧等反应,形成相应的化合物。
例如,与氧气反应会生成氧化钠(Na2O),与氮气反应会生成氮化钠(Na3N),与氢气反应则会生成氢化钠(NaH)。
2.2 氧化性钠具有很强的氧化性,可以与许多物质发生氧化反应。
当钠与氧气反应时,会产生氧化钠。
此外,钠还可以与其他金属形成合金,例如与铁形成钠铁合金。
2.3 燃烧性钠具有良好的燃烧性,可以在空气中燃烧并产生明亮的黄色火焰。
这是因为钠在燃烧时会与氧气反应,生成氧化钠并释放大量的热。
3. 应用钠具有广泛的应用领域,下面列举了几个主要的应用:3.1 表面活性剂钠的化合物,如硬皂和洗衣粉中的十二烷基苯磺酸钠,被广泛用作表面活性剂。
这些化合物在洗涤剂中起到乳化、起泡和清洁的作用。
3.2 非铁金属合金钠可以与其他金属形成合金,其中一种常见的合金是钠铁合金。
钠铁合金具有良好的延展性和韧性,被用于制造船舶和飞机的结构材料。
3.3 化学反应剂由于钠具有高度的反应性,因此被广泛用作化学反应剂。
例如,钠可以用于还原反应、合成反应和催化反应中。
3.4 医学应用钠具有调节体液平衡的功能,因此被广泛用于医学应用中。
(完整版)钠知识点

一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2(2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
钠及其化合物

一、钠的原子结构与性质的关系钠原子结构如下:最外层只有1个电子,在化学变化中易失去最外层电子,呈现很强的金属性,在氧化还原反应中作还原剂,具有强还原性。
二、钠的物理性质(1)银白色金属;(2)密度小,ρ(Na)=0.97g/cm3,比水的密度小;(3)熔点和沸点低,熔点97.81℃,沸点882.9℃;(4)硬度小,金属钠可用小刀切割;(5)钠是热和电的良导体。
可简单概括成:银白色、质软、轻金属。
三、钠的化学性质1.钠与非金属反应与O2反应:缓慢氧化现象:新切的钠表面变暗剧烈氧化 2Na+O2Na2O2 现象:明亮的黄色火焰,生成淡黄色固体与Cl2反应: 2Na+Cl22NaCl 现象:黄色火焰,生成白色固体与S反应: 2Na + SNa2S 现象:加热生成白色固体,研磨易爆炸2、钠与水反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na + 2H2O=2Na+ + 2OH-+ H2↑实验现象现象解释①钠浮在水面上ρ(Na)<ρ(H2O)②熔化成小球(银白色、闪亮) 反应放热,钠的熔点低③有嘶嘶声反应放热④钠球在水面迅速游动钠与水反应生成气体(H2)⑤滴入酚酞后溶液变红生成碱性物质NaOH[思考]钠在空气中长期放置有哪些现象?如何解释?将一小块银白色金属钠露置于空气中,很快看到钠表面变暗,过一段时间又会逐渐变潮湿,再过一些时间又转变为白色固体,最后变成白色粉末。
这是因为金属钠在空气中发生了如下反应:变暗是因为:4Na+O2=2Na2O变潮湿是因为生成的NaOH易潮解:Na2O+H2O=2NaOH(如空气较潮湿,也有可能发生:2Na+2H2O=2NaOH+H2↑)转变为白色固体,最后又变成白色粉末的原因:2NaOH+CO2+9H2O=Na2CO3·10H2O,Na2CO3·10H2ONa2CO3+10H2O(十水合碳酸钠在干燥的空气中发生风化而失去结晶水)银白色金属钠3.钠与酸反应现象:比与水反应更剧烈,甚至爆炸。
高一化学钠元素和氯知识点

高一化学钠元素和氯知识点钠元素和氯元素都是我们生活中非常常见的元素,它们经常出现在我们的日常生活和化学实验中。
本文将详细介绍钠元素和氯元素的性质、应用以及相关的化学反应。
一、钠元素的性质和应用1. 钠元素的性质钠(Na)元素是一种银白色的有金属光泽的金属。
它的原子序数为11,原子量为22.99。
钠的密度较低,且具有良好的延展性和导电性。
在常温下,钠呈现为固态,但在加热至98摄氏度时会熔化成液态。
钠元素在空气中极易氧化,因此需要储存在石油醚或煤油中以防止与空气反应。
2. 钠元素的应用钠元素由于其廉价和丰富,被广泛用于各个领域。
例如,钠常用于制备肥皂、玻璃、洗涤剂等化学制品。
此外,由于钠的导电性,钠也被应用于制造电池、合金等。
二、氯元素的性质和应用1. 氯元素的性质氯(Cl)元素是一种黄绿色的气体,在常温和常压下呈现为气态。
氯的原子序数为17,原子量为35.45。
氯元素具有刺激性气味,并具有较强的氧化性。
由于其高度反应性,氯常以盐酸的形式存在。
2. 氯元素的应用氯元素在许多领域都有重要的应用。
最常见的应用是作为消毒剂,用于水处理和游泳池消毒。
氯也被用于制造塑料、杀菌剂、药品和化学品等。
此外,氯化钠(食盐)是我们日常饮食中不可或缺的一部分。
三、钠和氯的反应1. 钠和氯的化学反应钠和氯可以通过化学反应生成氯化钠(NaCl),即食盐。
当钠与氯反应时,钠元素失去一个电子成为带正电荷的钠离子(Na+),而氯元素接受这个电子成为带负电荷的氯离子(Cl-)。
这两种离子结合形成晶体状的氯化钠,其化学方程式为:2Na + Cl2 -> 2NaCl2. 钠和氯的离子键钠和氯离子结合形成离子键。
在氯化钠晶体中,钠离子和氯离子以离子键的形式紧密联系在一起。
离子键的形成释放出大量的能量,使得氯化钠具有高熔点和高沸点。
结论综上所述,钠元素和氯元素是化学中重要的元素。
钠广泛应用于制造化学制品、合金和电池等领域,而氯常用作消毒剂、塑料制造和药品生产等。
na是什么元素

na是什么元素钠是一种金属元素,元素符号是Na,在周期表中位于第3周期、第ⅠA族,是碱金属元素的代表,质地柔软,能与水反应生成氢氧化钠,放出氢气,化学性质较活泼。
钠是有银白色光泽的软金属,用小刀就能很容易的切割。
熔点97.81℃,沸点882.9℃,密度0.97克/厘米³。
通常保存在煤油中。
钠是一种活泼的金属。
钠与水会产生激烈的反应,生成氢氧化钠和氢;钠还能与钾、锡、锑等金属生成和金;金属钠与汞反应生成汞齐,这种合金是一种活泼的还原剂,在许多时候比纯钠更适用。
钠离子能使火焰呈黄色,可用来灵敏地检测钠的存在。
以往金属钠主要用于制造车用汽油的抗暴剂,但由于会污染环境,已经日趋减少。
金属钠还用来制取钛,及生产氢氧化钠、氨基钠、氰化钠等。
熔融的金属钠在增值反应堆中可做热交换剂。
Na元素及金属钠在各领域中的应用1.1钠在人体及动物机体中的作用钠是动物与人必需的矿质营养元素,主要存在于体内的血液与水分中,能维持细胞渗透压和血液的酸碱平衡,主要是阴阳离子的平衡,并参与水的代谢。
此外,钠和其它离子一起参与维持正常肌肉神经的兴奋性,对心肌活动起调节作用。
以重碳酸盐形式存在的钠,可抑制反刍动物瘤胃中产生过多的'酸,为瘤胃微生物活动创造适宜的环境。
牲畜主要通过饲料与饮水摄取钠,动物缺钠时生长性能受阻,降低热能与已消化蛋白质的利用,使体重减轻,并影响动物的生殖能力。
另外,研究表明,在蛋鸡饲料中适当添加钠元素可使产蛋量明显提高,蛋壳质量也同时明显改善。
脑对钠浓度很敏感,所以首先会无精打采及思考迟钝。
若情况更严重,接下来会肌肉抽搐、神志不清、昏迷甚至死亡。
人体所需要的钠主要从食盐中取得,所以食盐是人们膳食中所不可缺乏的调味品,故有“百味之王”的美称。
与钠元素相关的Na-K泵在人体的正常代谢中具有非常重要的作用,与一些疾病的发生也有着密切的关系。
如肝水肿、白内障、囊纤维化、癫痫、偏头痛、高血压等。
研究发现,钠泵抑制剂可抑制肝癌HepG2细胞的增殖,引起细胞周期S期阻滞,诱导细胞凋亡。
钠的性质总结

钠的性质总结钠是一种常见的金属元素,化学符号为Na,原子序数为11。
它的性质丰富多样,下面我将详细总结钠的性质。
首先,钠是一种具有银白色光泽的金属。
它具有良好的延展性和导电性,能够被轻松地拉成细丝或者锤打成薄片。
钠的密度相对较低,为0.97克/立方厘米,而它的熔点为97.8摄氏度,沸点为882.9摄氏度。
钠也是一种相对活泼的金属,它与氧、水、酸等许多物质发生剧烈反应。
当钠与水接触时,会迅速剧烈地氧化,生成氢气并发出明亮的火焰。
这是由于钠能够轻松地失去一个电子,形成Na+离子,导致钠与水中的氢离子反应。
由于钠在空气中容易与氧气反应,因此在储存和运输钠时需要小心。
钠还具有良好的反应性,可以与许多非金属元素发生反应。
当钠与氧气反应时,会生成氧化钠(Na2O)或过氧化钠(Na2O2),从而产生热。
与氯气反应时,会产生氯化钠(NaCl),即我们日常生活中常见的食盐。
此外,钠还能与硫、碘等元素形成硫化钠(Na2S)或碘化钠(NaI),并释放出大量的能量。
除了与非金属元素反应外,钠也可以与许多金属形成合金。
例如,钠与铝形成的钠铝合金具有较低的熔点和高的导电性,常用于制造飞机的构架和汽车的零件。
钠作为一种有机化合物也具有广泛的应用。
钠的有机化合物主要有钠乙炔(NaC2H)和钠苯(C6H5Na)。
钠乙炔是一种剧毒的固体物质,可以用作制备乙炔和苯乙炔等有机化合物的试剂。
钠苯则是一种常用的还原剂,在有机合成中具有重要的应用。
此外,钠还具有较强的还原性,可以从一些化合物中还原出钠金属。
例如,当钠与二氧化碳反应时,会生成碳酸钠(Na2CO3),并释放出大量的热量。
钠的还原性还使其成为一种用于冶金和化学工业中的重要还原剂。
总之,钠是一种具有丰富多样性质的金属元素。
它具有良好的延展性和导电性,与氧、水、酸等物质发生剧烈反应,并能与非金属元素形成化合物。
钠也是一种常用的合金成分和有机化合物,具有广泛的应用。
钠的还原性使其成为一种重要的还原剂。
钠的化学性质

钠的化学性质钠是一种常见的金属元素,位于元素周期表的第1个周期,化学符号为Na,原子序数为11。
下面将分别介绍钠的物理性质和化学性质。
1. 物理性质钠是一种银白色的金属,具有光泽。
它的密度为0.97克/立方厘米,熔点为97.8℃,沸点为883℃。
钠是一种软金属,可以用刀片切割成薄片。
它的热导率和电导率都很高,属于良好的导体。
钠的比热比较小,因此它容易被加热。
2. 化学性质钠是一种极活泼的金属,它的化学性质非常活跃。
我们将钠暴露在空气中,钠会和氧气发生反应,在发热的情况下,生成氧化钠。
钠与水反应也非常激烈,会生成氢气和氢氧化钠。
钠的最大特点是单价一,因此钠只有失去一个电子才能达到八个价电子。
它可以轻易失去电子,成为阳离子,并与其他离子形成有力的化学结合;因此,在化学反应中,它往往是一个电子给体。
下面,我们将分别介绍钠与各种物质的化学反应:(1)钠与卤素的反应在卤素族元素中,氟气和氯气的反应比较微弱,溴气和碘气的反应则非常强烈。
钠和卤素的反应是一个原子可以很快给予另一个原子电子的过程。
例如:钠和氯气反应产生氯化钠:2Na(s)+ Cl2(g)→2NaCl(s)(2)钠与非金属元素的反应钠与非金属元素反应的方式之一是形成具有弱缩状的固体蒸气,被称为“脱屑反应”或“反应过程中的机械剥落”。
例如:钠与硫的反应产生硫化钠:2Na(s)+ S(s)→Na2S(s)- 钠和磷元素反应就产生磷化钠:3Na(S)+ P4(S)→4Na3P(S)(3)钠与水的反应钠与水的反应非常激烈,会生成氢气和氢氧化钠。
例如:2Na(s)+ 2H2O(l)→2NaOH(aq)+ H2(g)钠与水反应是释放出大量热能,甚至可以自燃,这是因为钠的单价电子非常活跃,强烈吸引水中氢离子而产生高温。
(4)钠与空气的反应当钠自然暴露在空气中时,表面会迅速形成氧化层,导致钠失去反应性。
但是,如果点燃它,它将与空气中的氧气反应生成氧化钠。
例如:4Na(s)+ O2(g)→2Na2O(s)(5)钠与碱金属的反应钠和其他碱金属极易形成领主垢(M +)和氫氧化物(MOH),并且这些金属碱的反应通常伴随着释放出大量的热。
钠元素高中知识点

钠元素高中知识点钠(Na)是一种常见的金属元素,在化学中属于碱金属。
它是地壳中丰度第六高的元素,并且在自然界中主要以盐的形式存在。
钠元素在高中化学中是一个重要的学习内容,下面将逐步介绍钠元素的相关知识点。
1.钠的基本性质–钠的原子序数为11,原子量为22.99,位于周期表的第3周期和第1主族。
–钠是一种银白色的金属,具有良好的延展性和导电性。
–在自然界中,钠主要以氯化钠(NaCl)的形式存在于盐湖、海水和岩盐中。
–钠可以与氯发生反应形成氯化钠,这是常见的食盐。
2.钠的电子结构–钠的电子结构为1s2 2s2 2p6 3s1,其中外层只有一个电子。
–外层只有一个电子的钠原子容易失去这个电子,成为Na+阳离子。
–钠元素的离子式通常写为Na+,表示失去了一个电子。
3.钠的化学反应–钠是一种极活泼的金属,在空气中容易与氧气反应生成氧化钠(Na2O)。
–钠与水反应时会放出大量氢气,并形成氢氧化钠(NaOH)。
–钠还可以与非金属元素反应,例如与氯反应生成氯化钠(NaCl)。
4.钠的应用和重要性–钠是人体必需的元素之一,在生物体内起着重要的调节作用。
–钠元素广泛应用于冶金工业、制备化学试剂、制备硫化钠等。
–钠离子在电解质溶液中具有良好的导电性,因此在电池和电解过程中也有重要应用。
5.钠的安全注意事项–钠是一种高度反应性的金属,在使用和储存时需要注意安全。
–钠与水反应会放出大量氢气,并且会产生剧烈的火焰,因此要小心操作。
–钠遇到空气中的氧气也会剧烈燃烧,需要避免与空气长时间接触。
总结:钠元素是一种重要的金属元素,在高中化学中有着重要的学习地位。
了解钠的基本性质、电子结构、化学反应以及应用和安全注意事项对于理解钠元素的特性和应用具有重要意义。
通过学习钠元素的相关知识点,可以更好地理解化学反应和金属元素的特性。
同时,要注意在实验操作和储存钠时遵守相关的安全规定,确保实验室和个人的安全。
钠的物理性质和化学性质

钠的物理性质和化学性质
一、物理性质
1、外观与结构:钠是一种银白色且有金属光泽的金属元素。
钠的原子在自然界中为单独存在的,且钠的原子半径较大。
钠的晶体结构为面心立方型。
2、密度:钠的密度为0.97 g/mL,在惰性气体中可以浮在
上方。
3、熔点和沸点:钠的熔点为97.79℃,沸点为882.94℃。
钠的沸点较高,表明钠是一种相对稳定的金属。
4、导电性:钠具有很好的导电性和导热性,可以被用作
电池的原料。
二、化学性质
1、与水的反应:钠是一种高度活性的金属,能够直接和
水反应,产生氢气和氢氧化钠。
Na + H2O → NaOH + H2
2、与氧的反应:钠在空气中大量氧化,会产生大量的氧
化钠,产生的化合物化学式为Na2O。
4Na + O2 → 2Na2O
3、与卤素的反应:钠和卤素(如氯、溴等)反应,可以
生成氯化钠、溴化钠等化合物。
2Na + Cl2 → 2NaCl
2Na + Br2 → 2NaBr
4、与硫的反应:钠和硫反应,可以产生硫化钠。
4Na + S → Na2S2
5、与非金属元素的反应:钠可以与非金属元素(如氮、
碳等)反应,形成相应的化合物。
6、钠的氧化态变化:钠在化学反应中,氧化态一般为+1,但也有+2这一氧化态。
此外,还有一些钠的高氧化态,在强
氧化剂存在的情况下也能出现。
总体来说,钠是一种高度活性的金属元素,常见于卤素化合物和氢氧化物中。
钠的物理性质和化学性质具有很高的独特性,因此钠被广泛应用于电池、润滑油、冶金炉及制取其他钠化合物等方面。
金属钠有关的知识点总结

金属钠有关的知识点总结金属钠是一种常见的金属元素,它的化学符号是Na,原子序数为11,属于碱金属元素。
金属钠的性质非常特殊,在我们的日常生活中也经常用到,下面就来总结一下金属钠有关的知识点。
1. 物理性质金属钠是一种银白色金属,在常温下是固体,熔点为97.8℃,沸点为883℃。
它的密度相对较小,为0.97g/cm³,具有良好的电导性和热导性,在空气中会氧化变黑,需要密封收纳。
2. 化学性质金属钠在水中易溶解,有剧烈的化学反应,可以放出氢气,反应方程式为:2Na(s) + 2H₂O(l) → 2NaOH(aq) + H₂(g)。
因此金属钠不宜与水接触,如果不小心接触到水,需要采取相应的安全措施,以免发生危险。
金属钠还可以和其他非金属元素发生化学反应,例如和氯气发生反应可以产生氯化钠,反应方程式为:2Na(s) + Cl₂(g) → 2NaCl(s)。
此外,金属钠也可以与硫、氧、氮等元素发生化学反应,反应性非常强。
3. 应用领域由于金属钠具有良好的电导性和热导性,因此在工业领域中广泛使用。
例如,在冶金工业中,金属钠可以被用来作为还原剂,如在铝的制造中加入少量的金属钠可以提高产量和质量。
在有机合成领域中,金属钠可以被用来进行加成反应、消除反应等多种反应,扩展了有机合成研究的应用范围。
此外,金属钠还可以被用来制取其他金属,如钨、铬等。
在生产过程中,需要通过金属钠的还原反应来获取金属物质。
4. 安全注意事项由于金属钠的高反应性,使用时需要格外小心,遵循相关的安全操作规范。
例如,在将金属钠与水接触时,需要缓慢地将其溶解,避免出现爆炸等意外情况。
在处理金属钠时,需要穿戴合适的防护设备,避免皮肤直接接触到金属钠。
总之,金属钠是一种非常有用的金属元素,在很多行业中都发挥着重要的作用。
但由于它的反应性较强,需要注意相应的安全事项,以免发生危险。
强烈推荐钠元素单质及其化合物知识点总结
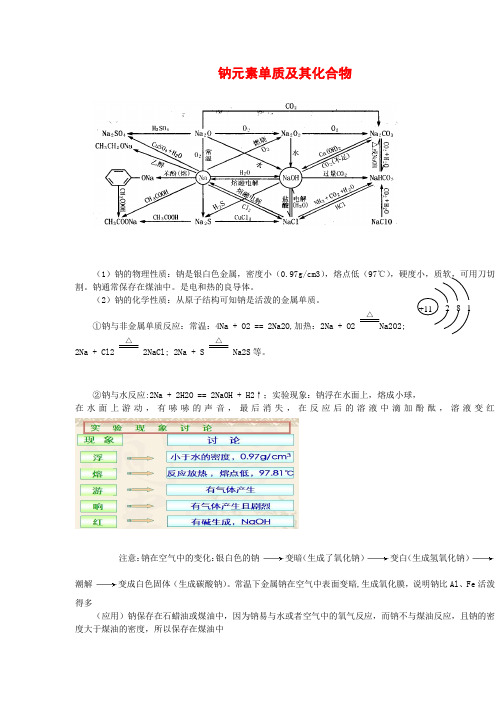
钠元素单质及其化合物(1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。
钠通常保存在煤油中。
是电和热的良导体。
(2)钠的化学性质:从原子结构可知钠是活泼的金属单质。
①钠与非金属单质反应:常温:4Na + O2 == 2Na2O,加热:2Na + O2△Na2O2; 2Na + Cl2△ 2NaCl; 2Na + S △Na2S 等。
②钠与水反应:2Na + 2H2O == 2NaOH + H2↑;实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红注意:钠在空气中的变化:银白色的钠变暗(生成了氧化钠)变白(生成氢氧化钠)潮解变成白色固体(生成碳酸钠)。
常温下金属钠在空气中表面变暗,生成氧化膜,说明钠比Al 、Fe 活泼得多(应用)钠保存在石蜡油或煤油中,因为钠易与水或者空气中的氧气反应,而钠不与煤油反应,且钠的密度大于煤油的密度,所以保存在煤油中+11 8 2 1③钠与酸反应:如2Na + 2HCl == 2NaCl + H2↑,Na放入稀盐酸中,是先与酸反应,酸不足再与水反应。
因此Na放入到酸中Na是不可能过量的。
同时Na与H2的物质的量比始终是2:1。
当然反应要比钠与水的反应剧烈多。
④钠与盐的溶液反应:钠不能置换出溶液中的金属,钠是直接与水反应。
反应后的碱再与溶液中的其他物质反应。
如钠投入到硫酸铜溶液的反应式:2Na + CuSO4 + 2H2O == Cu(OH)2 ↓+ Na2SO4 + H2 ↑。
⑤钠与氢气的反应:2Na + H2 == 2NaH。
NaH + H2O == NaOH + H2 ;NaH是强的还原剂。
(3)工业制钠:电解熔融的NaCl,2NaCl(熔融) 通电2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;②钠钾合金是快中子反应堆的热交换剂;③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2Na+CuSO4+2H2O=Cu(OH)2↓ +Na2SO4+H2↑
Na2O
• 黑色 • 常温固态
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O
氧化物
Na2O2
• 黄色 • 常温固态
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2↑
离子 Na+
2Na2O2+4HCl=4NaCl+2H2O+O2↑ 溶于水呈无色 【高中阶段暂无离子反应】
高中Байду номын сангаас学
银白色固体变为黑色。 固体熔成小球,剧烈燃烧, 生成淡黄色固体。 1.发出滋滋响声; 2.钠在水面上不规则游动; 3.滴有酚酞试剂的溶液变红; 4.钠浮在水面上; 5.钠在水上熔成小球。 又诀:想动红芙蓉。 剧烈燃烧,产生大量白烟。 放热,产生无色气体 生成无色气体,产生蓝色沉 淀,放出大量的热。 黑色固体溶解,放出大量的 热。 黑色固体逐渐变为白色
黄色固体溶于水,滴有酚酞 试剂的溶液先变红后褪色, 产生使带火星的木条复燃的 气体。 黄色固体变成白色,产生使 带火星的木条复燃的气体。
化学整理——徐致远
钠元素的性质
种类 化学式 物理性质
化学性质(反应方程式) 4Na+O2=2Na2O
2Na+O2=Na2O2(加热或点燃)
单质 Na
• 银白色 • 常温固态 • 熔点较低 • 密度小于水 • 质软
2Na+2H2O=2NaOH+H2↑ 2Na+Cl2=2NaCl(点燃)
2Na+2HCl=2NaCl+H2↑
