吸收液
吸收液

H2S吸收液:4.3g硫酸铬,0.3gNAOH,10.0g聚乙烯醇磷酸铵分别溶解,导入1000mI容量瓶,强烈振摇,定容。
长时间放置形成白色悬浮液,每次使用前摇匀。
H2S显色液:1,对氨基二甲基苯胺溶液储备液:量取50mI浓硫酸,缓慢加入30mI水中,放冷后,称量12g对氨基二甲基苯胺盐溶于硫酸溶液中,置于冰箱中,可保存一年。
使用液:量取2.5mI储备液,用1+1硫溶液稀释至100mI。
三氯化铁:称取100g三氯化铁(FecI3·6H2O)溶于水,稀释至100mI,若有沉淀,需过滤。
2,混合显色液:临用时,按1mI对氨基二甲基苯胺使用液和1滴(0.04mI)三氯化铁溶液的比例相混合,若出现沉淀,应弃之不用。
(以上均放入棕色试剂瓶中)NO2吸收液:5.0g对氨基苯磺酸于1000mI容量瓶,用热水400mI溶解,冷却后加50.0mI冰乙酸+0.05gN-1奈乙胺盐酸盐,定容,然后4:1稀释。
(棕色试剂瓶)SO2吸收液:吸取36%~38%的甲醛溶液5.5mI,浓度为0.05moI/L环己二胺四乙酸二钠溶液20.0mL,称取2.04g邻苯钾酸氢钾,溶于少量水中,将三种溶液混合,再用水稀释至100mI,贮存于冰箱保存。
SO2使用液:0.6g氨基磺酸于100mL容量瓶,再加4mL 1.5mo I/LNaoH溶解,定容。
(氨磺酸钠溶液)CS2吸收液:1,乙酸铜-乙醇溶液称量0.05g乙酸铜,溶解于少量无水乙醇中,移入100mL容量瓶中,并用无水乙醇稀释至标线混合。
2,吸取乙酸铜-乙醇溶液10mL于500mL容量瓶中,依次加入无水乙醇300mL,二乙胺2.5mL和乙醇胺2.5mL,并用无水乙醇稀释至标线。
(棕色试剂)NH3吸收液:取500mL容量瓶加入适量一级水(多半),取0.14mL浓硫酸=0.01mo l/L硫酸移入到容量瓶中,再用一级水稀释至标线转入白色试剂瓶中。
甲醇吸收液:取1000mL一级水加入1000mL的试剂瓶中(白色)。
吸收液配置详细表(理化室)
缓冲液(pH=6.8):称取6.80g磷酸二氢钾,7.10g无水磷酸
氢二钠,溶于水,稀释到1L。
吸收液 体积(ml)
9.00ml
吸收瓶 多孔波板吸收管
吸收液 取适量储备液用磷酸盐缓冲液稀释成每毫升相
当于2.5μg(或5.0μg)此溶液20℃以下暗处可保存一个
月
储备
液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到
氯化氢
职业卫生
氟化氢
职业卫生
配制气体一览表
吸收液/膜
吸收液 靛蓝二磺酸钠溶液:量取25.00ml靛蓝二磺酸
钠储备液,用磷酸盐缓冲液稀释到1L棕色容量瓶中,冰
箱内储放可使用1个月。
储
备液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到
500ml棕色容量瓶中,在室温暗处存放24h后标定。标定
后的溶液在冰箱内可稳定1月。磷酸盐
有组织:125ml多 有组织:50.0ml 孔波板吸收瓶 无组织:10.0ml 无组织:10mlU型
多孔波板吸收管
A:碳酸钠+碳酸氢钠吸收液 B:微孔滤膜(0.8μm)
A:5.0 B:/
A:多孔波板吸收管 B:/
微孔滤膜(0.8μm) 碳酸钠+碳酸氢钠吸收液
/
/5Biblioteka 0多孔波板吸收管碳酸钠+碳酸氢钠吸收液
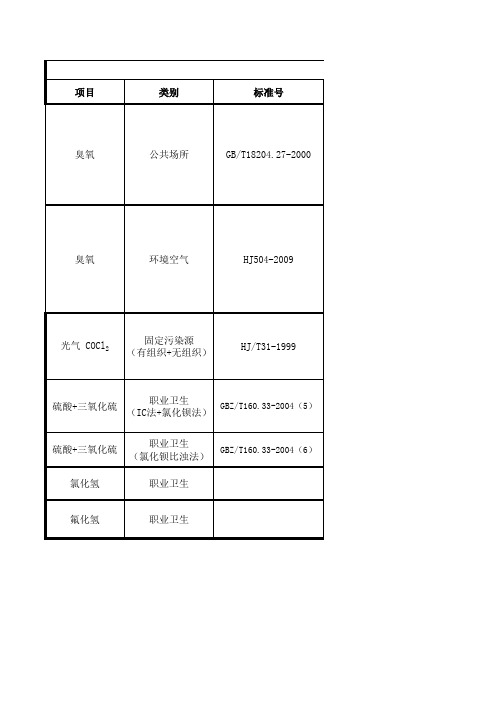
项目
类别
标准号
臭氧
公共场所
GB/T18204.27-2000
配制气体一览表
臭氧
环境空气
HJ504-2009
光气 COCl2
固定污染源 (有组织+无组织)
HJ/T31-1999
硫酸+三氧化硫
职业卫生 (IC法+氯化钡法)
吸收液配置详细表

硫酸+三氧化硫 氯化氢
GBZ/T160.33-2004(6)
氟化氢
职业卫生
列3
吸收液/膜
吸收液 靛蓝二磺酸钠溶液:量取25.00ml靛蓝二磺酸 钠储备液,用磷酸盐缓冲液稀释到1L棕色容量瓶中,冰 箱内储放可使用1个月。 储 备液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到 500ml棕色容量瓶中,在室温暗处存放24h后标定。标定 后的溶液在冰箱内可稳定1月。磷酸盐 缓冲液(pH=6.8):称取6.80g磷酸二氢钾,7.10g无水磷酸 氢二钠,溶于水,稀释到1L。 吸收液 取适量储备液用磷酸盐缓冲液稀释成每毫升相 当于2.5μ g(或5.0μ g)此溶液20℃以下暗处可保存一个 月 储备 液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到 500ml棕色容量瓶中,在室温暗处存放24h后标定。标定 后的溶液在20℃下暗处存放可稳定2周。 磷酸盐缓冲液(c=0.050mol/L):称取6.80g磷酸二氢 钾,7.10g无水磷酸氢二钠,溶于水,稀释到1L。
配制气体一览表
项目
列1
类别
列2
标准号
臭氧
公共场所
GB/T18204.27-2000
臭氧
环境空气
HJ504-2009
光气 COCl2
固定污染源 (有组织+无组织)
HJ/T31-1999
硫酸+三氧化硫
职业卫生 GBZ/T160.33-2004(5) (IC法+氯化钡法) 职业卫生 (氯化钡比浊法) 职业卫生
列4
吸收液 体积(ml)
列5
吸收瓶
9.00ml
多孔波板吸收管
10.00±0.02ml
多孔波板吸收管
化工原理实验报告_吸收

化工原理实验报告_吸收
实验名称:吸收实验
实验目的:
1. 掌握吸收塔的操作方法;
2. 熟悉吸收塔的工作原理;
3. 了解吸收塔在化工过程中的应用。
实验原理:
吸收是指将气体中的某种成分溶解在液体中的过程。
在工业生产中,吸收常用于气体分离和净化。
吸收塔是常用的吸收装置,常见的吸收塔有塔板吸收塔和填料吸收塔两种类型。
实验仪器及材料:
1. 塔式吸收塔;
2. 气源;
3. 转子流量计;
4. 吸收液;
5. 相应的连接管道。
实验步骤:
1. 将吸收液倒入吸收塔中,注意液位不要过高;
2. 连接气源至吸收塔的底部,控制气源流量;
3. 打开气源,调节气源流量;
4. 连接转子流量计并调节流量;
5. 观察吸收液的变化并记录实验数据。
实验数据记录和分析:
根据实验步骤所得到的数据,可以计算出气体吸收的效率和吸收塔的传质系数。
根据数据分析,可以得到吸收塔的工作效果和适用范围。
实验结果和结论:
通过实验可以得到气体吸收的效率和吸收塔的传质系数,进而评估吸收塔的性能。
根据实验结果,可以判断吸收塔是否适用于化工过程中的气体分离和净化。
根据实验结果和结论,可以调整吸收塔的操作方法和参数,进一步优化吸收塔的性能。
实验注意事项:
1. 操作吸收塔时需注意安全,避免发生意外事故;
2. 控制气源流量时需谨慎,避免发生压力过大或流量过大的情况;
3. 实验结束后,及时清洗吸收塔和相关设备。
化工单元操作-传质过程(吸收)

• 2.解吸方法 • 解吸方法有汽提解吸、减压解吸、加热解吸、
加热减压解吸。工程上很少采用单一的解吸方 法,往往是先升温再减压至常压,最后采用汽 提法解吸。 • (1)汽提解吸 也称为载气解吸法。 • 向解吸塔中通入不含溶质的惰性气体或溶剂蒸 气等气体,降压液面上溶质气体的分压,使吸 收剂中溶质气体更完全的解吸出来,常以空气 、氮气、二氧化碳、水蒸气、吸收剂蒸气作为 载气。
经济上:X 2L (1.1 ~ 2.0)Lmin
4、塔内返混
吸收塔内气液两相可因种种原因造成少量流体发生
与主流提方向相反的流动,这一现象称为返混。
传质设备发生返混会使传质推动力下降、效率降低
或填料层高度增加。
5、吸收剂是否再循环
吸收剂再循环会降低吸收推动力,使填料层 高度加大,但当喷淋密度不足以保证填料的 充分润湿时,必须采用溶剂再循环。
• 第五节 解吸和吸收流程
一、基本概念——解吸
• 从吸收液中分离岀已被吸收的气体吸收 质的操作称为解吸。显然,解吸与吸收 是相反的过程。生产中解吸的作用有两 个:一个是把吸收剂中吸收的气体重新 释放出来,获得高纯度的吸收质气体; 另一个是使吸收剂释放了被吸收的气体 ,使吸收剂从新具有吸收作用,再返回 吸收塔循环使用,节约操作费用。
1、液气比
操作线斜率L/V称为液气比,是吸收剂与惰性气体摩 尔流量之比,反映了单位气体处理量的吸收剂消 耗量的大小。
当气体处理量一定时,确定吸收剂用量就是确定液 气比,是一个重要参数。
吸收液配制方法
75
是
按顺序串联一支空的多孔玻板吸收 管,一只氧化管(三氧化铬-海砂或 第二个吸收瓶呈 0.05~0.2 河砂氧化管),两只装有吸收液的 微红色即停止 多孔玻板吸收管,冰浴,避光,吸 收瓶要置于冰浴中 用烟尘测 在采样管出口处 试方法等 串联3个吸收瓶 速采样 0.5~2.0 5~20min 吸收液颜色明显 减退停止;如果 0.2 毫无变化,则选 择60min。 吸收液颜色明显 减退停止;如果 毫无变化,则选 择60min。 5~30min 30~60min 尘氟和气态氟共存 只存在气态氟 有组织
有组织
是
0.5~1.0
无组织 烟气二氧化硫浓度低于1000㎎/m³ (可用冰水浴控制温度提高吸收效 率) 烟气二氧化硫浓度高于1000㎎/m³ (可用冰水浴控制温度提高吸收效 率)
2
二氧化硫
HJ/T 56-2000 (碘量法)
11.0g氨基磺酸铵,7.0g硫酸铵 溶于1000ml水中,再加入5ml稳 吸收液:贮存于玻璃瓶 定剂(稳定剂:5.0g乙二胺四 中,冰箱冷藏,3个月 乙酸二钠盐(DTA-2Na),溶于热 多孔玻板吸收瓶 稳定剂:冰箱冷藏,12 水,冷却后,加入50ml异丙 个月 醇,用水稀释至500ml,冰箱保 存1年)
/
大型气泡吸收管
5
是
0.5
15min
采样后,采集氯化汞的样品,立即 向每个吸收管加入0.5ml高锰酸钾溶 液摇匀。
19
称取4.0g对氨基苯磺酰胺、10g 酒石酸和100mg乙二胺四乙酸二 钠盐,溶于400mL热的水中。冷 多孔玻板吸收管 GB 12372-1990 却移入1L容量瓶中。加入 25℃暗处可稳定3个 (改进的Saltzman 100mLN-(1-萘基)乙二胺盐酸 月,若出现淡红色,表 二氧化氮 法) )——居住 盐储备液(0.45gN-(1-萘基) 示已被污染,应弃之重 区 乙二胺盐酸盐溶于500ml水 配。 中),混匀后,稀释定容至刻 大型多孔玻板吸 度。实验用水为无亚硝酸根离 收管 子二次蒸馏水。 GB/T 18204.22014(靛酚蓝分光 光度法) GB/T 18204.22014(纳氏试剂分 光光度法) 量取2.8ml浓硫酸加入水中,稀 释至1L。用时再稀释10倍。水 为无氨蒸馏水。 量取2.8ml浓硫酸加入水中,稀 释至1L。用时再稀释10倍。水 为无氨蒸馏水。 称取1.0g三乙醇胺,0.25g偏重 GB/T 16129-1995 亚硫酸钠和0.25g乙二胺四乙酸 (分光光度法)— 二钠溶于水中,定容1000ml。 —居住区 水为蒸馏水。 现配现用 大型气泡吸收管
化工原理少学时知识点

1、吸收分离的依据是什么?如何分类?答:依据是组分在溶剂中的溶解度差异。
(1)按过程有无化学反应:分为物理吸收、化学吸收(2)按被吸收组分数:分为单组分吸收、多组分吸收(3)按过程有无温度变化:分为等温吸收、非等温吸收(4)按溶质组成高低:分为低组成吸收、高组成吸收2、吸收操作在化工生产中有何应用?答:吸收是分离气体混合物的重要方法,它在化工生产中有以下应用。
①分离混合气体以回收所需组分,如用洗油处理焦炉气以回收其中的芳烃等。
②净化或精制气体,如用水或碱液脱除合成氨原料气中的二氧化碳等。
③制备液相产品,如用水吸收氯化氢以制备盐酸等。
④工业废气的治理,如工业生产中排放废气中含有NO SO等有毒气体,则需用吸收方法除去,以保护大气环境。
3、吸收与蒸馏操作有何区别?答:吸收和蒸馏都是分离均相物系的气—液传质操作,但是,两者有以下主要差别。
①蒸馏是通过加热或冷却的办法,使混合物系产生第二个物相;吸收则是从外界引入另一相物质(吸收剂)形成两相系统。
因此,通过蒸馏操作可以获得较纯的组分,而在吸收操作中因溶质进入溶剂,故不能得到纯净组分。
②传质机理不同,蒸馏液相部分气化和其相部分冷凝同时发生,即易挥发组分和难挥发组分同时向着彼此相反方向传递。
吸收进行的是单向扩散过程,也就是说只有溶质组分由气相进入液相的单向传递。
③依据不同。
4、实现吸收分离气相混合物必须解决的问题?答:(1)选择合适的溶剂(2)选择适当的传质设备(3)溶剂的再生5、简述吸收操作线方程的推导、物理意义、应用条件和操作线的图示方法。
答:对塔顶或塔底与塔中任意截面间列溶质的物料衡算,可整理得上式皆为逆流吸收塔的操作线方程。
该式表示塔内任一截面上的气液相组成之间的关系。
式中L/V为液气比,其值反映单位气体处理量的吸收剂用量,是吸收塔重要的操作参数。
上述讨论的操作线方程和操作线,仅适用于气液逆流操作,在并流操作时,可用相似方法求得操作线方程和操作线。
应予指出,无论是逆流还是并流操作,其操作线方程和操作线都是通过物料衡算得到的,它们与物系的平衡关系、操作温度与压强及塔的结构等因素无关。
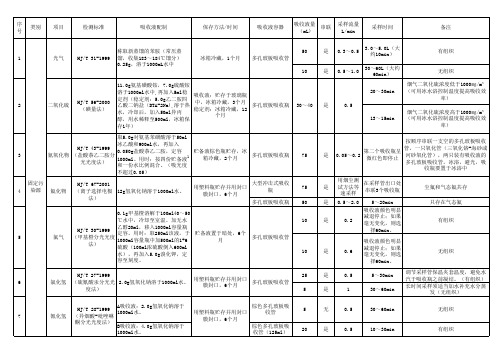
吸收液配制方法.docx

序类别项目检测标准吸收液配制保存方法 / 时间号称取新蒸馏的苯胺(常压蒸1光气HJ/T 31-1999馏,收集 183~184℃馏分)冰箱冷藏, 1个月0.25g ,溶于 1000mL水中11.0g 氨基磺酸铵, 7.0g 硫酸铵溶于1000ml水中, 再加入 5ml稳吸收液:贮存于玻璃瓶定剂(稳定剂: 5.0g 乙二胺四HJ/T 56-2000中,冰箱冷藏, 3个月2二氧化硫乙酸二钠盐( DTA-2Na),溶于热(碘量法)稳定剂:冰箱冷藏, 12水,冷却后,加入 50ml异丙个月醇,用水稀释至 500ml,冰箱保存1年)取5.0g 对氨基苯磺酸溶于 50mlHJ/T 43-1999冰乙酸和 900ml水,再加入0.050g盐酸萘乙二胺,定容贮备液棕色瓶贮存,冰3氮氧化物(盐酸萘乙二胺分11000ml。
用时:按四份贮备液箱冷藏, 2个月光光度法)和一份水比例混合。
(吸光度不超过 0.05 )固定污HJ/T 67-2001用塑料瓶贮存并用封口4染源氟化物(离子选择电极12g氢氧化钠溶于 1000ml水。
膜封口, 6个月法)0.1g 甲基橙溶解于 100ml40~50℃水中,冷却至室温。
加无水HJ/T 30-1999乙醇20ml,移入 1000ml容量瓶定容。
用时:取 250ml该液,于贮备液置于暗处, 6个5氯气(甲基橙分光光度1000ml容量瓶中加 500ml的1+6月法)硫酸( 100ml浓硫酸倒入 600ml水),再加入 5.0g 溴化钾,定容至刻度。
HJ/T 27-1999用塑料瓶贮存并用封口6氯化氢(硫氰酸汞分光光 2.0g 氢氧化钠溶于 1000ml水。
膜封口, 6个月度法)HJ/T 28-1999A吸收液: 2.0g 氢氧化钠溶于1000ml水。
用塑料瓶贮存并用封口7氰化氢(异烟酸 - 吡唑啉膜封口, 6个月酮分光光度法)B吸收液: 4.0g 氢氧化钠溶于1000ml水。
吸收液容器吸收液量串联采样流量采样时间备注(mL)L/min50是0.3 ~0.53.0 ~5.0L (大有组织约10min)多孔玻板吸收管10是0.5 ~1.030~60L(大约无组织60min)烟气二氧化硫浓度低于 1000㎎/m320~30min(可用冰水浴控制温度提高吸收效率)多孔玻板吸收瓶30~40是0.5烟气二氧化硫浓度高于 1000㎎/m313~15min(可用冰水浴控制温度提高吸收效率)按顺序串联一支空的多孔玻板吸收第二个吸收瓶呈管,一只氧化管(三氧化铬 - 海砂或多孔玻板吸收瓶75是0.05 ~0.2河砂氧化管),两只装有吸收液的微红色即停止多孔玻板吸收管,冰浴,避光,吸收瓶要置于冰浴中大型冲击式吸收用烟尘测在采样管出口处75是试方法等尘氟和气态氟共存瓶串联3个吸收瓶速采样多孔玻板吸收瓶50是0.5 ~2.05~20min只存在气态氟吸收液颜色明显10是0.2减退停止;如果有组织毫无变化,则选择60min。
大气污染控制工程-吸收法(解吸)

Thank You !Байду номын сангаас
• 惰性气体气提:以空气、氮气、二氧化碳做载气。该法适用于脱除少量 溶质以净化液体或使吸收剂再生为目的的解吸。
• 汽提:以水蒸气做载气,同时又兼做加热热源的解吸。 • 提馏:以溶剂蒸气作为载气的解吸。解吸后的贫液被解吸塔底部的再沸
器加热产生溶剂蒸气(作为解吸载气),在其上升过程中与沿塔而下的 吸收液逆流接触,液相中的溶质将不断地被解吸出来。该方法多用于以 水为溶剂的解吸。 减压解吸 对于在加压情况下获得的吸收液,可采用一次或多次减压的方法,使 溶质从吸收液中释放出来。 加热解吸 一般而言,气体溶质的溶解度随着温度的升高而降低,若将吸收液温度升高 ,则必然有部分溶质从液相中释放出来 加热—减压解吸 将吸收液加热升高之后再减压,加热和减压的结合,能显著提高吸收推动力 和溶质被解吸的程度。
吸收法(解吸)
6 解吸 概念:使吸收液中的溶质从吸收液中离出被吸收溶质的操作,成为解吸过 程。是吸收的逆过程,是气体溶质从液相向气相转移的过程。 解吸可获得所需较纯的气体溶质,并使溶剂再生返回到吸收塔循环使用, 使分离过程经济合理。 解吸方法:气提解吸、减压解吸、加热解吸、加热—减压解吸。
气提解吸 • 操作原理:吸收液从解吸塔顶喷淋而下,载气从解吸塔底靠 压差自下而上与吸收液逆流接触,载气中不含溶质或含溶质 质量极少,溶质从液相向气相转移,最后气体溶质从塔顶带 出。 • 使用载气解吸是在解吸塔中引入与吸收液不平衡的气相,通 常用做气提载气的气体有空气、氮气、二氧化碳、水蒸气等
常用吸收液配制

75
是
按顺序串联一支空的多孔玻板吸收 管,一只氧化管(三氧化铬-海砂或 第二个吸收瓶呈 0.05~0.2 河砂氧化管),两只装有吸收液的 微红色即停止 多孔玻板吸收管,冰浴,避光,吸 收瓶要置于冰浴中 用烟尘测 在采样管出口处 试方法等 串联3个吸收瓶 速采样 0.5~2.0 5~20min 吸收液颜色明显 减退停止;如果 0.2 毫无变化,则选 择60min。 吸收液颜色明显 减退停止;如果 毫无变化,则选 择60min。 5~30min 30~60min 尘氟和气态氟共存 只存在气态氟 有组织
16
取5.0g对氨基苯磺酸溶于50ml 工作场 冰乙酸和900ml水,再加入 一氧化氮 GBZ/T 160.29所 0.050g盐酸萘乙二胺,定容 和二氧化 2004 (盐酸萘乙 1000ml。用时:按四份贮备液1 氮 二胺分光光度法) 和一份水比例混合。(吸光度 不超过0.05)用水为蒸馏水。 氨 GBZ/T 160.29- 将ρ 20=1.84g/ml的硫酸26.6ml 2004 (纳氏试剂 加入到1000ml水中。水为无氨 分光光度法) 蒸馏水。
10
否
0.4
采气5-25L
短时间采样(如30min)采样期间, 可根据吸收液颜色程度,确定是否 终止采样。
50
否
0.2
24h
长时间采样(如24h)采样期间,可 根据吸收液颜色程度,确定是否终 止采样。 及时记录采样点温度和气压,室温 下保存,24h内分析。 及时记录采样点温度和气压,室温 下保存,24h内分析。
25 5
是 是
0.5 1
调节采样管保温夹套温度,避免水 汽于吸收瓶之前凝结。(有组织) 长时间采样须适当加水补充水分蒸 发(无组织) 无组织
含中药肠吸收液 定义

含中药肠吸收液定义
含中药肠吸收液是一种制剂,用于口服给药的中药制剂。
它是通过将中药煎煮
或提取后,经过浓缩、过滤等工艺得到的液体制剂。
中药肠吸收液的主要特点是通过口腔、胃肠道的吸收作用,将中药有效成分快
速传递到全身各个组织器官。
这种口服给药的方式,能够充分发挥中药的药效,提高药效的快速性和稳定性。
中药肠吸收液的制备需要遵循一定的工艺流程。
一般情况下,制剂中会使用一
些特殊的辅料,如增稠剂、湿润剂等,来提高药物的稳定性和可吸收性。
同时,为了确保中药的有效成分在制剂中能够保持稳定的状态,还需要对药物进行适当的包封或载体技术处理。
在临床应用上,含中药肠吸收液可以广泛用于治疗各种疾病。
它具有药效迅速、疗效较好、用药方便等优点。
与传统的药物剂型相比,含中药肠吸收液能够更好地提高中药的生物利用度和吸收速度,从而提高治疗效果。
总的来说,含中药肠吸收液是一种口服给药的中药制剂,通过口腔、胃肠道的
吸收作用,将中药有效成分快速传递到全身各个组织器官。
它在临床应用中具有较好的疗效和方便性,是一种重要的中药剂型。
二氧化氮吸收液的配置

二氧化氮吸收液的配置
一、计算所需药品的量
首先,我们需要根据实验需求计算所需药品的量。
以吸收100毫升二氧化氮为例,需要硝酸银10克、乙醇50毫升、活性炭适量。
二、准备所需药品
准备好所需的药品,包括硝酸银、乙醇、活性炭等。
这些药品在化学试剂店都可以买到。
三、配置吸收液
1.将硝酸银溶解在适量的乙醇中,制成银盐的乙醇溶液。
注意,溶解时应在
暗处放置过夜,以保证银离子完全析出。
2.取50毫升乙醇加入到硝酸银溶液中,搅拌均匀。
3.加入适量的活性炭,搅拌均匀,以增加吸收容量。
4.将吸收液装入棕色瓶中,置于阴凉处保存。
四、检查吸收效果
在配置完吸收液后,应进行吸收效果检查。
可以使用气相色谱法等方法进行检测,确保吸收液能够有效吸收二氧化氮。
五、保存吸收液
吸收液应存放在阴凉处,避免阳光直射和温度过高。
每次使用前应摇匀,避免出现沉淀。
若长期不使用,应定期更换新的吸收液,以保证其吸收效果。
空气采样各种吸收液的作用原理

空气采样各种吸收液的作用原理
作用:主要用于吸收以气态和蒸气态存在的有害物质。
当空气通过装有吸收液的吸收管时,有害物质分子被阻留在吸收液中,因而能同时达到采集大气和浓集有害物质的目的。
原理:
当空气通过适当的吸收液时,在气泡和吸收液的界面上,有害物质分子由于溶解作用或化学反应能很快地进入吸收液中。
同时,处于气泡中间的气体分子,由于运动速度很大,也能迅速地扩散到气液界面上而被吸收,因而整个吸收过程能很好的完成。
各种气体吸收管就是根据上述原理设计的。
常用的吸收液有水、水溶液和有机溶剂等。
选择吸收液时应考虑到以下几点:被测物质在吸收液中的溶解度大,且具有足够的稳定时间;选择吸收液要考虑下一步化学反应,应与以后的分析步骤衔接;吸收液要价廉易得。
吸收液的选择原则

吸收液的选择原则
吸收液的选择原则如下:
1.根据吸收操作的目的来选择:如果是用于分离或纯化混合气体中的某些组分,需要选择对目标组分具有较大吸收能力的吸收液。
如果吸收液的选择不合适,可能会导致目标组分吸收不完全或者杂质被带入吸收液中,影响分离效果。
2.根据吸收操作的温度和压力来选择:如果吸收过程是在低温或高压下进行,需要选择具有相应物理性质的吸收液,以保证吸收过程能够正常进行。
3.根据被吸收气体的性质来选择:被吸收气体的性质如化学组成、气体分压、温度等都会影响吸收液的选择。
例如,如果被吸收气体是酸性气体,可以选择碱性吸收液;如果被吸收气体是碱性气体,可以选择酸性吸收液。
4.根据吸收效率和操作成本来选择:在满足分离和纯化要求的前提下,应尽可能选择具有较高吸收效率和较低操作成本的吸收液。
同时,还需要考虑吸收液的再生和循环利用问题,以降低操作成本。
5.考虑到安全性和环保问题:在选择吸收液时,需要考虑到其安全性和环保性。
应选择对人体无害、对环境影响较小的吸收液,同时应尽量避免使用易燃易爆或有毒有害的吸收液。
6.考虑吸收液的物理性质:选择吸收液时还需要考虑其物理性质,如密度、粘度、表面张力等。
这些性质会影响到吸收操作的传质效率和设备设计,因此需要根据具体操作条件进行选择。
7.实验验证:在选择吸收液时,需要进行实验验证,以确定其在实际操作条件下的性能表现。
可以通过对比实验的方法对不同吸收液进行评估,以确定最佳的吸收液选择。
总之,在选择吸收液时需要综合考虑多方面的因素,并遵循一定的原则,以保证吸收操作的顺利进行和获得良好的分离效果。
脱硫吸收塔工作原理

脱硫吸收塔工作原理
脱硫吸收塔是用于从燃烧废气中去除二氧化硫(SO2)的设备。
脱硫吸收塔采用湿法脱硫技术,通过将含有SO2的废气通过吸收液中,利用吸收液中的碱性物质与SO2发生化学反应,将SO2捕捉并转化成溶解于液体中的硫酸盐。
以下是脱硫吸收塔的工作原理:
1.吸收液准备:在脱硫吸收塔中,准备一种碱性的吸收液,通常
是石灰浆液(氧化钙溶液)。
石灰浆液含有碱性物质(氢氧化钙,
Ca(OH)2),可以与SO2发生反应生成硫酸钙(CaSO3)。
2.废气进入吸收塔:含有SO2的燃烧废气从底部或侧面进入脱
硫吸收塔。
3.吸收液喷淋:石灰浆液从吸收塔的顶部喷淋下来,与废气接触。
在这个过程中,SO2会与氢氧化钙反应生成硫酸钙,并转化成
溶解在液体中。
4.SO2吸收:SO2被吸收液中的氢氧化钙捕获,并转化成硫酸
钙。
反应的化学方程式如下:
SO2+Ca(OH)2→CaSO3+H2OSO2+Ca(OH)2→CaSO3+H2O
5.生成硫酸钙:反应产生的硫酸钙溶解在吸收液中,形成硫酸钙
溶液。
6.排放净化后废气:经过吸收塔处理后,废气中的SO2大大减
少。
净化后的废气从吸收塔的顶部或侧面排放出去。
7.产生废液:吸收液中的硫酸钙会逐渐积累,形成废液。
废液中
的硫酸钙通常需要通过后续的处理过程,如过滤、浓缩等,以
回收和处理。
脱硫吸收塔是一种有效的脱硫设备,通过湿法脱硫的方式,能够高效地将SO2从废气中移除,以减少对环境的污染。
酸雾吸收器工作原理

酸雾吸收器工作原理酸雾吸收器是一种常用于工业领域的设备,用于处理含有酸性气体的废气。
它的主要功能是通过吸收和中和酸性气体,将其转化为无害的物质,以减少对环境的污染。
1. 工作原理概述酸雾吸收器基于化学原理,利用吸收液对酸性气体进行吸收和中和。
吸收液通常是一种碱性溶液,如氢氧化钠或者氢氧化钙溶液。
当酸性气体通过吸收器时,它会与吸收液接触并发生化学反应,从而将酸性气体转化为盐或者水。
2. 吸收过程酸性气体进入酸雾吸收器后,首先与吸收液接触。
吸收液通常通过喷淋系统将液体均匀地喷洒到气体流中。
当酸性气体与吸收液接触时,发生气液接触和物质传递的过程。
在这个过程中,酸性气体中的酸份子会与吸收液中的碱份子发生反应,形成盐或者水。
这些反应会释放出热量。
3. 中和过程酸性气体与吸收液反应后,酸性气体中的酸份子会被中和成盐或者水。
这些盐或者水会溶解在吸收液中,从而使吸收液的酸碱度发生变化。
吸收液中的酸碱度变化会通过传感器进行监测,并根据需要进行调节。
普通情况下,吸收液中的酸碱度会定期检测和调整,以确保其正常工作。
4. 吸收液再生随着时间的推移,吸收液中会积累大量的盐或者水。
为了保持吸收液的吸收能力和效率,需要对吸收液进行再生。
吸收液再生的过程通常包括蒸发、冷凝和回收。
在蒸发过程中,吸收液中的水分会被蒸发掉,而盐会留在吸收器中。
蒸发后的水蒸汽会被冷凝成液体,并回收到吸收液中,以保持吸收液的含水量。
5. 废气处理经过酸雾吸收器处理后,废气中的酸性气体已经被吸收和中和,转化为无害的物质。
处理后的废气可以通过排气管道排放到大气中,而不会对环境造成污染。
总结:酸雾吸收器的工作原理是通过吸收液对酸性气体进行吸收和中和,将其转化为无害的物质。
它通过喷淋系统将吸收液均匀地喷洒到气体流中,使酸性气体与吸收液接触并发生化学反应。
反应后的产物溶解在吸收液中,通过定期检测和调节酸碱度来保持吸收液的工作效果。
吸收液会定期进行再生,以去除积累的盐或者水。
吸收液汇总

标准号:
测定物质吸收液一氧化氮、二氧化氮氨二氧化硫
四氯汞钠溶液
硫化氢GBZ/T160.29
无机含氮化合物
GBZ/T 160.33
硫化物
将50ml 冰乙酸 (优级纯) 加入900ml 水中,摇匀;加入5g 对氨基苯磺酸,搅拌溶解后,加入0.05g 盐酸萘乙二胺,溶解后,用水稀释至1000ml,为贮备液。
置于棕色瓶中于冰箱内保存,可稳定1 个月。
临用前,取4 份此液与1份水混合。
吸收液在使用过程中应避免日光直接照射。
吸收液:将26.6ml 硫酸缓缓加入到1000ml 水中。
吸收液:称取10.86g 氯化汞、0.066g 乙二胺四乙酸二钠和5.96g 氯化钾,
溶于水中并稀释至1000ml。
吸收液:溶解2g 亚砷酸钠于100ml 碳酸铵溶液(50g/L)中,用水稀释至
1000ml。
溶液采样法中吸收液的种类

溶液采样法中吸收液的种类溶液采样法作为一种重要的化学分析方法,在分析实验中起着至关重要的作用。
而吸收液则是溶液采样法中必不可少的一种试剂。
本文将介绍吸收液的种类、性质及其适用范围,以便于读者在实验中选择合适的吸收液,准确地进行分析。
一、盐酸吸收液盐酸吸收液主要用于对气体中的氟、氯、溴等元素进行分析,其主要作用是将这些元素转化为易于检测的氯离子。
盐酸吸收液的配制方法是将纯的浓盐酸以一定比例加入蒸馏水中,然后调节pH值至2-3。
二、硫酸吸收液硫酸吸收液是一种广泛使用的吸收液,适用于对气体中的二氧化硫、氯气、氟气、一氧化碳等元素进行分析。
硫酸吸收液具有良好的吸收性能和稳定性,其配制方法是将纯的浓硫酸慢慢稀释到一定的饱和度,并添加适量的蒸馏水。
三、过氧化钾吸收液过氧化钾吸收液主要适用于对氧化亚氮进行分析,具有良好的性能和灵敏度。
过氧化钾吸收液的配制方法是将过氧化钾加入到碱性介质中溶解,然后调节pH值至9-10。
四、乙醇胺吸收液乙醇胺吸收液是一种新型的吸收液,主要适用于对硫化氢、氨气、乙烯等元素进行分析。
乙醇胺吸收液具有不易挥发、吸收性能好的优点,其配制方法是将纯的乙醇胺加入到蒸馏水中慢慢溶解。
五、氢氧化钠吸收液氢氧化钠吸收液主要适用于对二氧化碳进行分析,其作用是将二氧化碳转化为碳酸根离子。
氢氧化钠吸收液的配制方法是将纯的氢氧化钠慢慢加入蒸馏水中,然后调节pH值至11以上。
综上所述,针对不同的分析目标和物质样品,我们可以选择合适的吸收液来配合使用,以达到最佳的分析结果。
同时,在实验操作过程中,需要保持实验室环境的整洁和安全,严格遵守化学实验室安全规定,以确保实验顺利进行。
液体吸收剂的原理

液体吸收剂的原理
液体吸收剂的原理是通过表面张力和亲水性吸附和吸收液体。
液体吸收剂通常是由高分子材料制成的纳米或微米颗粒,具有大量的表面积和孔隙结构。
当液体接触到吸收剂表面时,由于表面张力的作用,液体会被吸附在吸收剂的表面上。
此外,液体吸收剂通常具有亲水性,可以吸附水分子或其他溶液分子。
亲水性意味着吸收剂具有与水分子相互吸引的能力。
当液体接触到吸收剂表面时,吸附剂上的亲水基团会与液体中的分子形成氢键或其他相互作用力,使液体分子被吸附在吸收剂的表面上。
随着液体的吸附,吸收剂会吸收更多的液体,孔隙结构也会逐渐填满。
通过内部的空隙和通道,液体可以在吸收剂内部扩散,从而将液体分散和储存起来。
液体吸收剂可以吸收多种液体,如水、油、溶液等。
液体吸收剂的原理还包括渗透和吸附的过程,其中渗透是指液体分子通过吸收剂的孔隙结构进入内部空间,而吸附则是指液体分子被吸附在吸收剂表面。
总之,液体吸收剂通过表面张力和亲水性吸附和吸收液体,通过孔隙结构和内部空隙储存和分散液体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
创新助手平台提供
北京万方软件股份有限公司
Hale Waihona Puke 2014-06-18报告目录
报告核心要素......................................................................................................... I 一、主题简介........................................................................................................ 1 二、主题相关科研产出总体分析........................................................................ 1 2.1 文献总体产出统计 ................................................................................ 1 2.2 学术关注趋势分析 ................................................................................ 2 三、主题相关科技论文产出分析........................................................................ 2 3.1 中文期刊论文 ........................................................................................ 2 3.1.1 近十年中文期刊论文分布列表 ................................................. 2 3.1.2 中文期刊论文增长趋势 ............................................................. 3 3.1.3 发文较多期刊 ............................................................................. 4 3.1.4 发文较多的机构 ......................................................................... 4 3.1.5 发文较多的人物 ......................................................................... 7 3.1.6 核心期刊分布数量对比 ............................................................. 7 3.1.7 最近相关中文期刊论文 ............................................................ 11 3.1.8 被引较多的相关期刊论文 ........................................................ 16 3.2 学位论文 .............................................................................................. 24 3.2.1 近十年学位论文年代分布列表 ............................................... 24 3.2.2 学位论文增长趋势 ................................................................... 25 3.2.3 硕博学位论文数量对比 ........................................................... 25 3.2.4 发文较多的机构 ....................................................................... 26 3.2.5 发文较多的人物 ....................................................................... 29 3.2.6 最近相关学位论文 ................................................................... 31 3.3 中文会议论文 ...................................................................................... 35 3.3.1 近十年中文会议论文年代分布列表 ....................................... 35 3.3.2 中文会议论文增长趋势 ........................................................... 36 3.3.3 中文会议论文主办单位分布 ................................................... 36 3.3.4 发文较多的机构 ....................................................................... 37 3.3.5 发文较多的人物 ........................................................................ 41 3.3.6 最近相关中文会议论文 ............................................................ 44 3.4 外文期刊论文 ...................................................................................... 49 3.4.1 近十年外文期刊论文年代分布列表 ....................................... 49 3.4.2 外文期刊论文增长趋势 ........................................................... 50 3.4.3 最近相关外文期刊论文 ........................................................... 50 3.5 外文会议论文....................................................................................... 50
