微生物限量标准
微生物限度标准
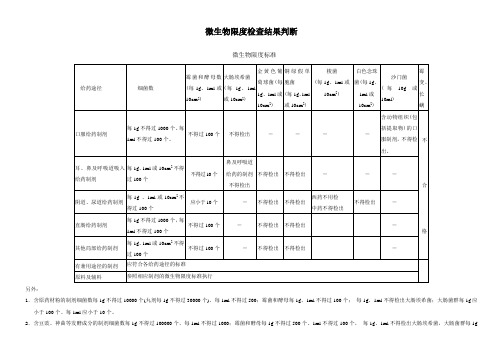
微生物限度检查结果判断
微生物限度标准
另外:
1.含原药材粉的制剂细菌数每1g不得过10000个(丸剂每1g不得过30000个)、每1ml不得过500;霉菌和酵母每1g、1ml不得过100个;每1g、1ml不得检出大肠埃希菌;大肠菌群每1g应小于100个、每1ml应小于10个。
2.含豆豉、神曲等发酵成分的制剂细菌数每1g不得过100000个、每1ml不得过1000;霉菌和酵母每1g不得过500个、1ml不得过100个,每1g、1ml不得检出大肠埃希菌,大肠菌群每1g
应小于100个、每1ml应小于10个。
3.用于表皮或黏膜不完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过1000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
4.用于表皮或黏膜完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过10000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
中国食品微生物限量规定

中国食品微生物限量规定中国食品微生物限量规定
drinking water
次检验
dried aquatic products of
2、致病菌系指沙门氏菌、金黄色葡萄
2、若非指定,以cfu/g或cfu/ml表示condensed milk and
formulated
菌
1、GB 14891.4-1997
如无特别说明,致病菌系指沙门氏菌、志贺氏菌、金黄色葡萄球菌n/c/m/M:
n:同一批次产品应采集的样品件数;
c:最大可允许超出m值得样品数;
m:微生物指标可接受水平的限量值;
M:微生物指标的最高安全限量值。
注1:按照二级采样方案设定的指标,在n个样品中,允许有≤c 个样品其相应微生物指标检验值大于m值。
注2:按照三级采样方案设定的指标,在n个样品中,允许全部样品中相应微生物指标检验值≤m值;允许有≤c个样品其相应微生物指标检验值在m值和M值之间;不允许有样品相应微生物指标检验值大于M值。
例如:n/c/m/M为5/2/(1 000 cfu/g)/(10 000 cfu/g),含义是从一批次中采集5个样品,若5个样品的检验结果均小于或等于m值(≤1 000 cfu/g),则判定为合格;若≤2个样品的结果(X)位于m值和M值之间(1 000 cfu/g<X≤10 000 cfu/g),则判定为合格;若有3个及以上样品的检验结果位于m值和M值之间,则判定为不合格;若有任一个样品的检验结果大于M值(>10 000 cfu/g),则判定为不合格。
非无菌药品微生物限度检查指导原则

非无菌药品微生物限度检查指导原则微生物限度检查是药品质量控制中的重要环节,尤其对于非无菌药品而言更为重要。
本文将对非无菌药品微生物限度检查的指导原则进行详细介绍,旨在提高药品的质量安全性。
一、检验项目及标准非无菌药品微生物限度检查的主要检验项目包括总生菌数、大肠菌群、霉菌和酵母菌等。
每一项检验项目都有相应的标准来衡量合格与否。
以下是常用的标准:1. 总生菌数:根据药典要求,大部分非无菌药品每克不得超过1000 CFU(菌落形成单位)。
2. 大肠菌群:大肠菌群是肠道中的常见菌种,其存在可能暗示有肠源性污染。
检验结果一般要求不得检出大肠菌群。
3. 霉菌和酵母菌:霉菌和酵母菌是环境中广泛存在的微生物,在非无菌药品中的存在可能引发变质,甚至导致严重的药品质量问题。
一般情况下,每克药品中不得检出霉菌和酵母菌。
二、样品的选择和采集在进行微生物限度检查前,需选择合适的样品,并采取正确的样品采集方式。
以下是一些常用的样品选择和采集方法:1. 样品选择:根据药品的特性,选择代表性的样品进行检测。
选取多个批次的不同规格的样品进行检验更有利于全面评估该药品的微生物污染水平。
2. 样品采集:在采集样品前,先进行适当的表面消毒,以避免外源性污染。
采集时应遵循严格的无菌操作,确保样品的真实性和可靠性。
常用的样品采集方法包括划线法、切割法、稀释法等。
三、检验方法和操作流程微生物限度检查需要使用一系列严格的操作流程和检验方法,以保证结果的准确性和可比性。
以下是一般的操作流程:1. 样品预处理:根据药品的特性,选择适当的预处理方法,如溶解、稀释、震荡等,以提高微生物的检出率。
2. 培养基选择:根据不同的菌种需求,选择适宜的培养基进行菌落的培养。
常用的培养基有营养琼脂平板、大肠埃希菌选择平板、马铃薯葡萄糖琼脂平板等。
3. 培养条件:根据菌种的生长特性和检验项目的要求,设定适当的温度、时间和培养条件,以促进菌落的生长。
4. 菌落计数:通过目视或自动计数法,对培养基上的菌落进行计数。
中国药典2020微生物限度检查

中国药典2020微生物限度检查
中国药典2020中对微生物限度的检查要求如下:
1.总菌落数限度:需满足以下要求:
- 不应含有大肠埃希菌或粪链球菌。
- 对无菌制品,其总菌落数规定不应超过制定的标准。
- 必须符合产品特性和验证的任何特定需求。
2.酵母和霉菌限度规定:
- 对无菌制品,每克中不应含有可繁殖的酵母和霉菌。
- 对非无菌制品,每克中不应含有可繁殖的酵母和霉菌。
建议
进行采样和检测多数生物制品样品。
3.大肠菌群限度规定:
- 每克中不应含有大肠菌群。
对某些产品(如消毒剂指定的测定),可以采用其他方法或者规定了合适分析方法的产品例外。
4.针对特定微生物的检查:
- 对某些产品,药典可能要求进行特定微生物的检查,以确保
产品的安全性和质量。
需要注意的是,这只是中国药典2020中关于微生物限度检查
的一般要求,具体的规定可能因产品类型和特性而有所不同。
因此,在进行微生物检查时,需根据产品的特定需求和合适的分析方法进行操作。
在实际生产和质量控制过程中,还需严格按照相关法规和标准进行操作,确保产品质量和安全性。
微生物限度标准
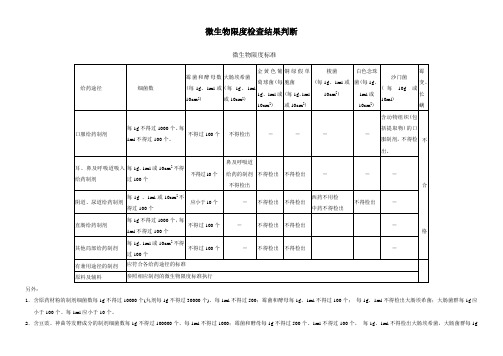
微生物限度检查结果判断
微生物限度标准
另外:
1.含原药材粉的制剂细菌数每1g不得过10000个(丸剂每1g不得过30000个)、每1ml不得过500;霉菌和酵母每1g、1ml不得过100个;每1g、1ml不得检出大肠埃希菌;大肠菌群每1g应小于100个、每1ml应小于10个。
2.含豆豉、神曲等发酵成分的制剂细菌数每1g不得过100000个、每1ml不得过1000;霉菌和酵母每1g不得过500个、1ml不得过100个,每1g、1ml不得检出大肠埃希菌,大肠菌群每1g
应小于100个、每1ml应小于10个。
3.用于表皮或黏膜不完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过1000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
4.用于表皮或黏膜完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过10000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
食品微生物限量规定

中国食品微生物限量规定
如无特别说明,致病菌系指沙门氏菌、志贺氏菌、金黄色葡萄球菌
n/c/m/M:
n:同一批次产品应采集的样品件数;
c:最大可允许超出m值得样品数;
m:微生物指标可接受水平的限量值;
M:微生物指标的最高安全限量值。
注1:按照二级采样方案设定的指标,在n个样品中,允许有≤c个样品其相应微生物指标检验值大于m值。
注2:按照三级采样方案设定的指标,在n个样品中,允许全部样品中相应微生物指标检验值≤m值;允许有≤c个样品其相应微生物指标检验值在m值和M值之间;不允许有样品相应微生物指标检验值大于M值。
例如:n/c/m/M为5/2/(1 000 cfu/g)/(10 000 cfu/g),含义是从一批次中采集5个样品,若5个样品的检验结果均小于或等于m值(≤1 000 cfu/g),则判定为合格;若≤2个样品的结果(X)位于m值和M值之间(1 000 cfu/g<X≤10 000 cfu/g),则判定为合格;若有3个及以上样品的检验结果位于m值和M值之间,则判定为不合格;若有任一个样品的检验结果大于M值(>10 000 cfu/g),则判定为不合格。
食品微生物的限量标准

食品微生物的限量标准食品微生物是指在食品中存在的各种微小微生物,包括细菌、霉菌、酵母菌等。
食品微生物在食品加工、储藏、运输和销售过程中可能会引起食品变质、腐败和污染,对人体健康造成危害。
因此,对食品微生物的限量标准是保障食品安全的重要措施之一。
食品微生物的限量标准主要是指对食品中微生物数量的限定,通常以菌落总数、大肠菌群、霉菌和酵母菌等指标来评价食品微生物的卫生质量。
各国家和地区对食品微生物的限量标准有所不同,但都是为了确保食品安全,保护消费者的健康。
菌落总数是评价食品微生物数量的重要指标之一。
它是指在一定条件下,菌落计数培养基上生长的细菌总数。
菌落总数的高低反映了食品中微生物的数量多少,是评价食品新鲜度和卫生质量的重要依据。
一般来说,菌落总数超过一定标准就会影响食品的品质和安全,甚至对人体健康造成危害。
大肠菌群是评价食品卫生质量的重要指标之一。
大肠菌群是一类肠道细菌的总称,它们存在于环境中和动植物体内,是一类潜在的致病菌。
食品中如果含有大肠菌群超标,就可能存在粪便污染或者加工过程中卫生条件不佳的问题,对消费者的健康构成潜在威胁。
霉菌和酵母菌是食品微生物中的另外两类重要指标。
霉菌和酵母菌在食品中的存在不仅会导致食品变质、腐败,还可能产生毒素对人体健康造成危害。
因此,对这两类微生物的限量标准也是食品安全的重要内容之一。
食品微生物的限量标准是食品安全的重要保障措施。
严格遵守食品微生物的限量标准,不仅能够保证食品的质量和安全,也能够保护消费者的健康。
同时,加强食品生产过程中的卫生管理,确保食品生产过程的卫生安全,也是保障食品微生物限量标准得以实施的重要环节。
总之,食品微生物的限量标准是食品安全的重要内容,对食品微生物的限量标准的严格执行,能够有效保障食品的质量和安全,保护消费者的健康。
同时,食品生产企业应加强卫生管理,确保食品生产过程的卫生安全,为食品微生物的限量标准的执行提供保障。
只有这样,才能够让消费者放心食用食品,确保食品安全。
微生物限量标准
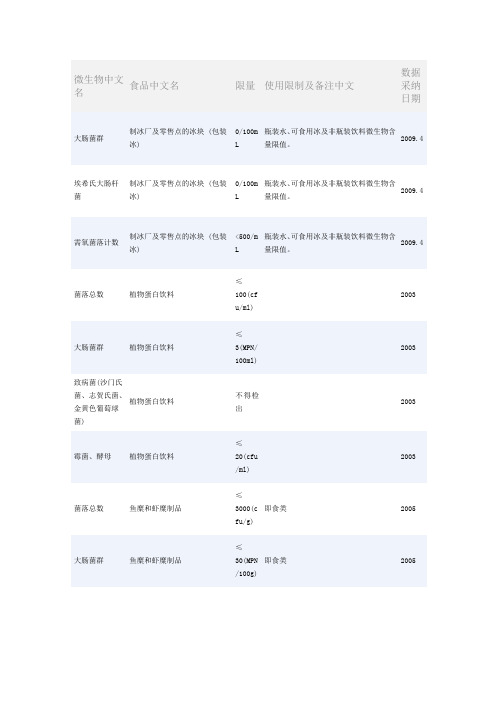
微生物中文名食品中文名限量使用限制及备注中文数据采纳日期大肠菌群制冰厂及零售点的冰块 (包装冰)0/100mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4埃希氏大肠杆菌制冰厂及零售点的冰块 (包装冰)0/100mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4需氧菌落计数制冰厂及零售点的冰块 (包装冰)<500/mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4菌落总数植物蛋白饮料≤100(cfu/ml)2003大肠菌群植物蛋白饮料≤3(MPN/100ml)2003致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌) 植物蛋白饮料不得检出2003霉菌、酵母植物蛋白饮料≤20(cfu/ml)2003菌落总数鱼糜和虾糜制品≤3000(cfu/g)即食类2005大肠菌群鱼糜和虾糜制品≤30(MPN/100g)即食类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 鱼糜和虾糜制品不得检出即食类2005菌落总数鱼糜和虾糜制品≤50000(cfu/g)非即食类2005大肠菌群鱼糜和虾糜制品≤450(MPN/100g)非即食类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 鱼糜和虾糜制品不得检出非即食类2005微生物鱼罐头符合罐头食品商业无菌要求2005菌落总数油炸小食品类≤1000(cfu/ml)2003大肠菌群油炸小食品类≤30(MPN/100ml)2003致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌) 油炸小食品类不得检出2003菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)婴儿配方粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)婴儿配方粉1997病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出婴儿配方粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)婴儿配方粉1997菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)(即食类)≤50000(cfu/g)(非即食类)婴幼儿补充谷粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)(即食类)≤90/(MPN/100g)(非即食类)婴幼儿补充谷粉1997致病菌(肠道致病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出婴幼儿补充谷粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)婴幼儿补充谷粉1997菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)较大婴儿和幼儿配方粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)较大婴儿和幼儿配方粉1997病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出较大婴儿和幼儿配方粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)较大婴儿和幼儿配方粉1997微生物婴幼儿辅助食品—肉泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—苹果泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—鸡肉菜糊无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—胡萝卜泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—骨泥无致病菌及因微生物作用所引起的腐败象征1989菌落总数婴幼儿辅助食品—番茄汁≤80(cfu/g)1989大肠菌群婴幼儿辅助食品—番茄汁≤3/(MPN/100g)1989致病菌(沙门氏菌、志贺氏菌、葡萄球菌) 婴幼儿辅助食品—番茄汁不得检出1989霉菌婴幼儿辅助食品—番茄汁≤40cfu/g或cfu/mL1989菌落总数婴幼儿断奶期辅助食品≤30000(cfu/g)即食类1997大肠菌群婴幼儿断奶期辅助食品≤40/(MPN/100g)即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期辅助食品不得检出即食类1997菌落总数婴幼儿断奶期辅助食品≤50000(cfu/g)非即食类1997大肠菌群婴幼儿断奶期辅助食品≤90/(MPN/100g)非即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期辅助食品不得检出非即食类1997菌落总数婴幼儿断奶期补充食品≤30000(cfu/g)即食类1997大肠菌群婴幼儿断奶期补充食品≤40/(MPN/100g)即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期补充食品不得检出即食类1997菌落总数婴幼儿断奶期补充食品≤50000(cfu/g)非即食类1997大肠菌群婴幼儿断奶期补充食品≤90/(MPN/100g)非即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期补充食品不得检出非即食类1997菌落总数婴儿配方乳粉Ⅰ≤30000(cfu/g)1997大肠菌群婴儿配方乳粉Ⅰ≤40/(MPN/100g)1997致病菌(肠道致病菌及致病球菌)婴儿配方乳粉Ⅰ不得检出1997酵母和霉菌婴儿配方乳粉Ⅰ≤50(cfu/g)1997菌落总数婴儿配方粉Ⅱ,Ⅲ≤30000(cfu/g)1997大肠菌群婴儿配方粉Ⅱ,Ⅲ≤40/(MPN/100g)1997致病菌(肠道致病菌及致病球菌)婴儿配方粉Ⅱ,Ⅲ不得检出1997酵母和霉菌婴儿配方粉Ⅱ,Ⅲ≤50(cfu/g)1997大肠菌群饮用天然矿泉水≤0(MPN/100ml)1个样品,如果检测结果为0合格;检测结果大于等于1但小于2时,进行第二次检测;检测结果大于等于2,不合格。
生物制品原液微生物限度标准

生物制品原液微生物限度标准
生物制品原液的微生物限度标准主要依据《中国药典》和《药品生产质量管理规范》进行制定。
以下是具体的标准:
1. 对于非无菌的生物制品,其微生物限度标准通常包括细菌、霉菌和酵母菌总数以及控制菌的检查。
2. 细菌、霉菌和酵母菌总数的标准:对于每1ml生物制品原液,细菌数不
得超过100cfu,霉菌和酵母菌数不得超过100cfu。
同时,对于每1g生物
制品原液,细菌数不得超过1000cfu,霉菌和酵母菌数不得超过1000cfu。
3. 控制菌检查的标准:对于生物制品原液,应按照《中国药典》和《药品生产质量管理规范》的规定进行控制菌检查,如大肠杆菌、金黄色葡萄球菌等。
控制菌检查应为阴性。
4. 对于有特殊用途或规定的生物制品,如用于免疫治疗的制品、基因治疗制品等,其微生物限度标准应根据相关规定进行制定。
此外,在生物制品的生产过程中,应遵循无菌操作规程,采用经过验证的无菌工艺和设备,并进行严格的质量控制,确保产品的安全性和有效性。
药典微生物限度标准

药典微生物限度标准
药典微生物限度标准是指药典(如中国药典、美国药典等)规定的药品中允许存在的微生物数量的限制。
微生物限度是为了保证药品的质量和安全所设立的,合理的微生物限度可防止和减少可能在药品生产和贮存过程中引入的微生物污染。
药典微生物限度标准通常需要考虑以下几个方面:
1. 总微生物数:药典规定了应当检测的总微生物数的限制,表示制备过程中可能存在的各种微生物的总数量。
不同类别的药品对总微生物数的限制可能有所不同。
2. 霉菌和酵母菌:霉菌和酵母菌是一类常见的微生物,它们生长迅速,可以在药品中引起变质和腐败。
因此,药典通常规定了对霉菌和酵母菌的数量限制。
3. 大肠菌群:大肠菌群是常见的肠道致病菌,它们存在于环境中,如食品、水源等,可能通过生产过程中的污染进入药品中。
药典通常规定了对大肠菌群的数量限制。
4. 特定致病菌:药典对某些具有危害性的致病菌也可能设置了数量限制,如沙门氏菌、金黄色葡萄球菌等。
药典微生物限度标准的设定是为了确保药品的质量和安全,各国的药典对微生物限度标准可能会有所不同。
生产药品时,企业需要按照药典要求的微生物限度标准进行检测,并确保药品符合规定的标准。
微生物限度内控样品检测标准

微生物限度内控样品检测标准
微生物限度内控样品检测标准通常包括以下内容:
1.菌落总数:每100ml样品中,菌落总数应控制在一定范围内,以保证样品的卫生质量。
2.大肠菌群:每100ml样品中,大肠菌群不得检出,以防止肠道致病菌的污染。
3.霉菌和酵母菌:每100ml样品中,霉菌和酵母菌的数量也应控制在一定范围内,以避免食品中腐败菌的滋生。
4.其他微生物:根据不同产品的要求,可能还需要对沙门氏菌、志贺氏菌等其他微生物进行检测,以确保产品的安全性。
在检测过程中,需要采用适当的检测方法,如常规法、培养基稀释法、高速离心集菌法等,以保证检测结果的准确性和可靠性。
同时,实验室环境、设备、操作规范等也需要符合相关规定,以确保检测结果的可靠性。
需要注意的是,不同的产品、不同的生产环境、不同的工艺流程都会影响微生物限度内控样品检测标准的具体要求,因此在实际操作中需要根据具体情况制定相应的检测标准。
药典 微生物限度标准

药典微生物限度标准微生物限度是指在药品中允许存在的微生物数量的标准,它是评价药品质量的重要指标之一。
微生物限度标准的制定是为了保证药品的安全性、有效性和稳定性,有效地控制微生物对药品的污染和变质。
微生物限度标准的制定需要考虑药品的性质、用途、生产工艺和储存条件等因素,以确保药品在整个生产和使用过程中都能保持良好的品质。
微生物对药品的污染可能会导致药品的变质和降低药品的有效性,甚至对人体健康造成危害。
因此,制定合理的微生物限度标准对于保障药品质量和人体健康具有重要意义。
微生物限度标准通常包括细菌总数、霉菌和酵母菌的数量限度。
细菌总数是指在一定数量的制剂中存在的细菌总数的限度,它反映了药品的卫生状况和生产过程的卫生控制水平。
霉菌和酵母菌是常见的微生物污染源,它们可能会导致药品的霉变和酵败,因此对其数量也有一定的限制标准。
在药典中,针对不同类型的药品和不同的用途,制定了相应的微生物限度标准。
例如,对于口服固体制剂,其微生物限度标准要求较为严格,因为口服固体制剂在服用过程中会直接进入消化道,对人体的影响较大。
而对于外用制剂,其微生物限度标准相对较宽松,因为外用制剂在使用过程中不会直接进入人体内部,对人体的影响较小。
此外,对于注射剂和眼科制剂等高风险药品,其微生物限度标准要求更为严格,以确保药品的安全性和稳定性。
在生产过程中,严格控制微生物的污染是确保药品质量的关键步骤之一。
生产企业需要建立健全的生产管理体系,包括良好的生产环境、严格的生产操作规程、有效的清洁消毒措施等,以确保药品在生产过程中不受微生物污染。
同时,生产企业还需要建立完善的微生物检测方法和检测体系,对原辅料、中间体和成品进行全面的微生物检测,确保药品符合微生物限度标准的要求。
总之,微生物限度标准是评价药品质量的重要指标之一,对于保障药品质量和人体健康具有重要意义。
生产企业应严格遵守药典中制定的微生物限度标准,建立健全的生产管理体系,确保药品在生产和使用过程中符合微生物限度标准的要求,为人体健康提供保障。
食品微生物限量规定
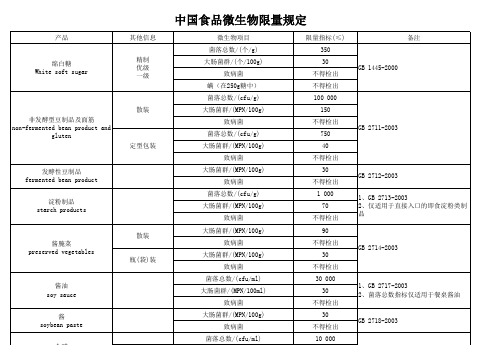
中国食品微生物限量规定
drinking water
次检验
dried aquatic products of
2、致病菌系指沙门氏菌、金黄色葡萄
2、若非指定,以cfu/g或cfu/ml表示condensed milk and formulated
菌
1、GB 14891.4-1997
如无特别说明,致病菌系指沙门氏菌、志贺氏菌、金黄色葡萄球菌
n/c/m/M:
n:同一批次产品应采集的样品件数;
c:最大可允许超出m值得样品数;
m:微生物指标可接受水平的限量值;
M:微生物指标的最高安全限量值。
注1:按照二级采样方案设定的指标,在n个样品中,允许有≤c个样品其相应微生物指标检验值大于m值。
注2:按照三级采样方案设定的指标,在n个样品中,允许全部样品中相应微生物指标检验值≤m值;允许有≤c个样品其相应微生物指标检验值在m值和M值之间;不允许有样品相应微生物指标检验值大于M值。
例如:n/c/m/M为5/2/(1 000 cfu/g)/(10 000 cfu/g),含义是从一批次中采集5个样品,若5个样品的检验结果均小于或等于m值(≤1 000 cfu/g),则判定为合格;若≤2个样品的结果(X)位于m值和M值之间(1 000 cfu/g<X≤10 000 cfu/g),则判定为合格;若有3个及以上样品的检验结果位于m值和M值之间,则判定为不合格;若有任一个样品的检验结果大于M值(>10 000 cfu/g),则判定为不合格。
食品中微生物限量标准

食品中微生物限量标准
食品中微生物限量标准是对食品中生物性污染物含量的限定。
它既能保障食品
安全,又能把控生产过程中产品质量,是国家标准规定中最为重要的一部分。
微生物限量标准根据食品中微生物种类和数量特征,分别针对食品及其原材料
和加工品,制定极限限量值,以控制食品污染。
营养价值,以及保持食品的长期新鲜度。
微生物限量标准分为总菌数限量和大肠埃希菌群(ESP)限量。
总菌数限量是
指针对开封食品中一定样本容量中,检测到的微生物活体总数,一般分为两种:非标准限量和标准限量。
ESP限量,主要指大肠埃希菌群的限定,以大肠菌株来衡量该类微生物的活力,主要检测冷冻,冷藏和回温食品,大肠菌群有极限限量值。
微生物限量是食品安全的重要保障,也是食品质量的确定依据。
由于食品的安
全性和品质都直接关系到消费者的身体健康,因此,食品微生物限量标准对于保障食品安全和维护消费者权益至关重要。
国家食品微生物限量标准

国家食品微生物限量标准
国家食品微生物限量标准是指在食品中允许存在的微生物的数量限制,以确保食品的质量和安全。
不同国家和地区的食品微生物限量标准可能有所不同,根据当地法律法规、卫生标准和食品安全要求制定。
常见的食品微生物限量标准包括以下几个方面:
1. 总菌落计数限量:表示食品中允许存在的总细菌数量的上限。
总菌落计数是指通过培养方法将食品中的细菌培育出来并计数。
2. 沙门氏菌限量:食品中不允许检出沙门氏菌,因为沙门氏菌是一种致病菌,可以引起食物中毒。
3. 大肠菌群限量:大肠菌群包括致病性大肠杆菌等菌种,其存在可能表示食品受到粪便污染,因此食品中允许存在的大肠菌群数量有一定限制。
4. 霉菌限量:食品中存在的霉菌数量也有一定限制。
霉菌的存在可能导致食品腐败、产生毒素等问题。
除了上述常见的微生物限量标准,不同食品可能还会有其他特定的微生物限量标准,比如嗜热菌、嗜盐菌、产气荚膜梭菌等。
这些限量标准的制定都旨在确保食品的质量和安全,保护消费者的健康。
食品微生物限量标准

食品微生物限量标准食品微生物限量标准是指对食品中微生物数量的限定标准,它是保障食品安全和卫生的重要指标。
微生物是一类微小的生物体,包括细菌、真菌、酵母菌和霉菌等,它们存在于自然界的各个环境中,包括空气、土壤、水和食品中。
在食品加工、储藏和运输过程中,微生物可能会引起食品变质、腐败和产生有害物质,对人体健康造成危害。
因此,对食品中微生物的限量标准是非常必要的。
食品微生物限量标准的制定是基于对微生物对食品质量和安全的影响进行科学评价的基础上,结合食品的种类、加工工艺、保存条件等因素进行制定的。
不同类型的食品对微生物的容忍度是不同的,因此,不同种类的食品都有相应的微生物限量标准。
一般来说,食品微生物限量标准包括总菌落数、大肠菌群、霉菌和酵母菌等指标。
总菌落数是指在一定条件下,一定时间内,菌落形成的数量。
总菌落数是评价食品卫生质量的重要指标之一,它反映了食品中微生物的总体数量。
食品中的总菌落数超过限量标准,可能导致食品变质、腐败,甚至产生有害物质,对人体健康造成危害。
大肠菌群是一类能在37℃下生长并产生酶的革兰氏阴性杆菌的总称。
大肠菌群是评价食品卫生质量的重要指标之一,它是一类致病菌的指示菌,其数量超过限量标准,可能导致食品中存在致病菌,对人体健康造成危害。
霉菌和酵母菌是一类能在食品中生长并产生孢子的真菌的总称。
霉菌和酵母菌是评价食品卫生质量的重要指标之一,它们在食品中的存在可能导致食品变质、腐败,甚至产生有害物质,对人体健康造成危害。
食品微生物限量标准的制定不仅是为了保障食品安全和卫生,也是为了引导食品生产企业加强食品卫生管理,提高食品质量。
食品生产企业应当严格按照食品微生物限量标准进行生产,加强生产过程中的卫生管理,确保生产出的食品符合卫生标准。
总之,食品微生物限量标准是保障食品安全和卫生的重要指标,它对食品生产企业和消费者都具有重要意义。
我们应当加强对食品微生物限量标准的学习和认识,提高对食品安全和卫生的重视,共同维护食品安全和卫生。
食品微生物限量标准

食品微生物限量标准食品微生物限量标准是指对食品中微生物数量的限制要求,其目的是保障食品的安全卫生,防止食品中微生物过多导致食品变质、腐败或引发食源性疾病。
食品微生物主要包括细菌、霉菌和酵母等,它们在食品加工、储藏和运输过程中可能会引起食品变质,对人体健康造成危害。
食品微生物限量标准的制定是基于对不同食品的微生物污染情况、食品特性以及人群的消费习惯等因素进行科学评估而确定的。
不同类型的食品对微生物的容忍度不同,因此针对不同食品制定不同的微生物限量标准是非常必要的。
在食品微生物限量标准中,通常会规定食品中允许的总菌落数、大肠菌群、沙门氏菌、金黄色葡萄球菌等微生物的限量要求。
这些限量标准的制定是基于对食品中微生物对人体健康的潜在危害进行科学评估而确定的,是食品安全的重要保障措施。
食品微生物限量标准的执行对食品生产企业和监管部门都具有重要意义。
对于食品生产企业来说,严格执行微生物限量标准是保证产品质量和食品安全的基本要求,也是企业自身形象和信誉的体现。
对于监管部门来说,加强对食品微生物限量标准的监督检查,能够有效地减少食品安全事故的发生,保障人民群众的身体健康。
在实际生产和监管过程中,应当加强对食品微生物限量标准的宣传和培训工作,提高从业人员对微生物限量标准的认识和重视程度,确保标准的有效执行。
同时,还应加强对食品生产过程中的卫生管理和控制措施的落实,减少微生物污染的可能性,保证食品的安全和卫生。
总的来说,食品微生物限量标准是保障食品安全和卫生的重要手段,对于食品生产企业、监管部门和消费者都具有重要意义。
只有严格执行微生物限量标准,加强对食品生产过程的监管和管理,才能有效地保障人民群众的饮食安全,促进食品行业的健康发展。
欧洲药典微生物限度标准

欧洲药典对微生物限度的标准通常包括以下几项:
1.细菌总数:每克或每毫升药品中含有的细菌总数不得超过10000个。
2.霉菌和酵母菌总数:每克或每毫升药品中含有的霉菌和酵母菌总数不得超过100个。
3.革兰阴性杆菌:每克或每毫升药品中不得检出革兰阴性杆菌。
4.沙门氏菌:每克或每毫升药品中不得检出沙门氏菌。
5.志贺氏菌:每克或每毫升药品中不得检出志贺氏菌。
6.金黄色葡萄球菌:每克或每毫升药品中不得检出金黄色葡萄球菌。
7.支原体和衣原体:每克或每毫升药品中不得检出支原体和衣原体。
8.病毒:每毫升药品中不得检出病毒。
这些标准旨在确保药品的安全性和有效性,防止因微生物污染而对使用者造成危害。
请注意,具体的微生物限度标准可能因不同的药品和用途而有所不同。
在实际操作中,应严格按照相关法规和标准进行药品的微生物限度检查。
灭菌前微生物限度监控标准

灭菌前微生物限度监控标准
灭菌前微生物限度监控标准是指在进行灭菌操作前,对制备完毕的产品进行微生物限度测试,以确保产品中微生物的数量符合卫生标准和安全规定,从而保证消费者的健康与安全。
具体的标准包括:
1.菌落总数限度:根据不同类型的产品及其应用领域,菌落总数限度也不尽相同。
一般来说,对于药品和食品来说,菌落总数要求极其严格,往往以CFU/g为单位,最大值一般在100-1000之间。
2.厌氧菌限度:防止产生有毒代谢物及恶臭气味。
这个值也根据应用领域不同,其限度也有所不同。
3.酵母和霉菌限度:这个值取决于产品的成分和使用情况,通常以CFU/g为单位。
4.大肠杆菌限度:大肠杆菌是一种肠道菌,它的存在会伴随着可能存在的其他细菌和病毒,因此限度非常严格,一般为未检出。
总之,灭菌前微生物限度监控标准对于保证产品的健康与安全非常重要,需要根据不同的产品应用领域和成分来确定相应的标准,并严格执行。
微生物限度标准

药品微生物限度标准非无菌药品的微生物限度标准是基于药品的给药途径和对患者健康潜在的危害以及药品的特殊性而制订的。
药品生产、贮存、销售过程中的检验,化学药品原料药、中药提取物及辅料的检验,新药标准制订,进口药品标准复核,考察药品质量及仲裁等,除另有规定外,其微生物限度均以本标准为依据。
非无菌制剂的总需氧菌数、总霉菌及酵母菌数测定照附录×××检查;非无菌制剂的控制菌检查照附录×××检查。
本限度标准解释如下:101CFU:最大可接受限值=20;102CFU:最大可接受限值=200;103CFU:最大可接受限值=2000。
以此类推。
1.制剂通则、品种项下要求无菌的制剂及标示无菌的制剂应符合无菌检查法规定。
2.口服给药制剂2.1 不含药材原粉的口服给药制剂需氧菌总数每1g不得过103cfu。
每1ml不得过102cfu。
霉菌及酵母菌总数每1g不得过102cfu。
每1ml不得过101cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌含脏器提取物的口服给药制剂每10g或10ml不得检出。
2.2含药材原粉的口服制剂2.2.1不含豆豉、神曲等发酵原粉的口服给药制剂需氧菌总数每1g不得过10000cfu。
每1ml不得过100cfu。
霉菌及酵母菌总数每1g或1ml不得过100cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌每10g或10ml不得检出。
耐胆盐革兰阴性菌每1g应小于102个。
每1ml应小于101个。
2.2.2 含豆豉、神曲等发酵原粉的口服制剂需氧菌总数每1g不得过100000cfu。
每1ml不得过1000cfu。
霉菌和酵母菌总数每1g不得过500cfu。
每1ml不得过100cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌每10g或10ml不得检出。
耐胆盐革兰阴性菌每1g应小于102个。
每1ml应小于101个。
3.局部给药制剂3.1 用于手术、烧伤或严重创伤的局部给药制剂应符合无菌检查法规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微生物中文名食品中文名限量使用限制及备注中文数据采纳日期大肠菌群制冰厂及零售点的冰块(包装冰)0/100mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4埃希氏大肠杆菌制冰厂及零售点的冰块(包装冰)0/100mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4需氧菌落计数制冰厂及零售点的冰块(包装冰)<500/mL瓶装水、可食用冰及非瓶装饮料微生物含量限值。
2009.4菌落总数植物蛋白饮料≤100(cfu/ml)2003大肠菌群植物蛋白饮料≤3(MPN/100ml)2003致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌) 植物蛋白饮料不得检出2003霉菌、酵母植物蛋白饮料≤20(cfu/ml)2003菌落总数鱼糜和虾糜制品≤3000(cfu/g)即食类2005大肠菌群鱼糜和虾糜制品≤30(MPN/100g)即食类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 鱼糜和虾糜制品不得检出即食类2005菌落总数鱼糜和虾糜制品≤50000(cfu/g)非即食类2005大肠菌群鱼糜和虾糜制品≤450(MPN/100g)非即食类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 鱼糜和虾糜制品不得检出非即食类2005微生物鱼罐头符合罐头食品商业无菌要求2005菌落总数油炸小食品类≤1000(cfu/ml)2003大肠菌群油炸小食品类≤30(MPN/100ml)2003致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌) 油炸小食品类不得检出2003菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)婴儿配方粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)婴儿配方粉1997致病菌(肠道致病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出婴儿配方粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)婴儿配方粉1997菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)(即食类)≤50000(cfu/g)(非即食类)婴幼儿补充谷粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)(即食类)≤90/(MPN/100g)(非即食类)婴幼儿补充谷粉1997致病菌(肠道致病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出婴幼儿补充谷粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)婴幼儿补充谷粉1997菌落总数婴幼儿配方粉及婴幼儿补充谷粉≤30000(cfu/g)较大婴儿和幼儿配方粉1997大肠菌群婴幼儿配方粉及婴幼儿补充谷粉≤40/(MPN/100g)较大婴儿和幼儿配方粉1997致病菌(肠道致病菌及致病球菌)婴幼儿配方粉及婴幼儿补充谷粉不得检出较大婴儿和幼儿配方粉1997酵母和霉菌婴幼儿配方粉及婴幼儿补充谷粉≤50(cfu/g)较大婴儿和幼儿配方粉1997微生物婴幼儿辅助食品—肉泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—苹果泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—鸡肉菜糊无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—胡萝卜泥无致病菌及因微生物作用所引起的腐败象征1989微生物婴幼儿辅助食品—骨泥无致病菌及因微生物作用所引起的腐败象征1989菌落总数婴幼儿辅助食品—番茄汁≤80(cfu/g)1989大肠菌群婴幼儿辅助食品—番茄汁≤3/(MPN/100g)1989致病菌(沙门氏菌、志贺氏菌、葡萄球菌) 婴幼儿辅助食品—番茄汁不得检出1989霉菌婴幼儿辅助食品—番茄汁≤40cfu/g或cfu/mL1989菌落总数婴幼儿断奶期辅助食品≤30000(cfu/g)即食类1997大肠菌群婴幼儿断奶期辅助食品≤40/(MPN/100g)即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期辅助食品不得检出即食类1997菌落总数婴幼儿断奶期辅助食品≤50000(cfu/g)非即食类1997大肠菌群婴幼儿断奶期辅助食品≤90/(MPN/100g)非即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期辅助食品不得检出非即食类1997菌落总数婴幼儿断奶期补充食品≤30000(cfu/g)即食类1997大肠菌群婴幼儿断奶期补充食品≤40/(MPN/100g)即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期补充食品不得检出即食类1997菌落总数婴幼儿断奶期补充食品≤50000(cfu/g)非即食类1997大肠菌群婴幼儿断奶期补充食品≤90/(MPN/100g)非即食类1997致病菌(肠道致病菌及致病球菌)婴幼儿断奶期补充食品不得检出非即食类1997菌落总数婴儿配方乳粉Ⅰ≤30000(cfu/g)1997大肠菌群婴儿配方乳粉Ⅰ≤40/(MPN/100g)1997致病菌(肠道致病菌及致病球菌)婴儿配方乳粉Ⅰ不得检出1997酵母和霉菌婴儿配方乳粉Ⅰ≤50(cfu/g)1997菌落总数婴儿配方粉Ⅱ,Ⅲ≤30000(cfu/g)1997大肠菌群婴儿配方粉Ⅱ,Ⅲ≤40/(MPN/100g)1997致病菌(肠道致病菌及致病球菌)婴儿配方粉Ⅱ,Ⅲ不得检出1997酵母和霉菌婴儿配方粉Ⅱ,Ⅲ≤50(cfu/g)1997大肠菌群饮用天然矿泉水≤0(MPN/100ml)1个样品,如果检测结果为0合格;检测结果大于等于1但小于2时,进行第二次检测;检测结果大于等于2,不合格。
2008粪链球菌饮用天然矿泉水≤0(cfu/250ml)1个样品,如果检测结果为0合格;检测结果大于等于1但小于2时,进行第二次检测;检测结果大于等于2,不合格。
2008铜绿假单胞菌饮用天然矿泉水≤0(cfu/250ml)1个样品,如果检测结果为0合格;检测结果大于等于1但小于2时,进行第二次检测;检测结果大于等于2,不合格。
2008产气荚膜梭菌饮用天然矿泉水≤0(cfu/50ml)1个样品,如果检测结果为0合格;检测结果大于等于1但小于2时,进行第二次检测;检测结果大于等于2,不合格。
2008大肠菌群饮用天然矿泉水n=4,c=1m=0,M=2(MPN/100ml)第二次检测2008粪链球菌饮用天然矿泉水n=4,c=1m=0,M=2(cfu/250ml)第二次检测2008铜绿假单胞菌饮用天然矿泉水n=4,c=1m=0,M=2(cfu/250ml)第二次检测2008产气荚膜梭菌饮用天然矿泉水n=4,c=1m=0,M=2(cfu/50ml)第二次检测2008菌落总数鲜、冻禽产品≤50000(cfu/g)冻禽产品2005大肠菌群鲜、冻禽产品≤5000(MPN/100g)冻禽产品2005沙门氏菌鲜、冻禽产品0/25g(n=5)冻禽产品2005出血性大肠埃希氏菌(O157:H7)鲜、冻禽产品0/25g(n=5)冻禽产品2005菌落总数鲜、冻禽产品≤10000(cfu/g)鲜禽产品2005大肠菌群鲜、冻禽产品≤10000(MPN/100g)鲜禽产品2005沙门氏菌鲜、冻禽产品0/25g(n=5)鲜禽产品2005出血性大肠埃希氏菌(O157:H7)鲜、冻禽产品0/25g(n=5)鲜禽产品2005菌落总数糖果≤750(cfu/g)硬质糖果、抛光糖果2003大肠菌群糖果≤30(MPN/100g)硬质糖果、抛光糖果2003致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 糖果不得检出硬质糖果、抛光糖果2003菌落总数糖果≤2500(cfu/g)夹心糖果2003大肠菌群糖果≤90(MPN/100g)夹心糖果2003致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 糖果不得检出夹心糖果2003菌落总数糖果≤20000(cfu/g)焦香糖果、充气糖果2003大肠菌群糖果≤440(MPN/100g)焦香糖果、充气糖果2003致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 糖果不得检出焦香糖果、充气糖果2003菌落总数糖果≤1000(cfu/g)凝胶糖果2003大肠菌群糖果≤90(MPN/100g)凝胶糖果2003致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 糖果不得检出凝胶糖果2003菌落总数碳酸饮料≤100(cfu/ml)2003大肠菌群碳酸饮料≤6(MPN/100ml)2003致病菌((沙门氏菌、志贺氏菌))碳酸饮料不得检出2003霉菌碳酸饮料≤10(cfu/ml)2003酵母菌碳酸饮料≤10(cfu/ml)2003大肠菌群酸牛乳≤90(MPN/100g)1999致病菌(肠道致病菌及致病球菌)酸牛乳不得检出1999菌落总数水产调味品≤8000(cfu/g)2005大肠菌群水产调味品≤30(MPN/100g)2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 水产调味品不得检出2005菌落总数熟肉制品50000(cfu/g)肉灌肠2005大肠菌群熟肉制品30(MPN/100g)肉灌肠2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出肉灌肠2005菌落总数熟肉制品≤50000(cfu/g)烧烤肉类2005大肠菌群熟肉制品90(MPN/100g)烧烤肉类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品≤不得检出烧烤肉类2005菌落总数熟肉制品≤50000(cfu/g)肴肉2005大肠菌群熟肉制品≤150(MPN/100g)肴肉2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出肴肉2005菌落总数熟肉制品≤80000(cfu/g)酱卤肉类2005大肠菌群熟肉制品≤150(MPN/100g)酱卤肉类2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出酱卤肉类2005菌落总数熟肉制品≤30000(cfu/g)熏煮火腿2005大肠菌群熟肉制品≤90(MPN/100g)熏煮火腿2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出熏煮火腿2005菌落总数熟肉制品≤30000(cfu/g)其他熟肉制品2005大肠菌群熟肉制品≤90(MPN/100g)其他熟肉制品2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出其他熟肉制品2005菌落总数熟肉制品≤30000(cfu/g)肉松、油酥肉松、肉松粉2005大肠菌群熟肉制品≤40(MPN/100g)肉松、油酥肉松、肉松粉2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出肉松、油酥肉松、肉松粉2005菌落总数熟肉制品≤10000(cfu/g)肉干、肉糜脯、肉脯、其他熟肉干制品2005大肠菌群熟肉制品≤30(MPN/100g)肉干、肉糜脯、肉脯、其他熟肉干制品2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 熟肉制品不得检出肉干、肉糜脯、肉脯、其他熟肉干制品2005菌落总数食用螺旋藻粉≤10000(cfu/g)1997大肠菌群食用螺旋藻粉≤90(MPN/100g)1997霉菌食用螺旋藻粉≤25(cfu/g)1997致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌)食用螺旋藻粉不得检出1997菌落总数食糖≤100(cfu/g)(白砂糖、绵砂糖)≤500(cfu/g)(赤砂糖)适用于甘蔗及甜菜为原料生产的原糖、白砂糖、绵砂糖及赤砂糖2005大肠菌群食糖≤30(MPN/100g)适用于甘蔗及甜菜为原料生产的原糖、白砂糖、绵砂糖及赤砂糖2005霉菌食糖≤25(cfu/g)适用于甘蔗及甜菜为原料生产的原糖、白砂糖、绵砂糖及赤砂糖2005酵母菌食糖≤10(cfu/g)适用于甘蔗及甜菜为原料生产的原糖、白砂糖、绵砂糖及赤砂糖2005致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌、溶血性链球菌) 食糖不得检出适用于甘蔗及甜菜为原料生产的原糖、白砂糖、绵砂糖及赤砂糖2005菌落总数食品工业用浓缩果蔬沐(浆)≤1000(cfu/g)2005大肠菌群食品工业用浓缩果蔬沐(浆)≤30(MPN/100g)2005霉菌食品工业用浓缩果蔬沐(浆)≤20(cfu/mL)2005酵母菌食品工业用浓缩果蔬沐(浆)≤20(cfu/mL)2005致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌)食品工业用浓缩果蔬沐(浆)不得检出2005菌落总数食醋≤10000(cfu/ml)2003大肠菌群食醋≤3(MPN/100g)2003致病菌(沙门氏菌、金黄色葡萄球菌、志贺氏菌) 食醋不得检出2003细菌总数生鲜牛乳≤50(万个/mL)Ⅰ级收购标准1986细菌总数生鲜牛乳≤100(万个/mL)Ⅱ级收购标准1986细菌总数生鲜牛乳≤200(万个/mL)Ⅲ级收购标准1986细菌总数生鲜牛乳≤400(万个/mL)Ⅳ级收购标准1986菌落总数生活饮用水≤100(cfu/ml)当水样检出总大肠杆菌时,应进一步检测大肠埃希氏菌和耐热大肠菌群。
