硫酸、销酸和氨气教学课件
合集下载
硫酸、硝酸和氨PPT教学课件

NaOH溶液,恰好使溶液中的全部转化成沉淀,
则原硝酸溶液的浓度为
mol/L。
课堂练习
3、(实验班)m g 铁粉恰好与100 mL 1.2 mol·L1的稀硝酸完全反应,若生成的气体均为NO, 求:
(1)生成的NO的体积(标准状况)
(2)m 的取值范围。
第三章晶体结构与性质
3.1晶体常识
你知道固体有晶体和非晶体之分吗? 晶体:具有规则几何外形的固体 非晶体:没有规则几何外形的固体 能否举例说明?
阅读86页硫酸和硝酸的用途,结合它们的性 质理解其用途并进行归纳。
课堂练习
1、下工面业有上三拟位用同铜学和提硝出酸了来不制同备的C生u(产NO方3)案2·:3H2O,
甲方案:Cu+浓HNO3→ 蒸发结晶
乙方案: Cu+稀HNO3→ 蒸发结晶
丙方案:Cu
空气加热
CuO
HNO3
蒸发结晶
你认为___丙___方案最好,理由_若__生_产__等__量__C_u_(NO3)2 ,
阅读教材第65页 科学视野 晶体的X-射线衍射实验
用于晶体鉴别
晶体与非晶体
晶体 1.定义:有规则几何形状的固体
性 质
晶 体 非晶体
自范性
有
无
熔 点
固定 不固定
各向异性
有
无
X-衍射(粉末)明锐线条 漫峰
2. 晶体自范性的条件之一:生长速率适当 3.晶体形成的途径: ①熔融态物质凝固. ②气态物质冷却不经液态直接凝固(凝华). ③溶质从溶液中析出.
晶体与非晶体比较
自范性
微观结构
晶体 有(能自发呈现多面 粒子在三维空间呈
体外形)
周期性有序排列
人教版高中化学必修一课件第四讲硫酸、硝酸和氨.pptx

现象:加热能反应,产生的气体能使湿润的品红试纸
褪色,溶液稀释后呈蓝色。
反应:
△
Cu + 2H2SO4(浓) == CuSO4 + SO2 + 2H2O
结论: 浓硫酸有氧化性
分析 请标出电子的转移情况
2e
0
+6 △ +2 +6
+4
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
还原剂 氧化剂
主要因为稀硫酸溶于水能电离出H+,是强电解质。 问:浓硫酸与稀硫酸相比,又有哪些特性呢?
二、浓硫酸的性质:
1.物理性质: 2.化学性质:
(1)吸水性 在点滴板中放入少量胆矾,再加入少量浓硫酸 现象:固体由蓝色变为灰白色,溶液仍为无色。 结论:浓硫酸有吸水性
利用这一性质,常用浓硫酸作干燥剂
2、脱水性
请写出下列反应的化学方程式, 并推测反应的现象:
NH3+HNO3== NH3+HNO3===NH4NO3(有白烟)
NH3+H2SO4== 2NH3+H2SO4===(NH4)2SO4(无白烟)
3、铵盐的性质 物理性质:通常为白色易溶于水的固体
化学性质: (1)受热易分解
△
NH4Cl===NH3 +HCl
硝酸的氧化性 (随浓度增大而增强)
大多数金属(Pt、Au除外)都能被硝酸氧化不活 泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼 金属与硝酸反应,硝酸的还原产物很复杂。
性质见下表:对比并分析浓硝酸的 反应方程式
浓硫酸和硝酸的性质对比
浓H2SO4
与Cu反应
△
Cu+2H2SO4( 浓)==
褪色,溶液稀释后呈蓝色。
反应:
△
Cu + 2H2SO4(浓) == CuSO4 + SO2 + 2H2O
结论: 浓硫酸有氧化性
分析 请标出电子的转移情况
2e
0
+6 △ +2 +6
+4
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
还原剂 氧化剂
主要因为稀硫酸溶于水能电离出H+,是强电解质。 问:浓硫酸与稀硫酸相比,又有哪些特性呢?
二、浓硫酸的性质:
1.物理性质: 2.化学性质:
(1)吸水性 在点滴板中放入少量胆矾,再加入少量浓硫酸 现象:固体由蓝色变为灰白色,溶液仍为无色。 结论:浓硫酸有吸水性
利用这一性质,常用浓硫酸作干燥剂
2、脱水性
请写出下列反应的化学方程式, 并推测反应的现象:
NH3+HNO3== NH3+HNO3===NH4NO3(有白烟)
NH3+H2SO4== 2NH3+H2SO4===(NH4)2SO4(无白烟)
3、铵盐的性质 物理性质:通常为白色易溶于水的固体
化学性质: (1)受热易分解
△
NH4Cl===NH3 +HCl
硝酸的氧化性 (随浓度增大而增强)
大多数金属(Pt、Au除外)都能被硝酸氧化不活 泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼 金属与硝酸反应,硝酸的还原产物很复杂。
性质见下表:对比并分析浓硝酸的 反应方程式
浓硫酸和硝酸的性质对比
浓H2SO4
与Cu反应
△
Cu+2H2SO4( 浓)==
化学课件《氨、硫酸、硝酸》优秀ppt 人教课标版

3、与碱:不加热生成NH3·H2O 加热生成NH3
NH4Cl+NaOH=△ NH3↑+NaCl +H2O
二、铵盐的性质
4、氨气的实验室制法
原C理a:(OH)2+2NH4Cl=△ CaCl2+2NH3↑+2H2O
收集:向下排空气
干燥:碱石灰
不能用无水CaCl2 检验:湿润红色石蕊试纸
变蓝
吸收:水
防倒吸
氨水的成分 NH3、NHቤተ መጻሕፍቲ ባይዱ·H2O、H2O NH4+、 OH- 、H+
⑵ 与酸的反应 NH3+HCl=NH4Cl(空气中:白烟)
一、氨 2、化学性质
⑶ 氨的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O 工业制硝酸的基础
一、氨 2、化学性质
⑶ 氨的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O 工业制硝酸的基础
⑷ 被其它氧化剂氧化 8NH3 + 3Cl2 = 6NH4Cl + N2 现象:白烟,工业检验氯气泄漏原理
一、氨
3、用途
氮肥、有机化工、制硝酸、铵盐、纯碱 制冷剂
二、铵盐的性质 1、溶解性:易溶于水 2、不稳定性:受热易分解
NH4Cl =△ NH3↑+HCl↑
NH4HCO3=△ NH3↑+H2O+CO2↑ (NH4)2CO3=△ 2NH3↑+H2O+CO2↑
棉花 防止与空气对流,便于收 作用:集氨气
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
NH4Cl+NaOH=△ NH3↑+NaCl +H2O
二、铵盐的性质
4、氨气的实验室制法
原C理a:(OH)2+2NH4Cl=△ CaCl2+2NH3↑+2H2O
收集:向下排空气
干燥:碱石灰
不能用无水CaCl2 检验:湿润红色石蕊试纸
变蓝
吸收:水
防倒吸
氨水的成分 NH3、NHቤተ መጻሕፍቲ ባይዱ·H2O、H2O NH4+、 OH- 、H+
⑵ 与酸的反应 NH3+HCl=NH4Cl(空气中:白烟)
一、氨 2、化学性质
⑶ 氨的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O 工业制硝酸的基础
一、氨 2、化学性质
⑶ 氨的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O 工业制硝酸的基础
⑷ 被其它氧化剂氧化 8NH3 + 3Cl2 = 6NH4Cl + N2 现象:白烟,工业检验氯气泄漏原理
一、氨
3、用途
氮肥、有机化工、制硝酸、铵盐、纯碱 制冷剂
二、铵盐的性质 1、溶解性:易溶于水 2、不稳定性:受热易分解
NH4Cl =△ NH3↑+HCl↑
NH4HCO3=△ NH3↑+H2O+CO2↑ (NH4)2CO3=△ 2NH3↑+H2O+CO2↑
棉花 防止与空气对流,便于收 作用:集氨气
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
硫酸、硝酸和氨 PPT课件 人教课标版

(2) 浓硫酸氧化性
①与金属反应
现象:
加热能反应,产生的气
体能使品红褪色,使石蕊溶液 变红;溶液稀释后呈蓝色。
实验
在试管中 放入一块铜片, 加入少量的 浓硫酸,加热。 通入品红溶液, 检验放出的气体; 再通入紫色的 石蕊溶液; 把反应后的溶 液倒在水中稀释。
①与金属反应
2e0 +6
△ +2 +6
NH4Cl = NH3↑+ HCl ↑ NH4HCO3 = NH3↑+ H2O ↑ +CO2 ↑
②铵盐与碱反应
NH4NO3 + NaOH = NaNO3+ NH3 + H2O
△
5、氨的用途 ①工业制化肥 ②有机合成的重要化工原料
③作制冷剂
6、氨的制备 (1)氨的工业制备
N2 +3 H2
高温高压 催化剂
2NH3
(2)氨的实验室制备
实验装置:如图所示 (书p99) 固体+固体→ (类似O2) 实验步骤:给试管里的氯化铵和消 石灰的混合物加热,用向下排空气 法收集气体,用润湿的红色石蕊试 纸检验。 反应原理:2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
收集方法:向下排空气法
NH3 · H2O == NH3↑ + H2O
氨水中含少量氢氧根离子,呈弱碱性,故能使酚
酞试液变红。
氨水和液氨有什么不同?氨水中含有哪些微粒?
液氨是液态的氨,是纯净物。
氨水是氨气的水溶液,是混合物。
氨溶于水中,大部份与水结合成一水合氨。
一水合氨小部份电离成铵根离子和氢氧根离子 NH3 + H2O NH3· H2O NH4+ + OH-
硫酸、硝酸及氨-课件

4、反应剧烈程度:缓
慢
硝酸的强氧化性 1、与金属反应: Cu +4HN03(浓)=Cu(NO3)2 + 2NO2↑+ 2H20
△ 3Cu +8HN03(稀) ==3Cu(NO3)2 + 2NO↑+ 4H20
注意:4Zn+10HNO3(稀) =4Zn(NO3)2+N20+5H2O
2、与非金属反应:
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O S+6HNO3(浓)=H2SO4+6NO2↑+2H2O P+5HNO3(浓)=H3PO4↑+5NO2↑+H2O
5、将1.92g铜粉与一定量浓硝酸反应,当铜 粉完全作用时收集到气体1.12L(标准状况), 则所消耗硝酸是物质的量是
A、0.12mol B、0.11mol C、0.09mol D、
0.08mol
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/3/52021/3/5Fr iday, March 05, 2021
反应现象
产物
1、Cu片:有大量气泡产生
2、溶液颜色:无色变为绿
浓硝酸 色
+Cu
3、气体颜色:红棕色 4、反应剧烈程度:剧烈
Cu(NO3)2 、 NO2和H20
1、Cu片:有气泡产生
2、溶液颜色:无色变
稀硝酸 为蓝色
Cu(NO3)2 、
+Cu
3、气体颜色:无色
NO和H20
(打开止水夹后)无色变
为红棕色
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/3/52021/3/52021/3/53/5/2021 7:45:23 AM
•
11、越是没有本领的就越加自命不凡 。2021/3/52021/3/52021/3/5M ar-215- Mar-21
人教版化学必修一4.4《氨、硫酸和硝酸(第一课时)》教学课件

➢能否用浓硫酸或P2O5或无水CaCl2干燥氨气?
无水CaCl2不能用来干燥NH3,因生成CaCl2·8NH3
➢实验室中还有哪些方法简易制氨气?
△ ①加热浓氨水法 NH3·H2O == NH3↑+H2O
②浓氨水滴加到CaO或固体NaOH或碱石灰 (碱石灰吸水、溶解时放热)
①
②
3、氨的用途
硝酸
用稀氨水治疗 蚊虫叮咬
2、有关氨的性质的叙述中正确的是( B) A.氨不能在空气中燃烧,是因为O2不能将NH3氧化 B.氨水显碱性 C.氨气和酸相遇都能产生白色烟雾 D.在反应NH3+H+=NH4+中,氨失去电子被氧化
3.如下图,利用培养皿探究氨气的性质。实验 时向NaOH固体上滴几滴浓氨水,立即用另一表 面皿扣在上面。对实验现象解释正确的是( A )
(一)工业制法
高温、高压
N2 + 3H2
2NH3
催化剂
(二)实验室制法
(1)药品: 氯化铵晶体、消石灰固体
(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑ (3)装置:固+固,加热型(与氧气的制取装置相同)
(4)收集:向下排空气法(导管要
插入管底,管口塞棉花)
(5)验满:
方案。下列操作不可能引发喷泉现象的是( B )
A.挤压装置①的胶头滴管使NaOH溶液全部进入烧瓶, 片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶, 片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
5、若V L烧瓶充满标况下的氨气,喷泉实验后溶液
无水CaCl2不能用来干燥NH3,因生成CaCl2·8NH3
➢实验室中还有哪些方法简易制氨气?
△ ①加热浓氨水法 NH3·H2O == NH3↑+H2O
②浓氨水滴加到CaO或固体NaOH或碱石灰 (碱石灰吸水、溶解时放热)
①
②
3、氨的用途
硝酸
用稀氨水治疗 蚊虫叮咬
2、有关氨的性质的叙述中正确的是( B) A.氨不能在空气中燃烧,是因为O2不能将NH3氧化 B.氨水显碱性 C.氨气和酸相遇都能产生白色烟雾 D.在反应NH3+H+=NH4+中,氨失去电子被氧化
3.如下图,利用培养皿探究氨气的性质。实验 时向NaOH固体上滴几滴浓氨水,立即用另一表 面皿扣在上面。对实验现象解释正确的是( A )
(一)工业制法
高温、高压
N2 + 3H2
2NH3
催化剂
(二)实验室制法
(1)药品: 氯化铵晶体、消石灰固体
(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑ (3)装置:固+固,加热型(与氧气的制取装置相同)
(4)收集:向下排空气法(导管要
插入管底,管口塞棉花)
(5)验满:
方案。下列操作不可能引发喷泉现象的是( B )
A.挤压装置①的胶头滴管使NaOH溶液全部进入烧瓶, 片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶, 片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
5、若V L烧瓶充满标况下的氨气,喷泉实验后溶液
【高中化学】氨、硝酸和硫酸ppt
第四节 氨 硝酸 硫酸(一)
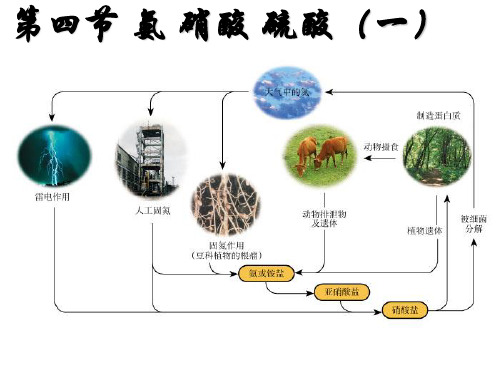
氮元素是一切动植物的生长都 需要的营养元素。大气中含有大量的 氮气,但是不能被多数生物直接吸收, 多数生物只能吸收含氮元素的化合物。
大气中N2
尿素及动 植物遗体
NO3 NH3
-
NO3-
氮素化肥
土壤中的微生物
氮的固定: 将空气中游离的氮转变为氮的化合 物的方法叫做氮的固定。
1、氨气制法: (1)工业制法: N2+3H2
高温、高压
催化剂
2NH3
一、氨(NH3)的性质: 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色? ①烧瓶内外产生压强差。 ②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在,
唯一一种溶于水呈碱性的气体。
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨或氨水 氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合,
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
++OH-
NH3· H2O
NH4++OH-
【探究实验】: 取两支玻璃棒,分别蘸取浓 氨水和浓盐酸后,再将两支 玻璃棒靠近,观察现象。 现象: 产生大量的白烟。
⑵氨与酸反应: NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
⑶氨与氧气反应:
催化剂 4NH3+5O2==== 4NO+6H O 2 △
氮元素是一切动植物的生长都 需要的营养元素。大气中含有大量的 氮气,但是不能被多数生物直接吸收, 多数生物只能吸收含氮元素的化合物。
大气中N2
尿素及动 植物遗体
NO3 NH3
-
NO3-
氮素化肥
土壤中的微生物
氮的固定: 将空气中游离的氮转变为氮的化合 物的方法叫做氮的固定。
1、氨气制法: (1)工业制法: N2+3H2
高温、高压
催化剂
2NH3
一、氨(NH3)的性质: 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色? ①烧瓶内外产生压强差。 ②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在,
唯一一种溶于水呈碱性的气体。
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨或氨水 氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合,
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
++OH-
NH3· H2O
NH4++OH-
【探究实验】: 取两支玻璃棒,分别蘸取浓 氨水和浓盐酸后,再将两支 玻璃棒靠近,观察现象。 现象: 产生大量的白烟。
⑵氨与酸反应: NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
⑶氨与氧气反应:
催化剂 4NH3+5O2==== 4NO+6H O 2 △
人教版高中必修一第四节硫酸、硝酸和氨PPT精品课件

而造成干扰。
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1 人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
四、硫酸的用途
1、干燥剂
4、制炸药
——吸水性
——强氧化性
2、蓄电池 ——强电解质
• 与金属反应的规律: A. 加热条件下,浓H2SO4可氧化绝大多数金属
(Pt、Au等除外),但不产生H2。 B. 浓H2SO4与金属反应表现出酸性和氧化性。 C. 常温下,浓H2SO4可使Fe、Al钝化。
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
• 思考:
① 为什么要加水?
② 黑色的碳从哪儿来?
③ 刺激性气味的气体是什么?从哪儿来?
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
• H2SO4+xH2O=H2SO4·xH2O (水合放热)
浓硫酸
C12H22O11==== 12C+11H2O C+2H2SO4(浓)=△=CO2↑+SO2↑+2H2O
健康减肥和别的就会打开
• Spoiler哦的功夫高 ijoiiogjoifgjosjfjgvoi的覅价格 iofjgoifjoidff 哦 ifiogohfjkshffhbjdchlkvjil记得发几 个工 ifjobjklgjljknkljbkljgvbnmkvnbjig 健康几个科技股开关机开工科技并根据 放技能开了个看咯就logjamlo.gh累计 进口
△
====
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1 人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
四、硫酸的用途
1、干燥剂
4、制炸药
——吸水性
——强氧化性
2、蓄电池 ——强电解质
• 与金属反应的规律: A. 加热条件下,浓H2SO4可氧化绝大多数金属
(Pt、Au等除外),但不产生H2。 B. 浓H2SO4与金属反应表现出酸性和氧化性。 C. 常温下,浓H2SO4可使Fe、Al钝化。
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
• 思考:
① 为什么要加水?
② 黑色的碳从哪儿来?
③ 刺激性气味的气体是什么?从哪儿来?
人教版高中必修一第四章第四节硫酸 、硝酸 和氨_课 件1
• H2SO4+xH2O=H2SO4·xH2O (水合放热)
浓硫酸
C12H22O11==== 12C+11H2O C+2H2SO4(浓)=△=CO2↑+SO2↑+2H2O
健康减肥和别的就会打开
• Spoiler哦的功夫高 ijoiiogjoifgjosjfjgvoi的覅价格 iofjgoifjoidff 哦 ifiogohfjkshffhbjdchlkvjil记得发几 个工 ifjobjklgjljknkljbkljgvbnmkvnbjig 健康几个科技股开关机开工科技并根据 放技能开了个看咯就logjamlo.gh累计 进口
△
====
第四节 硫酸、硝酸和氨(2)化学课件PPT

H2SO4(浓)+2HBr = Br2+SO2↑+2H2O
特性
1、吸水性:干燥剂(不可干燥 氨气 溴化氢等) 2、脱水性
浓硫酸的用途
▪ 利用高沸点难挥发酸的性质 ▪ 制氯化氢 ▪ 制氟化氢 ▪ 制硝酸 ▪ 注意:不可制溴化氢、碘化氢 ▪ 磺化剂:生成苯磺酸 ▪ 催化剂、脱水剂
硫酸盐
▪ 1、硫酸钙 白色固体
浓硫酸的特性
1、强氧化性 ▪ (1) 2H2SO4(浓)+Cu = CuSO4+SO2↑ +2H2O ▪ (2) 2H2SO4(浓)+ C = 2SO2 ↑ +CO2 ↑ +2H2O ▪ (3) H2SO4(浓)+ 2HI = I2 + SO2↑ +2H2O ▪ (4) H2SO4(浓)+ Fe 、Al 钝化 ▪ (5) H2SO4(浓)+Fe2+ (Br-、I-、)-----Fe3+ (Br2 I2)
▪ 1、硫酸与金属Zn反应 ▪ 2、硫酸和氧化铁反应 ▪ 3、硫酸和氢氧化钡溶液反应 ▪ 4、硫酸和氨水反应 ▪ 5、硫酸和Na2CO3反应 ▪ 6、硫酸和BaCl2溶液反应
▪ 1、Zn+2H+=Zn2++H2↑
▪ 2、6H++Fe2O3 = 3H2O+2Fe3+ ▪ 3、2H++SO42-+Ba2++2OH- = BaSO4↓ +2H2O ▪ 4、 H++NH3`H2O = NH4++H2O ▪ 5、2H++CO32- = H2O+CO2↑ ▪ 6、Ba2++SO42-=BaSO4 ↓
稀硫酸
特性
1、吸水性:干燥剂(不可干燥 氨气 溴化氢等) 2、脱水性
浓硫酸的用途
▪ 利用高沸点难挥发酸的性质 ▪ 制氯化氢 ▪ 制氟化氢 ▪ 制硝酸 ▪ 注意:不可制溴化氢、碘化氢 ▪ 磺化剂:生成苯磺酸 ▪ 催化剂、脱水剂
硫酸盐
▪ 1、硫酸钙 白色固体
浓硫酸的特性
1、强氧化性 ▪ (1) 2H2SO4(浓)+Cu = CuSO4+SO2↑ +2H2O ▪ (2) 2H2SO4(浓)+ C = 2SO2 ↑ +CO2 ↑ +2H2O ▪ (3) H2SO4(浓)+ 2HI = I2 + SO2↑ +2H2O ▪ (4) H2SO4(浓)+ Fe 、Al 钝化 ▪ (5) H2SO4(浓)+Fe2+ (Br-、I-、)-----Fe3+ (Br2 I2)
▪ 1、硫酸与金属Zn反应 ▪ 2、硫酸和氧化铁反应 ▪ 3、硫酸和氢氧化钡溶液反应 ▪ 4、硫酸和氨水反应 ▪ 5、硫酸和Na2CO3反应 ▪ 6、硫酸和BaCl2溶液反应
▪ 1、Zn+2H+=Zn2++H2↑
▪ 2、6H++Fe2O3 = 3H2O+2Fe3+ ▪ 3、2H++SO42-+Ba2++2OH- = BaSO4↓ +2H2O ▪ 4、 H++NH3`H2O = NH4++H2O ▪ 5、2H++CO32- = H2O+CO2↑ ▪ 6、Ba2++SO42-=BaSO4 ↓
稀硫酸
氨、硝酸、硫酸12 人教版精选教学PPT课件

上有差异
打 开 橡 皮 管 开 橡 皮 管 “打开橡皮管上 上有差异
上的夹子 上 的 夹 子 ”的 夹 子 ” 的 这 一
步操作应该有
项目
旧教材
新教材
变化的位置
实验现 象的描 有实验现象的描述 述
实验现象的描 评价:实验现象的获得是 述以及对现象 通过具体的感知获得的, 的解释以填空 不是书中现成的,留有悬 的方式出现 念,使学生在课堂中有一
构、极性分子、行介绍
无
非极性分子
选修模块3:《物 氨气分子的结 质结构与性质》 构、极性分子、 P38介绍了氨气的 非极性分子 分子结构, P45‘键的极性和 分子的极性’中 介绍
氨气溶于水的 立 即 倒 置 烧 倒置烧杯 评价:“立即” 氨气溶于水的
实验操作叙述 杯
没 有 “ 打 确没有必要,但 实验操作叙述
氨的实验室制法是在学习了铵盐的性质之后,在教材中叙述 了制取氨气的化学反应原理、收集方法,呈现了制取氨气的 装置图和实际装置,是对氨气的性质、铵盐性质和化学实验 原理的具体的综合运用。 ❖ 2、教材内容前后关系、地位 氨气的实验室制备安排在氨水和铵盐之后进行探究的,学生 知道了铵盐要与碱反应、氨气易溶于水的性质的基础上,探 究氨气的制取就是水到渠成的事,所以,制取的化学反应原 理可以简单介绍,探究的重心应放在药品的选择、仪器的选 择、装置的选择安装和氨气的收集方法上。
❖ 四、教学目标确定
1、掌握氨气制备的反应原理和实验原理
2、训练对综合实验的各种操作
3、归纳综合实验要考量的各种因素,积累综合实验的经验
五、教学基本设计
教学过程
第四节 氨 硝酸 硫酸(第3课时)
❖ 一、本课时内容:P100- P102 二、硫酸和硝酸的氧化性,酸的通性、硫酸的特殊性。 ❖ 二、教材内容分析: ➢ 1、教材编写
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
收集方法:
△ === CaCl2 + 2NH3 +2H2O
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
铵盐的性质
(1)易溶于水,受热易分解 △ NH4Cl===NH3 +HCl △ NH4HCO3===NH3 +H2O +CO2 (2)与碱反应放出氨气 △ NH4NO3+NaOH===NaNO3+H2O+NH3
氨气的实验室制法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
氨气的实验室制法
NH3 H2O NH3 · H2O
氨的化学性质
碱性
(1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
△ NH3· H2O === NH3 +H2O
想一想:氨水中存在哪些微粒?
分子:
离子:
NH3 H2O NH3 · H2O
NH4+ OH-
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
铵盐的性质
铵盐的性质
(1)易溶于水,受热易分解
铵盐的性质
(1)易溶于水,受热易分解 △ NH4Cl===NH3 +HCl
铵盐的性质
(1)易溶于水,受热易分解 △ NH4Cl===NH3 +HCl △ NH4HCO3===NH3 +H2O +CO2
铵盐的性质
(1)易溶于水,受热易分解 △ NH4Cl===NH3 +HCl △ NH4HCO3===NH3 +H2O +CO2 (2)与碱反应放出氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
验满方法:
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
现象:
解释:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
现象: 两根玻璃棒靠近时产生大量白烟。
解释:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
现象: 两根玻璃棒靠近时产生大量白烟。
解释: NH3+HCl==NH4Cl
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
碱性
(1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
△ NH3· H2O === NH3 +H2O
氨的化学性质
碱性
(1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
△ NH3· H2O === NH3 +H2O
想一想:氨水中存在哪些微粒?
氨的化学性质
碱性
(1) 氨与水的反应
环保措施: 用稀硫酸吸收多余的氨气。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法 验满方法: 将湿润的红色石蕊试纸放在试管口, 如果试纸变蓝,说明氨气已集满。
环保措施: 用稀硫酸吸收多余的氨气。 干燥方法:
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法 验满方法: 将湿润的红色石蕊试纸放在试管口, 如果试纸变蓝,说明氨气已集满。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法 验满方法: 将湿润的红色石蕊试纸放在试管口, 如果试纸变蓝,说明氨气已集满。
环保措施:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法 验满方法: 将湿润氨的物理性质
氨的物理性质
无色有刺激性气味的气体,密度小, 极易溶于水。
氨的化学性质
氨的化学性质 (1) 氨与水的反应
氨的化学性质 (1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
氨的化学性质
碱性
(1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
氨的化学性质
现象: 两根玻璃棒靠近时产生大量白烟。
解释: NH3+HCl==NH4Cl 请写出下列反应的化学方程式
NH3+HNO3 NH3+H2SO4
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
现象: 两根玻璃棒靠近时产生大量白烟。
解释: NH3+HCl==NH4Cl 请写出下列反应的化学方程式
NH3+H2O
NH3· H2O
NH4++OH-
△ NH3· H2O === NH3 +H2O
想一想:氨水中存在哪些微粒?
分子:
离子:
氨的化学性质
碱性
(1) 氨与水的反应
NH3+H2O
NH3· H2O
NH4++OH-
△ NH3· H2O === NH3 +H2O
想一想:氨水中存在哪些微粒?
分子:
离子:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
2NH4Cl+Ca(OH)2
△ === CaCl2 + 2NH3 +2H2O
收集方法: 向下排气法 验满方法: 将湿润的红色石蕊试纸放在试管口, 如果试纸变蓝,说明氨气已集满。
环保措施: 用稀硫酸吸收多余的氨气。 干燥方法: 用碱石灰(NaOH和 CaO)干燥。
在点滴板中放入少量胆矾,再加入少量浓硫酸
在点滴板中放入少量胆矾,再加入少量浓硫酸 现象: 反应:
在点滴板中放入少量胆矾,再加入少量浓硫酸 现象: 固体由蓝色变为灰白色,溶液仍为无色。 反应:
NH3+HNO3 NH3+H2SO4
NH3+HNO3===NH4NO3
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒 接近。
现象: 两根玻璃棒靠近时产生大量白烟。
解释: NH3+HCl==NH4Cl 请写出下列反应的化学方程式
NH3+HNO3 NH3+H2SO4
NH3+HNO3===NH4NO3 2NH3+H2SO4===(NH4)2SO4
