Ru(Ⅱ)和Ru(Ⅲ)配合物[Ru(bpy)(PH3)(-C≡CC6H4N02-p)C1] m(m=-O,+1)的光谱性质的密度泛
配 合 物 讲义

配 合 物【初赛要求】配合物。
路易斯酸碱。
配位键。
重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的配络合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物几何构型和异构现象基本概念和基本事实。
配合物的杂化轨道理论。
用杂化轨道理论说明配合物的磁性和稳定性。
八面体配合物的晶体场理论说明Ti(H 2O)63+的颜色。
软硬酸碱的基本概念和重要软酸软碱和硬酸硬碱。
【初识配合物】无水的硫酸铜晶体(白色)溶于水得到天蓝色的溶液,蒸发浓缩冷却结晶,得到天蓝色的五水合硫酸铜晶体。
结构分析证实,无论水溶液还是晶体,天蓝色都是四水合铜离子[Cu(H 2O)4]2+的颜色。
向硫酸铜溶液滴加氨水,先产生含铜化合物的沉淀,继续滴加过量的氨水,沉淀溶解,得到深蓝色的透明溶液,若是浓溶液,蒸发结晶,可以得到深蓝色的四氨合硫酸铜晶体。
结构分析证实,无论在氨水溶液里还是在晶体里,深蓝色都是四氨合铜离子[Cu(NH 3)4]2+的颜色。
取少量硫酸四氨合铜晶体用水溶解后滴加浓盐酸,用过量浓盐酸,最后得到的是黄色透明溶液,结构分析证实,其中存在四氯合铜酸根[CuCl 4]2-。
这种离子在晶体里也存在。
我们把象[Cu(H 2O)4]2+、[Cu(NH 3)4]2+、[CuCl 4]2-这样的由金属原子与中性分子或者阴离子结合形成的复杂离子叫做配离子(过去叫络离子),其中的金属原子是配离子形成体或中心原子,其中的H 2O 、NH 3、Cl -离子等叫做配体。
第一单元 配合物的定义、组成、类型与命名1.配合物定义:是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
例如:配合物:配盐:[Cu(NH 3)4]SO 4 [Cu(H 2O)4]SO 4.H 2O 配酸:H 2[PtCl 6]配碱:[Cu(NH 3)4](OH)2此外还有:配离子:[Cu(NH 3)4]2+ [Ag(CN)2]-配合分子:Ni(CO)4 [Co(NH 3)3Cl 3]等等。
钌络合物的抗癌机理(二):二价钌活性物种

钌络合物的抗癌机理(二):二价钌活性物种2016-08-23 13:38来源:内江洛伯尔材料科技有限公司作者:研发部钌络合物2最近发现被杂芳族配体稳定的Ru(Ⅱ)配合物展现出重要的抗癌活性。
例如,C2对称的cis-[Cl2(azpy)2Ru](azpy=2-(phenylazo)pyridine)的异构体在几种细胞系中都有很好的活性。
其可能原因有: (1)配体的π受体效应增加了金属离子的有效价态,氯水合作用速率下降并位于顺铂水解速率的范围之内; (2) 增加了与DNA的疏水或嵌入相互作用,使共价结合变得更容易; (3) 配体的几何效应可能引起(或阻碍)蛋白质与核酸的结合。
芳烃配体可稳定Ru(Ⅱ),并提供一个疏水面以增加识别和跨膜转运。
某些这样的配合物甚至还能抑制在DNA复制和细胞分裂中起重要作用的拓扑异构酶Ⅱ的活性。
拓扑异构酶Ⅱ可以改变DNA的拓扑性质,在细胞分裂的复制、转录、重组和染色体分离过程中帮助维持染色体骨架结构的稳定性。
由于上述性质在癌细胞增殖过程中非常重要,因此选择性地以拓扑异构酶Ⅱ为靶标,可以阻碍细胞分裂并通过裂解DNA而诱导细胞凋亡。
其他一些配合物如[X(η6-arene)(en)Ru (Ⅱ)]+(X=halide)虽然不能抑制拓扑异构酶Ⅰ或Ⅱ的活性,但是也表现出与同碳铂相近的抗癌活性。
Ru2X 键的水解对于反应是至关重要的,而Ru2Cl的水解却可以被氯离子所抑制。
在溶液中, [X(η6-p-arene )(en)Ru(Ⅱ)]+选择性地与DNA寡聚核苷酸上的鸟嘌呤碱基结合,形成单功能加合物并适度降低了DNA的解链温度。
由于这些配合物是单功能的,它们的生物学机制可能与顺铂或者NAMI类药物不同。
此外,[L(bpy)2Ru(Ⅱ)]+类型的配合物(L代表秋水仙素或者Tmca)在溶液中不解离,但是也展现出与自由配体近似的活性,显然它们抗慢性骨髓性白血病的活性是配合物整体作用的结果。
配位化合物习题答案

第十九章配位化合物1、[Pt(NH3)2Cl4]1、配合物:K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O螯合物:Ni(en)2Cl2, Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O简单盐:Cu(OOCH3)23、(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4、(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体H3N NO2H3N NO2Pt PtH3N Cl H3N Cl (2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体Cl Py Cl NH3Pt PtBr NH3 Br PyCl 3PtPy Br(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体3NH3NH3 NH333OH Cl(4)[Co(NH3)2(NO2)4]-八面体2种异构体23O22O2NH3NO2(5)[Co(NH3)3(OH)3] 八面体2种异构体H3H3NH3 OH(6)[Ni(NH3)2Cl2] 四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体enSCN en(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3] 八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5、该中心金属离子可能是Fe2+)2nn= 4.90 n = 4(即在八面体场中有四个成单电子八面体强场中磁矩为零,即无成单电子故Fe2+符合题意6、高自旋的有:(1),(2),(5),(7)低自旋的有:(3),(4),(6),(8)内轨型的有:(3),(4),(6),(8)外轨型的有:(1),(2),(5),(7)7、dsp28、由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”9、(1)Al3+与F-的配合物更加稳定,Al3+为硬酸;而碱F-的硬度比Cl-大(2)Pd2+与RSH配合后更加稳定,Pd2+为软酸,而RSH为软碱,ROH为硬碱。
螯合物-配合物-络合物

配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
钌配合物[Ru(bpy)2(PNT)] 2+的合成、表征及与DNA相互作用研究
![钌配合物[Ru(bpy)2(PNT)] 2+的合成、表征及与DNA相互作用研究](https://img.taocdn.com/s3/m/781c666addccda38376baf4c.png)
20 0 8年 l 2月
高 等 学 校 化 学 学 报
CHEMI CAL J OURNAL OF CHI S NE E UNI VERSTIS I E
No 1 .2
2 9 ~2 0 4 6 5 1
钌 配合 物 [ u b y 构表 征.利用 紫外 一 可见光谱 滴定 、 稳态荧 光光谱 滴定 、 N D A热变性和 黏度实验 研究 了配合物 与
D A的相 互作 用. N
1 实验部 分
1 1 仪器 与试 剂 .
Ee na ai E l t V r L元 素分析仪 , ai 0 MH 核 磁共振 波谱仪 , C me r o V r n50 z a L Q系统 (ingnM T U A) Fni A , S a
基金项 目:国家“ 九七三” 计划( 批准号 : 0 7 B 136 国家 自然科学基金 ( 2 0 C 8 50 )、 批准号 : 07 0 9 0 7 15 、教育部新世纪优秀 2 5 18 ,27 10 ) 人才支持计划( 批准号 :N E -657 8 、 C T0 0 -1 ) 教育部重点项 目( 批准号 :180 ) 0 13 和教育部 留学 回国人员科研启动基金( 批准号 :教外司留 [0 7 2 20 ]4号) 资助. 联系人简介 : 巢 晖, , 男 教授 ,主要从事生物无机化学研究.Ema :csh@ma .yu eu c . i ech l i ss .d .n l
平上 了解 生命现 象 的本质 .近 年来 , 设计合成 小分 子过渡金 属配合 物 , 研究 其与 大分子 D A 的相互 作 N
用受 到了广泛关 注 , 其是钌 (I) 吡啶配 合物 ,因易 于构 造一 个 既 为刚性 又 带手性 的八面 体构 型 , 尤 I多
钌的氯络合物详解

钌的氯络合物详解作者:研发中心来源:苏州市相城区北桥姑苏钛电极材料厂日期:2014-9-10 11:55:03人气:57钌的特征氧化态为Ru(IV)和Ru(III),在分析化学中这两种价态的氯钌络合物常被应用。
钌的氯络合物是用HCl吸收RuO4来制备,采用不同浓度的HCl可以得到不同组成和价态的络合物物种。
在高浓度的HCl介质中RuO4还原得到低价的钌络合物,而在0.5~3 mol/LHCl溶液中,Ru(VIII)还原为Ru(VI)。
M2[RuCl6]是用高于3 mol/LHCl与RuO4反应获得的,也可用[RuO2Cl4]2-与还原剂反应生成,但要制备纯M2[RuCl6]盐比较困难,因为在产物中可能含有Ru(Ⅲ)氯络合物和Ru(Ⅳ)的羟基氯络合物。
K2[RuCl6]和(NH4)2[RuCl6]均为黑色晶体,可溶于水和酸。
K2[RuCl6]的水溶液为黄色,由于易水解而很快变为黑色。
在>3 mol/LHCl介质中[RuCl6]2-发生快速的水合作用,生成的水合产物[Ru(H2O)Cl5]-和[Ru(H2O)2Cl4]又迅速离子化,形成两种羟基氯络合物物种,即[Ru2(OH)Cl5]2-和[Ru(OH)2Cl4]2-。
后一物种发生二聚作用并形成[Ru2OCl10]4-和[Ru2O2Cl8]4-,而且在比较稀的盐酸溶液中[Ru2O2Cl8]4-络离子占优势。
由于生成的含水和羟基氯络合物依赖于溶液中的酸度和Cl-浓度,因此随Cl-和H+ 浓度的不同溶液呈现不同颜色。
例如,当Cl-浓度<0.l mol/L 、H+浓度<0.4 mol/L时,溶液先由红变紫,再变为黄色;当Cl-浓度>0.l mol/L 、H+ 浓度>0.4 mol/L时,溶液先由红变黄,再变为紫色,最后又变为黄色。
M3[RuCl6]是由M2[Ru(H2O)Cl5]与浓HCl反应制成的。
Ru(III)的钠、钾、铵盐均为红色晶体,易溶子水和乙醇。
配合物[Ni(phen)3][(C6H5) 2C(OH)COO]26H2O的合成、晶体结构及电化学性质
![配合物[Ni(phen)3][(C6H5) 2C(OH)COO]26H2O的合成、晶体结构及电化学性质](https://img.taocdn.com/s3/m/60d7c62bbd64783e09122b72.png)
!!"
#$%& ! ’() "#$%&’()*+,"-./01*!2-30*233,4 " /043 *(+ # ,-./012345
" +<9 "
6 7 8 5$ ! ’ 9 $ : + / ’ 9 * ; : < = - $ > ? 5-67 #5%!7 #5%87 #5%97 @ABC9D $5%+7 E 5%:7 F G@AHI9D$ ’()?J + KLM*N(’ 9O % PAQRSTU*’9VW $ XY,-./? Z[\]^_‘abc8’9 & BCd=eI 5$%67
?
@
./d2f!e" 2" $ ~iR] X=} R]=yX=./i $ ¡¢£~¤¥¦i §\]X=¨¢©ª« d.e" ¥ ¬®¯£°±² ³a´}i7µ¶· ) ¸·¹º·‘ai§\»\ ]e¼½³X=y^_¾i./¿À " Á Â./ÃÄÅfÆÇÈÉʯ ) ËÈ̯ )®,Í i È Î Ï ¯ ¬ ® ¯ § _ _ D d_e$ Ð Ñ É È Ï Ò
KL’$+,0$M S4P TBTUP 1(<VUPW XBT4 YP58BUB1 ;1B7 ;57 %F%"#V4P5;5T4Z(UB5P <(5(4:7Z;TP 4;[ YPP5 [:5T4P[B8P7 ;57 14;Z;1TPZB8P7 B5 T4P [(U\P5T <BWTEZP (] X;TPZ ;57 <PT4:U#;U1(4(U0 HT ];UU[ B5T( T4P TZB1UB5B1F 14;Z;1TPZB[TB1 (] T4P [V;1P CZ(EV @% XBT4 2^%0%=2 #R*/ 5<F A^%0.*# #R=/ 5<F 5^%0.=! .R=/ 5<F !^_=0=2#R!/,F "^#=02"!R!/,F #^_=0$%_R!/,F B^ ( 20#.= $R%2/ 5<*F C1^%0*=_ C 1<‘*0 D^2F ER"""/^% 2%.F T4P ZPUB;YBUBT: ];1T(Z F%^"0".# $F GF2^"0%#$ $0 S4P 1Z:[T;U [TZE1TEZP [4(X[ T4;T T4P 5B16PU ;T(< B[ 1((Z7B5;TP7 XBT4 [BW 5BTZ(CP5 ;T(<[ ]Z(< T4P T4ZPP V4P5[F ](Z<B5C ; 7B[# T(ZTP7 (1T;4P7Z;U 1((Z7B5;TB(5 CP(<PTZ:0 S4P 1:1UB1 \(UT;<PTZB1 YP4;\B(Z (] T4P 1(<VUPW B[ ;U[( ZPV(ZTP70 33L3a 2_=%#=0
混配型亚硝酰钌配合物的合成及生物活性研究(Ⅰ)

混配型亚硝酰钌配合物的合成及生物活性研究(Ⅰ)利用细胞毒性化合物或小分子抑制剂治疗是治疗人类癌症的重要策略。
然而,在长期治疗中出现了耐药性以及副作用等主要问题。
顺铂是目前普遍使用的抗癌药物之一,但是其显著的副作用和耐药性阻碍了临床治疗的发展。
因此,开发非铂类药物成为越来越有吸引力的研究课题。
由于两个典型的Ru(III)配合物[ImH][trans-Ru Cl<sub>4</sub>(DMSO)(Im)](NAMI-A;Im=咪唑,DMSO=二甲基亚砜)和[IndH]-[trans-RuCl<sub>4</sub>Ind<sub>2</sub>](KP1019)}在治疗转移性实体瘤和铂耐药性结肠直肠癌的临床成功,使得人们注意到钌配合物作为对正常细胞具有低毒性的治疗性抗癌剂的潜在用途。
所以,钌成为了铂抗癌剂最有希望的替代品之一<sup>[1]</sup>。
一氧化氮(NO)是从细菌到人类等生物体生理反应产生的高活性双原子自由基。
已经发现这种反应性基团是不可或缺的信使分子,能够介入不同生理过程,例如调节血管张力,心肌收缩性,内皮的抗血栓作用,血管的渗透性以及细胞的增生作用等。
根据NO的浓度和暴露时间长短可以促进或抑制细胞死亡。
因此,选择在特定靶点释放NO的试剂浓度可以引发特定细胞死亡并且在癌症治疗中呈现潜在的应用。
经典的NO衍生物,例如有机亚硝酸盐和硝普钠,它们具有对光化学不稳定性和毒性,在临床治疗方面仍然存在明显的限制。
而金属亚硝酰基,特别是亚硝酰基钌配合物能够通过还原反应和光照射释放NO,是很有希望的NO供体试剂<sup>[2]</sup>。
并且亚硝酰钌配合物中Ru-NO键在室温下的稳定性,以及其在生理条件下光激活的性质,使得它成为生物医学和PDT治疗中的潜在治疗剂<sup>[3,4]</sup>。
过渡金属配合物

精选2021版课件
31
过渡金属有机化合物的基元反应
氧化加成与还原消除:
精选2021版课件
32
过渡金属有机化合物的基元反应
Wilkinson获得诺贝尔奖
1983年 K.G.Bergman和W.A.G.Graham在金属络合物与烷
烃的分子间反应中观察到C-H键的活化
精选2021版课件
28
过渡金属有机化合物的基元反应
基元反应并非机理的分类,而只是反应的类别,便于学习, 认识,研究和讨论,并在一定程度上预测反应结果。同一个基元 反应可能有不同的机理。
精选2021版课件
39
偶联反应:Negishi反应
精选2021版课件
40
Heck反应
Heck 反应是指卤代烃与碳—碳双键在钯催化和碱的存 在下生成取代碳– 碳双键的反应。
精选2021版课件
41
重要的配位催化循环
催化加氢--自催化循环 催化氧化--共催化循环 羰基合成--助催化循环 聚合催化反应循环
精选2021版课件
21
晶体场理论
是分裂后高能态的轨道和低能态轨道的能级差,在光 谱学上把 写成10Dq。根据量子力学原理,在外场作用 下,d轨道的平均能量是不变的。
2Eeg + 3Et2g=0
解得:
Eeg - Et2g=10Dq
Eeg= 3/5 = 6Dq Et2g= -4Dq
Dq是晶体场强度的衡量,场愈强,Dq越大。
精选2021版课件
14
ru(ⅱ)多吡啶类化合物的合成、晶体结构与光学性质与研究

通过对配位剂 dppz、tpphz 的 1H—NMR 核磁谱数据的分析,证明了合成结果的正确 性。
对晶体 5 所做的 X 射线粉末衍射实验所得数据和单晶衍射实验所得数据进行了比较, 可以看出峰位峰形吻合,由此可以说明晶体 5 结构的正确性。
dppz
N
N
H
diol
N
N
N
N
N
N
tpphz
III
Abstract
Ru (Ⅱ) complexes with pyridine have many excellent properties in photochemical, electrochemical and biological chemistry and so on.They are, however, became a study hotspot of scientific workers for a long time. Recently, they are been applied in antineoplastic drugs, the DNA probe, optical materials, supramolecular assembly and many other fields. In this paper we main reserch the complexs of Run(phen)2nL2n+ (phen:1,10-phenanthroline; L: phen derivatives), and discuss the crystal structure, electronic spectral properties, IR spectrum, 1H NMR spectroscopy, X-ray powder diffraction experiment and TGA–DSC experiment.
钌化合物催化炔醇或炔酸酯发生关环反应
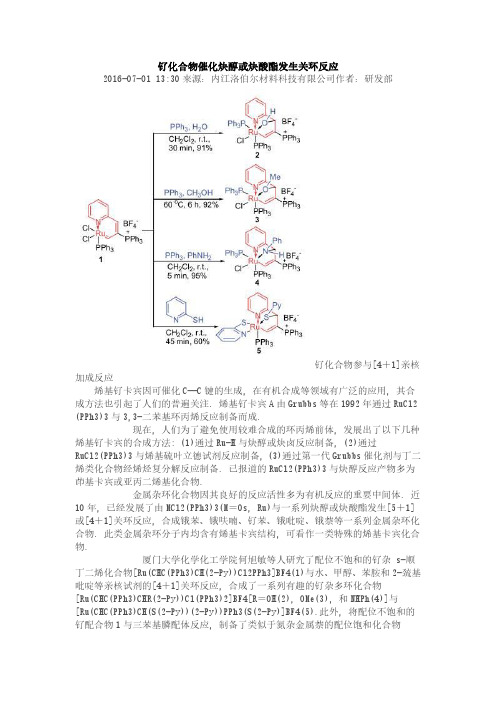
钌化合物催化炔醇或炔酸酯发生关环反应2016-07-01 13:30来源:内江洛伯尔材料科技有限公司作者:研发部钌化合物参与[4+1]亲核加成反应烯基钌卡宾因可催化C—C键的生成, 在有机合成等领域有广泛的应用, 其合成方法也引起了人们的普遍关注. 烯基钌卡宾A由Grubbs等在1992年通过RuCl2 (PPh3)3与3,3-二苯基环丙烯反应制备而成.现在, 人们为了避免使用较难合成的环丙烯前体, 发展出了以下几种烯基钌卡宾的合成方法: (1)通过Ru-H与炔醇或炔卤反应制备, (2)通过RuCl2(PPh3)3与烯基硫叶立德试剂反应制备, (3)通过第一代Grubbs催化剂与丁二烯类化合物经烯烃复分解反应制备. 已报道的RuCl2(PPh3)3与炔醇反应产物多为茚基卡宾或亚丙二烯基化合物.金属杂环化合物因其良好的反应活性多为有机反应的重要中间体. 近10年, 已经发展了由MCl2(PPh3)3(M=Os, Ru)与一系列炔醇或炔酸酯发生[5+1]或[4+1]关环反应, 合成锇苯、锇呋喃、钌苯、锇吡啶、锇萘等一系列金属杂环化合物. 此类金属杂环分子内均含有烯基卡宾结构, 可看作一类特殊的烯基卡宾化合物.厦门大学化学化工学院何旭敏等人研究了配位不饱和的钌杂 s-顺丁二烯化合物[Ru(CHC(PPh3)CH(2-Py))Cl2PPh3]BF4(1)与水、甲醇、苯胺和2-巯基吡啶等亲核试剂的[4+1]关环反应, 合成了一系列有趣的钌杂多环化合物[Ru(CHC(PPh3)CHR(2-Py))Cl(PPh3)2]BF4[R=OH(2), OMe(3), 和NHPh(4)]与[Ru(CHC(PPh3)CH(S(2-Py))(2-Py))PPh3(S(2-Py)]BF4(5).此外, 将配位不饱和的钌配合物1与三苯基膦配体反应, 制备了类似于氮杂金属萘的配位饱和化合物[Ru(CHC(PPh3)CH(2-Py))Cl2(PPh3)2]BF4(6).6与HBF4反应可生成金属杂环结构类似的分子内含三氯桥的双钌核配合物[{Ru(CHC(PPh3)CH(2-Py))PPh3}2(μ-Cl)3](BF4)3(7). 以上产物均通过核磁(NMR)与元素分析进行了表征, 并解析了部分产物的X射线单晶结构.。
配位化合物(习题参考答案)
K fψ ([FeF6 ] 3− ) K fψ ([Fe (NCS) 2 ] )
= 8.91×10 10
K ψ 很大,故该反应向右进行。
*13.解: (1)[Ni(CN)4]2− + 2e− 对于电极反应:Ni2+ + 2e−
2+ ψ 2+ 2+ − ψ 2−
Ni + 4CN− Ni
E (Ni /Ni) = E (Ni /Ni) + (0.0592 V / 2) lg c( Ni 2 + ) / c ψ
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
3 4 2+
x
4
=
0.050 − x = 2.09×1013 4 x( 2.8 + 4 x )
0.050 =2.1×1013, x =3.9×10−17 4 x (2.8)
c([Cu(NH3)4]2+) ≈0.050 mol·L−1,c(NH3·H2O) ≈2.8 mol·L−1 若在此溶液中加入 0.010 mol NaOH(s),即:c(OH− ) = 0.50 mol·L−1
ψ J = 3.9×10−17 × (0.50)2 = 9.8×10−18 > K sp (Cu (OH)2)
故有 Cu (OH)2 沉淀生成。 9.解: 设 1.0 L 6.0 mol·L−1NH3·H2O 溶解 x mol AgI, 则 c([Ag(NH3)2]+) = x mol·L−1 (实 际上应略小于 x mol·L−1)c(I− ) = x mol·L−1 AgI(s) + 2NH3·H2O −1 平衡浓度/(mol·L ) 6.0 − 2 x [Ag(NH3)2]+ + I− + 2H2O x x
钌和氧配位的配合物

钌和氧配位的配合物
从化学角度来看,钌和氧配位的配合物可以是各种形式的有机
和无机化合物。
有机配合物中,钌通常以羰基配位形成配合物,例
如钌的羰基配合物Ru(CO)5。
在无机配合物中,钌和氧也可以形成
配合物,例如RuO4(钌的氧化物)。
这些配合物在催化、药物和材
料科学等领域有着广泛的应用。
从生物学角度来看,钌和氧配位的配合物在生物体内也具有重
要的作用。
例如,一些钌配合物被用作抗肿瘤药物,其机制与配合
物中钌和氧的配位有关。
此外,钌和氧配位的配合物还被用作生物
标记物和生物传感器,用于研究生物体内的化学反应和生物过程。
总的来说,钌和氧配位的配合物在化学和生物学领域具有重要
的意义,对于理解化学反应机制、开发新型药物和材料具有重要的
应用前景。
希望这些信息能够帮助你对这个问题有一个全面的了解。
《2024年Ru-Co金属有机配合物的合成及其衍生物的催化性能研究》范文

《Ru-Co金属有机配合物的合成及其衍生物的催化性能研究》篇一Ru-Co金属有机配合物的合成及其衍生物的催化性能研究一、引言金属有机配合物因其独特的结构和性质,在催化、材料科学、生物医学等领域具有广泛的应用。
本文将重点研究Ru/Co金属有机配合物的合成及其衍生物的催化性能。
我们将详细介绍合成过程,并通过实验数据和图表分析其催化性能,以期为相关领域的研究提供参考。
二、Ru/Co金属有机配合物的合成1. 合成方法Ru/Co金属有机配合物的合成主要采用溶液法。
首先,将相应的金属盐与有机配体在适当的溶剂中混合,通过调节温度、pH 值等条件,使金属离子与配体发生配位反应,生成金属有机配合物。
2. 合成步骤(1)准备原料:选择合适的Ru盐、Co盐和有机配体。
(2)溶液配制:将金属盐和有机配体分别溶解在适当的溶剂中。
(3)混合反应:将金属盐溶液缓慢加入到有机配体溶液中,同时调节温度和pH值。
(4)分离纯化:通过离心、过滤等方法分离出金属有机配合物,并进行洗涤和干燥。
3. 产物表征通过X射线衍射、红外光谱、核磁共振等手段对合成的Ru/Co金属有机配合物进行表征,确定其结构和性质。
三、Ru/Co金属有机配合物衍生物的催化性能研究1. 实验方法以典型的催化反应为模型,探究Ru/Co金属有机配合物衍生物的催化性能。
通过改变反应条件、催化剂用量等因素,考察催化剂的活性、选择性和稳定性。
2. 实验结果与分析(1)活性分析:通过对比有无催化剂条件下的反应速率,分析Ru/Co金属有机配合物衍生物的催化活性。
实验结果表明,该类催化剂具有较高的活性,能显著提高反应速率。
(2)选择性分析:通过分析产物分布,考察催化剂的选择性。
实验数据显示,Ru/Co金属有机配合物衍生物具有较好的选择性,能促进目标产物的生成,减少副反应的发生。
(3)稳定性分析:通过重复实验,考察催化剂的稳定性。
实验结果表明,该类催化剂具有良好的稳定性,能在多次使用后保持较高的催化活性。
配合物课后习题答案Word版

课后习题答案8.1 区分下列概念:(1)接受体原子和给予体原子;(2)配位体和配位原子;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)高自旋配合物和低自旋配合物;(6)强场配位体和弱场配位体;(7)几何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中心部位的中心原子(可以是金属原子,也可是高价非金属原子)或离子与配体组成,前者提供空轨道,称接受体,即接受体原子,后者提供孤电子对,称给予体,给予体中直接提供孤电子对的原子即为给予体原子。
(2)配位个体中与中心原子或离子结合的分子叫配位体,简称配体;配位体中直接键合于中心原子的原子叫配位原子,亦即上述之给予体原子。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为广义的是路易斯酸与路易斯碱的加合物。
复盐是过去无机化学上对明矾、冰晶石、光卤石等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有比所谓复盐还复杂的;②从结构看,无论单盐还是复盐,都可认为是配合物;③复盐,无论在晶体中,在溶液从配位个体稳定性的观点,可将复盐看作是一类稳定性极小的配合物;由于存在着许多中间状态,显然无法在复盐和配合物之间确定出一条绝对的界线。
(4)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨道杂化而成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对大小,使得配合物中的电子可能有两种不同的排列组态,其中含有单电子数较多的配合物叫高自旋配合物,不存在单电子或含有单电子数少的配合物叫低自旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中心原子周围因排列方式不同而产生的异构现象,称为几何异构现象,常发生在配位数为 4 的平面正方形和配位数为 6 的八面体构型的配合物中。
配合物的中文命名法

实际上,某些配合物还常用俗名, 如K4[Fe(CN)6] (亚铁氰化钾) 又称黄血盐 。
K3〔Fe(CN)6〕(铁氰化钾) 称赤血盐 。
Fe4〔Fe(CN)6〕3 (亚铁氰化铁)称普 鲁士蓝。
二配合物的同 分异构体
2.配合物的异构现象
化合物的分子式相同而结构、性质不同的现象称 为
•
[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III)
④若同类配体的配位原子相同,则含较少原子数的配体排
在前
[Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化硝基·氨·羟氨·吡啶合铂(II)
⑤若配位原子相同,配体中所含原子数目也相同, 则按在结构式中与配位原子相连的原子的元素符号 字母顺序排列
普鲁士蓝的制造:
牛血 草木灰
烘焙
水渍取 过滤
清凉 蒸发浓缩 溶液
3K4Fe(CN)6+ 4FeCl3 → Fe4[Fe(CN)6]3 + 12KCl
普鲁士蓝
黄色 晶体
三 氯 化 铁
普鲁士蓝的结构:
普鲁士蓝是经典的配合物。其配体为六个氰基,中心离子 为二价铁离子。氰基与二价铁离子共同通过配位键组成六 氰合铁(II)酸根(整体显-4价)作为普鲁士蓝的内配位 层(内界)。而外层的三价铁离子与钾离子作为普鲁士蓝 的外配位层(外界)通过离子键与六氰合铁(II)酸根以 离子键的形式相连接。结构方面,普鲁士蓝为六面立方结 构。氰基作为立方的各条棱连结处于顶点的铁离子,其中 相同价态的铁离子在各面上均互为对角,而每间隔一个立 方,钾离子会被包裹在其中。
普鲁士蓝染色肝细胞
普鲁士蓝除了可以作为染料,还作为铊中毒的药物。 在医疗上铊可置换普鲁士蓝上的钾后形成不溶性物质随 粪便排出,对治疗经口急慢性铊中毒有一定疗效。用量一般 为每日250mg/kg,分4次,溶于50ml 15%甘露醇中口服。 (适量补充氯化钾,高钾能增加肾对铊的清除能力,可能与 钾竞争性阻断肾小管对铊的吸收有关,同时钾可动员细胞内 的铊到细胞外,使血铊含量增加,可使临床病情加重,因此 要慎用)
钌的氯络合物详解

钌的氯络合物详解作者:研发中心来源:苏州市相城区北桥姑苏钛电极材料厂日期:2014-9-10 11:55:03人气:57钌的特征氧化态为Ru(IV)和Ru(III),在分析化学中这两种价态的氯钌络合物常被应用。
钌的氯络合物是用HCl吸收RuO4来制备,采用不同浓度的HCl可以得到不同组成和价态的络合物物种。
在高浓度的HCl介质中RuO4还原得到低价的钌络合物,而在0.5~3 mol/LHCl溶液中,Ru(VIII)还原为Ru(VI)。
M2[RuCl6]是用高于3 mol/LHCl与RuO4反应获得的,也可用[RuO2Cl4]2-与还原剂反应生成,但要制备纯M2[RuCl6]盐比较困难,因为在产物中可能含有Ru(Ⅲ)氯络合物和Ru(Ⅳ)的羟基氯络合物。
K2[RuCl6]和(NH4)2[RuCl6]均为黑色晶体,可溶于水和酸。
K2[RuCl6]的水溶液为黄色,由于易水解而很快变为黑色。
在>3 mol/LHCl介质中[RuCl6]2-发生快速的水合作用,生成的水合产物[Ru(H2O)Cl5]-和[Ru(H2O)2Cl4]又迅速离子化,形成两种羟基氯络合物物种,即[Ru2(OH)Cl5]2-和[Ru(OH)2Cl4]2-。
后一物种发生二聚作用并形成[Ru2OCl10]4-和[Ru2O2Cl8]4-,而且在比较稀的盐酸溶液中[Ru2O2Cl8]4-络离子占优势。
由于生成的含水和羟基氯络合物依赖于溶液中的酸度和Cl-浓度,因此随Cl-和H+ 浓度的不同溶液呈现不同颜色。
例如,当Cl-浓度<0.l mol/L 、H+浓度<0.4 mol/L时,溶液先由红变紫,再变为黄色;当Cl-浓度>0.l mol/L 、H+ 浓度>0.4 mol/L时,溶液先由红变黄,再变为紫色,最后又变为黄色。
M3[RuCl6]是由M2[Ru(H2O)Cl5]与浓HCl反应制成的。
Ru(III)的钠、钾、铵盐均为红色晶体,易溶子水和乙醇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D T a d T DF n et ain n t eS e to c pcP o e t s f () n um F n D T I v s g t s p cr so i r p ri 1 a d R () i o o h e o Ru I Co lx s 【 u b y ( H3 - mpe e : R ( p ) P ) C三CC H NO2 ) ] ,= ,1 ( 64 - C1 , O+ ) p (l
b yii ; = 1, 1(+的基 态 几 何 结 构 , 到 的 几 何 参 数 与 实 验 结 果 吻 合 的很 好 。采 用 T D F方 法 。 到 了配 合 物 1和 1 i r n m O( + 1) p de ) 】 得 D F 得 + 的 激 发态 电 子结 构 和 电子 吸 收 光 谱 。 研 究 结果 表 明 , 合 物 1和 1随着 氧化 过 程 的发 生 , 谱 性 质 也 发 生 变 化 。uⅡ配合 物 的 配 光 R () 低 能 吸 收被 指 认 为 ML TL C C /L T混 合 跃 迁 , 而氧 化 的 R ( 合 物 l的 低 能 吸收 具 有 L T跃 迁性 质 。 u 町配 + MC 关 键 词 : 配 合 物 ;电荷 转 移 ; 收 光 谱 ; 度 泛 函 ;含 时 密度 泛 函 钌 吸 密 中图 分 类 号 : 641 ; 6 48 O 1.21 O 1.21 文献标识码 : A 文 章 编 号 : 0 1 6 (0 71.6 50 10 48 1 0 )0 19 .5 2
[ ub y( H) C-C 6 4O 一) 1( - ,1 R (p ) 3一 P ( C H N 2 C] m= + ) p ' O 的光谱性质的密度泛 函. 含时密度泛函理论研究
李 明 霞 1 周 欣 张 红 星 付 宏 刚 z - 家钟 , 2 , E 、
(吉林 大学理 论 化 学研 究所 , 理论 化 学计 算 国 家重点 实验 室 . 长春 10 2 ) 30 3
维普资讯
第1 O期
20 0 7年 1 O月
无
机
3 No 1 l .O 2 Oc一 2 0 t 07
C NE E J HI S OURNAL OFI NORGANI C CHEMITR S Y
R () u1 n 1  ̄
i nv ri , h n c u 0 2 1 n U iest C a g h n 1 0 3 y 3
( c ol C mir dMae a cec, i n agU i r t Habn1o 8 )  ̄ ho o h sy a S f e t n t r l Sine Heo  ̄i is l n nv sy ri 5o o e i,
Abta t T erte im 1 a drte i ( cmpee R (p ) H ) CiC 6 4 2 )1 b y 22-iyi— sr c: h uh nu () n h nu 皿 o l s[ ub y( 3- C HNO- C] p= ,' p r 1 u m x P ( p [ b d ie m= () + (+ aeivs gtdtert al t x lr te lc o i s u trsa dset so i po et n ; 01, 11) r et ae oei l epoe h i e t nc t cue n p c ocpc rp r 】 n i h c yo r e r r r — is T ego n — aego t t c rs f n r pi zdb eD T m to f3 Y )T ec l ltd e. h ru ds t eme ys t e a d1 aeot e yt F eh d B L P. h ac a t r r u o1 u mi h u e
(黑龙 江 大学化 学化 工与材 料 学 院 , 尔滨 10 8) 哈 50 0
摘要 :我们利用 D F中的 B L P方法优化 了 R () F 3Y uⅡ配合物 和氧化 的 R ㈣ 配合物【uby(H) C;C 64O -)1[p = , . u R (p ) 3一 P ( CH N 2 C] by 2 p m 2
L i g Xi ZHOU Xi Z IM n — a, 2 n HANG n — n Ho g Xi g F n — n  ̄ S i— u g U Ho g Ga g UN Ch a Ch n
(t eK yLb r oyo hoei l n o p t i a h msr Isi t o h oecl h m t , a e aoa r T ert a adC m ua o l e i y ntu St t f c t n C t, t e fT ert a C i r i e s y
g o t a a tr r n a r e n i x e i n a a u s e mer p r me e s a e i g e me tw t e p r y h me tlv l e .Ab o p i n s e ta f r c mp e e n a e s r t p c r o o l x s 1 a d 1 r o p e it d a h DDF / 3 YP l v 1 o o l x 1 h o e e g b o t n a e a mi e rdce tte T T B L e e .F r c mp e ,t e lw— n r y a s r i s h v x d ML T L C p o C /L T
