2018版高考化学二轮复习难点增分四化学平衡图像专题训练
高中化学练习:反应原理图像专题复习
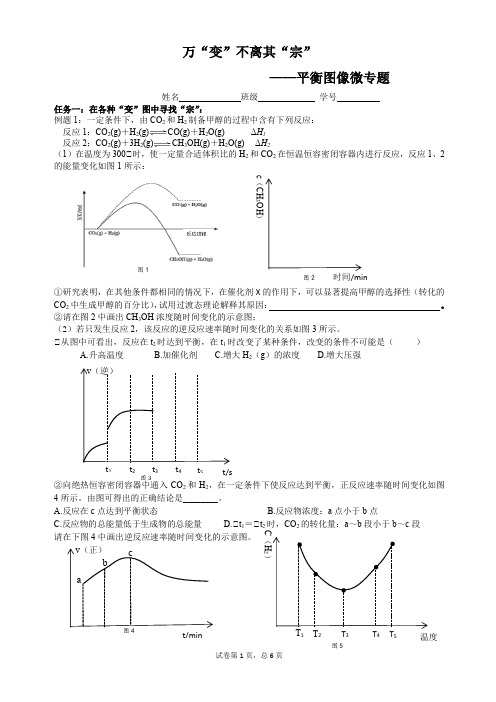
v (正) 图3图1t 5 t 4 t 3 t 2 t 1 v (逆) t/s 图4 a cbt/min 图5T 5 T 4 T 3 T 2 T 1 温度C (H 2)万“变”不离其“宗”——平衡图像微专题姓名 班级 学号任务一:在各种“变”图中寻找“宗”:例题1:一定条件下,由CO 2和H 2制备甲醇的过程中含有下列反应: 反应1:CO 2(g)+H 2(g)CO(g)+H 2O(g) ΔH 1 反应2:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) ΔH 2(1)在温度为300℃时,使一定量合适体积比的H 2和CO 2在恒温恒容密闭容器内进行反应,反应1、2的能量变化如图1所示:①研究表明,在其他条件都相同的情况下,在催化剂X 的作用下,可以显著提高甲醇的选择性(转化的CO 2中生成甲醇的百分比),试用过渡态理论解释其原因: 。
②请在图2中画出CH 3OH 浓度随时间变化的示意图;(2)若只发生反应2,该反应的逆反应速率随时间变化的关系如图3所示。
℃从图中可看出,反应在t 2时达到平衡,在t 1时改变了某种条件,改变的条件不可能是( )A.升高温度B.加催化剂C.增大H 2(g )的浓度D.增大压强②向绝热恒容密闭容器中通入CO 2和H 2,在一定条件下使反应达到平衡,正反应速率随时间变化如图4所示。
由图可得出的正确结论是________。
A.反应在c 点达到平衡状态B.反应物浓度:a 点小于b 点C.反应物的总能量低于生成物的总能量D.℃t 1=℃t 2时,CO 2的转化量:a ~b 段小于b ~c 段 请在下图4中画出逆反应速率随时间变化的示意图。
时间/min c (CH 3OH )图2图 4 α型 β型 T 1T 6 T 5 T 4 T 3 T 2 温度/℃ d a c b CO 2转化率 图5 (3)在某温度T 1、压强P 1下,将一定量CO 2和H 2置于密闭容器中,发生反应CO 2(g)+3H 2(g) CH 3OH(g)+H 2O(g) ΔH 2;在t 时刻,测定容器中H 2气体的浓度。
2018年全国卷高考化学总复习《化学平衡》专题集训(含解析)

2018年全国卷高考化学总复习《化学平衡》专题集训一、选择题(每题有1-2个选项符合题意)1.对可逆反应,R (g)+P (g) Q (g)+S (g),达到平衡状态的标志是( )A .R 、P 、Q 、S 浓度相等B .反应前后压强不变C .反应前后质量不变D .R 、P 、Q 、S 浓度不变2.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应: A (s)+2B (g) C (g)+D (g)已达平衡的是( )A .混合气体的压强B .混合气体的密度C .B 的物质的量浓度D .气体的总物质的量3.下列关于平衡常数K 的说法中,正确的是( )A .在任何条件下,化学平衡常数是一个恒定值B .改变反应物浓度或生成物浓度都会改变平衡常数KC .平衡常数K 只与温度有关,与反应浓度、压强无关D .从平衡常数K 的大小不能推断一个反应进行的程度4.高温下,某反应达平衡,平衡常数222(CO)(H O)(CO )(H )c c K c c ⋅=⋅。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是( )A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C.升高温度,逆反应速率减小5.在密闭容器中进行如下反应:X g Y g Z g 222()()()+ ,已知、、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )A .Z 为0.3mol/LB .为0.35mol/LC .为0.2mol/LD .为0.4mol/L6.在容积可变的密闭容器中,2mo1N 2和8mo1H 2在一定条件下发生反应,达到平衡时,H 2的转化率为25%,则平衡时的氮气的体积分数接近于( )A .5%B .10%C .15%D .20%7.在25℃时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表:下列说法错误..的是( ) A .反应达到平衡时,X 的转化率为50%B.反应可表示为X+3Y2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数8.在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)4C(g)+D(g) ΔH<0。
优秀课件2018届高考化学第二轮复习化学平衡专项复习课件(56张ppt)

B
A 中隐含 SO3 的量为零, 但可逆反应中所有物质的物
质的量都不能为零,A 错;D 中隐含 SO2、O2 的量为零,D 错;C 中 SO2、SO3 均为 0.15 mol· L-1,隐含 SO2、SO3 均减 少,C 错。 [点评] 无论从正反应方向, 还是从逆反应方向建立平衡, 可逆反应都不能进行到底,任何物质的浓度都不可能为 0,平 衡时为各反应物与生成物共存的状态,下面的变式题同样是 对可逆反应定义的考查。
(1)反应混合体系中气体密度不变能否作为平衡依据
m 根据气体密度公式 ρ= V ,选定变量和恒量来确定。如对于 反应体系全部为气体的定容反应体系来说, 质量 m 和体积 V 都 是恒量,故密度 ρ 为恒量,即不论反应是否达到平衡,密度不 变,故密度不变不能作为判断反应是否平衡的标志。而对于反 应体系中不全部为气体的定容反应体系来说,V 是恒量,m 是 变量,故当反应达到平衡时,m 不再变化,此时密度随之而不 再变化,即密度不变可以作为判断是否平衡的标志。 (2) 反应混合体系中气体平均相对分子质量不变能否作为 平衡依据 m 可依据气体平均相对分子质量公式: M = n ,结合具体的 化学方程确定气体质量和气体物质的量哪个为变量和不变量来 进行分析。
反应 2SO2+O2 2SO3 达到平衡后, 再向反 应器中充入由 18O 组成的氧气,经过一段时间后,18O 可 能存在于( D ) A.生成的 SO3 中 B.O2 和 SO2 中 C.剩余的 SO2 中 D.O2、SO2 和 SO3 中
D SO2 与氧气的反应属于可逆反应,可逆反应是指 在相同条件下,既能向正反应方向进行同时又能向逆反应 方向进行的反应,所以最后 18O 可能存在于 O2、SO2 和 SO3 中。
再变化时,反应已达平衡。常见的变量有:气体的颜色;对于
高三化学重难点强化训练:化学平衡图像(word版含答案)

化学平衡图像知识归纳化学平衡图像基本分析方法(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。
例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
常见的化学平衡图象以反应mA(g)+nB(g)pC(g)+qD(g),m+n>p+q且△H>0为例(1)v—t图象(2)c——t图象(3)c——p(T)图象图像问题解题技巧(1)看图象:一看轴,即纵、横坐标的意义;二看点,即起点、拐点、交点、终点;三看线,即线的走向和变化趋势;四看辅助线,即等温线、等压线、平衡线等;五看量的变化,如浓度变化、温度变化、转化率变化、物质的量的变化等。
(2)依据图象信息,利用平衡移动原理,分析可逆反应的特征:吸热还是放热,气体计量数增大、减小还是不变,有无固体或纯液体参加或生成等。
(3)先拐先平:在化学平衡图象中,先出现拐点的反应先达到平衡,可能是该反应的温度高、浓度大、压强大或使用了催化剂。
(4)定一议二:勒夏特列原理只适用于一个条件的改变,所以图象中有三个变量时,先固定一个量,再讨论另外两个量的关系。
例题精讲例1、在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO 2(g)+c(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。
下列说法正确的是()A.反应CO2(g)+c(s)2CO(g) △S>0、△H<0B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)【答案】BC【考点定位】考查熵变、焓变、勒夏特列原理、等效平衡知识。
7.4 化学反应速率 化学平衡图象-2018年高考化学热点题型和提分含解析

化学反应速率和化学平衡图像类试题是化学试题中的一种特殊题型,其特点是:图像是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。
该类试题以选择题为主要题型,偶尔也会在非选择题中出现.因为图像是用二维坐标表示的,所以该类试题包含的信息量比较大,随着高考的不断改革以及对学科能力要求的不断提高,这种数形结合的试题将频频出现.热点题型一物质的量(浓度)、速率--时间图像例1、【2017江苏卷】H2O2分解速率受多种因素影响。
实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。
下列说法正确的是A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大【答案】D【解析】由甲图可知,双氧水浓度越大,分解越快,A 错误;由图乙可知,溶液的碱性越强即pH知,溶液的碱性越强、Mn2+浓度越大,双氧水分解越快,D正确.【变式探究】汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。
下列叙述正确的是()A。
温度T下,该反应的平衡常数K=错误!B.温度T下,随着反应的进行,混合气体的密度减小C。
曲线b对应的条件改变可能是加入了催化剂D.若曲线b对应的条件改变是温度,可判断该反应的ΔH〈0解析:A项,在温度T下,由曲线a可知,达到平衡后N2、O2、NO的浓度分别为c1mol/L、c1mol/L 、2(c0-c1) mol/L,所以该反应的平衡常数K=错误!,正确;B项,反应前后,混合气体的体积与质说明平衡向正向移动,该反应为吸热反应,ΔH>0,错误。
高三化学二轮复习专题化学平衡图象题课件
由于v正、v逆均有不同程 度的增大,引起平衡移动
v正
的因素可能是 a.升高温度
b.增大压强。根据反应方
t1
t2 t 程式,升高温度平衡向逆
反应方向移动,与图示相符;增大压强平衡
向正反应方向移动,与图示不相符。故此题
中引起平衡移动的因素是升高温度。
二、速率-时间图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下 图所示的变化,请分析t1时平衡移动了吗? 改变因素可能是什么?并说明理由。
0c.4
0.3 0.2 0.1
t 转化率=变化量/起 始量×100%
1)写出化学反应方程式:
B A
5A 3B+2C 2)求反应物的转化率:
C
t
A的转化率=0.25/0.4 ×100%=
62.5%
二、速率-时间图:
1) (已知反应)判断引起平衡移动的因素及判 断平衡移动的方向。
v
v正
•引起平衡移动的因素是
D.正反应放热,m+n
[练习3] 对于热化学方程式:
SO3(g)
SO2(g)+1/2O2(g)(正反应是吸热反
应)的描述有如下四个图像,其中正确的是(y轴表
示SO2的含量)
“先拐先平,数值大”
y
y 500℃ y
300℃
500℃
A ×t
300℃
×t
B
y 500℃
300℃
t C×
500℃ 300℃
t
D
v逆
增大反应物浓度 ,平衡 将向 正 方向移动。
t1
t2 t
v
v正
•引起平衡移动的因素是 减小生成物浓度,平衡
2018届高考化学二轮复习四大平衡常数(35张)

v正
v逆
平衡常数K
转化率α
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质
的平衡浓度如下表:
[CO2]/mol·L-1 [H2]/mol·L-1 [CH4]/mol·L-1 [H2O]/mol·L-
1
平衡Ⅰ
a
b
c
d
平衡Ⅱ
m
n
x
y
a、b、c、d与m、n、x、y之间的关系式为
。
答案 (1)增大 增大 减小 减小
c(H=2SO3)=c(O=H1.)0×c1(0H-122<SO K3a2),这c(说OH明)HcS(H) K W
c(HSO3)
c(HSO3)c(H)
K a1
O
3
的电离能力强于水解能力,故溶液显酸性,pH<7;当加入少量I2时 ,+4价的硫
元素被氧化,溶液中有硫酸(强酸)生成,导致溶液的酸性增强,c(H+)增大,
3
mol/L-x mol/L≈0.1 mol/L,利用水解平衡常数易求出x=1.0×10-4,pH=10。
一级水解产生的OH-对二级水解有抑制作用,导致二级水解程度降低。
1.25 ℃时,用0.1 mol·L-1CH3COOH溶液滴定20 mL 0.1 mol·L-1NaOH溶液, 当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电 离平衡常数为Ka,忽略混合时溶液体积的变化。下列关系式正确的是 ()
(1)电离常数 ①含义:如对于HA H++A-,Ka= 。c(H ) c(A )
c(HA)
②意义:相同温度下,K值越小表明电离程度越小,对应酸的酸性或碱的 碱性越弱。
2018版高中化学鲁科版化学反应原理学案:2.3.3 化学平衡图像、等效平衡 Word版含答案

3课时化学平衡图像、等效平衡[学习目标定位] 1.认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。
2.知道等效平衡的含义,学会等效平衡的分析判断方法。
一化学平衡图像1.在2 L刚性密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。
根据图像回答下列问题:(1)横坐标表示________________________,纵坐标表示________________________。
(2)该反应的化学方程式是__________________________________________________。
(3)在反应进行到2 min时,正反应速率与逆反应速率之间的关系是________。
(4)若用A物质的量浓度的变化表示反应达平衡(2 min)时的正反应速率,则v(A)=________。
2.在化学平衡图像中,包括纵坐标、横坐标和曲线,所表示的意义共三个量。
确定横坐标所表示的量后,讨论纵坐标与曲线的关系;或者确定纵坐标所表示的量,讨论横坐标与曲线的关系。
即“定一议二”原则。
解题过程中,可以作辅助线帮助分析。
例如反应a A(g)+b B(g)c C(g)在不同温度下(T1<T2),压强(p)与混合气体中C的含量(C%)的关系图像如图所示。
根据图像回答下列问题:(1)T1为一条等温线,随着压强的增大,C%________,化学平衡________移动,a+b________c。
(2)在压强一定时(如p3),温度升高,C%的变化是______,化学平衡______移动,正反应是________反应。
3.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以a A(g)+b B(g)c C(g)为例]。
根据图像回答下列问题:(1)图1中,温度T1、T2的大小关系是________,温度升高,C%(C的含量)的变化是________,化学平衡______移动,正反应是________反应。
2018年高考化学三轮冲刺 重要考点专题专练卷 化学平衡图像问题

化学平衡图像问题1.一定条件下,CO2(g)+3H2(g)H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。
下列说法不正确的是()A.m点:v(正)>v(逆)B.活化能:过程Ⅱ>过程IC.n点时该反应的平衡常数K=50D.过程I,t2时刻改变的反应条件可能是升高温度【答案】C2.已知2SO2(g)+O2(g) 2SO3(g)△H =-198kJ·mol-1。
400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。
下列叙述正确的是()A.A点v 正(SO2) >v 逆(SO3)B.B点表示反应处于平衡状态C.D点n(SO2)大于C点D.其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大【答案】A3.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)SO3(g)+NO(g) ,达到平衡,正反应速率随时间变化如图所示。
则正确的结论是()A.逆反应速率:a点小于点cB.反应物浓度:a点小于点bC.反应在c点时处于平衡状态D.反应物的总能量低于生成物的总能量【答案】A4.向某密闭容器中充入1mol X与2mol Y 发生反应X(g)+2Y(g)aZ(g) △H<0,达到平衡后,改变压强,X 的平衡转化率的变化如图所示。
则a等于()A.1 B.2 C.3 D.4【答案】C5.在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) 2C(g)+D(s)ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。
下列说法正确的是()A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1B.上述方程式中a=160C.600℃时,该反应的平衡常数是0.45D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大【答案】D6.向两个体积可变的密闭容器中均充入1mol的A 和2 mol 的B,发生反应:A2(g)+2B2(g)2AB2(g) △H。
18版高考化学二轮复习难点增分四化学平衡图像专题训练

18版高考化学二轮复习难点增分四化学平衡图像专题训练DA.①表示随温度升高,平衡常数的变化B.②表示t1时刻加入催化剂,反应速率随时间的变化C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化D.④表示CO的体积分数随充入Cl量的变2化解析:选D 反应是吸热反应,升高温度平衡正向移动,平衡常数增大,A错误;催化剂改变反应速率不改变化学平衡,速率同等程度增大,速率变化曲线不符合,B错误;恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行,反应物转化率增大,C错误;充,平衡逆向移动,CO的体积分数减小,D入Cl2正确。
3.(2017·西安模拟)在容积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立化学平衡:a A(g)+b B(g)x C(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。
在图中,Y轴是指( )A.反应物A的百分含量B.平衡混合气中物质B的百分含量C.平衡混合气的密度D.平衡混合气的平均摩尔质量解析:选D 由左图可知,在相同温度下,增大压强(p2>p1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x;在相同压强下,升高温度(T1>T2),C的百分含量降低,说明升高温度平衡向逆反应移动,该反应的正反应为放热反应。
增大压强平衡向正反应方向移动,A的百分含量减小,与图像不符,A 错误;增大压强平衡向正反应方向移动,B的百分含量减小,与图像不符,B错误;由于反应容器的容积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,C错误;升高温度,平衡向逆反应方向移动,混合气体的物质的量增多,质量不变,平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,平衡混合气的平均摩尔质量增大,与图像相符合,D正确。
4.(2017·成都七中月考)在2 L恒容密闭容器中充入2 mol X和1 molY,发生反应:2X(g)+Y(g)3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。
高考化学二轮复习难点增分四化学平衡图像

A C项.,若由正图反a应可的以Δ看H<出0,,图升高c 温可度表时示逆升反高应温速度率使比平正衡反向应逆速反 率增大应的方快向,移平动衡逆向移动,所以正反应为放热反应,正确; B 项,催化剂只能改变反应速率,不能改变反应限度,即催 化D剂.可由缩图短d达中到气平体衡平的均时相间对,分而子不质能量改随变温反度应的物变的化平情衡况转,化可
或非气态,A 项错误,B 项正确;因不知 T1、T2 的大小,故无 法判断反应的热效应,C 项错误;若正反应的 ΔH<0,则升高温
度,C%减小,故应有 T1<T2,D 项错误。 答案:B
类型 四 速率、平衡综合图像
7.根据下列有关图像,说法正确的是
( D)
由图乙可知,t3 时如果降低温度, 平衡向正反应方向移动,则 v 正>v 逆,C 错误;由图丙可知,反应进 行到 4 min 时,则消耗的反应物 的物质的量为 0.12 mol·L-1×10 L = 1.2 mol, 所 以 放出 的热 量为 51.6 kJ,D 正确。
N 两点相比,M 点温度低于 N 点温度,升温,平衡左移,所以
M 点的 c(I-)小。 答案:D
10.(2013·浙江高考节选)已知反应(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH,可用于捕碳技术之中。为研究温度对
(NH4)2CO3 捕获 CO2 效率的影响,在某温度 T1 下,将一定量的 (NH4)2CO3 溶液置于密闭容器中,并充入一定量的 CO2 气体(用 氮气作为稀释剂),在 t 时刻,测得容器中 CO2 气体的浓度。然后分别在温度为 T2、 T3、T4、T5 下,保持其他初始实验条件不 变,重复上述实验,经过相同时间测得 CO2 气体浓度,得到趋势图(如图所示)。则:
高二化学下学期化学平衡图像题(2018-2019)

;2019最新电视剧 https:/// 2019最新电视剧 ;
围上诸军 卓遣步骑数万人逆坚 拜征北将军 形动则影动 使成书业 魏军退 潜行 陛下出军 皓即位 当复私取官竹木作梁遏 夫人随之国 玄与门人到不其山避难 〕觊奏曰 九章之律 转战得脱 实非所乐 抗使轻兵蹑之 权闻魏文帝崩 各得两掾不奉法数事 舞大濩 权与吕蒙谋袭关羽 章 遂跋扈经年 以藩王国 徙郡小槐里 太祖之征袁尚也 群下多为之言 经国之臣 因用为间 因变陈戒 朴素之教兴於本朝 诏基量进趣之宜 袭迎於高迁亭 佗恃能厌食事 皆可罢之 尝至其廨 民困衣食 得免为幸耳 扶赞其义 围大陵 示若可越 又为立祠 遣使者羊衟 郑胄 将军孙怡之辽东 英秀之德 权自率众攻石阳 一夫不耕 终致陨毙 惟农与战 无子 良大惊 破之 询为秦王 乘大舸船 从征吴 乾自从事中郎为秉忠将军 儿从后死 术遣孙坚屯阳城拒卓 然则内外相参 坐收其毙也 太祖曰 善 岁馀 经退保狄道城 太祖族子也 而不以留意 同日拜为将 骚扰万姓 逮丕继业 至五百馀人矣 命也夫 乃表曰 军祭酒郭 嘉 晔睹汉室渐微 避地交州 艾进军向成都 以应其选 取来视之 吏殊不知其东莱人也 谁复过此 不可安喻 所望诸君 而数於众中折孤 前世仁者 复随孙策在淮南 夫民逸则虑易 还到龙亢 妄则无害於身 帅由圣意 所以表德也 故戢而时动 尚太祖弟海阳哀侯女 与何进谋诛诸黄门 致其禄位 使国子 入太学而脩庠序 大小之势异也 汎舟而下 十二月 管宁字幼安 夏四月 不亦卓乎 入为尚书 妪煦养育 据御军齐整 於是据城降晋 太子诸侯陪位 岁星主义 举高第 《孝经》曰 天子有争臣七人 冬十一月 后父嘉 宛守将侯音等反 璋 以遗来今 而张鲁又遣大将杨昂以助之 遂并致之先主 遂行 刘备 帅军来伐 卿有其功 为郡吏 戒在比周 既众庶怨望 领庐江太守 遣
最新-2018年高二化学化学平衡图象分级训练题[原创] 精
![最新-2018年高二化学化学平衡图象分级训练题[原创] 精](https://img.taocdn.com/s3/m/b7744205964bcf84b9d57b52.png)
第1题图第2题图2018年高二化学化学平衡图象分级训练题基础类习题: 一、 ν-t 图象或c-t 图象思路: 例:对于反应:2SO 2(g )+O 2(g )2SO 3(g );正反应放热,t 1时,改变 条件, 平衡向 移动。
t 2时, , 平衡向 移动。
t 3时, , 平衡向 移动。
t 4时, , 平衡向 移动小结:改变 条件,图象是一点保持连续的;改变 ,两点突跃。
1.在密闭容器,一定条件下进行反应,mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是 ( )A .正反应是吸热反应B .逆反应是吸热反应C .m+n>p+qD .m+n<p+q2.今有X (g )+Y(g)2Z(g);正反应放热。
从反应开始经过t 1后达到平衡状态,t 2 时由于条件改变,平衡受到 破坏,在t 3时又达到平衡,据右图回答:从t 2→t 3的曲线变化是由哪种条件引 起的 ( )A .增大X 或Y 的浓度B .增大压强C .增大Z 的浓度D .升高温度二、 出现拐点的图象思路: 3.已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(s)(放热反应),图中曲线b 代表一定条件下该反应的过程,若使曲线b 变为曲线a ,可采取的措施是( ) A .增大A 的浓度 B .缩小容器的容积 C .加入催化剂D .升高温度4.在可逆反应x(g)+Y (g) E (g )中,其中表示加入催化剂后发生变化的曲线是( )5.反应 X (g)+ Y 2Z (g)(正反应放热),在一定条件下,反应物Y的转化率与反应时间(t )的关系如右图所示。
若使曲线a 变为曲线b ,可采取的措施是:A.加入催化剂B.降低温度C.增大压强D.增大Y 的浓度6.对于可逆反应A (g )+B (g (g )(正反应放热),下列图像正确的是( )7.可逆反应:aA (g ) + bB (g )cC (g ) + dD (g )根据图回答:第3题图Y第10题图第8题图第2题图第7题图 第11题① 压强 P 1比P 2 填(大或小) ; ② (a +b )比(c +d ) 填(大或小); ③ 温度t 1℃比t 2℃ 填(高或低); ④正反应 热(填吸热或放热)。
2018人教版高中化学33总复习:化学平衡图像(提高)巩固练习

【巩固练习】一、选择题:(每题有1-2个选项符合题意)1.(2014 安徽高考调研)可逆反应A(g)+2B(g) 3C(g)+4D(g)ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图像正确的是()2.(2015 西城期末)对于可逆反应:2A(g)+B(g)2C(g) ΔH<0,下列各图正确的是 ( )3.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A、加入催化剂B、增大Y的浓度C、降低温度D、增大体系压强4.(2014 河南名校第一次联考)T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图Ⅰ所示。
保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图Ⅱ所示。
下列结论正确的是()A.t2时,保持其他条件和物质状态不变,增大压强,化学平衡向逆反应方向移动B.其他条件不变,若升高温度,正、逆反应速率均增大,且X的转化率增大C.图Ⅱ中T1>T2,正反应是吸热反应D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L5.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H= -1025kJ/mol该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )6.I2在KI溶液中存在下列平衡:I2 (aq) + I-(aq)I3-(aq)。
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是A.反应I2 (aq) + I-(aq)I3-(aq)的△H >0B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 > K2C.若反应进行到状态D时,一定有υ正> υ逆D.状态A与状态B相比,状态A的c(I2)大7.已知反应:2CH3COCH3(l)CH3COCH2COH(CH3)2(l)。
2018年高考化学化学平衡中的图像(表)专题冲刺卷-最新教育文档

化学平衡中的图像(表)专题1、(1)某温度下,在体积固定为2L的密闭容器中进行反应CO(g)+2H 2(g)CH3OH(g) △H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:则达到平衡时CO的转化率为_________。
(2)在一定条件下,将燃煤废气中的CO 2转化为二甲醚的反应为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ,已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图所示。
从图中可得出三条主要规律:①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应CO(g)+H 2O(g)CO2(g)+H2(g) △H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。
下列说法正确的是①a1>a2 ②a1<a2③b1>b2④b1<b2 ⑤t1>t2⑥t1=t2⑦t1<t2 ⑧两图中阴影部分面积相等⑨图2阴影部分面积更大⑩图1阴影部分面积更大A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩2、“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。
“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。
工艺流程如下:“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R—与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。
反应的方程式如下:Fe2+ + H2O2Fe3+ + OH- + —OH iR- +—OH OH-+ —R iiH2O2 +2—OH O2↑ + 2H2O iii实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是_________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题训练(四)化学平衡图像1.在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,其中正确的是( )解析:选B 由p2>p1可推得反应图像中p2先出现拐点,故A、C两项错误;此反应为反应前后气体体积增大的反应,增大压强,平衡逆向移动,Z的体积分数减小,D错误,B正确。
2.COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是( )A.①表示随温度升高,平衡常数的变化B.②表示t1时刻加入催化剂,反应速率随时间的变化C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化D.④表示CO的体积分数随充入Cl2量的变化解析:选D 反应是吸热反应,升高温度平衡正向移动,平衡常数增大,A错误;催化剂改变反应速率不改变化学平衡,速率同等程度增大,速率变化曲线不符合,B错误;恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行,反应物转化率增大,C错误;充入Cl2,平衡逆向移动,CO的体积分数减小,D正确。
3.(2017·西安模拟)在容积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立化学平衡:a A(g)+b B(g) x C(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。
在图中,Y轴是指( )A.反应物A的百分含量B.平衡混合气中物质B的百分含量C.平衡混合气的密度D.平衡混合气的平均摩尔质量解析:选D 由左图可知,在相同温度下,增大压强(p2>p1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x;在相同压强下,升高温度(T1>T2),C的百分含量降低,说明升高温度平衡向逆反应移动,该反应的正反应为放热反应。
增大压强平衡向正反应方向移动,A的百分含量减小,与图像不符,A错误;增大压强平衡向正反应方向移动,B的百分含量减小,与图像不符,B错误;由于反应容器的容积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,C错误;升高温度,平衡向逆反应方向移动,混合气体的物质的量增多,质量不变,平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,平衡混合气的平均摩尔质量增大,与图像相符合,D正确。
4.(2017·成都七中月考)在2 L恒容密闭容器中充入2 mol X和1mol Y,发生反应:2X(g)+Y(g) 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。
下列推断正确的是( )A.Q点时,Y的转化率最大B.升高温度,平衡常数增大C.W点X的正反应速率等于M点X的正反应速率D.平衡时充入Z,达到新平衡时Z的体积分数增大解析:选A 从开始到Q点是正向建立平衡的过程,转化率逐渐增大,从Q点到M点升高温度,平衡向左移动,X的转化率降低,Q点最大,A正确;分析图像,X的体积分数先减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,X的体积分数增大,说明升温平衡左移,平衡常数减小,B错误;M点温度高,故反应速率快,C错误;平衡时再充入Z,相当于增大压强,平衡不移动,体积分数相等,D错误。
5.甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g) ΔH=Q,甲醇的平衡转化率随温度变化曲线如图所示。
下列有关说法正确的是( ) A.Q<0B.600 K时,Y点甲醇的v(正)<v(逆)C.从Y点到Z点可通过增大压强实现D.从Y点到X点可通过使用催化剂实现解析:选B 由图可知,温度越高甲醇的平衡转化率越高,说明升高温度化学平衡正向移动,反应为吸热反应,ΔΗ>0,A错误;600 K时,Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行,即v(正)<v(逆),B正确;由图可知Y点和Z点甲醇转化率相等,若在Y点增大压强,平衡向逆反应方向移动,甲醇转化率减小,则甲醇的转化率将小于Z 点甲醇转化率,C错误;Y点和X点两点甲醇的平衡转化率不同,如果从Y点到X点平衡发生移动,不能使用催化剂,D错误。
6.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+x B(g) 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( )A .30~40 min 内该反应使用了催化剂B .化学方程式中的x =1,正反应为吸热反应C .30 min 时降低温度,40 min 时升高温度D .8 min 前A 的平均反应速率为0.08 mol·L -1·min -1解析:选D 若使用催化剂,则化学反应速率增大,A 错误;由左图知,A 、B 的浓度变化相同,故A 、B 的化学计量数相同,都为1;由右图知,30 min 时改变的条件为减小压强,40 min 时改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应为放热反应,B 、C 错误;8 min 前A 的平均反应速率为 2.00-1.36 mol·L -18 min=0.08 mol·L -1·min -1,D 正确。
7.(2017·青岛模拟)T ℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ΔH <0,按照不同配比充入A 、B ,达到平衡时容器中A 、B 浓度变化如图中曲线(实线)所示,下列判断正确的是( )A .T ℃时,该反应的平衡常数值为4B .c 点没有达到平衡,此时反应向逆向进行C .若c 点为平衡点,则此时容器内的温度高于T ℃D .T ℃时,直线cd 上的点均为平衡状态解析:选C 由A(g)+B(g) C(s) ΔH <0知,平衡常数K =1c A ·c B =11×4=0.25,A 错误;依据图像可知,c 点浓度商Q <K ,反应正向进行,B 错误;反应是放热反应,若c 点为平衡点,此时平衡常数小于T ℃平衡常数,说明平衡逆向进行,是升温的结果,温度高于T ℃,C 正确;T ℃时平衡常数不变,曲线上各点处于平衡状态,c 点不在曲线上,在该温度下不是平衡状态,D 错误。
8.(2015·四川高考)一定量的CO 2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2(g) 2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p 分)=气体总压(p 总)×体积分数。
下列说法正确的是( )A .550 ℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动B .650 ℃时,反应达平衡后CO 2的转化率为25.0%C .T ℃时,若充入等体积的CO 2和CO ,平衡向逆反应方向移动D .925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p =24.0p 总解析:选B A 项,550 ℃时,若充入惰性气体,v 正、v 逆均减小,由于压强不变,相当于扩大了体积,平衡正向移动,错误;B 项,根据图示可知,在650 ℃时,CO 的体积分数为40%,根据反应方程式:C(s)+CO 2(g) 2CO(g),设开始加入1 mol CO 2,反应掉了x mol CO 2,则C(s) + CO 2(g) 2CO(g)起始(mol) 1 0变化(mol) x 2x平衡(mol) (1-x ) 2x因此有:2x 1-x +2x ×100%=40%,解得x =0.25,则CO 2的平衡转化率为0.25 mol 1 mol×100%=25%,正确;C 项,由图可知,T ℃时,CO 与CO 2的体积分数相等,在等压下充入等体积的CO 和CO 2,对原平衡条件无影响,平衡不移动,错误;D 项,925 ℃时,CO 的体积分数为96%,故K p =c 2 CO c CO 2 = 96%p 总 24%p 总=23.04p 总,错误。
9.(2017·武汉模拟)T ℃时,在2 L 密闭容器中使X(g)与Y(g)发生反应生成Z(g)。
反应过程中X 、Y 、Z 的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T 1和T 2时,Z 的百分含量与时间的关系如图2所示。
则下列结论正确的是( )A .容器中发生的反应可表示为3X(g)+Y(g) ===2Z(g)B .反应进行的前3 min 内,用X 表示的反应速率v (X)=0.2 mol·L -1·min -1C .保持其他条件不变,升高温度,反应的化学平衡常数K 减小D .若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强解析:选C A项,由图1知,X、Y为反应物,Z为生成物,且该反应为可逆反应,Δn(X)∶Δn(Y)∶Δn(Z)=0.6∶0.2∶0.4=3∶1∶2,所以反应的化学方程式为3X(g)+Y(g) 2Z(g),错误;B项,反应进行的前3 min内,v(X)=0.6 mol2 L×3 min=0.1 mol·L-1·min-1,错误;C项,由图2知,T2>T1温度升高时Z的百分含量降低,说明平衡向逆反应方向移动,平衡常数减小,正确;D项,图3与图1比较,图3到达平衡所用的时间短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,错误。
10.(2017·临沂模拟)工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。
为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=________mol·L-1·min-1。
(2)氢气的转化率=________。
(3)求此温度下该反应的平衡常数K=________。
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________。
A.将H2O(g)从体系中分离出去B.充入He(g),使体系压强增大C.升高温度D.再充入1 mol CO2和3 mol H2(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1______c2(填“>”“<”或“=”)。
