大肠系统表达及纯化操作指南
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1. 仪器与材料:-80℃冰箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5;50ml 离心管;冷冻高速离心机2.方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4℃离心15min,弃上清。
2.1.2 菌体沉淀中加入相同菌液体积的50mM PBS 或50mM Tris-HCl(选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3 然后按原菌液体积的1/4加入缓冲液重悬菌体,并加入蛋白酶抑制剂PMSF和EDTA(带His标签不加),PMSF终浓度为100μg/ml, EDTA的终浓度为。
取20μl重悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4 将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2超声波处理 (对超声波及热敏感的蛋白慎用)2.2.1 将反复冻融的菌液(必要时可加入1mg/ml 溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变清澈为止,大约花费时间。
2.2.2 取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上清和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford法或者紫外吸收法。
(4)可通过SDS-PAGE 电泳观察菌体破碎程度及目标条带占总蛋白的含量。
大肠杆菌系统表达和纯化流程
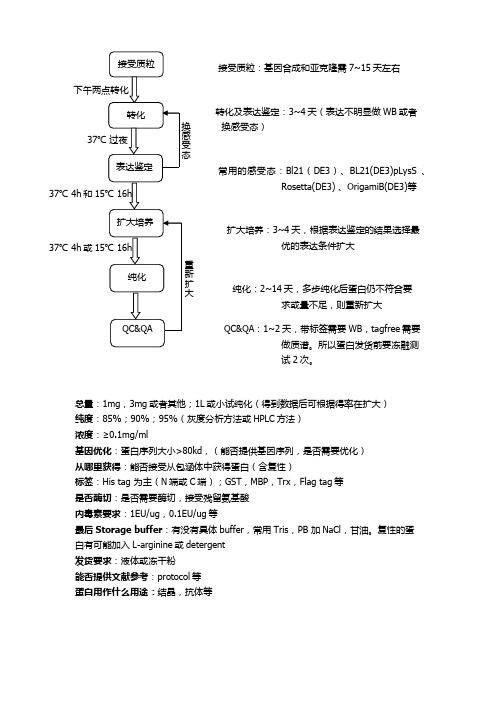
转化及表达鉴定:3~4天(表达不明显做WB或者
换感受态)
常用的感受态:Bl21(DE3)、BL21(DE3)pLysS 、
Rosetta(DE3) 、OrigamiB(DE3)等
扩大培养:3~4天,根据表达鉴定的结果选择最
优的表达条件扩大
纯化:2~14天,多步纯化后蛋白仍不符合要
求或量不足,则重新扩大
:1~2天,带标签需要WB,tagfree需要
做质谱。
所以蛋白发货前要冻融测
试2次。
总量:1mg,3mg或者其他;1L或小试纯化(得到数据后可根据得率在扩大)
纯度:85%;90%;95%(灰度分析方法或HPLC方法)
浓度:≥0.1mg/ml
基因优化:蛋白序列大小>80kd,(能否提供基因序列,是否需要优化)
从哪里获得:能否接受从包涵体中获得蛋白(含复性)
标签:His tag 为主(N端或C端);GST,MBP,Trx,Flag tag等
是否酶切:是否需要酶切,接受残留氨基酸
内毒素要求:1EU/ug,0.1EU/ug等
最后Storage buffer:有没有具体buffer,常用Tris,PB 加NaCl,甘油。
复性的蛋
白有可能加入L-arginine或detergent
发货要求:液体或冻干粉
能否提供文献参考:protocol等
蛋白用作什么用途:结晶,抗体等。
大肠杆菌表达系统与蛋白表达纯化

8.大肠杆菌表达系统与蛋白表达纯化发布时间:2011年03月07日点击次数::次8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建8.1.1表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括 Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP 等。
其中His-Tag 和GST-Tag 是目前使用最多的。
His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen 提供的pET 系列和 Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
大肠杆菌表达纯化蛋白

大肠杆菌表达纯化蛋白大肠杆菌是一种常见的细菌,被广泛用于表达和纯化蛋白的研究中。
本文将探讨大肠杆菌表达纯化蛋白的方法和应用。
一、大肠杆菌表达纯化蛋白的方法大肠杆菌表达纯化蛋白的方法主要包括以下几个步骤:1. 质粒构建:首先需要构建包含目标蛋白基因的质粒。
这通常包括选择一个适当的表达载体,将目标蛋白基因克隆到质粒中,并添加相应的启动子和信号序列,以实现高效的蛋白表达。
2. 转化大肠杆菌:将质粒导入大肠杆菌中,使其成为宿主细胞。
常用的转化方法包括化学转化、电转化和热激转化等。
3. 诱导表达:通过添加适当的诱导剂,如IPTG(异丙基β-D-硫代半乳糖苷),诱导大肠杆菌开始表达目标蛋白。
4. 细胞培养:大肠杆菌在适当的培养基中进行培养,以提供足够的营养物质和条件来支持蛋白的表达。
5. 细胞破碎:培养达到一定密度后,通过破碎细胞膜的方法将细胞内的目标蛋白释放出来。
常用的方法包括超声波破碎、高压破碎和化学破碎等。
6. 蛋白纯化:通过一系列的层析、过滤和浓缩等步骤,从细胞裂解液中纯化目标蛋白。
常用的纯化方法包括亲和层析、离子交换层析和凝胶过滤层析等。
大肠杆菌表达纯化蛋白的方法被广泛应用于生物医学研究、药物开发和工业生产等领域。
1. 生物医学研究:通过大肠杆菌表达纯化蛋白,可以获得大量高纯度的目标蛋白,用于研究其结构、功能和相互作用等。
这对于研究蛋白质的生物学特性、疾病机制以及药物研发具有重要意义。
2. 药物开发:大肠杆菌表达纯化蛋白广泛应用于药物的筛选和研发。
通过表达和纯化目标蛋白,可以用于药物靶标的筛选、药物的活性评价以及药物的结构优化等。
3. 工业生产:大肠杆菌表达纯化蛋白的方法也被应用于工业生产中。
通过大肠杆菌表达大量的目标蛋白,可以用于生产酶类、抗体和其他重要蛋白制剂。
三、大肠杆菌表达纯化蛋白的优势和挑战大肠杆菌作为常见的宿主细胞,表达纯化蛋白具有以下优势:1. 高表达水平:大肠杆菌能够高效表达目标蛋白,产量较高。
大肠系统表达及纯化操作指南

大肠系统小量表达蛋白的操作指南1,第一天9:00:挑一个单克隆到1.5ml LB(K+)液体培养基中(试管中),37℃,200rpm培养。
2,培养至OD=0.6~0.8,IPTG诱导(3ulIPTG/支试管),37℃,200rpm培养2h。
3,收菌:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,取1管弃上清,沉淀用30~100ul 10mM Tris-HCl(pH8.0)溶液吹散(加入缓冲液的量视菌体量而定),加入与缓冲液等体积的2×溴酚蓝Buffer,100℃煮5min,电泳。
另4支管的沉淀,共用400ul 10mM Tris-HCl(pH8.0)溶液吹散,转至1管中,超声处理,超声5秒,停5秒,超20次,功率200W,13000rpm,离心10min,取50ul上清至另一EP 管,加50ul 2×溴酚蓝Buffer,100℃煮5min,电泳,上清去除干净后沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
1,第一天10:00:接10ul保菌液到1~2ml LB(K+)液体培养基中,37℃,200rpm,活化菌种。
2,17:00:接1~2ul活化的菌液到250ml LB(K+)液体培养基中,37℃,200rpm,过夜培养。
3,第二天9:00:过夜培养的250ml菌液与等体积LB(K+)液体培养基混合,37℃,200rpm,培养至OD=0.6~0.8,IPTG诱导(125ulIPTG/250ml菌液),2h后收菌。
4,小样收菌检测:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,弃上清,取1管,沉淀用50ul 10mM Tris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
(完整版)1-大肠杆菌重组蛋白表达提取及纯化实验

第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200µlAMP(1:1000)、60µl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200µlAMP,摇床培养1小时左右。
2、诱导(超净台)加40µlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300µl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20µl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20µl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
大肠杆菌系统蛋白表达纯化流程

大肠杆菌系统蛋白表达纯化流程英文回答:Introduction:The expression and purification of proteins in Escherichia coli (E. coli) is a commonly used method in molecular biology research. E. coli is a well-studied and easily manipulated organism, making it an ideal host for protein expression. In this article, we will discuss the general workflow for the expression and purification of proteins in E. coli.Expression of the target protein:1. Gene cloning: The first step is to clone the gene encoding the target protein into an expression vector. This vector contains a promoter that drives the expression of the gene in E. coli.2. Transformation: The recombinant expression vector is then introduced into E. coli cells through a process called transformation. This results in the production of many E. coli cells carrying the target gene.3. Expression induction: The transformed E. coli cells are grown in a suitable culture medium until they reach a specific growth phase. At this point, expression of the target gene is induced by adding a chemical inducer or by changing the growth conditions.4. Protein expression: The induced E. coli cells produce the target protein, which can either be present in the soluble fraction or form insoluble aggregates called inclusion bodies.Protein purification:1. Cell lysis: The E. coli cells are harvested by centrifugation and then lysed to release the proteins. Various methods can be used for cell lysis, such as sonication, freeze-thaw cycles, or enzymatic digestion.2. Removal of cell debris: The cell lysate is then clarified by centrifugation to remove cell debris and insoluble material. The resulting supernatant contains the target protein along with other cellular components.3. Protein purification: Different purification techniques can be employed to isolate the target protein from the crude lysate. These techniques include affinity chromatography, ion exchange chromatography, size exclusion chromatography, and hydrophobic interaction chromatography. The choice of purification method depends on the properties of the target protein.4. Protein concentration: After purification, thetarget protein is often in a dilute solution. Concentration can be achieved by using techniques such as ultrafiltration or precipitation with ammonium sulfate.5. Protein characterization: The purified protein should be characterized to confirm its identity and purity. Techniques such as SDS-PAGE, western blotting, and massspectrometry can be used for protein analysis.Conclusion:The expression and purification of proteins in E. coli is a well-established and widely used technique in molecular biology research. The workflow involves gene cloning, protein expression, cell lysis, protein purification, concentration, and characterization. By following this general procedure, researchers can obtain purified proteins for further analysis and functional studies.中文回答:简介:大肠杆菌(E. coli)中的蛋白表达和纯化是分子生物学研究中常用的方法。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1.仪器与材料:-80℃冰箱;超声波细胞破碎仪;50mmpbs或50mmtris-hclph7.5;50ml离心管;冷冻高速离心机2.方法2.1反复冻融2.1.1搜集菌液500ml,等分后10份,4000r/min4℃Vergt15min,弃上清。
2.1.2菌体沉淀中加入相同菌液体积的50mmpbs或50mmtris-hcl(选择使蛋白稳定的缓冲液和ph)重悬洗涤一次。
2.1.3然后按原菌液体积的1/4重新加入缓冲液轻高悬菌体,并重新加入蛋白酶抑制剂pmsf和edta(拎his标签不提),pmsf终浓度为100μg/ml,edta的终浓度为。
挑20μl 轻高悬菌液展开电泳,检测蛋白抒发的情况(与否抒发,就是可溶性抒发还是涵括体抒发)。
2.1.4将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2超声波处置(对超声波及热脆弱的蛋白禁用)2.2.1将反复冻融的菌液(必要时可加入1mg/ml溶菌酶,缓冲液ph>8.0,加入后需静置20min),进行超声破碎,超声条件:400w,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变清澈为止,大约花费时间。
2.2.2挑少量经超音波碎裂后的菌液,10000rpmVergt10分钟,分别对上清和结晶展开检测,用全菌做为阳性对照,检测菌体碎裂程度及目标条带占到总蛋白的含量。
注意事项:(1)超音波碎裂具体条件可以根据实验情况而的定,必须掌控不好功率和每次超音波时间,减少蛋白被水解的可能将。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体碎裂后总蛋白浓度的测量需用bradford法或者紫外稀释法。
(4)可通过sds-page电泳观察菌体破碎程度及目标条带占总蛋白的含量。
(完整版)1-大肠杆菌重组蛋白表达提取及纯化实验

(完整版)1-大肠杆菌重组蛋白表达提取及纯化实验第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200μlAMP(1:1000)、60μl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200μlAMP,摇床培养1小时左右。
2、诱导(超净台)加40μlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300μl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20μl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20μl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
大肠杆菌表达系统与蛋白表达纯化

8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点,是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建根据启动子的不同这些载体大致可以分为热诱导启动子,如入PL, cspA等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc ,tac,T5/lac operator ,T5/lac operator 等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括Poly-Arg,Poly-His, Strep-Tag II,S-tag,MBP等。
其中His-Tag 和GST-Tag 是目前使用最多的。
His Tag大多数是连续的六个His融合于目标蛋白的N端或C端,通过His与金属离子:Ci2+>Fe2+>Zn2+>Ni2+的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen提供的pET系列和Qiagen公司提供的pQE系列。
除了His标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。
此外,与His相比,GST很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his标签表达易形成包涵体的蛋白,可以尝试用GST融合表达来改进。
1-大肠杆菌重组蛋白表达提取及纯化实验

第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200µlAMP(1:1000)、60µl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200µlAMP,摇床培养1小时左右。
2、诱导(超净台)加40µlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300µl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20µl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20µl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
大肠杆菌表达系统教(学)案蛋白表达纯化

8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建8.1.1表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP等。
其中His-Tag 和GST-Tag 是目前使用最多的。
His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1. 仪器与材料:-80℃冰箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5;50ml 离心管;冷冻高速离心机2. 方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4℃离心15min,弃上清。
2.1.2 菌体沉淀中加入相同菌液体积的50mM PBS 或50mM Tris-HCl(选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3 然后按原菌液体积的1/4加入缓冲液重悬菌体,并加入蛋白酶抑制剂PMSF 和EDTA(带His标签不加),PMSF终浓度为100μg/ml, EDTA的终浓度为。
取20μl重悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4 将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2 超声波处理(对超声波及热敏感的蛋白慎用)2.2.1 将反复冻融的菌液(必要时可加入1mg/ml 溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变清澈为止,大约花费时间。
2.2.2 取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上清和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford 法或者紫外吸收法。
大肠杆菌表达系统及蛋白表达纯化

8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建8.1.1表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括 Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP等。
其中His-Tag 和GST-Tag 是目前使用最多的。
His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1.仪器与材料:-80。
觥箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5; 50ml离心管;冷冻高速离心机2.方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4仙心15min,弃上活。
2.1.2菌体沉淀中加入相同菌液体积的50mM PBS或50mM Tris-HCl (选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3然后按原菌液体积的1/4加入缓冲液重悬:菌体,并加入蛋白酶抑制剂PMSF 和EDTA(带His标签不加),PMSF终浓度为100 g/ml, EDTA的终浓度为。
取20 匝悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2超声波处理(对超声波及热敏感的蛋白慎用)2.2.1将反复冻融的菌液(必要时可加入1mg/ml溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变活澈为止,大约花费时间。
2.2.2取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上活和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford法或者紫外吸收法。
(4)可通过SDS-PAGE电泳观察菌体破碎程度及目标条带占总蛋白的含量。
1-大肠杆菌重组蛋白表达提取及纯化实验(最新整理)

1-大肠杆菌重组蛋白表达提取及纯化实验(最新整理)第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200μlAMP(1:1000)、60μl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200μlAMP,摇床培养1小时左右。
2、诱导(超净台)加40μlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300μl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20μl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20μl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1.仪器与材料:-80。
觥箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5; 50ml离心管;冷冻高速离心机2.方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4仙心15min,弃上活。
2.1.2菌体沉淀中加入相同菌液体积的50mM PBS或50mM Tris-HCl (选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3然后按原菌液体积的1/4加入缓冲液重悬:菌体,并加入蛋白酶抑制剂PMSF 和EDTA(带His标签不加),PMSF终浓度为100 g/ml, EDTA的终浓度为。
取20 匝悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2超声波处理(对超声波及热敏感的蛋白慎用)2.2.1将反复冻融的菌液(必要时可加入1mg/ml溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变活澈为止,大约花费时间。
2.2.2取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上活和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford法或者紫外吸收法。
(4)可通过SDS-PAGE电泳观察菌体破碎程度及目标条带占总蛋白的含量。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1. 仪器与材料:-80℃冰箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5;50ml 离心管;冷冻高速离心机2. 方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4℃离心15min,弃上清。
2.1.2 菌体沉淀中加入相同菌液体积的50mM PBS 或50mM Tris-HCl(选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3 然后按原菌液体积的1/4加入缓冲液重悬菌体,并加入蛋白酶抑制剂PMSF 和EDTA(带His标签不加),PMSF终浓度为100μg/ml, EDTA的终浓度为。
取20μl重悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4 将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2 超声波处理(对超声波及热敏感的蛋白慎用)2.2.1 将反复冻融的菌液(必要时可加入1mg/ml 溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变清澈为止,大约花费时间。
2.2.2 取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上清和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford 法或者紫外吸收法。
(4)可通过SDS-PAGE 电泳观察菌体破碎程度及目标条带占总蛋白的含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大肠系统小量表达蛋白的操作指南1,第一天9:00:挑一个单克隆到1.5ml LB(K+)液体培养基中(试管中),37℃,200rpm培养。
2,培养至OD=0.6~0.8,IPTG诱导(3ulIPTG/支试管),37℃,200rpm培养2h。
3,收菌:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,取1管弃上清,沉淀用30~100ul 10mM Tris-HCl(pH8.0)溶液吹散(加入缓冲液的量视菌体量而定),加入与缓冲液等体积的2×溴酚蓝Buffer,100℃煮5min,电泳。
另4支管的沉淀,共用400ul 10mM Tris-HCl(pH8.0)溶液吹散,转至1管中,超声处理,超声5秒,停5秒,超20次,功率200W,13000rpm,离心10min,取50ul上清至另一EP 管,加50ul 2×溴酚蓝Buffer,100℃煮5min,电泳,上清去除干净后沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
1,第一天10:00:接10ul保菌液到1~2ml LB(K+)液体培养基中,37℃,200rpm,活化菌种。
2,17:00:接1~2ul活化的菌液到250ml LB(K+)液体培养基中,37℃,200rpm,过夜培养。
3,第二天9:00:过夜培养的250ml菌液与等体积LB(K+)液体培养基混合,37℃,200rpm,培养至OD=0.6~0.8,IPTG诱导(125ulIPTG/250ml菌液),2h后收菌。
4,小样收菌检测:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,弃上清,取1管,沉淀用50ul 10mM Tris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
另4支管的沉淀,共用400ul 10mMTris-HCl (pH8.0)溶液吹散,转至1管中,超声处理,超声5秒,停5秒,超20次,功率200W,13000rpm,离心10min,取50ul上清至另一EP管,加50ul 2×溴酚蓝Buffer,100℃煮5min,电泳,上清去除干净后沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
5,大量收菌:50ml圆底离心筒,12000rpm,离心2min。
弃上清,沉淀用20~30ml 10mM Tris-HCl(pH8.0)溶液吹散,超声,超声20秒,停20秒,超50次,功率400W,13000rpm,离心10min,根据小样超声的电泳结果决定留上清还是留沉淀(包涵体)。
1,第一天17:00:取保菌的菌液平板划线,37℃,过夜培养,活化菌种。
2,第二天9:00:划线的平板4℃保存。
15:00:挑一个单克隆接到5ml LB(K+)液体培养基中,37℃,200rpm,过夜培养。
3,第三天9:00:过夜培养的5ml菌液转接到250ml的LB(K+)液体培养基中,37℃,200rpm,培养至OD=0.6~0.8,IPTG诱导(125ulIPTG/250ml菌液),2h后收菌。
4,小样收菌检测:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,弃上清,取1管,沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
另4支管的沉淀,共用400ul 10mMTris-HCl(pH8.0)溶液吹散,转至1管中,超声处理,超声5秒,停5秒,超20次,功率200W,13000rpm,离心10min,取50ul上清至另一EP管,加50ul 2×溴酚蓝Buffer,100℃煮5min,电泳,上清去除干净后沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
5,大量收菌:50ml圆底离心筒,12000rpm,离心2min。
弃上清,沉淀用20~30ml 10mMTris-HCl(pH8.0)溶液吹散,超声,超声20秒,停20秒,超50次,功率400W,13000rpm,离心10min,根据小样超声的电泳结果决定留上清还是留沉淀(包涵体)。
1,第一天10:00:接10ul保菌液到1~2ml LB(K+)液体培养基中,37℃,200rpm,活化菌种。
2,第一天17:00:接1~2ul活化的菌液到5ml LB(K+)液体培养基中,37℃,200rpm,过夜培养。
3,第二天9:00:过夜培养的5ml菌液转接到250ml的LB(K+)液体培养基中,37℃,200rpm,培养至OD=0.6~0.8,IPTG诱导(125ulIPTG/250ml菌液),2h后收菌。
4,小样收菌:取5只1.5ml的EP管,每管加入1ml菌液,13000rpm,离心1min,弃上清,取1管,沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
另4支管的沉淀,共用400ul 10mMTris-HCl(pH8.0)溶液吹散,转至1管中,超声处理,超声5秒,停5秒,超20次,功率200W,13000rpm,离心10min,取50ul上清至另一EP管,加50ul 2×溴酚蓝Buffer,100℃煮5min,电泳,上清去除干净后沉淀用50ul 10mMTris-HCl(pH8.0)溶液吹散,加入50ul 2×溴酚蓝Buffer,100℃煮5min,电泳。
5,大量收菌:50ml圆底离心筒,12000rpm,离心2min。
弃上清,沉淀用20~30ml 10mMTris-HCl(pH8.0)溶液吹散,超声,超声20秒,停20秒,超50次,功率400W,13000rpm,离心10min,根据小样超声的电泳结果决定留上清还是留沉淀(包涵体)。
大肠系统表达的包涵体蛋白小量预洗的操作指南1,20~30ml 10mMTris-HCl(pH8.0)溶液重悬超声离心得到的沉淀(500ml菌液所得),2,取1ml于EP管中,13000rpm,离心2min。
弃上清。
3,1.2ml Buffer B重悬沉淀,摇动或静置3h。
4,13000rpm,离心2min,弃上清(上清留50ul做电泳对比)。
5,1.2ml 10mMTris-HCl(pH8.0)溶液重悬沉淀,13000rpm,离心2min,弃上清。
6,重复5一次。
7,1.2ml 含2M尿素的10mMTris-HCl(pH8.0)溶液重悬沉淀,室温静置15min。
13000rpm,离心2min,弃上清(上清留50ul做电泳对比)。
8,1.2ml 10mMTris-HCl(pH8.0)溶液重悬沉淀9, 重复8一次。
10,1.2ml含8M尿素的10mMTris-HCl(pH8.0)溶液重悬沉淀,取50ul小样电泳。
大肠系统表达蛋白的大量洗涤的操作指南一、包涵体的纯化1,20~30ml 10mM Tris-HCl(pH8.0)溶液重悬超声离心得到的沉淀(500ml菌液所得),12000rpm,离心10min。
弃上清。
2,20~30ml Buffer B重悬沉淀,摇动或静置3h。
3,12000rpm,离心10min,上清转入另一管中保存(上清留50ul做电泳对比)。
4,20~30ml 10mM Tris-HCl(pH8.0)溶液重悬沉淀,12000rpm,离心10min,弃上清。
5,重复4一次。
6,20~30ml 含2M尿素的10mM Tris-HCl(pH8.0)溶液重悬沉淀,室温静置30min。
12000rpm,离心10min,上清转入另一离心管中(上清留50ul做电泳对比)。
7,20~30ml 10mM Tris-HCl(pH8.0)溶液重悬沉淀。
8,重复7一次。
9,先加入1~2ml的10mM Tris-HCl(pH8.0)溶液重悬沉淀,再加5~10ml含8M尿素的10mM Tris-HCl(pH8.0)溶液重新溶解沉淀(先加5~10ml,如溶解不好,可增加溶液体积至15~20ml),取50ul小样电泳。
10,上清和沉淀冷冻之前均需要加适量的甘油。
Buffer B含有:5% Triton50mM Tris-HCl(pH8.0)50mM氯化钠5mM EDTA镍柱亲和层析1,填柱,注意不能有气泡。
2,用纯水洗柱,至pH7.0.(流速7)3,挂镍,至pH2~3. (流速7)4,纯水洗柱至pH7.0(流速7)5,10mMTris-HCl(pH8.0)溶液平衡镍柱,约80ml(流速7)。
6,含0.5M氯化钠的10mMTris-HCl(pH8.0)溶液平衡镍柱,约80~100ml。
(流速7)7,标定紫外检测器,A调0,T调95.8,上样。
样品需要事先加入氯化钠,终浓度为0.5M。
注意流速要慢(3~4)。
9,上样结束后,用含0.5M氯化钠的10mMTris-HCl(pH8.0)溶液洗柱,至OD很低且稳定。
(流速7)10,15mM咪唑0.5M氯化钠的10mMTris-HCl(pH8.0)溶液,40ml(0.5MNaCl 的10mMTris-HCl(pH8.0)溶液中加1.5M咪唑0.4ml),洗脱,收集蛋白峰。
(流速7)11,60mM咪唑0.5M氯化钠的10mMTris-HCl(pH8.0)溶液,40ml(0.5MNaCl的10mMTris-HCl(pH8.0)溶液中加1.5M咪唑1.6ml),洗脱,收集蛋白峰。
(流速7)12,300mM咪唑0.5M氯化钠的10mMTris-HCl(pH8.0)溶液,40ml(0.5MNaCl 的10mMTris-HCl(pH8.0)溶液中加1.5M咪唑8ml),洗脱,收集蛋白峰。
(流速7)13,拆柱,处理填料。
Ni Sepharose 6 Fast Flow非变性条件纯化蛋白Protocol 一,Ni Sepharose 6 Fast Flow 介质的预处理1,轻柔震荡,使介质均匀重悬。
2,取1.5ml混悬液(介质净体积1ml,)/柱,转入15ml离心管中,2500rpm,离心5min,弃上清。
3,加入5ml双蒸水/柱,轻柔震荡3min,2500rpm,离心5min,弃上清。
4,加入5ml Buffer B/柱,轻柔震荡3min,2500rpm,离心5min,弃上清。
5,重复4一次。
6,加入1ml/柱的Buffer B,制成2ml/柱的50%的混悬液,装柱。
