高考化学富集在海水中的元素——卤素(精练)一轮复习(解析版)
高中化学第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测(解析版)

第四章非金属及其化合物第12讲富集在海水中的元素——卤素(精讲)【考情分析】本讲内容与化工生产、日常生活、科学技术等方面有着广泛的联系,如氯碱工业、漂白粉应用、饮用水消毒、环境保护等,往往与氧化还原反应、离子反应、化学实验方案的设计与评价等知识结合出现。
预计今后:1.以氯单质及其重要化合物的性质、用途设计选择题;2.以制取氯气设计有关实验题;3.根据同主族元素性质的相似性设计信息题,考查溴、碘及其重要性质和用途。
【核心素养分析】1.宏观辨识与微观探析:能从宏观和微观相结合的视角分析与解决实际问题,在卤素学习过程中,使用“宏观—微观—结合”来认识物质及其递变规律,形成科学的方法论。
2.科学探究与创新意识:能和同学交流实验探究的成果,提出进一步探究或改进氯及其化合物的制备及性质实验的设想,培养勇于质疑和批判的创新精神。
认识科学探究是进行科学发现、创造和应用的科学实践活动;能从问题和假设出发,依据探究目的,设计探究方案,获得卤素单质的提取方法。
3.科学态度与社会责任:认识氯及其化合物对环境的影响,形成绿色环保的意识。
关注与化学有关的社会热点问题。
了解环境保护与资源开发的关系.具有绿色化学观念。
勇于承担责任,权衡利弊,积极参与化学问题的社会决策。
【网络构建】【知识梳理】智能点一氯气及其重要化合物(一)氯气1.物理性质【特别提醒】实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
2.化学性质1)从氯的原子结构认识氯气的氧化性:依据氯气的氧化性完成下列方程式: (1)与金属反应①Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟。
②Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟。
(2)与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰; H 2和Cl 2的混合气体光照时会发生爆炸。
(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
高考化学一轮复习专题4.2富集在海水中的元素—氯(知识讲解)(含解析)

第二讲富集在海水中的元素——卤素【真题速递】1.(2019.北京)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )【答案】B【解析】A.FeCl3与Fe反应生成FeCl2,2FeCl3+Fe=2FeCl2,此过程中Fe的化合价发生变化,涉及到了氧化还原法应,故A不符合题意;B.MgCl2与NaOH溶液发生复分解反应MgCl2+2NaOH=Mg(OH)2 +2NaCl,过量的NaOH溶液可用HCl除去HCl+NaOH=NaCl+H2O ,此过程中没有元素化合价发生变化,未涉及氧化还原反应,故B符合题意;C.部分氯气与H2O 发生反应生成氯化氢和次氯酸,反应过程中氯元素化合价变化,涉及到了氧化还原法应,故C不符合题意;D.NO2与水反应生成硝酸和NO。
反应过程中氮元素化合价发生变化,涉及到了氧化还原法应,故D不符合题意。
2.(2019.江苏)下列有关化学反应的叙述正确的是A. Fe在稀硝酸中发生钝化B. MnO2和稀盐酸反应制取Cl2C. SO2与过量氨水反应生成(NH4)2SO3D. 室温下Na与空气中O2反应制取Na2O2【答案】C【解析】A.常温下,Fe在与浓硝酸发生钝化反应,故A错误;B.二氧化锰与浓盐酸在加热条件下反应制取氯气,故B错误;C.二氧化硫与过量氨水反应生成硫酸铵,故C正确;D.常温下,Na与空气中的氧气反应生成Na2O;加热条件下,钠与氧气反应生成Na2O2,故D错误。
3.(高考选项组合)下列说法不正确的是( )A.漂白粉可用于生活用水的消毒(2018·全国卷Ⅱ,7B)B.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色,不涉及氧化还原反应(2018·北京,9B)C.氯水具有较强的氧化性,可用于漂白纸张、织物等(2018·海南,5D)D.清洗碘升华实验所用试管,先用酒精清洗,再用水清洗(2017·全国卷Ⅲ,9B)【答案】B【解析】B项,红色褪去是HClO表现强氧化性;D项,碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗即可洗净,正确。
2024年高考化学一轮复习一遍过专题13富集在海水中的元素_氯含解析1

专题13 富集在海水中的元素-氯1.化学与生活亲密相关,下列说法正确的是A.六水氯化钙能用作食品干燥剂B.漂白粉可用于生活用水的消毒C.疫苗一般应冷藏存放,以避开蛋白质盐析D.水垢中含有,可先用溶液处理,而后用酸除【答案】B【解析】A、六水氯化钙没有吸水性,不能做干燥剂,选项A错误;B、漂白粉的有效成分是次氯酸钙[化学式为Ca(ClO)2]可用于水的杀菌消毒,选项B正确;C、疫苗是将病原微生物(如细菌、立克次氏体、病毒等)及其代谢产物,经过人工减毒、灭活或利用转基因等方法制成的用于预防传染病的自动免疫制剂,疫苗受热作用可使蛋白质变性,不仅失去应有的免疫原性,甚至会形成有害物质而产生不良反应,因此疫苗必需冷藏运输和保存,选项C错误;D、锅炉水垢是一种平安隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为溶于酸的CaCO3,而后用酸除去CaCO3,水垢中的CaCO3干脆用酸除,选项D错误。
2.化学在生活中有着广泛的应用,下列对应关系正确的是()化学性质实际应用A 次氯酸具有氧化性漂白粉漂白织物B 铁比铜金属性强FeCl3腐蚀Cu刻制印刷电路板C 硅透光性好,且折射率合适,能够发生全反射硅可作光导纤维D 明矾溶于水可生成Al(OH)3胶体可用于自来水消毒【答案】A【解析】A.次氯酸具有氧化性,可以将有色物质氧化为无色物质,因此可作漂白粉漂白织物,A正确;B. FeCl3腐蚀Cu刻制印刷电路板,是由于发生反应:2FeCl3+Cu=2FeCl2+CuCl2,与Fe、Cu的金属活动性强弱无关,B 错误;C.二氧化硅透光性好,且折射率合适,能够发生全反射,因此二氧化硅可作光导纤维,C错误;D.明矾溶于水可生成Al(OH)3胶体,胶体表面积大,吸附力强,可将水中悬浮的固体吸附,形成沉淀除去,从而有净水作用,不是用于自来水消毒,D错误。
3.ClO2和NaClO2均具有漂白性,工业上用ClO2气体制备NaClO2的工艺流程如下图所示:下列说法不正确的是A.工业上可将ClO2制成NaClO2固体,便于贮存和运输B.通入空气的目的是驱逐出ClO2,使其被汲取器充分汲取C.汲取器中生成 NaClO2的离子方程式:2ClO2+H2O2=2ClO2-+O2↑+2H+D.步骤a的操作包括过滤、洗涤和干燥【答案】C【解析】A.ClO2为气体,不易储存和运输,常将其制备成NaClO2固体以便运输和贮存,A不符合题意;B. 反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分汲取,B不符合题意;C. 反应的环境是碱性环境,离子方程式应当为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O,C符合题意;D. NaClO2溶液中获得NaClO2固体须要真空蒸发浓缩,冷却结晶,过滤,洗涤和干燥,D不符合题意。
(全国版)2021高考化学一轮复习课时作业14富集在海水中的元素——卤素(含解析)

课时作业(十四) 富集在海水中的元素——卤素1.(2019·辽宁凌源抽考)下列实验事实可用同一原理解释的是( )A .漂白液和双氧水都能漂白物质B .氯水和二氧化硫都能使紫色石蕊试液变色C .将苯和裂化汽油分别滴入溴水中,水层褪色D .加热盛有I 2和NH 4Cl 的试管,管口有固体凝结A [漂白液的有效成分是NaClO ,NaClO 、双氧水均具有强氧化性,能把有色物质氧化,A 正确;氯水和二氧化硫都能使紫色石蕊试液变色,但原理不同,氯水中有次氯酸,其具有强氧化性,可以把石蕊氧化为无色物质,而二氧化硫溶于水后使溶液呈酸性,石蕊遇酸变红,B 不正确;将苯和裂化汽油分别滴入溴水中,水层褪色,两者的褪色原理不同,前者把溴水中的溴萃取出来而使水层褪色,后者与溴发生了加成反应生成了无色物质,C 不正确;分别加热盛有I 2和NH 4Cl 的试管,管口有固体凝结,两者原理不同,前者是碘升华后遇冷凝华,后者是NH 4Cl 受热分解生成氯化氢和氨,氯化氢和氨在管口又重新化合为氯化铵,D 不正确。
]2.(2019·山东潍坊模拟)下列关于氯水的说法正确的是( )A .新制氯水中只含Cl 2和H 2O 分子B .光照氯水有气泡冒出,该气体是氯气C .新制氯水可使蓝色石蕊试纸先变红后褪色D .氯水放置数天后pH 将变大C [氯气溶于水,只有少量水发生Cl 2+H 2O =HCl +HClO ,新制氯水中存在Cl 2、H 2O 、HClO 、H +、Cl -、ClO -,存在三种分子,A 错误;新制氯水中存在HClO ,HClO 见光受热易分解,发生2HClO=====光照 2HCl +O 2↑,产生气体是氧气,B 错误;新制氯水中含有HCl 和HClO ,盐酸显酸性,使蓝色石蕊试纸变红,HClO 具有强氧化性,能把有色物质漂白,因此新制氯水可使蓝色石蕊试纸先变红后褪色,C 正确;根据B 选项分析,久置的氯水是稀盐酸,pH 将减小,D 错误。
高考化学一轮复习 4.2富集在海水中的元素 卤素

1.发现氯气泄漏应如何自救?(至少答2种方法) ①Cl2密度比空气大,因此要逆着风向朝高处转移。 ②由于Cl2易和碱性溶液反应,可用蘸有肥皂水或纯碱溶液 的毛巾捂住鼻子。 ③向空中喷洒石灰水用于处理Cl2。 2.向新制氯水中加入碳酸钙粉末,能增加氯水中HClO的浓度 吗?为什么?
3.能否用pH试纸测量氯水的pH?为什么? 不能;原因是氯水中含有HClO,能将pH试纸氧化而褪色
富集在海水中的元素——卤素
栏目索引
1 考点 ● 梯级落实
地球与地图请
2 微课 ● 通法悟道
点
击
3 真题 ● 重组集训
相 关
栏
4 课时 ● 规范训练
目
考点一 氯气
1.氯气
【知识的气体。
②水溶性:能溶于水。 ③毒性:有毒。
(2)
质
化 学 性
【问题与探究】
A.氯气 B.次氯酸 C.次氯酸根 D.氯化氢
D
考点三 卤素的性质及X-的检验 【知识梳理】
× ×
× × ×
①②④
3.(1)请分类列举哪些物质能使溴水褪色?
①被H2S、SO2、SO32-、I-等还原剂还原而褪色。 ②与NaOH等强碱溶液发生自身氧化还原反应而褪色: Br2+2NaOH==NaBrO+NaBr+H2O。 ③与较活泼金属(如Mg+Br2==MgBr2)反应而褪色。 ④能与溴发生加成反应的不饱和烃及其衍生物,如烯烃、炔 烃等。 ⑤能被溴水氧化的、含有醛基的化合物。 ⑥能与溴水发生反应的碱性物质,如Na2CO3等。 ⑦加入活性炭等吸附剂,使溴水褪色。
高三化学一轮复习强化训练富集在海水中的元素——氯溴和碘(含解析)

富集在海水中的元素——氯、溴和碘1.有关氯气和氯水性质的叙述正确的是( )2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO-增多,酸性增强D.不能用pH试纸测定氯水的pH,是因为其中含有的Cl2有漂白性1.答案 B2.特大洪水过后,受灾地区的水源常常被严重污染。
下列物质中,可用于对污染的饮用水消毒杀菌的是( )C.Al(OH)322.答案 D ClO2具有强氧化性,可以用于饮用水的杀菌消毒,D正确。
3.检验氯化氢气体中是否混有氯气,不可采取的是( )3.答案 C HCl+AgNO3AgCl↓+AgNO3,Cl2+H2O HCl+HClO,混有Cl2也能与AgNO3溶液反应生成白色沉淀,C符合题意。
4.氯气及其化合物在生产和生活中有重要应用,下列关于氯气及其化合物的说法中正确的是( )A.NaClO是“84”消毒液的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性2与烧碱溶液反应的实质是Cl2+OH - Cl-+ClO-+H2OC.氯气有毒,在通风橱中制备氯气可以消除氯气的污染2通入淀粉-KI溶液,溶液变蓝色4.答案 D NaClO是“84”消毒液的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现氧化性,A错误;Cl2与烧碱溶液反应的实质是Cl2+2OH- Cl-+ClO-+H2O,B错误;氯气有毒,在通风橱中制备氯气可以防止中毒,但不能消除氯气的污染,C 错误;氯气具有强氧化性,与碘化钾反应生成碘,因此将Cl 2通入淀粉-KI 溶液,溶液变蓝色,D 正确。
5. ClO 2是一种消毒杀菌剂,实验室可通过下列反应制得ClO 2:2KClO 3+H 2C 2O 4+H 2SO 42ClO 2↑+K 2SO 4+2CO 2↑+2H 2O,下列说法中正确的是( )3在反应中得到电子2是氧化产物2C 2O 4被还原 D.1 mol KClO 3发生反应,转移的电子数为2N A5.答案 A 题给反应中,KClO 3中氯元素由+5价变为+4价,得电子被还原,对应还原产物;H 2C 2O 4中碳元素由+3价变为+4价,失电子被氧化,对应氧化产物;1 mol KClO 3发生反应,转移的电子数为N A 。
第11讲富集在海水中的元素—卤素-2023年高考化学一轮复习”四点“卓越讲义

第11讲富集在海水中的元素—卤素(精准检测卷)时间:50分钟一、选择题(12个小题,每小题只有一个正确选项,每题5分,共60分)1.明朝宋应星《天工开物》中记载:“同一海卤传神,而取法则异。
……一法潮波浅被地,……候潮一过,明日天晴,半日晒出盐霜,疾趋扫起煎炼。
”下列有关叙述错误的是A.海卤焰色试验时火焰为黄色判断“盐霜”中不含钾元素B.古代可利用盐霜延长食物的保存时间C.“半日晒出盐霜”是蒸发结晶的过程D.“海卤”的主要成分为NaCl【答案】A【解析】A.海卤焰色试验时未通过蓝色钴玻璃观察,则不能判断“盐霜”中是否含钾元素,故A错误;B.用氯化钠腌制的食物可以延长保存时间,故B正确;C.“半日晒出盐霜”是指利用太阳的热量将海水晒干得到氯化钠固体,为蒸发结晶的过程,故C正确;D.海卤的主要成分为NaCl,故D正确;故选A。
2.下列有关实验室制取Cl2的装置正确的是A.制备Cl2B.净化Cl2C.收集Cl2D.尾气处理【答案】D【解析】A.浓盐酸和二氧化锰制取氯气要加热,该装置没有加热,故A项错误;B.净化氯气应先用饱和食盐水除去氯化氢,再用浓硫酸除去水,该装置顺序颠倒,故B项错误;C.该装置只有通气管,没有排气管,会导致瓶内压强过大,发生安全事故,故C项错误;D .氯气有毒,能与碱酚酞,多余的氯气应用氢氧化钠除去,故D 项正确。
故答案选D 。
3.如图:某同学用高锰酸钾和浓盐酸制备氯气,验证氯气性质实验装置。
相关说法错误的是A .脱脂棉中的无水氯化钙可以用碱石灰代替B .该实验装置可证明干燥的氯气没有漂白作用C .湿润石蕊试纸先变红,但也不能说明生成了酸性物质D .淀粉碘化钾试纸先变蓝后褪色,说明氯气将I 2氧化【答案】A【解析】A .无水氯化钙主要是干燥氯气,碱石灰会与氯气反应,因此脱脂棉中的无水氯化钙不能用碱石灰代替,故A 错误;B .从左边出来的干燥氯气,先与干燥品红接触,品红不褪色,说明干燥的氯气没有漂白作用,故B 正确;C .由于HCl 易挥发,因此挥发的HC l 使湿润石蕊试纸先变红,因此不能说明生成了酸性物质,故C 正确;D .淀粉碘化钾试纸先变蓝后褪色,先变蓝,是碘离子被氯气氧化为单质碘,单质碘遇淀粉变蓝,后褪色,说明氯气将I 2氧化,故D 正确。
2023年老高考化学一轮复习练习13 富集在海水中的元素——卤素

课时规范练13富集在海水中的元素——卤素一、选择题:本题包括12小题,每小题只有1个选项符合题意。
1.(2021江西九江期末)下列说法不正确的是()A.液氯可以储存在钢瓶中B.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色C.电解饱和食盐水可制取氯气D.碘酒可用于皮肤外用消毒2.化学来源于生活,也服务于生活。
下列有关生活中的化学知识叙述正确的是()A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH,测定结果无影响D.“洁厕灵”不能与“‘84’消毒液”混用,原因是两种溶液混合产生的HClO易分解3.下列有关卤素的说法错误的是()A.从HF、HCl、HBr、HI酸性递增的事实可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度4.(2021宁夏青铜峡高级中学检测)用下列装置制备并检验Cl2的性质:下列说法正确的是()A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完B.Ⅱ图中:生成蓝色的烟C.Ⅲ图中:试管中发生了加成反应D.Ⅳ图中:湿润的有色布条能褪色,将浓硫酸滴入烧杯中,至溶液显酸性,结果有Cl2生成5.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO6.(2021四川成都蓉城名校联盟联考)某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。
富集在海水中的元素—卤素2022年高考化学一轮复习考点全通关(解析版)

考点18 富集在海水中的元素—卤素一、 氯及其化合物的性质和应用1.Cl 2的性质及其应用(写出有关化学方程式)Cl 2在通常情况下,是一种黄绿色具有刺激性气味的有毒气体,可溶于水,通常状况下,1体积水能溶解2体积Cl 2,密度比空气的大。
(1)与金属反应与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应与H 2反应:H 2+Cl 2=====点燃或光照2HCl ,(3)与水反应溶于水中的部分氯气与水反应离子方程式为Cl 2+H 2O H ++Cl -+HClO 。
氯水中含有的粒子有H 2O 、Cl 2、HClO 、H +、Cl -、ClO -、OH -。
(4)与碱反应①制漂白液(NaClO)的离子方程式Cl 2+2OH -===Cl -+ClO -+H 2O 。
②制漂白粉的化学方程式2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 。
(5)与还原性无机化合物反应①与碘化钾溶液反应的化学方程式:2KI +Cl 2===I 2+2KCl 。
②与SO 2水溶液反应的化学方程式:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应的离子方程式:2Fe 2++Cl 2===2Fe 3++2Cl -。
2.次氯酸的性质(1)不稳定性:2HClO=====光照2HCl +O 2↑。
氯水须现用现配,保存在棕色试剂瓶中,置于冷暗处。
(2)强氧化性①能将有色物质氧化为无色物质,有漂白性。
②杀菌、消毒。
(3)弱酸性NaClO 溶液中通入少量CO 2,化学方程式为2NaClO +CO 2+H 2O===2HClO +Na 2CO 3。
3.漂白粉的性质(1)主要成分为Ca(ClO)2和CaCl 2,有效成分为Ca(ClO)2。
(2)化学性质①水溶液呈碱性,水解的离子方程式为ClO -+H 2O HClO +OH -②与酸性物质作用生成强氧化性的次氯酸,作消毒剂和漂白剂。
专题4.3富集在海水中的元素(二)-卤素(教学案)-2017年高考化学一轮复习精品资料(解析版)
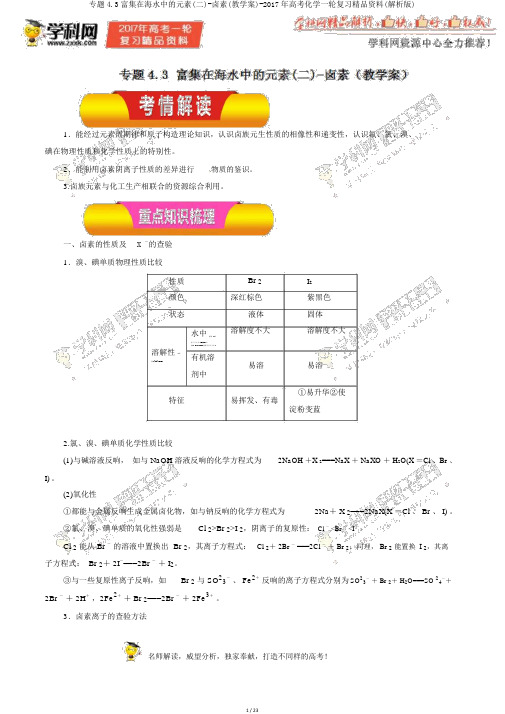
1.能经过元素周期律和原子构造理论知识,认识卤族元生性质的相像性和递变性,认识氟、氯、溴、碘在物理性质和化学性质上的特别性。
2.能利用卤素阴离子性质的差异进行物质的鉴识。
3.卤族元素与化工生产相联合的资源综合利用。
一、卤素的性质及X -的查验1.溴、碘单质物理性质比较性质Br 2 I2颜色深红棕色紫黑色状态液体固体溶解度不大溶解度不大水中[根源 ][来源学科网 Z|X|X|K][ 来源:Z_xx_][ 根源学§科§网 ]溶解性[ 来有机溶源:Z+xx+] 易溶易溶剂中①易升华②使特征易挥发、有毒淀粉变蓝2.氯、溴、碘单质化学性质比较(1)与碱溶液反响,如与 NaOH 溶液反响的化学方程式为2NaOH +X 2===NaX + NaXO + H2O(X =Cl 、Br 、I)。
(2)氧化性①都能与金属反响生成金属卤化物,如与钠反响的化学方程式为2Na+ X 2===2NaX(X =Cl 、 Br 、 I) 。
②氯、溴、碘单质的氧化性强弱是Cl 2>Br 2>I 2,阴离子的复原性:Cl - <Br - <I -。
Cl 2能从 Br -的溶液中置换出Br 2,其离子方程式:Cl 2+ 2Br - ===2Cl -+ Br 2;同理, Br 2能置换 I 2,其离子方程式: Br 2+ 2I-===2Br -+ I2。
③与一些复原性离子反响,如Br 2与 SO23-、 Fe2+反响的离子方程式分别为SO23-+ Br 2+ H2O===SO 24-+2Br -+ 2H+,2Fe2++ Br 2===2Br -+ 2Fe3+。
3.卤素离子的查验方法(1)AgNO 3溶液——积淀法滴加 AgNO 白色积淀,则有 Cl -未知液溶液Br -――→3 生成淡黄色积淀,则有和稀硝酸黄色积淀,则有 I-(2)置换——萃取法加适当新制饱和氯水加入 CCl 4 基层或汽油上层未知液――――――――――→――――――――――→振荡振荡红棕色或橙红色,表示有Br -有机层呈I-紫色、浅紫色或紫红色,表示有-(3)氧化——淀粉法查验 I加入适当新制饱和氯水双氧水淀粉溶液I -未知液――――――――――――――――→――→ 蓝色溶液,表示有振荡振荡二、含卤物质的生产流程1.氯的提取——氯碱工业精制电解阳极产物: Cl 2海水―→ 粗盐――→ 饱和食盐水――→阴极产物: H 2、 NaOH电解化学方程式为2NaCl +2H 2O===== 2NaOH +H 2↑+Cl 2↑。
高三化学一轮复习题库 富集在海水中的元素卤素

证对市爱幕阳光实验学校第二讲富集在海水中的元素—卤素一、选择题1.一条件下磷与枯燥氯气反,假设0.25 g磷消耗掉314 mL氯气(状况),那么产物中PCl3与PCl5的物质的量之比接近于( )A.3∶1 B.5∶3 C.2∶3 D.1∶2解析假设生成的PCl3的物质的量为n1,PCl5的物质的量为n2,那么由P 原子守恒和Cl原子守恒可得n1+n2=n(P)、3n1+5n2=n(Cl),可得n1≈0.006 mol、n2≈0.002 mol,故两者的物质的量之比接近3∶1。
答案A2.以下关于卤素的表达中,正确的选项是( )①卤素的钾盐中,最容易被氧化的是氟化钾②溴中溶有少量氯气,可以参加溴化钠溶液再用汽油萃取的方法提纯③溴化银具有感光性,碘化银不具有感光性④某溶液与淀粉碘化钾溶液反出现蓝色,那么证明该溶液是氯水或溴水⑤氯气跟水反时,水既不是氧化剂也不是复原剂A.①③ B.②④⑤ C.②⑤ D.①③④解析①在卤素的钾盐中,氟化钾最难氧化;③AgI也具有感光性;④能氧化I-→I2的还有其他溶液,碘水本身也能与淀粉反出现蓝色。
答案C3.某同学在一张pH试纸上滴几滴制的氯水,现象如下图,以下有关该的说法中正确的选项是( )A.该说明Cl2分子具有漂白性B.该说明H+的扩散速度比HClO分子快C.将后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D.假设用久置的氯水进行上述,现象完全相同解析HClO具有漂白性,Cl2无漂白性。
久置的氯水主要成分为稀盐酸无漂白性,HClO的漂白持久、稳。
答案B4.以下关于氯的说法正确的选项是( )。
A.Cl2具有很强的氧化性,在化学反中只能作氧化剂B.3517Cl、3717Cl为不同的核素,有不同的化学性质C.室制备Cl2,可用排饱和食盐水集气法收集D.1.12 L Cl2含有N A个质子(N A表示阿伏加德罗常数)解析Cl2中的氯元素化合价为0价,处于中间价态,既有氧化性又有复原性,A错误;同位素原子的质子数和电子数分别相,所以化学性质几乎完全相同,B错误;通过实验室制得的Cl2中含有少量HCl,Cl2在饱和食盐水中溶解度很小,而HCl 易溶,C正确;没有指明气体所处的状态,D错误。
高考化学一轮复习 考点精练精析《富集在海水中的元素 氯》1

回夺市安然阳光实验学校富集在海水中的元素——氯学一、选择题1.(2013·试题调研)检验Cl-所用的试剂为AgNO3和HNO3,其中HNO3的作用是( )A.防止CO2-3的干扰B.防止Cl-的干扰C.生成AgNO3沉淀D.防止NO-3的干扰【答案】A【点拨】检验Cl -时,加入AgNO3会生成AgCl白色沉淀,而Ag2CO3同样是白色沉淀,但加入稀HNO3后,AgCl不溶解,而Ag2CO3溶解于稀HNO3,所以加稀HNO3的作用是防止CO2-3的干扰。
2.下列反应的离子方程式书写不正确的是( )A.向漂白液中通入过量CO2:ClO-+H2O+CO2===HClO+HCO-3B.氯气与水反应:Cl2+H2O===2H++Cl-+ClO-C.二氧化锰与浓盐酸反应:MnO2+4H++4Cl-===Mn2++2H2O+2Cl2↑D.碳酸钙粉末与新制的氯水反应:CaCO3+2H+===Ca2++CO2↑+H2O【答案】BC【点拨】B项生成物HClO应写成化学式,C项中化合价升降总数不相等,电荷不守恒,正确的写法应为:MnO2+4H++2Cl-===Mn2++2H2O+Cl2↑。
碳酸钙主要与氯水中的盐酸反应。
3.(2013·经典习题选萃)将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( ) A.23B.12C.13D.14【答案】B【点拨】 1 mol Cl2与H2O完全反应,最后分解生成0.5 mol O2。
4.检验HCl气体中是否混有Cl2,可采用的正确方法是( )A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸【答案】D【点拨】本题考查Cl2、HCl及氯水、盐酸的性质,并且要知道淀粉遇碘单质变蓝这一实验现象。
5.在500 g含1.17 g NaCl和0.84 g NaF的溶液中,滴加过量的AgNO3溶液,静置,过滤,洗涤,称重得到2.87 g固体,由此可以得出的正确结论是( )A.氯离子只有一部分参加反应B.氟离子只有一部分参加反应C.氟化钠与AgNO3在溶液中无沉淀生成D.氟化银难溶于水【答案】C【点拨】通过计算知1.17 g NaCl与过量AgNO3溶液作用生成2.87 g沉淀。
2022届高考化学一轮复习第四章第13讲富集在海水中的元素_卤素课时作业练习含解析

第13讲富集在海水中的元素—卤素1.(2021·某某模拟)卤族元素与其化合物与社会、生活关系密切。
如下有关说法不正确的答案是( )A.加碘食盐中参加的是碘酸钾B.常用于杀菌消毒的84消毒液的成分是液氯C.可用硝酸银溶液来鉴别纯净水和自来水D.变色眼镜和照相器材的生产都要用到溴化银答案:B2.当大量氯气泄漏时,用浸润如下某物质水溶液的毛巾捂住鼻子可防中毒。
适宜的物质是( )A.NaOH B.KIC.NH3D.Na2CO3答案:D3.潮湿的氯气、新制的氯水、次氯酸钠溶液、漂白粉溶液均能使有色布条褪色,这是由于它们含有或能生成( )A.氯气B.次氯酸C.次氯酸根D.氯化氢解析:Cl2+H2O HCl+HClO;ClO-+H2O HClO+OH-。
答案:B4.向新制氯水中参加少量如下物质,能增强溶液漂白能力的是( )A.碳酸钙粉末B.稀硫酸C.氯化钙溶液D.二氧化硫水溶液解析:氯水中存在如下平衡:Cl2+H2O H++Cl-+HClO。
向新制氯水中参加碳酸钙粉末,消耗H+使平衡向正反响方向移动,HClO浓度增大,漂白能力增强,A项正确;向新制氯水中参加稀硫酸,溶液中的H+浓度增大,使平衡逆向移动,HClO浓度减小,漂白能力减弱,B项错误;向新制氯水中参加CaCl2溶液,溶液中的Cl-浓度增大,平衡逆向移动,HClO的浓度减小,漂白能力减弱,C项错误;SO2与氯水发生反响:SO2+Cl2+2H2O===4H++2Cl-+SO2-4,降低氯水的漂白性,D项错误。
答案:A5.如下对氯气与其化合物的说法正确的答案是( )A.过量的铁在氯气中燃烧可生成氯化亚铁B.用pH试纸测得氯水的pH=4C.溴化钠溶液中参加少量新制氯水振荡,再参加少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色D.由Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO可推出Ca(ClO)2+SO2+H2O===CaSO3↓+2HClO解析:A项反响生成FeCl3,与Fe的多少无关;B项试纸被漂白;D项CaSO3会被HClO氧化为CaSO4。
第12讲 富集在海水中的元素——卤素(练)高考化学一轮复习讲练测(解析版)

第12讲 富集在海水中的元素——卤素第一部分:高考真题感悟1.(2021·福建·高考真题)实验室配制碘水时,通常将2I 溶于KI 溶液:--23I (aq)+I (aq)I (aq)。
关于该溶液,下列说法正确的是A .KI 的电子式为 K I ::B .滴入淀粉溶液,不变蓝C .加水稀释,平衡逆向移动D .加少量3AgNO 固体平衡正向移动 【答案】C【解析】A .KI 是离子化合物,电子式为··+··K [:I :]-,A 错误;B .该溶液存在2I ,滴入淀粉溶液,变蓝,B 错误;C .根据勒夏特列原理,加水稀释,平衡朝着离子浓度增大的方向移动,即逆向移动,C 正确;D .加少量3AgNO 固体,+Ag 与-I 生成沉淀,-I 浓度下降,平衡逆向移动,D 错误;故选C 。
2.(2022·浙江·高考真题)下列推测不合理...的是 A .相同条件下,Br 2与PBr 3反应比Cl 2与PCl 3反应难B .OPBrCl 2与足量H 2O 作用生成2种酸C .相同条件下,与水反应由快到慢的顺序:OPBr 3、OPCl 3、OPF 3D .PBr 3与足量C 2H 5OH 作用可得到P(OC 2H 5)3【答案】B【解析】A .氯原子半径较小,氯气更容易靠近三氯化磷中的磷原子发生反应生成五氯化磷,A 正确;B .OPBrCl 2与H 2O 反应的方程式为:OPBrCl 2+3H 2O=H 3PO 4+2HCl+HBr ,一共生成3种酸,B 错误;C .从P—Br 键到P—F 键,键的稳定性逐渐增强,在和水反应时越难断裂,反应速率越慢,C 正确;D .PBr 3与C 2H 5OH 反应的时候,Br 乙醇羟基上的氢原子结合,乙醇的其余部分和磷结合生成P(OC 2H 5)3,D 正确;故选B 。
3.(2022·浙江·高考真题)关于反应+-22Cl (g)+H O(l)HClO(aq)+H (aq)+Cl (aq)ΔH<0,达到平衡后,下列说法不正确...的是 A .升高温度,氯水中的c(HClO)减小B .氯水中加入少量醋酸钠固体,上述平衡正向移动,c(HClO)增大C .取氯水稀释,()-c Cl /c(HClO)增大D .取两份氯水,分别滴加3AgNO 溶液和淀粉KI 溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度【答案】D【解析】A .HClO 受热易分解,升高温度,HClO 分解,平衡正向移动,c(HClO)减小,A 正确;B .氯水中加入少量醋酸钠固体,醋酸根离子和氢离子结合生成醋酸分子,氢离子浓度减小,平衡正向移动,c(HClO)增大,B 正确;C .氯水稀释,平衡正向移动,而c(HClO)和c(Cl -)均减小,但HClO 本身也存在电离平衡HClO ⇌H ++ClO -,稀释促进了HClO 的电离,使c(HClO)减少更多,因此-c(Cl )c(HClO)增大,C 正确;D .氯水中加硝酸银产生白色沉淀,证明溶液中有氯离子,氯水中加淀粉碘化钾溶液,溶液变蓝,证明生成了碘单质,溶液中有强氧化性的物质,而氯气和次氯酸都有强氧化性,不能证明反应物和生成物共存,即不能证明上述反应存在限度,D 错误;答案选D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
富集在海水中的元素卤素完卷时间:50分钟可能用到的相对原子质量:O16 Cl35.5一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·江苏无锡市·高三一模)氯气是常用的化工原料,可用作消毒剂和漂白剂;实验室用MnO2和盐酸反应可制取氯气。
氯气有毒,泄漏时需要妥善处理。
下列有关氯气的说法不正确...的是A.Cl2是由共价键构成的非极性分子B.制备漂白粉的方法是用石灰水吸收Cl2C.利用湿润的淀粉—KI试纸可检验Cl2D.工业上可用电解饱和食盐水制得Cl2【答案】B【解析】A.氯气是由氯原子通过共价键形成的非极性分子,故A正确;B.石灰水中氢氧根离子浓度小,不利于氯气与氢氧化钙充分反应,吸收效率低,不适合制备漂白粉,制备漂白粉的方法是用石灰乳吸收氯气,故B错误;C.氯气能碘化钾溶液反应生成氯化钾和碘,反应生成的碘使淀粉溶液变蓝色,则利用湿润的淀粉—KI试纸可检验Cl2,故C正确;D.电解饱和食盐水时,反应生成氢氧化钠、氢气和氯气,则工业上可用电解饱和食盐水制得Cl2,故D正确;故选B。
2.(2021·上海高三二模)氯气性质非常活泼,能和很多物质反应。
下列关于其相关反应的实验现象的“解释或结论”正确的是A.A B.B C.C D.D【答案】D【解析】A.氯气能使湿润的淀粉KI试纸变蓝说明氯气能置换KI中的碘,则氧化性:Cl2>I2;氯气能使NaBr 溶液变橙色说明氯气能置换NaBr中的溴,则氧化性:Cl2>Br2,不能比较Br2和I2的氧化性,A错误;B.氯气能使湿润的蓝色石蕊试纸先变红,后褪色,说明氯气与水生成了酸性物质(变红)以及漂白性物质(HClO),B错误;C.H2S是弱酸,属于弱电解质,其溶液中离子浓度较小,导电性较弱,氯气通入H2S的水溶液中,溶液的导电性增强,说明氯气与H2S反应产生了比H2S电离程度大的电解质,但氯气属于单质,既不是电解质也不是非电解质,C错误;D.氯气通入FeCl2和KSCN混合液,溶液变红色,说明氯气将Fe2+氧化成了Fe3+,则氧化性:Cl2>Fe3+,D正确;答案选D。
3.(2021·全国高三三模)2020年11月10日,第三届中国国际进口博览会闭幕,该届“进博会”新设公共卫生防疫专区、智慧出行专区、节能环保专区和体育用品及赛事专区。
下列有关卫生防疫知识的描述错误的是A.家庭餐具可采取开水蒸煮的方式进行热力消毒B.“84”消毒液的成分为NaClO、表面活性剂和水等,使用“84”消毒液的浓度越高越好C.医用酒精应密封保存并远离明火D.H2O2消毒液和ClO2泡腾片的消毒原理相同【答案】B【解析】A.开水煮沸,可以消毒,因为高温可使蛋白质变性,从而杀死细菌,故A正确;B.“84”消毒液具有腐蚀性,浓度越高腐蚀性增强,浓度越高见光越易分解,极不安全,所以使用“84”消毒液的浓度不是越高越好,故B错误;C.医用酒精易挥发,易燃烧,所以应密封保存,置于阴凉处,且远离火源,故C 正确;D.H2O2消毒液和ClO2泡腾片均具有强氧化性,能够使病毒氧化变质而失去生理活性,因而具有杀菌消毒作用,所以它们消毒原理相同,故D正确;答案为B。
4.(2021·辽宁丹东市·高三一模)利用下列装置(夹持装置略)进行实验,能达到实验目的的是①②③④A.图①装置可制备无水 MgCl2B.图②装置可证明氧化性:Cl2>Br2>I2C.图③装置可制乙烯并验证其还原性D.图④装置可观察铁的析氢腐蚀【答案】A【解析】A.由于镁离子水解,因此得到MgCl2,需要在HCl气流中加热,因此图①装置可制备无水 MgCl2,故A符合题意;B.图②装置不能证明氧化性:Cl2>Br2>I2,可能氯气过量,将KI氧化为I2,从而使淀粉变蓝,故B 不符合题意;C .由于乙醇易挥发,图③装置可制乙烯,但乙醇和乙烯都能使酸性高锰酸钾褪色,因此不能证明酸性高锰酸钾褪色是乙烯的还原性,故C 不符合题意;D .NaCl 溶液是中性环境,因此图④装置可观察铁的吸氧腐蚀,故D 不符合题意。
综上所述,答案为A 。
5.(2021·江苏南京市·高三二模)氯及其化合物在生产、生活中有广泛应用。
下列物质的性质与用途具有对应关系的是A .Cl 2能溶于水,可用于工业制盐酸B .ClO 2有强氧化性,可用于自来水消毒C .HClO 不稳定,可用作棉、麻的漂白剂D .FeCl 3溶液呈酸性,可用于蚀刻印刷电路板【答案】B【解析】A .工业制盐酸的方法是将氢气和氯气点燃生成氯化氢,而不是氯气与水反应,A 项错误;B .ClO 2用于自来水消毒是利用其强氧化性,B 项正确;C .HClO 可用作棉、麻的漂白剂是利用HClO 的氧化性,C ;D .FeCl 3用于蚀刻印刷电路板是利用Fe 3+的氧化性,D 项错误;答案选B 。
6.(2021·上海高三一模)BrCl 是一种卤素互化物,与Cl 2性质相似,也能与水或碱溶液反应。
下列说法正确的是A .BrCl 与水反应生成HBrO 和HCl ,该反应属于氧化还原反应B .1molBrCl 与KBr 溶液完全反应时转移的电子为1molC .BrCl 可与Cl 2反应得到Br 2D .BrCl 与稀氢氧化钠溶液反应可生成NaBr 和NaClO【答案】B【解析】A .BrCl +H 2O =HBrO +HCl ,反应中化合价无变化,因此该反应属于非氧化还原反应,故A 错误;B .BrCl +KBr =KCl +Br 2,BrCl 中Br 化合价降低1个价态变为Br 2,因此1mol BrCl 与KBr 溶液完全反应时转移的电子为1mol ,故B 正确;C .Cl 2氧化性比BrCl 氧化性强,因此BrCl 不与Cl 2反应,故C 错误;D .BrCl 中Br 为+1价,因此BrCl 与稀氢氧化钠溶液反应可生成NaCl 和NaBrO ,故D 错误。
综上所述,答案为B 。
7.(2021·河北高三三模)2NaClO 是一种高效的漂白剂,实验室中一种制备2NaClO 的过程如图所示,下列说法错误的是A .2NaClO 的漂白原理与2SO 不同B .每生成1 mol 2ClO 有0.5 mol 224HC O 被氧化C .反应2过程中,22H O 作氧化剂D .粗产品经重结晶可得到纯度更高的2NaClO【答案】C【解析】反应Ⅰ中NaClO 3在硫酸作用下与草酸发生氧化还原反应生成ClO 2,吹出的ClO 2在溶液中与加入氢氧化钡溶液、H 2O 2反应,除去气体中的二氧化碳,ClO 2被转化为NaClO 2,过滤除去碳酸钡沉淀,在滤液中加入硫酸钠除去过量的氢氧化钡得到NaClO 2溶液,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到粗产品NaClO 2。
A .2NaClO 的漂白原理是依靠其氧化性,2SO 的漂白原理是与有色物质反应生成无色的物质,2NaClO 的漂白原理与2SO 不同,故A 正确;B .反应1中3NaClO 生成2ClO 过程Cl 元素由+5价变为+4价,224HC O 反应生成2CO 过程C 元素由+3价变为+4价,每生成1 mol 2ClO 有0.5mol 224H C O 被氧化,故B 正确;C .反应2 的反应之一为2NaOH+2ClO 2+H 2O 2=2NaClO 2+O 2↑+2H 2O ,反应过程中Cl 元素由+4价变为+3价,2ClO 作氧化剂,22H O 作还原剂,故C 错误;D .粗产品经重结晶可得到纯度更高的2NaClO ,故D 正确;故选C 。
8.(2021·河南郑州市·高三三模)某小组按如图装置探究氯气和双氧水的反应。
将注射器中的浓盐酸注入试管中,在盛NaOH 溶液的试管中收集到无色气体,该气体可以使带火星的木条复燃。
下列说法错误的是A .饱和食盐水的作用是除去氯气中的HClB .NaOH 溶液不可以用水代替C .由反应H 2O 2+Cl 2=2HCl+O 2可证明非金属性:Cl>OD .仅根据此实验现象无法证明一定是氯气氧化了H 2O 2【答案】C【解析】发生装置为高锰酸钾和浓盐酸反应制备氯气:42222KMnO 16HCl()2KCl 2MnCl 5Cl 8H O +=++↑+浓,经过饱和食盐水除去挥发出的HCl 气体,由于在盛NaOH 溶液的试管中收集到无色气体,该气体可以使带火星的木条复燃,说明氯气与双氧水发生核心反应产生O 2,用氢氧化钠溶液吸收多余的氯气防止污染环境并且收集产生的O 2。
A .根据分析可知饱和食盐水的作用是除去氯气中的HCl ,A 正确;B .水吸收氯气的效果不好,所以NaOH 溶液不可以用水代替,B 正确;C .由反应H 2O 2+Cl 2=2HCl+O 2可说明该条件下氧化性:Cl 2>O 2,但不可证明非金属性:Cl>O ,客观事实是O 的电负性大于Cl ,即O 的非金属性大于Cl ,所以C 错误;D .实验产生的O 2有可能是H 2O 2分解所得,不一定是氯气氧化了H 2O 2产生了O 2,D 正确;答案选C 。
9.(2021·福建宁德市·高三三模)利用如图装置进行Cl 2制备及其化学性质的探究。
下列说法错误的是A .拉动a 或b 的活塞,可检查装置气密性B .c 中反应的氧化产物与还原产物的质量比为6:1C .c 中产生Cl 2后,d 褪色的原因是次氯酸具有漂白性D .性质实验结束后,加入b 中溶液除去多余的Cl 2,溶液由红色变为无色【答案】B【解析】c 中反应KClO 3+6HCl(浓)=KCl+3Cl 2↑+3H 2O ,d 中先发生:Cl 2+H 2O=HCl+HClO ,实验结束后:加入b 中溶液除去多余的Cl 2,Cl 2+2NaOH=H 2O+NaCl+NaClO 。
A . 拉动a 或b 的活塞,松开后看活塞能否恢复到原位,可检查装置气密性,故A 正确;B . 由KClO 3+6HCl(浓)=KCl+3Cl 2↑+3H 2O ,化合价升高的氯与化合价降低的氯比为5:1,c 中反应的氧化产物与还原产物的质量比为5:1,故B 错误;C . c 中产生Cl 2后,Cl 2+H 2O=HCl+HClO ,HClO 具有强氧化性、漂白性,d 褪色的原因是次氯酸具有漂白性,故C 正确;D . 性质实验结束后,加入b 中溶液除去多余的Cl 2,Cl 2+2NaOH=H 2O+NaCl+NaClO ,碱性变弱,溶液由红色变为无色,故D 正确;故选B 。
10.(2021·天津高三二模)“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:下列有关说法不正确...的是 A .氧化1所用的氯气可通过电解饱和NaCl 溶液制得B .吹出后剩余溶液中可能大量存在的离子有Na +、2Mg +、Cl -、Br -C .吸收过程发生反应的离子方程式为22224SO Br 2H O 4H 2Br SO +--++++═D .氧化2所得溶液可通过萃取分离出溴【答案】B【解析】由题给流程可知,足量氯气与海水中的溴离子发生置换反应生成溴,用热空气将生成的溴吹出,用二氧化硫的水溶液吸收吹出的溴,溴与二氧化硫水溶液反应生成硫酸和氢溴酸,向硫酸和氢溴酸中通入氯气,氯气与溶液中氢溴酸发生置换反应生成溴,用合适的有机溶剂萃取溴水中的溴,分液得到溴的有机溶液,蒸馏有机溶液得到液溴。
