高中化学原电池和电解池全面总结超全版
高中化学原电池和电解池全面总结超全版

高中化学原电池和电解池全面总结超全版公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-原电池和电解池1.原电池和电解池的比较:2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):↑+2NaOH强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收: MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
高中化学原电池和电解池全面总结超全版

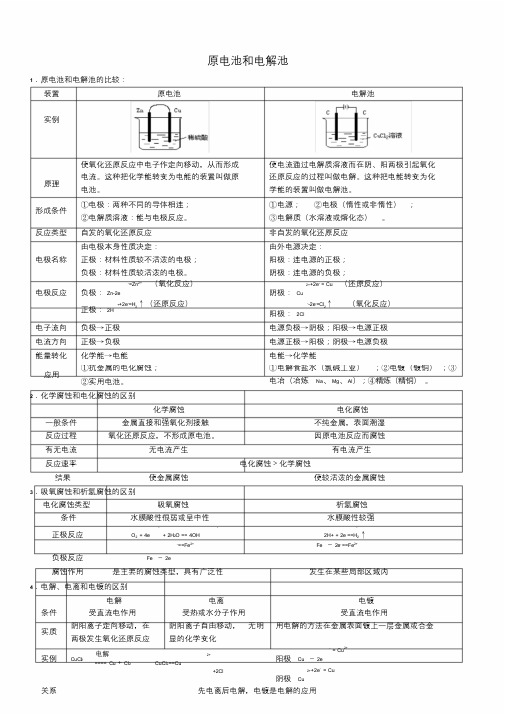
原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极〔惰性或非惰性〕;③电解质〔水溶液或熔化态〕。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ 〔氧化反应〕正极:2H++2e-=H2↑〔还原反应〕阴极:Cu2+ +2e- = Cu 〔还原反应〕阳极:2Cl--2e-=Cl2↑〔氧化反应〕电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水〔氯碱工业〕;②电镀〔镀铜〕;③电冶〔冶炼Na、Mg、Al〕;④精炼〔精铜〕。
化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应O2 + 4e- + 2H2O == 4OH-2H+ + 2e-==H2↑负极反应Fe -2e-==Fe2+Fe -2e-==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuCl2电解====Cu+Cl2CuCl2==Cu2++2Clˉ阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu阳极:Zn - 2e-=Zn2+Cu-2e- =Cu2+等阴极:Cu2++ 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例〔用惰性电极电解〕:电解质溶液阳极反应式阴极反应式总反应方程式〔条件:电解〕溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生〔1〕吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O〔2〕析氢腐蚀:CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版
原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例使氧化还原反应中电子作定向移动,从而形成使电流通过电解质溶液而在阴、阳两极引起氧化原理电流。
这种把化学能转变为电能的装置叫做原电池。
还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应由电极本身性质决定:由外电源决定:电极名称正极:材料性质较不活泼的电极;阳极:连电源的正极;负极:材料性质较活泼的电极。
阴极:连电源的负极;电极反应-=Zn2+ (氧化反应)负极:Zn-2e++2e-=H2↑(还原反应)正极:2H2++2e- = Cu (还原反应)阴极:Cu--2e-=Cl2↑(氧化反应)阳极:2Cl电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀3.吸氧腐蚀和析氢腐蚀的区别电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强- 正极反应O2 + 4e-+ 2H2O == 4OH-2H+ + 2e ==H2↑-==Fe2+ Fe -2e- ==Fe2+负极反应Fe -2e腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内4.电解、电离和电镀的区别电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuC2l 电解2+==== Cu+Cl2 CuCl2==Cu+2Clˉ- = Cu2+阳极Cu -2e2++2e- = Cu阴极Cu关系先电离后电解,电镀是电解的应用5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀粗铜金属作阳极,精铜作阴极,CuSO4溶液作液必须含有镀层金属的离子电解液电极反应- 2+阳极 Cu -2e= Cu 2++2e -= Cu阴极 Cu-2+阳极: Zn - 2e = Zn 2+ + 2e -= Cu阴极: Cu- Cu - 2e2+= Cu等溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例 (用惰性电极电解) :电解质溶液阳极反应式 阴极反应式总反应方程式 (条件:电解)溶液酸碱性变化CuCl 2 2Cl--2e -=Cl 2↑ Cu 2++2e -= Cu CuCl 2= Cu +Cl 2↑ —— HCl 2Cl--2e -=Cl 2↑2H ++2e -=H 2↑2HCl=H 2↑+Cl 2↑酸性减弱--+-Na 2SO 4 4OH -4e =2H 2O+O 2↑ 2H +2e=H 2↑2H 2O=2H 2↑+O 2↑不变H 2SO 4 4OH--4e -=2H 2O+O 2↑ 2H ++2e -=H 2↑ 2H 2O=2H 2↑+O 2↑ 消耗水,酸性增强 NaOH4OH--4e -=2H 2O+O 2↑2H ++2e -=H 2↑2H 2O=2H 2↑+O 2↑消耗水,碱性增强--+-NaCl2Cl -2e+2e =H 2↑ =Cl 2↑2H2NaCl+2H 2O=H 2↑+Cl 2↑+2NaOH+H 放电,碱性增强CuSO 44OH --4e -=2H 2O+O 2↑Cu 2++2e -= Cu--4e -=2H 2O+O 2↑ Cu 2++2e -= Cu 2CuSO 4+2H 2O=2Cu+ O 2↑+2H 2SO 4OH ˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生 (1)吸氧腐蚀-2+负极: Fe -2e==Fe-+2H 2O==4OH - 正极: O 2+4e总式: 2Fe+O 2+2H 2O==2Fe(OH)24Fe(OH)2+O 2+2H 2O==4Fe(OH)3 2Fe(OH)3==Fe 2O 3+3H 2O++HCO 3-(2)析氢腐蚀: CO 2+H 2O H 2CO 3H-==Fe 2+ 负极: Fe -2e+ + 2e -==H 2↑正极: 2H总式: Fe + 2CO 2 + 2H 2O = Fe(HCO 3)2 + H 2↑ Fe(HCO 3)2 水解、空气氧化、风吹日晒得 Fe 2O 3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):↑+Cl2↑+2NaOH增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应O2 + 4e- + 2H2O == 4OH-2H+ + 2e-==H2↑负极反应Fe -2e-==Fe2+Fe -2e-==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuCl2电解==== Cu+Cl2CuCl2==Cu2++2Clˉ阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu阳极:Zn - 2e- = Zn2+Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):+2NaOHCuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全

原电池和电解池1.原电池和电解池的比较:装置 原电池电解池实例使氧化复原反响中电子作定向挪动,进而形成使电流经过电解质溶液而在阴、阳两极惹起氧化 原理电流。
这类把化学能转变成电能的装置叫做原复原反响的过程叫做电解。
这类把电能转变成化电池。
学能的装置叫做电解池。
形成条件①电极:两种不一样的导体相连; ①电源;②电极(惰性或非惰性) ;②电解质溶液:能与电极反响。
③电解质(水溶液或融化态) 。
反响种类自觉的氧化复原反响非自觉的氧化复原反响由电极自己性质决定:由外电源决定:电极名称正极:资料性质较不开朗的电极; 阳极:连电源的正极;负极:资料性质较开朗的电极。
阴极:连电源的负极;电极反响负极: Zn-2e - =Zn 2+ (氧化反响)阴极: Cu 2+ +2e - = Cu(复原反响)正极: +-2阳极: 2Cl --2e -2↑(氧化反响)2H +2e =H ↑(复原反响) =Cl电子流向 负极→正极 电源负极→阴极;阳极→电源正极 电流方向 正极→负极 电源正极→阳极;阴极→电源负极能量转变化学能→电能电能→化学能应用①抗金属的电化腐化;①电解食盐水(氯碱工业) ;②电镀(镀铜) ;③②适用电池。
电冶(冶炼 Na 、 Mg 、 Al );④精华(精铜) 。
2.化学腐化和电化腐化的差别化学腐化电化腐化一般条件 金属直接和强氧化剂接触 不纯金属,表面湿润反响过程 氧化复原反响,不形成原电池。
因原电池反响而腐化有无电流 无电流产生有电流产生反响速率电化腐化>化学腐化结果使金属腐化使较开朗的金属腐化3.吸氧腐化和析氢腐化的差别电化腐化种类吸氧腐化 析氢腐化条件 水膜酸性很弱或呈中性水膜酸性较强正极反响2 -+ 2H 2-- 2O + 4eO == 4OH2H+ + 2e==H ↑ 负极反响-2+-2+Fe - 2e ==FeFe -2e ==Fe腐化作用是主要的腐化种类,拥有宽泛性发生在某些局部地区内4.电解、电离和电镀的差别电解条件 受直流电作用阴阳离子定向挪动,在 本质两极发生氧化复原反响实例电解CuCl ==== Cu + Cl22关系5.电镀铜、精华铜比较电离电镀受热或水分子作用 受直流电作用阴阳离子自由挪动, 无明 用电解的方法在金属表面镀上一层金属或合金显的化学变化2+ˉ阳极 Cu - 2e - = Cu 2+CuCl ==Cu +2Cl2+-2阴极 Cu +2e = Cu先电离后电解,电镀是电解的应用电镀铜 精华铜形成条件电极反响溶液变化6.电解方程式的实例电解质溶液CuCl 2HClNa2SO4H2SO4NaOHNaClCuSO4镀层金属作阳极,镀件作阴极,电镀液一定含有镀层金属的离子阳极 Cu-2e-= Cu2+2+-阴极 Cu +2e = Cu(用惰性电极电解):阳极反响式阴极反响式--2+-2Cl -2e =Cl ↑Cu+2e = Cu22Cl - -2e - =Cl 2↑2H++2e- =H2↑--=2H2O+O↑+-4OH-4e2H +2e =H↑22--=2H2O+O2↑+-4OH-4e2H +2e =H2↑--22+-24OH-4e=2H O+O↑2H +2e =H↑2Cl - -2e - =Cl 2↑2H++2e- =H2↑--222++2e-= Cu4OH-4e=2H O+O↑Cu粗铜金属作阳极,精铜作阴极, CuSO4溶液作电解液阳极: Zn - 2e - = Zn 2+Cu - 2e-= Cu 2+等阴极: Cu2+ + 2e - = Cu溶液中溶质浓度减小总反响方程式(条件:电解)溶液酸碱性变化CuCl = Cu +Cl ↑——222HCl=H2↑ +Cl 2↑酸性减弱2H2↑ +O2↑不变O=2H2H2O=2H↑ +O2↑耗费水,酸性加强2H O=2H↑ +O↑耗费水,碱性加强222NaCl+2H2O=H2↑+Cl 2↑H+放电,碱性加强+2NaOH2CuSO4+2H2O=2Cu+ O2↑OHˉ放电 , 酸性增+2H SO强24考点讲解1.电化腐化:发生原电池反响,有电流产生( 1)吸氧腐化负极: Fe- 2e- ==Fe2+--正极: O+4e +2H O==4OH22总式: 2Fe+O+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH) 3==Fe2O3+3H2O+-(2)析氢腐化: CO2+H2O H2 CO3 H +HCO3负极: Fe - 2e- ==Fe2+正极: 2H+ + 2e - ==H2↑总式: Fe + 2CO 2 + 2H 2O = Fe(HCO3) 2 + H 2↑Fe(HCO3) 2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:实例CuCl2电解==== Cu+Cl2CuCl2==Cu2++2Clˉ阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu阳极:Zn - 2e- = Zn2+Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO 2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解.这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn—2e—=Zn2+ (氧化反应)正极:2H++2e—=H2↑(还原反应)阴极:Cu2+ +2e—= Cu (还原反应)阳极:2Cl——2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池. ①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜).2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较阴极:Cu2+ + 2e— = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):总反应方程式溶液酸碱性变化电解质溶液阳极反应式阴极反应式(条件:电解)CuCl22Cl——2e—=Cl2↑Cu2+ +2e—= Cu CuCl2= Cu +Cl2↑—-HCl 2Cl-—2e—=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH-—4e-=2H2O+O2↑2H++2e—=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH—-4e-=2H2O+O2↑2H++2e—=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强2NaCl+2H2O=H2↑+Cl2↑NaCl 2Cl—-2e—=Cl2↑2H++2e—=H2↑H+放电,碱性增强+2NaOH2CuSO4+2H2O=2Cu+ O2OHˉ放电,酸性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu↑+2H2SO4考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e—==Fe2+正极:O2+4e-+2H2O==4OH—总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO2+H2O H2CO3H++HCO3—负极:Fe -2e—==Fe2+正极:2H+ + 2e—==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3.2.金属的防护⑴改变金属的内部组织结构。
高中化学原电池和电解池全面总结超全版

高中化学原电池和电解池全面总结超全版Modified by JACK on the afternoon of December 26, 2020原电池和电解池1.原电池和电解池的比较:2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极 Cu -2e- = Cu2+阴极 Cu2++2e- = Cu 阳极:Zn - 2e- = Zn2+ Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO 3)2水解、空气氧化、风吹日晒得Fe 2O 3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O+H2O H2CO3H++HCO3-(2)析氢腐蚀:CO负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极:Pb-2e-+ SO42- = PbSO4正极:PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-总式:Pb + PbO2 + 2H2SO4放电===充电2PbSO4 + 2H2O注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池。
高中化学原电池和电解池全面总结超全版

原电池和电解池极发生氧化还原反应显的化学变化实例CuCl2电解==== Cu+Cl2CuCl2==Cu2++2Clˉ阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu阳极:Zn - 2e- = Zn2+Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应O2 + 4e- + 2H2O == 4OH-2H+ + 2e-==H2↑负极反应Fe -2e-==Fe2+Fe -2e-==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuCl2电解==== Cu+Cl2CuCl2==Cu2++2Clˉ阳极 Cu -2e- = Cu2+阴极 Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用5电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极 Cu -2e- = Cu2+阴极 Cu2++2e- = Cu阳极:Zn - 2e- = Zn2+ Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池56(条件:电解)CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
高中化学原电池和电解池全面总结超全版

原电池和电解池装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应O2 + 4e- + 2H2O == 4OH-2H+ + 2e-==H2↑负极反应Fe -2e-==Fe2+Fe -2e-==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuCl2电解==== Cu+Cl2CuCl2==Cu2++2Clˉ阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu关系先电离后电解,电镀是电解的应用电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu -2e- = Cu2+阴极Cu2++2e- = Cu阳极:Zn - 2e- = Zn2+Cu - 2e- = Cu2+等阴极:Cu2+ + 2e- = Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH 4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl 2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO 2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池和电解池1.原电池和电解池的比较:装置原电池实例使氧化还原反应中电子作定向移动,从而形成原理电流。
这种把化学能转变为电能的装置叫做原电池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
反应类型自发的氧化还原反应由电极本身性质决定:电极名称正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
电极反应负极: Zn-2e-=Zn2+(氧化反应)正极: 2H++2e-=H2↑(还原反应)电子流向负极→正极电流方向正极→负极能量转化化学能→电能①抗金属的电化腐蚀;应用②实用电池。
2.化学腐蚀和电化腐蚀的区别电解池使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
非自发的氧化还原反应由外电源决定:阳极:连电源的正极;阴极:连电源的负极;2+-阴极: Cu +2e = Cu(还原反应)--阳极: 2Cl-2e =Cl2↑(氧化反应)电源负极→阴极;阳极→电源正极电源正极→阳极;阴极→电源负极电能→化学能①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼 Na、 Mg、Al);④精炼(精铜)。
化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀3.吸氧腐蚀和析氢腐蚀的区别电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应---O2 + 4e + 2H2O == 4OH2H+ + 2e ==H2↑负极反应Fe - 2e-==Fe2+Fe - 2e- ==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内4.电解、电离和电镀的区别条件实质实例关系电解受直流电作用阴阳离子定向移动,在两极发生氧化还原反应电解CuCl2 ==== Cu+Cl2电离电镀受热或水分子作用受直流电作用阴阳离子自由移动,无明用电解的方法在金属表面镀上一层金属或合金显的化学变化2+阳极 Cu - 2e- = Cu2+CuCl2==Cu +2Clˉ阴极 Cu2++2e- = Cu先电离后电解,电镀是电解的应用5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀 粗铜金属作阳极,精铜作阴极, CuSO4溶液作液必须含有镀层金属的离子电解液阳极 Cu -2e -2+阳极: Zn - 2e -2+-2+电极反应= Cu= ZnCu - 2e= Cu 等阴极 Cu 2++2e -= Cu阴极: Cu 2++ 2e -= Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解) :电解质溶液阳极反应式阴极反应式总反应方程式 溶液酸碱性变化(条件:电解)CuCl 2 2Cl --2e -=Cl 2 ↑ Cu 2+ +2e -= Cu CuCl 2= Cu +Cl 2↑ —— HCl 2Cl --2e -=Cl 2 ↑2H ++2e -=H 2 ↑ 2HCl=H 2↑+Cl 2↑酸性减弱 Na 2SO 4 --+ -2H 2O=2H 2↑ +O 2↑不变4OH -4e =2H 2O+O 2↑ 2H +2e =H 2 ↑H 2SO 4 4OH --4e -=2H 2O+O 2↑2H ++2e -=H 2 ↑2H 2O=2H 2↑ +O 2↑消耗水,酸性增强 NaOH 4OH --4e -=2H 2O+O 2↑2H ++2e -=H 2 ↑2H 2O=2H 2↑ +O 2↑消耗水,碱性增强NaCl--+-2NaCl+2H 2O=H 2↑ +Cl 2↑+2Cl -2e =Cl 2 ↑2H +2e =H 2 ↑ +2NaOHH 放电,碱性增强CuSO 44OH --4e -=2H 2O+O 2↑Cu 2+ +2e -= Cu2CuSO 4+2H 2O=2Cu+ O 2↑ OH ˉ放电 ,酸性增强+2H 2SO 4考点解说1.电化腐蚀:发生原电池反应,有电流产生( 1)吸氧腐蚀-2+负极: Fe - 2e ==Fe正极: O 2+4e -+2H 2O==4OH - 总式: 2Fe+O 2 +2H 2O==2Fe(OH)24Fe(OH)2+O 2 +2H 2 O==4Fe(OH)3 2Fe(OH)3==Fe 2O 3+3H 2O( 2)析氢腐蚀: CO 2+H 2O H 2CO 3 负极: Fe - 2e -==Fe 2+正极: 2H + + 2e -==H 2↑总式: Fe + 2CO + 2H O = Fe(HCO)223 2H ++HCO 3-+ H 2↑Fe(HCO 3)2 水解、空气氧化、风吹日晒得 Fe 2O 3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属 表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我 保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法 : 接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极 3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满 MnO 2 的石墨、溶有NH 4Cl 的糊状物。
②电极反应负极: Zn-2e -=Zn 2+正极: 2NH 4++2e -=2NH 3+H 2NH 3 和 H 2 被 Zn 2+、 MnO 2 吸收: MnO 2+H 2=MnO+H 2 O,Zn 2++ 4NH 3=Zn(NH 3)4 2+⑵铅蓄电池(属于二次电池、可充电电池)① 结构:铅板、填满PbO 2 的铅板、稀H 2 SO 4。
② A.放电反应-2-负极: Pb-2e + SO4 = PbSO4正极: PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应阴极: PbSO4 +2e- = Pb+ SO42--2-阳极: PbSO4 -2e + 2H2 O = PbO2 +4H+ + SO4放电2PbSO4 + 2H2O总式: Pb + PbO2 + 2H2SO4 ===充电注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池。
电极名称看电子得失,电极反应式的书写要求与离子方程式一样,且加起来应与总反应式相同。
⑶锂电池① 结构:锂、石墨、固态碘作电解质。
②电极反应负极: 2Li-2e-= 2Li+正极: I2 +2e-= 2I-总式: 2Li + I2 = 2LiI⑷ A.氢氧燃料电池①结构:石墨、石墨、②电极反应负极:正极:KOH溶液。
H2- 2e-+ 2OH- = 2H2OO2 + 4e- + 2H2O = 4OH-总式: 2H2+O2=2H2O(反应过程中没有火焰,不是放出光和热,而是产生电流)注意:还原剂在负极上反应,氧化剂在正极上反应。
书写电极反应式时必须考虑介质参加反应(先常规后深入)。
若相互反应的物质是溶液,则需要盐桥(内装KCl的琼脂,形成闭合回路)。
B.铝、空气燃料电池以铝—空气—海水电池为能源的新型海水标志灯已研制成功。
这种灯以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而源源不断产生电流。
只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~ 50 倍。
电极反应:铝是负极4Al-12e-== 4Al3+;石墨是正极3O2 +6H2O+12e-==12OH-4.电解反应中反应物的判断——放电顺序⑴阴极 A.阴极材料 (金属或石墨 )总是受到保护。
B.阳离子得电子顺序—金属活动顺序表的反表:2+2+3+2+2+2+2+2+2++K+ <Ca < Na+ < Mg < Al < (H+) < Zn< Fe < Sn< Pb< Cu< Hg< Ag⑵阳极 A.阳极材料是惰性电极(C、 Pt、Au、 Ti 等 )时:阴离子失电子: S2->I-> Br-> Cl-> OH-> NO3-等含氧酸根离子> F-B.阳极是活泼电极时:电极本身被氧化,溶液中的离子不放电。
5.电解反应方程式的书写步骤:①分析电解质溶液中存在的离子;②分析离子的放电顺序;③确定电极、写出电极反应式;④写出电解方程式。
如:电解PH 增大解 NaCl 溶液: 2NaCl+2H2O ====H2↑ +Cl2↑ +2NaOH,溶质、溶剂均发生电解反应,电解PH 减小。
⑵电解 CuSO4溶液: 2CuSO4 + 2H2O====2Cu + O2↑ + 2H2SO4溶质、溶剂均发生电解反应,电解⑶电解 CuCl2溶液: CuCl2==== Cu+ Cl2↑电解PH 增大。
电解盐酸:2HCl ==== H2↑+ Cl2↑溶剂不变,实际上是电解溶质,电解PH分别减⑷电解稀 H2SO4、NaOH 溶液、 Na2 SO4溶液: 2H2O==== 2H2↑ + O2↑,溶质不变,实际上是电解水,小、增大、不变。
酸、碱、盐的加入增加了溶液导电性,从而加快电解速率(不是起催化作用)。
电解⑸电解熔融NaOH: 4NaOH ====4Na + O2↑ + H2O↑电解⑹用铜电极电解 Na 2SO 4 溶液 :Cu +2H 2O==== Cu(OH)2 + H 2↑ (注意:不是电解水。
)6.电解液的 PH 变化 :根据电解产物判断。
口诀:“有氢生成碱, 有氧生成酸; 都有浓度大 ,都无浓度小” 。
(“浓度大”、“浓度小”是指溶质的浓度)7.使电解后的溶液恢复原状的方法:先让析出的产物(气体或沉淀)恰好完全反应,再将其化合物投入电解后的溶液中即可。
如:①NaCl 溶液:通HCl 气体(不能加盐酸) ;② AgNO 3 溶液:加 Ag 2O 固体(不能加 AgOH );③ CuCl 2 溶液:加 CuCl 2 固体;④ KNO 3 溶液: 加 H 2O ;⑤ CuSO 4 溶液: CuO (不能加 Cu 2O 、 Cu(OH)2、 Cu 2(OH)2CO 3)等。
8.电解原理的应用A 、电解饱和食盐水(氯碱工业)⑴反应原理阳极: 2Cl - - 2e -== Cl 2↑ 阴极: 2H+ + 2e -== H 2↑电解总反应: 2NaCl+2H 2O====H 2↑+Cl 2↑ +2NaOH⑵设备 (阳离子交换膜电解槽)①组成:阳极 —Ti 、阴极 —Fe ②阳离子交换膜的作用:它只允许阳离子通过而阻止阴离子和气体通过。
