热学
热学

第一章 温度
1.系统和外界
孤立系、封闭系、开放系。
2.平衡状态
一孤立系经过一段时间,会达到各种宏观性质不变化的状态, 又简称平衡态。
3.热力学第零定律
如果两个系统中的每一个都与第三个系统处于热平衡,它们彼 此也必定处于热平衡。
4.温度
温度是决定一个系统是否能与其他系统处于热平衡的宏观物理 性质。
5.理想气体状态方程
(D)温度相同,但但氦气的压强小于氮气的压强;
t
3 kT 2
PV= mRT/M P=RT /M
一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们 都处在平衡状态,则它们: (A)温度相同,压强相同;(B)温度相同,压强都不相同; (C)温度相同,但氦气的压强大于氮气的压强;
(D)温度相同,但但氦气的压强小于氮气的压强;
4. 热力学第一定律:
Q E2 E1 A
dQ dE dA
5. 循环过程:
热循环——系统从高温热源吸热,对外做功,向 低温热源放热
致冷循环——系统从低温热源吸热,接受外界 做 功,向高温热源放热 热循环:系统从高温热源吸热Q1,对外做功A,向低温热源放 热Q2,效率为 Q A = 1 2 Q1 Q1
卡诺定理:
(1).工作在两个恒温热源之间卡诺热机的效率最高。 (2).工作在两个恒温热 源之间的所有卡诺热机的效率相等, 只与温度有关,与工作物质无关。
热力学第一定律
过程
等容 等压
E
CV ,m T
CV ,m T
A
0
Q
CV ,m T
p(V2 V1 ) C p ,m T
V2 V2 RT ln RT ln V1 V1
初中物理热学知识点

初中物理热学知识点初中物理知识点:热学热学一、热现象:(一.)温度:1.物理意义:表示物体的冷热程度。
2.单位;摄氏度( ℃ )。
3.测量工具:温度计;4.温度计(1)制作原理:利用液体的胀热冷缩。
(2)常用种类:实验用温度计(测量范围:0℃~100℃)、体温计(测量范围:35℃~42℃)、寒暑表(测量范围:-30℃~50℃)。
(3)使用方法:使用前------使用时-------5.体温计的特殊结构:(1)三棱形的柱体(起放大液体的作用,容易观察液面的位置);(2)缩口——液泡和毛细管之间有一段非常细的部分(作用:上升到毛细管的水银不能自动回到玻璃泡内,在缩口处被切断)。
6.使用方法:使用前必须先向下甩一甩,读数时可以离开人体读)。
(二)物态变化:1.熔化:固变液,吸热,(晶体有熔点,熔化时吸热,但温度保持不变,非晶体没有熔点,熔化时吸热,但温度一直升高)。
2.凝固:液变固,放热。
3.汽化:液变气,吸热。
(1)两种方式;蒸发和沸腾。
(2)蒸发:A.条件:任何温度,只在液体的表面。
B.影响蒸发快慢的因素:液体温度、表面积、液面上的气流。
(3)沸腾:A.条件:达到沸点,继续吸热,液体表面和内部同时发生的。
B .影响沸腾的因素:液体表面上气压的大小(气压越大,沸点越高)。
4液化:气变液,放热。
(1)液化方法:A.降温 B.压缩体积(2)例如:“白气”、雾、露。
液化气。
二、热和能:1.分子动理论:(1)物质是由分子组成的;(2)一切物质的分子都在不停地做无规则运动 (扩散现象表明分子在不停地运动着;温度越高,分子运动越激烈,扩散现象越明显。
)(3)分子间有相互作用的引力和斥力2、内能:(1)概念:物体内部所有分子热运动的动能和势能的总和。
(2)内能大小与温度有关:同一个物体温度越高,内能越大。
(3)改变物体内能的方式有:做功和热传递。
(在热传递过程中传递能量的多少叫热量,单位是焦耳J。
物体间只要有温度差存在就有热传递发生。
大学热学知识点总结

等温压缩系数 K T M-1 f VV dP压强系数:v J (虫)Vp dT线膨胀系数:=1(dL )p 通常:V =3:-l dT热力学第零定律:在不受外界影响的情况下,只要A 和B 同时与C 处于热平衡,即使B 没有接触,它们仍然处于热平衡状态,这种规律被称为热力学第零定律。
1)「 选择某种测温物质,确定它的测温属性; 经验温标二要素:J 2选定固定点;3)进行分度,即对测温属性随温度的变化关系作出规定。
经验温标:理想气体温标、 华氏温标、兰氏温标、摄氏温标(热力学温标是国际实用温标不是经验温标 )理想气体物态方程N A =6.02 1023 个 /mol理想气体微观模型1分子本身线度比起分子间距小得多而可忽略不计23洛喜密脱常数 :n o 6.02― m ° = 2.7 1025 m22.4X10距离:11 3_9 =(25)3m =3.3 10 m2.7 10251 13 3 3M m 3-10r =( )3 =( —)3 =2.4 10 m'4 兀 n'4 兀 PN A2、 除碰撞一瞬间外,分子间互作用力可忽略不计。
分子在两次碰撞之间作自由的匀速直线 运动;3、 处于平衡态的理想气体,分子之间及分子与器壁间的碰撞是完全弹性碰撞;热学复习大纲二丄(巴) V dT PV =;RT二恒量 RTp = nkT P 0V 0R= —=8.31 J/mol K To »M = Nm, M m = N A m R _23k=1.38X10 J / KN An 为单位体积内的数密度标准状态下分子间平均11 3L =( )3氢分子半径体膨胀系数4、分子的运动遵从经典力学的规律 :在常温下,压强在数个大气压以下的气体,一般都能很好地满足理想气体方程。
处于平衡态的气体均具有分子混沌性单位时间内碰在单位面积器壁上的平均分子数名师整理 精华知识点6P P i =RTV m -b人P i =[单位时间内碰撞在单位 面积上平均分子数nAt 时间内碰在 AA 面积器壁上的平均分子数N = Avt 丄6单位时间碰在单位面积器壁上的平均分子数 N Atnv以后可用较严密的方法 得到]二巴42 - 统计关系式n rp = — n 名 k1 ~2分子平均平动动能 ;=理想气体物态方程的另 一种形式p = nkTRk 二兀十8 10‘J K 」,k 为玻尔兹曼常数 温度的微观意义JmV 2 亠绝对温度是分子热运动剧烈程度的度量是分子杂乱无章热运动的平均平动动能,它不包括整体定向运动动能。
热学

§2.2.1 理想气体分子模型和统计假设
理想气体:宏观上指:压强不太大,温度不太低的气体; 理想气体:宏观上指:压强不太大,温度不太低的气体; 在常温下,压强在数个大气压以下的气体, 在常温下,压强在数个大气压以下的气体,一般都能很好地满 足理想气体。 足理想气体。
一、理想气体的分子模型
1、分子本身尺寸比分子间距小得多而可忽略不计——质点; 分子本身尺寸比分子间距小得多而可忽略不计——质点; ——质点 2、除碰撞一瞬间外,分子间互作用力可忽略不计。分子重力 除碰撞一瞬间外,分子间互作用力可忽略不计。 也忽略不计。 分子两次碰撞之间作自由的匀速直线运动; 也忽略不计。 分子两次碰撞之间作自由的匀速直线运动; 3、处于平衡态的理想气体,分子之间及分子与器壁间的碰撞是 处于平衡态的理想气体, 完全弹性碰撞 分子可视为弹性小球 弹性小球); 完全弹性碰撞 (分子可视为弹性小球); 重力势能忽略不计; 4、分子的运动遵从经典力学的规律 ,重力势能忽略不计;
11
§2.1 分子运动的基本概念
一、分子数密度和分子线度
实验表明: 的任何物质所含有的分子数目相同, 实验表明:1mol的任何物质所含有的分子数目相同,且为阿 的任何物质所含有的分子数目相同 伏加德罗常数: 伏加德罗常数: 23
N A = 6.02 ×10 个 / mol
分子数密度:单位体积内的分子数,用n表示; 表示; 分子数密度:单位体积内的分子数, 表示 根据结构,分子可分为三类: 根据结构,分子可分为三类: -----单原子分子:惰性气体,He、Ne、Ar、Kr、Xe 单原子分子: 单原子分子 惰性气体, 、 、 、 、 -----双原子分子:H2、N2、O2、 双原子分子: 双原子分子 多原子分子: -----多原子分子:H2O、CO2、CH4 多原子分子 、
初中物理热学知识
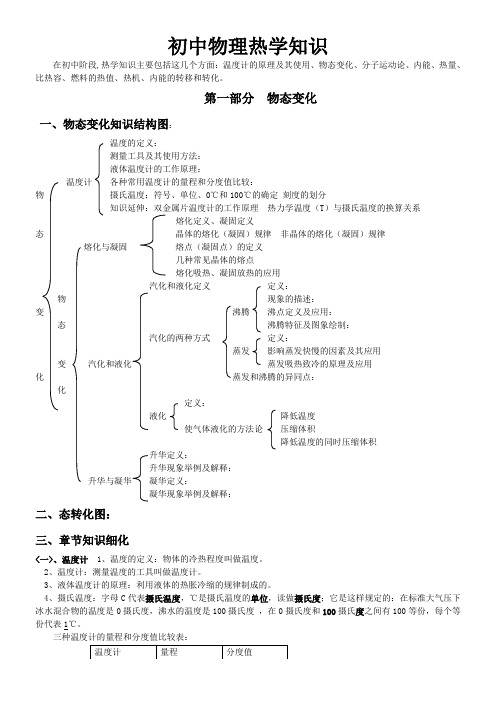
初中物理热学知识在初中阶段,热学知识主要包括这几个方面:温度计的原理及其使用、物态变化、分子运动论、内能、热量、比热容、燃料的热值、热机、内能的转移和转化。
第一部分物态变化一、物态变化知识结构图:温度的定义:测量工具及其使用方法:液体温度计的工作原理:温度计各种常用温度计的量程和分度值比较:物摄氏温度:符号、单位、0℃和100℃的确定刻度的划分知识延伸:双金属片温度计的工作原理热力学温度(T)与摄氏温度的换算关系熔化定义、凝固定义态晶体的熔化(凝固)规律非晶体的熔化(凝固)规律熔化与凝固熔点(凝固点)的定义几种常见晶体的熔点熔化吸热、凝固放热的应用汽化和液化定义定义:物现象的描述:变沸腾沸点定义及应用:态沸腾特征及图象绘制:汽化的两种方式定义:蒸发影响蒸发快慢的因素及其应用变汽化和液化蒸发吸热致冷的原理及应用化蒸发和沸腾的异同点:化定义:液化降低温度使气体液化的方法论压缩体积降低温度的同时压缩体积升华定义:升华现象举例及解释:升华与凝华凝华定义:凝华现象举例及解释:二、态转化图:三、章节知识细化<一>、温度计1、温度的定义:物体的冷热程度叫做温度。
2、温度计:测量温度的工具叫做温度计。
3、液体温度计的原理:利用液体的热胀冷缩的规律制成的。
4、摄氏温度:字母C代表摄氏温度,℃是摄氏温度的单位,读做摄氏度;它是这样规定的:在标准大气压下冰水混合物的温度是0摄氏度,沸水的温度是100摄氏度,在0摄氏度和100摄氏度之间有100等份,每个等份代表1℃。
三种温度计的量程和分度值比较表:5、温度计的使用:使用前,①观察量程②观察分度值;使用方法:浸、稳、留、平浸:.玻璃泡要全部浸入液体中,不要碰到容器底或壁稳:.要等温度计的示数稳定后再读数留:读数时玻璃泡要留在被测液体中平:视线与温度计中液柱的上表面相平6、双金属片温度计的工作原理:根据铜片和铁片膨胀系数不同,在受热相同的情况下,铜片膨胀较快而向铁片方向弯曲。
物理高中热学公式

物理高中热学公式1. 热力学第一定律:ΔU = Q + W,其中ΔU为内能变化,Q为系统与外界交换的热量,W为系统所做的功。
2. 热力学第二定律:ΔS = Q/T,其中ΔS为系统熵的变化,Q为热量,T为温度。
3. 热容:C = Q/ΔT,其中C为热容,Q为系统吸收或释放的热量,ΔT为温度变化量。
4. 比热容:c = C/m,其中m为物体的质量。
5. 热传导定律:Q = kAΔT/x,其中Q为热量,k为热导率,A为面积,ΔT为温度差,x为导热距离。
6. 热辐射定律:P = σA(T^4 – T0^4),其中P为单位时间内辐射的能量,σ为斯蒂芬—玻尔兹曼常数,A为发射体参考面积,T为发射体温度,T0为参考温度。
7. 热力学循环效率:η = (W净 / Q热) × 100%,其中W净为系统净工作量,Q热为系统吸收的热量。
8. 热力学效率公式:η = (T1 – T2) / T1,其中T1为热源温度,T2为冷源温度。
9. 热平衡方程:m1c1ΔT1 = m2c2ΔT2,其中m为物体的质量,c为比热容,ΔT为温差。
10. 热力学势公式:G = H – TS,其中G为吉布斯自由能,H为焓,T为温度,S为熵。
11. 熵变公式:ΔS = Qrev / T,其中ΔS为系统的熵变,Qrev为可逆过程吸放热量,T为温度。
12. 等温过程:Q = W,即等温过程中外界对系统所做的功等于系统吸收的热量。
13. 等体过程:W = 0,即等体过程中系统不做功,热量全部转化为内能。
14. 等压过程:W = PΔV,即等压过程中外界对系统所做的功等于压力乘以体积的变化量。
15. 等焓过程:Q = ΔH,即等焓过程中外界与系统的热交换量等于系统焓的变化量。
热学 第一章 导论

我国殷商时期
五行学说:金、木、水、 火、土是构成世界万物的五种基本元素, 称为五行。中国古代提出的元气说,就认 为热(火) 是物质元气聚散变化的表现。
3
从钻木取火到商周的青铜器
伽利略温度计 16世纪 (明)
4
清 初
瓦特早期蒸汽机
5
6
1807年
嘉庆12年
7
1823年
道光3年
8
1892年
33
三、热力学温标 1. 热力学温标是建立在第二定律基 础上,不 依赖于任何物质的特性 的温标。 2. 热力学温度国际单位为“开尔 文”,简称开.记为K 3. 可证明在理想气体温标有效范围 内,热力学温标与理想气体温标 完全一致。 不依赖于测温物质和测温属性的温标
34
开尔文
四、摄氏温标、华氏温标与兰氏温标
V=V0 1 p t
m,p一定
m,V 一定
22
p p0 1 V t
二、理想气体物态方程
p1V1 p2V2 常量 T1 T2
令1mol气体的常量为R
pVm RT R=8.31 Jmol 1K 1
若气体的物质的量为
普适气体 常量
与热力学温度 的关系
T=T
通用 情况 国际 通用
热力学温度 K
摄氏温标 华氏温标
C F
t
tF - 459.67 0
32.00 32.02
t T 273 .15 100.00 0 C K t 9 T 459 .67 英美 212.00 0 F 5 K 等国
兰氏温标 R TR
491.67 491.69 67初步知识 • 液体、固体、相变等物性学
大学热学物理知识点总结

大学热学物理知识点总结1.热力学基本定律热力学基本定律是热学物理的基础,它包括三个基本定律,分别是热力学第一定律、热力学第二定律和热力学第三定律。
(1)热力学第一定律热力学第一定律是能量守恒定律的热学表述,它规定了热力学系统能量的守恒性质。
简单地说,热力学第一定律表明了热力学系统能量的增减只与系统对外界做功和与外界热交换有关。
热力学第一定律的数学表达式为ΔU=Q-W,其中ΔU表示系统内能的增量,Q表示系统吸热的大小,W表示系统对外界所作的功。
由此可以看出,系统的内能变化量等于吸收热量减去做的功。
(2)热力学第二定律热力学第二定律是热力学系统不可逆性的表述,它规定了热力学系统内部的熵增原理,即系统的熵不会减小,而只会增加或保持不变。
简单地说,热力学第二定律表明了热力学系统内部的任何一种热力学过程都是不可逆的。
这意味着热力学系统永远无法使热量全部转化为功,总会有一部分热量被转化为无效热。
热力学第二定律还表明了热力学过程的方向性,即热量只能从高温物体传递到低温物体,而不能反向传递。
(3)热力学第三定律热力学第三定律规定了当温度趋于绝对零度时,任何物质的熵都将趋于一个有限值,这个有限值通常被定义为零。
简单地说,热力学第三定律表明了在绝对零度时,任何系统的熵都将趋于零。
热力学第三定律的提出对于热学物理的研究具有非常重要的意义,它为我们理解热学系统的性质提供了重要的基础。
2.热力学过程热力学过程是指热力学系统内部发生的一系列变化,包括各种状态参数的变化和热力学系统对外界的能量交换。
常见的热力学过程有等温过程、绝热过程、等容过程和等压过程等。
这些过程在日常生活以及工业生产中都有着广泛的应用。
(1)等温过程等温过程是指在恒定温度下进行的热力学过程。
在等温过程中,系统对外界做的功和吸收的热量之比是一个常数。
这意味着等温过程的压强和体积成反比,在P-V图上表现为一条双曲线。
常见的等温过程有等温膨胀和等温压缩等。
(2)绝热过程绝热过程是指在无热交换的情况下进行的热力学过程。
热学PPT课件

(2) Plato: The fire is a kind of athletic manifestation
▪ At the beginning of 18 centuries, has the caloric theory says
The middle of 18 centuries, the first law of thermodynamics: The conservation law of energy; The second law of thermodynamics: Concerning the thermal process is irreversible.
3
Thermal physics investigate is a system that constituted by a large numbers of particles.
For example: one mole of material includes 6.02 1023 molecules, supposing a superman
4
thermal physics has two different kinds of describe methods: macroscopic and microscopic.
From observe and experiment summary come out with the thermal phenomenon regulation, constitute macroscopic theories of the thermal phenomenal, be called the thermodynamics. Statistical physics is the microscopic method to thermal physics.
热学-(PDF)

一. 重力场中粒子数按高度的分布
在重力场中
分子热运动使分子在空间趋于均匀分布 重力作用使分子趋向地面降落
当二种作用共存达到平衡态时,分子在空间形成一种 非均匀的稳定分布:
从统计规律看:粒子总是优先占据低能量状态
ε ↘ ,dN ↗
18
出现的几率最大) ,最大多数分子所具有的速率。
从极值条件 d dv
f (v) = 0 求出:vp
f (v) = 4π (
μ
3
)2
− μv2
⋅ e 2kT
⋅v2
2π kT
vp =
2kT =
μ
2kN0T =
μ N0
2RT M mol
= 1.41 RT M mol
T
与
有关
Mmol (气体种类)
9
从 vp 的物理意义来分析分布曲线和 T、μ 的关系:
这是粒子关于位置的分布的规律. 常称为玻耳兹曼分布律。 它表明,在势场中的分子总是优先占据势能较低的状态。
17
三. 麦克斯韦–玻耳兹曼分布律
平衡态下温度为 T 的气体中,位置在 x~x+dx, y~y+dy, z~z+dz 中, 且速度在 vx ~ vx+dvx , vy ~ vy+dvy ,vz ~ vz+dvz 区间的分子数为
2
v
而不是:ε = 1 μv 2
2
12
3. 讨论 1。说出下列各式的物理意义 f (v) 在速率v 处,单位速率区间内的分子数占总分子数的百分比
大学物理热学知识点

大学物理热学知识点一、理论基础力学1、运动学参照系。
质点运动的位移和路程,速度,加速度。
相对速度。
矢量和标量。
矢量的制备和水解。
匀速及匀速直线运动及其图象。
运动的合成。
抛体运动。
圆周运动。
刚体的对应状态和绕定轴的旋转。
2、牛顿运动定律力学中常用的几种力牛顿第一、二、三运动定律。
惯性参照系的概念。
摩擦力。
弹性力。
胡克定律。
万有引力定律。
光滑球壳对壳内和壳外质点的引力公式(不建议求出)。
开普勒定律。
行星和人造卫星的运动。
3、物体的平衡共点力促进作用下物体的均衡。
力矩。
刚体的均衡。
战略重点。
物体平衡的种类。
4、动量冲量。
动量。
动量定理。
动量守恒定律。
反冲运动及火箭。
5、机械能功和功率。
动能和动能定理。
重力势能。
引力势能。
质点及光滑球壳壳内和壳外的引力势能公式(不建议求出)。
弹簧的弹性势能。
功能原理。
机械能守恒定律。
相撞。
6、流体静力学恒定流体中的应力。
浮力。
7、振动简揩振动。
振幅。
频率和周期。
位相。
振动的图象。
参考圆。
振动的速度和加速度。
由动力学方程确认四极振动的频率。
阻尼振动。
受迫振动和共振(定性了解)。
8、波和声横波和纵波。
波长、频率和波速的关系。
波的图象。
波的干预和绕射(定性)。
声波。
声音的响度、音调和音品。
声音的共鸣。
乐音和噪声。
热学1、分子动理论原子和分子的量级。
分子的热运动。
布朗运动。
温度的微观意义。
分子力。
分子的动能和分子间的势能。
物体的内能。
2、热力学第一定律热力学第一定律。
3、气体的性质热力学温标。
理想气体状态方程。
普适气体恒量。
理想气体状态方程的微观解释(定性)。
理想气体的内能。
理想气体的等容、等压、等温和绝热过程(不要求用微积分运算)。
4、液体的性质流体分子运动的特点。
表面张力系数。
浸润现象和毛细现象(定性)。
5、液态的性质晶体和非晶体。
空间点阵。
液态分子运动的特点。
6、物态变化熔融和凝结。
熔点。
熔解热。
蒸发和凝结。
饱和汽压。
沸腾和沸点。
汽化热。
临界温度。
液态的升华。
空气的湿度和湿度计。
热学知识点及题目

一、分子热运动:1、物质是由分子组成的。
分子若看成球型,其直径以10-10m来度量。
2、一切物体的分子都在不停地做无规则的运动①扩散:不同物质在相互接触时,彼此进入对方的现象。
②扩散现象说明:A分子之间有间隙。
B分子在做不停的无规则的运动。
③课本中的装置下面放二氧化氮这样做的目的是:防止二氧化氮扩散被误认为是重力作用的结果。
实验现象:两瓶气体混合在一起颜色变得均匀,结论:气体分子在不停地运动。
④固、液、气都可扩散,扩散速度与温度有关。
⑤分子运动与物体运动要区分开:扩散、蒸发等是分子运动的结果,而飞扬的灰尘,液、气体对流是物体运动的结果。
3、分子间有相互作用的引力和斥力。
①当分子间的距离d=分子间平衡距离r ,引力=斥力。
②d<r时,引力<斥力,斥力起主要作用,固体和液体很难被压缩是因为:分子之间的斥力起主要作用。
③d>r时,引力>斥力,引力起主要作用。
固体很难被拉断,钢笔写字,胶水粘东西都是因为分子之间引力起主要作用。
④当d>10r时,分子之间作用力十分微弱,可忽略不计。
破镜不能重圆的原因是:镜块间的距离远大于分子之间的作用力的作用范围,镜子不能因分子间作用力而结合在一起。
二、内能:1、内能:物体内部所有分子做无规则运动的动能和分子势能的总和,叫做物体的内能。
2、物体在任何情况下都有内能:既然物体内部分子永不停息地运动着和分子之间存在着相互作用,那么内能是无条件的存在着。
无论是高温的铁水,还是寒冷的冰块。
3、影响物体内能大小的因素:①温度:在物体的质量,材料、状态相同时,温度越高物体内能越大。
②质量:在物体的温度、材料、状态相同时,物体的质量越大,物体的内能越大。
③材料:在温度、质量和状态相同时,物体的材料不同,物体的内能可能不同。
④存在状态:在物体的温度、材料质量相同时,物体存在的状态不同时,物体的内能也可能不同。
4、内能与机械能不同:机械能是宏观的,是物体作为一个整体运动所具有的能量,它的大小与机械运动有关内能是微观的,是物体内部所有分子做无规则运动的能的总和。
热学的研究对象和研究方法

02 热学的基本概念
温度与热量
温度
表示物体热度的物理量,常用的温度单位有摄氏度、华氏度和开 尔文。
热量
物体之间由于温差而转移的能量,单位是焦耳。
温度与热量之间的关系
热量是物体之间温度差的表现,热量转移的方向总是从温度高的物 体流向温度低的物体。
热容与热传导
1 2 3
热容
表示物体吸收或释放热量的能力,分为质量热容 和比热容。
THANKS FOR WATCHING
感谢您的观看
热设计
在产品设计过程中,需要考虑材料的热性能,如导热性、比热容等,以及产品在工作过程中产生的热量,这些都 需要用到热学的知识。
05 热学的发展趋势和挑战
新型热学材料的研发
总结词
新型热学材料的研发是当前热学领域的重要发展趋势之一,旨在寻找具有优异热性能和功能特性的新 材料,以满足不断增长的技术需求。
计算机模拟法通常需要建立计算机模型、编写程序、进行模拟计算,并对结果进 行可视化展示和分析。
04 热学在各领域的应用
能源领域
热能转换与利用
热学在能源领域中主要涉及热能与其 他形式能量的转换与利用,如热力发 电、热泵等。
节能技术
通过热学原理,开发各种节能技术, 如热回收、热能梯级利用等,提高能 源利用效率。
热学的研究对象和研究方法
目 录
• 热学的研究对象 • 热学的基本概念 • 热学的研究方法 • 热学在各领域的应用 • 热学的发展趋势和挑战
01 热学的研究对象
热现象
热现象 热学主要研究物体热运动、热量 传递、物质相变等现象,这些现 象与温度有关,是热力学系统中 的基本物理现象。
物质相变 物质在不同温度和压力下会发生 相变,如熔化、凝固、蒸发和凝 结等现象,热学研究这些相变过 程的规律。
热学 (7 第九章 相变)

四、气液两相图
汽化曲线, 是液态和气态的分界线
饱和蒸汽压与温度的关系 沸点与外界压强的关系
汽化曲线终点就是临界点K 汽化曲线始点O是三相点
§9.3 克拉珀龙方程
一、方程的推导
两相平衡时的温度T和压强p有函数关系,相平衡曲线
气液二相图 汽化曲线
固液二相图 熔化曲线
Q1 ml
A m(2 1) p
在凹(凸)液面情况下,分 子由气相进入液相的概率比 平页面情况的概率大(小)
3、过饱和蒸气、凝结核、云室
若没有足够的凝结核,或凝结核过小,即使蒸气压强超过 该温度下的饱和蒸气压,液滴仍不能形成并长大,因而出现 过饱和现象,这样的蒸气称为过饱和蒸气压,或过冷蒸气。
4、云及人工降雨
暖云:大小水滴共存 冷云:由冰晶组成 混合云:由冰晶和水滴组成
pk
Vmk
Tk
pk
a
V2 2 mk
Vmk
b
R Tk
a 27b2
a
2 9b2
3b
b
R
8a 27bR
对比物态方程
3
2
3
1
8
对应态定理: 一切物质在相同的对比压强和对比温度下, 就有相
同的对比体积了.
8a Tk 27bR Vmk 3b
a pk 27b2
临界比容:液态的最大比容 临界压强:液态的最大饱和蒸汽压 临界温度:等温压缩使气体液化的最高温度
pk, k Tk之间的关系
临界系数
热学主要知识点

热学主要知识点1、熔化:物质从固态变成液态的过程叫做熔化。
(1)固体分晶体和非晶体两类:①晶体:有确定的熔化温度的固体叫晶体。
常见的晶体:海波、冰、雪花、石英、水晶、食盐、明矾、萘、各种金属。
②非晶体:没有确定的熔化温度的固体叫非晶体。
常见的非晶体:松香、塑料、橡胶、玻璃、蜂蜡、沥青等。
(2)晶体的熔化:①晶体在熔化过程中保持在一定的温度,这个温度叫熔点。
②晶体熔化的条件:温度达到熔点,继续吸热。
③晶体熔化的特点:晶体在熔化过程中吸热温度保持不变。
(3)非晶体的熔化:①非晶体在熔化过程中没有一定的温度,温度会一直升高。
②非晶体熔化的特点:吸热,先变软,然后逐渐变稀成液态,温度不断长升高,没有固定的熔化温度(即没有熔点)。
2、汽化:物质从液态变为气态的过程叫汽化。
(1)汽化的两种方式:沸腾和蒸发①沸腾:沸腾是在一定温度下在液体内部和表面同时发生的剧烈的汽化现象。
a. 沸点:液体沸腾时的温度叫沸点。
不同的液体沸点不同;同一种液体的沸点还与液面上方的气压有关系。
b. 液体沸腾的条件:一是温度达到沸点,二是需要继续吸热。
c. 液体沸腾时吸热温度保持在沸点不变。
d.液体沸腾前,气泡(溶在液体中的气体)上升过程中越来越小,甚至消失;沸腾后,液体内部有大量的气泡生成,(液体内部发生剧烈的汽化作用)气泡在上升过程中由于有大量的气体进入,越来越大。
②蒸发:在任何温度下都能发生的且只在液体表面发生的缓慢的汽化现象。
a. 影响蒸发发快慢的因素:液体的温度越高蒸发越快(如洗过的衣服夏天比冬天干得快);液体的表面积越大蒸发越快(晒衣服要展开,晒粮食要摊薄);液体表面上的空气流动越快蒸发越快(有风的日子洗过的衣服干得快)晾衣服,吹头是很典型多因素加快蒸发。
b. 蒸发的特点:在任何温度下都能发生;只发生在液体表面;是一种缓慢的汽化现象;蒸发吸热。
c. 蒸发致冷:是指液体蒸发时要从周围或自身吸收热量,从而使周围物体或自身温度下降。
《 热学》各章思考题+参考解答

热学思考题和参考解答第一章 热学基础知识和温度1.1 若热力学系统处于非平衡态,温度概念能否适用?【答】 对于处于非平衡态的系统,只要局域平衡条件能满足,则对于处于局域平衡的每个子系统来说,温度概念仍能适用。
1.2 系统A 和B 原来各自处在平衡态,现使它们互相接触,试问在下列情况下,两系统接触部分是绝热的还是透热的,或两者都可能?(1)当A V 保持不变,A p 增大时,B V 和B p 都不发生变化;(2)当A V 保持不变,A p 增大时,B p 不变而B V 增大;(3)当A V 减少,A p 增大时,B V 和B p 均不变.【答】设容器都是密闭的.(1)是绝热的.因为A p A V 增大,所以A 的温度 增加.但它并不使B 状态发生变化,说明既没有热量传递也没有做功.(2)是透热的.因为A p A V 增大,所以A 的温度增加.从B 来说,B V 增加了,说明B 膨胀对外做了功,其能量只能来源于从A 吸热.(3)因为B V 和B p 均不变,说明B 的温度不变.但是A V 减少,同时A p 增大,这两者的乘积可变可不变,所以A 的温度也可变可不变.若A 的温度改变则是绝热的;若A 的温度不变,则A ,B 相互 接触的部分仍然绝热,因为B 的状态始终不变.1.3 在建立温标时是否必须规定热的物体具有较高的温度,冷的物体具有较低的温度?是否可作相反的规定?在建立温标时,是否须规定测温属性一定随温度作线性变化?【答】 在建立温标时必须规定热的物体具有较高的温度,冷的物体具有较低的温度,因为热量是从高温物体传递到低温物体的.很有意思的是,对于处于负温度的子系则是例外.因为负温度比正温度还要高,热量是从负温度物体流向正温度物体的.建立温标时并不一定规定测温属性随温度作线性变化,这完全由分度公式来规定.1.4 冰的正常溶点是多少?纯水的三相点温度是多少?【答】 冰的正常溶点是273.15K,纯水的三相点温度是273.16K 。
热学基础知识资料

V2
举例:几种特殊热力学过程的功的计算
p
1
A
V2
V1
pdV
2
等容过程:
A等容 = 0
等压过程: A等压 = p(V2-V1)
0
3
V
理想气体等温过程:
A等温 pdV V
1
V3
V3
RT
V1
V3 dV RT ln V1 V
pV RT
四. 热量
系统和外界温度不同,就会传热,或称能量交换, 热量传递 也可以改变系统的状态。 传热过程中所传递的能量的多少叫热量,以Q(或 Q )表示, 热量传递的方向用Q的符号表示。 > 0 表示系统从外界吸热; < 0 表示系统向外界放热。
n个方程相加得:
( p1 p2 pn )V (v1 v2 vn ) RT
道尔顿分压定理
n n
令
p pi v vi
1 1
pV vRT
形式不变
§6.3 热力学第一定律
一. 准静态过程 一个热力学系统处于平衡态(即静态),可用状态参 量P、T、V来定量地加以描述。 当系统的状态随时间变化时,我们就说系统在经历一 个热力学过程,简称过程。 u 例:推进活塞压缩汽缸内的气体时, 气体的体积、密度、温度、压强都 将变化,在过程中的任意时刻,气 体各部分的密度、压强、温度都不 完全相同。因而,原则上讲,任意时刻,系统作为一个整体, 无法用统一的状态参量来描述其状态. 一个过程,如果任意时刻的中间态都无限接近于一个 平衡态,则此过程为准静态过程。显然,这种过程只 有在进行的 “ 无限缓慢 ” 的条件下才可能实现。
§6.1 热学基础知识概述 热学:包括热力学(宏观)和统计物理(微观) 一. 热现象
热学总结

E 3RT
2
E 5RT
2
E 3RT
麦克斯韦速率分布函数:
f
v
dN Ndv
4 ( m 2 kT
) v e 3/2
2
m v2 2kT
---- 概率密度
明确表达式的物理意义:
(1)nf (v)dv
(2)
Nf
(v)dv
(3) n
v2 v1
f (v)dv (4)
N v2 v1
f (v)dv
气体的三种统计速率: a.最概然速率大小: vp
Cp, m =
R
2
单位:J/K
Cv
dQ dT
v
i Cv, m = R
2
C p,m CV ,m R
Cp, m
Cv, m
比热比
等值过程 绝热过程 循环过程 等温: dE = 0 dQ = dA Q = A RTln V2
V1
等压: dA = PdV A = P(V2 -V1)
dQ Cp, mdT Q = Cp, mT
子数为0,则: (A)a = N / (2 v 0). (B) a = N / (3 v 0). (C)a = N / (4 v 0). (D) a = N /(5v0).
Nf(ห้องสมุดไป่ตู้)
答:[ B ]
a
2a/3
a/3 O
v
v0 2v03v0 4v0 5v0
P5 5. 金属导体中的电子,在金属内部作无规则运动,
热学总结
一:基本概念 二:热力学第一定律
三:热力学第二定律
一:基本概念
宏观: 热力学第零定律: ~
温度T: 反映物质分子运动的剧烈程度。
热学知识点

热学十热现象(一)温度1、温度表示物体的冷热程度温度:温度是用来表示物体冷热程度的物理量;注:热的物体我们说它的温度高,冷的物体我们说它的温度低,若两个物体冷热程度一样,它们的温度亦相同;我们凭感觉判断物体的冷热程度一般不可靠;2、摄氏温度:(1)我们采用的温度是摄氏温度,单位是摄氏度,用符号“℃”表示;(2)摄氏温度的规定:把一个大气压下,冰水混合物的温度规定为0℃;把一个标准大气压下沸水的温度规定为100℃;然后把0℃和100℃之间分成100等份,每一等份代表1℃。
(3)摄氏温度的读法:如“5℃”读作“5摄氏度”;“-20℃”读作“零下20摄氏度”或“负20摄氏度”物态变化:物质在固、液、气三种状态之间的变化;固态、液态、气态在一定条件下可以相互转化。
物质以什么状态存在跟物体的温度有关。
(二)熔化和凝固:1、熔化和凝固现象物质从固态变为液态叫熔化;从液态变为固态叫凝固;2、晶体、非晶体熔化和凝固的区别固体可分为晶体和非晶体;晶体:熔化时有固定温度(熔点)的物质;非晶体:熔化时没有固定温度的物质;晶体和非晶体的根本区别是:晶体有熔点(熔化时温度不变继续吸热),非晶体没有熔点(熔化时温度升高,继续吸热);3、晶体的熔点熔点:晶体熔化时的温度;同一晶体的熔点和凝固点相同;4、熔化过程中吸热、凝固过程中放热熔化和凝固是可逆的两物态变化过程;熔化要吸热,凝固要放热;晶体熔化的条件:温度达到熔点;继续吸收热量;晶体凝固的条件:温度达到凝固点;继续放热;(三)汽化和液化1、蒸发现象蒸发:在任何温度下都能发生,且只在液体表面发生的缓慢的汽化现象2、影响蒸发快慢的因素(1)、与液体温度高低有关:温度越高蒸发越快(夏天洒在房间的水比冬天干的快;在太阳下晒衣服快干);(2)、跟液体表面积的大小有关,表面积越大,蒸发越快(凉衣服时要把衣服打开凉,为了地下有积水快干要把积水扫开);(3)、跟液体表面空气流速的快慢有关,空气流动越快,蒸发越快(凉衣服要凉在通风处,夏天开风扇降温);3、蒸发过程中吸热及其应用液体在蒸发过程中要吸收热量,所以蒸发可致冷:夏天在房间洒水降温;人出汗降温;发烧时在皮肤上涂酒精降温;4、沸腾现象沸腾:在一定温度下,在液体表面和内部同时发生的剧烈的汽化现象;5、沸点、沸点与压强的关系(1)沸点:液体沸腾时的温度叫沸点;(2)不同液体的沸点一般不同;同种液体的沸点与压强有关,压强越大沸点越高(高压锅煮饭);液体沸腾的条件:温度达到沸点还要继续吸热;注:沸腾和蒸发的区别和联系:它们都是汽化现象,都吸收热量;沸腾在一定温度下才能进行;蒸发在任何温度下都能进行;沸腾在液体内部、外部同时发生;蒸发只在液体表面进行;沸腾比蒸发剧烈;6、沸腾过程中吸热7、液化现象物质从气态变为液态的现象是液化现象8、液化过程中放热注:液化的方法:(1)降低温度;(2)压缩体积(增大压强,提高沸点)如:氢的储存和运输;液化气;(四)升华和凝华1、升华和凝华现象物质从固态直接变为气态叫升华;物质从气态直接变为固态叫凝华2、升华过程中吸热、凝华过程中放热(1)升华吸热,凝华放热;(2)升华现象:樟脑球变小;冰冻的衣服变干;人工降雨中干冰的物态变化;(3)凝华现象:雪的形成;北方冬天窗户玻璃上的冰花(在玻璃的内表面)注:云、霜、露、雾、雨、雪、雹、“白气”的形成温度高于0℃时,水蒸汽液化成小水滴成为露;附在尘埃上形成雾;温度低于0℃时,水蒸汽凝华成霜;水蒸汽上升到高空,与冷空气相遇液化成小水滴,就形成云,大水滴就是雨;云层中还有大量的小冰晶、雪(水蒸汽凝华而成),小冰晶下落可熔化成雨,小水滴再与0℃冷空气流时,凝固成雹;“白气”是水蒸汽遇冷液化而成的十一内能和热量(一)分子运动理论分子动理论的基本观点(1)物质由分子组成的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1/ 2
=
为多少? 1∶2∶4,则其压强之比 A∶pB∶Pc 为多少? ∶ ∶ ,则其压强之比p 解:
1 2 2 p = nmv = nε 3 3
1∶4∶16 ∶ ∶
哈尔滨工程大学理学院 孙秋华
热学 2、一容器内装有N1个单原子理想气体分子和 2个刚性双 、一容器内装有 个单原子理想气体分子和N 原子理想气体分子,当该系统处在温度为T的平衡态时, 原子理想气体分子,当该系统处在温度为 的平衡态时, 的平衡态时 其内能为多少? 其内能为多少? 解.理想气体的内能是所有分子的动能总和。 理想气体的内能是所有分子的动能总和。
2.能量均分定理:在温度为T 的平衡态下1 气体分子每个 能量均分定理:在温度为 的平衡态下, 能量均分定理 , 自由度的平均动能都相等, 自由度的平均动能都相等,其大小等于 2 kT 。
哈尔滨工程大学理 6
一个分子的平 均平动动能
一个分子的平 均转动动能
一个分子的平 均动能
作业90. 有2×10 –3 m3刚性双原子分子理想气体,其内能 刚性双原子分子理想气体, 作业 × ;(2) 为6.75×10 2J. (1)试求气体的压强;( )设分子总数 × )试求气体的压强;( 求分子的平均平动动能及气体的温度. 为5.4×1022个,求分子的平均平动动能及气体的温度 ×
哈尔滨工程大学理学院
哈尔滨工程大学理学院 孙秋华
热学 压强:所有分子每秒钟施于单位面积器壁的冲量。 压强:所有分子每秒钟施于单位面积器壁的冲量。
1 2 2 p = nmv = nε 3 3
温度:标志物体内分子无规则运动的剧烈程度。 温度:标志物体内分子无规则运动的剧烈程度。 3 2 ε ε = kT ⇒ T = 2 3 k 3.内能:在一个系统内,所有分子的动能和分子间 内能: 内能 在一个系统内, 相互作用势能的总和称为系统的内能。 相互作用势能的总和称为系统的内能。 4.理想气体的内能:所有分子的动能总和。 4.理想气体的内能:所有分子的动能总和。 理想气体的内能
哈尔滨工程大学理学院 孙秋华
热学
1 2 p = nm v 2 = n ε 3 3
气体分子动理论
T = 2 3
ε
k
dN N
= f ( v ) dv
vp = 2 kT m v = 8 kT πm v2 = 3 kT m
热 学
能量均分定理
E=
M CV T M mol
热力学第一定律
V2
热力学
M Q = C V (T 2 − T 1 ) + M mol
A =
V2
∫
V
2
pdV
1
Q =
哈尔滨工程大学理学院 孙秋华
M ⋅ C V (T 2 − T 1 ) + M mol
∫
pdV
V1
热学 热力学第一定律对理想气体四个过程的应用 过程 等容 等压 等温 绝热 ∆E
M cv ∆T M mol M cv ∆T M mol
A 0
p (V2 − V1 )
Q
M cv ∆T M mol M c p ∆T M mol
3 5 E = N 1 kT + N 2 kT 2 2
哈尔滨工程大学理学院
孙秋华
热学 作业88. 容积 = 1 m 3的容器内混有 1= 1.0×10 25个 容积V 的容器内混有N 作业 × 氢气分子和N 个氧气分子,混合气体的温 氢气分子和 2 = 4.0×10 25个氧气分子 混合气体的温 × 度为400K , 求:( )气体分子的平动动能总和;( ) :(1)气体分子的平动动能总和;( ;(2) 度为 混合气体的压强. 混合气体的压强
单原子 双原子 多原子
3/2kT 3/2kT 3/2kT
0 2/2kT 3/2kT
3/2kT 5/2kT 6/2kT
1.热力学第一定律: 热力学第一定律: 热力学第一定律
Q = (E 2 − E1 ) + A
V
理想气体无摩擦的平衡过程
M (E 2 − E1 ) = ⋅ C V (T 2 − T 1 ) M mol
热学
大学物理期末 总复习二
-- 热 学
孙秋华
哈尔滨工程大学理学院 孙秋华
热学 教学要求: 教学要求
1.掌握压强和温度的微观意义。 掌握压强和温度的微观意义。 掌握压强和温度的微观意义 2.在微观方面,掌握能量按自由度均分原则,从而导出理想气体的内能公式。 在微观方面,掌握能量按自由度均分原则,从而导出理想气体的内能公式。 在微观方面 在宏观方面,掌握理想气体的内能只是温度的单值函数。 在宏观方面,掌握理想气体的内能只是温度的单值函数。理解真实气体的内 能是温度和体积的状态函数。 能是温度和体积的状态函数。 3.掌握气体分子速率的统计分布规律 3.掌握气体分子速率的统计分布规律。着重利用分布函数能计算气体分子三 掌握气体分子速率的统计分布规律。 种速率及其它的物理量。 种速率及其它的物理量。 4.掌握内能、功和热量三者的意义。了解做功和传递热量对系统内能的变化 掌握内能、功和热量三者的意义。 掌握内能 是等效的,但其本质是有区别的。内能是状态的函数。 是等效的,但其本质是有区别的。内能是状态的函数。而做功和传递热量则 与过程有关。 与过程有关。 5.从普遍的能量转换和守恒定律掌握热力学第一定律及其理想气体各等值过 从普遍的能量转换和守恒定律掌握热力学第一定律及其理想气体各等值过 程中的应用。会计算循环过程的效率。 程中的应用。会计算循环过程的效率。 6.理解热力学第二定律时,掌握热力学第二定律的微观实质。 理解热力学第二定律时,掌握热力学第二定律的微观实质。 理解热力学第二定律时
∫v
2
Nf (v ) d v +
5 v0
v0
2 2 + ∫ v Nf (v ) d v + ∫ v Nf (v ) d v + ∫ v 2 Nf (v )dv 3v 3v 4v 4 v0 2v 2v 0 1 1 1 3 2 1 3 3 = { a v 0 + a [(2v 0 ) − v 0 ] + N 3 3 3 3
孙秋华
热学 3、2.0×10-2kg氢气装在 ×10-3m3的容器内,当容器内 、 × 氢气装在4.0× 的容器内, 氢气装在 的容器内 的压强为3.90×105Pa时,氢气分子的平均平动动能为多 的压强为 × 时 大? 解:由物态方程
M PV = RT M mol
3kPVM 3PVMmol 3 mol ε k = kT = = = 3.89×10−22 J 2 2MR 2MNA
哈尔滨工程大学理学院 孙秋华
热学 一、基本概念 1.平衡态和平衡过程 平衡态和平衡过程 平衡态:若系统与外界无能量交换, 平衡态:若系统与外界无能量交换,则系统的宏观性质 不随时间改变,这样的状态称为平衡态。 不随时间改变,这样的状态称为平衡态。 平衡过程:系统从一个状态不断地变化到另一个状态, 平衡过程:系统从一个状态不断地变化到另一个状态, 我们称系统经历了一个过程。 我们称系统经历了一个过程。若其间所经历 的所有中间状态都无限地接近平衡态, 的所有中间状态都无限地接近平衡态,这个 过程称为平衡过程。(准静态过程) 。(准静态过程 过程称为平衡过程。(准静态过程) 2.理想气体的压强和温度 2.理想气体的压强和温度
2 x
0 kT/m
哈尔滨工程大学理学院 孙秋华
热学 5、 N个粒子,其速率分布如图所示(v > 5 v 0 时粒子数 、 个粒子 其速率分布如图所示( 个粒子, 为零). 为零). (1) 试用 与 v 0 表示 a 的值. 试用N 的值. (2) 试求速率在 2 v 0 ─ 3 v 0 间的粒子数. 间的粒子数. (3) 试求粒子的方均根速率. 试求粒子的方均根速率. Nf(v) a 2a/3 a/3 o
热力学第二定律: 热力学第二定律:两种表述
∫
pdV
V1
哈尔滨工程大学理学院
孙秋华
热学 典型题: 典型题: 1、宏观状态量的计算(P,T,E) 、宏观状态量的计算( 2、微观 量的计算( 、 量的计算(
ε k ,ε r ,ε
)
3、利用速率分布函数求相应物理量 、 4、利用理想气体速率分布函数曲线判断物理量的大小 、 5、利用热力学第一定律求相应物理量 、 6、计算热机的效率 、
哈尔滨工程大学理学院
孙秋华
热学 宏观状态量的计算( 宏观状态量的计算(P, T, E) 的计算 1、三个容器A、B、C中装有同种理想气体,其分子数密 、三个容器 、 、 中装有同种理想气体 中装有同种理想气体, 相同, 度n相同,而方均根速率之比为 v 相同
( ) : (v ) : (v )
2 A 1/ 2 2 B 1/ 2 2 C
备注
i cV = R 2 i cp = R + R 2
0
M cv ∆T M mol
孙秋华
V2 V2 M M RT ln RT ln V1 M mol V1 M mol
M − cv ∆T M mol
0
γ
=
c c
p V
哈尔滨工程大学理学院
热学 3.热力学第二定律: 热力学第二定律: 热力学第二定律 开尔文表述:不可能从单一热源吸取热量,使之完全变 开尔文表述:不可能从单一热源吸取热量, 成有用功而不产生其它影响。 成有用功而不产生其它影响。 克劳修斯表述: 克劳修斯表述:热量不可能自动地从低温物体传向高温 物体。 物体。 热力学第二定律的统计意义: 热力学第二定律的统计意义:一个不受外界影 统计意义 响的“孤立系统” 其内部发生的过程, 响的“孤立系统”,其内部发生的过程,总是由概 率小的状态向概率大的状态进行, 率小的状态向概率大的状态进行,由包含微观状态 数少的状态向包含微观状态数多的状态进行。 数少的状态向包含微观状态数多的状态进行。
