枸橼酸喷托维林片说明书.doc
FAS-DPD Titrating Reagent (氯秦維磷) 產品說明書说明书

SAFETY DATA SHEETAccording to 29 CFR 1910.1200 Hazard Communication Standard 2012 (HazCom 2012)SECTION 1: IdentificationProduct identifierProduct name FAS-DPD Titrating Reagent (Chlorine)Product number R-0875Recommended use and restrictions To be used in accordance with manufacturer instructions or under the direct guidance of the manufacturer.Manufacturer Taylor Technologies, Inc.31 Loveton CircleSparks, MD 21152Phone: (410) 472-4340Emergency phone: (800) 837-8548SECTION 2: Hazard(s) IdentificationPhysical hazards Not applicableHealth hazards Not applicableEnvironmental hazards Not currently regulated by OSHA. For additional information, refer to section 12 of the SDS.Label elementsHazard pictograms Not applicableSignal word Not applicableHazard statements Not applicablePrecautionary statementsPrevention Avoid contact with skin, eyes, or clothing. For contact with skin or eyes, flush 20 minutes withwater. If ingested, contact physician or local poison control center. Treat symptoms as needed.Response This reagent is not defined as a hazardous chemical per OSHA’s Hazard CommunicationStandard 2012; however, use care when handling.Storage Keep tightly capped. Store out of direct sunlight between 36°F−85°F.Disposal Dispose of contents/container in accordance with local/regional/national/internationalregulations.Hazards not otherwise classified Not applicableSECTION 3: Composition/Information on IngredientsMixtureChemical name Common name and synonyms CAS number % w/w Water Dihydrogen oxide 7732-18-5 80-100 Nonhazardous and othercomponents below reportable levelsNot applicable Not applicable 0.1‒1 SECTION 4: First-Aid MeasuresIf inhaledRemove individual to fresh air. Seek medical advice/attention if breathing becomes difficult or if respiratory irritation develops. Give oxygen or artificial respiration if needed.In case of skin contactImmediately flush skin with plenty of water for at least 20 minutes. If clothing comes in contact with the product, the clothing should be removed and laundered before reuse. Seek medical advice/attention if irritation develops.In case of eye contactImmediately flush eyes with plenty of water for at least 20 minutes. Remove contact lenses if present and easy to do. Continue rinsing. If symptoms persist or in all cases of concern, seek medical advice/attention.If swallowedRinse mouth. Never give anything by mouth to a person who is unconscious or is having convulsions. Do NOT induce vomiting unless directed by physician. If vomiting occurs, keep head low so that stomach content does not get into the lungs. If symptoms persist or in all cases of concern, seek medical advice/attention.Most important symptoms and effects, both acute and delayedRefer to section 2 and/or section 11 of the SDS for the most important known symptoms and effects.Indication of any immediate medical attention and special treatment neededProvide general supportive measures and treat symptomatically.General informationEnsure medical personnel are aware of the material(s) involved and take precautions to protect themselves.Extinguishing mediaSuitable extinguishing media Use extinguishing media appropriate for surrounding fire.Unsuitable extinguishing media Do not use a heavy water stream. Use of heavy stream of water may spread fire.Specific hazards arising from the substance or mixtureFire hazard Not flammableExplosion hazard Not explosiveReactivity Hazardous reactions will not occur under normal conditions.Hazardous combustion products Carbon oxides, hydrogen gas, nitrogen oxides, sulfur oxides. Other irritating fumes and smoke. Advice for firefightersPrecautionary measures Exercise caution when fighting any chemical fire; hazardous fumes will be present.Use water spray or fog for cooling exposed containers.Firefightingequipment/instructionsProtection during firefighting Do not enter fire area without proper protective equipment, including respiratory protection.Other information Refer to section 9 of the SDS for flammability properties.Personal precautions, protective equipment, and emergency proceduresWear appropriate protective equipment and clothing during cleanup. Local authorities should be advised if significant spillages cannot be contained. For personal protective equipment, refer to section 8 of the SDS.Environmental precautionsAvoid discharge into drains, watercourses, or onto the ground.Methods and material for containment and cleaning upDike the spilled material where this is possible. Stop leak if it can be done without risk. Absorb spillage to prevent material damage. Absorb in vermiculite, dry sand or earth, and place into containers. Prevent entry into waterways, sewers, basements, or confined areas. Following product recovery, flush area with water. Never return spills to original containers for reuse.Contaminated absorbent material may pose the same hazards as the spilled product. In the event of a spill or accidental release, notify relevant authorities in accordance with all applicable regulations.Reference to other sectionsFor exposure controls and personal protection, refer to section 8 of the SDS. For waste disposal, refer to section 13 of the SDS.Personal precautions, protective equipment, and emergency proceduresDo not breathe mist or vapor. Do not get in eyes, on skin, or on clothing. Do not taste or swallow. Avoid prolonged exposure.Provide adequate ventilation. Wear appropriate personal protective equipment. For personal protective equipment, refer to section8 of the SDS. Keep away from incompatibles. Observe good industrial hygiene practices. Label containers appropriately. Conditions for safe storage, including any incompatibilitiesKeep tightly capped. Store out of direct sunlight between 36°F−85°F. Store away from incompatible materials (refer to section 10 of the SDS).Occupational exposure limitsUS ACGIH Threshold Limit ValuesNot regulatedUS NIOSH: Pocket Guide to Chemical HazardsNot regulatedUS OSHA Table Z-1 Limits for Air Contaminants (29 CFR 1910.1000)Not regulatedBiological limit valuesNo biological exposure limits noted for the ingredient(s).Exposure controlsAppropriate engineering controls Good general ventilation (typically 10 air changes per hour) should be used. Ventilation ratesshould be matched to conditions. If applicable, use process enclosures, local exhaustventilation, or other engineering controls to maintain airborne levels below recommendedexposure limits. If exposure limits have not been established, maintain airborne levels to anacceptable level. Eyewash facilities and emergency shower must be available when handlingthis product.Personal protective equipmentEye/face protection Wear appropriate chemical safety goggles if contact is likely to occur.Skin protection Wear appropriate chemical-resistant gloves and clothing if contact is likely to occur.Body protection Wear appropriate protective clothing if contact is likely to occur.Respiratory protection In case of insufficient ventilation, wear suitable respiratory equipment. Use a NIOSH/MSHAapproved respirator if there is a risk of exposure to dust/fumes at levels exceeding theexposure limits. Advice should be sought from respiratory protection suppliers.Information on basic physical and chemical propertiesPhysical state LiquidForm LiquidColor Clear, colorless or nearly colorlessOdor OdorlessOdor threshold No data availablepH No data availableEvaporation rate No data availableMelting point No data availableFreezing point No data availableInitial boiling point (boiling range) No data availableFlash point No data availableSpecific gravity No data availableAuto-ignition temperature No data availableDecomposition temperature No data availableFlammability (solid, gas) No data availableUpper Flammability Limit No data availableLower Flammability Limit No data availableVapor pressure No data availableVapor density No data availableSolubility Soluble in all proportionsNo data availablePartition coefficient(n-octanol/water)Viscosity No data availableExplosive properties No data availableOxidizing properties No data availableReactivity Hazardous reactions will not occur under normal conditions.Chemical stability Stable under recommended handling and storage conditions (refer to section 7 of the SDS).No dangerous reaction known under conditions of normal use.Possibility of hazardousreactionsConditions to avoid Contact with incompatible materials. Do not use in areas without adequate ventilation. Incompatible materials Metals, strong oxidizing agents, strong reducing agentsHazardous decompositionHazardous reactions will not occur under normal conditions.productsInformation on toxicological effectsLikely routes of exposure are skin/eye contact and ingestion.Most importantsymptoms/effects, acute and delayed Direct skin contact may cause slight or mild transient irritation. Symptoms may include redness and itching.Direct eye contact may cause slight or mild transient irritation. Symptoms may include stinging, tearing, redness, swelling, and blurred vision.Inhalation of mists can cause respiratory irritation. Symptoms may include coughing and breathing difficulties.Ingestion may cause gastrointestinal irritation, nausea, vomiting, and diarrhea.Acute toxicity This product is not classified as an acute toxicity hazard.Skin corrosion/irritation No data availableSerious eye damage/eye irritation No data availableRespiratory sensitization No data availableSkin sensitization No data availableGerm cell mutagenicity No data availableCarcinogenicityIARC Monographs. Overall Evaluation of CarcinogenicityNot regulatedOSHA Specifically Regulated Substances (29 CFR 1910.1001-1096)Not regulatedUS National Toxicology Program (NTP) Report on CarcinogensNot regulatedReproductive toxicity No data availableSpecific target organ toxicity(single exposure)No data availableSpecific target organ toxicity(repeated exposure)No data availableAspiration hazard No data availableEcotoxicity This product is not classified as environmentally hazardous.Persistence and degradability No data availableBioaccumulative potential No data availableMobility in soil No data availableOther adverse effects Large or frequent spills can have a harmful or damaging effect on the environment.Collect and reclaim or dispose of in sealed containers at a licensed waste disposal site. Since emptied containers may retain product residue, follow label warnings even after container is emptied. This material and its container must be disposed of in a safe manner. Dispose of contents/container in accordance with local/regional/national/international regulations.DOT Not regulated as dangerous goodsIATA Not regulated as dangerous goodsIMDG Not regulated as dangerous goodsUS federal regulationsCERCLA Hazardous Substance (40 CFR 302.4)Not regulatedSARA 302 Extremely Hazardous Substance (40 CFR 355 Appendices A / B)Not regulatedSARA 304 Emergency Release NotificationNot regulatedSARA 311/312 Hazardous ChemicalNot regulatedSARA 313 (TRI reporting)Not regulatedTSCA Section 8(b) Chemical InventoryAll components are on the U.S. EPA TSCA Inventory list.TSCA Section 12(b) Export Notification (40 CFR 707, Subpt. D)Not regulatedOther federal regulationsClean Air Act (CAA) Section 112 Hazardous Air Pollutants (HAPs)Not regulatedClean Air Act (CAA) Section 112(r) Accidental Release Prevention (40 CFR 68.130)Not regulatedClean Water Act, Toxic and Priority Pollutants (40 CFR 401.15 and CFR 423, Appendix A)Not regulatedSafe Drinking Water Act (SDWA)Not regulatedUS state regulationsCalifornia Safe Drinking Water and Toxic Enforcement Act of 1986 (California Proposition 65)Not regulatedMassachusetts Right-to-Know ActNot regulatedNew Jersey Worker and Community Right-to-Know ActNot regulatedPennsylvania Worker and Community Right-to-Know ActNot regulatedRhode Island Right-to-Know ActNot regulatedNFPA RatingHealth hazard 0Fire hazard 0Reactivity 0Specific N/ADisclaimerThe information in the Safety Data Sheet is offered for your consideration and guidance for safe handling, use, storage,transportation, disposal, and release of this product and is not considered a warranty or quality specification. Taylor Technologies, Inc., disclaims all expressed or implied warranties and assumes no responsibility for the accuracy of completeness of the data contained herein. The data in this SDS does not apply to use with any other product or in any other process.License granted to make unlimited paper copies for internal use only. This Safety Data Sheet may not be altered in any way without the expressed knowledge and permission of Taylor Technologies, Inc. The information contained in this sheet is based on lab experience and the most current data available.Issue date:May 2015Last revisionsJanuary 2020。
药品名称
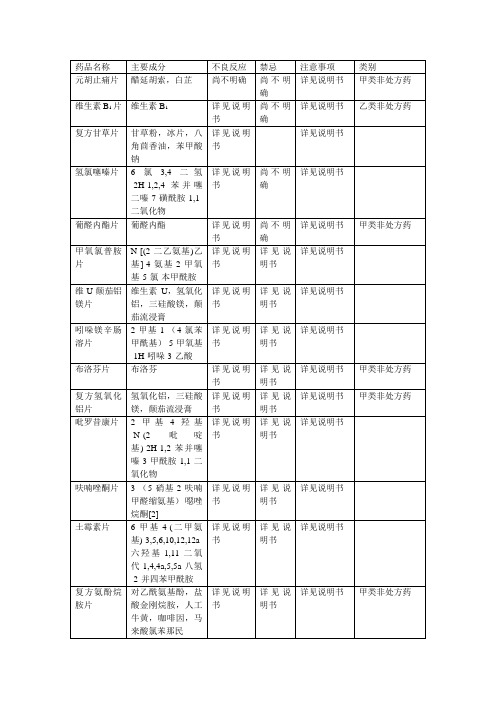
详见说明书
详见说明书
盐酸左旋咪唑片
(S)-(-)-6-苯基-2,3,5,6-四氢咪唑并[2,1-b]噻唑盐酸盐
详见说明书
详见说明书
详见说明书
保泰松片
1,2-二苯基-4-正丁基吡唑烷-3,5-二酮
详见说明书
详见说明书
详见说明书
连蒲双清片
盐酸小檗碱,蒲公英浸膏
尚不明确
尚不明确
尚不明确
腰息痛胶囊
白芷,草乌(制),独活,续断,牛膝,三七,防风,威灵仙,秦艽,川加皮,防己,海风藤,杜仲,土萆薢,何首乌,桑寄生,当归,骨碎补,红花,千年健,赤芍,桂枝,对乙酰氨基酚
详见说明书
详见说明书
详见说明书
布洛芬片
布洛芬
详见说明书
详见说明书
详见说明书
甲类非处方药
复方氢氧化铝片
氢氧化铝,三硅酸镁,颠茄流浸膏
详见说明书
详见说明书
详见说明书
甲类非处方药
吡罗昔康片
2-甲基-4-羟基-N-(2-吡啶基)-2H-1,2-苯并噻嗪-3-甲酰胺-1,1-二氧化物
详见说明书
详见说明书
详见说明书
详见说明书
详见说明书
盐酸氨溴索片
盐酸氨溴索
详见说明书
详见说明书
详见说明书
甲类非处方药
阿莫西林颗粒
(2S,5R,6R)-3,3-二甲基-6-[(R)-(-)-2-氨基-2-(4-羟基苯基)乙酰氨基]-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸三水合物
详见说明书
详见说明书
详见说明书
复方磺胺甲噁唑片
磺胺甲噁唑,甲氧苄啶
详见说明书
详见说明书
HPLC法测定枸橼酸喷托维林片的含量word版本

H P L C法测定枸橼酸喷托维林片的含量分类号 UDC 单位代码密级公开学号XX学校本科毕业论文HPLC法测定枸橼酸喷托维林片的含量学生姓名:二级学院:专业:班级:学号:指导教师:完成时间: 2014 年 5 月日中国• X X20 14 年 5 月目录摘要................................................................................................................................................... Abstract .............................................................................................................................................1 引言................................................................................................................................................2 实验部分 02.1 主要实验试剂与仪器 02.2 实验原理 (1)2.3 测定方法 (1)2.4 液相色谱仪工作条件 (1)3 条件与讨论 (3)3.1 样品的处理方法选择 (3)3.2 仪器工作条件的选择 (3)3.2.1 流动相的选择 (3)3.2.2 进样器进样的时间设置 (4)3.2.3 色谱柱的选择 (4)3.2.4 检测器的选择 (4)3.2.5 色谱柱温度的调节 (5)3.2.6标准曲线 (5)4 样品分析 (6)4.1试样的处理与测定 (6)4.2 枸橼酸喷托维林片样品液相色谱图及其数据 (6)4.3 实验结果与计算 (7)5 结论 (8)参考文献 (8)致谢 (10)HPLC法测定枸橼酸喷托维林片的含量应用化学专业20XX级X班:X X 指导教师:X X摘要:本实验采用高效液相色谱法测量枸橼酸喷托维林片中枸橼酸喷托维林的含量。
托法替尼项目简介

托法替尼一、基本信息1、项目名称:枸橼酸托法替尼原料及片剂英文名称:TOFACITINIB CITRATE商品名称:XELJANZ ®化学名称:3-((3R,4R)-4-甲基-3-(甲基(7H-吡咯并[2,3-D]嘧啶-4-基)氨基)哌啶-1-基)-3-氧代丙腈;分子式:C16H20N6O.C6H8O7分子量:504.5CAS号:540737-29-9化学结构式:2、剂型:原料药、片剂(外观圆形,白色,速释,薄膜包衣片)3、注册分类:化药3+34、规格:5mg5、适应症:用于对氨甲喋呤治疗应答不充分或不耐受的中至重度活动性类风湿关节炎(RA)6、用法用量:口服,XELJANZ 5毫克,每日两次,空腹或餐后服用均可7、是否医保:否8、零售价:XELJANZ (TOFACITINIB CITRATE) 5mg. Mfg: Pfizer (US). Pack Size: 60Tablets. Price: $4204.7二、国内外上市申报情况国外上市情况枸橼酸托法替尼由辉瑞公司研发,2012年11月6日,美国FDA批准tofacitinib(商品名Xeljanz)治疗对氨甲喋呤(methotrexate)无足够应答或不能耐受的成人中度至重度活动性类风湿关节炎。
国内上市情况国内注册申报情况三、政策法规行政保护:无新药监测期:无专利保护:本品化合物专利于2020年到期,晶型专利于2022年到期,按目前药品审评的进度判断上述专利对本品的开发基本没有影响;新用途专利不影响本品在现有适应症方面的应用;而工艺专利可通过一些制备方法手段避开专利的限制。
四、产品特点Xeljanz通过抑制JAK通路-细胞内在类风湿关节炎中发挥显著的作用的信号转导通路。
JAKs是胞内酶传递信号,产生细胞因子或与细胞膜上生长因子受体相互作用。
五、临床疗效Tofacitinib的III期临床试验(开发代码:CP-690,550)ORALStandard(A3921064)和ORALStep(A3921032)获得喜人的研究结果,该药是一种新型的在研口服蛋白酪氨酸激酶(JAK)抑制剂。
枸橼酸喷托维林合成工艺

枸橼酸喷托维林合成工艺
枸橼酸喷托维林是一种镇咳药,主要用于治疗咳嗽和咳痰等症状。
其合成工艺主要是将枸橼酸喷托维林压制成粉末,然后应用盐水溶解,形成液体,再把液体吸入到呼吸道内。
在实际生产过程中,为了保证产品的质量和稳定性,需要对合成工艺进行不断的改进和优化。
例如通过将滑石粉和枸橼酸喷托维林原料预先混合,在枸橼酸喷托维林外层形成包覆粉膜,避免原料与压片冲模直接接触,解决了在冲压过程中粘冲的问题。
在制粒过程中,通过控制水分含量,降低处方水分,并将部分滑石粉内加,取消外加玉米淀粉,有效解决了素片硬度较低的问题,提高了素片的硬度。
此外,还可以控制原料的加入粒径的配比,将过筛和整粒后的原料合并使用,既保证了产品的混合均匀性,又不会浪费大量原料药。
总之,枸橼酸喷托维林的合成工艺需要综合考虑多方面的因素,并不断优化和改进,以确保产品的质量和稳定性。
Viltepso (viltolarsen) 产品说明书

Viltepso® (viltolarsen)(Intravenous)Document Number: IC-0562 Last Review Date: 08/01/2022Date of Origin: 09/01/2020Dates Reviewed: 09/2020, 01/2021, 04/2021, 08/2021, 08/2022I.Length of AuthorizationCoverage will be for 6 months and may be renewed.II.Dosing LimitsA.Quantity Limit (max daily dose) [NDC Unit]:•Viltepso 250 mg/5 mL single-dose vial: 36 vials per 7 daysB.Max Units (per dose and over time) [HCPCS Unit]:•920 billable units (9200 mg) every 7 daysIII.Initial Approval CriteriaCoverage is provided in the following conditions:Universal Criteria 1,5•Patient is not on concomitant therapy with other DMD-directed antisense oligonucleotides(e.g., eteplirsen, golodirsen, casimersen, etc.); AND•Patient does not have symptomatic cardiomyopathy; AND•Serum cystatin C, urine dipstick, and urine protein-to-creatinine ratio (UPCR) are measured prior to starting therapy and periodically during treatment; AND Duchenne Muscular Dystrophy (DMD) † Ф1-8•Patient has a confirmed mutation of the DMD gene that is amenable to exon 53 skipping;AND•Patient has been on a stable dose of corticosteroids, unless contraindicated or intolerance, for at least 3 months; AND•Patient retains meaningful voluntary motor function (e.g., patient is able to speak, manipulate objects using upper extremities, ambulate, etc.); AND•Patient is receiving physical and/or occupational therapy; AND•Baseline documentation of one or more of the following:o Dystrophin levelo Timed function tests (e.g., 6-minute walk test [6MWT], time to stand [TTSTAND], time to run/walk 10 meters [TTRW], time to climb 4 stairs [TTCLIMB], etc.)o Upper limb function (ULM) testo North Star Ambulatory Assessment (NSAA) scoreo Forced Vital Capacity (FVC) percent predicted† FDA-labeled indication(s); ‡ Compendia recommended indication(s); Ф Orphan DrugIV.Renewal Criteria 1,5,6Coverage may be renewed based upon the following criteria:•Patient continues to meet the universal and other indication-specific relevant criteria such as concomitant therapy requirements (not including prerequisite therapy), etc. identified in section III; AND•Absence of unacceptable toxicity from the drug. Examples of unacceptable toxicity include: kidney toxicity (e.g., fatal glomerulonephritis, persistent increase in serum cystatin C,proteinuria, etc.), etc.; AND•Patient has responded to therapy compared to pretreatment baseline in one or more of the following (not all-inclusive):o Increase in dystrophin levelo Improvement in quality of lifeo Stability, improvement, or slowed rate of decline in one or more of the following: ▪Timed function tests (e.g., 6-minute walk test [6MWT], time to stand [TTSTAND], time to run/walk 10 meters [TTRW], time to climb 4 stairs [TTCLIMB], etc.) ▪Upper limb function (ULM) test▪North Star Ambulatory Assessment (NSAA) score▪Forced Vital Capacity (FVC) percent predictedV.Dosage/Administration 1Duchenne MuscularAdminister 80 mg/kg intravenously once weekly.DystrophyVI.Billing Code/Availability InformationHCPCS Code:•J1427 – Injection, viltolarsen, 10 mg; 1 billable unit = 10 mgNDC:•Viltepso 250 mg/5 mL single-dose vial: 73292-0011-xxVII.References1.Viltepso [package insert]. Paramus, NJ; NS Pharma, Inc.; March 2021. Accessed June 2022.2.Topaloglu H, Gloss D, Moxley RT 3rd, et al. Practice guideline update summary:Corticosteroid treatment of Duchenne muscular dystrophy: Report of the GuidelineDevelopment Subcommittee of the American Academy of Neurology. Neurology. 2016 Jul12;87(2):238.3.Bushby K, Finkel R, Birnkrant DJ, et al. Diagnosis and management of Duchennemuscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management.Lancet Neurol; 2010 Jan; 9(1):77‑93.4.Bushby K, Finkel R, Birnkrant DJ, et al. Diagnosis and management of Duchennemuscular dystrophy, part 2: implementation of multidisciplinary care. Lancet Neurol; 2010Jan; 9(2):177-189.5.Clemens PR, Rao VK, Connolly AM, et al; CINRG DNHS Investigators. Safety, Tolerability,and Efficacy of Viltolarsen in Boys With Duchenne Muscular Dystrophy Amenable to Exon53 Skipping: A Phase 2 Randomized Clinical Trial. JAMA Neurol. 2020 May 26. doi:10.1001/jamaneurol.2020.1264. [Avail at:https:///pmc/articles/PMC7251505/]6.Bushby K, Connor E. Clinical outcome measures for trials in Duchenne musculardystrophy: report from International Working Group meetings. Clin Investig (Lond).2011;1(9):1217-12357.Birnkrant DJ, Bushby K, Bann CM, et al. Diagnosis and management of Duchennemuscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, andgastrointestinal and nutritional management. Lancet Neurol 2018; 17:251.8.Birnkrant DJ, Bushby K, Bann CM, et al. Diagnosis and management of Duchennemuscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedicmanagement. Lancet Neurol 2018; 17:347.Appendix 1 – Covered Diagnosis CodesG71.01 Duchenne or Becker muscular dystrophyAppendix 2 – Centers for Medicare and Medicaid Services (CMS)Medicare coverage for outpatient (Part B) drugs is outlined in the Medicare Benefit Policy Manual (Pub. 100-2), Chapter 15, §50 Drugs and Biologicals. In addition, National CoverageDetermination (NCD), Local Coverage Articles (LCAs) and Local Coverage Determinations (LCDs) may exist and compliance with these policies is required where applicable. They can be found at: https:///medicare-coverage-database/search.aspx. Additional indications may be covered at the discretion of the health plan.Medicare Part B Covered Diagnosis Codes (applicable to existing NCD/LCA/LCD): N/AJurisdiction Applicable State/US Territory ContractorE (1) CA, HI, NV, AS, GU, CNMI Noridian Healthcare Solutions, LLCF (2 & 3) AK, WA, OR, ID, ND, SD, MT, WY, UT, AZ Noridian Healthcare Solutions, LLC5 KS, NE, IA, MO Wisconsin Physicians Service Insurance Corp (WPS)6 MN, WI, IL National Government Services, Inc. (NGS)H (4 & 7) LA, AR, MS, TX, OK, CO, NM Novitas Solutions, Inc.8 MI, IN Wisconsin Physicians Service Insurance Corp (WPS) N (9) FL, PR, VI First Coast Service Options, Inc.J (10) TN, GA, AL Palmetto GBA, LLCM (11) NC, SC, WV, VA (excluding below) Palmetto GBA, LLCNovitas Solutions, Inc.L (12) DE, MD, PA, NJ, DC (includes Arlington &Fairfax counties and the city of Alexandria in VA)K (13 & 14) NY, CT, MA, RI, VT, ME, NH National Government Services, Inc. (NGS)15 KY, OH CGS Administrators, LLC。
愈创维林那敏片中枸橼酸喷托维林的含量测定

p n0y eie c rt w s 1 . 8 0 . g L ( =0 9 99 n )T e a e g e oe a a 9 8 % , J 0 2 % ( 9 . o c s n e t v r ia a 0 0 —1 0 8 / r . 9 , =6 . h vr e rc vI rt w s9 . 7 尺 l = . 6 n= ) C n l i x n t e m a y e S , uo
5 m)流 动 相 为 0 0 m lL庚 烷 磺 酸 钠 溶 液 ( 三 乙胺 00 % , , . 5m o/ 含 . 5 用磷 酸 调 p 至 3 0 一甲醇 (0:0 , 速 1 / i, 测 波 长 2 0n H .) 5 5 )流 m n检 mL 1 m, 柱温 3 0℃ 。 果 枸 橼 酸 喷 托 维 林 质 量 浓 度 在 1 . 8 o . g L的 范 围 内 与峰 面积 线性 关 系 良好 ( = . 9 , = ) 平 均 回 收 率 为 结 0 0 ~10 8m / r 0 9 99 6 ,
Th me d s e stv , a t n a c r t.I a b us d 0 t dee mi t n f pe tx v rn ctae n e m0 i s n i e fs a d c u ae t n e i c e fr he tr nai o no y e ie irt i Gu ie e i P n o yv rne o af n sn e t x e i Ci ae t t r ad n Ch o p e a n Mae t Ta lt. l r h n mi e la e be s K e w0r : y ds HPLC; Guafn i Pe tx v rn Cir t a d ie esn no y e ie tae n Ch o p e a n Ma e t Ta lt p n o y e i e ir t lr h n mi e la e b es; e t x v rn c tae
拖法替布中文说明书Tofacinix

Tofacinix 使用说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:枸橼酸托法替布片商品名称:Tofacinix ®英文名称:Tofacitinib Citrate Tablets【成份】活性成份:枸橼酸托法替布。
化学名称:(3R,4R)-4-甲基-3-(甲基-7H-吡咯并[2,3-d]嘧啶-4-基氨基)-β-氧代-1-哌啶丙腈枸橼酸盐 化学结构式:MeOHCO 2HC HHO 2C分子式:C 16H 20N 6O•C 6H8O 7 分子量:504.5【适应症】Tofacinix 适用于甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性类风湿关节炎(RA )成年患者,可与甲氨蝶呤或其他非生物改善病情抗风湿药(DMARD )联合使用。
使用限制:不建议将Tofacinix与生物DMARD 类药物或强效免疫抑制剂(如硫唑嘌呤和环孢霉素)联用。
【规格】5mg(以Tofacitinib计)【用法用量】类风湿关节炎Tofacinix可与甲氨蝶呤或其他非生物DMARD 药物联合使用。
Tofacinix的推荐剂量为5 mg,每天两次。
口服给药,有无进食皆可。
因严重感染和血细胞减少进行剂量调整(见下表1、2 和3)▪不建议在淋巴细胞绝对计数低于500 细胞/mm3、中性粒细胞绝对计数(ANC)低于1000 细胞/mm3 或血红蛋白水平低于9 g/dL 的患者中开始Tofacinix用药。
▪出现淋巴细胞减少症、中性粒细胞减少症和贫血症时,建议调整剂量或中断治疗[见注意事项和不良反应]▪如果患者发生严重感染,应该避免Tofacinix给药,直至感染得到控制。
因药物相互作用进行剂量调整▪在下列患者中:•同时接受细胞色素P450 3A4(CYP3A4)的强效抑制剂(如酮康唑)治疗,或者•接受一种或多种可同时导致CYP3A4 中等抑制和CYP2C19 强效抑制的合并用药(如氟康唑),Tofacinix的推荐剂量应为5 mg,每天一次。
枸橼酸托法替布片(JXHS1500126)说明书

核准日期:枸橼酸托法替布片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:枸橼酸托法替布片商品名称:尚杰® / Xeljanz ®英文名称:Tofacitinib Citrate Tablets汉语拼音:Juyuansuan Tuofatibu Pian【成份】活性成份:枸橼酸托法替布。
化学名称:(3R,4R)-4-甲基-3-(甲基-7H-吡咯并[2,3-d]嘧啶-4-基氨基)-β-氧代-1-哌啶丙腈枸橼酸盐。
化学结构式: N N MeMeNN N H O N HO 2CCO 2H HO 2C OH •分子式:C 16H 20N 6O•C 6H 8O 7分子量:504.5【性状】本品为白色圆形薄膜衣片,一面有“Pfizer ”字样,另一面有“JKI5”字样,除去包衣后显白色至类白色。
【适应症】托法替布适用于甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性类风湿关节炎(RA)成年患者,可与甲氨蝶呤或其他非生物改善病情抗风湿药(DMARD)联合使用。
使用限制:不建议将托法替布与生物DMARD类药物或强效免疫抑制剂(如硫唑嘌呤和环孢霉素)联用。
【规格】5mg(以托法替布计)。
【用法用量】类风湿关节炎托法替布可与甲氨蝶呤或其他非生物DMARD药物联合使用。
托法替布的推荐剂量为5 mg,每天两次。
口服给药,有无进食皆可。
因严重感染和血细胞减少进行剂量调整(见下表1、2和3)▪不建议在淋巴细胞绝对计数低于500细胞/mm3、中性粒细胞绝对计数(ANC)低于1000细胞/mm3或血红蛋白水平低于9 g/dL的患者中开始托法替布用药。
▪出现淋巴细胞减少症、中性粒细胞减少症和贫血症时,建议调整剂量或中断治疗[见注意事项和不良反应]▪如果患者发生严重感染,应该避免托法替布给药,直至感染得到控制。
因药物相互作用进行剂量调整▪在下列患者中:•同时接受细胞色素P450 3A4(CYP3A4)的强效抑制剂(如酮康唑)治疗,或者•接受一种或多种可同时导致CYP3A4中等抑制和CYP2C19强效抑制的合并用药(如氟康唑),托法替布的推荐剂量应为5 mg,每天一次。
枸橼酸莫沙必利说明书

枸橼酸莫沙必利片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:枸橼酸莫沙必利片商品名称:加斯清英文名称:Mosapride Citrate Tablets汉语拼音:Juyuansuan Moshabili Pian【成份】本品主要成份为枸橼酸莫沙必利。
化学名称:4-氨基-5-氯-2-乙氧基-N-[[4-(4-氟苄基)-2-吗啉基]甲基]苯甲酰胺枸橼酸二水化合物。
化学结构式:略分子式:C21H25ClFN3O3·C6H8O7·2H2O分子量:650.05【性状】本品为白色薄膜衣片,除去包衣后显白色。
【适应症】用于缓解慢性胃炎伴有的消化系统症状(烧心、早饱、上腹胀、上腹痛、恶心、呕吐)。
【规格】5mg(以无水枸橼酸莫沙必利计)【用法用量】成人通常用量为1日3次,每次l片(5mg),饭前或饭后口服。
【不良反应】998例中有40例(4.0%)出现不良反应。
主要为腹泻和稀便(1.8%),口干(0.5%)、疲倦感(0.3%)等。
服用本品的患者792例中有30例(3.8%)临床检验值发生异常变化,主要是嗜酸性粒细胞增多(1.1%)、甘油三酯升高(0.1%)、AST、ALT、ALP以及γ-GTP的上升(各0.4%)等。
1.严重不良反应:急性肝炎,肝功能障碍,黄疸(均不足0.1%)由于可能发生过急性肝炎伴有AST、ALT、γ-GTP等显著升高的严重肝功能障碍、黄疸,并且出现过死亡病例,因此应对患者密切观察,如发现异常应立即停止服药并采取相应措施。
2.其他不良反应1对本品成份过敏者禁用。
【注意事项】1.重要的基本注意事项通常持续使用本品一段时间(2周),仍未见消化系统症状改善时,不应再长期盲目服药。
2.服药时的注意事项患者应将本品从 PTP 薄板中取出后再服用。
(据报告,曾有患者误食PTP 薄板,尖硬的锐角刺伤食道粘膜,甚至发生穿孔,造成纵隔炎等严重并发症)。
【孕妇及哺乳期妇女用药】1.孕妇及有可能怀孕的妇女,只有在治疗上受益大于风险时才可使用本品(孕妇服用本品的安全性还未得到确认)。
MeteoSpasmyl乐健素(复方枸橼酸阿尔维林软胶囊)使用说明

MeteoSpasmyl乐健素(复方枸橼酸阿尔维林软胶囊)
【用法用量】口服饭前服用。
每次1粒,每日服用2-3次,只供成年人使用。
【注意事项】使用本品时如有疑问,请向医生或药剂师咨询。
【不良反应】服用本品可能发生如下:-荨麻疹,有时伴随咽喉肿痛甚至发生休克;-有时发生肝部病变,一旦停止服用该药物,症状即可消失。
如患者发生该说明书未能涉及的其它副作用,务必及时向医生或药剂师说明情况。
【禁忌】患者对枸橼酸阿尔维林或药物中其它万分有不耐受性或过敏反应史时禁止使用。
如有疑问,请向医生或药剂师咨询。
【适应症】主要用于治疗胃肠胀气和消化道疼痛等症状。
【药物相互作用】为避免与其他任何药物间的相互作用,在服用其他药物时,切记向医生或药剂师做系统咨询。
【药理毒理】本品药物治疗分类为抗平滑肌痉挛,抗胃肠胀气,其中枸橼酸阿尔维林是非阿托品,罂粟碱抗平滑肌痉挛,二甲硅油是一种惰性物,无药理活性,它通过改变气泡表面张力消除泡沫。
【儿童用药】尚缺乏本品的有效性和安全性研究资料。
【老人用药】参见其他项下内容,或遵医嘱。
【包装】20粒/盒
【药物过量】如发生过量,请咨询医生意见。
【类型】处方药
【医保】非
【国家/地区】法国
【剂型】胶囊剂
【药代动力学】参见详细说明
【成份】每一胶囊含枸橼酸阿尔维林60毫克,二甲硅油300毫克
说明:以上信息仅供参考,具体请以商品说明书为准。
枸橼酸西地那非片说明书.pdf_1694216884.1319058
核准日期:2020年02月05日修改日期:枸橼酸西地那非片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:枸橼酸西地那非片英文名称:Sildenafil Citrate Tablets汉语拼音:Juyuansuan Xidinafei Pian【成份】本品活性成份为枸橼酸西地那非化学名称:1-{4-乙氧基-3-(6,7-二氢-1-甲基-7-氧代-3-丙基-1氢-吡唑并[4,3d]嘧啶-5-基)苯磺酰}-4-甲基哌嗪枸橼酸盐化学结构式:分子式:C22H30N6O4S C6H8O7分子量:666.70【性状】本品为白色或类白色双面凸圆形薄膜衣片,除去包衣后显白色。
【适应症】本品适用于治疗成人肺动脉高压(PAH,WHO第1组),以改善运动能力和延缓临床恶化。
已在依前列醇治疗基础上加用本品的临床研究中证明了临床恶化的延缓效应。
证明有效性的研究主要纳入的患者为WHO功能分级II-III级的特发性PAH(71%) 、与结缔组织病相关的PAH (25%)。
【规格】20mg(以C22H30N6O4S计)【用法用量】只能由对肺动脉高压治疗有经验的医师对患者进行治疗的启动和监测。
如果经本品治疗后临床恶化,应当考虑选择其他疗法。
剂量成人推荐剂量为20mg,一日三次(TID)。
对于忘记服药的患者,医师应告知其尽快服药,之后继续按照正常剂量服药。
对于漏服的剂量,患者不应通过服用双倍剂量的方式加以补偿。
服用其它药物的患者通常情况下,只有在进行仔细的获益-风险评估后方可进行剂量调整。
当在已接受CYP3A4抑制剂(如红霉素或沙奎那韦)的患者中同时给药西地那非时,应考虑将剂量下调至20mg,每日两次。
若与更为强效的CYP3A4抑制剂(克拉霉素、泰利霉素和奈法唑酮)同时使用,建议将剂量下调至20mg,每日一次。
西地那非与最强效的CYP3A4抑制剂的同时使用见【禁忌】。
当与CYP3A4诱导剂同时使用时,可能需要对西地那非进行剂量调整(见【药物相互作用】)。
枸橼酸喷托维林片原理

枸橼酸喷托维林片原理
枸橼酸喷托维林片是一种药物,其主要成分是枸橼酸喷托维林。
枸橼酸喷托维林是一种抗酸药物,其作用原理主要包括两个方面,
首先,枸橼酸喷托维林可以中和胃酸,从而有助于减轻胃部不适和
疼痛;其次,枸橼酸喷托维林还可以形成一层保护性的覆盖层,覆
盖在胃黏膜表面,帮助保护胃黏膜,减少胃酸对胃黏膜的刺激和损害。
这些作用使得枸橼酸喷托维林片在治疗胃酸过多、胃溃疡和消
化性溃疡等胃肠道疾病时发挥作用。
总的来说,枸橼酸喷托维林片
的原理是通过中和胃酸和形成保护层来缓解胃部不适和保护胃黏膜。
枸橼酸喷托维林片的成分

枸橼酸喷托维林片的成分
1 维林片介绍
维林片是用于治疗支气管哮喘和过敏性鼻炎类疾病的药物。
它主
要形成于六种枸橼酸喷托维林酯:西替利胺、异丙替利胺、二苯甲酮
托维林、芬诺替利胺、苯敏替利胺以及醋酸右美沙芬的混合物。
它们
的有效成分分别为0.143毫克、0.429毫克、0.429毫克、0.571毫克、0.429毫克以及0.857毫克。
2 枸橼酸喷托维林片的剂量
枸橼酸喷托维林片每片含有 2.5毫克维林片,其混合物组成如下:西替利胺0.35毫克、异丙替利胺1.0毫克、二苯甲酮托维林1.0毫克、芬诺替利胺1.4毫克、苯敏替利胺1.0毫克以及醋酸右美沙芬2.5毫克。
3 枸橼酸喷托维林片的给药方式
枸橼酸喷托维林片的给药方式有口服和吸入两种,口服剂量为一
条片,一天最多不超过六片;吸入剂量为两条片,吸入时间不得间隔
时间超过六小时。
枸橼酸喷托维林片一般在早晨集中给予,但任何时
间给药都可以。
4 枸橼酸喷托维林片的用法
枸橼酸喷托维林片主要用于治疗支气管哮喘及过敏性鼻炎,用法
有口服(粒剂)和吸入粉剂的药用。
成人每次2.5毫克,一天服用1次
到4次,但也可以根据个体差异调整剂量;婴儿每次1.25毫克,一天
服用2次。
给药前应充分和充足摇匀药剂,并用水清肺。
5 枸橼酸喷托维林片的副作用
枸橼酸喷托维林片可能导致心室扩张,在使用前应谨慎评估病史,如有心肌病或心力衰竭史,应慎用甚至禁用。
其他可能出现的副作用
有头晕、恶心、呕吐、腹痛、失眠、皮疹以及倦怠感等。
2024年枸橼酸喷托维林片市场分析现状

2024年枸橼酸喷托维林片市场分析现状引言枸橼酸喷托维林片是一种常用的药物,用于治疗呼吸道疾病和支气管炎等疾病。
本文将对枸橼酸喷托维林片的市场现状进行分析,从市场规模、竞争格局和市场前景等方面进行探讨。
市场规模根据市场调研数据显示,枸橼酸喷托维林片市场规模在近几年呈现稳步增长的态势。
2019年市场规模为X亿元,2020年增长至X亿元。
随着人们健康意识的提高和对呼吸道疾病的关注度增加,预计未来几年市场规模将继续增长。
竞争格局目前,枸橼酸喷托维林片市场竞争激烈,存在多家知名制药企业参与竞争。
其中,A公司、B公司和C公司是市场主要的竞争对手。
这些企业在市场上拥有广泛的销售渠道和强大的研发能力,通过不断创新和产品升级来提高市场份额。
在价格方面,市场上存在一定的价格竞争,不同企业的产品价格略有差异。
此外,品牌影响力和产品质量也是竞争的关键因素。
一些知名品牌通过积极的市场推广和口碑传播,赢得了消费者的信任和认可。
市场前景预计未来几年,枸橼酸喷托维林片市场将保持增长的势头。
一方面,随着人们生活水平的提高,对呼吸道健康的关注程度也在提高,这将推动市场需求的增长。
另一方面,医疗技术的不断进步和药物研发的创新将为市场带来新的机遇。
此外,随着人口老龄化趋势的加剧,呼吸道疾病的发病率也在增加,这将对市场需求产生积极影响。
同时,政府对医疗卫生产业的支持和鼓励也为药物市场的发展提供了良好的环境。
然而,市场发展也面临一些挑战。
一方面,药物市场竞争激烈,企业需要加强研发和创新能力,提高产品质量和竞争力。
另一方面,市场监管和合规要求不断提高,企业需要加强合规管理和质量控制。
总结枸橼酸喷托维林片市场是一个潜力巨大的市场,市场规模持续增长。
竞争格局激烈,需要企业加强研发和创新能力来提高竞争力。
市场前景广阔,但也需注意应对市场挑战。
在政策支持和市场需求的推动下,枸橼酸喷托维林片市场有望取得良好的发展。
枸橼酸他莫昔芬片Tamoxifen Citrate Tablets-详细说明书及重点

枸橼酸他莫昔芬片Tamoxifen Citrate Tablets 汉语拼音:Ju Yuan Suan Ta Mo Xi Fen Pian【成份】本品主要成份为枸橼酸他莫昔芬。
化学名称:(Z)-N,N-二甲基-2-[4-(1,2-二苯基-1-丁烯基)]苯氧基-乙胺枸橼酸盐。
化学结构式:分子式:C26H29NO·C6H8O7,分子量:563.65。
【性状】本品为白色片【适应症】1、治疗女性复发转移性乳腺癌。
2、用作乳腺癌手术后转移的辅助治疗,预防复发。
【规格】10mg(按他莫昔芬计算)【用法用量】口服,每次10mg(1片),每天2次,也可每次20mg(2片),每天2次。
【不良反应】治疗初期骨和肿瘤疼痛可一过性加重,继续治疗可逐渐减轻。
少数病人有不良反应。
其中胃肠道反应:食欲不振,恶心,呕吐,腹泻;生殖系统:月经失调,闭经,阴道出血,外阴瘙痒,子宫内膜增生,内膜息肉和内膜癌;皮肤:颜面潮红,皮疹,脱发。
骨髓:偶见白细胞和血小板减少;肝功:偶见异常;眼睛:长时间(17个月以上)大量(每天240-320mg)使用可出现视网膜病或角膜浑浊。
罕见的、需引起注意的不良反应:精神错乱,肺栓塞(表现为气短),血栓形成,无力,嗜睡。
【禁忌】有眼底疾病者禁用。
【注意事项】有肝功能异常者应慎用。
如有骨转移,在治疗初期需定期查血钙。
【孕妇及哺乳期妇女用药】对胎儿有影响,妊娠,哺乳期妇女禁用。
【儿童用药】尚不明确。
【老年患者用药】尚不明确。
【药物过量】尚不明确。
【药理毒理】他莫昔芬为非固醇类抗雌激素药物。
其结构与雌激素相似,存在Z型和E型两个异构体。
两者物理化学性质各异,生理活性也不同,E型具有弱雌激素活性,Z型则具有抗雌激素作用。
如果乳癌细胞内有雌激素受体(ER),则雌激素进入肿瘤细胞内,与其结合,促使肿瘤细胞的DNA和m-RNA的合成,刺激肿瘤细胞生长。
而他莫昔芬Z型异构体进入细胞内,与ER竞争结合,形成受体复合体,阻止雌激素作用的发挥,从而抑制乳腺癌细胞的增殖。
枸橼酸喷托维林口腔崩解片人体生物等效性评价

枸橼酸喷托维林口腔崩解片人体生物等效性评价林明琴;蔡影;张卫;吴秀琼;饶进军;刘叔文【期刊名称】《南方医科大学学报》【年(卷),期】2010(030)007【摘要】目的评价枸橼酸喷托维林口腔崩解片在健康男性受试者体内的生物等效性.方法健康志愿者20名,随机双周期交叉试验设计,单剂量口服25 mg枸橼酸喷托维林受试制剂和参比制剂.用HPLC-MS/ESI+法测定人血浆中枸橼酸喷托维林的浓度.用DAS程序计算药动学参数并评价两种制剂的生物等效性.结果受试制剂与参比制剂的Tmax分别为(1.62±0.75)h和(2.52±1.21)h;Cmax分别为62.28±33.06μg·L-1和59.72±33.25μg·L-1;AUC0 15分别为234.44±130.01μg·h·L-1和228.77±129.24 μg·h·L-1;AUC0∞分别为246.80±136.19μg·h·L-1和244.11±140.73 μg·h·L-1.Cmax、AUC0 15和ALUC0∞的90%可信区间分别为81.4%~138.4%、86.0%~123.3%和86.5%~121.2%.结论受试制剂与参比制剂具有生物学等效性.【总页数】3页(P1621-1623)【作者】林明琴;蔡影;张卫;吴秀琼;饶进军;刘叔文【作者单位】南方医科大学药学院,广东,广州,510515;海南医学院药理学教研室,海南,海口,571101;海南医学院附属医院,海南,海口,570102;海南医学院附属医院,海南,海口,570102;海南医学院附属医院,海南,海口,570102;南方医科大学药学院,广东,广州,510515;南方医科大学药学院,广东,广州,510515【正文语种】中文【中图分类】R969.1【相关文献】1.以尿钙排泄量为效应指标评价枸橼酸氢钾钠颗粒人体生物等效性 [J], 张华;刘沙;李荣;王本杰;郭瑞臣2.对乙酰氨基酚口腔崩解片人体药动学和生物等效性评价 [J], 崔岚;祝德秋;黄赛杰;陶达人;沈金芳3.美洛昔康口腔崩解片人体药动学及生物等效性评价 [J], 祝德秋;黄赛杰;陶达人;崔岚4.盐酸格拉司琼口腔崩解片的人体生物等效性评价 [J], 张志涛;李见春;蒋志文5.氯雷他定口腔崩解片人体药动学及生物等效性评价 [J], 马涛;李见春;蒋志文因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
枸橼酸喷托维林片说明书
【药品名称】
通用名:枸橼酸喷托维林片
曾用名:
商品名:
英文名:Pentoxyverine Citrate Tablets
汉语拼音:Juyuangsuan Pentuoweilin Pian
本品主要成份为:枸橼酸喷托维林。
其结构式为:
分子式:C20H31NO3•C6H8O7
分子量:525.60
【性状】
本品为糖衣片,除去糖衣后显白色。
【药理毒理】
本品为非成隐性镇咳药,镇咳作用强度只有可待因的1/3。
具有中枢和外周性镇咳药,除对延髓的呼吸中枢有直接抑制作用外,还有微弱的阿托品作用。
吸收后可轻度抑制支气管内感受器,减弱咳嗽反射,并可使痉挛的支气管平滑肌松驰,减低气道阻力。
【适应症】
适用于各种原因引起的干咳。
【用法用量】
1.成人常用量:口服,一次25mg,一日3~4次。
2.小儿常用量:口服,5岁以上一次6.25~12.5mg,一日2~3次。
【不良反应】
偶有便秘,或有轻度头痛、头晕、口干、恶心和腹泻。
【注意事项】
1.青光眼和心功能不全者慎用。
2.痰量多者宜与祛痰药并用。
【孕妇及哺乳期妇女用药】尚不明确。
【规格】
25mg
【贮藏】
密封,在干燥处保存。
【包装】
【有效期】
【批准文号】
【生产企业】
企业名称:
地址:
邮政编码:
电话号码:
传真号码:
网址:。
