化工原理下册第二章
化工原理第二章流体输送设备

化工原理-第二章-流体输送设备一、选择题1、离心泵开动以前必须充满液体是为了防止发生()。
AA. 气缚现象;B. 汽蚀现象;C. 汽化现象;D. 气浮现象。
2、离心泵最常用的调节方法是()。
BA. 改变吸入管路中阀门开度;B. 改变压出管路中阀门的开度;C. 安置回流支路,改变循环量的大小;D. 车削离心泵的叶轮。
3、离心泵的扬程,是指单位重量流体经过泵后获得的()。
BA. 包括内能在内的总能量;B. 机械能;C. 压能;D. 位能(即实际的升扬高度)。
4、离心泵的扬程是()。
DA. 实际的升扬高度;B. 泵的吸液高度;C. 液体出泵和进泵的压差换算成液柱高度D. 单位重量液体出泵和进泵的机械能差值。
5、某同学进行离心泵特性曲线测定实验,启动泵后,出水管不出水,泵进口处真空计指示真空度很高,他对故障原因作出了正确判断,排除了故障,你认为以下可能的原因中,哪一个是真正的原因()。
CA. 水温太高;B. 真空计坏了;C. 吸入管路堵塞;D. 排出管路堵塞。
6、为避免发生气蚀现象,应使离心泵内的最低压力()输送温度下液体的饱和蒸汽压。
AA. 大于;B. 小于;C. 等于。
7、流量调节,离心泵常用(),往复泵常用()。
A;CA. 出口阀B. 进口阀C. 旁路阀8、欲送润滑油到高压压缩机的气缸中,应采用()。
输送大流量,低粘度的液体应采用()。
C;AA. 离心泵;B. 往复泵;C. 齿轮泵。
9、1m3气体经风机所获得能量,称为()。
AA. 全风压;B. 静风压;C. 扬程。
10、往复泵在启动之前,必须将出口阀()。
AA. 打开;B. 关闭;C. 半开。
11、用离心泵从河中抽水,当河面水位下降时,泵提供的流量减少了,其原因是()。
CA. 发生了气缚现象;B. 泵特性曲线变了;C. 管路特性曲线变了。
12、离心泵启动前____ ,是为了防止气缚现象发生。
DA 灌水;B 放气;C 灌油;D 灌泵。
13、离心泵装置中____ 的滤网可以阻拦液体中的固体颗粒被吸入而堵塞管道和泵壳。
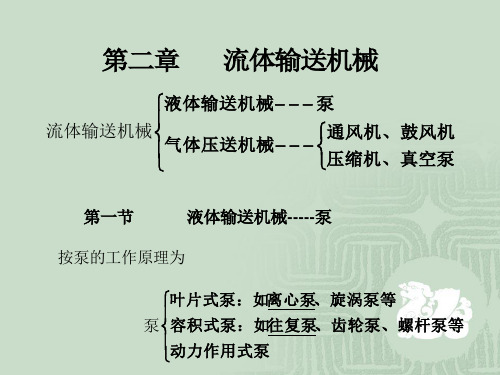
化工原理第二章 流体输送机械

3、适应被输送流体的特性
二、 流体输送机械的分类
输送液体——泵
1、流体根据输送介质不同
输送气体——风机或压缩机
动力式
2、根据工作原理不同 容积式
流体作用式
离心泵的外观
第一节 离心泵
一、 离心泵的工作原理和基本结构
1、离心泵的主要构造: (1)叶轮 ——叶片(+盖板)
1)叶轮
a)叶轮的作用 将电动机的机械能传给液体,使液体的动能有所提高。
一般都采用后弯叶片。2=25-30o
(4)理论流量
当离心泵确定,其β2、b2、D2一定,
当转速一定时,理论压头和流量呈直 线关系,
H A BqT
采用后弯叶片。2<90o,B>0,因此,H随q增大而减小。
3、实际压头
离心泵的实际压头与理论压头有较大的差异,原因在于流 体在通过泵的过程中存在着压头损失,它主要包括: 1)叶片间的环流 2)流体的阻力损失 3)冲击损失
H e K Bqv2 ——管路特性方程
对于气体输送系统,由于 常数 ,列伯努利方程以单位
体积为基准
HT
gZ
P
u 2 2
gH f
由于气体密度较小,位风压 gZ 一项一般可以忽略。
2、管路系统对输送机械的其他性能要求
1、结构简单,重量轻,投资费用低
2、运行可靠,操作效率高,日常操作费用低
理论压头、实际压头及各种压头损失与流量的关系为 H
q-H
实际压 头
实际压头和流量关系: H A BqT2
二、离心泵的主要性能参数和特性曲线
1、离心泵的主要性能参数
流量 q,泵单位时间实际输出的液体量,m3/s或m3/h。 压头 H,泵对单位重量流体提供的有效能量(扬程),m。 轴功率和效率p,电机输入离心泵的功率,单位W 或kW。 允许汽蚀余量 △h,泵抗气蚀性能参数,m 。
化工原理(天大版)---(下册)第二章 吸收

c c A c B 常数
根据菲克定律:
DAB DBA
dc A J A D AB dc z
dcB J B ห้องสมุดไป่ตู้BA dcz
1.
2-2-2 气相中的稳态分子扩散
等分子反方向扩散 pB1<pB2
第二章 吸收
• 吸收定义
利用组成混合气体各组分在溶剂中溶解度不同,来分离 气体混合物的操作,称为吸收操作。 溶质A 惰性组分B 溶剂S 吸收溶液 吸收尾气
• 吸收操作示意图 • 吸收在工业上的用途
分离混合气体以回收所需的组分 除去有害组分以净化气体 制备某种气体的溶液 工业废气的治理
• 吸收的分类
按有无化学反应 按溶质气体的数目
物理吸收 化学吸收
按有无明显热效应,
分单组分吸收 多组分吸收 等温吸收 非等温吸收
• 吸收与蒸馏的不同
原理不同 蒸馏可获得较纯的产品,而吸收则不能
2.1气体吸收的相平衡关系
2-1-1 气体的溶解度
• 相平衡 • 平衡分压(饱和分压) • 平衡浓度(饱和浓度) • 气体的溶解度:指气体在液相中的饱和浓度,用单位质
3. 指明传质过程进行的极限 yi2min≥y*i2=m xi2
xi1max≤x*i1=yi1/m
2.2 传质机理与吸收速率
2.2.1分子扩散与菲克定律
•
2.2.1分子扩散与菲克定律
扩散通量
J A D AB dc A dc z
菲克(Fick) 定律
JA:物质A在z方向上的分子扩散通量,kmo1/(m2· s) dcA/dcz:物质A的浓度梯度,kmol/ m4 DAB:物质A在介质B中的分子扩散系数, m2/s 当系统总压不高且各处温度均匀
化工原理下册第二章吸收1027教材

Z H O G N O G 2 .5 9 2 2 .5 m
26
5、 某吸收塔在101.325kpa,293k下用清水吸收空气中丙酮。当采 用2.1液气比时,丙酮回收率为95%。今拟在操作中将气体流量增加20 %,而液气进口浓度不变。试估计该塔此时的回收率。
已知系统符合Y=1.18X关系,且Kya与气体流率的0.8次方成正比。 已知:
P 1 0 1 . 1 K P a , T 2 9 3 K , V L 2 . 1 , X 2 0 , 9 5 % , Y 1 . 1 8 X , K Y a V 0 . 8
求,当其它条件不变,V’=1.2V时,则φ’?
27
解:因V变化后,而塔高不变
ZH O G N O GH O 'GN O 'G
7
5、吸收速率方程
N A kG (p A G p A i) NAky(yyi) N AkL (cA icA)L NAkx(xi x)
ky pkG kx ckL
8
N AK G(pA GpA * )L
NAKy(yy*)
N AK L(cA * GcA)L NAKx(x*x)
NAK Y YAYA
23
4、某吸收系统y=2x,入塔气含组分6%(体积),回收率90% (摩尔比),用清水吸收,用水量为1800kg/h。
求1)液气比(V/L)。2)如果操作线与平行线平行,且知塔D =1m,KYa=25.5Kmol/m3.h 。求出塔液X,及塔填料层Z。 已知: y=2x, y1=6%, X2=0,φ=90%, L=1800Kg/h, D=1m,
(1)出塔尾气的摩尔组成; (2)吸收剂的用量,Kg/h
(1)出塔尾气组成 已知y1=0.055,X2=0,φA=0.95
化工原理下册课件第二章 吸收第6次课解吸及其他条件下的吸收

V
6k 7m h -1ol
Z K ya N O G 1.0 3 k2 m m 3h o 1 l 0 .8 2 m 2 6 .3 7 8 .3m 2
4
点评:此题是对吸收章节的全面复习, 涉及到下面五个重要的知识点。 1.吸收平衡关系——亨利定律,涉及了m与H的换算
公式,H的单位,也复习到了。 2.操作线方程和最小液气比的计算。 3.传质系数及其关系的换算, 4.平均推动力法求算填料层高度。 5.吸收因数法求算填料层高度。还有吸收率和理想
L
思路就是由所求目标推至已知条件。
( 1) 求 x1
L y1 y2 V x1 x2
y1 y2 y1
或
y2
1 y 1
L 1 .5 L 1 .5 y 1 y 2
V
V min
y1 / m x2
y1
x1
mE
s
P M s H P
解题过程是由已知到未知。即求出 m
L V
y2
已知:在操作条件下,亨利系数E=1.73×105kN/m²。水溶
液的密度取1000kg/ m³,CO2的分子量44。
7. 常压25℃下,气相溶质A的分压为0.054atm的混 合气体分别与
– 溶质A浓度为0.002mol/l的水溶液; – 溶质A浓度为0.001mol/l的水溶液; – 溶质A浓度为0.003mol/l的水溶液; 接触,求以上三种情况下,溶质A在二相间的转移
2. 对于难溶气体,吸收时属于______控制 的吸收,强化吸收的手段是_____。
3. 物理吸收的极限取决于当时条件下______ __________,吸收速率取决于吸收质 从气相主体传入液相主体的_______。
4. 用Δp为推动力的气膜传质速率方程有两种,以气相 传质膜系数表达的传质速率方程为 ________________,以总传质系数表达的传质速率 方程为__________________。
化工原理化工原理第二章
H
节流损失
泵的特性曲线
he
工作点
he
阀门开大
p u 2 8 l le 2 he z Q 2 5 g 2 g d g A BQ 2
Q
六、离心泵的组合操作 ——串、并联 1、并联
叶片后弯,2<90,ctg2>0,即H随流量增大而减小;
叶片径向,2=90,ctg2=0,即H不随流量而变化; 叶片前弯,2>90,ctg2<0,即H随流量增大而增大。
(4)理论压头与液体密度无关。 这就是说,同一台泵无论输送何种液体, 所能提供的理论压头是相同的。 注意:泵对单位体积流体所加的能量=gH 与密度呈正比。
若不变,则
2
切割定律
2 思考:若泵在原转速 n 下的特性曲线方程为 H A BQ ,则新转速 n下泵的特性曲线
方程表达式如何? Q n Q
n
若叶轮切割,又如何?
n H H n
2
n n 2 H A B Q 2 n n n H A BQ 2 n
请思考:与 H有关的因素有那些?分别是什么关系?
讨论: (1)理论压头与流量 Q、叶轮转速、叶轮的尺寸和构造(r2、b2、2)有关;
(2)叶轮直径及转速越大,则理论压头越大;
(3)在叶轮转速、直径一定时,流量 Q 与理论压头 H的关系受装置角2 的影响,列于下面:
叶片后弯,2<90,ctg2>0,即H随流量增大而减小;
2
五、离心泵的工作点与流量调节
匹配: 泵------供方 管路------需方
泵提供的流量 = 管路所需的流量 泵提供的压头 H = 管路所需的压头 he
化工原理第二章-传递过程基本方程

z
o x
z
x y
y
2.1.5 控制体与控制面
柱坐标系(Cylindrical coordinates):r,,z
= 0
z
z u
o
r
uz
r z
ur
2.1.5 控制体与控制面
球坐标系( Spherical coordinates):r,,
= 0
= 0
u r o
ur
r
u
作业 p.114-115 2.1,2.2
2.2 质量守恒与连续性方程
2.2.1 宏观质量恒算(总质量恒算)
恒算范围:宏观控制体
q m ,in qmi ,in
i 1,2,...,n
qm,out qmi ,out
i 1,2,...,n
若控制体内的流体包含 n 个组分,则对任一组分 i应用质 量守恒定律有:
对质点的其它物理量A也可进行上述运算
DA Dt
A t
A x
ux
A y uy
A z
uz
A t
u • A
DA/Dt称为物理量A的随体导数,A/t称 为局部导数,(u•)A称为对流导数
2.1.5 控制体与控制面
控制体与控制面 控制体:位置和大小固定的空间体积。可以是假想的,
对稳定流动过程,管道任一截面处的质量流量相等。
不可压缩流体 A2u2 A1u1 qV 对不可压缩流体,管道任一截面处的体积流量相等。
不可压缩流体在均匀管道内流动时,平均流速沿途保持 定值,并不因摩擦而减速!
【例2.4】
密度为920kg/m3、粘度为3.5cP的某油料,稳定流经一大 小管组成的串联管路。大小管尺寸分别为φ38×2.5mm和 φ25×2.5mm。已知油料在大管中的流速为0.8m/s,试分 别求该油料在大管和小管中的体积流量、质量流量及质 量流速。
化工原理第二章1

③工作点对应的各性能参数反映一台泵的实际工作状态。
14
3.离心泵的流量调节 (1)改变管路特性------变出口阀的开度
15
(2)改变泵的特性 ----变叶轮转速 nA<nB,转速增加,流量和压头均
增加。
(3)改变泵的特性 ----切削叶轮直径
调节范围不大,只能变小,适合 长期性调整,操作中调整不可行
P63
例2-3
16
四
离心泵的组合操作
1.双泵并联 ①理论上,H不变,Q加倍; ②实际工作流量并未加倍(QB<2QA),压头有所增加 ;n台完全相同的泵并联,组合泵的特性方程为: ③
H A B Q2 n2
2.双泵串联 ①理论上,Q不变,H加倍;
θ
28
3.往复泵特点:
(1) 流量只与泵缸尺寸、冲程、活塞往复次数有关,与泵的压
头、管路等无关。
(2) 理论上
单动泵的流量:QT=ASnr 双动泵的流量:QT=(2A-a)S nr 式中: QT —— 往复泵理论流量,m3/s; A —— 活塞截面积,m2;
a —— 活塞杆截面积,m2;
有效功率Ne :单位时间离心泵对流体做的功。 Ne=gQH ;
轴功率N:单位时间内由电机输入离心泵的功。 效率η :泵对外加能量的利用程度。 η = Ne /N 2.离心泵的性能曲线 ①H-Q曲线:随着流量的增加,泵的压头下降, 此规律对流量很小的情况可能不适用。 ② N-Q曲线:轴功率随流量的增加而增大,离心
部真空,周围液体以很高的流速冲向真空区域; ③当汽泡的冷凝发生在叶片表面附近时,大量液体以高频冲 击力冲击叶片,使叶轮损伤,这种现象称为“汽蚀”。
化工原理第二章习题及答案

C安置回流支路,改变循环量的大小
D车削离心泵的叶轮
21、 当管路性能曲线写为H=A+BV2时()
A A只包括单位重量流体需增加的位能
BA包括单位重量流体需增加的位能与静压能之和
Cbv2代表管路系统的局部阻力损失
D BV2代表单位重量流体增加的动能
22、往复泵没有以下缺点
A流量不均匀
B与流量成直线关系
C可写为He】A+BV2,且B>0
D dHe/dV<0B
28、 离心泵在n=ni时的特性曲线(Hi〜V关系)与n=门2时的特性曲线(出〜V关系)对应点 的关系是()。
A
B
D
29、当离心泵内充满空气时,
A气体的黏度太小
C气体比液体更容易起漩涡D
30、 离心泵漏入大量空气后将发生(
A汽化现象B气缚现象
第二章 流体输送机械
1、泵流量 泵单位时间输送液体体积量
2、压头 流体输送设备为单位重量流体所提供的能量
3、效率 有效功率与轴功率的比值
4、轴功率 电机为泵轴所提供的功率
5、理论压头 具有无限多叶片的离心泵为单位重量理想流体所提供的能量
6、气缚现象 因为泵中存在气体而导致吸不上液体的现象
7、离心泵特性曲线 在一定转速下,离心泵主要性能参数与流量关系的曲线
C汽蚀现象D气浮现象
31、离心泵的调节阀开大时,则()A吸入管路的阻力损失不变
C泵入口处真空度减小
B泵出口的压力减小
D泵工作点的扬程升高
2
1、离心泵的安装高度超过允许安装高度时,离心泵会发生
气蚀
2、离心通风机的全风压是指
动风压和静风压之和
3、单级往复泵的理论流量计算式为
化工原理下册第二章吸收2

解:令p代表CO2在气相中的分压,那么由分压定律可知: p=Py==
在此题的浓度范围内亨利定律适用。 根据式2-2可知:c*=Hp 其中H为30℃时CO2在水中的溶解度系数。 由式2-4可知:
H EM S
故
c* p EM S
查表2-1可知30℃时CO2在水中的亨利系数E=1.88×105kPa,又因CO2为难溶于水的 气体,故知溶液浓度甚低,所以溶液密度可以按纯水计算。Ρ=1000kg/m3,那么
苯
加 热 器 含苯煤气
冷 却
水
器
过热蒸汽
煤气脱苯的吸收与解吸流程
h
6
2、气体吸收的工业应用
•净化或精制气体
例:合成氨工艺中,合成气中的净化脱碳
•制取某种气体产品的液态产品
例:用水吸收氯化氢气体制取盐酸
•回收混合气体中所需的组分
例:用洗油处理焦炉气以回收其中的芳烃,硫酸回收焦炉气中的氨
•工业废气的制理
吸收操作所得到的溶液称为吸收液成分为吸收操作所得到的溶液称为吸收液成分为和溶质和溶质排出的气体称为吸收尾气排出的气体称为吸收尾气主要成分主要成分为惰性气体为惰性气体还含有剩余的溶质还含有剩余的溶质吸收剂吸收尾气混合气吸收液逆流吸收操作示意图气体溶剂被吸收气体板式塔气体溶剂填料被吸收气体填料塔吸收设备流程填料塔板式塔吸收设备解吸流程吸收剂在吸收塔内再循环流程吸收煤气脱苯的吸收与解吸流程含苯煤气脱苯煤气净化或精制气体例
h
2
吸收操作所得到的溶液称为吸收液〔成分为S和溶质A〕,排出的气体称为吸收尾气(主 要成分为惰性气体B,还含有剩余的溶质A)。
吸收操作的逆过程〔即含溶质气体的液体,受到另一汽〔气〕相的作用使溶质与溶剂别离 的过程〕称为解吸。
化工原理第二章

化工原理第二章
•五、离心泵的安装高度
•安装高度: •液面到泵入口处的垂直距离(Hg)
•问题: •安装高度有无限制?
化工原理第二章
•0-0~1-1,B.E. •Hg,则p1 •当p1pv,•叶轮中心汽化汽泡•被抛向外围•压力升高 •凝结局部真空•周围液体高速冲向汽泡中心
化工原理第二章
•4-8个叶片(前弯、后弯,径向)•液体通道。 •前盖板、后盖板,无盖板 •闭式叶轮 •半开式 •开式
化工原理第二章
•(2)泵壳:•泵体的外壳,包围叶轮
•截面积逐渐扩大的蜗牛壳形通道
• 液体入口——中心
•出口——切线
思考:泵壳的主要作用是什么?
•①汇集液体,并导出液体; •②能量转换装置
•< 90度 — 后弯~流动能量损失小 •= 90度 — 径向叶片 •(2)后弯叶片,ctg >0 •b、r、, 则H
•Q ,则H (线性规律)
•(3)理论压头H与流体的性质无关
•(4)H与H的差距—•叶片间环流;阻力损失;冲击损失
化工原理第二章
•问:为什么泵采用后弯叶片的居多?
•后弯叶片:理论压头随流量增大而减少;径向:无关; •前弯:增大。在一定的叶轮尺寸、转速和流量下,前弯叶 •片产生的理论压头最大。但压头的提高包括静压头和动压 •头的提高。对后弯叶片静压头的提高大于动压头的提高,而 •对前弯叶片则相反,液体动压头的提高较大,同时液体在泵 •壳流动部分动压头转换为静压头时能量损失较大。为获得较 •高的能量利用率,离心泵总是采用后弯叶化片工原形理第式二章
化工原理第二章
•(2)转速——比例定律
•—— n 20%以内
化工原理下册第二章

第二章 吸收1. 从手册中查得101.33 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为0.987 KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33NH NH C P H*=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *==+∴===⋅ (2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.00974/0.9280.0105NH NH NH NH NH NH NH NH y m x P y P x m y x ****======+=== 2. 101.33 kpa 、10 ℃时,氧气在水中的溶解度可用p O2=3.31×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为0.21.故:222266101.330.2121.2821.28 6.43103.31106 3.3110O O a O O P Py kP P x -==⨯====⨯⨯⨯ 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=⨯所以:溶解度6522232()6.4310321.1410()/()11.4118()g O kg O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。
化工原理第2章解析

• 流速(u) ——在单位时间内流体在导管中流 过的距离,[m s1]
流速u
体积流量 qV 导管截面积 A
• 管道直径(d)
2-2 定常态流动与非定常态流动
• 在流体流动系统内,任一空间位置上的流量、 流速、压力和密度等物理参数,只随空间位置 的改变而改变.而不随时间变化的流动称为定 常态流动或稳定流动。
• 此数群被称之为雷诺准数。 雷诺准数值的大小,可以用来判断流动类型。
Re<2000,层流; Re>4000 ,湍流, Re=2000-4000,过渡流。
2-4 牛顿粘性定律
• 选相邻两薄圆筒流体(1,2)进行分析。设两 薄层之间垂直距离为dy,两薄层速度差为du, 即(u2-u1),两薄层之间接触的圆筒表面积为 A,两薄层之间的内摩擦力为F。
第二章 流体流动与输送
内容提要:主要讨论化工生产过程中的流体流 动的基本原理及流体流动的基本规律,并运用这 些原理与规律去分析和解决化工生产中的物料输 送问题。
基本要求: 1.了解化工生产过程中流体流动的基本规律; 2.掌握柏努利方程及其在化工生产中的应用; 3.掌握流体在管内流动阻力的计算; 4.了解流体输送机械的工作原理和相关计算。
大小。
2-5 流动边界层
• 在δ距离内流体层呈现速度梯度,这个速度梯 度区称为流动边界层。
• 稳定段的长度 L0:流体流动从管道入口开始形
成边界层起直到发展到边界层在管道中心汇合 为止的长度。
L0/d=0.0575Re
2-6 动量传递
层流:Байду номын сангаас
du dy
F A
M
L T 2
L2
质量 速度 面积 时间
《化工原理》(下)第二章吸收第一课时

Y2
X2
Y1
X1
22
思考题
含SO2为10%(体积)的气体混合物与浓度C为 0.020kmol.m-3的SO2水溶液在一个大气压下相接触。 操作条件下两相的平衡关系为pe=1.62C(大气 压) ,则SO2将从___相向___相转移, 以 气相组成表示的传质总推动力为_________ 大气压.
第二章 吸 收
2019/6/9
1
本章基本内容
① 吸收过程中气液相平衡 ② 吸收过程的传质机理* ③ 吸收过程传质模型及传质速率表达* ④ 吸收操作的物料衡算(重点) ⑤ 填料层高度的计算方法(重点)
2019/6/9
2
概述
一. 吸收生产中的应用
分离和净化原料气。原料气在加工以前,其中无 用的或有害的成分都要预先除去。如合成氨所用 的原料气中分离出CO2、CO等杂质。
易溶气体m<难溶气体m
2019/6/9
19
2.1.3 相平衡在吸收过程中的应用
1. 判断过程进行的方向 因自发进行过程总是趋向体系的平衡方向的,如图 中A、B点所示。
A点: y>ye; x<xe 溶质向液体转移:
吸收过程
ቤተ መጻሕፍቲ ባይዱB点: y<ye; x>xe 溶质向气相转移
解吸过程
2019/6/9
20
2. 确定传质过程的推动力
B 空气
2019/6/9
5
三. 典型吸收解吸流程
解吸的目的:回收溶质、溶剂的再生―使之循环使用
2019/6/9
6
采用吸收操作实现气体混合物分离必须解决的问 题:
选择合适的溶剂(吸收剂) 选择性地溶解某一组分(或某些组分)(一般原则)
化工原理下册第二章

第二章 吸收1. 从手册中查得101.33 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为0.987 KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33N H N HC P H*=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3N H C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987N H N H N H a C km ol mH C P km ol m kP *==+∴===⋅(2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.00974/0.9280.0105N H N H N H N H N H N H N H N H y m x P y Px m y x ****======+===2. 101.33 kpa 、10 ℃时,氧气在水中的溶解度可用p O2=3.31×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为0.21.故:222266101.330.2121.2821.28 6.43103.311063.3110O O a O O P Py kP P x -==⨯====⨯⨯⨯因2O x 值甚小,故可以认为X x ≈即:2266.4310O O X x -≈=⨯所以:溶解度6522232()6.4310321.1410()/()11.4118()g O kg O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。
化工原理第二版_(下册)夏清贾绍义_课后习题解答

化工原理第二版_(下册)夏清贾绍义_课后习题解答化原答案第1章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃)80.1859095100105某0.9620.7480.5520.3860.2360.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压PB 某,PA某,由于总压P=99kPa,则由某=(P-PB)/(PA-PB)可得出液相组成,这样就可以得到一组绘平衡t-某图数据。
以t=80.1℃为例某=(99-40)/(101.33-40)=0.962同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当某=0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P=13.3kPa下该溶液的平衡数据。
温度C5H12223.1233.0244.0251.0260.6275.1291.7309.3KC6H14248.2259.1276.9279.0289.0304.8322.8341.9饱和蒸汽压(kPa)1.32.65.38.013.326.653.2101.3某某某解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t=248.2℃时为例,当t=248.2℃时PB某=1.3kPa查得PA某=6.843kPa得到其他温度下A¸B的饱和蒸汽压如下表t(℃)248251259.1260.6275.1276.9279289291.7304.8309.3化原答案PA某(kPa)6.8438.00012.47213.30026.60029.48433.42548.87353.20089.000101.300PB某(kPa)1.3001.6342.6002.8265.0275.3008.00013.30015.69426.60033.250利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t=260.6℃时某=(P-PB某)/(PA某-PB某)=(13.3-2.826)/(13.3-2.826)=1平衡气相组成以260.6℃为例当t=260.6℃时y=PA某/P=13.3某1/13.3=1同理得出其他温度下平衡气液相组成列表如下t(℃)260.6275.1276.9279289某10.38350.33080.02850y10.7670.7330.5240根据平衡数据绘出t-某-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的某-y数据,并与习题2的结果相比较。
化工原理下册第二章吸收3.26

pA pAi * pA
.
kL 较小 kG
1 1 K L kL
H较小难溶气体
* cA cA cAi cA
cA cAi
c
* A
* cA ) N A K L (cA cA ) kL (cA
提高传质速率的措施:提高液体流速;加强液相湍流程度。
30
双膜模型
31
气膜控制
液膜控制
N A K L (cA cA )
XA xA 1 X A
ci cx
X A XA N A KL c c 1 X 1 X A A K Lc KX 1 X A 1 X A
K Lc NA X A XA 1 X A 1 X A
J A J B
3
2)传质速率方程 D NA ( p A1 p A2 ) RTz 6.单向扩散
D N A (c A1 c A2 ) z
A、B组分都同时参加两种运动。总体流动和分子扩散 (1)总体流动:因溶质A扩散到界面溶解于溶剂中,造成界面与主 体的微小压差,使得混合物向界面处的流动。 (2)总体流动的特点: 1)因外部压力引起的宏观流动。
N A k c c A
k c 对流传质系数,kmol /( m 2 s c )
8
1)靠近相界面处层流内层:传质机理仅为分子扩散,溶质A 的浓度梯度较大,pA随z的变化较陡。 2)湍流主体:涡流扩散远远大于分子扩散,溶质浓度均一化, pA随z的变化近似为水平线。 3)过渡区:分子扩散+涡流扩散,pA随z的变化逐渐平缓。
2)A、B在总体流动中方向相同,流动速度正比于摩尔分率(分压)。
化工原理下册第二章吸收10.8

流动速度正比于摩尔分率(分压)。
25
cA N' A N c
cB N'B N c
(3)单向扩散传质速率方程 :N的计算
NA J A N ' A
cA NA J A N c
N B J B N 'B
cB 0 JB N c
26
cB NB JB N c
cB JB N c
22
等分子反向扩散的过程
在气体吸收过程中,A为被吸收组分,B为惰性组分,液相不存 在B组分,不可能向界面提供组分B,因此吸收过程所发生的是组分 A的单相扩散,而不是等摩尔的分子扩散。此时,组分B被界面截留, 使得组分B在界面处的浓度高于气相主体,组分B的反向扩散依然存 在。
例如:吸收
23
界面处A不断被液体吸收;B由界面向主体反向扩散。 →界面处总压降低。→ 主体与界面间产生压差。 → 使气层向界面总体流动。 (携带A、B一起向界面流动,携带B的量正好补偿B的反向扩散) 气相主体与界面间产生的微小压差所促使的混合气体向界面流 动就称为主体流动。 主体流动不同于扩散流,扩散流是分子微观运动的宏观结果, 它传递的是纯组分A或B。主体流动是宏观运动,它同时携带组分A 与B流向界面。
而且组分A沿z方向的扩通量等于B沿 z的扩通量 J A JB
J A DAB dcA dc ; J B DBA B dz dz
DAB DBA
结论:在由A、B两种气体所构成的混合物中,A和B的扩散系数相等
12
速率理论:有时物质传递通量也可表示为该物质的浓 度与其传递速度的乘积。对于任一点处物质A的扩散通量:
cB JA J B N c
cB cA cA cB NA N N N N c c c
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 吸收1. 从手册中查得 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为 KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33NH NH C P H*=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *==+∴===⋅ (2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.00974/0.9280.0105NH NH NH NH NH NH NH NH y m x P y P x m y x ****======+=== 2. kpa 、10 ℃时,氧气在水中的溶解度可用p O2=×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为0.21.故:222266101.330.2121.2821.28 6.43103.31106 3.3110O O a O O P Py kP P x -==⨯====⨯⨯⨯ 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=⨯所以:溶解度6522232()6.4310321.1410()/()11.4118()g O kg O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。
混合气体的温度为30 ℃,总压强为 kPa 。
从手册中查得30 ℃时CO 2在水中的亨利系数E = KPa ,试求溶解度系数H (kmol/(m 3·kPa、))及相平衡常数m ,并计算每100克与该气体相平衡的水中溶有多少克CO 2。
解:(1). 求H 由2H OH EM ρ=求算.243510002.95510/()1.881018a H OH kmol m kP EM ρ-===⨯⋅⨯⨯ (2). 求m51.8810371506.6Em ρ⨯===(1) 当0.02y =时.100g 水溶解的2CO (2)(3)2255506.60.0210.1310.13 5.39101.8810CO aCO P kP P x E **-=⨯====⨯⨯ 因x 很小,故可近似认为X x ≈552222422()()445.3910 5.3910()()18()()1.31810()kmol CO kg CO X kmol H O kg H O kg CO kg H O ---⎡⎤⎡⎤=⨯=⨯⨯⎢⎥⎢⎥⎣⎦⎣⎦⎡⎤=⨯⎢⎥⎣⎦故100克水中溶有220.01318CO gCO4.在 kPa 、0 ℃下的O 2与CO 混合气体中发生稳定的分子扩散过程。
已知相距 cm 的两截面上O 2的分压分别为 kPa 和 kPa ,又知扩散系数为 cm 2/s ,试计算下列两种情况下O 2的传递速率,kmol/(m 2·s): (1) O 2与CO 两种气体作等分子反向扩散。
(2) CO 气体为停滞组分。
解: (1) 等分子反向扩散时2O 的传递速率:122523125523()0.185/ 1.8510/.273101.325.0.221013.33. 6.671.8510(13.33 6.67) 2.7110(/)8.314273210A A A a A a A aA DN P P RTZD cm s m s T K P kP Z cm m P kP P kP N kmol m s -----=-==⨯====⨯==⨯∴=⨯-=⨯⋅⨯⨯⨯(2) 2O 通过停滞CO 的扩散速率52123152 1.8510101.33101.33 6.67()ln ln8.314273210101.3313.333.0110/B A A A Bm B P DP DP N P P RTZP RTZ P kmol m s---⨯⨯-=-==⨯⨯⨯-=⨯⋅ 5. 一浅盘内存有2 mm 厚的水层,在20 ℃的恒定温度下逐渐蒸发并扩散到大气中。
假定扩散始终是通过一层厚度为5 mm 的静止空气膜层,此空气膜层以外的水蒸气分压为零。
扩散系数为×10-5 m 2/s ,大气压强为 KPa 。
求蒸干水层所需的时间。
解: 这是属于组分()A 通过停滞组分的扩散。
已知扩散距离(静止空气膜厚度)为3510Z m -=⨯.水层表面的水蒸气分压(20)C o 的饱和水蒸气压力为1 2.3346A a P kP =. 静止空气膜层以外;水蒸气分压为20A P =522.610/.101.33.27320293a D m s P kP T K -=⨯==+=单位面积上单位时间的水分蒸发量为52123162 2.610101.33101.33()ln ln8.314293510101.33 2.33465.0310/()B A A A Bm B P DP DP N P P RTZP RTZ P kmol m s ---⨯⨯=-==⨯⨯⨯-=⨯⋅ 故液面下降速度:685.0310189.0710/998.2A A L d N M m s d δθρ--⋅⨯⨯===⨯ 水层蒸干的时间:348510 2.20510 6.125/9.0710h h s h d d θθ--⨯===⨯=⨯ 6. 试根据马克斯韦尔-吉利兰公式分别估算0 ℃、 kPa 时氨和氯化氢在空气中的扩散系数D (m 2/s),并将计算结果与表2-2中的数据相比较。
解:(1). 氨在空气中的扩散系数. 查表2.4知道,空气的分子体积:329.9/B V cm mol =氨的分子体积:325.8/A V cm mol =又知29/.17/B A M g mol M g mol ==则0.101.33a C kP o 时,氨在空气中的扩散系数可由Maxwea Gilliland :式计算.353/21/2521/31/3114.3610(273)()17291061410/101.33(25.8)(29.9)NH D m s --⨯⨯⨯+==⨯⎡⎤⨯+⎣⎦(2) 同理求得521.32310/HCl D m s -=⨯7. 在 kPa 、27 ℃下用水吸收混于空气中的甲醇蒸气。
甲醇在气、液两相中的组成都很低,平衡关系服从亨利定律。
已知溶解度系数H = kmol/(m 3·kPa),气膜吸收系数k G =×10-5 kmol/(m 2·s·kPa),液膜吸收系数k L =×10-5 kmol/(m 2·kmol/m 3)。
试求总吸收系数K G ,并算出气膜阻力在总阻力中所占百分数。
解: 总吸收系数5255111.12210/()11111.5510 1.9552.0810G a G CK kmol m s kP k Hk ---===⨯⋅⋅++⨯⨯⨯气膜P 助在点P 助中所占百分数.1/ 1.12272.31/1/ 1.55G G C k k Hk ==+o o8. 在吸收塔内用水吸收棍子空气中的甲醇,操作温度27 ℃,压强 KPa 。
稳定操作状况下塔内某截面上的气相甲醇分压为 5 kPa ,液相中甲醇组成为 kmol/m 3。
试根据上题中的有关数据算出该截面上的吸收速率。
解: 吸收速率()A G A A N K P P *=- 由上题已求出521.12210/()G a k kmol m s kP -=⨯⋅⋅ 又知:31.955/()a H kmol m kP =⋅则该截面上气相甲醇的平衡分压为/ 2.11/1.955 1.08.5.A a A a P C H kP P kP *====则55221.12210(5 1.08) 4.410/()0.1583/()A N kmol m s kmol m h --=⨯⨯-=⨯⋅=⋅9. 在逆流操作的吸收塔中,于 kpa 、25 ℃下用清水吸收混合气中的H 2S ,将其组成由2%降至 (体积)。
该系统符合亨利定律。
亨利系数E =×16 kPa。
若取吸收剂用量为理论最小用量的12倍,试计算操作液气比及出口液相组成若压强改为1013 kPa ,其他条件不变,再求手及解: (1) 求101.33a kP 下,操作液气比及出口液相组成。
41112222 5.5210545.101.330.020.0204110.020.0010.001110.001E m P y Y y y Y y X ⨯======--===--= 最小液气比12min 120.02040.001()518.0.0204/545Y Y L Y V X m --===-操作液气比为min 1.2() 1.2518622.L LV V=⨯=⨯=出口液相浓度12125()10(0.02040.001) 3.1210622VX X Y Y L-=+-=+⨯-=⨯(2) 求1013a kP 下的操作液气比及出口液组成45.5210545.1013E m P ⨯=== 则:'12min 120.02040.0001()51.80.0204/5451.251.862.2Y Y L Y V X mLV--===-=⨯=出口液相组成:''41212'1()0(0.02040.001) 3.121062.2V X X Y Y L -=+-=+⨯-=⨯11. 在 kPa 下用水吸收据于空气中的氨。
已知氨的摩尔分数为,混合气体于40 ℃下进入塔底,体积流量为 m 3/s ,空塔气速为 m/s 。
吸收剂用量为理论最小用量的倍,氨的吸收率为95%,且已估算出塔内气相体积吸收总系数的平均值为。
在操作条件下的气液平衡关系为,试求塔径及填料层高度。
解:121212min 1211220.10.111110.1(1)0.1111(10.95)0.005555.0.0.11110.005555() 2.47.0.11112.61.1 2.47 2.72.1()(0.11110.005555)00.0388.2.722.60.956.2.721G Y Y Y X Y Y L Y V X mLVV X Y Y X L mV S L N ϕ==-=-=⨯-==--===-=⨯==-+=⨯-+=====o 122210.1111ln[(1)]ln[(10.956)0.956]13.8110.9560.005555Y Y S S S Y Y **--+=-⨯+=--- 塔截面积:20.556/1.20.463.m Ω==塔径:0.77.D m ==又知:0.5562730.90.0195/.22.427340V kmol s =⨯⨯=+ 则:0.01950.38.0.11120.463G Ya V H m K ===Ω⨯o 塔上填料层高度:0.3813.8 5.23.G G Z H N m =⋅=⨯=o o12.在吸收塔中用清水吸收混合气中的SO 2,气体流量为5000 m 3(标准)/h ,其中SO 2占10%,要求SO 2回收率为95%。
