微生物环氧化物水解酶的研究进展
生物催化手性合成

用于手性合成药物的生物催化剂的发现与利用—中国科学家的研究和发展的综述郁惠蕾许建和等摘要:活性药物成分中手性问题的重要性是毋庸置疑的,药理学家,化学家,化学工程师,和行政管理人员都有这样的认识。
事实上,世界范围的单一对映体药物已超过1500亿美元。
在这些单一对映体中生物催化合成的贡献仍在不断增加(已上升到15-20%)这篇文章将集中讲述制药工业中的生物催化合成手性化合物。
不同的酶,例如氧化还原酶,环氧化物水解酶,腈水解酶,和羟基腈裂解酶,它们是从不同来源的物种包括微生物和植物中分离出来的一种酶。
利用这些酶进行的单一对映体和不对称合成会在这里简洁的讨论。
关键词:生物催化,生物催化剂的筛选,中国,手性合成,筛选方法目录:引言生物催化剂来源:来自菌株保藏机构或公司的商业酶目标生物催化剂自然界的筛选植物材料中生物催化剂的筛选宏基因组中生物催化剂的筛选快速筛选的方法:传统和新型筛选检测型筛选立体选择性筛选手性合成中生物催化举例氧化还原酶脱氢酶氧化酶水解酶脂肪酶酯酶环氧化物水解酶腈水解酶裂解酶羟裂合酶醛缩酶其他裂解酶异构酶展望参考文献1.0引言自从认识到手性药物对人体的作用,新手性药物试剂的市场需求正在不断的增长。
在2000年的时候,35%的药物中间体是手性的,这个数字有望在2010年的时候达到70%。
含有手性中心的化合物通常以单一异构体的形式合成。
目前美国食品和药监局法规要求有非治疗型的异构体必须是非致畸的证据。
更重要的是日益增长的规模和这些分子复杂性频繁导致了多个手性中心。
然而对用于商业目标的催化剂98%的单一对映体ee值是最低可以接受的水平。
化学家们已经研究了几百年的有机化学,但是微生物做这项工作了至少几百万年。
来自于微生物和其他来源的酶在化疗、区域选择性、和对映体的选择性方面在温和的pH、温度以及压力下有多种不同的反应范围。
奥地利生物催化应用研究中心的教授Kurt Faber曾说过当涉及到需要98%甚至更高的选择性时,你最好选择生物催化过程,因为要超过95%其他方法是非常困难的。
微生物对有机物的降解作用

微生物对有机物的降解作用摘要:本文介绍了有机物的性质、污染状况及处理方法;以多环芳烃和农药为例阐述了微生物降解有机物的机理及影响因素;综述了国内外研究较多的几种生物难降解污染物微生物处理技术的进展,并对今后的几个研究发展方向进行了展望。
关键词:微生物有机物降解作用1 引言有机污染物是指以碳水化合物、蛋白质、氨基酸以及脂肪等形式存在的天然有机物质及某些其他可生物降解的人工合成有机物质为组成的污染物,主要包括酚类化合物、芳香族化合物、氯代脂肪族化合物和腈类化合物等。
目前,由于大量工业废水和生活污水未达标排放,以及广大农村地区大量使用化肥和农药等农用化学物质,使我国水体和土壤受到不同程度的污染,严重的破坏了地球的生态平衡。
七大水系的411个地表水监测断面中,水质为I〜川类、W〜V类和劣V类的断面比例分别为41%、32%和27%。
其中,珠江、长江水质较好,辽河、淮河、黄河、松花江水质较差,海河污染严重。
而农业土壤中15种多环芳烃(PAHs)总量的平均值为4.3mg/kg,且主要以4环以上具有致癌作用的污染物为主,占总含量的约85 %,仅有6%的采样点尚处于安全级。
而工业区附近的土壤污染远远高于农业土壤:多氯联苯、多环芳烃、塑料增塑剂等,这些高致癌的物质可以很容易在重工业区周围的土壤中被检测到,而且超过国家标准多倍。
处理有机物的一般方法可分为三大类[1]:物理方法:主要有吸收法、洗脱法、萃取法、蒸馏法和汽提法等;化学方法:如光催化氧化法、超临界水氧化法、湿式氧化法、以及声化学氧化法等,这一方法应用较多;生物方法:包括植物修复,动物修复和微生物降解三类技术。
与其他处理方法相比,微生物降解有机物具有无可比拟优势:(1)微生物可将有机物彻底分解成C02和出0,永久的消除污染物,无二次污染;( 2)降解过程迅速,费用低,为传统物理、化学方法费用的30% 〜50%;(3)降解过程低碳节能,符合现在节能减排的环保理念。
酶的应用及酶工程的研究进程

酶的应用及酶工程的研究进程第一部分:酶的应用酶是生物催化剂,可以加速化学反应的速率,并在温和条件下进行。
由于其高效、选择性和环境友好性等特点,酶在许多领域都有广泛的应用。
以下是一些常见的酶应用:一、食品工业:酶在食品加工中起到重要作用。
例如,淀粉酶可将淀粉分解为糖类,增加产品甜度;蛋白酶可用于肉类嫩化或乳制品凝固等。
是的,酶在食品工业中发挥着重要作用。
以下是一些常见的酶在食品加工中的应用:1.淀粉酶:淀粉酶可以将复杂的淀粉分子降解为较简单的糖类,如葡萄糖和麦芽糖。
这种转化过程被广泛应用于面包、啤酒、乳制品和果汁等产品中,以增加甜度、改善口感或促进发酵。
2.蛋白酶:蛋白质水解酶可以将肉类中较大分子量的蛋白质分解成更小的片段。
这种嫩化处理可使肉质变得更加柔软,并提高其口感和咀嚼性。
3.凝固剂:某些特定类型的微生物产生了能够凝结牛奶或豆浆等液体的特殊凝固剂(例如拉丁语"rennet")。
这些凝固剂主要含有胰凝乳素(chymosin),它可以水解牛奶中存在的一种叫做κ- 链球菌素(k-casein) 的蛋白质,在此过程中形成凝固物。
4.果汁澄清酶:果汁中的浑浊物质可以通过果汁澄清酶来降解和去除。
这种酶能够分解果胶、纤维素等多糖类,从而使果汁更加透明和清澈。
这些是食品工业中常见的一些酶应用,它们帮助改善产品的口感、稳定性和质量,并提高生产效率。
二、制药工业:许多药物合成过程需要使用特定的酶来催化关键步骤。
此外,生产抗体、激素和维生素等也需要借助酶。
在制药工业中,酶的应用非常广泛。
以下是一些常见的酶在制药工业中的应用:1.合成酶:许多药物的生产需要使用特定的酶来催化关键步骤。
例如,通过利用氨基转移酶和脱水氢化酶等,可以合成抗生素、激素和维生素等重要药物。
2.抗体生产:单克隆抗体是治疗和诊断许多疾病所需的重要工具。
在抗体生产过程中,将目标蛋白注射到动物或人体内后,通过特定细胞分泌出相应抗体。
微生物降解农药的研究进展

微生物降解农药的研究进展一、简述农药作为现代农业中不可或缺的一部分,对于提高农作物产量和防治病虫害起到了关键作用。
农药的过量使用不仅会导致环境污染,还可能对人体健康产生潜在威胁。
寻找一种高效、环保的农药降解方法显得尤为迫切。
微生物降解农药作为一种新兴的技术手段,逐渐受到研究者的关注。
微生物降解农药是指利用微生物的代谢活动将农药分解为无毒或低毒物质的过程。
这种降解方式具有高效、环保、低成本等优点,且不会对环境产生二次污染。
已有多种微生物被证实具有降解农药的能力,如细菌、真菌和放线菌等。
这些微生物通过分泌特定的酶类,将农药分子中的化学键断裂,从而实现农药的降解。
随着研究的深入,微生物降解农药的机理逐渐得到揭示。
研究者发现,微生物降解农药的过程涉及到多个生物化学反应,包括氧化、还原、水解等。
这些反应能够将农药分子转化为更易降解的小分子物质,进而被微生物完全利用。
微生物降解农药的效率还受到多种因素的影响,如温度、湿度、pH值以及农药的种类和浓度等。
关于微生物降解农药的研究已经取得了一定的进展。
研究者通过筛选具有高效降解能力的微生物菌株、优化降解条件以及研究降解过程中的关键酶类等方面,不断提高微生物降解农药的效率。
一些研究还关注于将微生物降解农药技术应用于实际生产中,为农业生产提供更为环保、安全的解决方案。
尽管微生物降解农药具有诸多优点,但其在实际应用中仍面临一些挑战和限制。
某些农药分子结构复杂,难以被微生物完全降解;不同地区的土壤和气候条件也可能影响微生物降解农药的效果。
未来研究需要进一步深入探索微生物降解农药的机理和影响因素,以期为该技术的广泛应用提供更为坚实的理论基础和实践指导。
微生物降解农药作为一种环保、高效的农药降解方法,具有广阔的应用前景。
随着研究的不断深入和技术的不断完善,相信微生物降解农药将在未来农业生产中发挥越来越重要的作用,为农业可持续发展贡献力量。
1. 农药在现代农业生产中的重要性农药在现代农业生产中扮演着举足轻重的角色。
微生物降解农药的研究进展

加强 农药 的降解研究 、 解决农 药对 环境 、 的污染 问题 , 食物 是 人类 当前迫切需要 解决 的课题 。 生物修 复 (ie eii ) Bo m d tn是指 利用微 生物 或其他 生物将 r ao 存在 于土壤 、 水 和海洋 中的有毒 、 害 污染 物降 解 为二 地下 有 氧 化碳 和 水 或转 化 为无 害 物质 的 系统 , 与物 理 化学 方 法 相
Abta t T e d ga ain o e t ie n si b cora im Sa f ciemeh d.T e tp s o co ra s whc e sr c h erd t fp si d si ol y mirog ns Wa n e e t to h y e fmirogni o c v m ih d
摘要 利 用微 生物降解 土壤 中残 留的农 药是 一种 非常有效 的方法 。从 降解农 药的微 生物 种 类 、 解机理 、行 了综述 , 并且 对今后微 生物降解农 药的应 用前景和研 究趋 势进 行 了展 望。
关键 词 农 药; 生物 ; 微 降解 中图分类号 X 9 文献标 识码 52 A 文章 编号 0 1 — 6 12o )4 0 6 — 2 5 7 6 1(o82 —1 3 0 6
菌降解农药的本质是酶促反应【 9, 8 ]即化合物通过一定的方 -
式 进入 细菌 体 内 , 后在 各 种酶 的作 用下 , 过一 系列 的生 然 经
理生化反应 , 最终将农药完全降解或分解成分子量较小的无
毒或毒 性较小 的化合物 的过 程 。常见 的降解 酶类 主要有 : ① 水解 酶类 , 括磷酸 酶 、 磷水解 酶 、 包 对硫 酯酶 、 酰胺 酶 、 硫基 裂 解酶等 ; 化还原酶 类 , 括过氧 化物 酶和 多酚氧化 酶 ( ②氧 包 酪
《有机化学》有机合成方法研究进展

有机合成方法研究进展一、前言1.有机合成是有机化学中最富活力的领域有机合成是表现有机化学家非凡创造力的舞台。
有机合成是化学科学对人类文明作出重大贡献的领域。
资料:* 1900-2000年的100年中,化学合成和分离了2285万种化合物(包括天然产物、药物、染料、高分子化合物等)。
其中大部分都是有机合成的产物。
* 许多天然存在的有机化合物,包括复杂的天然产物,都可以用有机合成方法制得。
有机合成是有机化学中永不枯竭的研究资源:* 生命科学: 生物大分子,生物活性分子,生化分析试剂等* 医药学: 药物,药理、病理分析试剂等* 农业: 农药、农用化学品等* 石油: 石油化工产品等* 材料科学: 高分子化合物,功能材料等* 食品: 食品添加剂等* 日用化工: 染料,涂料,化装品等有机合成是推动有机化学发展的永恒动力:人类文明发展对新结构、新功能、新用途的有机化合物永恒的需求。
有机化学家在解决有机合成问题过程中,全面发展了有机化学:化学结构理论,反应理论,合成方法,分离纯化方法,结构鉴定方法等。
具有重要功能的复杂有机分子,如生物大分子、天然有机化合物、药物、染料、材料、特殊有机试剂、精细有机化学产品以及其它功能有机化合物的合成需要;结构与功能关系研究需要等是有机合成方法研究的基本动力。
例如:* 手性纯氨基酸的合成--------->不对称合成法* 多肽合成--------->固相合成法* 大规模药效筛选--------->组合化学法* 特殊结构化合物合成、零污染合成--------->生物有机合成法(酶法和基因工程法)2. 有机合成发展历史(1)1828年Wohler用典型的无机物合成了尿素。
开始了近代有机化学以及有机合成的历史。
(2)1917年,Robinson合成了托品酮。
开创了系统的有机结构理论、合成方法、反应机制和结构鉴定等的研究。
并第一次开设了有机合成课程。
(3)20世纪50年代NMR技术开始应用于有机化合物结构测定。
手性药物研究跨出重要一步_周雨

分类号:B J624科技日报/2001年/12月/10日/第009版/医药与健康2001年10月,一个关于手性药物的/九五0重大科研项目通过国家验收,它在多方面取得的重大成果标志着手性药物研究跨出重要一步周雨畸婴启示了一个产业上个世纪60年代,欧洲发生了一场医药惨剧。
当时欧洲曾广泛给妊娠妇女服用镇静剂反应停(t h a l i d o m i d e)作为镇痛药和止咳剂,很多孕妇在服用此种药物后,生出了无头或缺腿的先天畸形儿,有的胎儿没有胳膊,手生在肩膀上,模样非常恐怖。
后来科学家经研究发现,反应停是一种消旋体药物,它的S-对映体有镇静作用,但它的R-对映体对胚胎有很强的致畸作用。
这引起了科学家的高度重视,由此在国外引发了手性药物开发的课题。
中国医学科学院药物研究所的黄量院士告诉笔者,手性是自然界的本质属性之一,生物体内大分子(如蛋白质、多糖、核苷和酶等)几乎全是手性的。
这些大分子在体内往往具有重要的生理功能。
而目前所用的药物多为有机小分子,很大一部分也具有手性,它们主要通过与体内酶、核酸等大分子中固有的结合位点产生诱导契合,从而抑制(或激动)该大分子的生理活性,达到治疗的目的。
人对药物有很高的选择性,人的各种酶有识别和选择性,要选择与之相匹配的药物的立体结构。
比如人体里的氨基酸都是左旋的,只有与左旋的氨基酸才能合成蛋白质。
因此,消旋药物中的一个对映体往往能很好地与手性大分子契合而发挥预期的药理作用,另一个对映体则往往不能很好地契合而成为无效对映体,或与其它大分子契合而产生不同的药理作用和具有毒副作用。
但这部分无效或具有毒副作用的对映体有的可以开发成为新用途的手性药物,在早几年,科学家经研究发现,反应停具有致畸作用的R-对映体具有抗H I V作用,这便是很好的例子。
手性药物不仅具有的技术含量高、疗效好、副作用小的优点,而且与创制新药相比,开发手性药物研究相对要风险小、周期短、耗资少、成果大。
这使得开发手性药物不仅具有重大的科学价值,同时也蕴藏着巨大的经济效益,世界许多国家纷纷投入巨额资金用于手性药物的开发。
溶菌酶的研究进展

溶菌酶的研究进展溶菌酶概述溶菌酶,也称为裂解素,是一种在细菌、真菌、动物和植物中都存在的水解酶。
它们可以降解细胞墙材料,使细胞变为裸露状态。
溶菌酶广泛应用于医学、食品和制药等领域。
溶菌酶的来源溶菌酶存在于多种微生物和真菌中,如链球菌、金黄色葡萄球菌、葡萄球菌、肺炎克雷伯菌、支原体和放线菌等。
通过培养和发酵技术,可以大规模制备纯净的溶菌酶。
此外,许多动植物也拥有溶菌酶,如人类唾液中的溶菌酶可以消化细菌、口腔扁桃体中的溶菌酶可以抵御病毒和细菌。
植物中的溶菌酶则是一种抗病毒和抗真菌的重要保护因子。
溶菌酶的作用溶菌酶的主要作用是降解细胞壁,使细胞膜完整性受到破坏,导致细胞死亡。
此外,溶菌酶也能辅助免疫反应,促进抗菌作用,调节免疫细胞的活动,增强自身的抵抗力。
在食品和制药领域,溶菌酶可以作为肉制品厌氧菌的灭菌方法,促进乳制品中的凝乳和定型,同时也可用于生产肝素和生物制剂等。
溶菌酶的研究进展溶菌酶研究的重点在于其抗菌作用和免疫调节作用。
近年来,溶菌酶的研究进展主要集中在以下两个方面。
溶菌酶与细菌感染溶菌酶可以降解细菌细胞壁,对于抗菌作用具有重要的意义。
近年来,科学家发现溶菌酶与多种细菌感染相关联,如肺炎球菌感染、链球菌感染等。
溶菌酶的研究有助于了解病原菌与免疫细胞之间的互动机制,为治疗细菌感染提供新的思路。
溶菌酶的免疫调节作用溶菌酶不仅有着明显的抗菌作用,还可以调节免疫细胞的活动,增强自身的抵抗力。
最新研究发现,溶菌酶还具有降低过敏反应和抗肿瘤等作用,将为临床治疗提供新的方向。
,溶菌酶具有广泛的应用价值和研究前景。
通过深入研究溶菌酶的结构、功能和作用机制,可为疾病的治疗和疫苗的研发提供新的思路,并推动溶菌酶在医药和食品等领域的应用。
酶工程的研究进展

酶工程的研究进展黎海彬,郭宝江(华南师范大学生命科学学院,广东广州510631)摘要:酶工程是现代生物技术的重要组成部分,它作为一项高新技术将为工业的发展起重要推动作用。
介绍了自然酶的开发、酶的化学和遗传修饰、酶的固定化、人工合成酶、酶基因的克隆和表达、酶的遗传设计等方面的理论和技术研究的最新进展。
关键词:酶工程;人工合成酶;酶基因的克隆和表达;固定化;遗传修饰中图分类号:Q814 文献标识码:A 文章编号:0253-4320(2006)S1-0040-04Advance in research on enzyme engineeringLI Hai 2bin ,G UO Bao 2jiang(C ollege of Life Science ,S outh China N ormal University ,G uangzhou 510631,China )Abstract :Enzyme engineering is an important part of m odern bio 2technology ,it will give an impetus to the industries as a new hi 2technology.The new advance in enzyme engineering research such as development of natural enzymes ,chemical and genetic m odification of enzymes ,imm obilization of enzymes ,synzymes ,cloning and expression of enzyme genes and genetic design of enzymes are introduced.K ey w ords :enzyme engineering ;synzymes ;cloning and expression of enzyme genes ;imm obilization ;genetic m odification 收稿日期:2006-03-30;修回日期:2006-06-03 作者简介:黎海彬(1964-),男,博士后,副教授,主要从事生物工程及生物物质分离纯化的研究,013005152637,haibinli2000@s 。
三种重要木质素降解酶研究进展

收稿日期:2003-02-09作者简介:王海磊(1978-),男,硕士;李宗义(1942-),男,教授,河南师范大学生命科学学院,研究方向:环境微生物学。
基金项目:河南省科技攻关项目(001200217)文章编号:1008-9632(2003)05-0009-03三种重要木质素降解酶研究进展王海磊,李宗义(河南师范大学生命科学学院,新乡 453002)摘 要:就三种重要木质素降解酶:LiP 、MnP 和漆酶在自然界的分布,化学组成、结构特征、降解机制、分子生物学等进行综述,并探讨了其作用协同性。
关键词:木质素过氧化物酶;锰过氧化物酶;漆酶;中图分类号:Q936文献标识码:A木质素是造纸工业排放黑液C OD 和色度形成的主要原因,其结构是由甲氧基取代的对-羟基肉桂酸聚合而成的异质多晶三维多聚体,分子间多为稳定的醚键、C-C 键,是目前公认的微生物难降解芳香化合物之一。
自1934年Boruff 和B uswell 首次发现能降解木质素的微生物种群,人们对木质素的生物降解进行了大量研究,1983年和1984年发现了木质素过氧化物酶(LiP)和锰过氧化物酶(MnP),由日本吉田首次在生漆中发现的漆酶(Laccase),也始终引起着人们的关注。
这三种酶被公认为是木质素重要的降解酶。
本文就三种木质素降解酶的最新研究进展进行综述,尝试为造纸废水的生物降解提供一些参考。
1 木质素过氧化物酶(LiP)1 1 分布及种类LiP 是第一个从黄孢原毛平革菌(Phanerochaete chrysospo rium )发现的木质素降解酶,在木质素降解中起关键性作用。
LiP 的产生菌在自然界分布相当广泛,许多腐朽木材的白腐菌、褐腐菌都可以产生LiP,主要产生菌见表1。
表1 Li P 的主要产生菌属名菌种名Trametes T.gibbosa ,T.versicolorPhlebia P.bre vispora ,P.radiata ,P.oc hrace o fulva,P.t reme llosa ,P.adustaCoriolus C.consors , C.hi rsutusOthersBj e rkande ra adusta ,Chrysonilia sito phila,Chrysospo rium pruinosum,Coriolopsis occ identalis,Phe llinus pini,Pol yporus ostrei formis,Phanerochaete chrysos porium ,Strepto myce s viridosporu ,Pleurotus ostreatus ,Junghuhunia se parabalima ,Fomes lignosus1 2 结构及特点LiP 代表一系列含Fe 3+、卟啉环(IX)和血红素附基的同工酶,由不同微生物产生的酶的种类和理化性质各不相同。
微生物降解农药研究的新进展

到 目前为止 , 人们 已分离 了许多可降解农 药的微 生 物, 这些微生物包 括细 菌、 真菌 、 放线 菌 和藻类。其 中 ,
收 稿 日期 :0 6—0 20 5—2 2
对硫磷水解 酶酒 旨酶 、 基酞胺 酶 、 硫 裂解 酶等 ;2 氧 ()
属( r hdr a 、 T coe ) 镰刀菌属 ( u r m) 。在这些微生 i m Fa i 等 au 物 中, 往往一种微生物 可降解 多种农 药 , 如细菌中假单
孢菌属 的一些种可降解 D T 一 H 、 D 、 B C 艾氏剂 、 毒杀芬 、 马拉硫磷等 2 0多种农 药 , 真菌 中曲霉属 的一些种 可 而 降解狄氏剂屏 狄 氏剂 、 七氯 、 敌百虫 、 硫磷 、 虫磷 等 澳 地 多种农药。同时一种农药也可被多种微生物所降解 。 存在于 自然环境中的藻类对有机磷也有降解作用 , 如小 球绿藻属 ( h rl) C o l 降解 甲拌磷 、 oa 对硫 磷等。获取高效 农药降解菌和降解基因的主要途径是从受污染 的土壤 、 水体底泥 、 污水处理厂排 出的污泥等受 污染 的环境介质
化 学农药 多为有毒物 品 , 巨大数 量 的有 毒物质 进 入环境中不 可避 免地会对生态环境乃至人类 造成不利 影响。化学农药 在环境 中 的残 留、 迁移 和 降解 主要取 决于生物 和非生物 因子二个 方面 , 中因微 生物 的作 其 用 而 引 起 的 降 解 过 程 称 为 生 物 降 解 ( i erd— bo gaa d t n …。生物降解的研究 始 于 2 i ) o 0世 纪 4 0年代 , 初 起 人们认为 , 生物降解是指土壤 、 水体和废水生物处 理系 统 中的需氧微 生物对天然和合 成有机 物的破坏 或矿 化 作用 。随着对有机 污染物 降解过 程研究 的深 入 , 物 生 降解的 内涵也在不断深 化和拓 展。由于在各种生物 降 解 中微生 物所 起 的作用最 大 , 以~般 提 到生 物降 解 所 主要是指微生物 降解 。在过 去几十 年中 , 有机氯 、 有 机磷等农 药的开发与应用 , 曾为人类在农 、 业生产 中 林 防治病虫 害 、 提高农 作物产 量中起 到了不可磨 灭 的积 极作用 。但对那些 性质 比较稳 定 、 于分解 的有 毒农 难 药 的长期 、 大量使用 , 已造成严重的全球性环境 污染和 生态破坏 。近年 来 , 继 提 出 了“ 相 软农 药 ” sf ps— (o et t i c e) 抑菌剂 ” fniac 等概 念 , 物农 药也 引 i s 和“ d (ug t i) st 生 起 了人们 的广泛兴趣 , 就 目前的技术水平来 看 , 但 化学 农药在今后很长一段时问 内还是不可替代 的产品。因 此, 解决 环境 中存 在 的农 药残 留问题 已经成 为世界 各 国的研 究热点 。其 中 , 微生物 的 降解 作用 也 引起 了更
我国生防微生物代谢产物研发应用进展与展望

微生物代谢产物农药(microbial metabolite pesticide,简称MMP)是以微生物发酵产生的代谢产物为活性成分,用于防治病虫草鼠等有害生物或促进植物生长发育的生物农药。
MMP 主要包括农用抗生素、微生物源植物免疫诱抗剂和微生物源植物生长调节剂,是我国应用面积最广的生物农药。
部分微生物代谢产物农药兼具预防与治疗效果,是未来绿色农药研发的一个重要方向。
本文总结了我国研发和应用的主要代谢产物农药种类、特点和最新研究进展,例如成都新朝阳研发生产的冠菌素,分析了我国代谢产物农药研发过程中存在的问题和挑战,为新型代谢产物农药的研发与应用提供参考。
中国是一个农业大国,生态环境多样,作物种类繁多,病、虫、草等危害频繁发生。
农药是农业生产中必需的生产资料,我国目前使用的农药以化学农药为主、生物农药为辅,为促进生态文明建设和农业可持续性发展,研发和使用无公害的生物农药得到全社会的高度重视。
生物农药的定义和范畴因不同国家和不同发展时期稍有不同,主要包括植物源农药、动物源农药、生物化学农药和微生物源农药。
微生物源农药主要包括活体微生物农药和微生物代谢产物农药(microbial metabolite pesticide,简称MMP)。
MMP 是以微生物发酵产生的代谢产物为活性成分、用于防治病虫草等有害生物或调节植物生长发育的生物农药,主要包括农用抗生素、植物免疫诱抗剂和植物生长调节剂。
农用抗生素具有特定的杀菌或杀虫活性,化学结构和防治作用机理明确,如井冈霉素和多抗霉素;植物免疫诱抗剂诱导植物产生免疫反应,增强植物抗病虫害能力,如阿泰灵;植物生长调节剂调节植物生长发育或抗逆性,如S-诱抗素。
本文总结了我国研发的主要代谢产物农药种类、特点和最新研发与应用进展,分析了目前研发与应用中面临的问题与挑战,为新型代谢产物农药的研发与应用提供参考。
01微生物代谢产物的特点(1)化学结构复杂,不能或不易通过化学方法合成;(2)生物活性具有选择性,病原菌对这些代谢产物不易产生抗药性;(3)兼具诱导植物产生免疫反应,提高植物抗病性,且有增产效果;(4)在土壤环境中的残留时间短,能够被微生物分解利用;(5)微生物代谢产物生产原料多为淀粉、糖类、玉米浆、黄豆粉等廉价再生性生物资源;采用发酵工艺生产,废液和废水可以回收再利用,对环境污染小,同一套设备略加改造可应用于其它菌种的发酵生产,投入成本相对较低。
【国家自然科学基金】_环氧化物水解酶_基金支持热词逐年推荐_【万方软件创新助手】_20140731
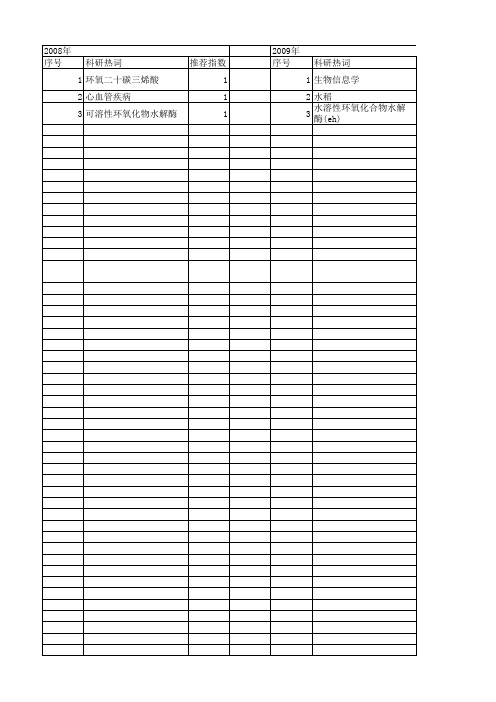
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
科研热词 推荐指数 环氧化物水解酶 3 高血压 1 苯乙烯 1 肾脏疾病 1 结构 1 细胞增殖 1 糖尿病肾病 1 研究进展 1 生物活性 1 生物拆分 1 生物学作用 1 生物信息学分析 1 环氧水解酶类 1 炎症反应 1 有机溶剂/缓冲液双相体系 1 手性环氧氯丙烷 1 宇佐美曲霉 1 多态性,单核苷酸 1 基因克隆 1 可溶性环氧化物水解酶 1 功能 1 内皮细胞 1 全细胞 1 侧翼未知dna序列 1 代谢 1
2011年 科研热词 推荐指数 高血压 1 遗传 1 脂细胞 1 胆固醇 1 绿豆环氧化物水解酶 1 环氧苯乙烯 1 环氧化物 1 环氧二十碳三烯酸 1 有机溶剂/缓冲液双相体系 1 心血管疾病 1 多态现象 1 多态性,单核苷酸 1 多囊卵巢综合征/遗传学 1 基因 1 可溶性环氧化物水解酶 1 可溶性环氧化合物水解酶抑制剂 1 不对称水解 1 (r)-苯基乙二醇 1
科研热词 推荐指数 可溶性环氧化物水解酶抑制剂 2 酵母双杂交 1 血管内皮生长因子 1 苯并芘 1 细胞核分裂 1 环氧二十碳三烯酸 1 毒性试验 1 心血管疾病 1 微核,染色体不完整 1 可溶性环氧化物水解酶 1 冠心病 1 内皮祖细胞 1 乙型肝炎病毒 1 rna剪接 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
2008年 序号
科研热词 1 环氧二十碳三烯酸 2 心血管疾病 3 可溶性环氧化物水解酶
推荐指数 1 1 1
2009年 序号
科研热词 1 生物信息学 2 水稻 3 水溶性环氧化合物水解酶(eh)
生物酶及其应用研究进展

生物酶及其应用研究进展生物酶是一种特殊的蛋白质,是生物体内的一种催化剂,能够加速化学反应的速度,也叫做酶。
生物酶在生命体内起着至关重要的作用,在生物体内的代谢中起到了重要的催化作用。
在人类社会中,生物酶的研究和应用也得到了广泛的关注和应用,本篇文章将重点介绍生物酶及其应用研究进展。
一、生物酶的分类根据催化反应的位置和类型,生物酶可以分为六大类:1. 氧化还原酶,如酒精脱氢酶、乳酸脱氢酶。
2. 转移酶,如转移辅酶A酶、转移单胺素酶。
3. 水解酶,如淀粉酶、脂肪酶。
4. 合成酶,如酰基转移酶、己糖酰基转移酶。
5. 氨基酸酶,如蛋白酶、重氮化酶。
6. 其他,如光化学反应酶、核糖体等。
二、生物酶的应用生物酶广泛应用于医疗、食品、环境等领域。
下面分别介绍:1. 医疗领域在医疗领域中,生物酶是一种非常重要的药物,其应用包括诊断、治疗和预防。
例如,蛋白酶就是一种常用的药物,用于消化蛋白质。
另外,类胰岛素酶在治疗糖尿病和血栓溶解中也有广泛的应用。
另外,现在糖尿病已成为人群中的高发病一种,生物酶的研究在治疗糖尿病方面有着广泛的应用。
2. 食品领域在食品工业中,生物酶也有着广泛的应用。
如果汁厂使用的酸脱氢酶、糖化酶、过氧化酶等;酿酒厂使用的乳酸脱氢酶、酒精脱氢酶等;饲料添加剂中含有消化酶、纤维酶等;制药行业则广泛使用酶制剂等。
3. 环境领域在环境领域中,生物酶的应用也得到了广泛的研究。
如在石油开采中,生物酶可以作为石油污染的治理剂;在环境监测中,生物酶也可以作为指示生物治理的模型酶;在废水处理中,利用微生物的酵素来去除水中的污染物质等。
三、生物酶研究的新进展1. 生物酶的结构研究生物酶的结构研究是目前生物学中的热点研究方向之一。
其研究的对象是生物酶的结构,通过分析酶分子的各种力学、光学、热力学及其它性质,揭示酶的构成和催化机制。
2. 酶工程技术酶工程技术是将分子生物学、生物化学、化学工程等学科综合运用,针对特定的催化反应,对酶进行改良,以提高酶的稳定性、活性和选择性等特性,从而实现酶在各种生产领域的广泛应用。
环氧化物水解酶的作用机制及应用研究

20 年第 , 卷第 2 06 3 7 期
文章编号 :0 6 4 8 20 ) 2 0 2 — 3 10 - 14( 0 6 0 — 0 9 0
《浙 江 化 工 》
・ 9・ 2
环氧化物水解酶的作用机制及应用研究 水
沈佳佳 ’张晓 军 2周 晓云 ( 、 江工 业大 学生物 与环 境 工程 学院 , 江 杭 州 300 ; , 1浙 浙 104 2 浙 江工业 大学 生物制 药研 究所 , 、 浙江 杭 州 3 00 ) 104
NC -环 ( 6 5 a 1 — 7a)
图 3 环 氧 化 物 水 解 酶 的 宏 观 结 构 图圈
帽
环氧化物水解酶属于 / p折叠型水解酶 , 其
微观结构 已经得到了充分的描述[ 是 由两个功能 4 1 , 性结构组成 : 核心结构和帽子结构。核心结构从 N 一
末端到 c 末端 , 由 8 p 折叠片组成的区域 , 一 是 个 一
从而产生较强的毒性和致癌性。
O
选择性的。
直到 19 和 1 9 年 , 91 9 3 两个独立的研究小组分 别发现 了微生物来源 的环氧 化物 水解酶能选择性
:
(1 d
^
地拆分环氧化物 , 得到的光学活性环氧化物能应用 于合成 。值得强调 的是 , 环氧化物水解酶的催化反 应要 比其他类型反应 ( 如酯类的生物催化反应 ) 要
其中,天冬氨酸残基亲核进攻环氧乙烷三元环中的
一
个碳原子 , 生成一个共价结合的酯 中间体 ; 在组氨
酸残基和羧酸残基的帮助下活化—个水分子 ,氢氧
使其水解成邻位二醇和酶。同 帽子结构 由五个螺旋组成 。图 3 描述了环氧化物水 根进攻将酯中间体 , Rn k等发现在 环氧化物水解酶的帽子结构中至 解酶的宏观结构[ 图中的 N 一环处于 N 催化末 时 , i 5 1 , C 一 端和帽子结构之 间 ,它的长度在 1-7 残基之 少存在—个酪氨酸残基 ,它为整个催化反应提供质 65 个 子, 并且和底物的结合程度有关 , 因此在环氧乙烷的 间, 帽子结构中有个帽子环 , 可插入 5 5 个残基。  ̄9
环氧化物水解酶

微生物环氧化物水解酶引言环氧化物水解酶广泛分布于动物界(包括人类),在肝脏中,环氧化物水解酶主要分布在内质网网上,最近的研究表明,它也分布于肝细胞的核膜、胞浆中,而在环氧化物酶体、溶酶体和线粒体中缺失。
环氧化物水解酶以多种同工酶形式存在,酶的单体相对分子量为48k-54k之间,没有血红蛋白和黄素做辅基。
环氧化物水解酶也可催化内源性和外源性的环氧化物,其中对内源性环氧化物的速率远大于外源性的环氧化物。
因为环氧化物水解酶在致癌物的形成中扮演一定角色,所以被作为肝癌的早期标志二受到广泛关注!环氧化物(epoxide)在多种生物体的代谢过程中广泛存在,又在多种生物活性物质的合成中被广泛应用,它们是一类很有价值的手性有机合成砌块和中间体。
环氧化物具有环氧乙烷三元环,该环中各原子的轨道由于不能在正面充分重叠,而是以弯曲键连接,因而具有较强的张力,其碳氧键具有很强的亲电性,故其能与各种亲核试剂反应,通过选择性开环及官能团转换,就可以很方便地合成很多种光学活性物质,而且它们的反应活性高,其开环反应中通常具有极好的位置选择性和立体选择性。
环氧化物水解酶(epoxide hydrolase)又称环氧化物水合酶(epoxide hydratase)或环氧化物水化酶(epoxide hydrolase),能立体选择性地将水分子加到环氧底物上生成相应的手性1,2-二醇。
应用此酶,能够得到具有光学活性的剩余环氧化物和相应的二醇化合物。
该酶在生物体内的外源性化合物代谢中起着重要的作用。
因此,环氧化物水解酶在生物体内,尤其是微生物体内,是普遍存在的。
一、选育对细菌EH的研究最早是在1967年,Schroepfer等人在Pseudomonad(NRRL.2994)中发现了EH,并利用该酶成功催化水解了环氧油酸。
此后奥地利的K.Faber研究小组开辟了对微生物环氧化物的研究。
细菌环氧化物水解酶在自然界中普遍存在,分组成型和诱导型两大类。
环氧化物水解酶的研究进展

环氧化物水解酶的研究进展娄文勇;赵莹;彭飞;宗敏华【摘要】环氧化物水解酶可高效率、高选择性地水解环氧化物生成手性邻二醇,对光学活性的邻二醇的合成和光学活性的环氧化物的制备具有重要意义.文章阐述了环氧化物水解酶的作用、来源、结构及其催化机制,进一步综述了环氧化物水解酶催化环氧化物水解、环氧化物水解酶的克隆表达等研究进展.%Epoxide hydrolases can highly and selectively catalyze epoxides to chiral diols, which is an effective way to synthesize chiral diols. This article introduces the structure, functions, sources and mechanism of catalysis of this enzyme. The research on the hydrolyzation of epoxides by epoxide hydrolases, the enzyme cloning and expression in other bacteria are summarized.【期刊名称】《华南师范大学学报(自然科学版)》【年(卷),期】2017(049)006【总页数】6页(P1-6)【关键词】水解酶;环氧化物;邻二醇;催化【作者】娄文勇;赵莹;彭飞;宗敏华【作者单位】华南理工大学食品科学与工程学院,应用生物催化实验室,广州510640;华南理工大学,广东省天然产物绿色加工与产品安全重点实验室,广州510640;华南理工大学食品科学与工程学院,应用生物催化实验室,广州510640;华南理工大学,广东省天然产物绿色加工与产品安全重点实验室,广州510640;华南理工大学食品科学与工程学院,应用生物催化实验室,广州510640;华南理工大学,广东省天然产物绿色加工与产品安全重点实验室,广州510640;华南理工大学食品科学与工程学院,应用生物催化实验室,广州510640;华南理工大学,广东省天然产物绿色加工与产品安全重点实验室,广州510640【正文语种】中文【中图分类】Q556.9环氧化物通过选择性开环可以制备具有光学活性的手性醇类化合物及选择性保留具有重要价值的环氧化物. 如作为神经保护药关键性合成子的(R)-4-氯苯基乙二醇可经环氧化物水解酶水解相应的环氧化物制备而得. 与之类似,茚环类环氧化物经环氧化物水解酶催化开环水解也可以制得抗艾滋病药物齐夫而定的重要中间体物质:(1R,2S)-环氧化合物和(1R,2R)-二醇. 环氧化物水解酶广泛存在于自然界中,在植物、动物、真菌和细菌中均存在环氧化物水解酶,其催化环氧化物水解反应相比化学催化有诸多优点,如选择性高、催化效率高、环境友好等,因此引起了广泛关注. 然而,从自然界筛选的环氧化物水解酶也存在一定的局限,如理论产率不超过50%,底物的耐受性较低,酶提取纯化困难和酶表达量较低等缺点. 针对这些问题,研究人员采用了基因克隆表达及基因突变等技术有效地克服了这些困难.近年来,光学纯的醇、氨基酸、胺、环氧化物和有机酸的制备成为研究的热点,其中手性醇具有重要的应用价值[1]. 1,2-苯乙二醇是一种手性醇,因其烷基链上α位连有4个不同的化学基团而具有一定的旋光性. 目前,像这种具有旋光性的手性醇被广泛用于医药领域、农药领域和材料领域. 光学纯的(S)-1,2-苯乙二醇因具有光学、热学和化学稳定性等特点不仅是液晶材料中重要的添加剂,同时还可以作为农药的中间体;而光学纯的(R)-1,2-苯乙二醇是制备具有光学活性的医用药物的重要中间体,如进一步合成光学活性药物β-肾上腺素阻断剂、(R)-硝基心定、抗心律失常药等[2-4]. (R)-1,2-庚二醇是用于合成铁电液晶材料的γ-内酯的前体[5].(2R,3S)-3-(4-甲氧基苯基)缩水甘油酸酯可用于合成抗癌药物氨肽酶N抑制剂Besattin、Phebetin、Porbestni和MR-387等一系列化合物[6]. (R)-苄基缩水甘油醚用于合成Acetogenins等免疫抑制剂[7].环氧化物是合成手性醇的重要中间体,其立体选择性开环可得到手性环氧化物或手性醇化合物,并用于后续的应用. 目前,环氧化物开环水解成手性醇的反应多集中在化学法和生物法[8]. 化学法常存在诸多不足,因为环氧化物在水中溶解性较差,需要添加有机溶剂,溶剂的消耗量比较大,步骤较繁琐,反应条件较苛刻,产品光学纯度低,而且反应中需要添加有毒的手性催化剂和保护剂[9-10]. 另外,Jacobsen法虽然能水解外消旋环氧化物得到手性邻二醇和手性环氧化物,但其存在底物谱窄、反应条件苛刻、选择性低、产物分离纯化困难和环境污染等问题. 与化学法相比,生物法利用酶或细胞作为催化剂,不仅具有催化效率高、选择性高、反应温和、污染小等优点,而且能够制备一些化学法难以合成的对映体纯的小分子手性邻二醇和手性环氧化物,因而生物法日益受到人们青睐,逐渐成为手性化合物制备的重要手段[11-13].环氧化物水解酶是可以将水分子选择性地加成至环氧环上,从而生成邻二醇类化合物的一种酶[14],它还可通过水解人体内环氧化物从而降低人体患癌症的几率[15]. 在活细胞中,芳香族和脂肪族的环氧化物均可被环氧化物水解酶水解,获得二醇,取得解毒和信号调节作用.[16-17]. 环氧化物水解酶的来源较为广泛,普遍存在于自然界的生物体中,几乎所检测过的哺乳动物体内都存在环氧化物水解酶. 在土豆、绿豆、黄豆、香蕉及烟草等植物中均发现了该水解酶. 另外,通过对微生物的研究也发现,该酶广泛存在于微生物体内,其主要微生物来源有Agrobacterium radiobacter、Arthrobacter spp.、Aspergillus niger、Bacillus megaterium、Beauveria Sulfurescens、Chryseomonas luteola、Corynebacterium spp.、Mycobacterium paraffinicum、Methylobacterium spp.、Norcadia spp.、Pseudomonas spp.、Rhodococcus erythropolis、Rhodosporidium toluloides、Rhodotorula glutinis、Streptomyces antibioticus、Trichosporon loubierii、Xanthophyllomyces dendrorhous等[18].自HECHTBERGER等[19]报道了利用来源于红球菌的环氧化物水解酶选择性地催化1,2-环氧庚烷不对称水解生成相应的R-二醇后,在水相中不同来源的环氧化物水解酶催化不同结构的环氧化物不对称水解的研究相继出现. 21世纪初,我国的研究人员在产环氧化物水解酶的菌株筛选方面做了大量工作. 曲音波课题组从全国多地收集到的长期被石油、动物油或植物油污染的土壤或水样中分离得到一株产环氧化物水解酶的类产碱假单胞菌,该菌可用于拆分苯基缩水甘油酸乙酯. 研究发现,在添加吐温60的反应体系中,该菌全细胞催化的底物浓度可达78 mmol/L,且产物的光学纯度达98%,但产率较低(33%)[20-21]. 孙万儒课题组从土壤样品中筛选出一株产环氧化物水解酶的黑曲霉菌株[22],利用该菌株催化外消旋环氧苯乙烷不对称水解,得到(R)-1,2-苯基乙二醇的光学纯度大于99%,但随着反应时间的延长,底物的非酶水解严重,导致产物的光学纯度明显下降[23]. 许建和课题组从土壤中筛选出一株产环氧化物水解酶的巨大芽孢杆菌,该菌具有较高的对映体选择性,可选择水解(R)-缩水甘油苯基醚,对映体选择率E值高达47.8%,可选择性地水解(R)-缩水甘油苯基醚[24],后期他们还报道了绿豆中存在环氧化物水解酶的事实[25]. 国外同样也对产环氧化物水解酶的菌株进行了筛选研究. DUARAH等[26]从土壤里筛选到一株塔宾曲霉,该菌株具有反应速度快、选择性高等优点,反应45 min可将外消旋的环氧苯乙烷水解成光学纯度达97%的(R)-苯乙二醇,且底物的转化率高达99%. 同时还研究了苯环上的氯取代对反应的影响,结果表明,取代后底物的转化率不受影响,但是产物的光学纯度以及反应时间受到严重影响.目前,已发现的环氧化物水解酶可以分为以下几类:可溶性环氧化物水解酶、微粒体环氧化物水解酶、保幼激素环氧化物水解酶、胆固醇环氧化物水解酶、羟环氧烯酸水解酶、白三烯A4环氧化物水解酶以及柠檬烯环氧化物水解酶7个亚家族[27-29].对比不同来源环氧化物水解酶的蛋白氨基酸序列发现,不同来源酶的氨基酸序列相似程度很高,且基本上都属于α/β折叠型的水解酶[30],它们具有三位一体的结构[31],1个电荷中继网和亲核基团共同组成了催化三联体. 活性位点由核心结构和帽子结构组成,核心结构由2个天冬氨酸残基和1个组氨酸残基构成[32-33].目前接受程度较高的催化机理为:先由酶的帽子结构中2个酪氨酸残基将环氧化物中的1个O原子质子化,再经酶的1个天冬氨酸残基进攻该部分被质子化的环氧化物,形成1个共价结合的中间体,然后落入酶活性中心的1个水分子受到组氨酸残基和另一个天冬氨酸残基的活化,失去1个质子,形成1个羟基,该羟基进而进攻乙二醇-单酯-酶中间体,酪氨酸被还原,环氧化物被水解生成二醇[33].然而,不同类型和不同来源的环氧化物水解酶的蛋白相对分子质量大小却明显不同,哺乳动物的可溶性环氧化物水解酶是由2个62 kDa单体结构组成的同型二聚体,而来源于植物的可溶性环氧化物水解酶一般以单体或二聚体蛋白的形式存在,其相对分子质量为35 kDa左右[33-34]. 微粒体环氧化物水解酶的相对分子质量约50 kDa[35],而羟环氧化物烯酸水解酶和白三烯A4环氧化物水解酶的相对分子质量分别为53 kDa和70 kDa.环氧化物水解酶可以高效催化环氧化物水解并生成邻二醇,这也引起了研究人员对该酶催化反应条件的探索. 娄文勇课题组先后研究了来源于绿豆和黄豆的环氧化物水解酶的催化特性[32,36-40]. 在2012年,该课题组陈文静[32]利用从绿豆中提取的环氧化物水解酶催化环氧苯乙烷. 由于环氧苯乙烷在水相中(特别是在高底物浓度情况下)易水解的性质,建立了在磷酸缓冲液体系中,底物浓度为5 mmol/L的绿豆环氧化物水解酶高效催化环氧苯乙烷的反应体系. 在这个体系里,催化终止时可获得(R)-1,2-苯乙二醇的对映体过量率高达92.6%,且产率高达47.6%. 为解决水相体系中催化反应时底物浓度较低的问题,随后研究了在有机溶剂-缓冲液双相反应体系中绿豆环氧化物水解酶催化环氧苯乙烷,选取6种有机溶剂构建双相催化体系,分别是乙酸乙酯、三氯甲烷、环己烷、正己烷、辛烷和癸烷. 采用这6种有机溶剂-缓冲液双相反应体系,利用绿豆环氧化物水解酶催化环氧苯乙烷生成(R)-1,2-苯乙二醇,对比研究了这6种有机溶剂体系中反应的对映体过量率、产率以及有机溶剂对酶活性的影响. 结果表明,乙酸乙酯和三氯甲烷对绿豆环氧化物水解酶的毒性较大,易使酶失活. 进一步研究底物和产物在双相体系的分配系数发现,所选取的有机溶剂对底物都具有较好的萃取效果,反应体系的底物浓度得到了一定程度的提高,表明在所选取的有机溶剂-缓冲液体系中可以有效解除底物对酶的毒性. 综合酶在6种双相反应体系中的催化结果以及底物的分配情况,最终确定正己烷-缓冲液体系为进一步研究的催化反应体系. 经过催化反应条件的优化后,最终底物浓度有效提高4倍,且产率和对映体过量率也有提高,分别为49.2%和94.3%.离子液体作为一种替代有机溶剂的绿色溶剂,具有低毒、难挥发、呈液态的温度范围大、生物相溶性好的特点,在催化领域表现出较好的应用前景. 用疏水性离子液体替代有机溶剂,构成疏水性离子液体-缓冲液双相体系,研究绿豆环氧化物水解酶在此类双相体系中的催化性能. 在所研究的9种疏水性离子液体中,C4MIM·PF6对绿豆环氧化物水解酶的生物相容性最好,可以较好地保留酶的活性,经过处理后,活性仍保留85.5%. 进一步优化该反应体系的反应条件后,所得产物的产率和对映体纯度均有提高,分别为49%和97%,证明离子液体可用于催化体系中提高环氧化物水解酶的催化性能[36]. 进一步研究发现,亲水性离子液体可以促进环氧化物水解酶的活力,其中C2OHMIM·BF4和C2OHMIM·TfO对该酶的毒性较低,且C2OHMIM·BF4能有效提高酶的催化速度[32].酶的固定化技术有利于提高酶的稳定性,固定化酶可以重复使用并容易与反应体系分离,降低了产物的纯化难度. 本课题组于春杨等[37-38]使用戊二醛作交联剂,形成绿豆环氧化物水解酶交联聚体,该酶聚集体的酶活性回收率达到92.5%,且重复使用4次后,仍保留有原始酶活性的85%以上. 进一步研究酶聚集体在正己烷-缓冲液双相体系中催化环氧苯乙烷发现,该酶聚集体的活性明显较游离酶的活性高,大大缩短了催化的时间(由20 h缩短至6 h),这也说明该种固定化方法能有效提高酶的稳定性. 黄豆也被证实具有环氧化物水解酶,本课题组岳东梅等[39-40]从黄豆中提取出环氧化物水解酶(SEH),并成功地将其固定在金属有机框架材料UiO-66-NH2中,制备出SEH@UiO-66-NH2固定化酶. 考察在水相缓冲液体系,添加深度共熔溶剂作助溶剂时发现,SEH@UiO-66-NH2在含氯化胆碱:尿素的缓冲液体系中,利用1,2-环氧辛烷作底物可选择性制备(R)-1,2-辛二醇,产率和产物光学纯度可以达到40.29%和80.52%.环氧化物水解酶因其野生菌株表达量较低、菌体培养周期长、或从其它来源提取酶的过程复杂且酶的纯度较低等缺点,不少研究人员将环氧化物水解酶的基因在大肠杆菌中进行克隆表达,以获得高表达环氧化物水解酶的工程菌,并可使工程菌内的目的基因进一步突变,从而得到更高效的环氧化物水解酶. 另外,又因环氧化物水解酶只能高选择性水解对映体中的一种环氧化物,这样会造成产物的理论产率不超过50%的现象. 为了进一步提升产物的产率,研究人员将可以水解不同构型底物但能生成相同构型产物的环氧化物水解酶的基因克隆表达于同一工程菌中,以提高产物的产率,突破理论上产率不超过50%的限制.HWANG等[41]报道了一株产环氧化物水解酶的Caulobacter crescentus菌株,该菌株所产生的环氧化物水解酶能将外消旋的对氯环氧苯乙烷不对称水解成R型的邻二醇,将该环氧化物水解酶的基因克隆表达于其它细胞中,该细胞在产物浓度大于40 mmol/L时,存在较明显的产物抑制作用. 后续又进行了一个制备级的规模实验,在底物质量浓度为16.8 g/L时,催化终止时可获得高纯度、高产率的产物,对映体纯度为95%,产率为72%. 贺婉红[42]对来源于绿豆环氧化物水解酶的基因进行克隆表达,先提取出编码该酶的mRNA,再通过反转录合成cDNA,然后扩增成双链的DNA,将该DNA在大肠杆菌中进行克隆表达,获得了产绿豆环氧化物水解酶的工程菌株,同时评价了该工程菌株产的绿豆环氧化物水解酶的酶学性质. 该酶的米氏常数为2.05 mmol/L,最大反应速率为14.8 μmol/(min·mg). JIN等[43]发现一株Agrobacterium radiobacter菌株,该菌株具有编码环氧化物水解酶的基因,所编码的水解酶能高效且特异性地拆分外消旋3-氯-1,2-环氧丙烷. 通过将该环氧化物水解酶的目的基因成功克隆表达于大肠杆菌,进一步研究了重组工程菌动力学拆分3-氯-1,2-环氧丙烷的性能. 结果表明,重组后的大肠杆菌对3-氯-1,2-环氧丙烷的两种对映体均有较好的水解能力,但由于S构型的对映体对酶的亲和力较强,催化过程会优先水解S型的环氧化物对映体,从而保留R型的环氧化物对映体. 然而,当S型底物被消耗殆尽后,R型的环氧化物水解加快,导致R型底物的产率下降,因此催化时间的控制对该拆分反应尤为重要. 此外,由于底物和产物的抑制作用,当底物浓度为384 mmol/L时,尽管延长反应时间,最终获得的R型3-氯-1,2-环氧丙烷的光学纯度也明显下降. 在所验证的重组菌菌量的范围内,光学纯度不超过61%. 为进一步提升底物浓度,通过分批添加底物和使用双相反应体系来降低底物的抑制作用. 在分批添加底物时,最终添加底物的尝试浓度为448 mmol/L,可获得目标产物的光学纯度超过80%,而在环己烷-缓冲液双相反应体系中,底物的最终添加浓度为512 mmol/L,目标产物的光学纯度大于98%.来源于Bacillus megaterium ECU1001的环氧化物水解酶的结构与其它来源的水解酶的结构相似,均含有α和β结构,且含有1个覆盖活性位点的盖子. KONG 等[44]成功将该菌株的环氧化水解酶的目的基因克隆表达于大肠杆菌,但来源于该野生菌株的环氧化物水解酶的产物释放通道较窄,限制了酶的催化速率. 通过对释放通道附近的氨基酸(如第128位和第145位氨基酸)进行突变,有效拓宽了产物的释放通道,提升了酶的催化速率.环氧化物选择性水解或拆分受限于理论产率不超50%,通过将选择性不同的两种或多种酶克隆表达于1个工程菌中,可有效突破这一限制. KIM等[45]通过将来源于新月柄杆菌和鲻鱼的环氧化物水解酶基因同时克隆表达于大肠杆菌中,从而实现了对外消旋环氧苯乙烷的催化水解,生成R型邻二醇的产率超过50%,产物光学纯度高达94%,且底物浓度较高,达到50 mmol/L. CAO等[46]将来源于土豆和Agrobacterium radiobacter的环氧化物水解酶的基因表达于大肠杆菌中,该菌可将廉价易得的环氧苯乙烷选择性地水解为(R)-1,2-型苯乙二醇,在底物浓度为5 mmol/L时,其转化率高达100%且产物的光学纯度高达98%.环氧化物水解酶的来源广泛,普遍存在于自然界的植物和微生物中,较易获得. 在水相和非水相反应体系中(如:有机溶剂-缓冲液双相体系、含离子液体反应体系等),环氧化物水解酶均表现出优异的催化选择性,且酶催化三联体结构清晰. 但是,由于环氧化物难溶于水或易水解的性质,限制了该催化反应在水相体系中的应用,而在非水相反应体系中催化环氧化物水解可有效克服这些问题,提升催化的效率. 分子生物学技术的应用促进了环氧化物水解酶的研究进展,其可以用来获得不同来源的环氧化物水解酶,研究酶的酶学性质,以及对自然来源酶的改造,获得更加高效的环氧化物水解酶或重组工程菌.探索绿色且有利于环氧化物溶解的反应介质是建立高效催化环氧化物反应体系的关键一环,深度共熔溶剂也已证明可用于土豆环氧化物水解酶的催化反应,提高酶对底物的选择性,但其它来源的环氧化物水解酶在该类介质中反应的研究并不多. 随着生物技术的发展,利用基因工程技术改造原有的环氧化物水解酶,提升其催化的选择性、活力以及底物的耐受力,也逐渐成为主要发展趋势.【相关文献】[1] 刘荣仕. 树脂原位吸附提高全细胞不对称制备(S)-苯基乙二醇催化效率研究[D]. 无锡:江南大学,2008.[2] JANSSEN A J M,KLUNDER A H,ZWANENBURG B. PPL-catalyzed resolution of 1,2- and 1,3-diols in methyl propionate as solvent. An application of the tandem use of enzymes[J]. Tetrahedron,1992,23(1):7409-7416.[3] KATAOKA M,KITA K,WADA M,et al. Novel bioreduction system for the production of chiral alcohols[J]. Applied Microbiology & Biotechnology,2003,62(5/6):437-445.[4] SCHMID A,DORDICK J S,HAUER B,et al. Industrial biocatalysis today and tomorrow[J]. Nature,2001,409(6817):258-268.[5] SOLARES F L,MATEO C. Improvement of the epoxide hydrolase properties for the enantioselective hydrolysis of epoxides[J]. Current Organic Chemistry,2013,17(7):744-755.[6] BALA N,CHIMNI S S. Recent developments in the asymmetric hydrolytic ring opening of epoxides catalysed by microbial epoxide hydrolase[J]. TetrahedronAsymmetry,2010,21(24):2879-2898.[7] BALA N,KAUR K,CHIMNI S S,et al. Bioresolution of benzyl glycidyl ether using whole cells of Bacillus alcalophilus[J]. Journal of Basic Microbiology,2012,52(4):383-389.[8] HWANG S,CHOI C Y,LEE E Y. Bio- and chemo-catalytic preparations of chiral epoxides[J]. Journal of Industrial & Engineering Chemistry,2010,16(1):1-6.[9] BHARATHI B,RANJAN M,RICHARDSON D E. Osmium-catalyzed asymmetric dihydroxylation by carbon dioxide-activated hydrogen peroxide and N-methylmorpholine[J]. Tetrahedron Letters,2008,49(6):1071-1075.[10] CHOI D S,HAN S S,KWUEON E K,et al. New mono-quaternized bis-cinchona alkaloid ligands for asymmetric dihydroxylation of olefins in aqueous medium:unprecedented high enantioselectivity and recyclability[J]. Advanced Synthesis & Catalysis,2007,38(19):2560-2564.[11] NIE Y,XIAO R,XU Y,et al. Novel anti-prelog stereospecific carbonyl reductases from Candida parapsilosis for asymmetric reduction of prochiral ketones[J]. Organic & Biomolecular Chemistry,2011,9(11):4070-4078.[12] TIAN X,ZHENG G W,LI C X,et al. Enantioselective production of ( S )-1-phenyl-1,2-ethanediol from dicarboxyesters by recombinant Bacillus subtilis esterase[J]. Journal of Molecular Catalysis B:Enzymatic,2011,73(1):80-84.[13] ZHU D,YANG Y,MAJKOWICZ S,et al. Inverting the enantioselectivity of a carbonyl reductase via substrate-enzyme docking-guided point mutation[J]. OrganicLetters,2008,10(4):525-528.[14] 鞠鑫,潘江,许建和. 绿豆环氧水解酶催化对硝基苯乙烯氧化物的对映归一性水解[J]. 催化学报,2008,29(8):696-700.JU X,PAN J,XU J H.Enantioconvergent hydrolysis of p-Nitrostyrene oxide catalyzed by Mung bean epoxide hydrolase[J]. Chinese Journal of Catalysis,2008,29(8):696-700.[15] 赵晶. 环氧水解酶的克隆表达和催化性能研究[D]. 上海:华东理工大学,2011.[16] WEIJERS C A G M. Enantioselective hydrolysis of aryl,alicyclic and aliphatic epoxides by Rhodotorula glutinis[J]. Tetrahedron Asymmetry,1997,8(4):639-647.[17] OESCH F. Mammalian epoxide hydrases:inducible enzymes catalysing the inactivation of carcinogenic and cytotoxic metabolites derived from aromatic and olefinic compounds[J]. Xenobiotica:the Fate of Foreign Compounds in BiologicalSystems,1973,3(5):305-340.[18] 江克翊. 微生物产环氧化物水解酶的筛选及对苯基缩水甘油醚的动力学拆分研究[D]. 杭州:浙江工业大学,2009.[19] HECHTBERGER P,WIRNSBERGER G,MISCHITZ M,et al. Asymmetric hydrolysis of epoxides using an immobilized enzyme preparation from Rhodococcus sp[J]. Tetrahedron Asymmetry,1993,4(6):1161-1164.[20] 李从发. 新型环氧化物水解酶筛选及其在手性合成中的应用[D]. 济南:山东大学,2003.[21] LI C,LIU Q,SONG X,et al. Epoxide hydrolase-catalyzed resolution of ethyl 3-phenylglycidate using whole cells of Pseudomonas sp[J]. BiotechnologyLetters,2003,25(24):2113-2116.[22] 沙倩,杨柳,王建军,等. 产环氧化物水解酶的黑曲霉菌种分离和发酵条件的研究[J]. 菌物学报,2001,20(4):494-502.SHA Q,YANG L,WANG J J,et al. Isolation and fermentation conditions of aspergillus niger capable of production epoxide hydrolysis[J]. Mycosystema,2001,20(4):494-502.[23] LIU Y,SHA Q,WU S,et al. Enzymatic resolution of racemic phenyloxirane by a novel epoxide hydrolase from Aspergillus niger SQ-6 and its fed-batch fermentation[J]. Journal of Industrial Microbiology & Biotechnology,2006,33(4):274-282.[24] 唐燕发,许建和,武慧渊,等. 高对映选择性环氧化物水解酶产生菌的筛选及特性研究[J]. 微生物学通报,2001,28(5):14-17.TANG Y F,XU J H,WU H Y,et al. Isolation and characterization of an epoxide hydrolase producer for enantioselec tive hydrolysis of (R,S)-phenyl glycidyl ether[J]. Microbiology China,2001,28(5):14-17.[25] XU W,XU J H,PAN J,et al. Enantioconvergent hydrolysis of styrene epoxides by newly discovered epoxide hydrolases in Mung bean[J]. Organic Letters,2006,8(8):1737-1740. [26] DUARAH A,GOSWAMI A,BORA T C,et al. Erratum to:enantioconvergent biohydrolysis of racemic styrene oxide to R-phenyl-1,2-ethanediol by a newly isolated filamentous fungus aspergillus tubingensis TF1[J]. Applied Biochemistry &Biotechnology,2013,171(1):261.[27] MORISSEAU C,HAMMOCK B D. Epoxide hydrolases:mechanisms,inhibitor designs,and biological roles[J]. Cheminform,2005,45(39):311-333.[28] SMIT M S. Fungal epoxide hydrolases:new landmarks in sequence-activity space[J]. Trends in Biotechnology,2004,22(3):123-129.[29] 彭华松,宗敏华,聂凌鸿. 环氧化合物水解酶的研究进展[J]. 分子催化,2003,17(1):75-80.[30] JANSSEN D B,PRIES F,VAN D P J,et al. Cloning of 1,2-dichloroethane degradation genes of Xanthobacter autotrophicus GJ10 and expression and sequencing of the dhlA gene[J]. Journal of Bacteriology,1989,171(12):6791-6799.[31] CHOI W J,CHOI C Y. Production of chiral epoxides:epoxide hydrolase-catalyzed enantioselective hydrolysis[J]. Biotechnology & Bioprocess Engineering,2005,10(3):167-179.[32] 陈文静. 绿豆环氧化物水解酶催化环氧苯乙烯不对称水解反应[D]. 广州:华南理工大学,2012.[33] 盛艳旻. 环氧化物水解酶产生菌的筛选及其发酵条件和对苯基缩水甘油醚类化合物拆分条件的研究[D]. 杭州:浙江工业大学,2010.[34] BEETHAM J K,TIAN T,HAMMOCK B D. cDNA cloning and expression of a soluble epoxide hydrolase from human liver[J]. Archives of Biochemistry &Biophysics,1993,305(1):197-201.[35] SCHLADT L,THOMAS H,HARTMANN R,et al. Human liver cytosolic epoxide hydrolases[J]. European Journal of Biochemistry,1988,176(3):715-723.[36] CHEN W J,LOU W Y,ZONG M H. Efficient asymmetric hydrolysis of styrene oxide catalyzed by Mung bean epo-xide hydrolases in ionic liquid-based biphasic systems[J]. Bioresource Technology,2012,115(115):58-62.[37] 于春杨. 绿豆环氧化物水解酶交联酶聚体的制备、表征及应用[D]. 广州:华南理工大学,2013.[38] YU C Y,LI X F,LOU W Y,et al. Cross-linked enzyme aggregates of Mung bean epoxide hydrolases:a highly active,stable and recyclable biocatalyst for asymmetric hydrolysis of epoxides[J]. Journal of Biotechnology,2013,166(1/2):12-19.[39] 岳东梅. 金属有机框架材料(MOFs)的制备及其固定化黄豆环氧化物水解酶的研究[D]. 广州:华南理工大学,2015.[40] CAO S L,YUE D M,LI X H,et al. Novel Nano-/micro-biocatalyst:soybean epoxide hydrolase immobilized on UiO-66-NH2 MOF for efficient biosynthesis of enantiopure (R)-1,2-Octanediol in deep eutectic solvents[J]. ACS Sustainable Chemistry & Engineering,2016,4(6):3586-3595.[41] HWANG S,CHOI C Y,LEE E Y. Enantioconvergent bioconversion of p-chlorostyrene oxide to (R)-p-chlorophenyl-1,2-ethandiol by the bacterial epoxide hydrolase of Caulobacter crescentus[J]. Biotechnology Letters,2008,30(7):1219-1225.[42] 贺婉红. 绿豆环氧水解酶基因克隆、表达及酶学性质表征[D]. 上海:华东理工大学,2010.[43] JIN H X,LIU Z Q,HU Z C,et al. Biosynthesis of (R)-epichlorohydrin at high substrateconcentration by kinetic resolution of racemic epichlorohydrin with a recombinant epoxide hydrolase[J]. Engineering in Life Sciences,2013,13(4):385-392.[44] KONG X D,YUAN S,LI L,et al. Engineering of an epoxide hydrolase for efficient bioresolution of bulky pharmaco substrates[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(44):15717-15722.[45] KIM H S,LEE O K,HWANG S,et al. Biosynthesis of (R)-phenyl-1,2-ethanediol from racemic styrene oxide by using bacterial and marine fish epoxide hydrolases[J]. Biotechnology Letters,2008,30(1):127-133.[46] CAO L,LEE J,CHEN W,et al. Enantioconvergent production of (R)-1-phenyl-1,2-ethanediol from styrene oxide by combining the Solanum tuberosum and an evolved Agrobacterium radiobacter AD1 epoxide hydrola-ses[J]. Biotechnology & Bioengineering,2006,94(3):522-529.。
微粒体环氧化物水解酶

微粒体环氧化物水解酶微粒体环氧化物水解酶(Microsomal epoxide hydrolase,简称MEH)是一种重要的酶类蛋白质,在细胞内发挥着关键的生物转化作用。
它参与着多种生物代谢过程,特别是对于外源性化合物的代谢和解毒具有重要作用。
本文将从酶的结构、功能、代谢途径等多个方面来介绍微粒体环氧化物水解酶的研究进展和应用前景。
一、微粒体环氧化物水解酶的结构与功能微粒体环氧化物水解酶是一种单体蛋白质,分子量约为62kDa。
其基因位于人类基因组中的1p36.1-36.3区域,编码的蛋白质由451个氨基酸残基组成。
酶的结构主要由N端的信号肽序列、N端的α-螺旋结构、C端的β-折叠结构以及C端的α-螺旋结构组成。
这种特殊的结构使得微粒体环氧化物水解酶能够与多种底物发生特异性结合并发挥其催化作用。
微粒体环氧化物水解酶主要参与外源性化合物的代谢和解毒过程。
它能够催化环氧化物的水解反应,将其转化为相应的二醇。
这种反应对于许多环氧化物类化合物的代谢具有重要意义,如多环芳烃、多氯联苯等。
通过水解反应,微粒体环氧化物水解酶能够将这些具有潜在毒性的环氧化物转化为相对稳定和无毒的二醇类代谢产物,从而保护细胞免受有害物质的侵害。
微粒体环氧化物水解酶参与的代谢途径主要包括环氧化物代谢途径和亚硝酸盐代谢途径。
在环氧化物代谢途径中,微粒体环氧化物水解酶催化环氧化物的水解反应,将其转化为二醇类产物。
而在亚硝酸盐代谢途径中,酶可将亚硝酸盐转化为相应的亚硝酸酯,进而参与到亚硝酸酯的降解过程中。
三、微粒体环氧化物水解酶的研究进展微粒体环氧化物水解酶的研究得到了广泛关注。
研究表明,该酶在人体中的表达水平受到基因多态性的影响。
不同基因型的个体可能表现出不同的酶活性和底物亲和力,从而对药物代谢和毒物解毒能力产生影响。
因此,微粒体环氧化物水解酶的基因多态性已成为一些疾病的遗传易感因素。
微粒体环氧化物水解酶还被广泛应用于药物研发和毒理学领域。
微生物降解霉菌毒素的研究进展

微生物降解霉菌毒素的研究进展张高娜*,张建梅,谷巍(山东宝来利来生物工程股份有限公司,山东泰安271000)摘要:霉菌毒素(mycotoxin)是霉菌在生长过程中产生的次级代谢产物,具有高毒性和强致癌性,对畜牧业生产造成严重的危害。
本文就畜牧生产过程中常见的几种霉菌毒素的种类、毒性机理及生物脱毒等方面作一综述。
关键词:霉菌毒素;微生物;生物降解;毒性机理Research Progress on microbial degradation of the mycotoxinZhang Gao-na Zhang Jian-mei Gu Wei(Bora Lee Shandong to bio-engineering Co., Ltd., Tai'an, Shandong, 271000) Abstract: Mycotoxin are fungal secondary metabolites produced in the process of growth, highly toxic and carcinogenic, caused serious harm to the livestock production. In this paper, livestock production process of several common species of mycotoxins, toxic mechanism and biological detoxification of reviewed.Key words: mycotoxin; microorganism; biodegradation; toxic mechanism1.引言霉菌毒素是由霉菌产生的次生代谢产物,分子量在几百到几千道尔顿,没有抗性,但有热稳定性,不因加热而被破坏。
因物理和化学的去毒方法存在一些弊端,故生物降解法作为一种安全、高效、环保的方法倍受畜牧生产者的关注。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
构域 ( 核心结构域和 帽子 结构 域 ), 由 螺旋 和 折叠 组成。 活性位点为亲核残基 A sp、H is和羧酸残 基 ( A sp或 G lu), 帽子
收稿日期: 2009 - 09- 10; 修回日期: 2009- 10- 22 基金项目: 浙江省自然科学基金重点项目 ( N o. Z4080032) 资助 作者简介: 壮晓健 ( 1985- ), 男, 杭州人, 在读硕 士生, 研 究方向: 生物 催化与生物转化。* 通讯作者: 郑裕国 ( 1961 - ) , 男, 教授, 博导, 发表 论文 400 余篇, 获专利 15项, Em ai:l zhengyg@ zju t. edu. cn。
Rhodococcus ery thropo lis DCL 14的柠 檬烯 环氧化 物水 解酶 ( LEH )具有不 同的结 构和 催化 反应机 制。该酶 分子 量较 小, 为 螺 旋 和 折 叠 弯 曲 形 成 的 口 袋 状 结 构, 活 性 位 点 为 A rg99、A sp101和 A sp132。其催化反应 机制为: A sp101 为环氧 化物的氧提供质子; A sp132吸引水分子中的质子, 辅助环氧碳 的亲 核 攻 击; A rg99 定 位 两 个 天 冬 氨 酸 的 羧 基, 稳 定 电 荷; T yr53、A sn55、A sp132与水 分子 形成 氢键, 定 位于 有 利于 水分 子亲核攻击底物的氧环, 水解过程中没有酯中间体的形成 [ 3] 。 1. 2 EH 活力的快速检测方法
N a IO4 氧化法是利用 N aIO4 的强氧化性, 将酶水解生 成的 邻二醇氧化成醛或酮, 通 过一 定方法 检测 醛、酮的量 或 N aIO4 的消耗量, 从而检测 EH 的活力。该类方法是通过酶解和 化学 氧化相结合的机制而 建立, 而且检测 的是产物, 降 低了假 阳性 现象, 具有检测方便快速、应用 潜力大的优点。
玉米须维生素 E提取效 率的 因素 依次为: 甲 酯化 温度 > 甲酯 化时间 > 料 液比 > 回流 提取 时间, 甲酯 化温 度对 玉米须 VE 的提取效率影响最大。
目前, 此实 验仍处于摸索 阶段, 着 重于 VE 的提 纯。由于 VE的易被氧化 性、不耐高温性等, 今后还应考虑 VE 活性保护 问题。 参考文献: [ 1] 匡轩, 匡芮, 朱海涛, 等. 玉米 须的化学 成分及药 理保健 功能 [ J ]. 中国食物与营养, 2007, ( 4) : 46 - 48. [ 2] 中药大辞典 [ M ] . 上海: 上海科技出版社, 1977: 555.
pox ide hydro lase w ere described in deta i.l K ey word s: epox ide hydrolase; enzym e assay; gene eng ineer ing
手性环 氧 化物 是有 机 合成 中的 重 要中 间 体, 在 医 药、农 结构域中至少存在一个 T yr在 催化过程 中提供 质子 [2] 。其催
药、香料等方面有着重要的应用价 值。如手性 苯基 - 2, 3 - 环 化反应机制为: 第一步, 天冬氨酸残 基亲核攻 击环氧化 物上的
氧酸乙酯可用于合成紫杉醇; ( S) - 芳基缩水 甘油醚可用 于合 成阿替洛尔。
环碳原子, 形成 共价酯 中间体; 第 二步, 另 一天 冬氨 酸残 基辅 助组氨酸活化水分子, 使酯中间体水解, 释ART ICLES
微生物环氧化物水解酶的研究进展
壮晓健, 金火喜, 胡忠策, 郑裕国*
(浙江工业大学生物 工程研究所, 浙江 杭州 310014) 摘要: 环氧化物水解酶 ( EH ) 是一类能催化外消旋环氧化物水解生成有光学活性的环氧化物和二醇的酶 , 应用 前景广阔。自 然界筛选到的微生物 往往存在产酶活力低、对映体选择性不高 等问题。近年 来, 基因 工程技术 的发展及 其在微 生物环氧 化物水 解酶中的应用, 改善了酶的催化特性, 为酶的工业化应用提供了条件。该 文简单介绍 了微生物 环氧化物 水解酶 的催化反 应机制 和快速检测方法, 详细介绍了环氧化物水解酶基因工程方面的研究进展。 关键词: 环氧化物水解酶; 检测方法; 基因工程 中图分类号: Q 815 文献标识码: A 文章编号: 1004- 311X ( 2010) 01- 0091- 04
4- (对硝基苄基 ) 吡啶 ( N BP ) 能与 烷基化 物质 如活性 卤 代化合物、环氧化合物等反应, 生成的中间 体经碱 化可产 生紫 色、蓝色或棕色芳甲烷类染料。 Frank Zocher等 [ 5]以 N BP 为显 色剂, 建立了 96孔板法和滤纸 法, 对 120株 链霉菌 ( Strep tom y ces)的 EH 活力进行初筛, 快速 得到了 3株高活 力的菌 株。国 内, 李从发等 [ 6] 以苯基环氧乙烷为模型化合物, 选择 580nm 为 测量波长, 650nm 为参比波长, 建立 了定量 检测含 有细菌 细胞 等混浊体系中环氧化 物的双波长微板 法。该类方 法可用 于酶 或细胞的酶活检 测, 但不 适用于 以卤 代环氧 化物 为底 物的 酶 活检测。 1. 2. 3 N a IO4 氧化法
目前, 已报 道的快速 酶活检 测方 法一 般是 基于 显色 试剂 与底物或产物反应, 通 过颜 色变化 定性 检测酶 活或 比色 法定 量检测酶活。这些快速方法的建立 将有助于 微生物酶 源的快 速筛选和基因改造的研究。
1. 2. 1 直接分光光度法 T e j Bha tnagar等 [ 4]以 A. niger 水 解对 硝基 苯基 环氧 乙烷
近年来, 微生物 EH 拆分外消旋的环氧化物 已成为研究的 热点, 相关的文 献 报道 较 多, 且部 分酶 已 经 被分 离 纯化 和 测 序, 并被克隆到不同 的宿主 中表 达, 改善 了酶 的催 化特 性, 为 EH 的大规模制备 和应用提供了条件。
1 微生物 EH 的简介
1. 1 微生物 EH 的催化反应机制 大多数 EH 属于 / 折叠 型的 酶, 含有 两个 功能 性的 结
环氧化物水解 酶 ( EH ) 能选 择性水 解外 消旋 环氧 化物 生 成具有光活性的环 氧化物 和二醇。微 生物来 源的 EH 不对 称 拆分外消旋的环氧化 物, 不仅底物谱 广泛, 而且具 有酶的 来源 广泛, 对映体选择性 高, 不需要 金属 离子 和辅 酶, 菌体 可以 通 过发酵大量得到, 在 非水 介质中 也能 保持较 高催 化活 性等 特 点 [ 1] 。
eng inee ring and its applica tion to m icrob ial epox ide hydro lase, cata lytic properties we re improved. R eaction m echanism o fm icrobia l epox ide hydrolase and h igh- throughput assay m ethods w ere br iefly rev iew ed in th is paper, the research o f gene eng ineer ing in m icrobial ex
Fabrizio Badalassi等 [ 7] 以 潜荧光的 环氧化物为 底物, 经酶 水解拆分、N aIO 4 氧化、 - 消 除反应 后, 释 放荧光 物质 7 - 羟 基香豆素, 筛选 EH 活力 ( 图 2)。该方法以特 定的环氧化 物为 底物, 因此, 检测到有 活力的 EH 并不 一定对 特定的 底物有 拆 分活力。
2010年 20( 1)
生物技术
91
表 3 平行试验
T able 3 The balance experim en t
批次
1
2
3
平均得率 (% )
得率 (% )
0. 056
0. 055
0. 057
0. 056
3 讨论
植物 中的维 生素 E 含量一 般较少, 索 氏回流提 取法可 达 到高效目的, 甲酯化法是 近几 年来 较常用 的纯 化维生 素 E 的 方法, 通过甲酯化降低杂质中甘油酯 和脂肪酸 的沸点, 从 而保 证维生素 E在低温 下不易 被破 坏, 再通 过减压 蒸馏 除去杂 质 而达到纯化效 果。通过 单因 素试 验发 现: 提取 时间、温 度、料 液比、甲酯化等因素均能影响维生素 E 的提取效果, 故本 实验 从回流提取、料液比、甲酯化温 度和甲酯化 时间等 4种因 素的 不同水平上, 通过正交实验研究发现: 玉米须维 生素 E最 佳的 提取工艺条件 是: 回流 时间 2h, 料 液比 1: 10, 甲酯 化 温度 为 70 , 甲酯化时间为 1h。得率为 0. 056% 。根据极差得出影响
[ 3] N ozzo lillo C, R eid L. A n thocyan in p igm entat ion of ma ize silk [ J] . B ull
L ia ison- G roupe poly. Pheno ls, 1992, ( 16 ): 187. [ 4] 王荣萍, 王爱华. 天然维生素 E 的提取及应 用 [ J] . 河 南工业大学, 2005, ( 1) : 25- 26. [ 5] 赵贵兴, 陈霞, 赵红宇, 等. 大豆脱臭馏出物中天然维生素 E 的提取 [ J] . 黑龙江农业科学, 2006, ( 5) : 118 - 119.
