高中物理选修3-3知识复习提纲:第八章 气体(人教版)
最新人教版高中物理选修3-3:8.3理想气体的状态方程 知识点总结及课时练习

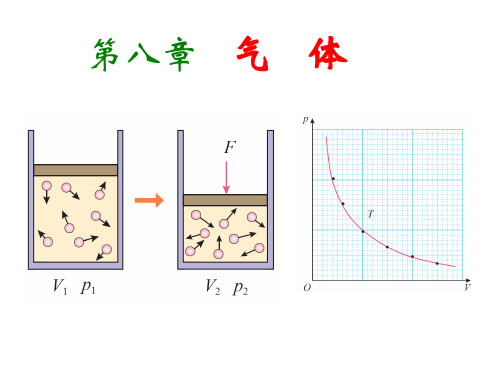
3理想气体的状态方程记一记理想气体的状态方程知识体系一个模型——理想气体一个方程——理想气体的状态方程三个特例——p1V1T1=p2V2T2⎩⎪⎨⎪⎧T1=T2时,p1V1=p2V2V1=V2时,p1T1=p2T2p1=p2时,V1T1=V2T2辨一辨1.理想气体也不能严格地遵守气体实验定律.(×)2.实际气体在温度不太低、压强不太大的情况下,可看成理想气体.(√)3.一定质量的理想气体,当压强不变而温度由100 ℃上升到200 ℃时,其体积增大为原来的2倍.(×)4.气体由状态1变到状态2时,一定满足方程p1V1T1=p2V2T2.(×)5.一定质量的理想气体体积增大到原来的4倍,可能是因为压强减半且热力学温度加倍.(√)想一想什么样的气体才是理想气体?理想气体的特点是什么?提示:在任何温度、任何压强下都严格遵从实验定律的气体;特点:①严格遵守气体实验定律及理想气体状态方程,是一种理想化模型.②理想气体分子本身的大小与分子间的距离相比可忽略不计,分子不占空间,可视为质点.③理想气体分子除碰撞外,无相互作用的引力和斥力.④理想气体分子无分子势能的变化,内能等于所有分子热运动的动能之和,只和温度有关.思考感悟:练一练=1.有一定质量的理想气体,如果要使它的密度减小,可能的办法是( )A .保持气体体积一定,升高温度B .保持气体的压强和温度一定,增大体积C .保持气体的温度一定,增大压强D .保持气体的压强一定,升高温度解析:由ρ=m /V 可知,ρ减小,V 增大,又由pV T =C 可知A 、B 、C 三项错,D 项对.答案:D2.对于一定质量的理想气体,下列状态变化中可能的实现是( )A .使气体体积增加而同时温度降低B .使气体温度升高,体积不变、压强减小C .使气体温度不变,而压强、体积同时增大D .使气体温度升高,压强减小、体积减小解析:由理想气体状态方程pV T =恒量得A 项中只要压强减小就有可能,故A 项正确;而B 项中体积不变,温度与压强应同时变大或同时变小,故B 项错;C 项中温度不变,压强与体积成反比,故不能同时增大,故C 项错;D 项中温度升高,压强减小,体积减小,导致pV T 减小,故D 项错误.答案:A3.一定质量的理想气体,经历一膨胀过程,这一过程可以用图上的直线ABC 来表示,在A 、B 、C 三个状态上,气体的温度T A 、T B 、T C 相比较,大小关系为( )A .TB =T A =T CB .T A >T B >T CC .T B >T A =T CD .T B <T A =T C解析:由图中各状态的压强和体积的值可知:p A · V A =p C ·V C <p B ·V B ,因为pV T =恒量,可知T A =T C <T B .答案:C4.如图所示,1、2、3为p -V 图中一定量理想气体的三种状态,该理想气体由状态1经过程1→3→2到达状态2.试利用气体实验定律证明:p 1V 1T 1=p 2V 2T 2. 证明:由题图可知1→3是气体等压过程,据盖—吕萨克定律有:V 1T 1=V 2T3→2是等容过程,据查理定律有:p 1T =p 2T 2联立解得p 1V 1T 1=p 2V 2T 2.要点一对理想气体的理解1.(多选)关于理想气体,下列说法中正确的是()A.严格遵守玻意耳定律、盖—吕萨克定律和查理定律的气体称为理想气体B.理想气体客观上是不存在的,它只是实际气体在一定程度上的近似C.和质点的概念一样,理想气体是一种理想化的模型D.一定质量的理想气体,内能增大,其温度可能不变解析:理想气体是一种理想化模型,是对实际气体的科学抽象;温度不太低、压强不太大的情况下可以把实际气体近似视为理想气体;理想气体在任何温度、任何压强下都遵从气体实验定律,A、B、C三项正确;理想气体的内能只与温度有关,温度升高,内能增大,温度降低,内能减小,D项错误.答案:ABC2.(多选)关于理想气体,下列说法正确的是()A.温度极低的气体也是理想气体B.压强极大的气体也遵从气体实验定律C.理想气体是对实际气体的抽象化模型D.理想气体实际并不存在解析:气体实验定律是在压强不太大、温度不太低的情况下得出的,温度极低、压强极大的气体在微观上分子间距离变小,趋向于液体,故答案为C、D两项.答案:CD要点二对理想气体状态方程的理解和应用3.(多选)一定质量的理想气体,初始状态为p、V、T,经过一系列状态变化后,压强仍为p,则下列过程中可以实现的是() A.先等温膨胀,再等容降温B.先等温压缩,再等容降温C.先等容升温,再等温压缩D.先等容降温,再等温压缩解析:根据理想气体状态方程pVT=C,若经过等温膨胀,则T不变,V增加,p减小,再等容降温,则V不变,T降低,p减小,最后压强p肯定不是原来值,A项错,同理可以确定C项也错,正确为B、D两项.答案:BD4.一定质量的气体,从初态(p0、V0、T0)先经等压变化使温度上升到32T0,再经等容变化使压强减小到12p0,则气体最后状态为()A.12p0、V0、32T0 B.12p0、32V0、34T0C.12p0、V0、34T0 D.12p0、32V0、T0解析:在等压过程中,V∝T,有V0T0=V33T02,V3=32V0,再经过一个等容过程,有:p032T0=p02T3,T3=34T0,所以B项正确.答案:B5.如图所示,一定质量的空气被水银封闭在静置于竖直平面的U形玻璃管内,右管上端开口且足够长,右管内水银面比左管内水银面高h,能使h变小的原因是()A.环境温度升高B.大气压强升高C.沿管壁向右管内加水银D.U形玻璃管自由下落解析:对于左端封闭气体,温度升高,由理想气体状态方程可知:气体发生膨胀,h增大,故A项错.大气压升高,气体压强将增大,体积减小,h减小,故B项对.向右管加水银,气体压强增大,内、外压强差增大,h将增大,所以C项错.当管自由下落时,水银不再产生压强,气体压强减小,h变大,故D项错.答案:B6.一水银气压计中混进了空气,因而在27 ℃、外界大气压为758 mmHg时,这个水银气压计的读数为738 mmHg,此时管中水银面距管顶80 mm.当温度降至-3 ℃时,这个气压计的读数为743 mmHg,求此时的实际大气压值为多少?解析:画出该题初、末状态的示意图分别写出被封闭气体的初、末状态的状态参量p1=758 mmHg-738 mmHg=20 mmHgV1=(80 mm)·S(S是管的横截面积)T1=(273+27) K=300 Kp2=p-743 mmHgV2=(738+80) mm·S-743(mm)·S=75(mm)·ST2=(273-3)K=270 K将数据代入理想气体状态方程p1V1 T1=p2V2 T2解得p=762.2 mmHg.答案:762.2 mmHg要点三理想气体变化的图象7.在下图中,不能反映理想气体经历了等温变化→等容变化→等压变化,又回到原来状态的图是()解析:根据p -V ,p -T 、V -T 图象的意义可以判断,其中D 项显示的理想气体经历了等温变化→等压变化→等容变化,与题意不符.答案:D8.图中A 、B 两点代表一定质量理想气体的两个不同的状态,状态A 的温度为T A ,状态B 的温度为T B ;由图可知( )A. T B =2T AB. T B =4T AC. T B =6T AD. T B =8T A 解析:对于A 、B 两个状态应用理想气体状态方程p A V A T A =p B V B T B可得:T B T A =p B V B p A V A =3×42×1=6,即T B =6T A ,C 项正确. 答案:C基础达标1.关于一定质量的理想气体发生状态变化时,其状态参量p 、V 、T 的变化情况不可能的是( )A .p 、V 、T 都减小B .V 减小,p 和T 增大C.p和V增大,T减小D.p增大,V和T减小解析:由理想气体状态方程pVT=C可知,p和V增大,则pV增大,T应增大.C项不可能.答案:C2.(多选)理想气体的状态方程可以写成pVT=C,对于常量C,下列说法正确的是()A.对质量相同的任何气体都相同B.对质量相同的同种气体都相同C.对质量不同的不同气体可能相同D.对质量不同的不同气体一定不同解析:理想气体的状态方程的适用条件就是一定质量的理想气体,说明常量C仅与气体的种类和质量有关,实际上也就是只与气体的物质的量有关.对质量相同的同种气体当然常量是相同的,而对质量不同的不同气体,只要物质的量是相同的,那么常量C也是可以相同的.答案:BC3.(多选)对一定质量的理想气体,下列说法正确的是() A.体积不变,压强增大时,气体分子的平均动能一定增大B.温度不变,压强减小时,气体的密度一定减小C.压强不变,温度降低时,气体的密度一定减小D.温度升高,压强和体积可能都不变解析:由pVT=C(常量)可知,V不变、p增大时T增大,故A项正确;T增大时,p与V至少有一个要发生变化,故D错误;把V=mρ代入pVT=C得pmρT=C,由此式可知,T不变时,ρ随p的减小而减小,故B项正确;p不变时,ρ随T的减小而增大,故C 项错误.答案:AB4.(多选)关于理想气体的状态变化,下列说法中正确的是()A.一定质量的理想气体,当压强不变而温度由100 ℃上升到200 ℃时,其体积增大为原来的2倍B .一定质量的理想气体由状态1变到状态2时,一定满足方程p 1V 1T 1=p 2V 2T 2C .一定质量的理想气体体积增大到原来的4倍,可能是压强减半,热力学温度加倍D .一定质量的理想气体压强增大到原来的4倍,可能是体积加倍,热力学温度减半解析:理想气体状态方程p 1V 1T 1=p 2V 2T 2中的温度是热力学温度,不是摄氏温度,A 项错误,B 项正确;由理想气体状态方程及各量的比例关系即可判断C 项正确,D 项错误.答案:BC5.光滑绝热的轻质活塞把密封的圆筒容器分成A 、B 两部分,这两部分充有温度相同的气体,平衡时V A :V B =1:2,现将A 中气体温度加热到127 ℃,B 中气体温度降低到27 ℃,待重新平衡后,这两部分气体体积的比V A ′:V B ′为( )A .1:1B .2:3C .3:4D .2:1解析:对A 部分气体有:p A V A T A =p A ′V ′A T A ′① 对B 部分气体有:p B V B T B =p B ′V B ′T B ′② 因为p A =p B ,p A ′=p B ′,T A =T B ,所以由①②得V A V B =V A ′T B ′V B ′T A ′,所以V A ′V B ′=V A T A ′V B T B ′=1×4002×300=23答案:B6.如图所示,内壁光滑的汽缸和活塞都是绝热的,缸内被封闭的理想气体原来体积为V ,压强为p ,若用力将活塞向右压,使封闭的气体体积变为V 2,缸内被封闭气体的( )A .压强等于2pB .压强大于2pC .压强小于2pD .分子势能增大了解析:汽缸绝热,压缩气体,其温度必然升高,由理想气体状态方程pV T =C (恒量)可知,T 增大,体积变为V 2,则压强大于2p ,故B 项正确,A 、C 两项错,理想气体分子无势能的变化,D 项错.答案:B7.(多选)如图所示,一定质量的理想气体,从图示A 状态开始,经历了B 、C 状态,最后到D 状态,下列判断正确的是( )A .A →B 温度升高,压强不变B .B →C 体积不变,压强变大C .B →C 体积不变,压强不变D .C →D 体积变小,压强变大解析:由图象可知,在A →B 的过程中,气体温度升高、体积变大,且体积与温度成正比,由pV T =C ,气体压强不变,是等压过程,故A 项正确;由图象可知,在B →C 是等容过程,体积不变,而热力学温度降低,由pV T =C 可知,压强p 减小,故B 、C 两项错误;由图象可知,在C →D 是等温过程,体积减小,由pV T =C可知,压强p 增大,故D 项正确.答案:AD8.一气泡从30 m 深的海底升到海面,设水底温度是4 ℃,水面温度是15 ℃,那么气泡在海面的体积约是水底时的( )A .3倍B .4倍C .5倍D .12倍解析:根据理想气体状态方程:p 1V 1T 1=p 2V 2T 2,知V 2V 1=p 1T 2p 2T 1,其中T 1=(273+4) K =277 K ,T 2=(273+15) K =288 K ,故T 2T 1≈1,而p 2=p 0≈10ρ水 g ,p 1=p 0+p ≈40 ρ水 g ,即p 1p 2≈4,故V 2V 1≈4.故选B 项.答案:B9.(多选)如图所示,用活塞把一定质量的理想气体封闭在导热汽缸中,用水平外力F 作用于活塞杆,使活塞缓慢向右移动,由状态①变化到状态②.如果环境保持恒温,分别用p 、V 、T 表示该理想气体的压强、体积、温度.气体从状态①变化到状态②,此过程可用下图中哪几个图象表示( )解析:由题意知,由状态①到状态②过程中,温度不变,体积增大,根据pV T =C 可知压强将减小.对A 项图象进行分析,p -V图象是双曲线即等温线,且由状态①到状态②体积增大,压强减小,故A 项正确;对B 项图象进行分析,p -V 图象是直线,温度会发生变化,故B 项错误;对C 项图象进行分析,可知温度不变,但体积增大,故C 项错误;对D 项图象进行分析,可知温度不变,压强减小,D 项正确.答案:AD10.如图所示为伽利略设计的一种测温装置示意图,玻璃管的上端与导热良好的玻璃泡连通,下端插入水中,玻璃泡中封闭有一定量的空气.若玻璃管中水柱上升,则外界大气的变化可能是( )A .温度降低,压强增大B .温度升高,压强不变C .温度升高,压强减小D .温度不变,压强减小解析:由题意可知,封闭空气温度与大气温度相同,封闭空气体积随水柱的上升而减小,将封闭空气近似看作理想气体,根据理想气体状态方程pV T =常量,若温度降低,体积减小,则压强可能增大、不变或减小,A 项正确;若温度升高,体积减小,则压强一定增大,B 、C 两项错误;若温度不变,体积减小,则压强一定增大,D 项错误.答案:A11.某不封闭的房间容积为20 m 3,在温度为7 ℃、大气压强为9.8×104 Pa 时,室内空气质量为25 kg.当温度升高到27 ℃、大气压强为1.0×105 Pa 时,室内空气的质量是多少?(T =273 K +t )解析:假设气体质量不变,末态体积为V 2,由理想气体状态方程有:p 1V 1T 1=p 2V 2T 2, 解得V 2=p 1V 1T 2p 2T 1=9.8×104×20×3001.0×105×280=21.0 m 3. 因为V 2>V 1,即有部分气体从房间内流出,设剩余气体质量为m 2,由比例关系有:V 1V 2=m 2m 1,m 2=m 1V 1V 2=23.8 kg.答案:23.8 kg12.图甲为1 mol 氢气的状态变化过程的V -T 图象,已知状态A 的参量为p A =1 atm ,T A =273 K ,V A =22.4×10-3 m 3,取1 atm=105 Pa ,在图乙中画出与甲图对应的状态变化过程的p -V 图,写出计算过程并标明A 、B 、C 的位置.解析:据题意,从状态A 变化到状态C 的过程中,由理想气体状态方程可得:p A V A T A =p C V C T C ,p C =1 atm ,从A 变化到B 的过程中有:p A V A T A=p B V B T B,p B =2 atm. A 、B 、C 的位置如图所示.答案:见解析13.[2019·潍坊高二检测]内燃机汽缸里的混合气体,在吸气冲程结束瞬间,温度为50 ℃,压强为1.0×105 Pa ,体积为0.93 L .在压缩冲程中,把气体的体积压缩为0.155 L 时,气体的压强增大到1.2×106 Pa.这时混合气体的温度升高到多少摄氏度?解析:气体初状态的状态参量为p 1=1.0×105 Pa ,V 1=0.93 L ,T 1=(50+273) K =323 K.气体末状态的状态参量为p 2=1.2×106 Pa ,V 2=0.155 L ,T 2为未知量.由p 1V 1T 1=p 2V 2T 2可求得T 2=p 2V 2p 1V 1T 1, 将已知量代入上式,得T 2=1.2×106×0.1551.0×105×0.93×323 K =646 K , 所以混合气体的温度t =(646-273) ℃=373 ℃.答案:373 ℃能力达标14.[2019·长春市质检]如图所示,绝热气缸开口向上放置在水平地面上,一质量m =10 kg,横截面积S=50 cm2的活塞可沿气缸无摩擦滑动;被封闭的理想气体温度t=27 ℃时,气柱长L=22.4 cm.已知大气压强为标准大气压p0=1.0×105Pa,标准状况下(压强为一个标准大气压,温度为0 ℃)理想气体的摩尔体积为22.4 L,阿伏加德罗常数N A=6.0×1023mol-1,g=10 m/s2.求:(计算结果保留两位有效数字)(1)被封闭理想气体的压强;(2)被封闭气体内所含分子的数目.解析:(1)被封闭理想气体的压强为p=p0+mg Sp=1.2×105 Pa(2)由p0V0T0=pVT得标准状况下的体积为V0=pVT0 p0T被封闭气体内所含分子的数目为N=N A V0 V m解得N=3.3×1022个答案:(1)1.2×105 Pa(2)3.3×1022。
最新人教版高中物理选修3-3第八章理想气体的状态方程1

1.1 DNA重组技术的基本工具
首 页
J 基础知识 Z 重点难点
ICHU ZHISHI
HONGDIAN NANDIAN
S 随堂练习
UITANG LIANXI
探究一
探究二
3.理想气体的内能 (1)对于一切物体而言,物体的内能包括分子动能和分子势能。 (2)对于理想气体而言,其微观本质是忽略了分子力,即不存在分子势能, 只有分子动能,故一定质量的理想气体的内能完全由温度决定。 【例题 1】关于理想气体,下列说法不正确的是(
-7-
1.1 DNA重组技术的基本工具
首 页
J 基础知识 Z 重点难点
ICHU ZHISHI
HONGDIAN NANDIAN
S 随堂练习
UITANG LIANXI
探究一
探究二
题后反思理想气体是一种理想化模型,客观上不存在,它
是对实际气体的科学抽象。实际气体在温度不太低、压强不太大时可以看 成理想气体。
-5-
1.1 DNA重组技术的基本工具
首 页
J 基础知识 Z 重点难点
ICHU ZHISHI
HONGDIAN NANDIAN
S 随堂练习
UITANG LIANXI
探究一
探究二
●名师精讲● 1.理想气体的特点 (1)严格遵守气体实验定律及理想气体状态方程。 (2)理想气体分子本身的大小与分子间的距离相比可以忽略不计,分子 可视为质点。 (3)理想气体分子除碰撞外,无相互作用的引力和斥力,故无分子势能, 理想气体的内能等于所有分子热运动动能之和,一定质量的理想气体内能 只与温度有关。 2.对理想气体的理解 (1)理想气体是为了研究问题方便而提出的一种理想模型,是实际气体 的一种近似,实际上并不存在,就像力学中的质点、电学中的点电荷模型一 样。 (2)从宏观上讲,实际气体在压强不太大、温度不太低的条件下,可视为 理想气体。 而在微观意义上,理想气体是指分子本身大小与分子间的距离相 比可以忽略不计且分子间不存在相互作用的引力和斥力的气体。
高中物理选修3-3气体
【练习4】课本第20页第1题、第23页第1题
(5)任意过程 【练习5】课本第25页例题、第2题
第二单元:气体热现象的微观意义
预习思考:
1、大量的可能性确定的随机事件,整体表现出的规律,叫做什么规律? 2、气体分子运动有什么样的特点? 3、同一温度下,气体分子热运动的分子动能都相同吗? 4、温度是物质热运动的平均动能的标志,这句话的具体意思是什么? 5、气体的压强是怎样产生的?从微观角度讲,它与哪些因素有关? 6、如何从微观角度推导气体的实验定律? 7、如何从微观角度理解气体的实验定律?
4、什么叫做理想气体?什么条件下可以把实际气体看做理想气体? 5、理想气体的状态方程是怎样的?它与玻意耳定律、查理定律、
盖-吕萨克定律是什么关系? 6、如何操作可以实现等温变化、等容变化或等圧变化? 7、等温等压条件下,气体的体积和物质的量满足怎样的关系?等温等
容条件下,气体的压强和物质的量满足怎样的关系? 8、理想气体状态方程中的常数C可能与什么因素有关?为什么气体实
⑤道尔顿分压定律:等温等容,p∝n
(混合气体的压强,等于各种气体单独产生压强的代数和,
且各种气体单独产生的压强与该气体的物质的量成正比。)
第一单元:气体实验定律
一、理想气体的状态方程
3、理想气体的四种过程 (1)等温过程:环境温度不变,器壁导热,且
变化过程缓慢,pV=C 【练习1】课本第25页第3题、第20页第2题
第八章 气 体
热学研究的思路
第一单元:气体实验定律
预习思考:
1、一定质量的气体,在保持温度不变时,压强和体积满足什么关系? p-V图象是怎样的?
2、一定质量的气体,在保持体积不变时,压强和温度满足什么关系? p-T图象是怎样的?
高中物理第八章气体章末专题归纳新人教版选修3

【解析】 (1)活塞刚离开 B 处时,体积不变,封闭
气体的压强为 p2=p0,由查理定律得:209.97pK0 =Tp0B,解得 TB=330 K。
(2)以封闭气体为研究对象,活塞开始在 B 处时,p1 =0.9p0,V1=V0,T1=297 K;活塞最后在 A 处时:V3
=1.1V0,T3=399.3
2.观察图像,弄清图像中各量的变化情况,看是 否属于特殊变化过程,如等温变化、等容变化或等压变 化。
3.若不是特殊过程,可在坐标系中作特殊变化的 图像(如等温线、等容线或等压线)实现两个状态的比 较。
4.涉及微观量的考查时,要注意各宏观量和相应 微观量的对应关系。
[例2] 如图8-2甲所示,水平放置的汽缸内壁光
(3)温度升高到T2为多少时,两管液面高度差为L。 【解析】 (1)活塞刚离开卡口时, 对活塞有mg+p0S=p1S
得 p1=p0+mSg。
(2)两侧气体体积不变,右管气体Tp00=Tp11得
T1=T01+pm0gS。
(3)左管内气体,L2=32L,p2=p0+mSg+ρgL
应用理想气体状态方程p0·T0LS=p2·T2L2S得
滑,活塞厚度不计,在A、B两处设有限制装置,使活塞 只能在A、B之间运动,B左面汽缸的容积为V0。A、B之间 的容积为0.1V0,开始时活塞在B处,缸内气体的压强为 0.9p0(p0为大气压强),温度为297 K,现缓慢加热汽缸内
气体,直至399.3 K。
图8-2
(1)求活塞刚离开B处时的温度TB; (2)求缸内气体最后的压强p3; (3)在图乙中画出整个过程的p-V图线。
图8-3
【解析】 初始状态下A、B两部分气体的压强分别
设为pA0、pB0,则对活塞A、B由平衡条件可得: p0S+mg=pA0S① pA0S+mg=pB0S② 最终状态下两部分融合在一起,压强设为p,体积设
人教版高中物理选修3-3复习素材: 第八章 气体知识点总结

选修3-3知识点第八章气体知识点8.1气体的等温变化1、气体的状态参量:压强、体积、温度2、等温变化:一定量的气体在温度不变的状态下,发生的变化。
3、探究气体等温变化的规律的方法:控制变量的方法。
一、玻意耳定律1、内容:一定质量的气体,在温度不变的情况下,它的压强跟体积成反比。
2、表达式:pV=C(常用于判断题)或p1V1=p2V2(常用于计算题)3、适用范围:温度不太低,压强不太大。
二、气体等温变化的P-V图像1、是一条以纵轴和横轴为渐近线的双曲线,称等温线。
2、物理意义:等温线上的某点表示气体的一个确定状态。
同一条等温线上的各点温度相同,即p与V乘积相同。
3、特点:温度越高,其等温线离原点越远。
解题步骤1、确定研究对象:被封闭的气体(液体)2、用一定的数字或表达式写出它们的初状态(P1、V1、T1)和末状态(P2、V2、T2)3、根据气体状态变化过程的特点,列出相应的气体公式(本节课中就是玻意耳定律公式p1V1=p2V2);4、将2中各条件代入气体公式中,求解未知量。
8.2等压等容变化一、气体的等容变化1、内容:一定质量的气体,在体积不变的情况下,它的压强P 与热力学温度T 成正比。
2、公式: 式中p 1、T 1和p 2、T 2分别表示气体在1(初态)、2(末态)两个不同状态下的压强和温度。
3、适用条件:①压强不太大,温度不太低;②气体的质量和体积都不变。
这里的C 和玻意耳定律表达式中的C 都泛指比例常数,它们并不相等。
二、气体等容变化的P-T 图像1、压力与热力学温度成正比例,称等容线。
2、特点:①一定质量的气体的P —T 图线其延长线过坐标原点,斜率反映体积大小。
②图线上每一个点表示气体一个确定的状态,同一根等容线上各状态的体积相同。
③不同体积下的等容线,斜率越大,体积越小(同一温度下,压强大的体积小)。
三、气体的等压变化1、内容:一定质量的某种气体,在压强不变的情况下,其体积V 与热力2211T p T p =C T p = 或学温度T 成正比.2、公式: 式中V 1、T 1和V 2、T 2分别表示气体在1(初态)、2(末态)两个不同状态下的压强和温度。
高中物理选修3-3-第八章-气体(全章)

p1V1 p2V2 或 pV C
T1
T2
T
方程具有 普遍性
答案: 1.25×10 5Pa
14
第八章 《气体》
15
气体的等容变化
问题:炎热的夏天,如果将自行车内胎充气过足,停 车时又没能放在阴凉处,而是放在阳光下曝晒,这样极易爆 裂,知道这是为什么吗?
答:曝晒过程中内胎容积变化甚微,可认为容积不变;
当温度升高时导致气体压强增大而使车胎爆裂.
结论:一定质量的气体,保持体积不变,当温度升高
压强跟体积的乘积与热力学温度的比值保持不变。
2、公式:
p1V1 p2V2
T1
T2
或 pV C T
3、使用条件: 一定质量的某种理想气体.
4、气体密度式: P1 P2
1T1 2T2 31
一定质量的理想气体,由初状态(p1、V1、T1) 变化到末状态(p2、V2、T2)时,两个状态的状态 参量之间的关系为:
3
探究方法: 控制变量法
4
第八章 《气体》
5
一、气体的等温变化: 气体在温度不变的状态下,
发生的变化叫做等温变化。
6
p/105 Pa
3
实 验2
1
0
1
2
3
4
V7
p/105 Pa3Leabharlann 实 验210
0.2
0.4
0.6
0.8
8
1/V
探究结论:
在温度不变时,压强p 和体积V成反比。
9
二、玻意耳定律
1、内容:
【课堂练习】
2、下列关于一定质量的气体的等容变化的说
法中正确的是: D
A、气体压强的改变量与摄氏温度成正比; B、气体的压强与摄氏温度成正比; C、气体压强的改变量与热力学温度成正比; D、气体的压强与热力学温度成正比。
2022届高三物理一轮复习 知识梳理:选修3-3 第八章 气 体

第八章气体第48讲气体实验定律、理想气体、气体热现象的微观意义(注:①考纲要求中Ⅰ代表了解和认识,Ⅱ代表理解和应用;②命题难度中的A代表容易,B代表中等,C代表难)一、气体的状态参量气体的状态参量是指气体的________、________、________三个状态参量.三个状态参量之间存在有一定的关系.二、气体的等温变化1.概念:一定质量的气体,在__________不变的条件下其________与________变化时的关系,我们把这种变化叫做等温变化.2.等温变化时的定性规律:一定质量的气体,在温度不变时,体积越大,压强越________.3.等温变化的定量规律:一定质量的某种气体,在________不变的情况下,________与________成________.这个规律称________定律.4.等温变化的表达式:p∝1V或pV=C(C为常量)或p1V1=p2V2(p1、V1和p2、V2分别表示气体在初、末两种不同状态下的压强和体积).5.等温变化的图象:三、气体的等容变化1.概念:一定质量的气体,在________不变的的条件下其________与________变化时的关系,我们把这种变化叫做等容变化.2.等容变化时的定性规律:一定质量的气体,在体积不变时,温度越高,压强越________.3.等容变化的规律:一定质量的某种气体,在________不变的情况下,________与________成__________.这个规律称________定律4.等容变化的表达式:p∝T、p=CT(C为常量)或p1T1=p2T2(p1、T1和p2、T2分别表示气体在初、末两种不同状态下的压强和温度).5.等容变化的图象:四、气体的等压变化1.概念:一定质量的气体,在__________不变的条件下其________与________变化时的关系,我们把这种变化叫做等压变化.2.等压变化时的定性规律:一定质量的气体,在压强不变时,温度越高,体积越________.3.等压变化的规律:一定质量的某种气体,在________不变的情况下,________与________成__________.这个规律称________定律4.等压变化的表达式:V∝T、V=CT(C为常量)或V1T1=V2T2(V1、T1和V2、T2分别表示气体在初、末两种不同状态下的体积和温度).5.等压变化的图象:五、理想气体的状态方程1.理想气体(1)宏观上讲,理想气体是指在任何条件下始终遵守气体实验定律的气体,实际气体在压强不太大、温度不太低的条件下,可视为理想气体.一般来说,在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,可以把实际气体当成理想气体来处理.(2)微观上讲,理想气体的分子间除碰撞外无其他作用力,分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间.2.理想气体的状态方程(1)一定质量的理想气体状态方程:________________或________________.(2)三个气体实验定律可看作一定质量理想气体状态方程的特例.·针对训练·(回归教材选修33第八章第3节)一定质量的某种理想气体由状态A变为状态D,其有关数据如图所示.若状态D的压强是104 Pa,状态A的压强是()A.1.5×104 Pa B.5×104 PaC.1.5×105 Pa D.2.5×105 Pa六、分子热运动速率的统计分布规律1.由于分子热运动是无规则的,所以对于任何一个分子而言,在每一时刻沿什么方向运动,以及运动的速率等都具有偶然性;但是对于大量分子的整体而言,它们却表现出规律性.这种由大量偶然事件的整体所表现出来的规律,叫做统计规律.2.分子的速率分布规律如图是氧气分子的速率分布图象,呈现出“中间多两头少”的统计分布规律,且由图象可看出温度越高,速率大的分子占总分子数的百分比越________,也说明热运动越________.3.理想气体的热力学温度T与分子的平均动能E-k成正比.即:T=αE-k,其中α为比例系数.这就是我们通常说的温度是分子平均动能的标志.七、对气体实验定律的微观解释1.一定质量的气体,影响压强大小的宏观因素为气体的________和________.从微观角度上看为________________和________________.2.等温变化:一定质量的理想气体,温度保持不变,体积增大时,压强________,原因是:___________________________________________________________ ____________________________________________________________________ _________________.3.等容变化:一定质量的理想气体,体积保持不变,温度增大时,压强________,原因是:___________________________________________________________ ____________________________________________________________________ _________________.4.等压变化:一定质量的理想气体,压强保持不变,温度增大时,体积________,原因是:___________________________________________________________ ____________________________________________________________________ _________________.考点1三个实验定律、理想气体及状态方程考点2气体分子运动的特点、气体实验定律的微观解释 1.气体分子间距较大,分子力可以忽略,因此分子间除碰撞外不受其他力的作用,故气体能充满它能达到的整个空间.2.分子做无规则的运动,速率有大有小,且一直在变化,大量分子的速率按“中间多,两头少”的规律分布.3.温度升高时,速率小的分子数减小,速率大的分子数增多,分子的平均速率将增加,速率分布规律仍然呈现“中间多,两头少”分布图象.4.一定质量的气体,体积决定了气体分子的密集程度、温度决定了气体分子的平均动能.状态参量变化时,从宏观量、微观量两个角度分析.·典型例题1·(16年连云港模拟)某理想气体在温度为0℃时,压强为2P0(P0为一个标准大气压),体积为0.5L,已知1mol理想气体标准状况下的体积为22.4L,阿伏加德罗常数N A=6.0×1023 mol-1.求:(1)标准状况下该气体的体积;(2)该气体的分子数(计算结果保留一位有效数字).【测量目标】本题考查了玻意尔定律、分子动理论、阿伏加德罗常数,测量考生的运用数学处理物理问题的能力.温馨提示涉及气体状态变化时p、V、T的求解时,要关注气体做等温变化、等压变化、等容变化,还是三个状态参量都发生变化.另外气体的问题还通常综合分子动理论、热力学第一定律.【练练手】·举一反三1·(16年淮安模拟)如图所示,一定质量的理想气体被活塞密封在一容器中,活塞与容器壁间无摩擦.当气体的温度升高时,气体体积__________ (选填“增大”“减小”或“不变”),从微观角度看,产生这种现象的原因是____________________________________.【测量目标】本题考查了气体等压变化的规律及其微观解释,测量考生的分析综合能力.温馨提示熟记密闭气体等压变化的规律,弄清气体压强产生的微观解释即可求解.·触类旁通·(16年忻州模拟)一定质量的理想气体从状态A变化到状态B再变化到状态C,其状态变化过程的p-V图象如图所示.已知该气体在状态A时的温度为27℃.(1)求该气体在状态B、C时的温度;(2)该气体从状态A到状态C的过程中是吸热还是放热?传递的热量是多少?【测量目标】本题考查了查理定律、盖·吕萨克定律,测量考生的分析综合能力.·典型例题2·(多选)关于气体分子运动和气体压强,下列说法正确的是()A.温度升高,所有气体分子的速率都增加B.温度升高,大量气体分子中速率小的分子数减少,速率大的分子数增多C.温度降低,分子平均速率减小,气体的压强一定降低D.一定质量的气体,温度一定,体积减小,分子密度增大【测量目标】本题考查了气体分子运动特点、气体压强的决定因素,测量考生的推理能力.温馨提示温度升高,分子的平均动能增加.气体的压强与气体的温度、体积有关.·举一反三2·(多选)如图所示,一定质量的理想气体由状态A 沿平行于纵轴的直线变化到状态B,则它的状态变化过程是() A.气体的温度不变B.气体的内能增加C.气体分子的平均速率减小D.气体的压强增大气体实验定律1.(14年江苏高考)下列对理想气体的理解,正确的有() A.理想气体实际上并不存在,只是一种理想模型B.只要气体压强不是很高就可视为理想气体C.一定质量的某种理想气体的内能与温度、体积都有关D.在任何温度、任何压强下,理想气体都遵循气体实验定律2.如图所示,一定质量的某种气体的等压线,等压线上的a、b 两个状态比较,下列说法正确的是()第2题图A.在相同时间内撞在单位面积上的分子数b状态较多B.在相同时间内撞在单位面积上的分子数a状态较多C.在相同时间内撞在相同面积上的分子数两状态一样多D.单位体积的分子数两状态一样多第3题图3.一定质量理想气体的状态变化如图所示,则该气体()A.状态b的压强大于状态c的压强B.状态a的压强大于状态b的压强C.从状态c到状态d,体积减小D.从状态a到状态c,温度不变4.如图,一定质量的理想气体从状态I变化到II的过程中,其压强随热力学温度变化的图象为双曲线的一支.若气体在状态I 的体积和温度分别为V 1、T 1,在状态II 的体积和温度分别为V 2、T 2,则( )第4题图A .V 1>V 2,且V 2=T 1T 2V 1B .V 1<V 2,且V 2=T 2T 1V 1C .V 1>V 2,且V 2=T 21T 22V 1D .V 1<V 2,且V 2=T 22T 21V 15.(多选)某种气体在不同温度下的气体分子速率分布曲线如图所示,图中f (v )表示v 处单位速率区间内的分子数百分率,由图可知( )第5题图A .气体的所有分子,其速率都在某个数值附近B .某个气体分子在高温状态时的速率可能与低温状态时相等C .高温状态下大多数分子的速率大于低温状态下大多数分子的速率D.高温状态下分子速率的分布范围相对较小6.如图所示,U形管内有一部分气体被水银封住,已知大气压为p0,则被封部分气体的压强p(以汞柱为单位)为()第6题图A.p0+h2B.p0-h1C.p0-(h1-h2) D.p0+h2-h17.(16年江苏模拟)若一条鱼儿正在水下10 m处戏水,吐出一个体积为1 cm3的气泡.气泡内的气体视为理想气体,且气体质量保持不变,大气压强为p0=1.0×105 Pa,g=10 m/s2,湖水温度保持不变,气泡在上升的过程中,气体________(选填“吸热”或者“放热”);气泡到达湖面时的体积为________ cm3.8.(16年徐州模拟)如图所示,用销钉固定的活塞把导热气缸分隔成两部分,A部分气体压强p A=6.0×105 Pa,体积V A=1L;B部分气体压强P B=2.0×105 Pa,体积V B=3L.现拔去销钉,外界温度保持不变,活塞与气缸间摩擦可忽略不计,整个过程无漏气,A、B两部分气体均为理想气体.求活塞稳定后A部分气体的压强.第8题图1.(15年江苏高考)给某包装袋充入氮气后密封,在室温下,袋中气体压强为1个标准大气压、体积为1L.将其缓慢压缩到压强为2个标准大气压时,气体的体积变为0.45L.请通过计算判断该包装袋是否漏气.2.(14年江苏高考)气体刚被压缩时的温度为27℃,体积为0.224m3,压强为1个标准大气压.已知1mol气体在1个标准大气压、0℃时的体积为22.4L,阿伏加德罗常数N A=6.02×1023 mol-1.计算此时气室中气体的分子数.(计算结果保留一位有效数字)出错题号___________________________________________________________ _____________错误分析___________________________________________________________ ____________________________________________________________________ ________________________________________________________________________ _________________解决方法___________________________________________________________ ____________________________________________________________________ ________________________________________________________________________ _________________。
高中物理第八章气体第2节气体的等容变化和等压变化讲义含解析新人教版选修3_3

第2节气体的等容变化和等压变化1.查理定律:一定质量的某种气体,在体积不变的情况下,压强p 与热力学温度T 成正比,即p T=C 。
2.盖-吕萨克定律:一定质量的某种气体,在压强不变的情况下,其体积V 与热力学温度T 成正比,即V T=C 。
3.玻意耳定律、查理定律、盖-吕萨克定律的适用条件均为一定质量的某种气体。
一、气体的等容变化 1.等容变化一定质量的某种气体,在体积不变时,压强随温度的变化。
2.查理定律 (1)内容:一定质量的某种气体,在体积不变的情况下,压强p 与热力学温度T 成正比。
(2)表达式:p T =C 或p 1T 1=p 2T 2。
(3)适用条件:①气体的质量不变;②气体的体积不变。
3.等容线一定质量的气体,在体积不变时,其p T 图像是一条过原点的直线,这条直线叫做等容线。
二、气体的等压变化 1.等压变化一定质量的某种气体,在压强不变时,体积随温度的变化。
2.盖-吕萨克定律 (1)内容:一定质量的某种气体,在压强不变的情况下,体积V 与热力学温度T 成正比。
(2)表达式:V =CT 或V T =C 或V 1T 1=V 2T 2。
(3)适用条件:①气体的质量不变;②气体的压强不变。
3.等压线一定质量的气体,在压强不变时,其V T 图像是一条过原点的直线,这条直线叫做等压线。
1.自主思考——判一判(1)气体的温度升高,气体体积一定增大。
(×)(2)一定质量的气体,在压强不变时体积与温度成正比。
(×)(3)一定质量的某种气体,在压强不变时,其V T 图像是过原点的直线。
(√) (4)一定质量的气体在体积不变的情况下,气体的压强与摄氏温度成正比。
(×) (5)pV =C 、p T =C 、V T=C ,三个公式中的常数C 是同一个值。
(×) 2.合作探究——议一议(1)某登山运动员在一次攀登珠穆朗玛峰的过程中,在接近山顶时他裸露在手腕上的防水手表的表盘玻璃突然爆裂了,而手表没有受到任何撞击,你知道其中的原因吗?提示:手表表壳可以看成一个密闭容器,出厂时封闭着一定质量的气体,登山过程中气体发生等容变化,因为高山山顶附近的压强比山脚处小很多,内外压力差超过表盘玻璃的承受限度,便会发生爆裂。
人教版高中物理选修3-3教学案:第八章 第1节 气体的等温变化-含解析

第1节气体的等温变化1.一定质量的气体,在温度不变的条件下,其压强与体积变化时的关系,叫做气体的等温变化。
2.玻意耳定律:一定质量的某种气体,在温度不变的情况下,压强p 与体积V 成反比,即pV =C 。
3.等温线:在p -V 图像中,用来表示温度不变时,压强和体积关系的图像,它们是一些双曲线。
在p -1V 图像中,等温线是倾斜直线。
一、探究气体等温变化的规律 1.状态参量研究气体性质时,常用气体的温度、体积、压强来描述气体的状态。
2.实验探究二、玻意耳定律1.内容一定质量的某种气体,在温度不变的情况下,压强与体积成反比。
2.公式pV=C或p1V1=p2V2。
3.条件气体的质量一定,温度不变。
4.气体等温变化的p -V图像气体的压强p随体积V的变化关系如图8-1-1所示,图线的形状为双曲线,它描述的是温度不变时的p -V关系,称为等温线。
一定质量的气体,不同温度下的等温线是不同的。
图8-1-11.自主思考——判一判(1)一定质量的气体压强跟体积成反比。
(×)(2)一定质量的气体压强跟体积成正比。
(×)(3)一定质量的气体在温度不变时,压强跟体积成反比。
(√)(4)在探究气体压强、体积、温度三个状态参量之间关系时采用控制变量法。
(√)(5)玻意耳定律适用于质量不变、温度变化的气体。
(×)(6)在公式pV=C中,C是一个与气体无关的参量。
(×)2.合作探究——议一议(1)用注射器对封闭气体进行等温变化的实验时,在改变封闭气体的体积时为什么要缓慢进行?提示:该实验的条件是气体的质量一定,温度不变,体积变化时封闭气体自身的温度会发生变化,为保证温度不变,应给封闭气体以足够的时间进行热交换,以保证气体的温度不变。
(2)玻意耳定律成立的条件是气体的温度不太低、压强不太大,那么为什么在压强很大、温度很低的情况下玻意耳定律就不成立了呢?提示:①在气体的温度不太低、压强不太大时,气体分子之间的距离很大,气体分子之间除碰撞外可以认为无作用力,并且气体分子本身的大小也可以忽略不计,这样由玻意耳定律计算得到的结果与实际的实验结果基本吻合,玻意耳定律成立。
最新人教版高中物理选修3-3第八章《理想气体的状态方程》教材梳理

庖丁巧解牛知识·巧学一、理想气体1.严格遵守气体实验定律的气体叫做理想气体.2.微观模型:①与分子间的距离相比,分子本身的大小可以忽略不计;②除碰撞的瞬间外,分子之间没有相互作用;③具有分子动能而无分子势能,内能由温度和气体物质的量决定,只是温度的函数,内能的变化与温度的变化成正比.3.理想气体是一种经科学的抽象而建立的理想化模型,实际上是不存在的,实际气体,特别是那些不易液化的气体,在压强不太大(和大气压强比较)、温度不太低(和室温比较)的条件下,都可视为理想气体,例如氢气、氧气、氮气、空气等在常温、常压的条件下,都可看作理想气体.深化升华 (1)宏观上讲,理想气体是指在任何条件下始终遵守气体实验定律的气体,实际气体在压强不太大、温度不太低的条件下,可视为理想气体.(2)微观上讲,理想气体应有如下性质:分子间除碰撞外无其他作用力;分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间.显然这样的气体是不存在的,只是实际气体在一定程度上近似.(3)从能量上看,理想气体的微观本质是忽略了分子力,所以其状态无论怎么变化都没有分子力做功,即没有分子势能的变化,于是理想气体的内能只有分子动能,即一定质量的理想气体的内能完全由温度决定.联想发散 理想气体实际上是不存在的,它只是为了研究问题的方便,突出事物的主要因素,忽略次要因素而引入的一种理想化模型,就像力学中引入质点、静电学中的点电荷模型一样,这些理想化模型的引入使我们对物体运动规律的研究大大简化.二、理想气体的状态方程1.状态方程的推导方法一:(1)条件:一定质量的理想气体(2)推导过程:设想气体状态变化过程,即气体由状态Ⅰ先经等温变化使气体体积由V 1变到V 2,然后再经过等容变化到状态Ⅱ,如图8-3-1所示.图8-3-1等温变化过程:p 1V 2=p c V 2p c =211V V p 等容变化过程:1T p C =22T p p C =212T T p 得111T V p =222T V p ,这就是理想的气体状态方程,即T pV =恒量. 方法二:推导推导过程:p A 、V A 、T A 、p C 、V C 、T C 的关系首先画出p-V 图象,如图8-3-2所示.图8-3-2由图8-3-2可知,A→B 为等温过程,根据玻意耳定律可得p A V A =p B V B ①从B→C 为等容过程,根据查理定律可得:B B T p =CC T p ② 又T B =T A ,V B =V C联立①②可得1A A A T V p =C C C T V p 上式表明,一定质量的某种理想气体在从一个状态1变化到另一个状态2时,尽管其p 、V 、T 都可能变化,但是压强跟体积与热力温度的比值保持不变,也就是说111T V p =222T V p 或T pV =C (C 为恒量). 学法一得 选定状态变化法设一定质量的气体由状态1(p 1、V 1、T 1)变化到状态2(p 2、V 2、T 2),我们给它选定一个中间过渡状态C ,遵守玻意耳定律,从状态C 至2遵守查理定律,所以p 1V 1=p C V 2,1T p C =22T p ,从两式消去p C 得111T V p =222T V p . 深化升华 中间状态的选定应使这一状态前后的状态变化各自遵守某一实验定律,并注意一定质量气体状态变化时,只有一个状态量变化是不可能的.2.理想气体状态方程(1)内容:一定质量的某种理想气体,从一个状态变化到另一个状态,压强和体积的乘积与热力学温度的比值保持不变.它是一定质量的某种理想气体处于某一状态时,三个状态参量必须满足的关系,即为理想气体的状态方程.(2)表达式一定质量的理想气体的状态方程为T pV =C (恒量)或111T V p =222T V p ① 深化升华 (1)把①式两边分别除以被研究气体的质量m ,可以得到方程111T p ρ=222T p ρ②即某种气体的压强除以这种气体的密度与绝对温度的乘积所得的商是一个常量.②式适用于密度变化的问题,如漏去气体或补充气体的情况,但等式两边所讨论的气体属于同种气体.(2)若理想气体在状态变化过程中,质量为m 的气体分成两个不同状态的部分m 1、m 2,或者由同种气体的若干个不同状态的部分m 1、m 2、…,m n 混合而成,有T pV =111T V p +222T V p +…+nn n T V p ③ ③式表示在总质量不变的前提下,同种气体进行分、合变态过程中各参量之间的关系,很多问题 可用这个来处理,显得较为简便.典题·热题知识点一 理想气体例1 关于理想气体,下列说法正确的是( )A.理想气体能严格遵守气体实验定律B.实际气体在温度不太高,压强不太大的情况下,可看成理想气体C.实际气体在温度不太低,压强不太大的情况下,可看成理想气体D.所有的实际气体在任何情况下,都可以看成理想气体解析:理想气体是在任何温度,任何压强下都能遵守气体实验定律的气体,A 选项正确.理想气体是实际气体在温度不太低,压强不太大情况下的抽象,故C 正确.答案:AC巧妙变式 能遵守气体实验定律的气体就是理想气体吗?不是.知识点二 理想气体的状态方程例2 一个半径为0.1 cm 的气泡,从18 m 深的湖底上升,如果湖底水的温度是8 ℃,湖面的温度是24 ℃,湖面的大气压强是76 cmHg ,那么气泡升至湖面时体积是多少?解析: 气泡从湖底上升过程中气泡的温度随上升而升高,可认为是水的温度.另外,气泡的压强和体积也发生变化.先确定初、末状态,再应用理想气体状态方程进行计算.此题的关键是确定气泡内气体的压强.由题意可知V 1=34πr 3=4.19×10-3 cm 3 p 1=p 0+汞水水p h p =76+6.1310182⨯ cmHg=208 cmHg T 1=273+8 K=281 Kp 2=76 cmHgT 2=273+24 K=297 K根据理想气体的状态方程111T V p =222V V p 得 V 2=12211T p T V p =28176297104.19208-3⨯⨯⨯⨯ cm 3=0.012 cm 3. 方法归纳 ①应用理想气体状态方程解题,关键是确定气体初、末状态的参量;②注意单位的换算关系;③用公式111T V p =222T V p 解题时,要求公式两边p 、V 、T 的单位分别一致即可,不一定采用国际单位.例3 用销钉固定的活塞把水平放置的容器分隔成A 、B 两部分,其体积之比为V A ∶V B =2∶1,如图8-3-3所示.起初A 中有温度为27 ℃、压强为1.8×105Pa 的空气,B 中有温度为127 ℃、压强为2×105 Pa 的空气.现拔出销钉,使活塞可以无摩擦地移动(无漏气),由于容器壁缓慢导热,最后气体都变到室温27 ℃,活塞也停止移动,求最后A 中气体的压强.图8-3-3解析:分别对A 、B 两部分气体列气态方程,再由A 、B 体积关系及变化前后体积之和不变、压强相等列方程,联立求解.(1)以A 中气体为研究对象:初态下:p A =1.8×105 Pa ,V A ,T A =300 K.末态下:p A ′=? V A ′=? T A ′=300 K.根据理想气体状态方程:p A V A =p A ′V A ′.(2)以B 中气体为研究对象:初态下:p B =2×105 Pa ,V B ,T B =400 K.末态下:p B ′=? V B ′=? T B ′=300 K.根据理想气体状态方程:B B B T V p ='''BB B T V p . (3)相关条件:V A ∶V B =2∶1,V A ′+V B ′=V A +V B ,p A ′=P B ′联立可解得:p A ′=1.7×105 Pa.方法归纳 本题涉及的两部分气体,虽然它们之间没有气体交换,但它们的压强或体积之间存在着联系,在解题时首先要用隔离法对各部分气体分别列式,再找出它们的压强和体积间的相关条件联立求解.知识点三 关于理想气体和力学知识的综合问题例4 如图8-3-4所示,一根一端封闭、一端开口向上的均匀玻璃管,长l=96 cm ,用一段长h=20 cm 的水银柱封住长h 1=60 cm 的空气柱,温度为27 ℃,大气压强p 0=76 cmHg ,问温度至少要升高到多少度,水银柱才能全部从管中溢出?图8-3-4解析:实际上,整个过程可分为两个阶段.第一阶段,水银柱尚未溢出阶段,加热气体,气体作等压变化,体积增大,温度升高;第二阶段,水银溢出,气体体积增大,但压强却减小,由TpV =C 可知,当p 、V 乘积最大时,温度应为最高. 由于第二个过程中,体积增大,压强减小,则可能出现温度的极值.以封闭气体为研究对象则初始状态下p 1=p 0+h=96 cmHgV 1=h 1S=60S T 1=300 K设管中剩余水银柱长为x cm 时,温度为T 2p 2=(p 0+x) cmHg=(76+x) cmHgV 2=(96-x)S根据理想气体状态方程111T V p =222T V p 有3006096⨯=2x)-x)(96(76T + 显然,要使T 2最大,则(76+x )(96-x )应最大,即x=10 cm 时,T 2有极大值是385.2 K. 温度至少要升至385.2 K ,水银柱才能全部排出.误区警示 当温度升高到T 2时管内水银柱全部排出,则1110)(T h h p +=20T l p T 2=100)(h h p L p +T=6020)(769676⨯+⨯×300 K=380 K 错误地认为温度升高后,水银逐步被排出管外,水银全部被排出时,对应温度最高,起初一看,似乎是合理的,但如果将末状态的压强和体积数值交换,即p 2=96 cmHg,h 2=76 cm ,这时温度仍为380 K ,但水银柱与气体的总和度却是(96-76+76) cm=96 cm ,恰好与管等长,也就是水银柱尚未溢出玻璃管.例5 如图8-3-5所示,粗细均匀的U 形玻璃管如图放置,管的竖直部分长为20 cm ,一端封闭,水平部分长40 cm ,水平段管内长为20 cm 的水银柱封住长35 cm 的气柱.已知所封闭的气体温度为7 ℃,大气压强为75 cmHg ,当管内温度升到351 ℃时管内空气柱的总长度是多少?(弯管部分体积忽略不计)图8-3-5解析:温度升高时,气体体积增加,水银柱可能进入直管也可能溢出,所以要首先分析各临界状态的条件,然后针对具体情况计算.设水银柱刚好与竖直管口平齐而正好不溢出,此时气柱高度为60 cm ,设温度为T 2. 以封闭气体为研究对象:初状态:p 1=p 0=75 cmHg,l 1=35 cm,T 1=280 K末状态:p 2′=95 cmHg,l 2=60 cm,T 2=?根据理想气体状态方程:111T S l p =222T S l p 所以T 2=1122l p l p T 1=35756095⨯⨯×280 K=608 K 即t 2=(608-273) ℃=335 ℃<351 ℃,所以水银柱会溢出.设溢出后,竖直管内仍剩余水银柱长为h cm ,则初状态:p 1=75 cmHg,l 1=35 cm,T 1=280 K末状态:p′2=(75+h) cmHg,l′2=(80-h) cm,T′2=(351+273) K=624 K根据理想气体状态方程得:111T S l p =222T S l p 即28035S 75⨯=624h)S h)(80(75++ h=15 cm故管内空气柱的长度为l 2′=(80-15) cm=65cm.方法归纳 理想气体状态方程的应用要点:(1)选对象:根据题意,选出所研究的某一部分气体,这部分气体在状态变化过程中,其质量必须保持一定.(2)找参量:找出作为研究对象的这部分气体发生状态变化前后的一组p 、V 、T 数值或表达式,压强的确定往往是个关键,常需结合力学知识(如力的平衡条件或牛顿运动定律)才能写出表达式.(3)认过程:过程表示两个状态之间的一种变化方式,除题中条件已直接指明外,在许多情况下,往往需要通过对研究对象跟周围环境的相互关系的分析中才能确定,认清变化过程是正确选用物理规律的前提.(4)列方程:根据研究对象状态变化的具体方式,选用气态方程或某一实验定律,代入具体数值,T 必须用热力学温度,p 、V 的单位统一,最后分析讨论所得结果的合理性及其物理意义.问题 ·探究交流讨论探究问题 为什么实际气体不能严格遵守气体实验定律?探究过程:郝明:分子本身占有一定的体积分子半径的数量级为10-10 m ,把它看成小球,每个分子的固有体积约为4×10-30 m 3,在标准状态下,1 m 3气体中的分子数n 0约为3×1025,分子本身总的体积为n 0V 约为1.2×10-4 m 3,跟气体的体积比较,约为它的万分之一,可以忽略不计.当压强较小时,由于分子本身的体积可以忽略不计,因此实际气体的性质近似于理想气体,能遵守玻意耳定律,当压强很大时,例如p=1 000×105 Pa ,假定玻意耳定律仍能适用,气体的体积将缩小为原来的千分之一,分子本身的总体积约占气体体积的1/10.在这种情况下,分子本身的体积就不能忽略不计了.由于气体能压缩的体积只是分子和分子之间的空隙,分子本身的体积是不能压缩的,就是说气体的可以压缩的体积比它的实际体积小.由于这个原因,实际气体当压强很大时,实测的p-V 值比由玻意耳定律计算出来的理论值偏大. 胡雷:分子间有相互作用力实际气体的分子间都有相互作用,除了分子相距很近表现为斥力外,相距稍远时则表现为引力,距离再大,超过几十纳米(纳米的符号是nm ,1 nm=10-9 m )时,则相互作用力趋于零.当压强较小时,气体分子间距离较大,分子间相互作用力可以不计,因此实际气体的性质近似于理想气体.但当压强很大时,分子间的距离变小,分子间的相互吸引力增大.于是,靠近器壁的气体分子受到指向气体内部的引力,使分子对器壁的压力减小,因而气体对器壁的压强比不存在分子引力时的压强要小,因此,当压强很大时,实际气体的实测p-V 值比由玻意耳定律计算出来的理论值偏小.探究结论:实际气体在压强很大时不能遵守玻意耳定律的原因,从分子运动论的观点来分析,有下述两个方面.(1)分子本身占有一定的体积;(2)分子间有相互作用力.上述两个原因中,一个是使气体的p-V 实验值偏大,一个是使气体的p-V 实验值偏小.在这两个原因中,哪一个原因占优势,就向哪一方面发生偏离.这就是实际气体在压强很大时不能严格遵守玻意耳定律的原因.同样,盖·吕萨克定律和查理定律用于实际气体也有偏差.思想方法探究问题 理想气体状态方程的推导可以有哪些种情况?探究过程:一定质量理想气体初态(p 1、V 1、T 1)变化到末态(p 2、V 2、T 2),因气体遵从三个实验定律,我们可以从三个定律中任意选取其中两个,通过一个中间状态,建立两个方程,解方程消去中间状态参量便可得到气态方程,组成方式有6种,如图8-3-6所示.图8-3-6我们选(1)先等温、后等压来证明从初态→中间态,由玻意耳定律得p 1V 1=p 2V′①从中间态→末态,由盖·吕萨克定律得2'V V =21T T ② 由①②得 111T V p =222T V p 其余5组大家可试证明一下.探究结论:先等温后等压;先等压后等温;先等容后等温;先等温后等容;先等压后等容;先等容后等压.。
高中物理选修3-3第八章《理想气体状态方程》
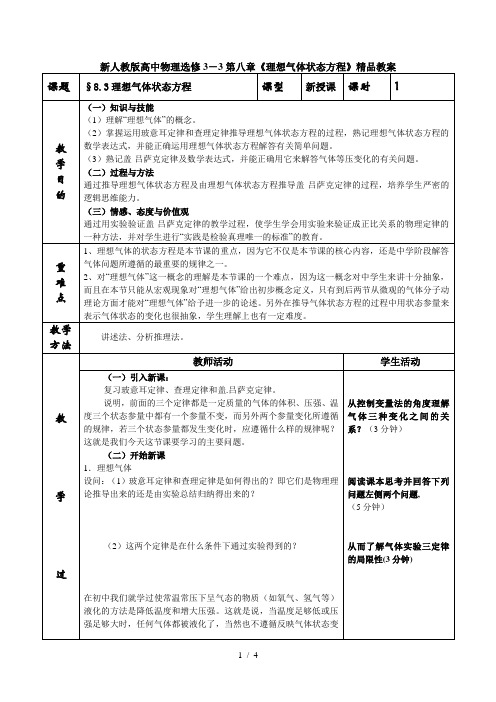
教学过态参量p c或p′c均可得到:这就是理想气体状态方程。
它说明:一定质量的理想气体的压强、体积的乘积与热力例题1 一水银气压计中混进了空气,因而在27℃,外界大气压为758毫米汞柱时,这个水银气压计的读数为738毫米汞柱,此时管中水银面距管顶80毫米,当温度降至-3℃时,这个气压计的读数为743毫米汞柱,求此时的实际大气压值为多少毫米汞柱?教师引导学生按以下步骤解答此题:(1)该题研究对象是什么?(2)画出该题两个状态的示意图:(3)分别写出两个状态的状态参量:p1=758-738=20mmHg V1=80Smm3(S是管的横截面积)。
T1=273+27=300 Kp2=p-743mmHg V2=(738+80)S-743S=75Smm3T2=273+(-3)=270K解得p=762.2 mmHg完成例题1,并总结此类问题的解题思路(5分钟)学习札记:课堂达标练习1、对于理想气体下列哪些说法是不正确的()A、理想气体是严格遵守气体实验定律的气体模型B、理想气体的分子间没有分子力C、理想气体是一种理想模型,没有实际意义D、实际气体在温度不太低,压强不太大的情况下,可当成理想气体2、一定质量的理想气体,从状态P1、V1、T1变化到状态P2、V2、T2。
下述过程不可能的是()A、P2>P1,V2>V1,T2>T1B、P2>P1,V2>V1,T2<T1C、P2>P1,V2<V1,T2>T1D、P2>P1,V2<V1,T2<T13、如图8—24所示,表示一定质量的理想气体沿从a到b到c到d再到a的方向发生状态变化的过程,则该气体压强变化情况是()ArrayA、从状态c到状态d,压强减小,内能减小B、从状态d到状态a,压强增大,内能减小C、从状态a到状态b,压强增大,内能增大D、从状态b到状态c,压强不变,内能增大4、密封的体积为2L的理想气体,压强为2atm,温度为270C。
加热后,压强和体积各增加20%,则它的最后温度是5、用活塞气筒向一个容积为V的容器内打气,每次能把体积为V0、压强为P0的空气打入容器内。
人教版高中物理选修3-3气体的等温变化知识点突破(解析版)

8.1 气体的等温变化学习目标1.了解玻意耳定律的内容、表达式及适用条件。
2.了解p-V图象的物理意义。
重点:1.掌握玻意耳定律的内容和公式。
2.理解气体等温变化的p-V图象的物理意义。
难点:1.理解气体等温变化的p-V图象的物理意义。
2.会用玻意耳定律计算有关的问题。
知识点一、等温变化1.气体的状态和状态参量:用以描述气体宏观性质的物理量,叫状态参量。
对于一定质量的某种气体来说,描述其宏观性质的物理量有温度、体积、压强三个。
(1)体积:指气体分子所能达到的空间,即气体所能充满的容器的容积。
(2)温度:从宏观角度看表示物体的冷热程度。
从微观角度看,温度是物体分子热运动的平均动能的标志。
(3)压强:垂直作用于容器壁单位面积上的压力。
单位:帕Pa。
2.气体的状态由状态参量决定,对一定质量的气体来说,当三个状态参量都不变时,我们就说气体的状态一定,否则气体的状态就发生了变化。
对于一定质量的气体,压强、温度、体积三个状态参量中只有一个量变而其他量不变是不可能的,起码其中的两个量变或三个量都发生变化。
3.等温变化:一定质量的气体,在温度不变的条件下其压强与体积变化时的关系。
【题1】下列过程可能发生的是A.气体的温度变化,但压强、体积保持不变B.气体的温度、压强保持不变,而体积发生变化C.气体的温度保持不变,而压强、体积发生变化D.气体的温度、压强、体积都发生变化【答案】CD【解析】p、V、T三个量中,可以两个量发生变化,一个量恒定;也可以三个量同时发生变化;一个量变化的情况是不存在的,故C、D选项正确。
【题2】(多选)一定质量的气体,在等温变化过程中,下列物理量中发生改变的有A.分子的平均速率B.单位体积内的分子数C.气体的压强D.分子总数【答案】BC【解析】温度不变,对于一定质量的气体,分子的平均动能不变,分子的平均速率也不会变;但体积和压强可以发生变化,故选B、C。
知识点二、实验:探究等温变化的规律1.实验器材:如图所示,有铁架台,带压力表的注射器、铁夹等。
人教版高中物理选修3-3 第八章 气体讲义 章末整合

章末整合一、气体压强的计算1.容器静止或匀速运动时求封闭气体的压强(1)连通器原理:在连通器中,同一液体(中间液体不间断、静止)的同一水平液面上的压强是相等的.(2)在考虑与气体接触的液柱所产生的附加压强p=ρgh时,应特别注意h是表示液面间竖直高度,不一定是液柱长度.(3)求由液体封闭的气体压强,应选择最低液面列平衡方程.(4)求由固体封闭(如汽缸和活塞封闭)气体的压强,应对此固体(如活塞或汽缸)进行受力分析,列合力平衡方程.2.容器加速运动时求封闭气体的压强(1)当容器加速运动时,通常选择与气体相关联的液体柱、固体等作为研究对象,进行受力分析,然后由牛顿第二定律列方程,求出封闭气体的压强.(2)封闭气体的压强,不仅与气体的状态变化有关,还与相关的水银柱、活塞、汽缸等物体的受力情况和运动状态有关.解决这类问题的关键是要明确研究对象,分析研究对象的受力情况,再根据运动情况,列研究对象的平衡方程或牛顿第二定律方程,然后解方程,就可求得封闭气体的压强.图1例1一段长为L的汞柱在均匀玻璃管中封住一定质量的气体,若将玻璃管开口向下放置,且管与水平面间的夹角为θ,如图1所示,则被封住气体的压强是多大?(水银的密度为ρ,大气压强为p 0)答案 p 0-ρgL sin θ解析 设被封住气体的压强为p ,则分析水银柱,其处于平衡状态,设水银柱的横截面积为S ,则有pS +ρgLS sin θ=p 0S ,p =p 0-ρgL sin θ.当封闭气体的液柱倾斜时,其产生的压强ρgh 中的h 是竖直高度.例2 如图2,一汽缸水平固定在静止的小车上,一质量为m 、面积为S 的活塞将一定量的气体封闭在汽缸内,平衡时活塞与汽缸底相距L .现让小车以一较小的水平恒定加速度向右运动,稳定时发现活塞相对于汽缸移动了距离d .已知大气压强为p 0,不计汽缸和活塞间的摩擦;且小车运动时,大气对活塞的压强仍可视为p 0;整个过程温度保持不变.求小车加速度的大小.图2答案p 0Sdm (L -d )解析 设小车加速度大小为a ,稳定时汽缸气体的压强为p 1,活塞受到汽缸内、外气体的压力分别为f 1=p 1S ① f 0=p 0S ②由牛顿第二定律得 f 1-f 0=ma ③小车静止时,在平衡情况下,汽缸内气体的压强应为p 0,由玻意耳定律得 p 1V 1=p 0V ④ 式中V =SL ⑤V 1=S (L -d )⑥ 联立①②③④⑤⑥式得 a =p 0Sdm (L -d )解题策略 这类问题的一般解题思路:首先明确研究对象,然后明确初、末状态及状态参量,再利用玻意耳定律列方程,从而联立求解.对于充气、抽气类问题可以通过灵活选取研究对象,化变质量为一定质量,进行解答.二、理想气体状态方程 应用状态方程解题的一般步骤(1)明确研究对象,即某一定质量的理想气体;(2)确定气体在始、末状态的参量p 1、V 1、T 1及p 2、V 2、T 2; (3)由状态方程列式求解; (4)讨论结果的合理性.特别提醒 在涉及到气体的内能、分子势能问题中要特别注意是否为理想气体,在涉及气体的状态参量关系时往往将实际气体当作理想气体处理,但这时往往关注的是是否满足一定质量.例3 如图3,绝热气缸A 与导热气缸B 均固定于地面,由刚性杆连接的绝热活塞与两气缸间均无摩擦.两气缸内装有处于平衡状态的理想气体,开始时体积均为V 0、温度均为T 0.缓慢加热A 中气体,停止加热达到稳定后,A 中气体压强为原来的1.2倍.设环境温度始终保持不变,求气缸A 中气体的体积V A 和温度T A .图3答案 76V 0 1.4T 0解析 设初态压强为p 0,膨胀后A 、B 压强相等 p B =1.2p 0B 中气体始、末状态温度相等,p 0V 0=1.2p 0(2V 0-V A ) 得V A =76V 0A 部分气体满足p 0V 0T 0=1.2p 0V AT A,得T A =1.4T 0.方法指导 这类问题的处理方法:确定研究对象后,再分析初、末状态的变化.若p 、V 、T 三个量都发生变化,则选用pVT =常数列方程.若某一个量不变,则选用合适的定律,列方程求解,在涉及两部分气体时,要注意找出两部分气体的联系,再列出联立方程.三、气体的图象问题要会识别图象反映的气体状态的变化特点,并且熟练进行图象的转换,理解图象的斜率、截距的物理意义.当图象反映的气体状态变化过程不是单一过程,而是连续发生几种变化时,注意分段分析,要特别关注两阶段衔接点的状态.例4 一定质量的理想气体,在状态变化过程中的p -T 图象如图4所示.在A 状态时的体积为V 0,试画出对应的V -T 图象和p -T 图象.图4答案 见解析图解析 对气体A →B 的过程,根据玻意耳定律,有p 0V 0=3p 0V B ,则V B =13V 0.由此可知A 、B 、C 三点的状态参量分别为:A :p 0,T 0,V 0;B :3p 0,T 0,13V 0;C :3p 0,3T 0,V 0.V -T 图象和p -V 图象分别如图甲、乙所示.四、对气体压强的理解1.气体压强的大小等于气体作用在器壁单位面积上的压力.2.产生原因:大量气体分子无规则运动碰撞器壁,形成对器壁各处均匀的持续的压力而产生.3.决定因素:一定质量气体的压强大小,微观上取决于分子的平均动能和单位体积内的分子数;宏观上取决于气体的温度T和体积V.例5如图5所示,两个完全相同的圆柱形密闭容器,甲中装有与容器容积相等的水,乙中充满空气,试问:图5(1)两容器各侧壁压强的大小关系及压强的大小决定于哪些因素?(容器容积恒定)(2)若让两容器同时做自由落体运动,容器侧壁上所受压强将怎样变化?答案见解析解析(1)对甲容器,上壁的压强为零,底面的压强最大,其数值为p=ρgh(h 为上下底面间的距离).侧壁的压强自上而下,由小变大,其数值大小与侧壁上各点距水面的竖直距离x的关系是p=ρgx.对乙容器,各处器壁上的压强大小都相等,其大小决定于气体的分子密集程度和温度.(2)甲容器做自由落体运动时器壁各处的压强均为零.乙容器做自由落体运动时,器壁各处的压强不发生变化.解题策略(1)掌握好气体分子压强的微观解释.(2)千万不要把液体和气体压强混淆,要从产生原因上加以区别.章末检测(时间:90分钟满分:100分)一、选择题(每小题5分,共50分)1.关于理想气体,正确说法是()A.只有当温度很低时,实际气体才可当作理想气体B.只有压强很大时,实际气体才可当作理想气体C.在常温常压下,许多实际气体可当作理想气体D.所有的实际气体在任何情况下,都可以当作理想气体答案 C2.已知湖水深度为20 m,湖底水温为4 ℃,水面温度为17 ℃,大气压强为 1.0×105Pa.当一气泡从湖底缓慢升到水面时,其体积约为原来的(取g=10 m/s2,ρ水=1.0×103 kg/m3)()A.12.8倍B.8.5倍C.3.1倍D.2.1倍答案 C解析湖底压强大约为p0+ρ水gh,即3个大气压,由气体状态方程,3p0V14+273=p0V217+273,当一气泡从湖底缓慢升到水面时,其体积约为原来的3.1倍,选项C 正确.3.一定质量的理想气体发生状态变化时,其状态参量p、V、T的变化情况可能是()A.p、V、T都增大B.p减小,V和T都增大C.p和V减小,T增大D.p和T增大,V减小答案ABD解析 由pVT =C 可知,A 、B 、D 正确,C 错误.4.如图1,一定质量的理想气体从状态a 沿直线变化到状态b ,在此过程中,其压强( )图1A .逐渐增大B .逐渐减小C .始终不变D .先增大后减小答案 A解析 气体从a 到b 的变化过程中,体积V 减小,温度T 升高,由理想气体状态方程pVT =C 可知,气体压强逐渐增大,本题只有选项A 正确.5.两个相同的密闭容器中分别装有等质量的同种理想气体,已知容器中气体的压强不相同,则下列判断中正确的是( )A .压强小的容器中气体的温度比较高B .压强大的容器中气体单位体积内的分子数比较少C .压强小的容器中气体分子的平均动能比较小D .压强大的容器中气体分子对器壁单位面积的平均作用力比较大 答案 CD解析 相同的容器分别装有等质量的同种气体,说明它们所含的分子总数相同,即分子数密度相同,B 错;压强不同,一定是因为两容器气体分子平均动能不同造成的,压强小的容器中分子的平均动能一定较小,温度较低,故A 错、C 对;压强大的容器中气体分子对器壁单位面积的平均作用力比较大,故D 项正确.6.如图2所示,两端封闭的粗细均匀的U 形管中,封闭两段气柱,长度分别为l 1,l 2,现让管在竖直方向上运动,下述判断正确的是( )图2A.加速上升时,l1变长,l2变短B.加速上升时,l2变长,l1变短C.减速下降时,l2变长,l1变短D.减速上升时,l1变短,l2变长答案BC解析管在竖直方向加速上升和减速下降时,加速度方向向上,水银柱超重,减速上升时失重.现在管静止时,p2=p1-p h,气柱l2的压强小,气柱l1的压强大,当超重时,l1长度变短,l2变长,B,C两项正确.当失重时,l1变长,l2变短.7.一端封闭的玻璃管开口朝下浸入水中,在某一深度恰好能保持静止.如果水面上方大气压突然降低一些,玻璃管在水中的运动情况是() A.加速上升,直到玻璃管一部分露出水面B.加速下降,直到水底C.先加速下降,后减速下降至某一深度平衡D.仍然静止答案 A解析上方大气压突然降低,玻璃管中的气体体积增大,将管中的水挤出一部分而上升,上升过程中压强进一步减小,管内气体进一步膨胀,继续加速上升,直到玻璃管一部分露出水面,A正确.8.如图3为一注水的玻璃装置,玻璃管D、E上端与大气相通,利用玻璃管C使A、B两球上部相通,D、C、E三管与两球接口处紧密封接.当A、B、D的水面高度差如图所示时,E管内水面相对B中水面的高度差h应等于()图3A.0米B.0.5米C.1米D.1.5米答案 D解析表面看,1区、2区液面不在同一水平面,但1、2区以管C相通,p1=p2=p C.即p1=p0+ρgh1h1=1.5 mp2=p1=p0+ρgh则h=1.5 m,D正确.注意:若液柱倾斜,仍有p=p0+ρgh,而h为液柱竖直高度.9.图4为伽利略设计的一种测温装置示意图,玻璃管的上端与导热良好的玻璃泡连通,下端插入水中,玻璃泡中封闭有一定量的空气.若玻璃管内水柱上升,则外界大气的变化可能是()图4A.温度降低,压强增大B.温度升高,压强不变C.温度升高,压强减小D.温度不变,压强减小答案 A解析 对于一定质量的理想气体pV T =C ,得出V =C Tp .当温度降低,压强增大时,体积减小,故A 正确;当温度升高,压强不变时,体积增大,故B 错;当温度升高,压强减小时,体积增大,故C 错;当温度不变,压强减小时,体积增大,故D 错.10.如图5所示为竖直放置的上细下粗密闭细管,水银柱将气体分隔为A 、B 两部分,初始温度相同.使A 、B 升高相同温度达到稳定后,体积变化量为ΔV A ,ΔV B ,压强变化量Δp A 、Δp B ,对液面压力的变化量为ΔF A 、ΔF B ,则( )图5A .水银柱向上移动了一段距离B .ΔV A <ΔV BC .Δp A >Δp BD .ΔF A =ΔF B 答案 AC解析 假定水银柱不动,升高相同的温度,对气体A :p A T 1=p A ′T 2,得p A ′-p A T 2-T 1=p AT 1,同理知p B ′-p B T 2-T 1=p B T 1,又因为p A >p B ,故p A ′-p A >p B ′-p B ,所以水银柱向上移动,水银柱上下液面压强差更大,所以Δp A >Δp B ,因此A 、C 两项正确;因为水银不可压缩,故ΔV A =ΔV B ,B 项错误;因为ΔF A =Δp A ·S A ,ΔF B =Δp B ·S B ,故D 项错.故正确答案为A 、C.二、填空题(每小题5分,共10分)11.一定质量的理想气体,当体积保持不变时,其压强随温度升高而增大,用分子动理论来解释,当气体的温度升高时,其分子的热运动加剧,因此(1)________;(2)________,从而导致气体的压强增大.答案 (1)每个分子每次碰撞器壁的平均作用力增大 (2)单位时间内对器壁单位面积上的碰撞次数增多12.对于一定质量的理想气体,以p 、V 、T 三个状态参量中的两个为坐标轴建立直角坐标系,在坐标系上描点能直观地表示这两个参量的数值.如图6所示,三个坐标系中,两个点都表示相同质量某种理想气体的两个状态.根据坐标系中不同点的位置来比较第三个参量的大小.图6(1)p -T 图象(图甲)中A 、B 两个状态,________状态体积小. (2)V -T 图象(图乙)中C 、D 两个状态,________状态压强小. (3)p -V 图象(图丙)中E 、F 两个状态,________状态温度低. 答案 (1)A (2)C (3)F解析 甲图画出的倾斜直线为等容线,斜率越小,体积越大,所以V B >V A .乙图画出的倾斜直线为等压线,斜率越小,压强越大,所以p D >p C .丙图画出的双曲线为等温线,离原点越远,温度越高,所以T E >T F .三、计算题(共4小题,共40分)13.(8分)如图7所示的试管内由水银封有一定质量的气体,静止时气柱长为l 0,大气压强为p 0.当试管绕竖直轴以角速度ω在水平面内匀速转动时气柱长变为l ,其他尺寸如图所示,求转动时气体的压强.图7答案 p 0+ρl 1ω2⎝ ⎛⎭⎪⎫l 2+l 0-l +l 12(设温度不变,试管横截面积为S ,水银密度为ρ)解析 选取水银柱为研究对象,转动所需向心力由液柱两侧气体压力差提供,则:(p -p 0)S =mω2R ,而m =ρl 1S ,R =l 2+(l 0-l )+l 12, 所以p =p 0+ρl 1ω2⎝ ⎛⎭⎪⎫l 2+l 0-l +l 12. 14.(10分)如图8所示,长31 cm 内径均匀的细玻璃管,开口向上竖直放置,齐口水银柱封住10 cm 长的空气柱,若把玻璃管在竖直平面内缓慢转动180°后,发现水银柱长度变为15 cm ,继续缓慢转动180°至开口端向上.求:图8(1)大气压强的值; (2)末状态时空气柱的长度. 答案 (1)75 cm Hg (2)10.67 cm 解析 (1)等温变化p 1V 1=p 2V 2 p 1=p 0+21 cmHg p 2=p 0-15 cmHg (p 0+21)×10×S =(p 0-15)×16×S 解得:p 0=75 cmHg.(2)由玻意耳定律得p 1V 1=p 3V 3 p 3=p 0+15 cmHgl 3=p 1l 1p 3=(75+21)×10 cm(75+15)=10.67 cm.15.(10分)如图9所示,足够长的圆柱形气缸竖直放置,其横截面积为1×10-3m 2,气缸内有质量m =2 kg 的活塞,活塞与气缸壁封闭良好,不计摩擦.开始时活塞被销子K 销于如图位置,离缸底12 cm ,此时气缸内被封闭气体的压强1.5×105 Pa ,温度为300 K .外界大气压为1.0×105 Pa ,g =10 m/s 2.图9(1)现对密闭气体加热,当温度升到400 K 时,其压强多大?(2)若在此时拔去销子K ,活塞开始向上运动,当它最后静止在某一位置时,气缸内气体的温度为360 K ,则这时活塞离缸底的距离为多少?答案 (1)2×105 Pa (2)18 cm解析 (1)气体体积不变,由查理定律得 p 1T 1=p 2T 2,即1.5×105300=p 400 解得:p =2×105 Pa(2)p 3=p 0+mg /S =1.2×105 Pa T 3=360 K由理想气体状态方程得p 1V 1T 1=p 3V 3T 3,即1.5×105×12300=1.2×105×l 3360解得:l 3=18 cm.16.(12分)如图10,两个侧壁绝热、顶部和底部都导热的相同汽缸直立放置,汽缸底部和顶部均有细管连通,顶部的细管带有阀门K.两汽缸的容积均为V 0,汽缸中各有一个绝热活塞(质量不同,厚度可忽略).开始时K 关闭,两活塞下方和右活塞上方充有气体(可视为理想气体),压强分别为p 0和p 03;左活塞在汽缸正中间,其上方为真空;右活塞上方气体体积为V 04.现使汽缸底与一恒温热源接触,平衡后左活塞升至汽缸顶部,且与顶部刚好没有接触,然后打开K ,经过一段时间,重新达到平衡.已知外界温度为T 0,不计活塞与汽缸壁间的摩擦.求:图10(1)恒温热源的温度T ;(2)重新达到平衡后左汽缸中活塞上方气体的体积V x . 答案 (1)75T 0 (2)12V 0解析 (1)与恒温热源接触后,在K 未打开时,右活塞不动,两活塞下方气体经历等压过程,由盖—吕萨克定律得TT 0=7V 045V 04①由此得T =75T 0②(2)由初始状态的力学平衡条件可知,左活塞的质量比右活塞的大,打开K 后,左活塞下降至某一位置,右活塞必须升至汽缸顶,才能满足力学平衡条件.汽缸顶部与外界接触,底部与恒温热源接触,两部分气体各自经历等温过程,设左活塞上方气体压强为p ,由玻意耳律得pV x =p 03·V 04③(p +p 0)(2V 0-V x )=p 0·7V 04④联立③④式,得6V 2x -V 0V x -V 20=0,其解为V x=12V 0 另一个解V x =-13V 0,不符合题意,舍去.。
人教版高中物理选修3-3第八章气体章末复习课

》》》》》》》》》积一时之跬步臻千里之遥程《《《《《《《《《《《《高中物理学习材料(马鸣风萧萧 ** 整理制作)章末复习课【知识体系】[ 答案填写 ] ①标志②t+ 273.15 K ③碰撞④密集程度⑤温度⑥原点⑦体积⑧直线⑨压强⑩理想气体主题 1气体的实验定律1.玻意耳定律.(1)条件:质量不变,温度不变.p1V2(2)公式: pV=C 或 p1V1=p2V2或p2=V1.2.查理定律.(1)条件:质量不变,体积不变.p p1p2(2)公式:T=C 或T1=T2.3.盖—吕萨克定律.(1)条件:质量不变,压强不变.V V1V2(2)公式:T=C 或T1=T2.4.使用步骤:(1)确定研究对象,并判断是否满足某个实验定律条件;(2)确定初末状态及状态参量;(3)根据实验定律列方程求解(注意单位统一 );(4)注意分析隐含条件,做出必要的判断和说明.【例 1】扣在水平桌面上的热杯盖有时会发生被顶起的现象,如图所示,截面积为S 的热杯盖扣在水平桌面上,开始时内部封闭气体的温度为 300 K ,压强为大气压强p0.当封闭气体温度上升至303 K 时,杯盖恰好被整体顶起,放出少许气体后又落回桌面,其内部压强立即减为 p0,温度仍为 303 K.再经过一段时间,内部气体温度恢复到 300 K .整个过程中封闭气体均可视为理想气体.求:(1)当温度上升到303 K 且尚未放气时,封闭气体的压强;(2)当温度恢复到300 K 时,竖直向上提起杯盖所需的最小力.解析: (1)气体进行等容变化,开始时,压强为p0,温度 T0=300 K ;当温度上升到 303 K 且尚未放气时,压强为p1,温度 T1=303 K.根据p0=p1可得T0T1T1303p1=T0p0=300p0=1.01p0.体温度恢复到300 K 时,由等容变化方程可得p 0=T1 p2T0,解得 p2=T0=300 0= p0 T1p303p1.01.当杯盖恰被顶起时有:p1S=mg+ p0S,若将杯盖提起时所需的最小力满足F min+p2S=p0S+mg,201解得 F min=10 100p0S≈ 0.02p0S.答案: (1)1.01p0 (2)0.02p0S针对训练1.如图所示为一种减震垫,上面布满了圆柱状薄膜气泡,每个气泡内充满体积为 V0,压强为 p0的气体,当平板状物品平放在气泡上时,气泡被压缩.若气泡内气体可视为理想气体,其温度保持不变,当体积压缩到 V 时气泡与物品接触面的面积为 S,求此时每个气泡内气体对接触面处薄膜的压力.解析:设压力为 F ,压缩后气体压强为p,由 p0V0=pV 和 F =pS,V0解得 F =V p0S.V0答案:V p0S主题 2理想气体状态方程1.条件:理想气体.pV=C 或p1V1 p2V22.公式:T T1=T2.3.步骤:(1)确定研究对象,是否质量不变;(2)确定初末状态及状态参量;(3)根据理想气体方程求解(注意单位统一 );(4)注意分析隐含条件 (变质量问题转化为定质量问题),做出必要的判断和说明.【例 2】(2014 ·上海卷 )如图,一端封闭、粗细均匀的 U 形玻璃管开口向上竖直放置,用水银将一段气体封闭在管中.当温度为280K时,被封闭的气柱长 L =22 cm,两边水银柱高度差 h=16 cm,大气压强 p0=76 cmHg.(1)为使左端水银面下降 3 cm,封闭气体温度应变为多少?(2)封闭气体的温度重新回到280 K 后,为使封闭气柱长度变为20cm,需向开口端注入的水银柱长度为多少?解析: (1)初态压强p1=(76-16)cmHg =60 cmHg.末态时左右水银面高度差为(16-2×3)cm= 10 cm,压强 p2= (76-10)cmHg=66 cmHg.由理想气体状态方程:p1V1=p2V2,T1T2p2V2T166×25解得 T2=p1V1=60×22×280 K =350 K.(2)设加入的水银高度为l ,末态时左右水银面高度差h′= (16+2×2)-l.由玻意耳定律: p1V1=p3V3.式中 p3= 76- (20-l),解得: l=10 cm.答案: (1)350 K (2)10 cm针对训练2.如图,气缸左右两侧气体由绝热活塞隔开,活塞与气缸光滑接触.初始时两侧气体均处于平衡态,体积之比V1∶V2=1∶2,温度之比 T1∶T2= 2∶5.先保持右侧气体温度不变,升高左侧气体温度,使两侧气体体积相同;然后使活塞导热,两侧气体最后达到平衡,求:(1)两侧气体体积相同时,左侧气体的温度与初始温度之比;(2)最后两侧气体的体积之比.解析: (1)设初始时压强为p.pV1 p′V左侧气体满足:T1=kT 1 ,右侧气体满足: pV2=p′V.V2解得 k=V=2.(2)活塞导热达到平衡.p′V1p″ V1′左侧气体满足:kT 1=T1′,p′V p″V2′右侧气体满足:T2=T2′,平衡时 T1′= T2′,V1′T2 5解得==.V2′kT1 45答案: (1)2(2)4主题 3气体的图象问题【例 3】(多选 )如图所示,用活塞把一定质量的理想气体封闭在气缸中,现用水平外力 F 作用于活塞杆,使活塞缓慢地向右移动一段距离,由状态①变化到状态②.如果环境保持恒温,分别用 p、V、T 表示该理想气体的压强、体积、温度.气体从状态①变化到状态②.下列图象中可以表示此过程的是()解析:由题意知,由状态①变化到状态②的过程中,温度保持不pV=C可知压强减小.对A图象进行分析,p-变,体积增大,根据TV 图象是双曲线即等温线,且由①到②体积增大,压强减小,故 A 正确.对 B 图象进行分析, p-V 图象是直线,温度会发生变化,故B 错误.对C 图象进行分析,可知温度不变,但体积减小,故 C 错误.对D 图象进行分析,可知温度不变,压强减小,体积增大,故D正确.答案: AD针对训练3.(多选 )一定质量的理想气体经过如图所示的一系列过程,下列说法中正确的是 ()A.a→b 过程中,气体体积增大,压强减小B.b→c 过程中,气体压强不变,体积增大C.c→a 过程中,气体压强增大,体积变小D.c→a 过程中,气体内能增大,体积不变答案: AD统揽考情气体是高考的必考部分,这也说明本章在高考中所占比重比较大.本章习题在新课标高考中多以计算题的形式出现,而且是必考的一类题.考查内容:气体实验定律和理想气体状态方程,还要涉及压强计算和压强的微观表示方法.真题例析(2015 ·课标全国Ⅰ卷)如图所示,一固定的竖直气缸有一大一小两个同轴圆筒组成,两圆筒中各有一个活塞,已知大活塞的质量为m1 =2.50 kg,横截面积为 S1=80.0 cm2,小活塞的质量为 m2=1.50 kg,横截面积为 S2=40.0 cm2;两活塞用刚性轻杆连接,间距保持为 l=40.0 cm,气缸外大气压强为p=1.00×105 Pa,温度为 T=303 K .初l始时大活塞与大圆筒底部相距2,两活塞间封闭气体的温度为T1=495 K,现气缸内气体温度缓慢下降,活塞缓慢下移,忽略两活塞与气缸壁之间的摩擦,重力加速度g 取 10 m/s2,求:(1)在大活塞与大圆筒底部接触前的瞬间,缸内封闭气体的温度;(2)缸内封闭的气体与缸外大气达到热平衡时,缸内封闭气体的压强.解析: (1)大小活塞缓慢下降过程,活塞外表受力情况不变,气缸内压强不变,气缸内气体为等压变化.L初始状态: V1=2(S1+S2),T1=495 K;末状态: V2=LS2.V1V2由盖-吕萨克定律:T1=T2代入数值可得: T2=330 K.(2)对大小活塞受力分析则有m1g+m2g+pS1+p1S2=pS2+p1S1,可得 p1= 1.1×105 Pa,缸内封闭的气体与缸外大气达到热平衡时,气体体积不变,为等容变化.初状态: p1=1.1×105 Pa,T2=330 K ,末状态: T=303 K,由查理定律p1=p2,得 p2=1.01×105Pa. T2T答案: (1)330 K(2)1.01×105 Pa针对训练(2014 ·课标全国Ⅱ卷)如图,两气缸 A、B 粗细均匀、等高且内壁光滑.其下部由体积可忽略的细管连通; A 的直径是 B 的 2 倍,A 上端封闭, B 上端与大气连通;两气缸除 A 顶部导热外,其余部分均绝热.两气缸中各有一厚度可忽略的绝热轻活塞a、 b,活塞下方充由氮气,活塞 a 上方充有氧气.当大气压为P0,外界和气缸内气体1 温度均为 7 ℃且平衡时,活塞 a 离气缸顶的距离是气缸高度的4,活塞b 在气缸正中间.(1)现通过电阻丝缓慢加热氮气,当活塞 b 恰好升至顶部时,求氮气的温度;(2)继续缓慢加热,使活塞 a 上升,当活塞 a 上升的距离是气缸1高度的16时,求氧气的压强.解析: (1)活塞 b 升至顶部的过程中,活塞 a 不动,活塞 ab 下方的氮气经历等压过程,设气缸 A 的容积为 V0,氮气初始状态的体积为V1,温度为 T1,末态体积 V2,温度为V0T2,按题意,气缸 B 的容积为4,由题给数据及盖—吕萨克定V1V2律有:T1=T2,①31V0 7且 V1=4V0+2 4=8V0,②3V0V2=4V0+4=V0.③由①②③式及所给的数据可得:T2=320 K .④(2)活塞 b 升至顶部后,由于继续缓慢加热,活塞 a 开始向上移1动,直至活塞上升的距离是气缸高度的16时,活塞 a 上方的氮气经历等温过程,设氮气初始状态的体积为V1′,压强为P1′;末态体积为V2′,压强为 P2′,由所给数据及玻意耳定律可得1 3V1′=4V0,p1′= p0′, V2′=16V,⑤p1′V1′= p2′ V2′.⑥4 由⑤⑥式可得: p2′=3p0.4答案: (1)320 K(2)3p01.(2014 上·海卷 )如图,竖直放置、开口向下的试管内用水银封闭一段气体,若试管自由下落,管内气体()A.压强增大,体积增大B.压强增大,体积减小C.压强减小,体积增大D.压强减小,体积减小解析:初始时,水银处于静止状态,受到的重力和封闭气体的压力之和与外界大气压力等大反向;当试管自由下落时,管中水银也处于完全失重状态,加速度为 g 竖直向下,所以封闭气体的压强与外界大气压等大;由此可知封闭气体的压强增大, 根据理想气体状态方程可知,气体的体积减小, B 项正确.答案: B2. (2015 ·苏卷江 )给某包装袋充入氮气后密封,在室温下,袋中气体压强为 1 个标准大气压、体积为1 L .将其缓慢压缩到压强为 2个标准大气压时, 气体的体积变为 0.45 L .请通过计算判断该包装袋是否漏气.解析:将包装袋压缩到压强为2 个标准大气压温度不变:初状态: p 1=1 atm ,V 1=1 L ;末状态: p 1=2 atm.由玻意耳定律: p 1V 1=p 2V 2,解得: V 2=0.5 L>0.45 L.则会漏气.答案:会漏气3. (2015 ·庆卷重 )北方某地的冬天室外气温很低,吹出的肥皂泡会很快冻结.若刚吹出时肥皂泡内气体温度为T 1,压强为 p 1,肥皂泡冻结后泡内气体温度降为T 2.整个过程中泡内气体视为理想气体,不计体积和质量变化,大气压强为 p 0.求冻结后肥皂膜内外气体的压强差.解析:由题知质量和体积不变得 初状态: p 1, 1,末状态: 2, 2T p T .由查理定理:p 1=p 2,则: p 2=P 1T 2,T 1 T 2T 1则压强差:= 21 T 211T 2-1 1p p -p =T 1p - p =T 1p .答案:T 2-1 p 14.(2015 课·标全国Ⅱ卷 )如图所示,一粗细均匀的 U 形管竖直放置,A 侧上端封闭,B 侧上端与大气相通,下端开口处开关K 关闭,A 侧空气柱的长度为 l =10.0 cm,B 侧水银面比 A 侧的高 h=3.0 cm. 现将开关K 打开,从U 形管中放出部分水银,当两侧的高度差为h1=10.0 cm 时,将开关 K 关闭,已知大气压强 P0=75.0 cmHg.(1)求放出部分水银后 A 侧空气柱的长度;(2)此后再向 B 侧注入水银,使A、B 两侧的水银达到同一高度,求注入水银在管内的长度.解析: (1)以 cmHg 为压强单位,设 A 侧空气长度 l=10.0 cm 时压强为 p;当两侧水银面的高度差为 h1=10.0 cm 时,空气柱的长度为 l 1,压强为 p1.由玻意耳定律得: pl=p1l1,由力学平衡条件得: p=p0+h.打开开关 K 放出水银的过程中, B 侧水银面处的压强始终为p0,而 A 侧水银面处的压强随空气柱的长度增加逐渐减小,B、A 两侧水银面的高度差也随之减小,直至 A 侧水银高出 B 侧水银面 h1为止.由力学平衡有p1=p0-h1,并代入数据得l1=12.0 cm.(2)当 A、B 两侧水银面达到同一高度时,设 A 侧空气柱的长度为 l 2,压强为2,由玻意耳定律得ppl=p2l 2,由力学平衡条件可知 p2=0p .代入数据得 l2=10.4 cm.设注入的水银柱在管内的长度为h,依题意得h= 2(l 1-2 +l ) h1=13.2 cm.答案: (1)12.0 cm (2)13.2 cm5.(2015 海·南卷 )如图所示,一底面积为S、内壁光滑的圆柱形容器竖直放置在水平地面上,开口向上,内有两个质量均为m 的相同活塞 A 和 B ;在 A 与 B 之间、B 与容器底面之间分别封有一定量的同样的理想气体,平衡时体积均为V.已知容器内气体温度始终不变,重力加速度大小为 g,外界大气压强为 p0 现假设活塞B 发生缓慢漏.气,致使 B 最终与容器底面接触.求活塞 A 移动的距离.解析: A 与 B 之间、 B 与容器底面之间的气体压强分别为p1、mg mgp2,在漏气前,对 A 分析有 p1=p0+S,对 B 有 p2=p1+S .人教版高中物理选修3-3第八章气体章末复习课 21 / 21 》》》》》》》》》积一时之跬步 臻千里之遥程《 《《《《《《《《《《《B 最终与容器底面接触后, AB 间的压强为 p ,气体体积为V ′,mg则有 p = p 0+ S ,因为温度始终不变,对于混合气体有 (p 1+p 2) ·2V = pV ′,2V漏气前 A 距离底面的高度为 h = S ,V ′漏气后 A 距离底面的高度为 h ′= S .2p 0S +3mg 2V 联立可得 h = -. (p 0S +mg )SS 答案: 2p 0S +3mg -2V(p 0S +mg )SS马鸣风萧萧。
高中物理 第八章 气体本章概览素材 新人教版选修33

1 第八章 气体
本章概览
三维目标
理解和掌握玻意耳定律:一定质量的某种气体,在温度不变时,压强p 和体积V 成反比.即pV=C(常数)或p 1V 1=p 2V 2.
理解和掌握查理定律:一定质量的某种气体在体积不变的情况下,压强p 跟热力学温度T 成正比.即T
P =C(常数)或2211T p T p =. 理解和掌握盖·吕萨克定律:一定质量的某种气体,压强不变时,体积V 和热力学温度T 成正比.即T
V =C(常数),2211T V T V =.会用控制变量法分析问题. 知道什么是理想气体,理想气体是物理中的一个理想化模型,实际气体通常情况下可以看作理想气体.了解物理学的一种研究方法——模型法.
知道理想气体状态的方程:用p 表示压强,V 表示体积,T 表示热力学温度.即T PV =C(常数)或2
22111T V p T V p =. 理解气体热现象的微观意义.培养科学的思维观念,渗透事物间相互联系的辩证唯物观. 知识网络
⎪⎪⎪⎪⎪⎪⎪⎪⎩
⎪⎪⎪⎪⎪⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧⎪⎩⎪⎨⎧==•==对实验定律的微观解释气体压强的微观意义
气体分子运动的特点气体热现象的微观意义恒量或理想气体状态方程理想气体理想气体状态方程吕萨克定律盖气体的等压变化查理定律气体的等容变化玻意耳定律气体的等温变化气体T pV T V p T V p T V T V T p T p V p V p 222111221122112221:)()()(。
【精品导学】物理选修3-3人教版讲义:第八章 气体 章末总结(Word版)

章末总结一、气体实验定律和理想气体状态方程的应用1.玻意耳定律、查理定律、盖—吕萨克定律可分别看成是理想气体状态方程在T恒定、V 恒定、p恒定时的特例.2.正确确定状态参量是运用气体实验定律的关键.求解压强的方法:(1)在连通器内灵活选取等压面,由两侧压强相等列方程求气体压强.(2)也可以把封闭气体的物体(如液柱、活塞、汽缸等)作为力学研究对象,分析受力情况,根据研究对象所处的不同状态,运用平衡条件或牛顿第二定律列式求解.3.注意气体实验定律或理想气体状态方程只适用于一定质量的气体,对打气、抽气、灌气、漏气等变质量问题,巧妙地选取研究对象,使变质量的气体问题转化为定质量的气体问题.例1如图1所示,足够长的圆柱形汽缸竖直放置,其横截面积为1×10-3m2,汽缸内有质量m=2kg的活塞,活塞与汽缸壁密封良好,不计摩擦.开始时活塞被销子K销于图中位置,离缸底12cm ,此时汽缸内密闭气体的压强为1.5×105Pa ,温度为300K .外界大气压为1.0×105Pa ,g =10m/s 2.图1(1)现对密闭气体加热,当温度升到400K 时,其压强为多大;(2)达到问题(1)的条件时拔去销子K ,活塞开始向上运动,当它最后静止在某一位置时,汽缸内气体的温度为360K ,则这时活塞离缸底的距离为多少? 答案 (1)2.0×105Pa (2)18cm解析 (1)气体体积不变,由查理定律得 p 1T 1=p 2T 2,即1.5×105Pa 300K =p 2400K 解得:p 2=2.0×105Pa.(2)p 3=p 0+mgS=1.2×105Pa ,T 3=360K设气体温度为360K 时活塞离缸底的距离为l 3,由理想气体状态方程得p 1V 1T 1=p 3V 3T 3,V 1=l 1S ,V 3=l 3S解得:l 3=18cm.例2 如图2所示,一定质量的理想气体被封闭在体积为V 0的容器中,室温为T 0=300K ,有一光滑导热活塞C (不占体积)将容器分成A 、B 两室,B 室的体积是A 室的两倍,A 室容器上连接有一U 形管(U 形管内气体的体积忽略不计),两边水银柱高度差为76cm ,B 室容器中连接有一阀门K ,可与大气相通(外界大气压等于76cmHg).求:图2(1)将阀门K 打开后,A 室的体积变成多少?(2)打开阀门K 后将容器内的气体从300K 分别加热到400K 和540K 时,U 形管内两边水银面的高度差各为多少?答案 (1)23V 0 (2)0 15.2cm解析 (1)初始时,p A 0=p 0+p h =152cmHg ,V A 0=V 03打开阀门后,A 室气体做等温变化,p A =76cmHg ,体积为V A ,由玻意耳定律得 p A 0V A 0=p A V A V A =p A 0V A 0p A =23V 0. (2)假设打开阀门后,气体温度从T 0=300K 升高到T 时,活塞C 恰好到达容器最右端,气体体积变为V 0,压强仍为p 0,即等压变化过程. 根据盖—吕萨克定律V 1T 1=V 2T 2得T =V 0V AT 0=450K因为T 1=400K<450K ,所以p A 1=p 0,水银柱的高度差为零.从T =450K 升高到T 2=540K 为等容变化过程.根据查理定律得p 0T =p A 2T 2,解得p A 2=91.2cmHg.T 2=540K 时,p 0+p h ′=91.2cmHg ,得 p h ′=15.2cmHg故水银面高度差h ′=15.2cm. 二、气体图象问题的综合应用要会识别图象反映的气体状态的变化特点,并且熟练进行图象的转化,理解图象的斜率、截距的物理意义.当图象反映的气体状态变化过程不是单一过程,而是连续发生几种变化时,注意分段分析,要特别关注两阶段衔接点的状态.例3 一定质量的理想气体,在状态变化过程中的p -T 图象如图3所示.在A 状态时的体积为V 0,试画出对应的V -T 图象和p -V 图象.图3答案 见解析图解析 对气体A →B 的过程,根据玻意耳定律,有p 0V 0=3p 0V B ,则V B =13V 0,C →A 是等容变化.由此可知A 、B 、C 三个状态的状态参量分别为:A :p 0、T 0、V 0;B :3p 0、T 0、13V 0;C :3p 0、3T 0、V 0.V -T 图象和p -V 图象分别如图甲、乙所示.例4 (多选)一定质量的理想气体的状态变化过程的p -V 图象如图4所示,其中A 是初状态,B 、C 是中间状态,A →B 是等温变化,如将上述变化过程改用p -T 图象和V -T 图象表示,则下列各图象中正确的是( )图4答案 BD解析 在p -V 图象中,由A →B ,气体经历的是等温变化过程,气体的体积增大,压强减小;由B →C ,气体经历的是等容变化过程,根据查理定律p B T B =p CT C ,p C >p B ,则T C >T B ,气体的压强增大,温度升高;由C →A ,气体经历的是等压变化过程,根据盖—吕萨克定律V CT C =V AT A,V C >V A ,则T C >T A ,气体的体积减小,温度降低.A 项中,B →C 连线不过原点,不是等容变化过程,A错误;C项中,B→C体积减小,C错误;B、D两项符合全过程.综上所述,正确答案选B、D.。
高中物理选修3-3第八章 3 理想气体的状态方程

3 理想气体的状态方程[学习目标] 1.了解理想气体的模型,并知道实际气体看成理想气体的条件.2.掌握理想气体状态方程,知道理想气体状态方程的推导过程.3.能利用理想气体状态方程分析、解决实际问题.一、理想气体1.理想气体:在任何温度、任何压强下都遵从气体实验定律的气体. 2.理想气体与实际气体(1)实际气体在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,可以当成理想气体来处理.(2)理想气体是对实际气体的一种科学抽象,就像质点、点电荷模型一样,是一种理想模型,实际并不存在. 二、理想气体的状态方程1.内容:一定质量的某种理想气体,在从一个状态(p 1、V 1、T 1)变化到另一个状态(p 2、V 2、T 2)时,尽管p 、V 、T 都可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变. 2.表达式:p 1V 1T 1=p 2V 2T 2或pV T =C .3.成立条件:一定质量的理想气体.1.判断下列说法的正误.(1)理想气体在超低温和超高压时,气体的实验定律不适用了.( × )(2)能用气体实验定律来解决的问题不一定能用理想气体状态方程来求解.( × ) (3)对于不同的理想气体,其状态方程pVT=C (恒量)中的恒量C 相同.( × )(4)一定质量的理想气体温度和体积均增大到原来的2倍,压强增大到原来的4倍.( × ) 2.一定质量的某种理想气体的压强为p ,温度为27 ℃时,气体的密度为ρ,当气体的压强增为2p ,温度升为327 ℃时,气体的密度是________. 答案 ρ一、对理想气体的理解气体实验定律对任何气体都适用吗?为什么要引入理想气体的概念?答案由于气体实验定律只在压强不太大,温度不太低的条件下理论结果与实验结果一致,为了使气体在任何温度、任何压强下都遵从气体实验定律,引入了理想气体的概念.1.理想气体严格遵守气体实验定律及理想气体状态方程.2.理想气体分子本身的大小与分子间的距离相比可忽略不计,分子不占空间,可视为质点.3.理想气体分子除碰撞外,无相互作用的引力和斥力.4.理想气体分子无分子势能的变化,内能等于所有分子热运动的动能之和,只和温度有关.例1(多选)下列对理想气体的理解,正确的有()A.理想气体实际上并不存在,只是一种理想模型B.只要气体压强不是很高就可视为理想气体C.一定质量的某种理想气体的内能与温度、体积都有关D.在任何温度、任何压强下,理想气体都遵从气体实验定律答案AD解析理想气体是一种理想模型,温度不太低、压强不太大的实际气体可视为理想气体;理想气体在任何温度、任何压强下都遵从气体实验定律,选项A、D正确,选项B错误.一定质量的理想气体的内能只与温度有关,与体积无关,选项C错误.二、理想气体的状态方程如图1所示,一定质量的某种理想气体从状态A到B经历了一个等温过程,又从状态B到C 经历了一个等容过程,请推导状态A的三个参量p A、V A、T A和状态C的三个参量p C、V C、T C之间的关系.图1答案从A→B为等温变化过程,根据玻意耳定律可得p A V A=p B V B①从B →C为等容变化过程,根据查理定律可得p B T B =p CT C ②由题意可知:T A =T B ③ V B =V C ④联立①②③④式可得p A V A T A =p C V CT C.1.对理想气体状态方程的理解 (1)成立条件:一定质量的理想气体.(2)该方程表示的是气体三个状态参量的关系,与中间的变化过程无关. (3)公式中常量C 仅由气体的种类和质量决定,与状态参量(p 、V 、T )无关.(4)方程中各量的单位:温度T 必须是热力学温度,公式两边中压强p 和体积V 单位必须统一,但不一定是国际单位制中的单位. 2.理想气体状态方程与气体实验定律p 1V 1T 1=p 2V2T2⇒⎩⎪⎨⎪⎧T 1=T 2时,p 1V 1=p 2V 2(玻意耳定律)V 1=V 2时,p 1T 1=p 2T 2(查理定律)p 1=p 2时,V 1T 1=V 2T2(盖—吕萨克定律)例2 关于气体的状态变化,下列说法正确的是( )A .一定质量的理想气体,当压强不变而温度由100 ℃上升到200 ℃时,其体积增大为原来的2倍B .任何气体由状态1变化到状态2时,一定满足方程p 1V 1T 1=p 2V 2T 2C .一定质量的理想气体体积增大到原来的4倍,则气体可能压强减半,热力学温度加倍D .一定质量的理想气体压强增大到原来的4倍,则气体可能体积加倍,热力学温度减半 答案 C解析 一定质量的理想气体压强不变,体积与热力学温度成正比,温度由100 ℃上升到200 ℃时,体积增大为原来的1.27倍,故A 错误;理想气体状态方程成立的条件为气体可看做理想气体且质量不变,故B 错误;由理想气体状态方程pVT =C 可知,C 正确,D 错误.例3 如图2所示,粗细均匀一端封闭一端开口的U 形玻璃管竖直放置,管内水银将一定质量的理想气体封闭在U 形管内,当t 1=31 ℃,大气压强p 0=76 cmHg 时,两管水银面相平,这时左管被封闭的气柱长L 1=8 cm ,则当温度t 2是多少时,左管气柱长L 2为9 cm?图2答案78 ℃解析设玻璃管的横截面积为S,初状态:p1=p0=76 cmHg,V1=L1·S=8 cm·S,T1=304 K;末状态:p2=p0+2 cmHg=78 cmHg,V2=L2·S=9 cm·S,根据理想气体状态方程p1V1T1=p2V2T2代入数据解得:T2=351 K,则t2=(351-273) ℃=78 ℃.应用理想气体状态方程解题的一般步骤1.明确研究对象,即一定质量的理想气体;2.确定气体在初、末状态的参量p1、V1、T1及p2、V2、T2;3.由理想气体状态方程列式求解;4.必要时讨论结果的合理性.例4(2019·唐山市期末)如图3所示,绝热性能良好且足够长的汽缸固定放置,其内壁光滑,开口向右,汽缸中封闭一定质量的理想气体,活塞(绝热)通过水平轻绳跨过轻质滑轮与重物相连,已知活塞的面积S=10 cm2,重物的质量m=2 kg,重力加速度g=10 m/s2,大气压强p0=1.0×105 Pa,滑轮摩擦不计.稳定时,活塞与汽缸底部间的距离为L1=12 cm,汽缸内温度T1=300 K.图3(1)通过电热丝对汽缸内气体加热,气体温度缓慢上升到T2=400 K时停止加热,求加热过程中活塞移动的距离d;(2)停止加热后,在重物的下方加挂一个2 kg的重物,活塞又向右移动4 cm后重新达到平衡,求此时汽缸内气体的温度T3.答案(1)4 cm(2)375 K解析 (1)加热前p 1S +F T =p 0S ,F T =mg 加热后p 2S +F T =p 0S ,F T =mg , 所以p 1=p 2=0.8×105 Pa , 加热过程为等压变化,故有L 1S T 1=(L 1+d )ST 2代入数据解得d =4 cm.(2)加挂重物后p 3S +F T ′=p 0S ,F T ′=(m +m ′)g 由理想气体状态方程p 1L 1S T 1=p 3(L 1+d +d ′)ST 3代入数据解得T 3=375 K.1.(理想气体的理解)(多选)关于理想气体的认识,下列说法正确的是( ) A .它是一种能够在任何条件下都能严格遵守气体实验定律的气体 B .它是一种从实际气体中忽略次要因素,简化抽象出来的理想模型 C .在温度不太高、压强不太低的情况下,气体可视为理想气体 D .被压缩的气体,不能视为理想气体 答案 AB2.(状态参量的关系)一定质量的理想气体,发生状态变化,下列变化不可能的是( ) A .p ↑,V ↑,T ↓ B .p ↑,V ↓,T ↑ C .p ↑,V ↑,T ↑ D .p ↓,V ↓,T ↓答案 A解析 根据理想气体状态方程pVT =C 进行判断.由理想气体状态方程分析可知p ↑,V ↑,则T ↑,故A 不可能发生,C 可能发生;由理想气体状态方程分析可知p ↑,V ↓,则T 可能升高,也可能降低或不变,故B 可能发生;由理想气体状态方程分析可知p ↓,V ↓,则T ↓,故D 可能发生.故选A.3.(理想气体状态方程的应用)(2019·清远市高三上期末)如图4所示,一汽缸竖直固定在水平地面上,活塞质量m =4 kg ,活塞横截面积S =2×10-3 m 2,活塞上面的汽缸内封闭了一定质量的理想气体,下面有气孔O 与外界相通,大气压强p 0=1.0×105 Pa.活塞下面与劲度系数k =2×103 N/m 的竖直轻弹簧相连,当汽缸内气体温度为T 1=400 K 时弹簧为自然长度,此时缸内气柱长度L 1=20 cm ,g 取10 m/s 2,活塞不漏气且与缸壁无摩擦.图4(1)当弹簧为自然长度时,缸内气体压强p 1是多少?(2)当缸内气柱长度L 2=24 cm 时,缸内气体温度T 2为多少K? 答案 (1)8×104 Pa (2)720 K解析 (1)当弹簧为自然长度时,设封闭气体的压强为p 1,对活塞受力分析得: p 1S +mg =p 0S代入数据得:p 1=8×104 Pa(2)当缸内气柱长度L 2=24 cm 时,设封闭气体的压强为p 2,对活塞受力分析得: p 2S +mg =p 0S +F 其中:F =k (L 2-L 1)联立可得:p 2=p 0+k (L 2-L 1)-mgS代入数据得:p 2=1.2×105 Pa 对缸内气体,根据题意得:V 1=20S V 2=24S T 1=400 K根据理想气体状态方程,得:p 1V 1T 1=p 2V 2T 2解得T 2=720 K.4.(理想气体状态方程的应用)如图5所示,U 形管左端封闭,右端开口,左管横截面积为右管横截面积的2倍,在左管内用水银封闭一段长为26 cm 、温度为280 K 的空气柱,左右两管水银面高度差为36 cm ,外界大气压为76 cmHg.若给左管的封闭气体加热,使管内空气柱长度变为30 cm ,(忽略温度对水银体积的影响)则此时左管内气体的温度为多少?图5答案420 K解析以封闭气体为研究对象,设左管横截面积为S,当左管封闭的空气柱长度变为30 cm 时,左管水银柱下降4 cm;右管水银柱上升8 cm,即两端水银柱高度差为:h′=24 cm,由题意得:V1=L1S=26S,p1=p0-p h=76 cmHg-36 cmHg=40 cmHg,T1=280 K,p2=p0-p h′=52 cmHg,V2=L2S=30S.由理想气体状态方程:p1V1T1=p2V2T2,解得T2=420 K.考点一理想气体及理想气体状态方程的理解1.(多选)关于理想气体的性质,下列说法正确的是()A.理想气体是一种假想的物理模型,实际并不存在B.理想气体的存在是一种人为规定,它是一种严格遵守气体实验定律的气体C.一定质量的理想气体,平均动能增大,其温度一定升高D.氦是液化温度最低的气体,任何情况下均可当作理想气体答案ABC2.对于一定质量的理想气体,下列状态变化中可能实现的是()A.使气体体积增加而同时温度降低B.使气体温度升高,体积不变、压强减小C.使气体温度不变,而压强、体积同时增大D.使气体温度升高,压强减小,体积减小答案 A解析由理想气体状态方程pVT=C得A项中若使压强减小就有可能,故A项正确;体积不变,温度与压强应同时变大或同时变小,故B项错误;温度不变,压强与体积成反比,故不能同时增大,故C 项错误;温度升高,压强减小,体积不可能减小,故D 项错误. 3.对于一定质量的理想气体,下列论述正确的是( ) A .当分子热运动变剧烈时,压强必变大 B .当分子热运动变剧烈时,压强可以不变 C .当分子间的平均距离变大时,压强必变小 D .当分子间的平均距离变大时,压强必变大 答案 B解析 分子热运动变剧烈,说明温度T 升高,由pVT =恒量知,pV 要变大,但不知体积变化情况,故无法判定压强变化情况(p 可以不变、变大或变小),因此选项A 错误,B 正确;分子间的平均间距变大,说明体积变大,由pV T =恒量知,pT 要变小,但温度T 的变化情况不确定,故无法确定p 是变大、变小或不变,因此选项C 、D 错误. 考点二 理想气体状态方程的应用4.如图1所示为伽利略设计的一种测温装置示意图,玻璃管的上端与导热良好的玻璃泡连通,下端插入水中,玻璃泡中封闭有一定质量的空气.若玻璃管中水柱上升,则外界大气的变化可能是( )图1A .温度降低,压强增大B .温度升高,压强不变C .温度升高,压强减小D .温度不变,压强减小 答案 A解析 由题意可知,封闭空气温度与大气温度相同,封闭空气体积随水柱的上升而减小,将封闭空气近似看作理想气体,根据理想气体状态方程pVT=常量,若温度降低,体积减小,则压强可能增大、不变或减小,A 正确;若温度升高,体积减小,则压强一定增大,B 、C 错误;若温度不变,体积减小,则压强一定增大,D 错误.5.已知湖水深度为20 m ,湖底水温为4 ℃,水面温度为17 ℃,大气压强为1.0×105 Pa.当一气泡从湖底缓慢升到水面时,其体积约为原来的(取g =10 m/s 2,ρ水=1.0×103 kg/m 3)( ) A .12.8倍 B .8.5倍 C .3.1倍 D .2.1倍 答案 C解析 湖底压强为p 0+ρ水gh =3.0×105 Pa ,即3个大气压强,由理想气体状态方程可得3p 0V 1(4+273.15) K =p 0V 2(17+273.15) K,即V 2=290.15277.15×3V 1≈3.14V 1.所以当一气泡从湖底缓慢升到水面时,其体积约为原来的3.1倍,C 正确.6.(多选)甲、乙两个相同的密闭容器中分别装有等质量的同种气体,已知甲、乙容器中气体的压强分别为p 甲、p 乙,且p 甲<p 乙,则( ) A .甲容器中气体的温度高于乙容器中气体的温度 B .甲容器中气体的温度低于乙容器中气体的温度C .甲容器中气体分子的平均动能小于乙容器中气体分子的平均动能D .甲容器中气体分子的平均动能大于乙容器中气体分子的平均动能 答案 BC解析 甲、乙两容器中的气体由于质量相等,可以看成同一气体的两个不同状态.则p 甲V 甲T 甲=p 乙V 乙T 乙,由于V 甲=V 乙,p 甲<p 乙,所以T 甲<T 乙,B 、C 正确.7.一定质量的理想气体,经历了如图2所示的状态变化过程,则此三个状态的温度之比是( )图2A .1∶3∶5B .3∶6∶5C .3∶2∶1D .5∶6∶3答案 B解析 由理想气体状态方程得:pVT =C (C 为常数),可见pV =TC ,即pV 的乘积与温度T 成正比,故B 项正确.8.我国“蛟龙”号深海探测船载人下潜超过七千米.在某次深潜试验中,“蛟龙”号探测到990 m深处的海水温度为280 K.某同学利用该数据来研究气体状态随海水深度的变化,如图3所示,导热良好的汽缸内封闭一定质量的气体,不计活塞的质量和摩擦,汽缸所处海平面的温度T0=300 K,压强p0=1 atm,封闭气体的体积V0=3 m3.如果将该汽缸下潜至990 m深处,此过程中封闭气体可视为理想气体.求990 m深处封闭气体的体积(1 atm相当于10 m深的海水产生的压强).图3答案 2.8×10-2 m3解析当汽缸下潜至990 m深处时,设封闭气体的压强为p,温度为T,体积为V,由题意知p=100 atm.由理想气体状态方程得p0V0T0=pVT,代入数据得V=2.8×10-2 m3.9.(多选)一定质量的理想气体,处于某一状态,要使它的压强经过变化后仍然回到初始状态的压强,下列过程可以实现的是()A.先保持体积不变,减小压强,再保持温度不变,压缩体积B.先保持体积不变,增大压强,再保持温度不变,压缩体积C.先保持温度不变,使体积膨胀,再保持体积不变,降低温度D.先保持温度不变,压缩体积,再保持体积不变,降低温度答案AD解析先等容变化,p减小,则T减小,再等温变化,V减小,p增大,p可能回到原状态,A正确;先等容变化,p增大,则T升高,再等温变化,V减小,则p又增大,p不可能回到原状态,B错误;先等温变化,V增大,则p减小,再等容变化,T降低,p又减小,p不可能回到原状态,C错误;先等温变化,V减小,则p增大,再等容变化,T降低,则p降低,p可能回到原状态,D正确.10.如图4所示,一根竖直的弹簧支持着一倒立汽缸的活塞,使汽缸悬空而静止.设活塞与缸壁间无摩擦,可以在缸内自由移动,缸壁导热性良好,使缸内气体的温度保持与外界大气温度相同,则下列结论正确的是()图4A .若外界大气压增大,则弹簧将压缩一些B .若外界大气压增大,则汽缸的上底面距地面的高度将增大C .若气温升高,则活塞距地面的高度将减小D .若气温升高,则汽缸的上底面距地面的高度将增大答案 D解析 以活塞和汽缸整体为研究对象可知,重力等于弹簧弹力,跟外界大气压无关,即弹簧压缩量不变,A 错误;因为弹力不变,故活塞距地面的高度不变,C 错误;以汽缸为研究对象,若外界大气压增大,则汽缸内气体体积减小,所以汽缸的上底面距地面的高度将减小,B 错误;若气温升高,汽缸内气体压强不变,故气体的体积增大,所以上底面距地面的高度将增大,D 正确.11.如图5所示,圆柱形汽缸A 中用质量为2m 的活塞封闭了一定质量的理想气体,气体温度为27 ℃,汽缸中的活塞通过滑轮系统悬挂一质量为m 的重物,稳定时活塞与汽缸底部的距离为h ,现在重物m 上加挂一个质量为m 3的小物体,已知大气压强为p 0,活塞横截面积为S ,m =p 0S g,不计一切摩擦,求当气体温度升高到37 ℃且系统重新稳定后,重物m 下降的高度.图5答案 0.24h解析 以汽缸内气体为研究对象,初状态:p 1S +mg =p 0S +2mgV 1=hS ,T 1=300 K末状态:p 2S +43mg =p 0S +2mg V 2=(h +Δh )S ,T 2=310 K由题意知m =p 0S g ,解得p 1=2p 0,p 2=53p 0 根据理想气体状态方程:p 1V 1T 1=p 2V 2T 2解得:Δh =0.24h .12.如图6所示,粗细均匀的U 形管左端封闭,右端开口,左端用水银封闭着长L =15 cm 的理想气体,当温度为27 ℃时,两管水银面的高度差Δh =3 cm ,设外界大气压恒为75 cmHg ,则:图6(1)若对封闭气体缓慢加热,为了使左右两管中的水银面相平,温度需升高到多少?(忽略温度对水银体积的影响)(2)若保持27 ℃不变,为了使左右两管中的水银面相平,需从右管的开口端再缓慢注入的水银柱的长度应为多少?答案 (1)70.75 ℃ (2)4.2 cm解析 (1)设U 形管横截面积为S ,以封闭气体为研究对象初态:p 1=p 0-ρg Δh =72 cmHgV 1=LS ,T 1=300 K末态:p 2=p 0=75 cmHg ,V 2=(L +Δh 2)S 根据理想气体状态方程p 1V 1T 1=p 2V 2T 2, 代入数据得:T 2=343.75 K ,故t 2=70.75 ℃(2)p 3=75 cmHg ,V 3=L ′S根据玻意耳定律有;p 1V 1=p 3V 3,代入数据得:L ′=14.4 cm则需从右管的开口端再缓慢注入的水银柱的长度l =Δh +2(L -L ′)=4.2 cm.13.(2018·全国卷Ⅰ)如图7,容积为V 的汽缸由导热材料制成,面积为S 的活塞将汽缸分成容积相等的上下两部分,汽缸上部通过细管与装有某种液体的容积相连,细管上有一阀门K.开始时,K 关闭,汽缸内上下两部分气体的压强均为p 0.现将K 打开,容器内的液体缓慢地流入汽缸,当流入的液体体积为V 8时,将K 关闭,活塞平衡时其下方气体的体积减小了V 6.不计活塞的质量和体积,外界温度保持不变,重力加速度大小为g .求流入汽缸内液体的质量.图7答案 15p 0S 26g解析 设活塞再次平衡后,活塞上方气体的体积为V 1,压强为p 1;下方气体的体积为V 2,压强为p 2.在活塞下移的过程中,活塞上、下方气体的温度均保持不变,由玻意耳定律得 p 0V 2=p 1V 1(2分) p 0V 2=p 2V 2(1分) 由已知条件得V 1=V 2+V 6-V 8=1324V (2分) V 1=V 2-V 6=V 3(1分) 设活塞上方液体的质量为m ,由力的平衡条件得p 2S =p 1S +mg (2分)联立以上各式得m =15p 0S 26g.(2分)14.竖直平面内有一直角形内径处处相同的细玻璃管,A 端封闭,C 端开口,最初AB 段处于水平状态,中间有一段水银将气体封闭在A 端,各部分尺寸如图8所示.初始时,封闭气体温度为T 1=300 K ,外界大气压强p 0=75 cmHg.求:图8(1)若对封闭气体缓慢加热,当水平管内水银全部进入竖直管内时,气体的温度是多少;(2)若保持(1)问的温度不变,从C端缓慢注入水银,使水银与C端管口平齐,需要注入水银的长度为多少.答案(1)450 K(2)14 cm解析(1)设细管的横截面积为S,以AB段内封闭的气体为研究对象.初态p1=p0+5 cmHg=80 cmHg,V1=30S,T1=300 K当水平管内水银全部进入竖直管内时,此时:p2=p0+15 cmHg=90 cmHg,体积V2=40S,设此时温度为T2,由理想气体状态方程得:p1V1T1=p2V2T2解得T2=450 K.(2)保持温度不变,初态p2=90 cmHg,体积V2=40S,末态p3=p0+25 cmHg=100 cmHg 由玻意耳定律得:p2V2=p3V3解得V3=36S故需要加入的水银长度Δl=(30+20-36) cm=14 cm.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中物理选修3-3知识点总结:第八章气体(人教版)本章内容主要是学习玻意尔定理、查理定律、盖-吕萨克定律以及理想气体状态方程。
其中包括多方面的计算,还有一重点是要认识几个图像,懂得其物理意义。
考试的要求:
Ⅰ、对所学知识要知道其含义,并能在有关的问题中识别并直接运用,相当于课程标准中的“了解”和“认识”。
Ⅱ、能够理解所学知识的确切含义以及和其他知识的联系,能够解释,在实际问题的分析、综合、推理、和判断等过程中加以运用,相当于课程标准的“理解”,“应用”。
要求Ⅰ:气体的实验定律、理想气体的定义及其物态方程。
气体温度的微观意义。
要求Ⅱ:没有要求。
知识网络:
内容详解:
一、玻意耳定律:(C为常量)→等温变化
微观解释:一定质量的理想气体,温度保持不变时,分子的平均动能是一定的,在这种情况下,体积减少时,分子的密集程度增大,气体的压强就增大。
适用条件:压强不太大,温度不太低。
图象表达:
二、查理定律:(C为常量)→等容变化
微观解释:一定质量的气体,体积保持不变时,分子的密集程度保持不变,在这种情况下,温度升高时,分子的平均动能增大,气体的压强就增大。
适用条件:温度不太低,压强不太大。
图象表达:
三、盖吕萨克定律:(C为常量)→等压变化
微观解释:一定质量的气体,温度升高时,分子的平均动能增大,只有气体的体积同时增大,使分子的密集程度减少,才能保持压强不变。
适用条件:压强不太大,温度不太低。
图象表达:
四、理想气体
宏观上:严格遵守三个实验定律的气体,在常温常压下实验气体可以看成理想气体。
微观上:分子间的作用力可以忽略不计,故一定质量的理想气体的内能只与温度有关,与体积无关。
理想气体的方程:
五、气体压强的微观解释
解释:大量分子频繁的撞击器壁的结果。
影响气体压强的因素:①气体的平均分子动能(温度)②分子的密集程度即单位体积内的分子数。
本章总结学习方法:
这一章的内容是气体状态变化的规律,是中学物理热学的重点。
通过本章的学习可以加深对分子动理论的进一步理解升华,也对后面学习物态变化有一定的帮助,同时,有助于应用知识解决实际问题的能力"建立物理模型的能力"利用图象解决实际问题的能力的提高,通过运用三个实验定律:玻意耳定律,查理定律—盖,吕萨克定律和理想气体状态方程来解决气体状态变化的问题,要养成力学问题力要清,热学问题态要清,力学问题选取研究对象后进行受力分析,热学问题选取研究对象后进行状态分析好习惯,用牛顿运动定律解力学问题要注意过程的特点和变化,用动能定理,理解力学问题常常可不追究过程的细节,用气体的三个实验定律解答气体状态变化问题要注意气体质量不变和某一状态参量保持不变的特点。
而气体微观模型的建立使人们对宏观实验规律获得了本质的认识,类比于雨滴对伞面的压力,启发人们对气体压强产生的理解,图象法、假设法和理想化方法是解决热学问题的常用方法。
学习中要注意以下几点:一、本章定量计算比较多,涉及的习题种类多,能力要求高,因此,在学习过程中要循序渐进,对可能出现的一些难以想通的物理过程或物理观点"方法有充分的思想准备,不要急于求成。
二、利用图象解决问题是本章常用的方法,注意加强练习应用图象解决问题。
三、正确理解气体的三个状态参量的宏观及微观意义,对学好本章有很大的帮助。
