肠道菌群失调及其相关疾病研究进展_杨泽冉
肠道菌群与机体代谢及相关疾病_感染微生态学的研究进展
新发和再发传染病防治热点研讨会2011Workshop for Control of EID2011肠道菌群与机体代谢及相关疾病—感染微生态学的研究进展 曹虹,郝小燕,彭亮,方幸幸 南方医科大学公共卫生与热带医学学院微生物学系 人体肠道菌群是由不同的细胞系组成,可被认为是机体中的一个细菌器官,并且肠道菌群中细 胞之间及细胞与宿主之间可以相互交换信息,消耗、储备和再分配能量,调节重要的化学转化,并 通过繁殖进行自身维护和修复。
通过对无菌动物的研究,越来越多的发现表明,肠道菌群对宿主的生 理、病理过程有着重要的影响,具有十分重要的生理功能。
新近研究表明,人体的健康不仅与自身 的基因组有关, 还与人出生后肠道内定居的永久居民-微生物有关。
肠道微生物可能影响人类的健康, 如胖瘦、糖尿病、胃病、甚至癌症。
一.肠道菌群的组成 复杂的微生态系统。
细菌培养手段的局限性,对其结构和组成知之甚少。
14 根据细菌 16S rRNA 序列的分类, 发现肠道内寄住的微生物群的种类超过 800 种, 数量超过 10 , 约 10 倍于人体细胞。
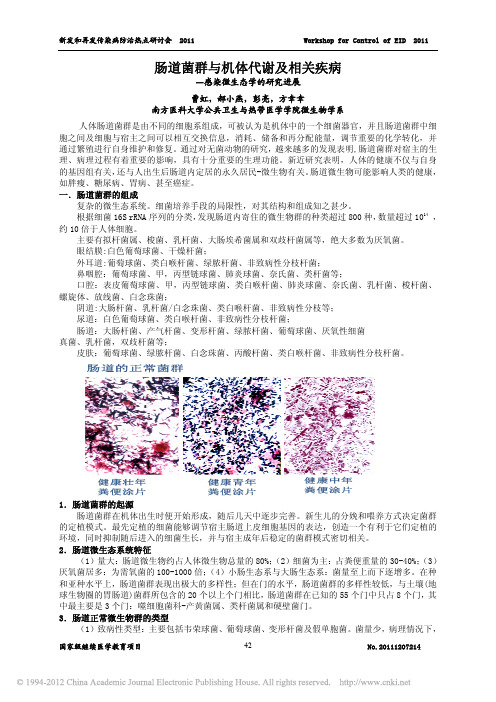
主要有拟杆菌属、梭菌、乳杆菌、大肠埃希菌属和双歧杆菌属等,绝大多数为厌氧菌。
眼结膜:白色葡萄球菌、干燥杆菌; 外耳道:葡萄球菌、类白喉杆菌、绿脓杆菌、非致病性分枝杆菌; 鼻咽腔:葡萄球菌、甲,丙型链球菌、肺炎球菌、奈氏菌、类杆菌等; 口腔:表皮葡萄球菌、甲,丙型链球菌、类白喉杆菌、肺炎球菌、奈氏菌、乳杆菌、梭杆菌、 螺旋体、放线菌、白念珠菌; 阴道:大肠杆菌、乳杆菌/白念珠菌、类白喉杆菌、非致病性分枝等; 尿道:白色葡萄球菌、类白喉杆菌、非致病性分枝杆菌; 肠道:大肠杆菌、产气杆菌、变形杆菌、绿脓杆菌、葡萄球菌、厌氧性细菌 真菌、乳杆菌,双歧杆菌等; 皮肤:葡萄球菌、绿脓杆菌、白念珠菌、丙酸杆菌、类白喉杆菌、非致病性分枝杆菌。
1.肠道菌群的起源 肠道菌群在机体出生时便开始形成,随后几天中逐步完善。
肠道菌群与阿尔茨海默病的相关性研究进展

Science & Technology Vision42科技视界作者简介:于震维,北京市神经外科研究所 助理研究员,从事帕金森病及相关疾病的诊断、生物标志物和分子机制探索,首次证实外周血中存在中枢少突胶质细胞来源外泌体,并对帕金森病和多系统萎缩这两种临床症状相似、误诊率高的神经退行性疾病进行鉴别诊断。
创新性地提出少突胶质细胞外泌体转运障碍导致的α-syn 异常堆积是胶质细胞胞质包涵体(Glial cytoplasmic inclusions, GCIs)产生的分子机制之一。
主持1项国家自然科学基金青年项目和1项北京市自然科学基金面上项目,承担了1项国家自然科学基金国际合作重点项目的子课题,参与包括科技部重点研发计划、国自然科学基金面上项目在内的多项科研项目。
以第一作者或者通信作者发表SCI 论文12篇,总影响因子82.6,其中包括Brain 、Annals of Neurology 等国际顶级神经科学期刊。
获受理PD 诊断及鉴别诊断相关的国家发明专利3项,国际专利2项。
阿尔茨海默病(AD )是最常见的痴呆形式,也是最常见的神经退行性疾病。
肠肠道菌群的变化能够引起多种症状和疾病,除了常见的各种肠道疾病外,甚至还能对中枢神经系统产生影响。
近年来,科学家提出了脑- "于震维(北京市神经外科研究所 首都医科大学附属北京天坛医院 病理生理室,北京 100070)肠道-肠道微生物轴(脑肠轴)的概念,目前这一概念的研究仍处在比较初级的阶段,但至少包括神经、免疫、内分泌和代谢等多条途径。
本文旨在总结和讨论当前发现,以阐明肠道微生物群在AD 发展中的作用。
阿尔茨海默病(AD )是最常见的神经退行性疾病,也是老年人痴呆的最常见原因。
我国65岁以上老年人群中,阿尔茨海默病的患病率达5.9%,目前患者约1 250万人,占世界患病人群的25%。
随着我国人口老龄化的加重,这一疾病的患病人数将在可见的未来急剧增加,严重危害着我国人民的身心健康,为家庭和社会带来巨大的负担。
肠道微生物与肥胖关系的研究进展

通信作者: 胡继宏 (1976— )ꎬ 女ꎬ 博士ꎬ 教授ꎬ 研究方向: 心血管病流行病学ꎮ
Copyright©博看网. All Rights Reserved.
74
中 国 食 物 与 营 养
2 1 3 奶制品及其蛋白质成分 奶及奶制品的蛋白成
胶囊ꎬ 还 可 促 进 肠 道 微 生 物 群 对 短 链 脂 肪 酸 的 生 物
合成[26] ꎮ
胖[34] ꎮ 肠道屏障功能障碍会导致细菌或有毒细菌的代
来改善肥胖和代谢综合征[36] ꎮ 褐藻黄质 ( Fx) 可通过
抑制与炎症相关的毛螺菌科和 Erysipelotrichaceae 的生长ꎬ
缓解肥胖和相关炎症的发展[18] ꎮ 肠道变形菌属可产生
2 1 5 水果 (葡萄、 石榴和蓝莓) 相关成分 Han 等[22]
肠道菌群稳态ꎬ 引起与肠道菌群失调有关的疾病ꎬ 包
发现ꎬ 葡萄提取物通过优化厚壁菌门与拟杆菌门的比率
括肥胖 [33] ꎮ
和增加双歧杆菌、 Akkermansia 和梭状芽胞杆菌属的丰度
3 肠道微生物与肥胖间的相关作用机理
进入血液中[13] ꎮ 慢性炎症细菌和 LPS 的积累会导致代
谢性菌血症 (MB) 和内毒素血症 ( ME)ꎬ 是肥胖和其
他代谢综合征表现特征的促炎过程[35] ꎮ 钙三醇联合联
iBRD9 治疗通过调节肥胖小鼠的肠道微生物群ꎬ 改善肠
黏膜屏障功能ꎬ 减少 LPS 吸收入血ꎬ 从而减轻肥胖[38] ꎮ
常化ꎻ 还可以减轻 HFD 诱导的肥胖ꎬ 提高循环促炎细
谢产物从肠道进入血液ꎬ 从而导致全身炎症ꎬ 这就是许
基于肠道菌群紊乱探讨中医药干预功能性消化不良的研究进展

基于肠道菌群紊乱探讨中医药干预功能性消化不良的研究进展罗月;李开楊;赵琦
【期刊名称】《基层中医药》
【年(卷),期】2024(3)1
【摘要】功能性消化不良(FD)是临床中常见的功能性胃肠病之一,但病理机制尚未
完全阐明,胃肠动力障碍、胃肠黏膜完整性受损、脑肠轴功能异常等多因素均报道
与其发病相关。
近年来研究表明肠道菌群紊乱在FD发病中起重要作用,是目前的
研究热点。
中医药作用具有多层次、多途径、多靶点的特点,中药活性成分或单体、经典复方以及经验效方通过调节肠道菌群紊乱治疗FD有一定的效果。
本文综述了近年来中药通过调节肠道菌群治疗FD的疗效及可能的作用机制,为未来进一步研
究治疗FD提供参考。
【总页数】6页(P99-104)
【作者】罗月;李开楊;赵琦
【作者单位】贵州中医药大学;贵州中医药大学第二附属医院
【正文语种】中文
【中图分类】R28
【相关文献】
1.肠道菌群紊乱与功能性消化不良关系的研究进展
2.基于肠道菌群探讨中医药干预多囊卵巢综合征
3.基于肠道菌群理论应用中医药干预高血压研究进展
4.基于肠道
菌群探讨中医药治疗功能性消化不良研究进展5.帕金森病病人肠道菌群紊乱的非药物干预研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
肠道菌群失调及其相关疾病的研究

肠道菌群失调及其相关疾病的研究作者:巫婷玉周芳月许春来源:《科教导刊·电子版》2018年第31期摘要正常肠道菌群参与营养物质代谢、免疫调节以及神经系统发育等多种重要的生理过程,肠道菌群失调导致机体多种生理活动紊乱,可能诱发和促进一些相关疾病的发生发展。
关键词肠道菌群失调帕金森病结肠癌中图分类号:R378 文献标识码:A人的肠道内寄居着种类繁多的微生物,这些微生物称为肠道菌群。
抗生素的使用可诱导肠道菌群失调,脑-肠轴参与了肠道菌群失调,其不仅可引起严重腹泻或慢性腹泻,还可能会引起一些相关性疾病。
本文根据近几年有关的最新研究,对肠道菌群失调可能引起的疾病进行阐述。
1介导酒精性肝病发生发展当机体长期摄入酒精后,酒精及其代谢物通过引起肠道菌群数量改变、肠道通透性增加,促使肠道微生物及其产物位移入体循环,诱导肝脏促炎症细胞因子聚集,引发炎症加速肝损伤。
目前通过调节肠道菌群改善酒精性肝病的治疗方法已经得到越来越多学者的认可。
通过服用抗生素、膳食纤维、益生菌改善酒精引起的肠道菌群紊乱已经初见成效。
2肠道菌群失调与帕金森病帕金森病的病理特点主要是 -突触核蛋白异常聚集形成路易小体。
肠道菌群失调可能通过引起或加剧炎症和氧化应激反应,促进体内多种促炎因子的释放,使 -突触核蛋白发生错误折叠,引起多巴胺神经元破坏或死亡,纹状体内多巴胺含量减少。
3诱导肥胖发生发展肥胖人群肠道微生态的破坏可诱导肥胖,肥胖人群与正常人群的肠道菌群结构组成不同。
正常人群生理情况下,肠道微生物的数目、种类及生物多样性相对稳定,而肥胖人群会发生不同程度的改变。
Turnbaugh 等对不同胖瘦程度的双胞胎的肠道菌群进行测序,发现双胞胎中肥胖者肠道菌群多样性明显降低。
4与结肠癌发生发展近年来,很多研究发现肠道菌群失调与结肠癌的发生、发展关系密切。
结肠癌人群与健康人群肠道微生物构成存在差异。
此外,研究还发现肠道菌群失调会释放大量的细菌毒素,诱发结肠炎等炎性肠病,肠道屏障功能的损伤会引起非致病性细菌的转位,进而影响免疫系统稳态,使其向致癌相关的免疫反应转变,进而诱导结肠癌的发生。
肠道菌群失调与结直肠癌关系的研究进展

现代消化及介入诊疗 2021年第26卷第4期ModernDigestion&Intervention2021牞Vol.26牞No.4·综述·肠道菌群失调与结直肠癌关系的研究进展孙中,艾江 【提要】 结直肠癌(CRC)是发生在人体下消化道结肠或直肠的恶性肿瘤。
在世界范围内,其发病率和死亡率均位居癌症的前三位,对人类健康构成巨大威胁。
CRC病因研究指出饮食、遗传、炎症等因素与其发病密切相关,近年来众多研究表明肠道菌群失衡在CRC的发生中可能发挥着重要作用,其可能通过肠道细菌对肠道上皮细胞DNA直接造成损伤、诱发肠管慢性炎症反应、干扰免疫反应信号通路诱导炎症因子释放或产生有毒代谢产物,影响CRC患者化疗药物疗效等作用促进肿瘤的发生。
肠道菌群失调促进CRC发生具体的作用机制尚未完全阐明。
本文通过查阅近几年相关文献并总结,就肠道菌群失调在结直肠癌发生和发展中的相关作用及机制进行综述。
【关键词】 结直肠癌;肠道菌群失调;炎症因子;细菌毒性代谢产物;细菌相关酶;肿瘤化疗中图分类号:R735.3;R574 文献标志码:A DOI:10.3969/j.issn.1672-2159.2021.04.029作者单位:157011牡丹江医学院附属红旗医院消化内科通信作者:艾江,E mail:aijiang1973@126.com 肠道中有数以亿计的微生物,其中99%是细菌,肠道菌群参与宿主的能量代谢过程和调节免疫功能,并在其中发挥重要作用。
肠道菌群微生态失衡对肥胖、糖尿病、非酒精性脂肪肝、炎症性肠病、相关肿瘤的发展具有促进作用[1-4]。
相关研究指出,肠道菌群失调可能在结直肠癌(colorectalcancer,CRC)的发展中起重要作用[5]。
本文通过查阅近几年相关文献并总结,就肠道菌群失调在CRC发生和发展中的相关作用及其机制进行综述。
1 肠道菌群概述1.1 肠道菌群的分布特点及生理作用人体内的众多微生物大部分存在于消化道中,尤其是下消化道。
肠道微生态失衡与癫痫发生的相关性研究

例符合中国癫痫诊疗指南标准;③患者 意识清楚,能够配合研究,且征得受试 患者的同意。
排除标准:①经颅脑 CI 或 MRI 证实 患者颅内占位;②患者有严重的心肝肾 等功能障碍;③存在药物或酒精滥用 史;④发生过脑外伤;⑤有神经系统病 变或中枢神经系统感染病史;⑥卒中后 癫痫。
论著·临床论坛
CHINESE COMMUNITY DOCTORS
肠道微生态失衡与癫痫发生的相关性研究
冯茜 1 孙庆 1 文芳 1 吴艳阳 2 412012 湖南中医药高等专科学校 1,湖南 株洲 412012 湖南中医药高等专科学校附属第一医院 2,湖南 株洲
doi:10.3969/j.issn.1007-614x.2021.18.007 基金项目 湖南省教育厅科研项目 17C1249 摘 要 目的:研究肠道微生态失衡与癫痫发生的相关性。方法:2018 年 1 月-2019 年 9 月收治癫痫患者 12 例,分为 癫痫控制组和难治性癫痫组,同时选取健康人作为对照组。比较三组粪便标本的肠道微生态菌群生物学、微生物多 样性及组间物种差异。结果:对照组肠 Chaol 指数显著高于癫痫控制组及难治性癫痫组,差异有统计学意义(P< 0.05);三组 Shannon 指数比较,差异无统计学意义(P>0.05)。结论:癫痫发生与患者肠道微生物失衡具有相关性,在 临床上可以通过调节患者肠道微生态环境,控制癫痫的发生。 关键词 肠道微生态;菌群;失衡;癫痫;相关性 Study on the relationship between intestinal microecological imbalance and epilepsy Feng Qian1,Sun Qing1,Wen Fang1,Wu Yanyang2 Hunan College of Traditional Chinese Medicine1,Hunan Zhuzhou 412012 The First Affiliated Hospital of Hunan College of Traditional Chinese Medicine2,Hunan Zhuzhou 412012 Fund project Scientific Research Project of Hunan Provincial Department of Education 17C1249 Abstract Objective:To study the correlation between the imbalance of intestinal microecology and the occurrence of epilepsy. Methods:From January 2018 to September 2019,12 patients with epilepsy were selected,they were divided into the epilepsy control group and the refractory epilepsy group,and healthy people were selected as the control group.The biology,microbial diversity and species differences of the intestinal microbiota of the stool specimens of the three groups of patients were compared. Results:The intestinal Chaol index of the control group was significantly higher than that of the epilepsy control group and the refractory epilepsy group,the difference was statistically significant(P<0.05).The Shannon index of the three groups was not statistically significant(P>0.05).Conclusion:The occurrence of epilepsy is related to the imbalance of intestinal microbes in patients.Clinically,the occurrence of epilepsy can be controlled by adjusting the intestinal microecological environment of patients. Key words Intestinal microecology;Flora;Imbalance;Epilepsy;Correlation
肠道菌群领域研究进展(完整版)

肠道菌群领域研究进展(完整版)已有大量研究证实,肠道菌群与肥胖、糖尿病、高脂血症、高血压、心脑血管疾病、慢性肾病、神经系统疾病等相关,肠道菌群科学家们2019年在肠道微生物组研究领域取得了研究成果;【1】Nat Biotechnol:突破!科学家在人类肠道微生物组中鉴别出100多种新型肠道菌群!近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自英国桑格研究院等机构的科学家们通过对肠道微生物组研究,从健康人群的肠道中分离出了100多个全新的细菌类型,这是迄今为止研究人员对人类肠道菌群进行的最全面的收集研究,相关研究结果获奖帮助研究人员调查肠道微生物组在人类机体健康及疾病发生过程中所扮演的关键角色。
本文研究结果能帮助研究人员快速准确地检测人类肠道中存在的细菌类型,同时还能帮助开发出治疗多种人类疾病的新型疗法,比如胃肠道疾病、感染和免疫疾病等。
人类机体中细菌大约占到了2%的体重,肠道微生物组就是一个主要的细菌聚集位点,同时其对人类健康非常重要。
肠道微生物组的失衡会诱发诸如炎性肠病等多种疾病的发生,然而由于很多肠道菌群难以在实验室环境下生存,因此研究人员就无法对其进行更加直观地研究。
【2】Science:肠道微生物组可能是药物出现毒副作用的罪魁祸首药物本是用于治疗很多患者,但是一些患者遭受这些药物的毒副作用。
在一项新的研究中,来自美国耶鲁大学的研究人员给出了一种令人吃惊的解释---肠道微生物组(gut microbiome)。
他们描述了肠道中的细菌如何能够将三种药物转化为有害的化合物,相关研究结果发表在Science期刊上。
研究者表示,如果我们能够了解肠道微生物组对药物代谢的贡献,那么我们能够决定给患者提供哪些药物,或者甚至改变肠道微生物组,这样患者具有更好的反应。
在这项新的研究中,研究人员研究了一种抗病毒药物,它的分解产物可引起严重的毒副反应,并确定了肠道细菌如何将这种药物转化为有害的化合物。
传统方法用于人肠道菌群分析的研究进展

1 肠道菌群概述 在人体体内及体表均生存着大量的微生物群,而人类肠道 菌群是人体内最为复杂并且新陈代谢极其活跃的生态系统,其 中以双歧杆菌、拟杆菌等菌为主,其次还包括肠杆菌、肠球菌、 乳酸杆菌等[3-6]。按照肠道菌群对人体的影响可将肠道菌群分为 正常菌群、条件致病菌和致病菌,人体在健康状况下,致病菌与 正常菌群始终保持着动态平衡。平衡的肠道菌群关系是正常人 体功能甚至结构的重要保障[7],但此平衡一旦被打破,将会对机 体的各个系统造成不同程度的破坏。 机体内的肠道菌群复杂多样,健康人群之间的肠道菌群分 布有着细微差别,而非健康人群的肠道菌群更是千变万化。因 此,肠道菌群的稳定是维持机体的正常新陈代谢和防御体系的 重要保证,已有越来越多的研究都证实了肠道菌群失调与疾病 之间有着密不可分的联系。菌群之间存在着相互拮抗的关系, 可以避免致病菌致病或条件致病菌成为优势菌而致病。但这种
人类慢性疾病中肠道菌群失衡的研究进展

人类慢性疾病中肠道菌群失衡的研究进展肠道菌群是人类肠道内自然生长的微生物群体。
它们以正常的代谢和能量利用维持着肠道内的微观生态平衡。
肠道菌群失衡对人类健康产生了广泛而深刻的影响。
在众多的慢性疾病中,肠道菌群失衡与肥胖症、炎症性肠病、自身免疫性疾病、糖尿病和肥胖相关疾病等紧密相关。
本文将综合介绍人类慢性疾病中肠道菌群失衡的研究进展。
一,肥胖症肥胖症是一种由于能量输入超过能量消耗导致的慢性代谢疾病,致使体重超过正常范围的病症。
多项研究表明,常规纤维含量较高、低脂肪、高碳水化合物、低蛋白质的西式饮食不仅会促使肥胖症的发生,还会引起肠道菌群失衡的现象。
研究发现,肥胖人类肠道内的芽孢杆菌、肠球菌和某些放线菌等有害菌群数量较高,而Lactobacillus属、Bifidobacterium属和一些丰富的球菌则比较缺乏。
二,炎症性肠病炎症性肠病(IBD)是一类慢性肠道炎症疾病,包括克罗恩病和溃疡性结肠炎。
研究表明,IBD患者的肠道内菌群失衡自主性明显,菌群数量和多样性均较低,肠道内众多诱导炎症反应的有害菌群比例高,而益生菌数量低。
这种菌群失衡进一步加剧了细胞因子和趋化因子等炎症因子的产生,导致肠道粘膜受损和肠道炎症反应的加重。
三,自身免疫性疾病自身免疫性疾病是由于机体免疫系统产生问题而导致的免疫失调疾病。
近年来,越来越多的研究显示,肠道菌群失衡与自身免疫性疾病存在密切的联系。
比如类风湿关节炎患者的肠道内菌群失衡比正常人更为明显;多发性硬化症的患者中,阻碍beta-1a干扰素治疗成功的原因之一就在于难以刺激肠道菌群平衡。
若特异性免疫细胞的增生导致胃肠道病变,影响正常肠道菌群的代谢状态,进而导致肠道菌群失衡,甚至会对人类产生致命危险。
四,糖尿病糖尿病是胰岛素产生或利用不全所引起的一种代谢性疾病,目前已成为全球性的健康危机。
肠道菌群失衡与糖尿病的关系主要在于首要代谢物、短链脂肪酸,其中人体主要的两种含量高的短链脂肪酸分别是丙酸和丁酸。
肠道菌群失调在非酒精性脂肪性肝病中研究进展

肠道菌群失调在非酒精性脂肪性肝病中研究进展乔兵1, 周永2, 马文洁3, 苟卫4, 邹晓3, 史昌河1(1.青岛市传染病医院 肝病5科,山东 青岛 266033;2.青岛市传染病医院 医务科,山东 青岛 266033;3.青岛市传染病医院 医院办公室,山东 青岛 266033;4.青岛市传染病医院 肝病6科,山东 青岛 266033)摘要:非酒精性脂肪性肝病(non-alcoholic fatty liver disease ,NAFLD )是最常见的慢性肝病之一,其发病机制尚未完全明确。
近期研究表明肠道菌群的改变参与了NAFLD 的发生。
在生理状态下,肠道菌群与内外环境保持动态均衡,各种原因导致的肠道菌群失衡均可影响宿主的代谢、能量吸收及肠道内分泌功能,与肥胖、高血压和血脂代谢异常等NAFLD 的高危因素及肝纤维化、肝硬化等密切相关,且在诱发机体代谢紊乱及胰岛素抵抗中具有重要作用。
本文对近年来肠道菌群改变与NAFLD 发生发展的研究进展进行综述,以期为NAFLD 的治疗提供新思路。
关键词:脂肪性肝病,非酒精性;肠道菌群;胰岛素抵抗Intestinal microflora imbalance in non-alcoholic fatty liver diseaseQiao Bing 1, Zhou Yong 2, Ma Wenjie 3, Gou Wei 4, Zou Xiao 3, Shi Changhe 1 (1.Department of No.5 Liver Disease, Qingdao Hospital of Infectious Diseases, Qingdao 266033, Shandong Province, China; 2.Department of Medical, Qingdao Hospital of Infectious Diseases, Qingdao 266033, Shandong Province, China; 3.Department of Hospital Office, Qingdao Hospital of Infectious Diseases, Qingdao 266033, Shandong Province, China; 4.Department of No.6 Liver Disease, Qingdao Hospital of Infectious Diseases, Qingdao 266033, Shandong Province, China)Abstract: Non-alcoholic fatty liver disease (NAFLD) has become one of the most common chronic liver diseases and the pathogenesis has not been fully elucidated. Recent studies showed that changes in the intestinal flora group contribute to the occurrence of NAFLD. Under normal physiology, intestinal flora maintains a dynamic ecological balance to the internal and external environment. The imbalance of intestinal flora caused by various factors can affect the metabolism, energy absorption and intestinal endocrine function of the host, and it is closely related to the high risk factors of NAFLD, such as obesity, hypertension, lipid metabolism, liver fibrosis and cirrhosis. The imbalance of intestinal flora plays an important role in inducing metabolic disorders and insulin resistance. The development of intestinal flora changes and NAFLD in recent years were reviewed in order to provide new ideas for the treatment of NAFLD.Key words: Fatty liver disease, non-alcoholic; Intestinal microflora; Insulin resistanceDOI: 10.3969/j.issn.1674-7380.2020.04.005基金项目:青岛市医疗卫生重点学科建设项目资助(青卫科教字〔2019〕9号);青岛市医疗卫生优秀人才培养项目资助(青卫科教字〔2019〕9号);山东省医药卫生科技发展计划项目(2016WS0292);青岛市中医药科研计划项目(2020-zyy041)通讯作者:史昌河Email:*************非酒精性脂肪性肝病(non-alcoholic fatty liver disease ,NAFLD )指除酒精和其他明确肝损伤因素外所致的、以肝细胞内脂肪过度沉积为特征的临床综合征,包括单纯性肝脂肪变(simple fatty liver disease ,SFL )、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis ,NASH )(伴或不伴肝纤维化)及相关肝硬化、肝癌。
基于肠道菌群探讨从脾论治特发性膜性肾病

66 环球中医药2024年1月第17卷第1期 Global Traditional Chinese Medicine,January 2024,Vol.17,No.1㊃学术论坛㊃基金项目:国家重点研发计划(2019YFC1709400);天津市卫健委中医中西医结合科研课题(2021012);天津市研究生科研创新项目(2022BKY194);天津中医药大学研究生科研创新项目(YJSKC⁃20222003)作者单位:300381 天津中医药大学第一附属医院肾病科国家中医针灸临床医学研究中心[许玉培(硕士研究生)㊁李静(博士研究生)㊁吴若曦(博士研究生)㊁孙禹新(硕士研究生)㊁姜晨㊁杨洪涛];北京中医药大学东直门医院脾胃科[张希颜(硕士研究生)]作者简介:许玉培(1997-),2021级在读硕士研究生㊂研究方向:中医内科学肾病㊂E⁃mail:xuyupei2185@通信作者:杨洪涛(1963-),博士,主任医师,博士生导师㊂研究方向:中西医结合防治肾脏疾病的临床与基础研究㊂E⁃mail:tjtcmht@基于肠道菌群探讨从脾论治特发性膜性肾病许玉培 李静 吴若曦 张希颜 孙禹新 姜晨 杨洪涛【摘要】 现代研究证实了特发性膜性肾病患者存在严重的肠道菌群失调㊂肠道菌群可通过影响代谢物的丰度以及肠道屏障稳态,并以代谢衍生物为中间介质,调节机体的免疫炎症反应,继而经肠 肾轴途径参与特发性膜性肾病的发病机制㊂特发性膜性肾病病位在肾,以脾肾亏虚为基本病机㊂肾病不独治肾,临床上多脾肾同调,尤以健脾为先㊂中医认为肠道菌群与脾土功能相通,是脾发挥功能的物质基础,是调脾类中药的重要作用靶点㊂临床上可通过调节脾胃来改善肠道菌群的生态,继而防治膜性肾病㊂本文着眼于探究脾与肠道菌群㊁特发性膜性肾病三者的联系,以期通过肠道微生物来诠释从脾论治膜性肾病的生物机制,进一步丰富中医药治疗特发性膜性肾病的科学内涵,为膜性肾病的治疗提供新途径和思路㊂【关键词】 肠道菌群; 特发性膜性肾病; 从脾论治; 代谢物; 肠道屏障; 肠 肾轴【中图分类号】 R259 【文献标识码】 A doi:10.3969/j.issn.1674⁃1749.2024.01.010 特发性膜性肾病(idiopathic membranous nephropathy,IMN)是一种自身免疫性肾小球疾病,以上皮下免疫复合物沉积㊁足细胞损伤㊁肾小球基底膜弥漫性增厚为主要病理特征[1],其发病机制可能与遗传易感性及环境㊁免疫相关[2]㊂我国膜性肾病的发病率为12.6%,并呈逐年上升的趋势[3],以中老年人为多发㊂部分患者可达到自我缓解,仍有1/3的患者经治疗后进展至终末期肾脏病㊂近年来,肠道菌群与宿主之间的联系越来越受到学者的关注㊂研究表明,IMN 患者存在明显的肠道菌群生态失调,且与病情的进展相关联[4]㊂粪菌移植疗法在治疗难治性膜性肾病患者中获得确切疗效[5],也进一步证明了肠道菌群可作为干预膜性肾病发展转归的靶点之一㊂IMN 在中医上多归属于 水肿” 尿浊” 虚劳”等病,以水肿㊁泡沫尿㊁乏力㊁头晕㊁耳鸣等为主要临床表现㊂现代诸医家多认为脾土功能失调与IMN 的发生密切相关,临床上多以健脾祛湿㊁益气升清为治疗法则㊂脾胃与肠道菌群在功能上相应,临床上可通过调脾来改善肠道微生物的生态㊂为进一步探求从脾论治IMN 的生物机制,笔者着眼于脾与肠道菌群㊁IMN 三者的相关性,以期为IMN 的治疗提供新的思路与见解㊂1 肠道菌群能影响IMN 的发生发展肠道菌群参与人体的代谢及免疫的发育与成熟,能通过代谢衍生物及微生物相关分子模式双向调节宿主免疫反应㊂IMN 为自身免疫性疾病㊂有研究表明辅助性T 细胞17(T helper cell 17,Th17)与调节性T 细胞(regulatory T cell,Treg)比例失衡与IMN 的发病密切相关[6],而炎症和氧化应激反应则为IMN 足细胞损伤的关键病理机制[7]㊂肠道菌群能影响代谢物的丰度,进而诱导Treg 和辅助性T 细胞分化,干预外周促炎因子及抗炎因子的释放[8]㊂另外,肠道菌群失调又能破坏肠道屏障稳态,并通过肠 肾轴途径参与IMN 的发病与进展㊂1.1 肠道菌群能调节代谢衍生物的丰度,以改善肾损伤1.1.1 短链脂肪酸可调节宿主炎症㊁免疫和氧化应激反应 短链脂肪酸(short chain fatty acids,SCFAs)是复合碳水化合物经肠道微生物代谢后的终产物,包含丁酸盐㊁丙酸盐和醋酸盐等㊂有研究证实IMN 患者Treg 细胞数量明显减少[6],而SCFAs 能够通过抑制组蛋白脱乙酰酶活性来刺激Treg 细胞的增殖[9],促进抗炎细胞因子白介素10产生,抑制肾脏炎症反应㊂而丁酸盐能促进叉头状转录因子3(forkhead box protein 3,Foxp3)位点启动子上的组蛋白H3乙酰化,从而增加转录因子Foxp3的表达,调控T 细胞向CD 4+FoxP 3+Treg 细胞极化,以增加Treg 细胞的数量[10]㊂此外,SCFAs 又能激活G 蛋白偶联受体(GPR43或GPR41),抑制核因子⁃κB(nuclear factor kappa B,NF⁃κB)通路活化和肿环球中医药2024年1月第17卷第1期 Global Traditional Chinese Medicine,January2024,Vol.17,No.167瘤坏死因子⁃α的表达[11]㊂氧化应激反应与炎症能够损伤IMN足细胞及肾小球基底膜[7],SCFCs能通过增加过氧化氢酶㊁氧化物歧化酶,减少一氧化氮和活性氧来抑制氧化应激,降低肾脏炎症,改善肾纤维化及肾小管损伤[12]㊂1.1.2 胆汁酸衍生物能调节机体免疫平衡 胆汁酸由肝脏合成分泌,经由结肠微生物修饰而产生新的代谢物,以调节宿主免疫稳态㊂胆汁酸的一种衍生物3β⁃羟基脱氧胆酸,可作用于树突状细胞来降低其免疫刺激特性,增加Foxp3诱导,以CNS1依赖性方式促进外周调节性T细胞分化[13],调节机体免疫㊂Treg细胞能维持外周免疫耐受性,Treg细胞的表达上调对IMN预后有着积极影响[14],而Th17细胞介导的炎症能增加IMN复发和血栓风险,可能为IMN发病的促发机制[15]㊂有研究发现石胆酸经肠道内共生菌修饰后可产生两种衍生物3⁃oxolithocholic acid和异石胆酸,二者能调整Th17和Treg细胞之间的平衡㊂异石胆酸可通过对Foxp3位点CNS3的组蛋白修饰,增加该启动子区域乙酰化来促进Treg分化;而3⁃oxolithocholic acid能与关键转录因子视黄酸受体相关孤儿受体γt结合并抑制其的活性,从而抑制Th17的分化[16]㊂1.2 肠道菌群失衡能干扰肠道屏障的稳态,诱导足细胞损伤肠道屏障由粘液层㊁上皮细胞㊁免疫细胞㊁肠道菌群构成,能够抵御外界病原体入侵,防止肠腔内毒素及微生物进入血液循环,以维护机体免疫稳态㊂肠道菌群作为人体的生物屏障,通过与病原体竞争营养和上皮的粘附位点以及增强粘膜免疫反应来抑制病原体的定植[17]㊂肠道菌群失调会扰乱肠道屏障的稳态,致病菌及内毒素可透过受损的屏障移位进入循环,引起免疫系统的异常激活,诱发炎症反应㊂IMN患者肠道菌群生态紊乱,链球菌属㊁韦荣氏球菌属㊁嗜血杆菌属等致病菌的丰度增加[18],导致肠道屏障稳固性破坏,肠道通透性增加[19]㊂大量致病菌能产生高水平的脂多糖,通过Toll样受体4(Toll⁃like receptor4,TLR4)识别,并经髓样分化因子88(myeloid differentiation factor88, MyD88)触发信号传导,激活NF⁃κB和丝裂原活化的蛋白激酶通路,诱导促炎细胞因子产生,促进全身性炎症反应,加重足细胞损伤及肾纤维化[9]㊂综上,肠道屏障功能受损是IMN病情进展的因素之一㊂2 肠道菌群与脾土功能相通中医五脏系统将人体六腑㊁情志及形体等相联系,构成一个有机整体㊂中医藏象理论认为脾在人体的作用,并不局限于西医形脏的功能,其表现于外的 象”,即功能之脏腑亦包含了肠道菌群的功能[20],二者在生理功能上相通㊂2.1 肠道菌群协助人体消化吸收功能与脾主运化相应 脾㊁胃㊁大肠㊁小肠㊁三焦㊁膀胱者,仓禀之本,营之居也,名曰器,能化糟粕,转味而入出者也 此至阴之类,通于土气㊂”人体的消化吸收代谢皆归于脾土系统,饮食水谷由脾胃受纳腐熟,以化生营卫气血,荣养周身㊂脾土居中焦,为气机㊁津液㊁精微转输之枢机㊂肠道菌群能发酵人体不能消化的外源性膳食纤维及多余的蛋白质,并参与糖脂代谢,协助营养物质的消化吸收,与脾主运化相通应㊂若脾虚失运,输布不利,则痰浊湿邪渐生㊂现代医学认为,脾主运化的功能对于血糖㊁血脂㊁血压等均有调节作用,微生物生态紊乱亦与糖尿病㊁高脂血症㊁代谢综合征㊁冠心病㊁脂肪性肝炎等发病机制相关[21]㊂2.2 肠道菌群参与人体免疫调节功能与脾为之卫相应张景岳在‘类经㊃藏象类“中指出: 脾主运化水谷以长肌肉,五脏六腑皆赖其养,故脾主为卫㊂”一方面脾胃化谷食,充元气,益精血,为脏腑提供生理活动所必须的物质基础,筋骨肌肉皆受脾胃化生水谷之气滋养,脾旺则 形充而大肉坚而有分”,正气充足,则脏腑不受邪气侵扰,继而发挥其卫外的功能;另一方面营卫由水谷之精所化生,卫气慓急滑利,调控皮毛腠理的开合,在外可抵御六淫之气侵袭人体,在内可与邪气相搏,相当于人体的免疫系统,这与肠道微生物在人体黏膜免疫系统中发挥的作用相似㊂肠道菌群产生的代谢衍生物可充当信号分子与宿主相互联系,参与人体的免疫调节㊂此外,肠道微生物能调节抗菌肽及分泌型免疫球蛋白A的形成,减少致病菌的粘附与定植,维持肠道屏障的稳固性,以抵御致病菌及肠腔内毒素进入循环,减轻宿主的炎症和氧化应激反应㊂3 肠道菌群为调脾类中药治疗IMN的作用靶点3.1 肠道菌群可作为调脾类中药的作用靶点脾土健运是肠道微生物生态平衡的前提条件㊂脾虚患者可出现肠道菌群失调,而健脾类的单味中药或复方能改善肠道微生物生态㊂有研究表明,茯苓水提物能显著减少脾虚模型大鼠不明梭菌,增加拟杆菌丰度,通过调节相应的代谢物来发挥健脾的疗效[22]㊂周丽婷等[23]将健康大鼠及麸炒苍术处理后的大鼠粪菌液移植予脾虚模型小鼠,证实了纠正肠道菌群紊乱能改善小鼠脾虚状态,且苍术能通过调节肠道菌群发挥作用㊂综上,肠道菌群可作为调脾类方药的治疗靶点㊂3.2 调脾类中药可通过调节肠道菌群来干预IMN的进展IMN患者的肠道菌群失调,微生物的多样性降低[24],而致病菌的丰度明显增加[18],且与病情的进展相关联[4]㊂肠道菌群参与宿主代谢,为脾土功能正常发挥的物质基础㊂肠道菌群失衡会引起宿主代谢及免疫功能紊乱,进而诱发或加重脾虚证,而脾胃功能失调与IMN的发生密切相关㊂有研究发现IMN患者粪便的有机酸含量(尤其是丙酸和丁酸)较健康成人明显减少,这可能与厚壁菌门㊁毛螺菌属和梭杆菌属等能产生SCFAs的菌群减少相关[25]㊂调脾类中药能以肠道菌群为靶点,通过改善肠道微生物生态,调节代谢物的丰度,来发挥抗炎及免疫调节作用,进而干预IMN的进展㊂如:山药多糖能增加厚壁菌门㊁毛螺菌属等丰度,降低大鼠肠道致病菌的数量,以减轻肾功能损伤程度[26]㊂黄芪可用于治疗IMN[27],其能通过增加肠道益生菌,减少活性68 环球中医药2024年1月第17卷第1期 Global Traditional Chinese Medicine,January2024,Vol.17,No.1氧的产生,以抑制氧化应激反应,减轻肾脏纤维化[28]㊂有研究证实黄芪多糖能够增加大鼠肠道菌群的丰度及多样性,以降低血清内毒素含量,提高SCFAs的丰度,并通过抑制TLR4/NF⁃κB通路来减少炎症反应,进而改善大鼠的免疫紊乱[29]㊂赵宏等[30]研究发现车钱子多糖能通过升高拟杆菌门/厚壁菌门的比值,增加SCFAs的浓度,继而诱导Treg细胞表达,促进抗炎细胞因子的表达,以减轻膜性肾病大鼠模型的肾损伤㊂另外,肠道通透性增加与全身炎症及肾脏进行性纤维化密切相关[31],为IMN的重要进展因素㊂肠道菌群作为人体肠道的生物屏障,可通过调节代谢产物的生成来影响肠道紧密连接蛋白的表达㊂健脾类中药能以肠道菌群为作用靶点来维持肠道屏障的稳固性㊂如:苍术苷A能通过调节肠道菌群结构,下调TLR4/MyD88/NF⁃κB信号通路的表达,增强肠道屏障的稳定性,进而以发挥抗炎作用[32]㊂茯苓多糖[33]可通过改变肠道菌群的组成结构和多样性,增加SCFAs含量,上调肠道闭锁蛋白和紧密连接蛋白Zo⁃1以及肠道组织中粘蛋白2㊁β⁃防御素和分泌型免疫球蛋白A的表达,以增强肠道物理㊁化学屏障,维持肠道稳态㊂4 基于调节肠道菌群从脾论治IMN的临床实践IMN病变部位虽在肾,但脾为后天之本,气血化生之源,脾肾互资,补肾必用健脾㊂且脾主运化㊁升清,脾虚则升提不利,精微不固,湿浊痰饮自生,病情多缠绵难愈㊂临床上多以健脾祛湿㊁益气升清为治疗法则㊂4.1 健脾助运以化水湿水肿为IMN最常见的症状㊂诸湿肿满皆属于脾,脾主运化,参与人体水液的代谢运行㊂水饮入胃,经脾运化转输而布散周身,脾气健旺则水循常路,脾虚气化不利则水失枢转,水湿痰饮之邪渐生㊂水湿溢于肌肤,则可见周身水肿;留于胃肠,则困遏气机,妨碍脾胃运化㊂故IMN水肿期患者脾胃症状较为突出,多伴有纳呆㊁食欲不振㊁腹胀㊁恶心㊁呕吐㊁腹泻等症状㊂‘诸病源候论“中云: 肾主水,脾主土㊂若脾虚则不能克制于水,肾虚则水气流溢,散于皮肤,故令身体浮肿㊂”水唯畏土,临床上多运脾以制水㊂聂莉芳教授[34]认为肾性水肿的治疗关键在于治脾,在治疗IMN时尤重视调理脾胃,对脾虚夹湿证多予以参苓白术散㊁香砂六君子汤㊂有实验研究表明参苓白术散能够提高大鼠有益菌的丰度,减轻肠道屏障损伤,改善肠道免疫调节[35]㊂香砂六君子汤能调控肠道菌群生态,进而减少血清内毒素,并通过下调TLR4/NF⁃κB信号通路以及相关炎性因子的表达,降低炎症反应[36]㊂余仁欢教授提出肾病不专治肾,应脾肾同调,健脾为先,其团队前期研究认为肠道菌群紊乱引起的免疫功能障碍可能是IMN发展的重要因素,而健脾祛湿和络方能够通过增加肠道益生菌的丰度,改善肠道菌群的结构,以发挥肾脏保护作用,并能显著降低IMN患者尿蛋白[37]㊂为进一步观察健脾祛湿和络方的作用机制, WANG XH等[38]将其应用于被动海曼肾炎大鼠模型4周后发现,健脾祛湿和络方能减少大鼠免疫复合物沉积,降低肾小管和肾小球的凋亡率,并能调节肠道菌群生态,在属水平上,显著增加了乳酸杆菌属与罕见小球菌属的丰度;在种水平上,以阴道乳酸杆菌和Subdoligranulum variabile的丰度变化最为明显㊂而阴道乳酸杆菌与肾小球细胞凋亡呈负相关,Subdoligranulum variabile的丰度与肾小球中免疫球蛋白G和膜攻击复合物的沉积㊁肾小球细胞的凋亡率呈负相关,这表明了健脾祛湿和络方能够通过调节肠道菌群发挥治疗作用㊂4.2 升清降浊以固摄精微IMN常伴见头晕㊁耳鸣及消化道症状,此多由脾胃气虚,清阳不升,湿邪困阻中焦所致㊂ 胃主降浊,脾主升清,湿则中气不运,升降反作,清阳下陷,浊阴上逆,人之衰老病死,莫不由此”㊂胃为水谷之海,脾与胃纳运相得,升降相因,水谷精微上输下达皆赖脾生发之气,以升清布散,上以荣皮毛官窍,充肌腠,下以滋养五脏六腑㊂若水湿困遏中焦,中气不运,脾虚升提不利,水谷精微下流,头面官窍不得濡养,湿浊上蒙,闭塞九窍,可见头晕㊁耳鸣等症状㊂李东垣谓: 脾胃不足,荣气下流,而乘肾肝㊂”脾虚生发之气不足,湿邪不化,蕴而化热,湿性下趋,闭塞肾络,肾络受损,藏纳不固,则可见血尿㊁蛋白尿㊂王耀献教授[39]在临床治疗膜性肾病蛋白尿常用升阳益胃汤加减化裁,以恢复脾土升清之机,使湿邪得化,清阳得升,津液行有常道㊂升阳益胃汤㊁补中益气汤均为李东垣所创健脾升清的经典方剂,在现代肾脏疾病中常用以治疗慢性肾炎蛋白尿㊂有研究发现补中益气汤能够增加肠道菌群α多样性,并减少致病菌的丰度[40]㊂王妤[41]研究表明补中益气汤中含有大量益生元成分,能升高乳酸杆菌㊁双歧杆菌丰度,进而减轻炎症反应㊂陈志强教授认为IMN非水肿期的蛋白尿多由脾肾亏虚,精关失约所致,脾主升清,脾虚则升提不利,精微下流,临床多应用大量黄芪㊁白术㊁山药㊁党参以益气固摄精关[42]㊂高婷婷等[43]研究发现黄芪能够减少慢性肾炎模型大鼠的致病菌丰度,降低血清内毒素水平,并能通过增加益生菌普雷沃氏菌科及拟杆菌属的相对丰度,升高SCFAs浓度,下调炎症反应的表达,降低肾脏组织中肿瘤坏死因子⁃α㊁白介素⁃6㊁白介素⁃17㊁白介素⁃23等炎症因子的含量㊂此外,黄芪又能增加肠道屏障修复相关代谢,维持肠道屏障结构,进而减轻肾脏损伤㊂5 结语肠道菌群能够调控宿主免疫㊁炎症及氧化应激反应,为脾土功能正常发挥的物质基础,与IMN的发生发展密切相关㊂调节脾胃能有效改善肠道菌群的生态,为中药复方的重要作用靶点㊂在临床中粪菌移植疗法可通过逆转肠道菌群生态失调,来改善IMN病情进展,证实了肠道菌群有望作为调脾类方药治疗IMN的新靶点㊂目前,通过肠 肾轴途径治疗IMN疾病的临床研究较少,中医药能否特异性调节微生物种类来治疗膜性肾病还不是十分明确,未来皆有待环球中医药2024年1月第17卷第1期 Global Traditional Chinese Medicine,January2024,Vol.17,No.169于进一步探索,为实现中医药肠道靶向给药治疗IMN提供更有利充分的证据㊂参考文献[1] ZHANG X D,CUI Z,ZHANG M F,et al.Clinical implicationsof pathological features of primary membranous nephropathy[J].BMC Nephrol,2018,19(1):215.[2] ZHANG X D,CUI Z,ZHAO M H.The Genetic andEnvironmental Factors of Primary Membranous Nephropathy:AnOverview from China[J].Kidney Dis(Basel),2018,4(2):65⁃73.[3] HU R,QUAN S,WANG Y,et al.Spectrum of biopsy provenrenal diseases in Central China:a10⁃year retrospective studybased on34,630cases[J].Sci Rep,2020,10(1):10994.[4] DONG R,BAI M,ZHAO J,et al.A Comparative Study of theGut Microbiota Associated With Immunoglobulin a Nephropathyand Membranous Nephropathy[J].Front Cell Infect Microbiol,2020,10:557368.[5] ZHOU G,ZENG J,PENG L,et al.Fecal microbiotatransplantation for membranous nephropathy[J].CEN CaseRep,2021,10(2):261⁃264.[6] Motavalli R,Etemadi J,Soltani⁃Zangbar M S,et al.AlteredTh17/Treg ratio as a possible mechanism in pathogenesis ofidiopathic membranous nephropathy[J].Cytokine,2021,141:155452.[7] 李鑫,雷根平,冯喆,等.基于足细胞损伤探讨中医药干预膜性肾病研究进展[J].中国实验方剂学杂志,2023,29(12):257⁃264.[8] Ivanov I,Tuganbaev T,Skelly A N,et al.T Cell Responses tothe Microbiota[J].Annu Rev Immunol,2022,40:559⁃587.[9] Foresto⁃Neto O,Ghirotto B,Câmara N O S.Renal Sensing ofBacterial Metabolites in the Gut⁃kidney Axis[J].Kidney360,2021,2(9):1501⁃1509.[10] Kayama H,Takeda K.Manipulation of epithelial integrity andmucosal immunity by host and microbiota⁃derived metabolites[J].Eur J Immunol,2020,50(7):921⁃931. [11] Kobayashi M,Mikami D,Kimura H,et al.Short⁃chain fattyacids,GPR41and GPR43ligands,inhibit TNF⁃α⁃inducedMCP⁃1expression by modulating p38and JNK signalingpathways in human renal cortical epithelial cells[J].BiochemBiophys Res Commun,2017,486(2):499⁃505. [12] LI L,MA L,FU P.Gut microbiota⁃derived short⁃chain fattyacids and kidney diseases[J].Drug Des Devel Ther,2017,11:3531⁃3542.[13] Campbell C,Mckenney P T,Konstantinovsky D,et al.Bacterial metabolism of bile acids promotes generation ofperipheral regulatory T cells[J].Nature,2020,581(7809):475⁃479.[14] Rosenzwajg M,Languille E,Debiec H,et al.B⁃and T⁃cellsubpopulations in patients with severe idiopathic membranous ne⁃phropathy may predict an early response to rituximab[J].Kidney Int,2017,92(1):227⁃237.[15] Cremoni M,Brglez V,Perez S,et al.Th17⁃Immune Responsein Patients With Membranous Nephropathy Is Associated WithThrombosis and Relapses[J].Front Immunol,2020,11:574997.[16] HANG S,Paik D,YAO L,et al.Bile acid metabolites control T(H)17and T(reg)cell differentiation[J].Nature,2019,576(7785):143⁃148.[17] WANG C,LI Q,REN J.Microbiota⁃Immune Interaction in thePathogenesis of Gut⁃Derived Infection[J].Front Immunol,2019,10:1873.[18] YU W,SHANG J,GUO R,et al.The gut microbiome indifferential diagnosis of diabetic kidney disease and membranousnephropathy[J].Ren Fail,2020,42(1):1100⁃1110. [19] O’callaghan A A,Corr S C.Establishing Boundaries:The Re⁃lationship That Exists between Intestinal Epithelial Cells andGut⁃Dwelling Bacteria[J].Microorganisms,2019,7(12):663.[20] 张鹤,白宇宁,刘绍能,等.现代医学视角下中医 脾主运化”探析[J].北京中医药,2022,41(2):179⁃181. [21] FAN Y,Pedersen O.Gut microbiota in human metabolic healthand disease[J].Nat Rev Microbiol,2021,19(1):55⁃71.[22] 张丹丹,叶晓川.基于肠道菌群和代谢组学探讨茯苓水提物健脾的作用机制[J].中华中医药杂志,2021,36(7):3994⁃4001.[23] 周丽婷,曾婉婷,赵雪岑,等.基于粪菌移植麸炒苍术对脾虚小鼠肠道菌群调节作用验证[J].亚太传统医药,2023,19(8):20⁃23.[24] LI M,WEI L,SUN J,et al.Association of gut microbiota withidiopathic membranous nephropathy[J].BMC Nephrol,2022,23(1):164.[25] ZHANG J,LUO D,LIN Z,et al.Dysbiosis of gut microbiotain adult idiopathic membranous nephropathy with nephroticsyndrome[J].Microb Pathog,2020,147:104359. [26] 张文杰,赖星海,陈佳薇.山药多糖治疗肥胖糖尿病肾病大鼠的效果观察及对其肾功能和肠道微生态的影响[J].中国微生态学杂志,2021,33(1):37⁃42.[27] WANG D,WANG L,ZHANG M,et al.Astragalus membranaceusformula for moderate⁃high risk idiopathic membranousnephropathy:A meta⁃analysis[J].Medicine(Baltimore),2023,102(9):e32918.[28] HAN C,JIANG Y H,LI W,et al.Astragalus membranaceusand Salvia miltiorrhiza ameliorates cyclosporin A⁃inducedchronic nephrotoxicity through the gut⁃kidney axis”[J].J Eth⁃nopharmacol,2021,269:113768.[29] ZHAO W,DUAN C,LIU Y,et al.Modulating effects ofAstragalus polysaccharide on immune disorders via gut microbiotaand the TLR4/NF⁃κB pathway in rats with syndrome of dampnessstagnancy due to spleen deficiency[J].J Zhejiang Univ Sci B,2023,24(7):650⁃662.[30] 赵宏,陈晨,赵岩,等.车前子多糖对膜性肾病大鼠肾损伤和肠道菌群的影响[J].中国实验方剂学杂志,2021,27(22):92⁃99.70 环球中医药2024年1月第17卷第1期 Global Traditional Chinese Medicine,January2024,Vol.17,No.1[31] YANG J,Lim S Y,Ko Y S,et al.Intestinal barrier disruptionand dysregulated mucosal immunity contribute to kidney fibrosisin chronic kidney disease[J].Nephrol Dial Transplant,2019,34(3):419⁃428.[32] XU J,LIU C,SHI K,et al.Atractyloside⁃A ameliorates spleendeficiency diarrhea by interfering with TLR4/MyD88/NF⁃κBsignaling activation and regulating intestinal flora homeostasis[J].Int Immunopharmacol,2022,107:108679. [33] DUAN Y,HUANG J,SUN M,et al.Poria cocos polysaccharideimproves intestinal barrier function and maintains intestinalhomeostasis in mice[J].Int J Biol Macromol,2023,249:125953.[34] 段锦绣,孙红颖,聂莉芳.聂莉芳教授运用调理脾胃法治疗多种慢性肾脏病的经验研究[J].中国中西医结合肾病杂志,2020,21(1):5⁃7.[35] 马琪,董婧,翁与竞,等.基于16S rDNA测序技术探究参苓白术散对溃疡性结肠炎小鼠肠道菌群的影响[J].中国兽医学报,2022,42(6):1230⁃1240.[36] 王杰,宋囡,隋国媛,等.香砂六君子汤对脾虚高脂血症大鼠肠道菌群及肝脏脂质沉积的防治作用机制[J].中华中医药杂志,2023,38(5):2264⁃2269.[37] LANG R,WANG X H,LI A F,et al.Effects of Jian Pi Qu ShiFormula on intestinal bacterial flora in patients with idiopathicmembranous nephropathy:A prospective randomized controlledtrial[J].Chronic Dis Transl Med,2020,6(2):124⁃133.[38] WANG X H,YANG Y N,LIANG Y,et al.Structuralmodulation of gut microbiota during alleviation of experimentalpassive Heymann nephritis in rats by a traditional Chinese herbalformula[J].Biomed Pharmacother,2022,145:112475. [39] 曹博宁,王耀献.王耀献教授应用升阳益胃汤治疗膜性肾病蛋白尿经验[J].世界中西医结合杂志,2023,18(4):663⁃667.[40] 赵春一,肖荣,杨玲玲,等.从肠道菌群角度探讨补中益气汤治疗脾虚型失眠疗效[J].广州中医药大学学报,2020,37(11):2057⁃2063.[41] 王妤.美沙拉嗪联合补中益气汤治疗慢性溃疡性直肠炎的临床效果观察[J].结直肠肛门外科,2019,25(1):91⁃95.[42] 马赟,仝新强,马二卫,等.陈志强治疗特发性膜性肾病经验[J].中华中医药杂志,2021,36(2):840⁃842. [43] 高婷婷,罗广波,方春平,等.基于肠道菌群研究黄芪治疗慢性肾炎[J].时珍国医国药,2022,33(1):5⁃9.(收稿日期:2023⁃05⁃17)(本文编辑:张楠)。
肠道菌群失调的临床研究进展

肠道菌群失调的临床研究进展在人体这个复杂而精妙的生态系统中,肠道菌群扮演着至关重要的角色。
它们如同一个庞大的“工作团队”,参与着人体的多种生理过程。
然而,当这个“团队”的平衡被打破,也就是发生肠道菌群失调时,一系列的健康问题可能接踵而至。
近年来,肠道菌群失调相关的临床研究取得了显著的进展,为我们深入理解和应对这一问题提供了更多的线索和方法。
肠道菌群是指生活在人体肠道内的微生物群落,其种类繁多,包括细菌、真菌、病毒等。
这些微生物与人体相互依存,形成了一种共生关系。
正常情况下,肠道菌群处于一种相对稳定的平衡状态,它们帮助人体消化食物、合成维生素、抵御病原体入侵,还参与调节免疫系统和神经系统的功能。
肠道菌群失调的发生原因多种多样。
饮食结构的不合理是常见的诱因之一。
长期高糖、高脂肪、低纤维的饮食,可能导致有益菌的减少和有害菌的增加。
抗生素的滥用也是一个重要因素。
抗生素在杀灭致病菌的同时,也可能“误伤”有益菌群,破坏肠道内的微生态平衡。
此外,压力、疾病、年龄增长、环境变化等也都可能对肠道菌群产生影响。
肠道菌群失调会引发一系列的临床症状和疾病。
常见的消化系统症状如腹泻、便秘、腹胀、腹痛等往往是肠道菌群失调的最初表现。
长期的肠道菌群失调还可能与肥胖、糖尿病、心血管疾病、过敏反应、自身免疫性疾病甚至精神疾病如抑郁症、焦虑症等密切相关。
在临床诊断方面,传统的方法包括粪便涂片检查、细菌培养等,但这些方法存在一定的局限性。
随着科技的发展,新一代的检测技术如高通量测序技术、宏基因组学分析等逐渐应用于肠道菌群的研究和临床诊断中。
这些技术能够更全面、准确地分析肠道菌群的组成和功能,为诊断肠道菌群失调提供了更有力的工具。
对于肠道菌群失调的治疗,调整饮食结构是基础。
增加膳食纤维的摄入,多食用富含益生元的食物如洋葱、大蒜、香蕉等,有助于促进有益菌的生长。
益生菌和益生元的补充也是常用的治疗方法。
益生菌是指对人体有益的活菌制剂,如双歧杆菌、乳酸杆菌等;益生元则是能够被有益菌利用的物质,如低聚果糖、菊粉等。
肠道菌群失调的临床研究进展

肠道菌群失调的临床研究进展在人体的健康领域中,肠道菌群失调这一概念逐渐引起了广泛的关注和深入的研究。
肠道菌群,这个在我们体内默默发挥着重要作用的“微小世界”,一旦失衡,可能给健康带来诸多问题。
肠道菌群是一个极其复杂且多样化的微生物群落,包括细菌、真菌、病毒等多种微生物。
它们与人体形成了一种微妙的共生关系,参与着人体的多项生理功能。
正常情况下,肠道菌群的种类和数量保持着相对稳定的平衡状态,为人体的健康保驾护航。
然而,当这种平衡被打破,即出现肠道菌群失调时,一系列的健康问题可能接踵而至。
引发肠道菌群失调的原因多种多样。
饮食结构的不合理是常见因素之一。
如今,高糖、高脂肪、低纤维的饮食在人们的餐桌上越来越常见。
这样的饮食模式不利于有益菌群的生长和繁殖,反而可能导致有害菌群的过度增长。
长期使用抗生素也是一个重要原因。
抗生素在杀灭病原微生物的同时,往往也会无差别地影响正常的肠道菌群,造成菌群结构的破坏。
此外,压力、睡眠不足、环境污染物等也都可能对肠道菌群的平衡产生不良影响。
肠道菌群失调与多种疾病的发生和发展密切相关。
在消化系统疾病方面,例如炎症性肠病,肠道菌群失调被认为是其发病机制中的一个关键环节。
失调的菌群可能导致肠道黏膜屏障受损,引发炎症反应,进而加重病情。
肠易激综合征患者也常常存在肠道菌群的异常,调整菌群状态有望改善症状。
在代谢性疾病中,肠道菌群失调与肥胖、糖尿病等有着千丝万缕的联系。
一些研究发现,肥胖者的肠道菌群组成与正常人存在差异,这种差异可能影响能量的吸收和代谢,从而促进肥胖的发生。
糖尿病患者的肠道菌群多样性通常降低,有益菌的数量减少,这可能影响血糖的调节和胰岛素的敏感性。
免疫系统疾病同样与肠道菌群失调有关。
肠道菌群被视为免疫系统的重要“调节器”,失调的菌群可能导致免疫失衡,增加自身免疫性疾病如类风湿关节炎、系统性红斑狼疮等的发病风险。
在神经系统疾病方面,越来越多的研究表明,肠道菌群失调可能通过肠脑轴影响大脑的功能和情绪。
中药调控肠道菌群改善阿尔茨海默病的研究进展

㊀基金项目:国家自然科学基金项目(No.82060718)作者简介:曾春晖ꎬ女ꎬ博士ꎬ教授ꎬ研究方向:中药炮制药理ꎬE-mail:121372449@qq.com通信作者:杨柯ꎬ男ꎬ硕士ꎬ教授ꎬ研究方向:抗炎免疫药理ꎬTel:0771-2279423ꎬE-mail:kyang_11@126.com中药调控肠道菌群改善阿尔茨海默病的研究进展曾春晖ꎬ李绍燕ꎬ周观琳ꎬ池鑫宇ꎬ杨柯(广西中医药大学ꎬ广西南宁530200)摘要:阿尔茨海默病(AlzheimerᶄsdiseaseꎬAD)是一种在中老年群体发病率高ꎬ严重影响生活质量的进行性神经退行性疾病ꎬ发病机制未明确ꎬ随着微生物-肠-脑轴领域的研究兴起ꎬ研究人员对中药用于治疗AD的深入研究ꎬ中药调控肠道菌群在AD的发生和发展进程中发挥的作用愈发受到重视ꎮ本文从AD与肠道菌群的关系ꎬ中药调节肠道菌群改善AD的研究现状进行综述ꎬ以期为中药防治AD的研究提供参考ꎮ关键词:中药ꎻ肠道菌群ꎻ阿尔茨海默病中图分类号:R749.1+6㊀文献标志码:A㊀文章编号:2095-5375(2024)01-0067-007doi:10.13506/j.cnki.jpr.2024.01.013ResearchprogressoftraditionalChinesemedicineinimprovingAlzheimerᶄsdiseasebyregulatingintestinalfloraZENGChunhuiꎬLIShaoyanꎬZHOUGuanlinꎬCHIXinyuꎬYANGKe(GuangxiUniversityofChineseMedicineꎬNanning530200ꎬChina)Abstract:Alzheimerᶄsdisease(AD)isaprogressiveneurodegenerativediseasewithhighincidenceinmiddle-agedandelderlypeopleꎬwhichseriouslyaffectsthequalityoflife.Thepathogenesisisunclear.Withtheriseofresearchinthefieldofmicroorganism-gut-brainaxisꎬresearchershavemadein-depthresearchontheuseoftraditionalChinesemedicineintrea ̄tingADꎬandtheroleoftraditionalChinesemedicineinregulatingintestinalfloraintheoccurrenceanddevelopmentofADhasbeenpaidmoreandmoreattention.InthispaperꎬtherelationshipbetweenADandintestinalfloraꎬandtheresearchsta ̄tusofregulatingintestinalfloratoimproveADbytraditionalChinesemedicinearereviewedꎬsoastoprovidereferencefortheresearchofpreventionandtreatmentofADbytraditionalChinesemedicine.Keywords:TraditionalChinesemedicineꎻIntestinalmicrobiotaꎻAlzheimerᶄsdisease㊀㊀阿尔茨海默病(AlzheimerᶄsdiseaseꎬAD)是一种进行性神经退行性疾病ꎬβ-淀粉样蛋白(Aβ)沉积㊁tau蛋白过度磷酸化和神经变性/神经元损伤是其主要的神经病理学变化[1]ꎬ临床表现主要为渐进性记忆认知障碍㊁语言理解表达能力㊁日常生活和社会适应能力下降[2]ꎮ肠道菌群是寄居在人体胃肠道中的数万亿微生物ꎬ发挥着能量摄取㊁抑制病原体生长㊁调节免疫系统等作用ꎬ与AD㊁帕金森病㊁多发性硬化等神经系统性疾病息息相关[3]ꎮ随着微生物-肠-脑轴领域的研究兴起ꎬ肠道菌群在AD的发生和发展进程中发挥的作用引起学者重视ꎮ中药可调节肠道菌群组成和功能ꎬ改变其代谢产物ꎬ同时中药成分可被肠道菌群转化为生物活性成分而发挥作用[4]ꎮ本文从肠道菌群与AD的关系ꎬ中药调节肠道菌群改善AD的研究现状进行综述ꎬ以期为中药防治AD的研究提供参考ꎮ1㊀肠道菌群与AD的关系1.1㊀AD进展过程中的肠道菌群及代谢产物的变化㊀从认知正常㊁轻度认知障碍(mildcognitiveimpair ̄mentꎬMCI)发展到AD的疾病进程中ꎬ肠道菌群构成会发生改变ꎮMCI可视为AD的前驱阶段ꎬ每年有5%~20%的MCI患者发展成AD[5]ꎮ在MCI受试者的肠道菌群中ꎬ厚壁菌门㊁变形菌门㊁肠杆菌科和莫吉杆菌科丰度增加ꎬ拟杆菌门和毛螺旋菌属丰度降低ꎬ菌群代谢产物氧化三甲胺明显升高ꎻ而在AD患者中ꎬ拟杆菌门㊁假单胞菌科和罕见小球菌属的丰度增加ꎬ厚壁菌门㊁放线菌门㊁双歧杆菌属㊁拟杆菌属和乳梭菌属的丰度降低ꎻ菌群代谢物中的原发性胆酸水平降低ꎬ甘氨石胆酸㊁脱氧胆酸㊁甘氨脱氧胆酸㊁牛磺石胆酸㊁牛磺脱氧胆酸㊁氧化三甲胺(TMAO)水平升高(见表1)ꎮ表1㊀MCI和AD患者的肠道菌群差异及其代谢产物变化情况研究对象肠道菌群肠道菌群代谢产物AD患者拟杆菌门见小球菌属[10]ꎬ假单胞菌科[11]厚壁菌门㊁放线菌门㊁双歧杆菌属[9]ꎬ毛螺旋菌科㊁拟杆菌属㊁乳梭菌属[10]甘氨石胆酸㊁脱氧胆酸㊁甘氨脱氧胆酸㊁牛磺石胆酸㊁牛磺脱氧胆酸[12]㊁TMAO[8]胆酸[12]㊀注: ꎬ未见报道1.2㊀肠道菌群影响AD的潜在机制㊀肠道微生物群主要通过免疫途径㊁内分泌途径㊁代谢途径等影响AD的进程ꎮ在免疫途径中主要调控免疫细胞活化ꎬ减轻或加重炎症ꎻ在内分泌途径中通过调节胰高血糖素样肽-1(GLP1)和单胺类神经递质的水平ꎻ在代谢途径中则是影响γ-氨基丁酸(GABA)㊁牛磺酸和色氨酸等氨基酸和短链脂肪酸(short-chainfattyacidsꎬSCFAs)的代谢ꎬ回调异常的肠道菌群结构ꎬ从而影响AD(见表2)ꎮ表2㊀肠道菌群影响AD的潜在机制主要途径研究对象作用机制内分泌途径海马CA1区注射Aβ1-42升高AD大鼠脑组织中去甲肾上腺素㊁多巴胺㊁5-羟色胺等单胺类神经递质水平[18]2㊀通过调节肠道菌群构成改善AD的中药中药成分众多ꎬ可通过多靶点㊁多途径干预肠道微生物构成而影响中枢神经系统(centralnervussys ̄temꎬCNS)ꎬ缓解中枢神经系统性疾病ꎬ研究表明部分中药㊁中药单体及中药复方可通过调控肠道菌群发挥改善AD的作用ꎮ2.1㊀中药单体㊀中药单体化合物主要通过调节肠道菌群的丰度ꎬ改善肠道菌群紊乱ꎬ减少脑内Aβ的含量ꎬ减缓AD的发生和发展(见表3)ꎮ2.2㊀单味中药㊀单味中药主要通过调节肠道菌群构成ꎬ增强胰岛素信号㊁减少神经炎症ꎬ减少Aβ沉积ꎬ改善AD的病理变化ꎮ受药物影响较大的差异菌群多隶属于厚壁菌门㊁拟杆菌门㊁变形菌门ꎬ见表4ꎮ2.3㊀中药复方㊀中药复方主要通过抑制炎症因子释放ꎬ减轻神经炎症ꎬ调控相关通路的级联反应ꎬ减少Aβ沉积ꎬ调节肠道菌群结构ꎬ改善ADꎮ中药复方作用后的差异菌群仍以厚壁菌门和拟杆菌门为主ꎬ放线菌门和变形菌门的数量增加ꎬ且出现新的差异菌群ꎬ如互养菌门㊁Pullicaecorum㊁黏液性细菌等(见表5)ꎮ表3 调控肠道菌群改善AD的中药单体分类药物名称研究对象研究样本作用机制药物作用后的差异菌群黄酮类+总皂苷淫羊藿苷+三七总皂苷[29]APP/PS1转基因小鼠海马㊁肠内容物调节肠道微生物分布及Oasl1㊁TCHP和MIPT3蛋白的表达乳酸杆菌科㊁双歧杆菌属㊁粘放线菌属㊁普雷沃氏菌属苷类人参皂苷Rg1[30]AD模型树鼩大脑㊁粪便减少Aβ产生㊁降低tau磷酸化水平㊁改善肠道微生物群失衡厚壁菌门㊁拟杆菌门㊁唾液乳酸杆菌文冠果壳苷[31]脑室注射Aβ1-42AD模型大鼠大脑㊁粪便㊁血浆调控肠道菌群结构及内源性代谢物厚壁菌门㊁拟杆菌门㊁红蝽杆菌属㊁梭菌第四簇ꎬ肠杆菌属㊁棒状杆菌㊁脱硫弧菌属㊁嗜热菌属㊁马氏甲烷球菌科㊁Azoarcus㊁Phyci ̄sphaera㊁醋酸杆菌属㊁拟普雷沃菌属红景天苷[32]SAMP8快速老化模型小鼠大脑㊁肠㊁粪便调节肠道微生物群组成ꎬ改善脑血屏障功能和抑制神经炎症刺激㊁调节外周循环Norank-f-Muribaculaceae㊁副萨特氏菌属㊁普雷沃氏菌科㊁拟普雷沃氏菌属㊁毛螺旋菌科NK4A136㊁Unclassified-f-Lachnospiraceae㊁Norank_f_Lachnospiraceae㊁另枝菌属㊁Odoribacter㊁理研菌科-RC9㊁瘤胃球菌科UCG-014㊁Ruminiclos ̄tridium-9多酚类姜黄素[33]APP/PS1转基因小鼠大脑㊁粪便改变AD的肠道菌群丰度拟杆菌科㊁普雷沃氏菌科㊁乳酸杆菌科㊁理研菌科㊁普雷沃氏菌属㊁拟杆菌属㊁副拟杆菌属生物碱药根碱[34]APP/PS1转基因小鼠大脑㊁粪便减少Aβ沉积㊁改善微生物群的丰度和多样性厚壁菌门㊁拟杆菌门㊁乳酸杆菌科㊁双歧杆菌属㊁嗜酸乳杆菌㊁粪便杆菌糖类菊粉[35]APOE4转基因模型小鼠粪便调节肠道菌群结构ꎬ增强代谢ꎬ减少海马体中炎症基因的表达乳酸杆菌属㊁普雷沃氏菌属㊁埃希氏杆菌属㊁绿脓杆菌属㊁阿克曼菌属巴戟天低聚糖[36]APP/PS1转基因小鼠大脑㊁粪便㊁小肠㊁血清下调细胞内AD标记物Aβ1-42的表达㊁减轻脑组织肿胀和神经元凋亡ꎬ调节肠道微生物群的组成和代谢拟杆菌门㊁厚壁菌门㊁双歧杆菌属㊁脱硫弧菌属㊁Roseburia㊁阿克曼菌属㊁乳杆菌属㊁拉克曼氏菌属㊁Blautia㊁毛螺旋菌科㊁瘤胃球菌科蛋白质人参蛋白[37]D-半乳糖/AlCl3联合诱导的AD模型小鼠海马㊁粪便调节肠道菌群㊁激活BDNF/p-TrkB信号通路拟普雷沃菌属㊁瘤胃球菌属-1㊁普雷沃氏菌科UCG-001萜类银杏内酯B[38]d-半乳糖和氯化铝诱导AD模型大脑㊁盲肠内容物减少Aβ沉积㊁抑制神经元凋亡ꎬ调节肠道生态失调厚壁菌门㊁拟杆菌门㊁拟杆菌目ꎬ乳酸杆菌科㊁鼠杆菌科㊁拟普雷沃表4㊀调控肠道菌群改善AD的单味中药药物名称作用功效研究对象研究样本作用机制药物作用后的差异菌群番杏[41]疏风清热㊁解毒消肿Aβ25-35的AD模型大鼠大脑㊁粪便增强海马胰岛素信号㊁降低胰岛素抵抗ꎬ改善肠道菌群丹毒杆菌目㊁脱硫弧菌目㊁肠杆菌目㊁拟杆菌目㊁乳杆菌目㊁梭菌属天麻[42]息风止痉㊁平抑肝阳㊁祛风通络d-半乳糖和氯化铝诱导AD模型小鼠大脑㊁粪便㊁血液调控肠道菌群结构ꎬ抑制p-tau蛋白的表达厚壁菌门㊁拟杆菌门㊁放线菌门㊁变形菌门㊁约氏乳杆菌㊁罗伊氏乳杆菌㊁鼠乳杆菌石菖蒲[43]开窍豁痰㊁醒神益智㊁化湿开胃APPswe/tauP301L/PS1M146V(3xTg-AD)小鼠盲肠和结肠内容物改善肠道菌群失调放线菌门㊁厚壁菌门㊁拟杆菌门㊁Olsenella㊁双歧杆菌属㊁Parvibacter㊁Enterorhabdu㊁脱硫弧菌属㊁嗜胆菌属㊁Turicibacter㊁孢子杆菌属㊁异杆菌属大黄[44]清热泻火㊁凉血解毒㊁逐瘀通经㊁利湿退黄APP/PS1转基因小鼠大脑㊁粪便作用于药物敏感菌㊁逆转与AD病理学指标相关的代谢物水平ꎬ改善小鼠认知障碍Norank-f-Ruminococcaceae㊁Marvin ̄bryantia㊁丹毒杆菌属㊁拟杆菌属连翘[45]清热解毒㊁消肿散结㊁疏散风热海马内注入Aβ25-35诱导的AD大脑㊁粪便增强海马胰岛素信号㊁减少氧化应激和神经炎症ꎬ调节肠道微生物群拟杆菌目㊁乳杆菌目㊁梭菌目表5㊀调控肠道菌群改善AD的中药复方药物名称作用功效研究对象研究样本作用机制药物作用后的差异菌群归脾汤[48]益气补血㊁健脾养心轻度AD患者粪便改变肠道菌群结构厚壁菌门㊁拟杆菌门㊁变形菌门㊁互养菌门㊁放线菌门加味黄连解毒汤[49]清热解毒侧脑室注射Aβ1-42诱导的AD模型小鼠大脑㊁粪便调控NMDA受体介导的谷氨酸能传递和腺苷/ATP酶/AMPK级联反应ꎬ调节肠道微生物群ꎬNMDA受体介导的谷氨酸能传递和腺苷Dorea㊁颤螺菌属㊁理研菌科㊁粘放线菌属㊁放线杆菌属解毒化瘀汤[50]清热解毒侧脑室注射寡聚化Aβ42AD模型小鼠大脑㊁肠调控NMDA/ATPase/AMPK信号通路厚壁菌门㊁拟杆菌门㊁变形菌门㊁Dorea佛手散[51]活血化瘀APP/PS1转基因小鼠大脑㊁粪便㊁血清调节碱性磷酸酶和肠道细菌ꎬ减轻与LPS相关的系统性炎症㊁氧化应激大肠杆菌㊁乳酸杆菌当归芍药散[52]调肝养血㊁健脾利湿APP/PS1转基因小鼠大脑㊁血清㊁肠内容物改变肠道菌群丰度ꎬ降低Aβ表达量㊁升高血清GABA浓度ꎬ改善学习记忆功能脱铁杆菌门㊁ε-变形菌纲㊁弯曲菌目㊁乳酸杆菌科㊁幽门螺杆菌属㊁黏液性细菌3㊀讨论由MCI发展至ADꎬ患者肠道菌群构成及其代谢产物发生明显改变ꎬ厚壁菌门/拟杆菌门的比值减小ꎬ与Aβ㊁Tau等蛋白水平正相关的菌群如肠杆菌科㊁莫吉杆菌科和假单胞菌科ꎬ及代谢产物如初级㊁次级胆酸和TMAO等增加ꎬ与认知功能正相关的拟杆菌属和毛螺旋菌属丰度减少ꎮ肠道微生物群主要由 微生物-肠-脑轴 介导与CNS进行双向㊁持续交流ꎬ通过免疫途径㊁内分泌途径㊁代谢途径影响AD进程ꎮ肠道菌群及其代谢紊乱可导致肠道屏障破坏和系统性炎症ꎬ引发系列免疫反应导致AD的发展[53]ꎮ通过调控免疫-内分泌系统ꎬ调节各种神经递质和神经调质的合成㊁释放ꎬ从而影响CNS功能ꎮ代谢组学研究发现ꎬAD患者粪便中色氨酸㊁短链脂肪酸和胆汁酸途径代谢失调ꎬ与肠道生态失调和认知障碍相关[21]ꎬ色氨酸可通过调节吲哚衍生物㊁犬尿氨酸途径和血清素合成来协调胃肠生理机能和CNS功能[54]ꎻ微生物来源的各种短链脂肪酸(SCFAs)是肠-脑轴的关键介质ꎬSCFAs诱导小胶质细胞成熟及调节小胶质细胞表型来促进Aβ沉积[19]ꎬAD患者肠道中产SCFAs的菌群比例显著降低[24ꎬ55]ꎮ中药单体的作用机制相对简单ꎬ主要通过减少Aβ沉积㊁降低Tau蛋白磷酸化水平ꎬ调节肠道菌群丰度来改善ADꎬ其中黄酮类成分还可以减少海马神经元损失㊁提高总SCFAs的浓度ꎮ单味中药作用机制较复杂ꎬ可以调节菌群紊乱ꎬ减少Aβ的形成并增加其清除ꎬ逆转AD病理学标志物和代谢物水平ꎬ增强海马胰岛素信号和学习记忆能力ꎬ减轻神经炎症ꎮ相较于中药单体和单味中药ꎬ改善AD的中药复方对肠道菌群构成的影响更为复杂ꎬ多味药共同发挥作用ꎬ其作用机制更全面㊁复杂ꎮ中药复方在中药单体和单味药的作用基础上ꎬ增加了调节激素受体水平和信号通路等作用ꎮ这也体现出中药通过多靶点㊁多途径发挥作用的特点ꎮ目前对中药调控肠道菌群改善AD的研究ꎬ还停留在分析中药影响肠道微生物的种类和代谢物的层面ꎬ中药㊁肠道菌群和AD三者之间的相互关系尚未明确ꎬ且多数研究还停留在动物模型阶段ꎮ由于实验动物与人之间的物种差异性ꎬ动物实验的结果说服力不强ꎬ还需开展更多临床实验研究加以验证ꎮ后续研究应着重于探讨中药与菌群之间的作用关系ꎬ鉴别对药物敏感的菌群及与AD相关的菌群及其代谢标记物ꎬ并加以验证ꎬ明确中药调控肠道菌群改善AD的作用机制ꎮ参考文献:[1]㊀JACKCRJRꎬBENNETTDAꎬBLENNOWKꎬetal.NIA-AAResearchFramework:TowardabiologicaldefinitionofAlzheimerᶄsdisease[J].AlzheimersDementꎬ2018ꎬ14(4):535-562.[2]刘彩燕ꎬ高晶.阿尔茨海默病的生物学定义对神经心理学提出的挑战[J].中国医刊ꎬ2020ꎬ55(8):816-819.[3]FANGPꎬKAZMISAꎬJAMESONKGꎬetal.TheMicrobi ̄omeasaModifierofNeurodegenerativeDiseaseRisk[J].CellHostMicrobeꎬ2020ꎬ28(2):201-222.[4]WUXMꎬTANRX.Interactionbetweengutmicrobiotaandethnomedicineconstituents[J].NatProdRepꎬ2019ꎬ36(5):788-809.[5]SCHOTTJMꎬPETERSENRC.NewcriteriaforAlzheimerᶄsdisease:whichꎬwhenandwhy?[J].Brainꎬ2015ꎬ138(Pt5):1134-1137.[6]NAGPALRꎬNETHBJꎬWANGSꎬetal.ModifiedMedi ̄terranean-ketogenicdietmodulatesgutmicrobiomeandshort-chainfattyacidsinassociationwithAlzheimerᶄsdiseasemarkersinsubjectswithmildcognitiveimpairment[J].EBioMedicineꎬ2019(47):529-542. [7]GUOMꎬPENGJꎬHUANGXꎬetal.GutMicrobiomeFea ̄turesofChinesePatientsNewlyDiagnosedwithAlzheimerᶄsDiseaseorMildCognitiveImpairment[J].JAlzheimersDisꎬ2021ꎬ80(1):299-310.[8]VOGTNMꎬROMANOKAꎬDARSTBFꎬetal.Thegutmicrobiota-derivedmetabolitetrimethylamineN-oxideiselevatedinAlzheimerᶄsdisease[J].AlzheimersResTherꎬ2018ꎬ10(1):124.[9]VOGTNMꎬKERBYRLꎬDILL-MCFARLANDKAꎬetal.GutmicrobiomealterationsinAlzheimerᶄsdisease[J].SciRepꎬ2017ꎬ7(1):13537.[10]ZHUANGZQꎬSHENLLꎬLIWWꎬetal.GutMicrobiotaisAlteredinPatientswithAlzheimerᶄsDisease[J].JAlzheimersDisꎬ2018ꎬ63(4):1337-1346.[11]XIJꎬDINGDꎬZHUHꎬetal.DisturbedmicrobialecologyinAlzheimerᶄsdisease:evidencefromthegutmicrobiotaandfecalmetabolome[J].BMCMicrobiolꎬ2021ꎬ21(1):226.[12]MAHMOUDIANDEHKORDISꎬARNOLDMꎬNHOKꎬetal.AlteredbileacidprofileassociateswithcognitiveimpairmentinAlzheimerᶄsdisease-Anemergingroleforgutmicrobiome[J].AlzheimersDementꎬ2019ꎬ15(1):76-92.[13]SHENHꎬGUANQꎬZHANGXꎬetal.NewmechanismofneuroinflammationinAlzheimerᶄsdisease:TheactivationofNLRP3inflammasomemediatedbygutmicrobiota[J].ProgNeuropsychopharmacolBiolPsychiatryꎬ2020(100):109884.[14]SHUKLAPKꎬDELOTTERIEDFꎬXIAOJꎬetal.Altera ̄tionsintheGut-Microbial-Inflammasome-BrainAxisinaMouseModelofAlzheimerᶄsDisease[J].Cellsꎬ2021ꎬ10(4):779.[15]LEEHJꎬHWANGYHꎬKIMDH.LactobacillusplantarumC29-FermentedSoybean(DW2009)AlleviatesMemoryIm ̄pairmentin5XFADTransgenicMicebyRegulatingMicrogliaActivationandGutMicrobiotaComposition[J].MolNutrFoodResꎬ2018ꎬ62(20):e1800359.[16]KIMMSꎬKIMYꎬCHOIHꎬetal.Transferofahealthymicro ̄biotareducesamyloidandtaupathologyinanAlzheimerᶄsdiseaseanimalmodel[J].Gutꎬ2020ꎬ69(2):283-294. [17]SUNJꎬLIUSꎬLINGZꎬetal.FructooligosaccharidesAmel ̄ioratingCognitiveDeficitsandNeurodegenerationinAPP/PS1TransgenicMicethroughModulatingGutMi ̄crobiota[J].JAgricFoodChemꎬ2019ꎬ67(10):3006-3017.[18]CHENDꎬYANGXꎬYANGJꎬetal.PrebioticEffectofFructooligosaccharidesfromMorindaofficinalisonAlzhei ̄merᶄsDiseaseinRodentModelsbyTargetingtheMicrobi ̄ota-Gut-BrainAxis[J].FrontAgingNeurosciꎬ2017(9):403.[19]COLOMBOAVꎬSADLERRKꎬLLOVERAGꎬetal.Mi ̄crobiota-derivedshortchainfattyacidsmodulatemicrogliaandpromoteAbetaplaquedeposition[J].Elifeꎬ2021(10):e59826.[20]HOLꎬONOKꎬTSUJIMꎬetal.ProtectiverolesofintestinalmicrobiotaderivedshortchainfattyacidsinAlzheimerᶄsdis ̄ease-typebeta-amyloidneuropathologicalmechanisms[J].ExpertRevNeurotherꎬ2018ꎬ18(1):83-90.[21]WANGQJꎬSHENYEꎬWANGXꎬetal.Concomitantme ̄mantineandLactobacillusplantarumtreatmentattenuatescognitiveimpairmentsinAPP/PS1mice[J].Aging(AlbanyNY)ꎬ2020ꎬ12(1):628-649.[22]SUNJꎬXUJꎬYANGBꎬetal.EffectofClostridiumbutyri ̄cumagainstMicroglia-MediatedNeuroinflammationinAlzheimerᶄsDiseaseviaRegulatingGutMicrobiotaandMetabolitesButyrate[J].MolNutrFoodResꎬ2020ꎬ64(2):e1900636.[23]FUJIIYꎬNGUYENTTTꎬFUJIMURAYꎬetal.Fecalme ̄taboliteofagnotobioticmousetransplantedwithgutmi ̄crobiotafromapatientwithAlzheimerᶄsdisease[J].BiosciBiotechnolBiochemꎬ2019ꎬ83(11):2144-2152. [24]LEBLHUBERFꎬSTEINERKꎬSCHUETZBꎬetal.ProbioticSupplementationinPatientswithAlzheimerᶄsDementia-AnExplorativeInterventionStudy[J].CurrAlzheimerResꎬ2018ꎬ15(12):1106-1113.[25]SHENLꎬLIULꎬLIXYꎬetal.RegulationofgutmicrobiotainAlzheimerᶄsdiseasemicebysilibininandsilymarinandtheirpharmacologicalimplications[J].ApplMicrobiolBiotechnolꎬ2019ꎬ103(17):7141-7149. [26]XUMꎬHUANGHꎬMOXꎬetal.Quercetin-3-O-Glucu ̄ronideAlleviatesCognitiveDeficitandToxicityinAbeta1-42-InducedAD-LikeMiceandSH-SY5YCells[J].MolNutrFoodResꎬ2021ꎬ65(6):e2000660.[27]YANGSꎬZHOUHꎬWANGGꎬetal.Quercetinisprotectiveagainstshort-termdietaryadvancedglycationendproductsintakeinducedcognitivedysfunctioninagedICRmice[J].JFoodBiochemꎬ2020ꎬ44(4):e13164. [28]ZHANGZꎬTANXꎬSUNXꎬetal.IsoorientinAffectsMark ̄ersofAlzheimerᶄsDiseaseviaEffectsontheOralandGutMicrobiotainAPP/PS1Mice[J].JNutrꎬ2022ꎬ152(1):140-152.[29]ZHANGTꎬDONGKꎬXIAOLꎬetal.EffectsofCo-Admin ̄istrationofIcariinandPanaxnotoginsengSaponinsonIn ̄testinalMicrobiotaandHippocampalProteinExpressioninaMouseModelofAlzheimerᶄsDisease[J].Neuropsy ̄chiatrDisTreatꎬ2020(16):2169-2179.[30]GUOYꎬWANGLꎬLUJꎬetal.GinsenosideRg1improvescognitivecapabilityandaffectsthemicrobiotaoflargein ̄testineoftreeshrewmodelforAlzheimerᶄsdisease[J].MolMedRepꎬ2021ꎬ23(4):291.[31]ZHOUHꎬTAIJꎬXUHꎬetal.XanthocerasideCouldAmel ̄iorateAlzheimerᶄsDiseaseSymptomsofRatsbyAffectingtheGutMicrobiotaCompositionandModulatingtheEn ̄dogenousMetaboliteLevels[J].FrontPharmacolꎬ2019(10):1035.[32]XIEZꎬLUHꎬYANGSꎬetal.SalidrosideAttenuatesCog ̄nitiveDysfunctioninSenescence-AcceleratedMouseProne8(SAMP8)MiceandModulatesInflammationoftheGut-BrainAxis[J].FrontPharmacolꎬ2020(11):568423.[33]SUNZZꎬLIXYꎬWANGSꎬetal.BidirectionalinteractionsbetweencurcuminandgutmicrobiotaintransgenicmicewithAlzheimerᶄsdisease[J].ApplMicro ̄biolBiotechnolꎬ2020ꎬ104(8):3507-3515.[34]WANGSꎬJIANGWꎬOUYANGTꎬetal.JatrorrhizineBal ̄ancestheGutMicrobiotaandReversesLearningandMemoryDeficitsinAPP/PS1transgenicmice[J].SciRepꎬ2019ꎬ9(1):19575.[35]HOFFMANJDꎬYANCKELLOLMꎬCHLIPALAGꎬetal.DietaryinulinaltersthegutmicrobiomeꎬenhancessystemicmetabolismandreducesneuroinflammationinanAPOE4mousemodel[J].PLoSOneꎬ2019ꎬ14(8):e0221828.[36]YANGXꎬCHENDLꎬYANGJꎬetal.EffectsofOligosac ̄charidesFromMorindaofficinalisonGutMicrobiotaandMetabolomeofAPP/PS1TransgenicMice[J].FrontNeu ̄rolꎬ2018(9):412.[37]李昶ꎬ雷天荣ꎬ王思明ꎬ等.人参蛋白对阿尔茨海默病小鼠肠道菌群及BDNF/TrkB信号通路的影响[J].中成药ꎬ2023ꎬ45(4):1319-1323.[38]LIUJꎬYETꎬZHANGYꎬetal.ProtectiveEffectofGinkgolideBagainstCognitiveImpairmentinMiceviaRegulationofGutMicrobiota[J].JAgricFoodChemꎬ2021ꎬ69(41):12230-12240.[39]WENGMHꎬCHENSYꎬLIZYꎬetal.Camelliaoilallevi ̄atestheprogressionofAlzheimerᶄsdiseaseinaluminumchloride-treatedrats[J].FreeRadicBiolMedꎬ2020(152):411-421.[40]李鑫洁ꎬ陈建新ꎬ鲁艺.锁阳乙酸乙酯提取物对阿尔茨海默病小鼠肠道菌群紊乱的调节作用[J].中医学报ꎬ2022ꎬ37(1):126-134.[41]KIMDSꎬKOBSꎬRYUKJAꎬetal.Tetragoniatetrago ̄nioidesProtectedagainstMemoryDysfunctionbyElevatingHippocampalAmyloid-betaDepositionthroughPotentiatingInsulinSignalingandAlteringGutMicrobiomeComposition[J].IntJMolSciꎬ2020ꎬ21(8):2900.[42]赵文斌.天麻及其有效物质对阿尔兹海默症模型小鼠的作用机制研究[D].兰州:兰州大学ꎬ2019.[43]林路宁ꎬ姬丽婷ꎬ傅云波ꎬ等.石菖蒲水提物对3xTg-AD小鼠肠道菌群的影响[J].浙江中医杂志ꎬ2020ꎬ55(7):471-474.[44]GAODꎬZHAOHꎬYINZꎬetal.RheumtanguticumAllevi ̄atesCognitiveImpairmentinAPP/PS1MicebyRegulatingDrug-ResponsiveBacteriaandTheirCorre ̄spondingMicrobialMetabolites[J].FrontPharmacolꎬ2021(12):766120.[45]KIMDSꎬZHANGTꎬPARKS.ProtectiveeffectsofFor ̄sythiaefructusandCassiaesemenwaterextractagainstmemorydeficitsthroughthegut-microbiome-brainaxisinanAlzheimerᶄsdiseasemodel[J].PharmBiolꎬ2022ꎬ60(1):212-224.[46]SUNYꎬLIUZꎬPIZꎬetal.Poriacocoscouldamelioratecog ̄nitivedysfunctioninAPP/PS1micebyrestoringimbalanceofAbetaproductionandclearanceandgutmicrobiotadysbi ̄osis[J].PhytotherResꎬ2021ꎬ35(5):2678-2690.[47]许青ꎬ赵晓芹ꎬ刘彦君ꎬ等.基于 心与小肠相表里 探讨回肠菌群在七圣丸抗阿尔茨海默病中的变化[J].中国实验方剂学杂志ꎬ2022ꎬ28(4):9-18.[48]姜洋ꎬ王燕萍ꎬ刘雪珍ꎬ等.基于高通量测序技术研究归脾汤对心脾两虚型轻度阿尔茨海默病患者肠道菌群多样性的影响[J].新中医ꎬ2021ꎬ53(1):17-22. [49]LIUYꎬDUTꎬZHANGWꎬetal.ModifiedHuang-Lian-Jie-DuDecoctionAmelioratesAbetaSynaptotoxicityinaMurineModelofAlzheimerᶄsDisease[J].OxidMedCellLongevꎬ2019(2019):8340192.[50]张云龙ꎬ刘妍ꎬ徐评议ꎬ等.基于调控脑肠轴探索解毒化瘀汤改善阿尔茨海默病小鼠认知功能的机制[J].中国药理学与毒理学杂志ꎬ2019ꎬ33(9):672.[51]LUJꎬGUOPꎬLIUXꎬetal.HerbalFormulaFoShouSanAttenuatesAlzheimerᶄsDisease-RelatedPathologiesviatheGut-Liver-BrainAxisinAPP/PS1MouseModelofAlzheimerᶄsDisease[J].EvidBasedComplementAlternatMedꎬ2019(2019):8302950.[52]杨玉芳.当归芍药散对APP/PSN阿尔茨海默病模型小鼠肠道菌群的影响及分子机制[D].芜湖:皖南医学院ꎬ2019.[53]KOWALSKIKꎬMULAKA.Brain-Gut-MicrobiotaAxisinAlzheimerᶄsDisease[J].JNeurogastroenterolMotilꎬ2019ꎬ25(1):48-60.[54]MANꎬHETꎬJOHNSTONLJꎬetal.Host-microbiomein ̄teractions:thearylhydrocarbonreceptorasacriticalnodeintryptophanmetabolitestobrainsignaling[J].GutMi ̄crobesꎬ2020ꎬ11(5):1203-1219.[55]ZHOUYꎬWANGYꎬQUANMꎬetal.GutMicrobiotaChangesandTheirCorrelationwithCognitiveandNeuro ̄psychiatricSymptomsinAlzheimerᶄsDisease[J].JAlzhe ̄imersDisꎬ2021ꎬ81(2):583-595.(收稿日期:2023-06-25)(上接第39页)[9]㊀SHANXZꎬZHAOZQꎬWANGCꎬetal.EmergingProdrug-EngineerednanomedicinesforsynergisticChemo-Photo ̄therapy[J].ChemEngJꎬ2022(442):136383.[10]YUYMꎬBUFZꎬLIULꎬetal.Anovelsustained-releaseformulationof5-fluorouracil-phenylalaninecocrystalself-assembledbycocrystal-entrappedmicellestrategydis ̄playsenhancedantitumorefficacy[J].JMolLiqꎬ2022(368):120665.[11]ZALBASꎬTENHAGENTLMꎬBURGUICꎬetal.Stealthnanoparticlesinoncology:FacingthePEGdilemma[J].JControlReleaseꎬ2022(351):22-36.[12]YANHXꎬDUXYꎬWANGRJꎬetal.ProgressinthestudyofD-α-tocopherolpolyethyleneglycol1000succi ̄nate(TPGS)reversingmultidrugresistance[J].ColloidsSurfBBiointerfacesꎬ2021(205):111914.[13]ZHANGZQꎬLIANꎬMINXQꎬetal.AnROS-sensitivetegafur-PpIX-heterodimer-loadedinsituinjectablether ̄mosensitivehydrogelforphotodynamictherapycombinedwithchemotherapytoenhancethetegafur-basedtreatmentofbreastcancer[J].BiomaterSciꎬ2021ꎬ9(1):221-237. [14]ENGELDꎬNUDELMANAꎬTARASENKONꎬetal.NovelprodrugsoftegafurthatdisplayimprovedanticanceractivityandAntiangiogenicproperties[J].JMedChemꎬ2008ꎬ51(2):314-323.(收稿日期:2023-05-09)。
肠道菌群在炎症相关肠癌中的研究进展

肠道菌群在炎症相关肠癌中的研究进展孔宪斌1,王方园1,彭莹莹1,郭玉珠2,孟静岩1△摘要:炎症相关肠癌(CAC)是世界医学难题,肿瘤微环境是目前研究的热点,肠道菌群失调与CAC的发病密切相关,肠道菌群失调加重结肠炎诱导CAC的发生。
随着微生态学的发展,肠道菌群在CAC研究中备受关注。
本文概述了CAC发生过程中肠道菌群与饮食、炎症机制、肠黏膜的关系以及在诊断、治疗中相关研究,重点讨论了肠道菌群可能成为CAC作用机制的新靶点和相关应用前景。
关键词:炎症;肠肿瘤;饮食习惯;诊断;治疗;综述;炎症相关肠癌中图分类号:R735.3文献标志码:A DOI:10.11958/20181639Research progress of intestinal flora in colitis associated cancerKONG Xian-bin1,WANG Fang-yuan1,PENG Ying-ying1,GUO Yu-zhu2,MENG Jing-yan1△1Tianjin University of Traditional Chinese Medicine,Tianjin301617,China;2Tianjin Hospital△Corresponding Author E-mail:mengjy@Abstract:Colitis associated cancer(CAC)is a worldwide medical problem.Tumor microenvironment is the hot spot of基金项目:天津市自然科学基金资助项目(18JCZDJC36600)作者单位:1天津中医药大学(邮编301617);2天津市天津医院作者简介:孔宪斌(1989),男,博士在读,主要从事肠道肿瘤方面研究△通讯作者E-mail:mengjy@[20]Gobbi A,Espregueira-Mendes J,Lane JG,et al.Bio-Orthopaedics: A new approach[M].Springer:Berlin/Heidelberg,Germnay,2017:87-103.ISBN:978-3-662-54180-7.[21]Sawatjui N,Limpaiboon T,Schrobback K,et al.Biomimetic scaffolds and dynamic compression enhance the properties of chondrocyte and MSC-based tissue-engineered cartilage[J].J Tissue Eng Regen Med,2018,12(5):1220-1229.doi:10.1002/ term.2653.[22]Peruzynska M,Cendrowski K,Barylak M,et parative in vitro study of single and four layer graphene oxide nanoflake-Cytotoxicity and cellular uptake[J].Toxicol In Vitro,2017,41:205-213.doi:10.1016/j.tiv.2017.03.005.[23]Tonelli FM,Goulart VA,Gomes KN,et al.Graphene based nanomaterials:biological and medical applications and toxicity[J]. Nanomedicine,2015,10(15):2423-2450.doi:10.2217/nnm.15.65.[24]魏丽君,曹均凯,李俊杰,等.低聚乙二醇富马酸酯/氧化石墨烯复合水凝胶对大鼠骨髓间充质干细胞成骨分化的调控作用[J].解放军医学院学报,2016,37(6):611-616,633.Wei LJ,Cao JK,Li JJ,et al.Effects of oligo[poly(ethylene glycol)fumarate]/ graphene oxide on osteogenic differentiation of bone marrow mesenchymal stem cells in rats[J].Academic Journal of Chinese PLA Medical School,2016,37(6):611-616,633.doi:10.3969/j. issn.2095-5227.2016.06.023.[25]Wang W,Caetano GF,Chiang WH,et al.Morphological,mechanical and biological assessment of PCL/pristine graphene scaffolds for bone regeneration[J].Int J Bioprint,2016,2(2):204-213.doi:10.18063/IJB.2016.02.009.[26]Shen H,Lin H,Sun AX,et al.Chondroinductive factor free chondrogenic differentiation of human mesenchymal stem cells in graphene oxide-incorporated hydrogels[J].J Mater Chem B,2018,6(6):908-917.doi:10.1039/C7TB02172K.[27]Zhou X,Nowicki M,Cui H,et al.3D bioprinted graphene oxide-incorporated matrix for promoting chondrogenic differentiation of human bone marrow mesenchymal stem cells[J].Carbon,2017,116:615-624.doi:10.1016/j.carbon.2017.02.049.[28]Nalvuran H,Elçin AE,Elçin YM.Nanofibrous silk fibroin/reduced graphene oxide scaffolds for tissue engineering and cell culture applications[J].Int J Biol Macromol,2018,114(15):77-84.doi: 10.1016/j.ijbiomac.2018.03.072.[29]Saxby DJ,Lloyd DG.Osteoarthritis year in review2016:mechanics [J].Osteoarthritis Cartilage,2017,25(2):190-198.doi:10.1016/j. joca.2016.09.023.[30]Heckelsmiller DJ,James RM,Baer TE,et al.Changes in joint contact mechanics in a large quadrupedal animal model after partial meniscectomy and a focal cartilage injury[J].J Biomech Eng,2017,139(5):54501.doi:10.1115/1.4036148.[31]Li D,Liu T,Yu X,et al.Fabrication of graphene-biomacromolecule hybrid materials for tissue engineering application[J].Polym Chem-Uk,2017,8(30):4309-4321.doi:10.1039/C7PY00935F.(2018-09-11收稿2018-10-30修回)(本文编辑陆荣展)综述最新全球癌症统计报告指出,2018年全球新增1810万癌症病例,结直肠癌(Colorectal carcinoma,CRC)发病率排名第4,死亡率排名第2[1]。
肠道菌群失调与慢性肾脏病关系研究

肠道菌群失调与慢性肾脏病关系研究
李姗姗;孙倩;杨少宁;于小勇
【期刊名称】《现代中医药》
【年(卷),期】2022(42)3
【摘要】近年来,慢性肾脏病(chronic kidney disease,CKD)越来越成为全球性的
公共健康问题,在中国乃至全世界范围内的疾病负担逐渐加重。
现代很多研究证实,
肠道菌群失调与很多疾病都存在相关性,肠道菌群失调与慢性肾脏病的关系也成为
研究的热点。
CKD患者由于尿毒症毒素在体内的蓄积,改变了肠道菌群的结构和组成,破坏了肠道上皮的屏障功能,激活了肠道的免疫调节功能,使得细菌和毒素等有害物质入血,诱导全身性的病变,最终损害肾脏,形成恶性循环。
而益生菌等微生态制剂、粪菌移植、中医药等干预手段通过稳定肠道菌群,修复肠道上皮黏膜的屏障功能,减
少肠源性尿毒素的蓄积,延缓CKD进展,发挥肾脏保护的作用。
因此,调节肠道菌群
紊乱可能作为防治CKD的新靶点。
【总页数】6页(P16-21)
【作者】李姗姗;孙倩;杨少宁;于小勇
【作者单位】陕西中医药大学;陕西省中医医院
【正文语种】中文
【中图分类】R265.5
【相关文献】
1.肠道微生态及肠道菌群失调与肠易激综合征关系的现状研究
2.高热量饮食诱导的肠道菌群失调与认知功能障碍关系的研究进展
3.慢性肾脏病菌群失调与肌少症的关系研究进展
4.基于RANKL/RANK/OPG通路研究绝经后老年骨质疏松患者骨代谢与肠道菌群失调的关系
5.2型糖尿病患者肠道菌群失调与其并发症关系的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东医药 2016 年第 56 卷第 1 期 达水平下降, 其下游的适应性免疫功能降低, 影响外 周免疫器官的正常功能, 从而导致机体免疫功能下 降。Brugman 等 通过对Ⅰ型糖尿病易感大鼠的研 究表明, 自发性糖尿病倾向大鼠中患病大鼠肠道拟 杆菌属数量明显高于未患病大鼠, 抗生素预处理能 够降低易感小鼠Ⅰ型糖尿病的发病率。提示肠道菌 群参与了Ⅰ型糖尿病的发生发展, 合理使用抗生素 可以影响肠道菌群的数量及分布, 并干预了相关免 疫性疾病的发生, 这为糖尿病的防治提供了新思路 和新策略。 2. 2 脑肠轴参与的肠道菌群失调 脑肠轴的微生 物轴包括中枢神经系统、 自主神经系统、 肠神经系
就会导致肠道菌群失衡, 进而引发疾病。 导致肠道 菌群失调的原因很多, 主要有饮食改变、 疾病及抗生 素的使用等。其中, 临床上最常见的原因是抗生素 的不合理使用, 尤其是广谱抗生素的长期应用。 刘 崇海等 选用临床上常用的头孢菌素类抗生素处 建立了肠道菌群失调动物模型, 并经口灌 加 重 菌 群 失 调。 研 究 证 实 了 Toll 样受体( TLR) 是天然免疫中的重要模式识别受 体, 经逐级信号传导过程参与抗感染的炎症过程 。 TLR 基因表 当肠道正常菌群受到抗生素的影响后, 99
基金项目: 辽宁省教育厅科学基金项目 ( L2012325 ) 。 mail: changdlmedu@ gmail. com) 通信作者: 吴大畅 ( E-
[15 ]
将导致肠道内微生态环境紊乱, 进而导致全身免疫 1 受体起到抑制免疫系统的功 系统过度活跃。 PD能, 其受体缺失, 免疫系统会出现过激反应, 最终导 致自体免疫疾病, 如糖尿病、 自身免疫性脑脊髓炎、 HIV 感染等。 受 淋巴细胞脉络丛脑膜炎病毒感染、 此影响, 肠道菌群的构成亦会发生明显变化 , 主要益 生菌如双歧杆菌减少到可检测下限, 而通常情况下 数量较少的有害肠杆菌属细菌数量却增加至原有的 400 倍左右。另有实验表明, PD1 受体缺失实验鼠 体内产生炎症细胞因子的辅助性 T 细胞的数量增 加到原来的 4 倍, 通常只存在于肠道内的肠道细菌 抗体在血液中也被检测出来。 由此, 研究人员得出 以下结论: 肠道内微生态环境紊乱可导致全身免疫 系统过度活跃, 进而有可能出现自体免疫性疾病等 病态改变。 3. 2 肥胖 肥胖是一种全身低度炎症性疾病。 目 前, 研究者普遍认为肠道菌群在能量代谢过程中起 100
胞的数量也逐渐增加。 1. 2 肠道菌群参与的黏膜免疫反应
肠道黏膜免 疫反应主要依靠肠腔内黏膜表面的免疫球蛋白 ( sI-
gA 为主 ) 和淋巴细胞为主的免疫活性细胞, 共同完 [4 ] 成肠道的局部免疫功能, 其主要功能有 : ① 阻断 细菌对黏膜的黏附, 使其不能形成集落, 达到排斥细 菌的目的; ② 中和病毒作用; ③ 中和毒素作用; ④ 对以异物形式摄入和从空气中吸入的某些抗原物质 具有封闭作用, 使外来抗原游离于黏膜表面, 不致进 入机体, 避免引起全身性免疫反应; ⑤ 激活补体的 C3 旁路途径, 参与补体和溶菌酶协同抗菌作用; ⑥ 阻止机体对肠腔内共栖的正常菌群产生免疫应答 。 由此推测, 肠黏膜免疫屏障的损害可能与肠外细菌 、 内毒素移位及诱导全身过度、 失控、 自毁的炎症性反 应密切相关。 2 2. 1 肠道菌群失调 抗生素诱导的肠道菌群失调 正常生理状态 , 下 肠道菌群与机体处于动态平衡状态 , 但当正常菌 、 群受到来自于机体内外的理化 生物因素的刺激时,
[7 ]
“代谢性内毒素血症 ” 用的 假说, 用以解释肥胖症患 者体内长期低水平全身性炎症反应状态 : 饮食诱导 肠道菌群改变, 机会致病菌数量增加, 肠屏障保护菌 数量下降, 导致肠道通透性增强, 入血内毒素量增 加, 引发慢性炎症反应, 进而产生肥胖等代谢失调。 3. 3 2 型糖尿病 2 型糖尿病是一种以肥胖诱导 的胰岛素抵抗为基础的代谢性疾病 。近来的研究显 示, 人体肠道微生物组与肥胖的发生发展 、 心血管疾 病和代谢综合征( 如 2 型糖尿病 ) 有着密切的联系。 [13 ] 黄旭东等 通过对 30 例 2 型糖尿病患者粪便的研 究发现: 该类患者肠杆菌科的数量明显增加 , 而双歧 杆菌和拟杆菌的数量显著下降; 这种现象同样出现 在空腹血糖大于 11. 1 mmoL / L 的患者中, 且变化较 空腹血糖小于 9. 0 mmoL / L 的人群更加显著。 这充 分证明了 2 型糖尿病与肠道菌群失调有着紧密的联 [14 ] 系, 并与血糖水平呈现一定相关性。 韦婷等 的研 Leper 突变的 2 型糖尿病模型会导致肠道菌 究显示, 群的改变, 并且证实了乳杆菌属和糖尿病的血糖变 化呈负相关。 Vrieze 等 也报道了糖尿病患者肠 糖诱发胰岛素的 道双歧杆菌数量降低, 糖耐量受损、 分泌不足, 增加毒素血症的发生率。 若肠道菌群长 期处于失衡状态, 长期高脂肪、 低膳食纤维导致肠道 内病原菌数量增加, 相应的病菌抗原亦增加, 有益菌 , 数量减少 取而代之的是有害菌产生的内毒素破坏 肠道黏膜, 使得肠道通透性增加, 内毒素入血; 免疫 系统因感染而分泌炎症因子, 最终炎症因子会散布 全身, 导致慢性病, 加速衰老等, 这也符合 Cani 提出 [12 ] “代谢性内毒素血症” 的 假说 。 3. 4 肠癌 具核梭杆菌是一种革兰阴性口腔共生
山东医药 2016 年第 56 卷第 1 期
肠道菌群失调及其相关疾病研究进展
杨泽冉, 辛毅, 侯洁, 曹雪姣, 吴大畅 ( 大连医科大学, 辽宁大连 116044 )
摘要: 肠道正常菌群参与机体的物质代谢 , 营养物质的吸收合成, 并能够促进生长发育, 维持人体正常生理活 动, 其对胃肠道消化和免疫作用的发挥与肠杆菌 、 肠球菌、 类杆菌和乳杆菌的关系密不可分 。 肠道黏膜免疫反应主 要依靠肠腔内黏膜表面的免疫球蛋白 ( sIgA 为主) 和淋巴细胞为主体的免疫活性细胞 , 共同完成肠道局部免疫 。 抗 2型 生素的使用可诱导肠道菌群失调 , 脑 - 肠轴参与了肠道菌群失调 , 其不仅可引起全身免疫疾病 , 还能导致肥胖、 糖尿病及肠癌。 关键词: 肠道菌群; 菌群失调; 肥胖; 2 型糖尿病; 肠肿瘤 doi: 10. 3969 / j. issn. 1002266X. 2016. 01. 039 中图分类号: R378 文献标志码: A 266X( 2016 ) 01009903 文章编号: 1002-
山东医药 2016 年第 56 卷第 1 期 菌, 是牙周炎主要致病菌。 在口腔乃至全身感染性 疾病中检出率极高, 与临床厌氧菌感染关系密切。 加拿大学者 Holtmeier 等
[16 ]
gut microbiota and the immune system[ J] . Gut Microbes, 2014 , 5 ( 3 ) : 411418. [ 5] 刘崇海, 刘恩梅, 等. 抗生素诱导小鼠肠道菌群失调对 杨锡强, 4 基因表达的影响[J] . 重庆医科大 免疫功能和 Toll 样受体 2 、 2007 , 32 ( 8 ) : 839842. 学学报, [ 6] Brugman S, Klatter FA, Visser JT, et al. Antibiotic treatment partially protects against type 1 diabetes in the BioBreeding diabetesprone rat. Is the gut flora involved in the development of type 1 diabetes[ J] . Diabetologia, 2006 , 49 ( 9 ) : 20152018. [ 7] 付蕾, 郑鹏远, 等. 双歧杆菌对应激大鼠肠道菌群及促 冀建伟, . 世 界 华 人 消 化 杂 志, 肾上腺皮质 激 素 释 放 激 素 的 影 响[J] 2010 , 18 ( 15 ) : 15441549. [ 8] Keir ME,Freeman GJ,Sharpe AH,et al. PD1 regulates selfreactive CD8 + T cell responses to antigen in lymph nodes and tissues [ J] . J Immunol, 2007 , 179 ( 8 ) : 50645070. [ 9] Collins KH,Paul HA,Reimer RA,et al. Relationship between inflammation,the gut microbiota,and metabolic osteoarthritis development: studies in a rat model[J] . Osteoarthritis Cartilage, 2015 , 23 ( 11 ) : 19891998. [ 10] Shen J, Obin MS, Zhao L. The gut microbiota, obesity and insulin resistance[ J] . Mol Aspects Med, 2013 , 34 ( 1 ) : 3958. [ 11] Besten G,van Eunen K,Groen AK,et al. The role of shortchain fatty acids in the interplay between diet ,gut microbiota,and host energy metabolism[ J] . J Lipid Res, 2013 , 54 ( 9 ) : 23252340. [ 12] Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance[J] . Diabetes,2007 , 56 ( 7 ) : 17611772. [ 13] 黄旭东, 郑赵利, 等. 2 型糖尿病患者肠道菌群的研究 郑晓鹏, [ J] . 河北医学, 2011 , 17 ( 8 ) : 10411043. DB 小鼠的小肠菌群结 [ 14] 韦婷, 等. 2 型糖尿病 BKS胡芳, 张红琳, J] . 生命科学研究, 2012 , 16 ( 6 ) : 483488. 构差异性分析[ [ 15] Vrieze A,Holleman F,Zoetendal EG,et al. The environment within now gut microbiota may influence metabolism and body composition[ J] . Diabetologia, 2010 , 53 ( 4 ) : 606613. [ 16] Holtmeier W, Kller J, Geisel W, et al. Development and compartmentalization of the porcine TCR delta repertoire at mucosal and extraintestinal sites: the pig as a model for analyzing the effects of age and microbial factors[J] . J Immunol,2002 , 169 ( 4 ) : 19932002. [ 17] Appleyard CB ,Cruz ML,Isidro AA,et al. Pretreatment with the probiotic VSL3 delays transition from inflammation to dysplasia in a rat model of colitisassociated cancer[ J] . Am J Physiol Gastrointest Liver Physiol, 2011 , 301 ( 6 ) : G1004G1013. [ 18] Zhang JW,Du P,Gao J,et al. Preoperative probiotics decrease postoperative infectious complications of colorectal cancer[ J]. Am J Med Sci, 2012 , 43 ( 3 ) : 199205. 0206 ) ( 收稿日期: 2014-
