片剂、胶囊、颗粒剂生产记录
022-00片剂、颗粒剂、胶囊剂制粒、干燥岗位SOP

片剂、颗粒剂、胶囊剂制粒、干燥岗位SOP1目的明确片剂、颗粒剂、胶囊剂配料、制粒、干燥岗位的标准操作程序和要求,规范生产操作。
2范围本标准适用于片剂、颗粒剂、胶囊剂配料、制粒、干燥岗位标准操作。
3责任人操作人员、车间主任、QA。
4内容4.1生产前的检查和准备4.1.1操作人员按《人员进出生产区S0P》进入。
4.1.2操作者检查片剂、颗粒剂、胶囊剂粉碎、过筛操作间应有现场QA发放的上品种、上批次、上规格的“清场合格证”副本。
并按《清场管理规程》中清场要求和标准确认清场符合要求。
4.1.3与本品种、木批次生产无关的物料、物品、文件、工用具不得出现在操作间。
4.1.4与本品种、本批次生产相关的物品、工用具、容器、辅助用具应按本操作间定置管理图中要求摆放,并不得有多余量出现。
4.1.5生产操作空白记录、生产状态卡、记录用笔等应齐全悬挂在操作间规定处。
4.1.6检查合格后由现场QA在片剂、颗粒剂、胶囊剂粉碎、过筛记录中“生产前检查栏”内签名,方可开始生产。
4. 1.7根据批生产指令,填写领料单,领取所需物料,按《物料进入生产区SOP》操作。
4.2操作过程4.2.1配料4.2.1.1取下台秤的“已清洁”、“完好”牌,按照《台秤、案秤使用及维护保养SOP》及《称量岗位SOP》进行操作。
4.2.1.2配料量应以《批生产指令》的限额量为准,各种物料应分别称量,且应做到一人称量、一人复核。
4.2.1.3称量后的物料应用洁净容器盛装,称量后应及时记录。
4.2.2制粒4.2.2.1取下槽型混合机、旋转制粒机、可倾夹层锅等设备的“已清洁”、“完好”牌,换上“运行”状态标志牌。
4.2.2.2物料的预混合:将待混合的物料按《批生产指令》的量加入槽型混合机料桶内,按《槽型混合机使用及维护保养SOP》开机进行预混合。
在对物料进行预混合的同时制浆。
4.2.2.3制浆(两种方法,视产品工艺而定):一冲浆:按《批生产指令》的要求量取规定量的水,将其中的80%加入夹层锅中,按《夹层锅使用及维护、保养SOP》开机加热,将用于制取粘合剂的物料与20%的水混合搅拌均匀作为生浆,备用。
批生产记录、批包装记录管理规程
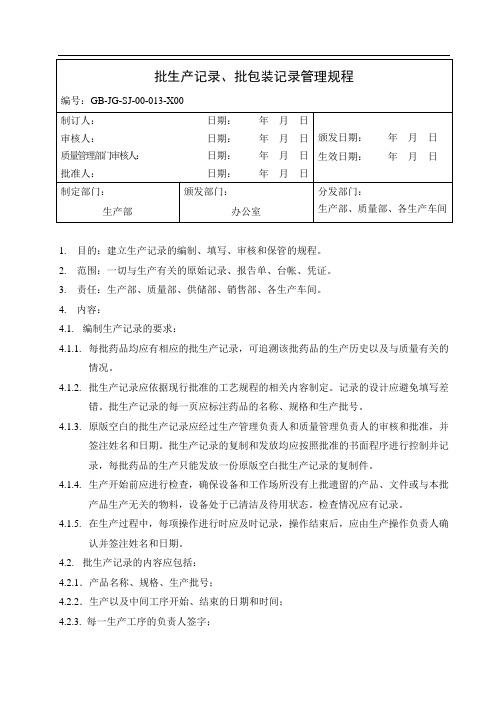
1.目的:建立生产记录的编制、填写、审核和保管的规程。
2.范围:一切与生产有关的原始记录、报告单、台帐、凭证。
3.责任:生产部、质量部、供储部、销售部、各生产车间。
4.内容:4.1.编制生产记录的要求:4.1.1.每批药品均应有相应的批生产记录,可追溯该批药品的生产历史以及与质量有关的情况。
4.1.2.批生产记录应依据现行批准的工艺规程的相关内容制定。
记录的设计应避免填写差错。
批生产记录的每一页应标注药品的名称、规格和生产批号。
4.1.3.原版空白的批生产记录应经过生产管理负责人和质量管理负责人的审核和批准,并签注姓名和日期。
批生产记录的复制和发放均应按照批准的书面程序进行控制并记录,每批药品的生产只能发放一份原版空白批生产记录的复制件。
4.1.4.生产开始前应进行检查,确保设备和工作场所没有上批遗留的产品、文件或与本批产品生产无关的物料,设备处于已清洁及待用状态。
检查情况应有记录。
4.1.5.在生产过程中,每项操作进行时应及时记录,操作结束后,应由生产操作负责人确认并签注姓名和日期。
4.2.批生产记录的内容应包括:4.2.1.产品名称、规格、生产批号;4.2.2.生产以及中间工序开始、结束的日期和时间;4.2.3. 每一生产工序的负责人签字;4.2.4.生产步骤操作人员的签名,必要时,还应有操作(如称量)复核人员的签名;4.2.5.每一原辅料的批号以及实际称量的数量(包括投入的,回收或返工处理产品的批号及数量)4.2.6.所有相关生产操作或活动、工艺参数及控制范围,以及所用主要生产设备的编号;4.2.7.中间控制和所得的结果的记录以及操作人员的签名;4.2.8.不同生产工序的产量及必要的物料平衡计算;4.2.9特殊问题的记录,包括对偏离生产工艺规程的偏差情况的详细说明或调查报告,并经签字批准。
4.3.编制批包装记录的要求:4.3.1.每批产品或每批产品中部分产品的包装,都应有相应的批包装记录,可追溯该批药品的包装操作以及与质量有关的情况。
片剂,胶囊剂,丸剂脆碎度,硬度,崩解度的测定实验

片剂,胶囊剂,丸剂脆碎度,硬度,崩解度的测定实验药品的剂型有很多种,常见的有片剂、胶囊剂、丸剂等。
针对不同的剂型,其质量控制标准也有所不同。
其中,脆碎度、硬度和崩解度是很重要的指标。
一、脆碎度脆碎度是指药品在外力作用下的断裂性能。
测定方法有深度感应试验法、单粒试验法和冲击试验法等。
其中,深度感应试验法最为常用。
具体实验步骤如下:1.将60粒样品放在试验仪上,设置深度感应测试装置。
2.通过压力针下压,记录药品断裂的压力值。
3.重复以上操作,取平均值作为药品的脆碎度。
通过测定药品脆碎度,可以判断药品是否易碎,易破损,从而进一步提高药品的质量。
二、硬度硬度是指药品在外力作用下的抗压能力。
药品硬度可以影响其在生产、包装、贮运过程中的保持完整和稳定的能力。
测定方法有毫米深度试验法、单粒试验法、三点弯曲试验法等。
其中,单粒试验法最为常用。
具体实验步骤如下:1.将60粒样品放在试验仪上,设置单粒硬度测试装置。
2.通过压力针下压,记录药品耐压值。
3.重复以上操作,取平均值作为药品的硬度。
通过检测药品的硬度,可以判断药品是否坚硬,从而保证其在生产和贮运过程中的完整性。
三、崩解度崩解度是指药品溶解度的物理量,即药品在一定时间内在溶液中崩解的百分比。
崩解度的测试对于口服药物质量的控制十分重要。
测定时,通常需要提前规定崩解时间,如15分钟等。
具体实验步骤如下:1.将每个样品放入分装好的容器中,加入适量溶剂。
2.设定崩解时间,开启试验仪,记录药品崩解时间。
3.计算崩解度百分比。
药品的崩解度与其水溶性有关,同时也可以反映药品的制备工艺和配方的优劣。
总结:脆碎度、硬度和崩解度是影响药品质量的重要指标。
上述三项测定实验可以指导药厂在制造过程中对药品进行定量控制,确保药物品质。
个体诊所药品清单表格

个体诊所药品清单表格篇一:个体诊所常用和急救药品目录个体诊所常用和急救药品目录一、抗微生物药(暂行)阿莫西林(片剂、胶囊剂、,颗粒剂)、阿奇霉素(针剂、片剂)、阿昔洛韦(无环鸟苷)(片剂、针剂、滴眼液)、氨苄西林钠(针剂)、哌拉西林钠(针剂)、硫酸阿米卡星(注射剂)、呋喃唑酮(痢特灵)(片剂)、呋喃妥因(呋喃坦啶)(片剂、胶囊剂),复方磺胺甲嗯唑(片剂)、红霉素(片剂、胶囊剂、眼膏、针剂)、盐酸小檗碱(黄连素)(片剂)、琥乙红霉素(片剂)、环丙沙星(针剂、片剂)、甲硝唑(灭滴灵)(片剂、注射剂)、盐酸克林霉素(胶囊剂、针剂)、利巴韦林(三氮唑核苷)(片剂、注射剂、滴眼剂)、盐酸林可霉素(针剂)、硫酸庆大霉素(针剂、片剂、)、利福平(片剂,胶囊剂)、氯霉素(滴眼剂)、罗红霉素(颗粒剂、片剂)、乙酰螺旋霉素(片剂)、诺氟沙星(胶囊剂)、青霉素钠(针剂)、头孢氨苄(片剂、胶囊剂、颗粒剂)、头孢拉定(胶囊剂、注射剂)、头孢曲松钠(针剂)、头孢噻肟钠(针剂)、头孢唑啉钠(针剂)、土霉素(片剂)、乙胺丁醇(片剂)、异烟肼(片剂)、氧氟沙星(针剂、片剂、滴眼剂)、鱼腥草(针剂)、制霉素(片剂)、左氧氟沙星(片剂、针剂),头孢克洛(胶囊剂>二、局部麻醉药盐酸利多卡因(注射剂、喷雾剂)、盐酸普鲁卡因(注射剂)、盐酸丁卡因(注射剂)三、镇痛、解热、抗炎、抗痛风药镇痛、解热、抗炎、阿司匹林(片剂)、白加黑(片剂)、百服宁(片剂、溶液剂)、布洛芬(片剂)、芬必得(胶囊剂)、复方对乙酰氨基酚(片剂、颗粒剂)、感康(胶囊剂、片剂)、感冒通(片剂)、康泰克(胶囊剂)、克感敏(片剂、颗粒剂)、清开灵(针剂)、去痛片(片剂)、伤风胶囊(胶囊剂)、伤湿膏(膏剂)、麝香壮骨膏(膏剂)、双氯酚酸钠(片剂、缓释片)、小儿速效感冒冲剂(颗粒剂)、小儿速效感冒片(片剂)、一清胶囊(胶囊剂)、秋水仙碱(片剂)、引哚美辛(片剂、胶囊)、复方氯唑沙宗(片剂)四、神经系统用药苯妥英钠片、盐酸苯海索(片剂)、尼可刹米(注射剂)、盐酸洛贝林(注射剂)、盐酸二甲氟林(注射剂)五、循环系统用药尼莫地平(片剂),盐酸氟桂利嗪(胶囊剂),吡拉西坦(片剂胶囊剂),北京降压0号(片剂)、地高辛(片剂)、复方降压片(片剂)、利血平(注射剂)、罗布麻片(片剂)、脉络宁(针剂)、尼群地平(片剂)、去氧肾上腺素(注射剂)、肾上腺素(注射剂)、曲克芦丁(片剂、针剂)、维拉帕米(片剂)、硝酸甘油(片剂,针剂)、鱼油降脂丸(丸剂)、盐酸普罗帕酮(片剂)、盐酸普萘洛尔(片剂)、盐酸胺碘酮(片剂)、硝苯地平(片剂)、硝酸异山梨酮(片剂、缓释片)、卡托普利片、重洒石酸间羟胺针、甲磺酸妥拉明针六、呼吸系统用药氨茶碱(注射剂、片剂)、百喘朋片(片剂)、华素片(片剂)、肌苷(针剂)、六神丸(丸剂)、蜜炼枇杷膏(膏剂)、糜蛋白酶(注射剂)、清音片(片剂)、蛇胆川贝液(口服液)、速效伤风胶囊(胶囊剂)、西瓜霜(含片、喷雾剂)、溴已新(片剂)、小儿化痰止咳冲剂(颗粒剂)、小儿止咳化痰颗粒(颗粒剂)、增效气管炎(片剂)、盐酸氨溴孛(片剂)七、消化系统用药氢溴酸山莨菪碱(654—2)(针剂)、硫酸阿托品(注射剂、片剂)、溴米因(爱茂尔针)(针剂)、多酶片、谷氨酸钠(注射剂)、干酵母片(片剂)、酵母片(片剂)、开塞露、硫酸镁(溶液剂)、雷尼替丁(胶囊剂、片剂)、丽珠得乐(片剂、颗粒剂)、多潘立酮(吗叮林)(片剂)、乳酸菌素片(片剂)、思密达(粉剂)、斯达舒(片剂)、碳酸氢钠(注射剂、片剂)、胃必治(片剂)、胃仙优(片剂)、温胃舒(颗粒剂)、西米替丁(针剂、片剂)、小儿泻痢停(片剂)、泻痢停(片剂)、养胃舒(颗粒剂)、硫糖铝(片剂、混悬剂),法莫替丁(片剂,针剂)八、泌尿系统用药大黄苏打片(片剂)、排石冲剂(颗粒剂)、三金片(片剂)、呋塞米(片剂、针剂)、氢氯噻嗪(片)、黄酮哌酯片九、血液系统用药氨基已酸针、卡巴克洛(安络血)(片剂,针剂)、硫酸亚铁(片剂)、Vk3针、维生素b12,(注射剂)、维生素k1(注射剂)、肝素钠(注射剂)、右旋糖酐—40(注射剂)、叶酸片、低分子肝素(注射剂)十、激素及影响内分泌药:地塞米松(氟美松)(注射剂、片剂、滴眼剂)、黄体酮(注射剂)、泼尼松(片剂、针剂)、氢化可的松片(片剂)、已烯雌酚(片剂)十一、抗变态反应药特非那丁(片剂)、马来酸氯苯那敏(扑尔敏)(片剂)、强力解毒敏(针剂)、盐酸赛庚啶(片剂)、盐酸异丙嗪(注射剂)、阿司咪唑(息斯敏)(片剂)十二、维生素、矿物质及肠内肠外营养药18种氨基酸(针剂)、50%葡萄糖注射液(针剂)、Vad(胶丸剂)、Vb6(片剂、针剂)、Vd3针(针剂)、Vk3(针剂)、氨基酸(针剂)、辅酶a(针剂)、复方维生素b(片剂)、葡萄糖酸钙(注射剂)、三磷酸腺苷(针剂)、维丁胶性钙(针剂)、维生素b1(片剂、针剂)、维生素b2(片剂)、维生素c(注射剂、片剂)、维生素e(胶丸剂)十三、调节水盐,电解质及酸碱平衡剂复方氯化钠(林格)(注射液)、口服补液盐、氯化钾(注射剂)、氯化钠(注射剂)、葡萄糖(注射剂5%、10%)、葡萄糖氯化钠(注射剂)十四、消毒防腐药碘酊、高锰酸钾粉、3%过氧化氢(溶液剂)、强力碘(溶液剂)、75%乙醇、甲紫(溶液剂)、依沙吖啶溶液十五、专科药皮康王(膏剂)、999皮炎平(乳膏剂)、醋酸可的松(滴眼剂)、达克宁霜(乳膏剂)、氟轻松软膏(膏剂)、可的松眼水(滴眼剂)、硫软膏(膏剂)、尿素软膏(膏剂)、润舒滴眼液(滴眼剂)、烧伤湿润膏(膏剂)、鱼石脂软膏(膏剂)、珍珠明目液(滴眼剂)、金十六、中成药云南白药(散剂、胶囊、擦剂、气雾剂、膏药)、999感冒冲剂(颗粒剂)、Vc银翘片(片剂)、八宝惊风散(散剂)、板兰根(针剂、冲剂)、冰硼散(散剂)、草珊瑚含片(片剂)、柴胡注射液(针剂)、陈香露白露片(片剂)、刺五加(针剂)、大青叶(针剂)、丹参(针剂、片剂)、当归(针剂、丸剂)、地奥心血康(胶囊剂)、跌打丸(丸剂)、妇科千金片(片剂)、复方丹参(片剂、滴丸剂)、复方甘草片(片剂)、复方甘草合剂(合剂)、骨宁(针剂)、黄连上清丸,(片)(丸剂、片剂)、藿香正气水(口服液、胶囊)、急支糖浆、健胃消食片(片剂)、金匮肾气丸(丸剂)、金嗓子喉宝(片剂)、季德胜蛇药片、咳必清(胶囊剂、片剂)、咳特灵片(片剂)、克咳胶囊、六味地黄丸(丸剂)、龙胆泻肝丸(丸剂)、牛黄解毒片(片剂)、人参健脾丸(丸剂)、三七片(片剂)、双黄连(针剂、口服液、片剂)、松节油、速效救心丸、乌鸡白凤丸(丸剂)、香砂养胃丸(丸剂)、消渴丸(丸剂)、消炎利胆片、小柴胡冲剂、小儿痢宝(颗粒剂)、小儿退热栓(栓剂)、小活络丹(丸剂)、血塞通(片剂、针剂)、牙痛安(片剂)、养阴清肺糖浆(糖浆剂)、益母草冲剂(颗粒剂)、银翘解毒片、正红花油(擦剂)、止咳化痰糖浆(糖浆剂)、朱砂安神丸(丸剂)篇二:个体诊所药品管理办法个体诊所药品管理办法第一章总则第一条为加强个体诊所使用药品和医疗器械的监督管理,保证人体用药安全有效,维护人民群众用药的合法权益,依据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《医疗器械监督管理条例》的有关规定,结合本市实际,制定本规范。
片剂各岗位生产记录

原生产品名批号
调换产品名批号
清场合格证
清场班组清场者签名
清场日期检查者签名
待清洁
已清洁
压片岗位生产记录
产品名称:
规格:
生产批号:
生产日期:年月日
生产前检查:1、计量器具有“周检合格证〞,并在周检效期内;〔〕2、设备有“完好〞证及“已清洁〞状态标记;〔〕3、容器具有“已清洁〞状态标记;〔〕4、该岗位门外有“清场合格证〞;〔〕5、岗位有“准许生产证〞;〔〕6、物料有“物料标示卡〞、流转证、检验报告单;〔〕7、岗位现场无上批生产产遗留物。〔〕
损耗量
本批剩余量
PVC
铝铂
生
产
操
作
预热时间
~
热封温度
待包品重
Kg
包装数量
Kg
残损数量
Kg
剩余量
Kg
操作时间
~
包装后重量
Kg
收率
包装数量
————————χ100%=
包装数量+残损数量
物
料
平
衡
包装数量+残损数量+剩余量
————————————χ100%=
待包品总重
备注
操作人:复核人:
数片包装岗位操作记录
单浆浓度:重量:色浆浓度:重量:
操作人:复核人:年月日时分
前工序片芯数量:平均片重:
包衣
操作人:复核人:年月日时分
详细操作见记录〔2〕
开始时间:
结束时间:
晾片时间:
投料量:产出总量:
废品量:物料平衡:
平衡计算:产出量+废品量/投料量×100%
清场操作人:复核人:年月日时分
(整理)片剂批生产记录

批生产记录产品名称:
规格:
批号:
投料量:
入库数:
生产车间:
******制药有限公司
批生产指令
编号:SOR-SC001-00 指令号:号
批包装指令
编号:SOR-SC002-00 指令号:号
签发者:
签发日期:
清场合格证
清场合格证
副本原辅料处理生产前确认记录
编号:
年月日班
粉碎、筛粉岗位生产记录
配料室配料生产前确认记录
编号:
年月日班
配料室配料记录
制粒生产前确认记录
编号:
年月日班
粘合剂(润湿剂)配制记录
制粒生产记录
总混生产前确认记录
编号:
年月日班
总混合生产记录
压片生产前确认记录
编号:
年月日班
压片岗位生产记录
包衣生产前确认记录
编号:年月日班
包衣岗位生产记录
包衣岗位生产记录
包衣岗位生产记录
包衣浆液配制记录
称量记录
中间产品交接单(正本)
编号:S O R-S C011-00
中间产品交接单(副本)
编号:S O R-S C011-00
内包装生产前确认记录
编号:
年月日班
内包装岗位生产记录
铝塑包装岗位生产记录
外包装生产前确认记录
编号:
年月日班
外包装岗位生产记录
残次说明书、印字包装销毁记录
编号:SOR-SC007-00
车间化验室检查记录
合箱记录
片剂生产过程监督检查记录
QA :年月日
清场记录
编号:
精品文档
精品文档
片剂批生产记录汇总。
片剂批生产记录模板

XXX批生产记录包装规格:
汇总人:_______________________________ 汇总日期: _____________________________
制粒工序生产前确认记录
制粒工序生产操作记录
房间名称/编号:制粒干燥一016 操作日期:年月日
总混工序生产操作记录
房间名称/编号:整粒总混O11 操作日期:
人):
备注:贴请验单、附中间
产品报告单:
检查情况:合格口不合格口QA:贴本批清场合格证正本:(见背页)
备注:
包衣工序生产记录
房间名称/编号:包糖衣室二038 操作日期: SħB
包衣工序生产操作记录
房间名称/编号:包糖衣室二038 操作日期: S 0
工序负责人(复核人):
检查情况:合格□不合格□QA:贴本批清场合格证正本:(见背页)
检查情况:合格□不合格□QA:贴本批清场合格证正本:(见背页)。
01片剂批生产记录举例1

E本批废品数
平衡率:(B+C+D+E)/A×100% = %
限度为99%~100%
3
平衡率:×100% = %
限度符合规定()
4清场
4.1清除与本批无关的物品。
4.2废弃物移至规定地点,
4.3填写清场记录正副本,本次清场记录正本与上批副本及清场合格证、成品检验报告单一同贴至记录背面。
1.2依据批生产记录。核对待包装品品名、规格、批号、数量。
1.3核对小盒、说明书、纸箱,、数量应与生产指令相符。
1.1已核对。()
1.2已核对.()
待包装品板
1.3说明书_______张小盒_________个热收缩膜_________个纸箱_________个
2包装
2.1小盒打印批号等
2.2装小盒。(数量准确、不得漏装说明书)
备注:
操作按要求做好打“√”,否则打“×”
批生产记录
产品名称:
批号:
规格: g/片
密级:绝密
页码:2
岗位:制粒、干燥、整粒
批次量:万片
操作日期:年月日
起止时间:
操作步聚与内容
操作记录
操作人
复核人
1制粒前的准备:
1.1检查清场情况及标识。
1.2根据批生产指令对从中转站转来的原辅料的品名、批号、重量等进行复核。
1.3将原辅料倒入混合机内,密封。
1.1清场合格,状态标识齐全明确。()
1.2已核对:
品名:
批号:干粉总重:kg
2制粒
按“制粒标准操作规程”操作,将原辅料加入混合机中混合15分钟,加入粘合剂混合均匀,用规定的筛网制粒,规定的温度下干燥后加入润滑剂进行总混,将总混好的物料装在不锈钢桶中转入中转站,标明:品名、批号、重量、生产日期。
按GMP规范审核药物片剂批生产记录

按GMP规范审核药物片剂批生产记录摘要:目的:通过对药物片剂批生产记录的审核,完善与强化《药品生产质量管理规范(GMP)》实施中的记录功能,规范其管理;方法:从符合性表达入手,进行汇总、分析;结果:记录使用中的真实性控制、执行中的适用性和可行性等问题,总结经验与教训;结论:做出正确的判断,采取适当的措施,期望降低错误的发生几率,确保药物片剂符合预定质量要求。
关键词:药物片剂批生产记录审核药品生产质量管理规范符合性1:前言药物片剂批生产记录:根据药物片剂的生产特点、工艺、质量要求编订、设计,记录一个批号的产品制造过程中使用原辅材料与所进行操作的文件,是生产全过程的真实记录,有制造过程中控制的细节。
药物片剂批生产记录能提供该批药物片剂的生产历史以及与质量有关的情况,具有质量的可追踪性。
根据药品GMP规定,每批药物片剂均应当有相应的生产记录。
本人对药物片剂批生产记录有充分的认识,审核该记录时熟悉每一步工艺流程,熟悉所监控产品的工艺专业知识与质量控制点,确保药物片剂放行前通过记录审核对该产品进行质量评价,完善与强化《药品生产质量管理规范(GMP)》实施中的记录功能,规范GMP管理,持续改进与质量相关的工作。
2.检查工作形式国家食品药品监督管理局检查的重点有三部分:现场、记录、软件等。
2.1.1记录主要检查记录的格式、内容是否齐全,GMP中规定的项目都应齐全;2.1.2检查现状和检查过去的生产状况。
通过对过去所填写的批生产记录及其他记录的检查,可发现过去的生产情况、设备运行情况、质量检验情况等,可了解生产全过程中的产品质量情况。
2.1.3检查现状:由点到面:批生产记录中的某一物料情况引申到仓库的物料情况,物料的采购、入库、发放、质量部的检验、留样等情况;批生产记录中的工艺参数、物料平衡、偏差、操作要点等引申到工艺流程、工艺执行情况、工艺监控等;批生产记录中的物料传递过程引申到工艺流动情况、中间站运转情况;压差、温湿度记录引申到厂房情况、空气净化系统运行情况;设备运行记录引申到设备情况;清场记录引申到卫生执行情况、卫生SOP、现场卫生监控;检验记录引申到质量控制情况(质量标准、分析方法、产品检验等)。
保健食品生产过程批生产记录的规范化探究

保健食品生产过程批生产记录的规范化探究张永宏近些年,随着社会经济发展的推动,人们的思想观念发生了很大的转变,尤其对身体健康方面的关注度越来越高,身体保健也成为人们关注的方向,尤其对于老年群体而言,身体保健能够提高老年群体的身体健康,减少疾病发生率,也能提高老年群体的生活质量。
并且我国也提倡医疗保健,提倡预防大于治疗的理念,人们患病主要源于身体营养补充不足,再加之人们长期劳作,随着时间积累导致人们患病,影响身体健康,人民群众的身体素质关系着国家经济的发展,因此人们注重保健食品的运用,有助于减少疾病的发病率,提高我国国民身体健康。
在当前时期的保健食品包括胶囊、片剂、粉状等类型,其中以软胶囊类型为主,因此,本文以保健食品中的软胶囊剂生产规范化为研究与表述对象,并反映出了其生产记录规范化的诸多问题,比如缺乏环节的清晰度、缺乏明确的物品去向、栏目不合理等诸多内容。
1 保健食品生产记录不规范的问题在我国社会经济快速发展过程中,工业生产的发展速度不断加快,食品生产规模不断扩大,其中保健食品生产对质量的要求比较高,主要保健食品主要用于人体保健,关系着人体身体健康,如果在保健食品生产过程中出现问题,我国保健食品将面临质量危机,不利于我国国民身体健康,同时也不利于我国保健食品的大力推广,影响我国保健食品的市场发展前景。
为了提高我国保健食品生产的规范性,需要在保健食品生产过程中进行详细记录。
因保健食品在生产过程中的记录内容比较多,主要包括生产指令、各工序生产记录、工艺参数、中间产品、产品检验报告、清场记录、物料平衡记录、生产偏差处理等方面的记录,以此确保保健食品生产的安全性。
但在实际记录期间存在许多问题,下面进行详细分析。
1.1 生产记录多数属于后补我国当前多数保健食品生产企业在生产记录编制中多数经核查属于后补记录的居多,主要是在保健食品批生产记录查看中明显发现有多数的生产记录笔记整齐、并无明显涂改、甚至连续多数记录书写字迹一致,存在明显的后补痕迹。
片剂批生产记录范文

片剂批生产记录范文<<片剂批生产记录>>批号:XXXXX生产日期:XXXX年XX月XX日生产工艺:XXX工艺生产线:XXX生产线1.原辅料准备:1.1配方:按照配方要求准备原辅料,确保原辅料符合《药品质量管理规范》的要求。
1.2填料区:将原辅料按照配方准确称量,记录称量数据,并签名确认。
1.3原料检查:对所使用的原辅料进行外观、标识、纯度等检查,记录检查结果,并签名确认。
1.4净化区:将准备好的原料送入净化区进行净化处理,确保原料的纯净度。
1.5粉碎:将净化后的原料送入粉碎设备进行粉碎,确保颗粒的大小符合要求,记录粉碎结果,并签名确认。
2.混合制粒:2.1将粉碎后的原料送入混合料仓,按照配方要求加入辅料,启动混合机,将原料和辅料充分混合均匀,记录混合时间,确保混合效果良好。
2.2将混合好的料送入制粒机进行制粒,确保颗粒的大小符合要求,记录制粒结果,并签名确认。
3.平片:3.1将制粒后的料送入平片机,设置适当的压片参数,启动平片机,将料压制成片,记录压片参数,并签名确认。
3.2检查片剂的外观、尺寸、硬度等指标,记录检查结果,并签名确认。
4.包装:4.1将平片好的片剂送入包装线进行包装,包装材料应符合相关要求。
4.2包装机自动计数、封口,并进行瓶装、包装箱装等操作,确保包装完整、无错漏。
4.3封口质量检查:对包装好的片剂进行封口质量检查,记录检查结果,并签名确认。
4.5包装记录:记录包装时的相关参数,包括包装机号、封口质量检查结果、包装箱数等,并签名确认。
5.清场:5.1包装线清场:清除包装线上的残留物和废品,确保下次生产使用的环境卫生。
5.2清点包装材料:清点包装材料的库存情况,记录库存数量,并签名确认。
以上记录内容属实,记录人员应严格按照相关规定操作,保证记录的准确性和真实性。
记录人:签名。
(13)批生产记录、批包装记录管理规程
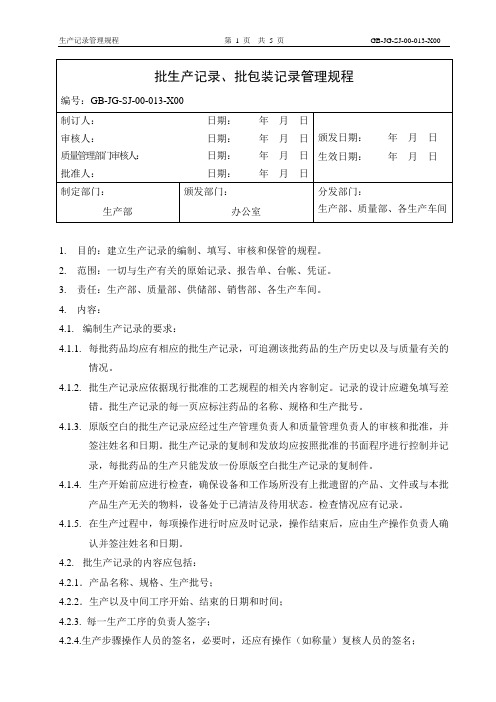
1.目的:建立生产记录的编制、填写、审核和保管的规程。
2.范围:一切与生产有关的原始记录、报告单、台帐、凭证。
3.责任:生产部、质量部、供储部、销售部、各生产车间。
4.内容:4.1.编制生产记录的要求:4.1.1.每批药品均应有相应的批生产记录,可追溯该批药品的生产历史以及与质量有关的情况。
4.1.2.批生产记录应依据现行批准的工艺规程的相关内容制定。
记录的设计应避免填写差错。
批生产记录的每一页应标注药品的名称、规格和生产批号。
4.1.3.原版空白的批生产记录应经过生产管理负责人和质量管理负责人的审核和批准,并签注姓名和日期。
批生产记录的复制和发放均应按照批准的书面程序进行控制并记录,每批药品的生产只能发放一份原版空白批生产记录的复制件。
4.1.4.生产开始前应进行检查,确保设备和工作场所没有上批遗留的产品、文件或与本批产品生产无关的物料,设备处于已清洁及待用状态。
检查情况应有记录。
4.1.5.在生产过程中,每项操作进行时应及时记录,操作结束后,应由生产操作负责人确认并签注姓名和日期。
4.2.批生产记录的内容应包括:4.2.1.产品名称、规格、生产批号;4.2.2.生产以及中间工序开始、结束的日期和时间;4.2.3. 每一生产工序的负责人签字;4.2.4.生产步骤操作人员的签名,必要时,还应有操作(如称量)复核人员的签名;4.2.5.每一原辅料的批号以及实际称量的数量(包括投入的,回收或返工处理产品的批号及数量)4.2.6.所有相关生产操作或活动、工艺参数及控制范围,以及所用主要生产设备的编号;4.2.7.中间控制和所得的结果的记录以及操作人员的签名;4.2.8.不同生产工序的产量及必要的物料平衡计算;4.2.9特殊问题的记录,包括对偏离生产工艺规程的偏差情况的详细说明或调查报告,并经签字批准。
4.3.编制批包装记录的要求:4.3.1.每批产品或每批产品中部分产品的包装,都应有相应的批包装记录,可追溯该批药品的包装操作以及与质量有关的情况。
片剂批生产记录

片剂批生产记录一、基本信息:1.1批号:XXXX1.2产品名称:片剂1.3生产日期:XXXX年XX月XX日1.4生产线:XXXX1.5生产班次:XX班1.6生产规模:XX万片二、原辅料准备:2.1主要原辅料清单:- 药品原料A: XXX kg- 药品原料B: XXX kg- 辅料A: XXX kg- 辅料B: XXX kg- 辅料C: XXX kg- 辅料D: XXX kg2.2原辅料领取情况:原辅料领取人:XXX时间:XXXX年XX月XX日物料名称/规格:XXX批号/有效期:XXX数量: XXX kg三、设备清洁及调试:3.1设备清洁情况:设备清洁人员:XXX时间:XXXX年XX月XX日设备名称:XXX清洁情况:XXX3.2设备调试情况:设备调试人员:XXX时间:XXXX年XX月XX日设备名称:XXX调试情况:XXX四、生产工艺参数:4.1工艺参数设置:-温度:XXX℃-湿度:XXX%-压力:XXXPa- 搅拌速度: XXX rpm4.2工艺过程记录:-XXX步骤:-工艺参数设置:XXX-操作人员:XXX-开始时间:XXXX年XX月XX日XX时XX分-完成时间:XXXX年XX月XX日XX时XX分-备注:XXX五、质量控制:5.1生产前样品检验:-检验员:XXX-检验项目:XXX-批号/日期:XXX-检验结果:XXX5.2中间检验记录:-检验员:XXX-检验项目:XXX-批号/日期:XXX-检验结果:XXX-备注:XXX5.3生产后样品检验:-检验员:XXX-检验项目:XXX-批号/日期:XXX-检验结果:XXX-备注:XXX6.1生产过程记录:-XXX步骤:-操作人员:XXX-开始时间:XXXX年XX月XX日XX时XX分-完成时间:XXXX年XX月XX日XX时XX分-备注:XXX6.2异常情况处理:-异常情况描述:XXX-处理人员:XXX-时间:XXXX年XX月XX日XX时XX分-处理结果:XXX-备注:XXX七、清洁消毒及封包记录:7.1清洁消毒记录:-清洁消毒人员:XXX-清洁消毒时间:XXXX年XX月XX日XX时XX分-清洁消毒情况:XXX7.2封包记录:-封包人员:XXX-封包时间:XXXX年XX月XX日XX时XX分-封包情况:XXX八、记录保存与档案整理:8.1记录保存:-批生产记录:XXXX年XX月XX日起,保存期限为XX年-检验记录:XXXX年XX月XX日起,保存期限为XX年-设备清洁记录:XXXX年XX月XX日起,保存期限为XX年8.2档案整理:-档案整理人员:XXX-时间:XXXX年XX月XX日-档案整理内容:XXX以上是片剂批生产记录(总),记录了批号、产品名称、生产日期、原辅料准备、设备清洁和调试情况、生产工艺参数、质量控制、生产记录、清洁消毒和封包记录、记录保存与档案整理等信息。
口服固体制剂

三、生产管理控制要点
(十)、包装
1、包装材料的选用应符合国家食品药品监督管理局2004 年第13号令《直接接触药品的包装材料和容器管理办 法》,在使用前应经预处理。 a. 玻璃瓶用饮用水洗干净,最后用纯化水冲洗并 经高温干燥灭菌,清洁贮存,贮存时间不得超过三天, 超过时间应重洗; b. 塑料瓶、袋、铝塑材料等的外包装应严密,内部 清洁干燥。必要时采取适当方法清洁消毒。 c. 直接接触药品的内包装材料应与药品不起作用, 并采取适当方法清洁消毒,消毒后于干燥密闭保存。
三、生产管理控制要点
(九)、胶囊剂灌装 1、操作室应与外室保持相对负压,粉尘由吸尘装臵排除。 室内应根据生产工艺要求控制温度和湿度。 2、在进行灌装前应核对颗粒的品名、规格、批号、重量, 并检查颗粒外观的质量和空壳规格、颜色是否与产品 工艺要求相符。 3、灌装前应试机,并检查胶囊的装量、崩解度。符合要 求后才能正常开机,开机后应定时抽样检查装量。 4、已灌装好的胶囊,筛去附在胶囊表面的细粉,拣去不 合格品,并用打光机或干净不脱落纤维的织物将胶囊 表面细粉揩净。盛于洁净的容器内,标明品名、规格、 批号、重量、操作者、生产日期等。
四、质量控制要点
主要工序 粉碎 质量控制点 原辅料 粉碎过筛 制粒 烘干 控制项目 异物 细度、异物 频率 每批 每批料
投料 颗粒
烘箱 沸腾床 喷雾制粒干燥 混合 混合 压片 素片
品种、规格、数量 粘合剂浓度、温度、筛网 含量、水份、粒度、微生物 温度、时间、清洁度 温度、滤袋完好、清洁度 温度、速度、料液的浓度 颗粒、色泽均匀一致 平均片重、片重差异 硬度、崩解时限、脆碎度 含量、均匀度、溶出度 外观
三、生产管理控制要点
(七)、压片ቤተ መጻሕፍቲ ባይዱ
1、压片室与外室保持相对负压,粉尘由吸尘装臵排除。
片剂批生产记录范文

片剂批生产记录范文产品名称:XXX片剂生产日期:2024年01月01日生产工艺流程:1.原料准备-按照生产配方准确称取所需原料。
-原料称量时,记录原料名称、批号、规格、称量量和准确度。
2.配料-将准备好的原料进行混合,使用搅拌设备进行均匀混合。
-动态记录混合时间、混合速度、温度等参数。
-完成混合后,取样进行质量检验。
3.加工-将混合好的原料倒入片剂成型机中。
-根据生产工艺要求,设置片剂成型机的压力、温度等参数。
-按照设定参数进行片剂成型。
-记录成型过程中的设定参数和实际参数,以及处理异常情况的措施。
4.包装-将成型好的片剂送入包装线。
-根据要求进行包装,如使用铝塑复合膜进行包装。
-记录包装设备的运行情况,包装时间、温度等参数。
-完成包装后,留取样品进行质量检验。
5.产品质量检验-取样进行外观、尺寸、硬度、含量等指标的检验。
-记录检验结果并进行统计分析。
6.清洁记录-记录清洁过程,包括清洗设备、工作台、生产区域等。
-清洁操作记录包括清洗剂的种类、使用量、清洗时间和清洗人员等信息。
-清洁记录需由生产人员和质量管理人员共同签字确认。
7.记录保存-所有记录的保存时间为至少两年,确保记录完整可追溯。
备注:-所有操作均需在GMP要求下进行,保持生产环境整洁有序。
-如遇异常情况,需立即停止生产并通知相关负责人进行调查和处理。
-生产过程中产生的废品需妥善处理,不能混入正常产品。
生产记录总结:本批次XXX片剂生产过程按照规定的生产工艺流程进行,原料配比准确,各项生产参数稳定可控,符合质量要求。
经过检验,产品外观正常,尺寸、硬度、含量等指标符合要求。
生产过程中无异常情况发生。
清洁记录完整并经过确认。
所有相关记录已妥善保存,为质量追溯提供了依据。
签字:生产人员签字____________日期____________。
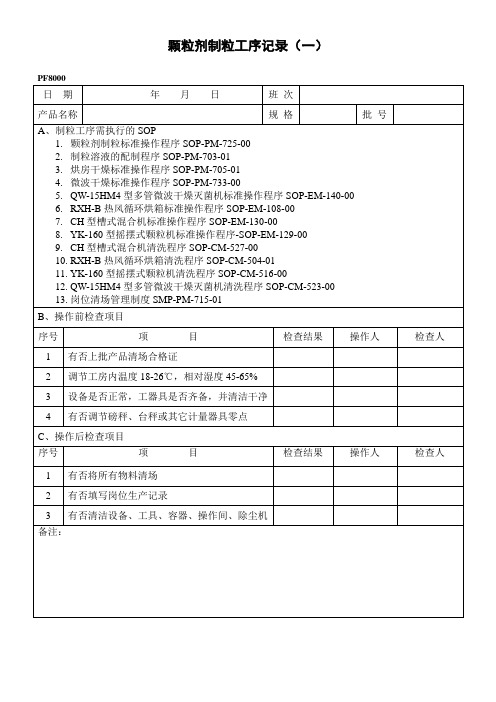
PF8000颗粒剂制粒工序记录(一)
7.CH型槽式混合机标准操作程序SOP-EM-130-00
8.YK-160型摇摆式颗粒机标准操作程序-SOP-EM-129-00
9.CH型槽式混合机清洗程序SOP-CM-527-00
10.RXH-B热风循环烘箱清洗程序SOP-CM-504-01
11.YK-160型摇摆式颗粒机清洗程序SOP-CM-516-00
12.QW-15HM4型多管微波干燥灭菌机清洗程序SOP-CM-523-00
13.岗位清场管理制度SMP-PM-715-01
B、操作前检查项目
序号
项目
检查结果
操作人
检查人
1
有否上批产品清场合格证
2
调节工房内温度18-26℃,相对湿度45-65%
3
设备是否正常,工器具是否齐备,并清洁干净
4
有否调节磅秤、台秤或其它计量器具零点
C、操作后检查项目
序号
项目
检查结果
操作人
检查人
1
有否将所有物料清场
2
有否填写岗位生产记录ຫໍສະໝຸດ 3有否清洁设备、工具、容器、操作间、除尘机
备注:
颗粒剂制粒工序记录(一)
PF8000
日期
年月日
班次
产品名称
规格
批号
A、制粒工序需执行的SOP
1.颗粒剂制粒标准操作程序SOP-PM-725-00
2.制粒溶液的配制程序SOP-PM-703-01
3.烘房干燥标准操作程序SOP-PM-705-01
4.微波干燥标准操作程序SOP-PM-733-00
5.QW-15HM4型多管微波干燥灭菌机标准操作程序SOP-EM-140-00
片剂批生产记录.汇总

xxxx 制药有限公司片剂批生产记录产品名称产品代码产品批号生产日期 ________________________产品规格 ________________________包装规格成品数车间主任 ________________________汇总制表人 _____________________片剂批生产记录目录1.批生产记录审核表2.批生产指令3.片剂生产物料平衡表4.粉筛操作记录5.称量操作记录6.粘合剂制备操作记录7.制粒干燥操作记录8整粒总混操作记录9.中间站颗粒进出站记录10.压片操作记录11.压片岗位质量监控记录12.中间站待包装品进出站记录13.批包装指令14.铝塑包装操作记录15.外包装操作记录16.工艺查证记录17.质量监控记录18.不合格品销毁记录XXXX制药有限公司批生产指令请按《工艺规程》组织生产备注:备注:QA签名:xxxx制药有限公司称量操作记录特殊情况及偏差处理:QA 签字: XXXX 制药有限公司 整粒总混操作记录 产品名称 产品代码 规格 产品批号 [生产日期 计划产量 指令单号 生产前准U 1.未见上批生产遗留物,并有上批清场合格 证副本。
是否匚 4.设备地面门墙面清洁兄 否口 2.生产文件齐备 是否匚 5.各种状态标志齐备 是口否口 3.设备完好,生产用具已清洁。
是 否6.领取并核对原 稱甫料是口 编号: 备 操作者 复核者 整粒筛目数(孔径)混 量 ⑦ kg ⑧ kg ⑨ kg ⑩ kg 总重量 kg 操作者: 复核者: 中间体 取样量(g) 颗粒水份 颗粒含量 总 kg kg 操作者: 检验 QA 检查结果 项 目 ⑤ ② ① kg 颗粒量(kg) 混合速度 总混后每桶重 kg 至 ⑥ 硬脂酸镁用量(kg) 混合时间 kg 复核者: 清场结果 无本批产品遗留物 清洁设备及容器内壁、器具、筛网、操 作台 更换相关生产文件及生产状态标志 清除本批废弃物料 清洁地面、门、墙面、顶棚 说明:凡符合要求,检查情况用“V”表示,不符合要求,检查情况用“x”表示。
药品购进记录

石家庄神威
西安市新龙药业
柯华
肾石通颗粒
颗粒剂
15g/10袋
盒
20
西安博爱
西安市新龙药业
柯华
黄连上清丸
丸剂
6g/20袋
盒
10
四川禾润
西安市新龙药业
柯华
克感敏片
片剂
2s/200袋
盒
2
西安利君
西安市新龙药业
柯华
华素片
片剂
盒
10
哈药总厂
西安市新龙药业
柯华
严迪片〔成人〕
片剂
75mg/12s
盒
10
哈药总厂
西安市新龙药业
1000s
瓶
2
湖北华中
2021.07
西安市新龙药业
柯华
维生素B2
片剂
1000s
瓶
2
湖北华中
西安市新龙药业
柯华
维生素B1
片剂
10mg/100s
瓶
10
湖北华中
西安市新龙药业
柯华
硫磺庆大霉素片
片剂
100s/4万单位
瓶
10
山西曙光
2021.06
西安市新龙药业
柯华
布洛芬片
片剂
/100s
瓶
10
山西太原
201
西安市新龙药业
瓶
12
兰州佛慈
西安市新龙药业
柯华
再林颗粒
颗粒剂
/18袋
盒
10
江苏先声
西安市新龙药业
柯华
消炎利胆片
片剂
100s/10瓶
瓶
20
广州白云山
西安市新龙药业
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SC-GJ-01302
片剂批生产记录目录
目录
一.批生产指令 (1)
二.物料流转表 (2)
三.批生产记录目录 (3)
四.批生产记录汇总表·································4
五.称量岗位记录 (5)
六.称量岗位清场记录 (6)
七.混合岗位记录 (7)
八.混合岗位清场记录 (8)
九.制粒岗位记录 (9)
十.制粒岗位清场记录 (10)
十一.总混合岗位记录 (11)
十二.总混合岗位清场记录 (12)
十三.压片岗位记录 (13)
十四.压片岗位清场记录 (14)
十五.片剂分装岗位记录 (15)
十六.片剂分装岗位清场记录 (16)
十七.批包装生产记录 (17)
批生产记录汇总表
称量岗位记录
称量岗位清场记录
制粒岗位记录
制粒岗位清场记录
混合岗位记录
混合岗位清场记录
装瓶岗位记录
装瓶岗位清场记录
SC-GJ-01402
胶囊剂批生产记录
目录
一. 批生产指令 (1)
二. 物料流转表 (2)
三. 批生产记录目录 (3)
四. 批生产记录汇总表 (4)
五. 称量岗位记录 (5)
六. 称量岗位清场记录 (6)
七. 干燥岗位记录 (7)
八. 干燥岗位清场记录 (8)
九. 混合岗位记录 (9)
十. 混合岗位清场记录 (10)
十一. 填充岗位记录 (11)
十二. 填充岗位清场记录 (12)
十三. 铝塑包装岗位记录 (13)
十四. 铝塑包装岗位清场记录 (14)
十五. 批包装生产记录 (15)
SC-GJ-01402
胶囊剂批生产记录
目录
一.批生产指令 (1)
二.物料流转表 (2)
三.批生产记录目录 (3)
四.批生产记录汇总表 (4)
五.称量岗位记录 (5)
六.称量岗位清场记录 (6)
七.粉碎岗位记录 (7)
八.粉碎岗位清场记录 (8)
九.混合岗位记录 (9)
十. 混合岗位清场记录 (10)
十一.填充岗位记录 (11)
十二.填充岗位清场记录 (12)
十三.铝塑包装岗位记录 (13)
十四.铝塑包装岗位清场记录 (14)
十五.批包装生产记录 (15)
SC-GJ-01402
批生产记录
品名:
规格:
批号:
批量:
实际产量:
QA检查员:
车间主任:
生产技术部:
干燥记录
干燥岗位清场记录
混合岗位记录
胶囊填充、抛光岗位记录
胶囊填充、抛光岗位清场记录
铝塑包装岗位记录
铝塑包装岗位清场记录
SC-GJ-01502
颗粒剂批生产记录目录
目录
一.批生产指令 (1)
二.物料流转表 (2)
三.批生产记录目录 (3)
四.批生产记录汇总表 (4)
五.称量岗位记录 (5)
六.称量岗位清场记录 (6)
七.粉碎记录 (7)
八.粉碎岗位清场记录 (8)
九.混合岗位记录 (9)
十.混合岗位清场记录 (10)
十一.制粒岗位记录 (11)
十二.制粒岗位清场记录 (12)
十三.总混合岗位记录 (13)
十四.总混合岗位清场记录 (14)
十五.分装岗位 (15)
十六.分装岗位清场记录 (16)
十七.批包装生产记录 (17)
批生产记录汇总表
工艺员:车间主任:生产部:
粉碎岗位记录
粉碎工序清场记录
分装岗位记录
分装岗位记录(附表)
分装岗位清场记录。
