结构化学习题解答
结构化学复习题及答案

结构化学复习题及答案一、选择题1. 原子轨道的波函数是关于原子核对称的,下列哪个轨道是关于z轴对称的?A. s轨道B. p轨道C. d轨道D. f轨道答案:A2. 根据分子轨道理论,下列哪个分子具有顺磁性?A. O2B. N2C. COD. NO答案:A3. 氢键通常影响分子的哪种性质?A. 熔点B. 沸点C. 密度D. 折射率答案:B二、填空题4. 原子轨道的电子云图是按照______概率密度绘制的。
答案:最高5. 根据价层电子对互斥理论,水分子H2O的几何构型是______。
答案:弯曲6. 一个分子的偶极矩为零,则该分子可能是______分子。
答案:非极性三、简答题7. 简述杂化轨道理论中sp^3杂化的特点。
答案:sp^3杂化是指一个原子的1个s轨道和3个p轨道混合形成4个等价的杂化轨道,这些杂化轨道的电子云呈四面体分布,通常用于描述四面体构型的分子,如甲烷。
8. 什么是分子轨道理论?它与价键理论的主要区别是什么?答案:分子轨道理论是一种化学理论,它将分子中的原子轨道组合成分子轨道来描述分子的电子结构。
与价键理论不同,分子轨道理论不假设电子成对形成共价键,而是将电子视为分布在整个分子空间中的分子轨道上的粒子。
分子轨道理论可以解释分子的磁性和电子的离域性,而价键理论则不能。
四、计算题9. 假设一个氢原子的电子从n=3的能级跃迁到n=2的能级,计算该过程中释放的光子能量。
答案:根据氢原子能级公式E_n = -13.6 eV / n^2,电子从n=3跃迁到n=2时释放的光子能量为ΔE = E_3 - E_2 = -13.6 eV / 3^2 - (-13.6 eV / 2^2) = 1.89 eV。
10. 计算一个CO分子的键能,已知C和O的电负性分别为2.55和3.44,CO的键长为1.128 Å。
答案:根据键能公式E = (χ1 - χ2)^2 / (4 * χ1 * χ2) * (1 - r / r0)^2,其中χ1和χ2分别是C和O的电负性,r是CO的键长,r0是C和O单键的标准键长1.43 Å。
结构化学基础习题答案

结构化学基础习题答案结构化学基础习题答案在学习结构化学的过程中,习题是不可或缺的一部分。
通过解答习题,我们可以巩固所学的知识,提高解决问题的能力。
下面我将为大家提供一些结构化学基础习题的答案,希望能对大家的学习有所帮助。
1. 以下化合物中,哪一个具有最高的沸点?答案:沸点取决于分子间的相互作用力。
在这些化合物中,氢键是最强的相互作用力,因此具有最高沸点的化合物应该是具有氢键的化合物。
在给出的化合物中,甲醇(CH3OH)具有氢键,因此其沸点最高。
2. 以下哪个分子是非极性分子?答案:分子的极性取决于键的极性和分子的几何形状。
如果分子中的键都是非极性的,并且分子的几何形状对称,那么该分子就是非极性分子。
在给出的分子中,二氧化碳(CO2)的键都是非极性的,并且分子的几何形状是线性的,因此二氧化碳是非极性分子。
3. 以下哪个分子是具有最高的极性?答案:分子的极性取决于键的极性和分子的几何形状。
在给出的分子中,氟化氢(HF)的键是最极性的,因为氟原子的电负性最高。
所以,氟化氢是具有最高极性的分子。
4. 以下哪个化合物是具有最高的熔点?答案:熔点取决于分子间的相互作用力。
在这些化合物中,离子键是最强的相互作用力,因此具有最高熔点的化合物应该是具有离子键的化合物。
在给出的化合物中,氯化钠(NaCl)具有离子键,因此其熔点最高。
5. 以下哪个分子是具有最高的沸点?答案:沸点取决于分子间的相互作用力。
在这些分子中,范德华力是最弱的相互作用力,而氢键是最强的相互作用力。
在给出的分子中,水(H2O)具有氢键,而其他分子都是通过范德华力相互作用的。
因此,水具有最高的沸点。
通过解答以上习题,我们可以巩固对结构化学基础知识的理解。
同时,我们也能够更好地理解分子间相互作用力对物质性质的影响。
希望这些答案能够对大家的学习有所帮助,并且激发大家对结构化学更深入的探索。
祝大家学习进步!。
高中结构化学试题及答案

高中结构化学试题及答案一、选择题(每题2分,共20分)1. 原子半径最大的元素是:A. 氢B. 氧B. 钠D. 氟2. 以下哪个元素的电子排布不是按照能量最低原理排列的?A. 氢B. 锂C. 氮D. 氧3. 化学键中,哪种键的性质是“头对头”的?A. 离子键B. 共价键C. 金属键D. 氢键4. 以下分子中,哪个是极性分子?A. CO2B. CH4C. H2OD. C2H45. 以下哪种化合物属于共价化合物?A. NaClC. H2OD. Fe6. 原子核外电子的排布遵循哪一条规则?A. 能量最低原理B. 泡利不相容原理C. 洪特规则D. 所有上述规则7. 以下哪种物质是离子晶体?A. 金刚石B. 石墨C. 食盐D. 干冰8. 以下哪种物质是金属晶体?A. 金刚石B. 石墨C. 铜D. 石英9. 以下哪种物质是分子晶体?A. 金刚石B. 石墨C. 铜D. 冰10. 以下哪种物质是原子晶体?A. 金刚石B. 石墨D. 冰答案:1. C 2. D 3. B 4. C 5. C 6. D 7. C 8. C 9. D 10. A二、填空题(每空1分,共10分)11. 原子中电子数等于________,质子数等于________。
12. 化学键的类型主要有________、________和金属键。
13. 根据分子的极性,分子可以分为________分子和极性分子。
14. 离子晶体是由________构成的,而金属晶体是由________构成的。
15. 原子晶体具有高硬度和高熔点的特性,这是因为它们具有________结构。
答案:11. 中子数,质子数 12. 离子键,共价键 13. 非极性 14. 离子,金属原子 15. 紧密排列的原子三、简答题(每题5分,共10分)16. 请简述什么是共价键,并给出一个例子。
17. 请解释什么是金属键,并说明金属晶体的一般特性。
答案:16. 共价键是由两个原子之间共享一对电子而形成的化学键。
结构化学习题解答

组态 a: m s 1 ,S 1 ;m L 3 ,L 3 ;L S 4 。因此,能量最
低的光谱支项为3F4,与光谱实验结果相同。
组态 b: m s 1 ,S 1 ,m L 2 ,L 2 ;L S 3 。因此,能量最
低的光谱支项为3D3,与光谱实验结果不同。
子组态的“电子—空位”关系,(2p)5组态与(2p)1组态具
有相同的谱项。因此,本问题转化为推求(2p)1组态的光
谱项和光谱支项。这里只有一个电子,S= ½ , L=1 ,故
光谱项为2P。又 J113或 J111 ,
22
22
因此有两个光谱支项: 2 P3 和 2 P1
2
2
对C原子激发态(1s)2(2s)2(2p)1(3p)1,只考虑组态(2p)1(3p)1即可。 2P和3P电子是不等价电子,因而(2p)1(3p)1组态不受Pauli原理限 制,可按下述步骤推求其谱项:由
2s和2p三个电子层皆充满电子,它们对整个原子的轨道
角动量和自旋角动量均无贡献。Na原子的轨道角动量和
自旋角动量仅由3s电子决定;L= 0,S = 1/2 ,故光谱项为
2S;J只能为1/2 ,故光谱支项为
S2 1/ 2
F原子的基组态为(1s)2(2s)2(2p)5。与上述理由相同,该组
态的光谱项和光谱支项只决定于(2p)5组态。根据等价电
(c)由于 p xnxcnx,p x 无本征值.可按下式计算 的p x平均值。
p l xp xdx
x
n
xn
0
l
2 sin nx ih d
2 sin nx dx
0l
l 2 dx l
l
ih
结构化学练习题带答案

结构化学复习题一、选择填空题第一章量子力学基础知识1.实物微粒和光一样,既有性,又有性,这种性质称为性。
2.光的微粒性由实验证实,电子波动性由实验证实。
3。
电子具有波动性,其波长与下列哪种电磁波同数量级?(A)X射线 (B)紫外线(C)可见光(D)红外线4。
电子自旋的假设是被下列何人的实验证明的?(A)Zeeman (B)Gouy (C)Stark (D)Stern-Gerlach5。
如果f和g是算符,则(f+g)(f—g)等于下列的哪一个?(A)f2-g2;(B)f2—g2-fg+gf; (C)f2+g2; (D)(f—g)(f+g)6.在能量的本征态下,下列哪种说法是正确的?(A)只有能量有确定值;(B)所有力学量都有确定值;(C)动量一定有确定值; (D)几个力学量可同时有确定值;7.试将指数函数e±ix表示成三角函数的形式——--——8.微观粒子的任何一个状态都可以用来描述; 表示粒子出现的概率密度。
9。
Planck常数h的值为下列的哪一个?(A)1.38×10-30J/s (B)1.38×10—16J/s (C)6。
02×10—27J·s (D)6.62×10—34J·s 10。
一维势箱中粒子的零点能是答案: 1.略。
2。
略. 3。
A 4。
D 5.B 6。
D 7.略 8.略 9。
D 10。
略第二章原子的结构性质1。
用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的?(A)2,1,—1,—1/2;(B)0,0,0,1/2; (C)3,1,2,1/2; (D)2,1,0,0。
2。
若氢原子中的电子处于主量子数n=100的能级上,其能量是下列的哪一个: (A)13。
6Ev;(B)13。
6/10000eV; (C)-13。
6/100eV;(D)—13.6/10000eV;3.氢原子的p x状态,其磁量子数为下列的哪一个?(A)m=+1;(B)m=—1;(C)|m|=1; (D)m=0;4.若将N原子的基电子组态写成1s22s22p x22p y1违背了下列哪一条?(A)Pauli原理;(B)Hund规则;(C)对称性一致的原则;(D)Bohr理论5。
结构化学试题库及答案

结构化学试题库及答案1. 请简述原子轨道的概念,并说明s、p、d轨道的形状。
答案:原子轨道是描述电子在原子核外的空间运动状态的数学函数。
s轨道呈球形,p轨道呈哑铃形,d轨道则有四个瓣状结构。
2. 什么是化学键?请列举三种常见的化学键类型。
答案:化学键是相邻原子之间强烈的相互作用,使得原子能够结合在一起形成分子或晶体。
常见的化学键类型包括离子键、共价键和金属键。
3. 描述分子轨道理论的基本原理。
答案:分子轨道理论是基于量子力学的化学键理论,认为分子中的电子不再属于单个原子,而是在整个分子范围内分布,形成分子轨道。
4. 什么是杂化轨道?请举例说明sp3杂化。
答案:杂化轨道是指原子轨道在形成化学键时,由于原子间的相互作用而重新组合成新的等价轨道。
sp3杂化是指一个s轨道和三个p轨道混合形成四个等价的sp3杂化轨道,常见于四面体构型的分子中。
5. 请解释价层电子对互斥理论(VSEPR)。
答案:价层电子对互斥理论是一种用来预测分子几何形状的理论,它基于中心原子周围的价层电子对(包括成键电子对和孤对电子)之间的排斥作用,从而推断出分子的空间几何结构。
6. 什么是超共轭效应?请给出一个例子。
答案:超共轭效应是指在有机分子中,非成键的σ电子与π电子之间的相互作用,这种效应可以增强分子的稳定性。
例如,在乙烷分子中,甲基上的σ电子可以与乙烯的π电子发生超共轭,从而稳定乙烯。
7. 描述共振结构的概念及其在化学中的重要性。
答案:共振结构是指分子中电子分布的两种或多种等效的描述方式,这些描述方式虽然不同,但都能合理地解释分子的性质。
共振结构在化学中的重要性在于它们提供了一种理解分子稳定性和反应活性的方法。
8. 什么是芳香性?请列举三个具有芳香性的化合物。
答案:芳香性是指某些环状有机化合物具有的特殊稳定性,这种稳定性来源于环上的π电子的离域化。
具有芳香性的化合物包括苯、吡啶和呋喃。
9. 请解释什么是分子的极性,并举例说明。
结构化学试题及答案

结构化学试题及答案一、选择题(每题2分,共10分)1. 以下哪个元素的原子核外电子排布遵循泡利不相容原理?A. 氢(H)B. 氦(He)C. 锂(Li)D. 铍(Be)答案:B2. 原子轨道的量子数l代表什么?A. 电子云的形状B. 电子云的径向分布C. 电子云的角动量D. 电子云的自旋答案:C3. 以下哪个化合物是离子化合物?A. 二氧化碳(CO2)B. 氯化钠(NaCl)C. 氮气(N2)D. 水(H2O)答案:B4. 共价键的形成是由于:A. 电子的共享B. 电子的转移C. 电子的排斥D. 电子的吸引答案:A5. 根据分子轨道理论,以下哪个分子是顺磁性的?A. 氮气(N2)B. 氧气(O2)C. 氟气(F2)D. 氢气(H2)答案:B二、填空题(每题2分,共10分)1. 原子轨道的量子数n=1时,可能的l值有______。
答案:02. 碳原子的价电子排布是______。
答案:2s^2 2p^23. 离子键是由______形成的。
答案:电子的转移4. 根据杂化轨道理论,甲烷(CH4)的碳原子采用______杂化。
答案:sp^35. 金属键的形成是由于______。
答案:电子的共享三、简答题(每题5分,共20分)1. 简述价层电子对互斥理论(VSEPR)的基本原理。
答案:价层电子对互斥理论认为,分子的几何构型是由中心原子周围的价层电子对之间的排斥作用决定的,这些电子对可以是成键电子对或孤对电子。
2. 什么是分子轨道理论?答案:分子轨道理论是一种化学理论,它将分子中的电子视为分布在整个分子空间内的轨道上,而不是局限于两个原子之间。
这些分子轨道是由原子轨道线性组合而成的。
3. 描述一下什么是超共轭效应。
答案:超共轭效应是指在有机分子中,通过σ键的π轨道与π键的π轨道之间的相互作用,从而降低π键的能级和增加σ键的稳定性的现象。
4. 什么是路易斯酸碱理论?答案:路易斯酸碱理论认为,酸是能够接受电子对的物种,而碱是能够提供电子对的物种。
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
结构化学习题答案

2 3x sin a a
只有2种可能的能量值:E1=h2/(8ma2),概率P1=c12=1/2
E3= 9h2/(8ma2),概率P3=c32=1/2
(2) 8ma
2 1 2 3
2
1.19 若在下一离子中运动的π电子可用一维 势箱近似表示其运动特征:
d2 exp ix( 2 ) exp[ix]dx dx
d2 exp[ ix]{( 2 ) exp[ ix]}* dx dx
d2 exp[ix]{( 2 ) exp[ ix]}dx dx
( ) d
1 1
*
e
ix
d ix (e i)dx dx
exp[ ix]{(i
d ) exp[ ix]}* dx dx
1.12 下列函数中,哪几个是算符 的本征函数?若是,求出本征值
e x , sin x,2 cos x, x 3 , sin x cos x
d2 dx 2
d2 x d2 解: 2 e 1 e x , e x是 2 的本征函数,本征值为 1 dx dx
第一章 习题
1.1 将锂在火焰上燃烧,放出红光,波长 λ=670.8nm,这是Li原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红 光的频率、波数以及以kJ/mol为单位的能量。
解
2.998 10 8 m s 1 4.469 1014 s 1 670 .8nm c
d2 (sinx cos x) (sin x cos x), sin x cos x 2 dx d2 是 2 的本征函数,本征值为 1 dx
1.17链型共轭分子CH2CHCHCHCHCHCHCH2在长 波460nm处出现第一个强吸收峰,试按一维势箱模 型估算其长度
结构化学章节习题(含答案)

结构化学章节习题(含答案)第⼀章量⼦⼒学基础⼀、单选题: 1、32/sinx l lπ为⼀维势箱的状态其能量是:( a ) 22229164:; :; :; :8888h h h hA B C D ml ml ml ml 2、Ψ321的节⾯有( b )个,其中( b )个球⾯。
A 、3 B 、2 C 、1 D 、03、⽴⽅箱中2246m lh E ≤的能量范围内,能级数和状态数为( b ). A.5,20 B.6,6 C.5,11 D.6,174、下列函数是算符d /dx的本征函数的是:( a );本征值为:( h )。
A 、e 2xB 、cosXC 、loge xD 、sinx 3E 、3F 、-1G 、1H 、2 5、下列算符为线性算符的是:( c )A 、sine xB 、C 、d 2/dx 2D 、cos2x6、已知⼀维谐振⼦的势能表达式为V = kx 2/2,则该体系的定态薛定谔⽅程应当为( c )。
A [-m 22 2?+21kx 2]Ψ= E ΨB [m 22 2?- 21kx 2]Ψ= E Ψ C [-m 22 22dx d +21kx 2]Ψ= E Ψ D [-m 22 -21kx 2]Ψ= E Ψ 7、下列函数中,22dx d ,dxd的共同本征函数是( bc )。
A cos kxB e –kxC e –ikxD e –kx2 8、粒⼦处于定态意味着:( c )A 、粒⼦处于概率最⼤的状态B 、粒⼦处于势能为0的状态C 、粒⼦的⼒学量平均值及概率密度分布都与时间⽆关系的状态.D 、粒⼦处于静⽌状态9、氢原⼦处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,⼜是M z 算符的本征函数?( c )A. (1) (3)B. (2) (4)C. (3) (4) (5)D. (1) (2) (5) 10、+He 离⼦n=4的状态有( c )(A )4个(B )8个(C )16个(D )20个 11、测不准关系的含义是指( d ) (A) 粒⼦太⼩,不能准确测定其坐标; (B)运动不快时,不能准确测定其动量(C) 粒⼦的坐标的动量都不能准确地测定;(D )不能同时准确地测定粒⼦的坐标与动量12、若⽤电⼦束与中⼦束分别作衍射实验,得到⼤⼩相同的环纹,则说明⼆者( b ) (A) 动量相同 (B) 动能相同 (C) 质量相同13、为了写出⼀个经典⼒学量对应的量⼦⼒学算符,若坐标算符取作坐标本⾝,动量算符应是(以⼀维运动为例) ( a )(A) mv (B) i x ?? (C)222x ?-? 14、若∫|ψ|2d τ=K ,利⽤下列哪个常数乘ψ可以使之归⼀化:( c )(A) K (B) K 2 (C) 1/K15、丁⼆烯等共轭分⼦中π电⼦的离域化可降低体系的能量,这与简单的⼀维势阱模型是⼀致的,因为⼀维势阱中粒⼦的能量( b )(A) 反⽐于势阱长度平⽅ (B) 正⽐于势阱长度 (C) 正⽐于量⼦数16、对于厄⽶算符, 下⾯哪种说法是对的( b )(A) 厄⽶算符中必然不包含虚数 (B) 厄⽶算符的本征值必定是实数(C) 厄⽶算符的本征函数中必然不包含虚数17、对于算符?的⾮本征态Ψ( c )(A) 不可能测量其本征值g . (B) 不可能测量其平均值.(C) 本征值与平均值均可测量,且⼆者相等18、将⼏个⾮简并的本征函数进⾏线形组合,结果( b )(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变 (C) 仍是原算符的本征函数,但本征值改变19. 在光电效应实验中,光电⼦动能与⼊射光的哪种物理量呈线形关系:( B )A .波长B. 频率C. 振幅20. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量( A)A .不能同时精确测定B .可以同时精确测定C .只有量纲不同的两种物理量才不能同时精确测定 21. 电⼦德布罗意波长为(C )A .λ=E /h B. λ=c /ν C. λ=h /p 22. 将⼏个⾮简并的本征函数进⾏线形组合,结果( A) A .再不是原算符的本征函数B .仍是原算符的本征函数,且本征值不变C .仍是原算符的本征函数,但本征值改变23. 根据能量-时间测不准关系式,粒⼦在某能级上存在的时间τ越短,该能级的不确定度程度ΔE (B)A .越⼩ B. 越⼤ C.与τ⽆关24. 实物微粒具有波粒⼆象性, ⼀个质量为m 速度为v 的粒⼦的德布罗意波长为:A .h/(mv)B. mv/hC. E/h25. 对于厄⽶算符, 下⾯哪种说法是对的 ( B )A .厄⽶算符中必然不包含虚数B .厄⽶算符的本征值必定是实数C .厄⽶算符的本征函数中必然不包含虚数 26. 对于算符?的⾮本征态Ψ (A ) A .不可能测得其本征值g. B .不可能测得其平均值.C .本征值与平均值均可测得,且⼆者相等 27. 下列哪⼀组算符都是线性算符:( C )A . cos, sinB . x, logC . x d dx d dx,,22⼆填空题1、能量为100eV 的⾃由电⼦的德布罗依波波长为( 122.5pm )2、函数:①xe ,②2x ,③x sin 中,是算符22dxd 的本征函数的是( 1,3 ),其本征值分别是( 1,—1;)3、Li 原⼦的哈密顿算符,在(定核)近似的基础上是:(()23213212232221223222123332?r e r e r e r e r e r e mH +++---?+?+?-= )三简答题1. 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光⼦的能量。
结构化学课后习题及答案
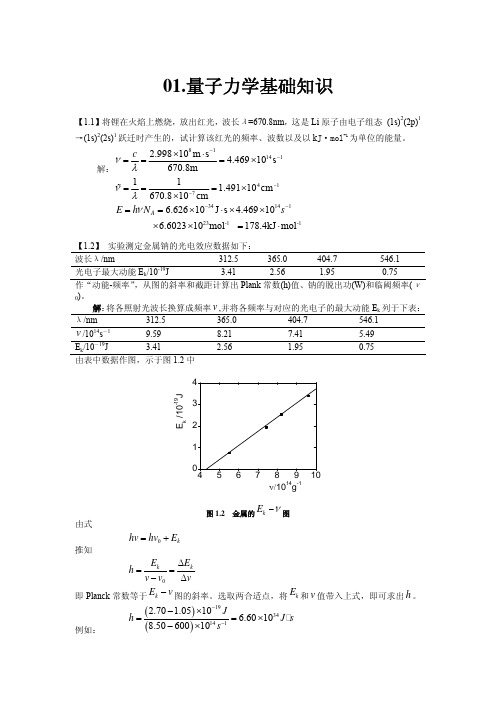
01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J·mol -1为单位的能量。
解:811412.99810m s 4.46910s 670.8m cνλ−−×⋅===× 41711 1.49110cm 670.810cm νλ−−===××%3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν−−==×⋅××××=⋅【1.2】 实验测定金属钠的光电效应数据如下:波长λ/nm 312.5 365.0 404.7 546.1 光电子最大动能E k /10-19J 3.41 2.56 1.95 0.75 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν0)。
解:将各照射光波长换算成频率,并将各频率与对应的光电子的最大动能E k 列于下表:v λ/nm 312.5 365.0 404.7 546.1v /1014s -19.59 8.21 7.41 5.49E k /10-19J 3.41 2.56 1.95 0.75 由表中数据作图,示于图1.2中E k /10-19Jν/1014g-1图1.2 金属的kE ν−图由式 0k hv hv E =+推知0k kE E h v v v Δ==−Δ即Planck 常数等于图的斜率。
选取两合适点,将和v 值带入上式,即可求出h 。
例如: k E −v k E ()()19341412.708.50 1.0510 6.601060010J h J s s −−−×==×−×图中直线与横坐标的交点所代表的即金属的临界频率,由图可知,。
中国科学技术大学结构化学习题参考答案

间恒为零。 取 xy 平 面
为
解之可得两个特解 7. (a)
(b) 在区间 8. 用 不 确 定 原 virial定理应成立。 9. 要求
整数,且
,得n为
12.
是的本 征函数, 所以动量 平方有确 粒子的 定值 几率为
-12
4. (a) 1.2 Å (b) 1.2×10 Å 5. 6. 势能算符 则圆周上的波函数不为零,其他区
作为用圆周面,则θ=90 °,r=a,Schröinger方程
理估算其电子的动能,对于Coulomb作用体系,
,
,利用单
值条件
10. 电 离能等 于轨
。
该
体
道能
量之负
2
值。
系 只有 一 个边 界 条件11. 2n 。
(即单值条件),无法
确定其通解的两个系 数 ,只 求 特解 就 可以。
了。
,当n=3
。
时有最大值
在
区间为
有限值,则k必
须是纯虚数,
此时本征值为
实数。
以忽略万有引力的贡献。
。完全可
13. 和具有相同的本征函数,本征值相差常数c。本题说明能量零点
的选取不影响体系的状态。
,
,
,
17. 0.32。
14.
15.
。
16. 0.°,135°
20.
21. ①
第 五章 多原子分 子
;(c)
3.
;(d) ;
; (e) 。
1. 。 2. 。
;
。
4. 相同。
; ,
, ,
。
11(略)。
5. 。 6.
7.
。 8. 四面体构型。
结构化学课后答案

一、练习题1.立方势箱中的粒子,具有的状态量子数,是A. 211 B. 231 C. 222 D. 213。
(参考答案)解:(C)。
2.处于状态的一维势箱中的粒子,出现在处的概率是多少?A.B.C.D.E.题目提法不妥,以上四个答案都不对。
(参考答案)解:(E)。
3.计算能量为100eV光子、自由电子、质量为300g小球的波长。
( )(参考答案)解:光子波长自由电子300g小球。
4.根据测不准关系说明束缚在0到a范围内活动的一维势箱中粒子的零点能效应。
(参考答案)解:。
5.链状共轭分子在波长方向460nm处出现第一个强吸收峰,试按一维势箱模型估计该分子的长度。
(参考答案)解:6.设体系处于状态中,角动量和有无定值。
其值是多少?若无,求其平均值。
(参考答案)解:角动量角动量平均值7.函数是不是一维势箱中粒子的一种可能的状态?如果是,其能量有没有确定值?如有,其值是多少?如果没有确定值,其平均值是多少?(参考答案)解:可能存在状态,能量没有确定值,8.求下列体系基态的多重性。
(2s+1) (1)二维方势箱中的9个电子。
(2)二维势箱中的10个电子。
(3)三维方势箱中的11个电子。
(参考答案)解:(1)2,(2)3,(3)4。
9.在0-a间运动的一维势箱中粒子,证明它在区域内出现的几率。
当,几率P怎样变?(参考答案)解:10.在长度l的一维势箱中运动的粒子,处于量子数n的状态。
求 (1)在箱的左端1/4区域内找到粒子的几率?(2)n为何值,上述的几率最大?(3),此几率的极限是多少?(4)(3)中说明什么?(参考答案)解:11.一含K个碳原子的直链共轭烯烃,相邻两碳原子的距离为a,其中大π键上的电子可视为位于两端碳原子间的一维箱中运动。
取l=(K-1)a,若处于基组态中一个π电子跃迁到高能级,求伴随这一跃迁所吸收到光子的最长波长是多少?(参考答案)解:12.写出一个被束缚在半径为a的圆周上运动的质量为m的粒子的薛定锷方程,求其解。
结构化学习题集答案

结构化学习题集答案习题选答习题11.2 600nm(红), 3.31310-19J, 199KJ2mol-1550nm(黄), 3.61310-19J, 218KJ2mol-1400nm(蓝), 4.97310-19J, 299KJ2mol-1200nm(紫), 9.93310-19J, 598KJ2mol-11.3 6.51310-34J2s1.4 (1)100eV电⼦ 122.6pm(2)10eV中⼦ 9.03pm(3)1000m/sH原⼦0.399nm1.5 ⼦弹~10-35m, 电⼦~10-6m1.6 Dx=1.226310-11m<< 10-6m1.8 (2),(4) 是线性厄⽶算符.1.9 (1) exp(ikx)是本征函数, 本征值ik.(2), (4)不是.1.101.12 , 本征值为±√B1.131.16 当两算符可对易, 即两物理量可同时测定时,式⼦成⽴.1.18 (1) (2) = l/2, (3)=01.19 0.4l~0.6l间, 基态出现⼏率0.387,第⼀激发态出现⼏率0.049.1.20 (1) 基态n x=n y=n z=1 ⾮简并(2) 第⼀激发态211, 121, 112 三重简并(3) 第⼆激发态221, 122, 212 三重简并1.23 λ=239nm.习题22.1 (1) E0=-13.6eV, E1=-3.4eV.(2) =3a0/2 ,=02.4 ψ1s波函数在r=a0, 2a0处⽐值为2.718ψ2在r=a0, 2a0处⽐值为7.389.2.6 3d z2 , 3d xy各有2个节⾯: 3d z2是2个圆锥节⾯, 3d xy是XZ,YZ⾯.2.9 (1) 2p轨道能量为-3.4eV ⾓动量为(2) 离核平均距离为5a0.(3) 极⼤值位置为4a0.2.102.11 ; He+ a0/2, F8+ a0/9.2.13(1)径向分布函数最⼤值离核距离a0/3,(2)电⼦离核平均距离为a0/2.(3) 因⽆电⼦相关, 2s, 2p态能量相同., 磁矩为2.15 轨道⾓动量为12.17 (1) N 原⼦价电⼦层半充满, 电⼦云呈球状分布.(2)基态谱项为4S, ⽀项为4S3/2(3)2p23s1光谱项: p2—3P,1D,1S, s1—2S, 偶合后4P, 2P, 2D, 2S. 2.19 Al S K Ti Mn基态谱项2P 3P 2S 3F 6S光谱⽀项2P1/23P22S1/2 3F2 6S5/22.20 C(2p13p1): 3D, 1D, 3P, 1P, 3S, 1S.Mg(3s13p1): 3P,1PTi(3d34s1): 5F,3F,5P,3P,3H,1H,3G,1G,3F,1F,3D,1D,3P,1P2.21 3d84s2态含3F4谱项2.22 I1=5.97eV , I2=10.17eV .习题33.2 CO: C∞, ∞个σv ;CO2: C∞, ∞个C2, ∞个σv, σh.3.3 顺丁⼆烯: C2, σv, σv/;反丁⼆烯: C2, σh, I3.4 (1)菱形: C2, C2', C2”, σh " D2h;(2) 蝶形: C2, σv, σv' "C2v(3) 三棱柱: C3,3C2,3σv, σh" D3h;(4) 四⽅锥: C4, 4σv" C4v(5) 圆柱体: C∞, ∞个C2, ∞个σv, σh. "D∞h(6) 五棱台: C5,5σv" C5v3.53.6 E,{C31, C32},{C2,C2',C2”},σh, {S31,S32}, {σv, σv', σv”}3.73.8 苯D6h; 对⼆氯苯D2h ; 间⼆氯苯C2v; 氯苯C2v; 萘D2h3.9 SO2 C2v, P4 T d, PCl5 D3h, S6(椅式) D3d,S8 D4d, Cl2 D∞h3.10 ①D2h②C2v ③D3h④C2v⑤D2h3.14 CoCl4F23+分⼦有2种异构体, 对⼆氟异构体为D4h, 邻⼆氟异构体为C2v3.15 ①C s②C2v③C s④C4v⑤D2h⑥C2v⑦C i⑧C2h3.16 (1) C60 I h⼦群: D5d, D5, C5v, C5, D3h, D3, C3v, C3等.(2) ⼆茂铁D5d,⼦群D5, C5v等.(3)甲烷T d, ⼦群C3v, C3, D2d, D2等.3.17 ①C3O2直线形D∞h②双氧⽔C2③NH2NH2鞍马型C2V ④F2O V形C2v ⑤NCCN 线形D∞h 3.18 8.7(邻), 5.0310-30C﹒m (间), 0 (对)3.20 ①~⑧均⽆旋光性; ①、③船式、⑦、⑧有偶极矩, 其余⽆。
结构化学习题解答

物质结构第三章习题1. 试述正八面体场、正四面体场、正方形场中,中心离子d 轨道的分裂方式;2. 试根据晶体场理论说明直线形配合物MX 2中以分子轴为z 轴,中心原子的d 轨道如何分裂,并给出这些轨道的能量高低顺序;3. 试根据晶体场理论说明三角双锥配合物中,中心原子的d 轨道如何分裂,并给出这些轨道的能量高低顺序;4. 简述分裂能与中心离子和配体的关系;5. 配体CN -,NH 3,H 2O,X -在络光谱化学序列中的顺序是 A X -< CN --< NH 3 < H 2O B CN -< NH 3< X - < H 2OC X -< H 2O < NH 3 < CN -D H 2O < X -< NH 3 < CN -6. 在下列每对络合物中,哪一个有较大的O ,并给出解释;① FeH 2O 62+ 和 FeH 2O 63+ ② bCoCl 64- 和 CoCl 42-③ CoCl 63- 和 CoF 63- ④ FeCN 64-和 OsCN 64-7. 下列配合物离子中, 分裂能最大的是ACoNH 362+BCoNH 363+CCoH 2O 63+DRhNH 363+8. 下列配位离子中,O 值最大的是A CoCl 64-B CoCl 42-C CoCl 63-D CoF 63-9. 以下结论是否正确“凡是在弱场配体作用下,中心离子d 电子一定取高自旋态;凡是在强场配体作用下,中心离子d 电子一定取低自旋态;”10. 试写出d 6金属离子在八面体场中的电子排布和未成对电子数分强场和弱场两种情况; 11. 下列络合物哪些是高自旋的A CoNH 363+B CoNH 362+C CoCN 64-D CoH 2O 63+12. 按配位场理论,正八面体场中无高低自旋态之分的组态是A d 3B d 4C d 5D d 6E d 713. 试判断下列配位离子为高自旋构型还是低自旋构型, 并写出d 电子的排布;①FeH 2O 62+②FeCN 64-③CoNH 363+④CrH 2O 62+⑤MnCN 64-14. 为什么正四面体的络合物大多是高自旋15. Ni 2+的低自旋络合物常常是平面正方形结构,而高自旋络合物则多是四面体结构,试用晶体场理论和杂化轨道理论解释之; 16. Ni 2+有两种络合物,根据磁性测定知 NiNH 342+是顺磁性,NiCN 42-为反磁性,试推测其空间结构;17. F -是弱配体,但配位离子NiF 62-却呈反磁性,这说明Ni 4+的d 电子按低自旋排布,试解释原因; 1-17答案1. 正八面体场中分裂成两组:低能级d xy , d xz , d yz t 2g ;高能级d x 2-y 2,d z 2e g 正四面体场中分裂成两组:低能级d x 2-y 2,d z 2 e ;高能级d xy , d xzd yz t 2正方形场中分裂成四组:由高到低依次为:{d xz , d yz }; {d z 2}{d xy };{d x 2-y 2}2. d z 2直指配体, 能量最高; d x 2-y 2, d xy 受到配体的斥力最小;d xzd yz 能量居中; 3. d z 2直指配体, 能量最高; d xz , d yz 受到配体的斥力最小;d x 2-y 2d xy 能量居中;4. ①配体固定时,中心离子的电荷越高,周期数越大,则越大;②中心离子固定时,随配体的变化由光谱化学序列确定该顺序几乎和中心离子无关,若只看配位原子,随配位原子半径的减小而增大:I<Br<Cl<S<F<O<N<C 5. C 6. ①FeH 2O 63+,因为Fe 3+有高电荷;②CoCl 64-,因为O >T ;③CoF 63-,因为F -是比Cl -强的配位体 ④OsCN 64-,因为Os 2+的周期数大于Fe 2+7. D NH 3是强配体,Rh 3+的电荷数高、周期数大; 8. D F -是Cl -强的配体,Co 3+引起的分裂能比Co 2+大;9. 此结论仅在正八面体场中,中心离子d 电子数为4,5,6,7时才成立;八面体场中,d 电子数为1,2,3,8,9,10时,无论强场弱场,电子只有一种排布方式,无高低自旋之分;正四面体场中,分裂能较小,故如果可有高、低自旋态,大多是高自旋态;而正方形场中则大多是低自旋态 10. 强场,t 2g 6,无未成对电子;弱场,t 2g 4e g 2,4个未成对电子 11. BD 12. A13. ①FeH 2O 62+,d 6,弱场高自旋,t 2g 4e g 2②FeCN 64-,d 6,强场低自旋,t 2g 6③CoNH 363+ d 6,强场低自旋,t 2g6④CrH 2O 62+,d 4,弱场高自旋,t 2g 3e g 1⑤MnCN 64-,d 5,强场低自旋,t 2g514. 正四面体场分裂能较小, 通常<P , 因此多高自旋配合物;15. Ni 2+为d 8组态1 根据配位场理论,若是正方形场,d 电子排布是d xz ,d yz 4d z 22d x 2-y 22,所有d 电子成对;若是四面体场,d 电子排布是e 4t 24,有两个未成对电子;2 根据杂化轨道理论,若为低自旋,则8个d 电子集中在 4 个轨道,空出的一个d 轨道和s ,p 轨道形成dsp 2杂化轨道,为平面正方形;若为高自旋,8个d 电子分布在5个d 轨道,取sp 3杂化,形成四面体形;16. NiNH342+是四面体构型,NiCN42-为正方形构型17. 分裂能随金属离子电荷增高而增大,Ni4+d6电荷高,使分裂能大于成对能,而采取低自旋排布t2g6,呈反磁性;18. 用晶体场理论推测下列络合物的未成对电子以及磁性:① FeCN64-② FeCN63-③ MnCN64-,④CoNO263-⑤ FeH2O63+⑥CoF63-19. 下列哪个络合物的磁矩最大A 六氰合钴Ⅲ离子B 六氰合铁Ⅲ离子C 六氨合钴Ⅲ离子D 六水合锰Ⅱ离子E 六氨合钴Ⅱ离子20. 下列配位离子中磁性最大的是A MnH2O63+B FeH2O63+C FeCN64-D CoNH363+E CrH2O62+21. 凡是低自旋络合物一定是反磁性物质;这一说法是否正确22. FeF63-络离子的磁矩为A 3B B 5BC BD B23. K3FeF6的磁矩为玻尔磁子,而K3FeCN6的磁矩为玻尔磁子,这种差别的原因是A 铁在这两种化合物中有不同的氧化数B CN-离子比 F-离子引起的晶体场场分裂能更大C 氟比碳或氮具有更大的电负性D K3FeF6不是络合物24. 已知FeCN63-,FeF63-络离子的磁矩分别为B,B,①分别计算两种络合物中心离子未成对电子数;②用图分别表示中心离子d轨道上电子排布情况;③两种络合物其配位体所形成的配位场,是强场还是弱场25. 某金属离子在八面体弱场中的磁矩为玻尔磁子, 而它在八面体强场中的磁矩为0, 该中心离子可能是A CrⅢB MnⅡC CoⅡD FeⅡ26. 在FeH2O62+和FeCN64-中,Fe2+的有效离子半径哪个大说明理由;27. 为什么过渡金属络合物大多有颜色28. 络合物的光谱d-d跃迁一般在什么区域A 远紫外B 红外C 可见-近紫外D 微波29. 络合物中电子跃迁属d-d跃迁,用_________光谱研究最为合适;30. 推测下列两对络合物中,哪一个络合物的d-d跃迁能量较高:①PtNH342+ , PdNH342+ ② CoCN63-, IrCN63-31.推测下列两对络合物中,哪一个络合物的d-d跃迁能量较高:①CoCN63-和IrCN63-②RhCl63-和RhCN63-32. 铁的两种络合物:A FeCN6,B Na3FeF6,它们的磁矩大小关系为A___B,它们的紫外可见光谱d-d跃迁的波长大小关系为A___B;33. 推测1六水合铁Ⅲ, 2六水合铁Ⅱ, 3六氟合铁Ⅱ三种络合物的d-d跃迁频率大小顺序A 1>2>3B 1>3>2C 3>2>1D 3>1>2E 2>1>334. 某同学测定了三种络合物d-d跃迁光谱,但忘了贴标签,请帮他将光谱波数和络合物对应起来;已知三种络合物为 CoF63-,CoNH363+,CoCN63-,它们的三个光谱波数分别为 34,000 cm-1,13,000 cm-1,23,000 cm-1;18-34答案18.络合物未成对电子磁性FeCN64-t2g6 0 反磁性FeCN63-t2g5 1 顺磁性MnCN64-t2g5 1 顺磁性CoNO263-t2g6 0 反磁性FeH2O63+t2g3e g2 5 顺磁性CoF63-t2g4e g2 4 顺磁性注,高自旋态的d电子配对情况和自由离子是相同的,例如,Co和CoF63-中,未成对d电子数都是4;19. D 络合物磁矩Bnnμμ)2(+=B为玻尔磁子, n是未成对电子数;容易看出,选项中只有D是弱场高自旋,未成对电子数为4.20. B FeH2O63+是弱场高自旋,有5个未成对电子21. 否,低自旋络合物仍可能有未成对电子;22. D Fe3+d5组态,八面体弱场,t2g3e g2,有5个未成对电子,BBBnnμμμμ9.5)25(5)2(=+=+=23. B24. Fe3+d5,八面体场,①FeCN63-:7.1)2(=+nn n=1; FeF63-:n=5② FeCN63-:低自旋,t2g5; FeF63-:高自旋,t2g3e g2③FeCN63-:强场; FeF63-:弱场25. D26. 高自旋态的离子半径大于低自旋态;FeH2O62+是弱场高自旋,FeCN64-是强场低自旋,前者Fe2+的有效半径大;27. 在配位场作用下, d轨道产生了分裂, 分裂后的能级差值落在可见光谱区域, 因此可以吸收可见光谱而产生d-d跃迁;物质的颜色为吸收的可见光谱的互补色, 故有颜色;28. C29. 紫外-可见光谱;30. 分裂能大的络合物d-d跃迁能量高①PtNH342+;② IrCN63-31. 分裂能大的络合物d-d跃迁能量高①IrCN63-;②RhCN63-32. <,<FeCN6,强场低自旋态,未成对电子少,故磁矩较小;又,分裂能大故d-d跃迁的波长较小频率或波数较大33. A 三种络合物的分裂能递增,故d-d跃迁频率递减34. CoF 63-13,000 cm -1CoNH 363+23,000 cm -1CoCN 63-34,000 cm -135. 解释为什么大多数Zn 2+的配合物无色;36. 用配位场理论判断NiCO 4不能观察到d-d 跃迁的光谱,对吗 37. 试用配位场理论解释变色硅胶变色的原因变色剂为CoCl 2; 38. 解释为什么FeF 63-是无色的39. 实验测得FeH 2O 62+配位离子在1000nm 处有一吸收峰, 试求出跃迁能级的间隔采用波数单位cm -1; 40. 求FeCN 64-的CFSE;41. 对于CoF 63-,试写出:①d 电子排布;②磁矩;③CFSE42. 已知:CoF 63-:O = 13,000 cm -1CoCN 63-:O = 34,000 cm -1P = 21, 000 cm -1确定上述两种络合物的磁性,并计算其 CFSE 以 cm -1为单位;43. 凡是中心离子电子组态为d 6的八面体络合物,其CFSE 都是相等的,这一说法是否正确 44. 已知 ML 6络合物中M 3+为d 6,f =1,g = 20,000 cm -1,P = 25,000 cm -1,求CFSE45. 为什么在过渡金属络合物中,八面体构型远较四面体构型多46. 用配位场理论估算下列离子的结构和未成对电子数: ①MoCl 63- ②RuNH 363+ ③MnO 43- ④NiI 42- ⑤AuCN 4- 47. Jahn-Teller 效应的内容为_____________; 48. 若忽略电子相互作用, d 2组态的基态在正八面体场中的简并度为_______; 49. 下列八面体络合物的电子结构中发生大畸变的是A t 2g 5e g 2B t 2g 3e g 2C t 2g 4e g 2D t 2g 6e g 335-49答案35. Zn 2+d 10的d 轨道填满电子,它通常是以sp 3杂化轨道形成配键,无d-d 能级跃迁;因此络合物一般无色;36. 对; 37. Co 2+为d 7组态;在无水CoCl 2中,当电子发生d-d 跃迁时,吸收波长为650~750nm 的红光,因而显示蓝色;但CoCl 2吸水后,变为CoH 2O 6Cl 2,即由相对较强的配体H 2O 取代了相对较弱的配体Cl -,引起分裂能变大,使电子发生d-d 跃迁时吸收的能量增大,即吸收光的波长缩短蓝移,吸收波长为490~500nm 的蓝光,因而呈粉红色;38. Fe 3+d 5的电子分占5个d 轨道,自旋平行,按照原子光谱的跃迁选律,此时t 2g →e g 的跃迁是自旋禁阻的,故FeCl 63-不吸收可见光,无色;在原子光谱中,若采用L-S 偶合,对于允许跃迁而言,两个状态的总自旋之差应等于零,即S =0,这表明当两个状态的自旋相同时,跃迁才可能发生,否则,跃迁是禁阻的,即称为自旋禁阻跃迁 39. 1/=1/1000×10-7cm=10000cm -140.t 2g 6,PD P P P q O O 22425123526SEF C -=-∆=⎥⎦⎤⎢⎣⎡+⎪⎭⎫ ⎝⎛∆-⨯-=41. ①t 2g 4e g 2;②B μ62;③ q O O O D P P 452532524CFSE =∆=⎥⎦⎤⎢⎣⎡+∆⨯+⎪⎭⎫⎝⎛∆-⨯-=42. CoF 63-:顺磁性,5200 cm -1CoCN 63-:反磁性,39600 cm -143. 否,与高、低自旋态的有关;44. 八面体络合物的分裂能可近似表示为g f O ⨯=∆,f 是配体的贡献以00.1O 2H =f 为标准,g 是中心离子的贡献;依据题意,1cm 20000-=⨯=∆g f O ,由于P O <∆,为弱场高自旋,t 2g 4e g 2,晶体场稳定化能为45. 正八面体场的LFSE 比正四面体场的CFSE 大, 只有在d 0, d和弱场d 5时二者相等, 这意味着八面体构型比四面体构型稳定所以八面体构型比四面体多;46. 离子 d 电子数 形状 d 电子排布 未成对电子数MoCl 63- d 3 八面体 t 2g 33RuNH 363+ d 5 八面体 t 2g 51MnO 43- d 2 四面体 e 22NiI 42- d 8 四面体 e 4t 242AuCN 4- d 8 正方形 d xz ,d yz 4d z 22d x 2-y 22一个配位离子究竟采取何种几何构型,主要决定于它在能量上和几何上是否有利; 对于6配位的离子,比较容易判断有时需要考虑是否会发生Jahn-Teller 效应;对于4配位的离子,因素复杂些;本题中的MnO 43-离子,从晶体场稳定化能来看,采取正方形比采取四面体构型有利,但由于MnV 半径较小47pm,若采取正方形构型,则配体之间的排斥力较大,不稳定;若采取四面体构型,则配体之间的排斥力减小,离子较稳定此时MnV 的半径也略有增大;在NiI 42-配离子中,尽管Ni 2+属d 8组态但由于它的半径仍较小,而I -的半径较大~216pm 且电负性也较大因而采取正方形构型时配体之间的斥力太大,而采取四面体构型可使斥力减小,因而稳定;同是d 8构型的Au 3+,它属第三长周期,半径较大,周围有较大的空间,此时晶体场稳定化能是决定配位离子几何构型的主导因素;由于采取正方形构型比采取四面体构型可获得较大的配位场稳定化能,因而它们的四配位离子,一般采取平面四方形,呈反磁性;47. 在对称的非线性分子中,如果体系的基态有几个简并能级,则是不稳定的,体系一定会发生畸变,使一个能级降低,以消除这种简并性; 48. 3 49. D50. 已知d x 2-y 2能级> d z 2能级>其他d 轨道能级,则应在下列何种场合产生A 正四面体场B 正八面体场C 拉长的八面体D 正方形场51. 在过渡金属的八面体络合物中,由于Jahn-Teller 效应使构型发生畸变,若为强场配体,大畸变发生在d 7,d 9,若为弱场配位体,大畸变发生在____________;52.下列络合物的几何构型哪一个偏离正八面体最大A 六水合铜ⅡB 六水合钴ⅡC 六氰合铁ⅢD 六氰合镍ⅡE 六氟合铁Ⅲ 53. 下列八面体络合物中,哪些会发生畸变为什么NiH 2O 62+,CuCl 64-,CrCN 63-,CoNH362+,FeH 2O 62+ 54.下列配为位离子中,哪个构型会发生畸变 A CrH 2O 63+B MnH 2O 62+C FeH 2O 63+D CrH 2O 62+55. 为什么 Mn 3+的六配位络离子为变形八面体,而 Cr 3+的配位络离子为正八面体构型 56. 在CuCl 2晶体中,Cu 2+周围有六个Cl -配位, 实验测得其中四个Cu —Cl 键长为230pm, 另外两个键长为295pm,试用配位场理论解释之;57. 某 AB 6n -型络合物属于O h 群,若中心原子 A 的d 电子数为6,试计算CFSE,并简单说明计算方案的理由;58. 试解释:①CoH 2O 62+比CoH 2O 63+稳定,②CoCN 63-比CoCN 64-稳定,③CoF 64-比CoBr 64-稳定; 59. 简述σ-π键的效应;60. NiCO 4中Ni 与CO 之间形成A 键B 键C -键61. CO 与过渡金属形成羰基络合物时,CO 键会A 不变B 加强C 削弱D 断裂62. 羰基络合物中,CO 键的键长比 CO 分子键长应A 不变B 缩短C 变长63. CN -是强场配体,ΔO 值特别大,按分子轨道理论,它以什么轨道形成反馈π键A 5σ轨道 B1π轨道 C2π轨道 D4σ轨道64. 试阐明银盐溶液分离烷烯烃混和物的基本原理; 65. 作图示出PtCl 3C 2H 4-中Pt 2+和C 2H 4间轨道重叠情况, 指出Pt 2+和C 2H 4 各用什么轨道成键以及电子授受情况,并讨论Pt 2+和C 2H 4形成的化学键对C 2H 4 中C-C 键的影响;50-65答案 50. C 51. d 4,d 952. A53. NiH 2O 62+,t 2g 6e g 2,不产生简并态,不发生畸变; CuCl 64-,t 2g 6e g 3,高能轨道出现简并态,大畸变; CrCN 63-,t 2g 3,不产生简并态,不发生畸变; CoNH 362+,t 2g 6e g 1,高能轨道出现简并态,大畸变; FeH 2O 62+,t 2g 4e g 2,低能轨道出现简并态,小畸变; 54. D55. Mn 3+: d 4,有Jahn-Teller 效应,发生畸变; Cr 3+: d 3,无Jahn-Teller 效应,正八面体;56. Cu 2+的d 电子排布是t 2g 6e g 3,e g 轨道上电子分布不对称, d z 2二个电子与配体斥力大, 呈拉长的八面体, 所以Cu-Cl 键长,d x 2-y 2上一个电子与配体的斥力小,Cu--Cl 键短;57. 属于O h 群,说明是理想的正八面体,没有John-Teller 效应引起的变形,d 电子应该按强场排布t 2g 6而不是弱场排布t 2g 4e g 2;58. ①H 2O 是弱场配体,对于Co 2+d 7,t 2g 5e g 2;对于Co 3+d 6,t 2g 4e g 2;前者的CFSE 较大,所以CoH 2O 62+较稳定;②CN -是强场配体,对于Co 2+d 7,t 2g 6e g 1;对于Co 3+d 6,t 2g 6;前者e g 上的一个电子很不稳定,易失去该电子而形成CoCN 63-;③CoF 64-的CFSE 较大,稳定;而CoBr 64-不稳定是由于Br -离子半径大不能形成六配位的八面体,可形成CoBr 42-,为四面体; 59. ①双重成键加强了两者之间的结合:金属离子和配体之间除了σ配键外,还有反馈π配键; ②削弱了配体内部的键:形成σ配键时,配体分子的成键π电子进入金属离子的空轨道,削弱了配体内部的键;形成反馈π键时电子从金属离子返回到配体分子的反键π轨道,去进一步削弱了配体内部的键; 60. C 61. C 62. C 63. CCN -:KK3σ24σ21π45σ21π0,其中充满电子的5σ轨道参与形成σ配键,1π空轨道参与形成反馈π键;64. Ag +的电子结构为4d 105s 0, 烯烃的电子与Ag +的5s 0形成配键,Ag的d 轨道与烯烃的反键空轨道形成反馈键, 生成稳定的-配合物而Ag +不与烷烃发生作用,从而达到分离的作用;65. Pt 2+5d 8采取dsp 2杂化,形成平面正方形配位结构,杂化轨道分别与Cl 的p 轨道和乙烯的成键轨道重叠,形成配键;Pt2+的未参与杂化的5d轨道与乙烯的反键轨道重叠形成反馈键,电子由Pt的5d流向乙烯的;乙烯成键轨道上的电子流向Pt, Pt上的电子流入乙烯的, 这两个效应均导致乙烯的C-C键削弱,键长增加;。
结构化学习题(含答案)

___________;若体系的能量为
7h2 4ma
2
,
其简并度是_______________。
二. 选择题
1. 若用电子束与中子束分别作衍射实验,得到大小相同的环纹,则说明二者( )
A. 动量相同
B. 动能相同
C. 质量相同
2. 任一自由的实物粒子,其波长为,今欲求其能量,须用下列哪个公式 ( )
量为_________;它有_____个径向节面,_____个角度节面。 3. 已知氢原子的某一状态波函数为:
n,l,m r, ,
1 26
a0
3 / 2 r e r / 2a0 .
a0
2
3 cos
则此状态角度分布的节面数为____ ,径向节面为_____个。处于该状态时,氢原 子的能量为________eV,其角动量的绝对值为|M|=______,此状态角动量在 z 方向
4. 微粒在间隔为 1eV 的二能级之间跃迁所产生的光谱线的波数 v~ 应为( )cm-1 (已知
1eV=1.602×10-19J)
A. 4032
B. 8065
C. 16130 D. 2016
5. 已知任一自由实物粒子的波长 λ,欲求其能量,须用下列( )公式
A. E h c
B.
E
h2 2m2
C.
A. d dx
B. 2
C.用常数乘 D.
E.积分
28. 在长 l=1 nm 的一维势箱中运动的 He 原子, 其零点能约为( )
A.16.5×10-24J B.9.5×10-7 J
C.1.9×10-6 J
D.8.3×10-24J
29.
在一立方势箱中,势箱宽度为
结构化学习题、详解、答案

第一章 量子力学基础题 解1.1. 给出黑体辐射频率分布函数),(T R ν的单位。
解: 黑体辐射的频率分布函数),(T R ν表示黑体辐射的频率分布,ννd ),(T R 表示在温度T 单位时间内由单位黑体表面积上所发射的频率在νννd ~+间的辐射能量。
121s m J s )(---⋅⋅=νR2m J )(-⋅=νRs m w s m sJm J 2-22⋅⋅=⋅⋅=⋅--式中w 是功率.1.2. 分别计算红光λ=600 nm 和X 射线λ=100 pm 的1个光子的能量、动量和质量。
解:λνc=,νh E =,λhp =,2ch m ν=(1) 波长1λ=600 nm 的红光,813419119310m s 6.62610J s 3.31310J 60010mE h ν----⨯⋅==⨯⋅⨯=⨯⨯ 12793411s m kg 10104.1m10600s J 10626.6----⋅⋅⨯=⨯⋅⨯==λhp 19361128123.31310J 3.68110kg (310m s )h m c ν---⨯===⨯⨯⋅ (2)X 射线2λ=100 pm8134152212310m s 6.62610J s 1.98810J 10010mE h ν----⨯⋅==⨯⋅⨯=⨯⨯ 124123422s m kg 10626.6m10100s J 10626.6----⋅⋅⨯=⨯⋅⨯==λhp 15322228121.98810J2.20910kg (310m s )h m c ν---⨯===⨯⨯⋅ 1.3. 计算波长λ=400nm 的光照射到金属铯上所产生的光电子的初速度。
已知铯的临阈波长为600nm解:根据W h T -=ν其中,201, 2e Tm W h υν== 2012e m h h υνν=-51 6.03010(m s )υ-====⨯⋅1.4. 氢原子光谱中巴尔麦系中波长最长的一条谱线的波数、波长和频率各是多少?波长最短的一条呢?解:氢原子光谱中巴尔麦系谱线的波数可表达为4, 3, )121(~~22=-=n n R ν 其中5-11.09710cm ,R=⨯ 称为Rydberg 常数。
结构化学习题解答

= 2 2sin πx cos πx cos πx = 2 sin 2πx cos πx
a aaaaa a
的箱体长度)。
解:一维箱粒子的Shrödinger方程、能量本征值En和本征函数ψ n ( x) − 2 d 2ψ ( x) = Eψ ( x)(1) 2m dx 2
En
=
h2 8ma 2
n2 (2)
ψ n(x) =
2 sin nπx (3)
aa
由ψ ( x) 和ψ n ( x)的表达式可知,① ψ ( x)是一品优函数,故ψ ( x)
dx
∂x
设体系的粒子数为1,则有
[ x, Hˆ ] = [ x,{−
2 ∂2 2m ( ∂x 2
+
∂2 ∂y 2
+
∂2 ∂z 2
) +V (x,
y, z)}]
=
[ x,{−
2 2m
∂
[x,( ∂ ∂x
)2
]
2
∂∂ ∂ ∂
= − {[ x, ] + [ x, ]}
2m ∂x ∂x ∂x ∂x
若是,则对应的本征值为何(结合一维箱粒子的势能设置思考
一下)?
3. 证明一维粒子动量算符
pˆ x
=
−i
d dx
是Hermite算符。
4. 若 Fˆ 和 Gˆ 均为Hermite算符,则 c1Fˆ + c2Gˆ 和 cFˆGˆ 是否亦为
Hermite算符?
5. 证明 [ Aˆ , Bˆ Cˆ ] = [ Aˆ , Bˆ ]Cˆ + Bˆ[ Aˆ , Cˆ ] [ Aˆ Bˆ , Cˆ ] = Aˆ[Bˆ , Cˆ ] + [ Aˆ , Cˆ ]Bˆ
结构化学试题及答案

结构化学试题及答案一、选择题(每题2分,共20分)1. 以下哪个元素的原子最外层电子数为6?A. 氢B. 碳C. 氧D. 硫答案:B2. 单质分子中,哪个分子的键角不是109.5°?A. 甲烷B. 乙烯C. 乙炔D. 二氧化碳答案:B3. 以下哪个是共价键?A. 离子键B. 金属键C. 范德华力D. 氢键答案:A4. 根据路易斯酸碱理论,以下哪个物质是酸?A. 氨气B. 氢气C. 氢氧化钠D. 二氧化碳5. 以下哪个元素的原子半径最大?A. 锂B. 钠C. 钾D. 铯答案:D6. 以下哪个化合物是离子化合物?A. 二氧化碳B. 氯化氢C. 水D. 氯化钠答案:D7. 以下哪个是分子间作用力?A. 离子键B. 共价键C. 金属键D. 氢键答案:D8. 以下哪个元素属于过渡金属?A. 氦B. 碳C. 铁D. 氖答案:C9. 以下哪个化合物具有平面三角形的分子结构?B. 乙烯C. 乙炔D. 二氧化碳答案:B10. 以下哪个元素的电子排布符合洪特规则?A. 氧B. 氮C. 碳D. 氦答案:B二、填空题(每题2分,共20分)1. 元素周期表中,第IA族的元素最外层电子数为______。
答案:12. 根据分子轨道理论,分子轨道可以分为______和______。
答案:成键轨道;反键轨道3. 金属晶体中,原子间的相互作用力主要是______。
答案:金属键4. 根据路易斯酸碱理论,酸是能够接受______的物质。
答案:电子对5. 元素的电负性越大,其原子半径越______。
答案:小6. 离子化合物中,正负离子之间的相互作用力是______。
答案:离子键7. 氢键是一种比范德华力稍强的______作用力。
答案:分子间8. 过渡金属通常具有______价电子。
答案:多个9. 二氧化碳分子的几何结构是______。
答案:线性10. 根据洪特规则,电子在原子轨道中填充时,优先单独占据______轨道。
答案:不同三、简答题(每题10分,共30分)1. 请简述什么是价层电子对互斥理论,并举例说明。
结构化学习题答案

I3和I6不是独立的对称元素,因为I3=,I6=。
4002判断:既不存在C n轴,又不存在h时,S n轴必不存在。
---------------------------- ( )4003判断:在任何情况下,2ˆn S=Eˆ。
---------------------------- ( )4004判断:分子的对称元素仅7种,即,i及轴次为1,2,3,4,6的旋转轴和反轴。
---------------------------- ( )4005下面说法正确的是:---------------------------- ( )(A) 分子中各类对称元素的完全集合构成分子的对称群(B) 同一种分子必然同属于一个点群,不同种分子必然属于不同的点群(C) 分子中有S n轴,则此分子必然同时存在C n轴和h面(D) 镜面d一定也是镜面v4006下面说法正确的是:---------------------------- ( )(A) 如构成分子的各类原子均是成双出现的,则此分子必有对称中心(B) 分子中若有C4,又有i,则必有(C) 凡是平面型分子必然属于C s群(D) 在任何情况下,2ˆn S=Eˆ4008对称元素C2与h组合,得到___________________;C n次轴与垂直它的C2组合,得到______________。
4009如果图形中有对称元素S6,那么该图形中必然包含:---------------------------- ( )(A) C6,h (B) C3,h (C) C3,i (D) C6,i4010判断:因为映轴是旋转轴与垂直于轴的面组合所得到的对称元素,所以S n 点群分子中必有对称元素h 和C n 。
---------------------------- ( )4011给出下列点群所具有的全部对称元素: (1) C 2h (2) C 3v (3) S 4 (4) D 2 (5) C 3i 4012假定 CuCl 43-原来属于 T d 点群,四个 Cl 原子的编号如下图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《物质结构》第三章习题1、试述正八面体场、正四面体场、正方形场中,中心离子d轨道的分裂方式。
2、试根据晶体场理论说明直线形配合物MX2中(以分子轴为z轴),中心原子的d轨道如何分裂,并给出这些轨道的能量高低顺序。
3*、试根据晶体场理论说明三角双锥配合物中,中心原子的d轨道如何分裂,并给出这些轨道的能量高低顺序。
4、简述分裂能∆与中心离子与配体的关系。
5、配体CN-,NH3,H2O,X-在络光谱化学序列中的顺序就是( )(A) X-< CN--< NH3 < H2O (B) CN-< NH3< X- < H2O(C) X-< H2O < NH3 < CN-(D) H2O < X- < NH3 < CN-6、在下列每对络合物中,哪一个有较大的∆O,并给出解释。
①[Fe(H2O)6]2+ 与[Fe(H2O)6]3+②(b)[CoCl6]4-与[CoCl4]2-③[CoCl6]3-与[CoF6]3-④[Fe(CN)6]4- 与[Os(CN)6]4-7、下列配合物离子中, 分裂能最大的就是( )(A)[Co(NH3)6]2+(B)[Co(NH3)6]3+(C)[Co(H2O)6]3+(D)[Rh(NH3)6]3+8、下列配位离子中,∆O值最大的就是( )(A) [CoCl6]4-(B) [CoCl4]2-(C) [CoCl6]3-(D) [CoF6]3-9、以下结论就是否正确?“凡就是在弱场配体作用下,中心离子d 电子一定取高自旋态;凡就是在强场配体作用下,中心离子d电子一定取低自旋态。
”10、试写出d6金属离子在八面体场中的电子排布与未成对电子数(分强场与弱场两种情况)。
11、下列络合物哪些就是高自旋的( )(A) [Co(NH3)6]3+(B) [Co(NH3)6]2+(C) [Co(CN)6]4-(D) [Co(H2O)6]3+12、按配位场理论,正八面体场中无高低自旋态之分的组态就是( )(A) d3 (B) d4(C) d5(D) d6(E) d713、试判断下列配位离子为高自旋构型还就是低自旋构型, 并写出d电子的排布。
①Fe(H2O)62+ ②Fe(CN)64- ③Co(NH3)63+ ④Cr(H2O)62+⑤Mn(CN)64-14、为什么正四面体的络合物大多就是高自旋?15、Ni2+的低自旋络合物常常就是平面正方形结构,而高自旋络合物则多就是四面体结构,试用晶体场理论与杂化轨道理论解释之。
16、Ni2+有两种络合物,根据磁性测定知[Ni(NH3)4]2+就是顺磁性,[Ni(CN)4]2-为反磁性,试推测其空间结构。
17、F-就是弱配体,但配位离子NiF62-却呈反磁性,这说明Ni4+的d 电子按低自旋排布,试解释原因。
【1-17答案】1、正八面体场中分裂成两组:低能级d xy, d xz, d yz(t2g);高能级d x2-y2,d z2 (e g)正四面体场中分裂成两组:低能级d x2-y2,d z2(e);高能级d xy, d xz, d yz (t2)正方形场中分裂成四组:由高到低依次为:{d xz, d yz}; {d z2};{d xy};{d x2-y2}2、d z2直指配体, 能量最高; d x2-y2, d xy受到配体的斥力最小;d xz, d yz能量居中;3*、d z2直指配体, 能量最高; d xz, d yz受到配体的斥力最小;d x2-y2, d xy 能量居中。
4、①配体固定时,中心离子的电荷越高,周期数越大,则∆越大。
②中心离子固定时,∆随配体的变化由光谱化学序列确定(该顺序几乎与中心离子无关),若只瞧配位原子,∆随配位原子半径的减小而增大:I<Br<Cl<S<F<O<N<C5、(C)6、①[Fe(H2O)6]3+,因为Fe3+有高电荷;②[CoCl6]4-,因为∆O>∆T;③[CoF6]3-,因为F-就是比Cl-强的配位体④[Os(CN)6]4-,因为Os2+的周期数大于Fe2+7、(D) NH3就是强配体,Rh3+的电荷数高、周期数大。
8、(D) F-就是Cl-强的配体,Co3+引起的分裂能比Co2+大。
9、此结论仅在正八面体场中,中心离子d电子数为4,5,6,7时才成立。
(八面体场中,d电子数为1,2,3,8,9,10时,无论强场弱场, d电子只有一种排布方式,无高低自旋之分。
正四面体场中,分裂能较小,故如果可有高、低自旋态,大多就是高自旋态;而正方形场中则大多就是低自旋态)10、强场,(t2g)6,无未成对电子;弱场,(t2g)4(e g)2,4个未成对电子11、(B)(D)12、(A)13、①Fe(H2O)62+,d6,弱场高自旋,(t2g)4(e g)2②Fe(CN)64-,d6,强场低自旋,(t2g)6③Co(NH3)63+ d6,强场低自旋,(t2g)6④Cr(H2O)62+,d4,弱场高自旋,(t2g)3(e g)1⑤Mn(CN)64-,d5,强场低自旋,(t2g)514、正四面体场分裂能较小, 通常∆<P, 因此多高自旋配合物。
15、Ni2+为d8组态(1) 根据配位场理论,若就是正方形场,d电子排布就是(d xz,d yz)4(d z2)2(d x2-y2)2,所有d电子成对;若就是四面体场,d电子排布就是(e)4(t2)4,有两个未成对电子。
(2) 根据杂化轨道理论,若为低自旋,则8个d电子集中在4 个d轨道,空出的一个d轨道与s,p轨道形成dsp2杂化轨道,为平面正方形;若为高自旋,8个d电子分布在5个d轨道,取sp3杂化,形成四面体形。
16、[Ni(NH3)4]2+就是四面体构型,[Ni(CN)4]2-为正方形构型17、分裂能随金属离子电荷增高而增大,Ni4+(d6)电荷高,使分裂能大于成对能,而采取低自旋排布(t2g)6,呈反磁性。
18、用晶体场理论推测下列络合物的未成对电子以及磁性:①[Fe(CN)6]4-②[Fe(CN)6]3-③[Mn(CN)6]4-,④[Co(NO2)6]3-⑤[Fe(H2O)6]3+⑥[CoF6]3-19、下列哪个络合物的磁矩最大( )(A) 六氰合钴(Ⅲ)离子(B) 六氰合铁(Ⅲ)离子(C) 六氨合钴(Ⅲ)离子(D) 六水合锰(Ⅱ)离子(E) 六氨合钴(Ⅱ)离子20、下列配位离子中磁性最大的就是( )(A) Mn(H2O)63+(B) Fe(H2O)63+(C) Fe(CN)64-(D) Co(NH3)63+(E) Cr(H2O)62+21、凡就是低自旋络合物一定就是反磁性物质。
这一说法就是否正确?22、[FeF6]3-络离子的磁矩为( )(A) 3μB(B) 5μB(C) 2、5μB(D) 5、9μB23、K3[FeF6]的磁矩为5、9玻尔磁子,而K3[Fe(CN)6]的磁矩为1、7玻尔磁子,这种差别的原因就是( )(A) 铁在这两种化合物中有不同的氧化数(B) CN-离子比F-离子引起的晶体场场分裂能更大(C) 氟比碳或氮具有更大的电负性(D) K3[FeF6]不就是络合物24、已知[Fe(CN)6]3-,[FeF6]3-络离子的磁矩分别为1、7μB,5、9μB,①分别计算两种络合物中心离子未成对电子数;②用图分别表示中心离子d轨道上电子排布情况;③两种络合物其配位体所形成的配位场,就是强场还就是弱场?25、某金属离子在八面体弱场中的磁矩为4、90玻尔磁子, 而它在八面体强场中的磁矩为0, 该中心离子可能就是( )(A) Cr(Ⅲ) (B) Mn(Ⅱ) (C) Co(Ⅱ) (D) Fe(Ⅱ)26、在Fe(H2O)62+与Fe(CN)64-中,Fe2+的有效离子半径哪个大?说明理由。
27、为什么过渡金属络合物大多有颜色?28、络合物的光谱(d-d跃迁)一般在什么区域( )(A) 远紫外(B) 红外(C) 可见-近紫外(D) 微波29、络合物中电子跃迁属d-d跃迁,用_________光谱研究最为合适。
30、推测下列两对络合物中,哪一个络合物的d-d跃迁能量较高:①Pt(NH3)42+ , Pd(NH3)42+ ②Co(CN)63-, Ir(CN)63-31、推测下列两对络合物中,哪一个络合物的d-d跃迁能量较高:①Co(CN)63-与Ir(CN)63-②[RhCl6]3-与[Rh(CN)6]3-32、铁的两种络合物:(A) Fe(CN)6,(B) Na3FeF6,它们的磁矩大小关系为μA___μB,它们的紫外可见光谱d-d跃迁的波长大小关系为λA___λB。
33、推测(1)六水合铁(Ⅲ), (2)六水合铁(Ⅱ), (3)六氟合铁(Ⅱ)三种络合物的d-d跃迁频率大小顺序( )(A) ν1>ν2>ν3(B) ν1>ν3>ν2(C) ν3>ν2>ν1 (D) ν3>ν1>ν2(E) ν2>ν1>ν334、某同学测定了三种络合物d-d跃迁光谱,但忘了贴标签,请帮她将光谱波数与络合物对应起来。
已知三种络合物为[ CoF6]3-,[Co(NH3)6]3+,[Co(CN)6]3-,它们的三个光谱波数分别为34,000 cm-1,13,000 cm-1,23,000 cm-1。
【18-34答案】18、络合物未成对电子磁性[Fe(CN)6]4-(t2g)60 反磁性[Fe(CN)6]3-(t2g)5 1 顺磁性[Mn(CN)6]4-(t2g)5 1 顺磁性[Co(NO2)6]3-(t2g)60 反磁性[Fe(H2O)6]3+(t2g)3(e g)2 5 顺磁性[CoF6]3-(t2g)4(e g)2 4 顺磁性注,高自旋态的d电子配对情况与自由离子就是相同的,例如,Co3+与[CoF6]3-中,未成对d电子数都就是4。
19、(D) 络合物磁矩Bnnμμ)2(+=(μB为玻尔磁子,n就是未成对电子数)。
容易瞧出,选项中只有(D)就是弱场高自旋,未成对电子数为4、20、(B) Fe(H2O)63+就是弱场高自旋,有5个未成对电子21、否,低自旋络合物仍可能有未成对电子。
22、(D) Fe3+(d5组态),八面体弱场,(t2g)3(e g)2,有5个未成对电子,BBBnnμμμμ9.5)25(5)2(=+=+=23、(B)24、Fe3+(d5),八面体场,①[Fe(CN)6]3-:7.1)2(=+nn⇒n=1; [FeF6]3-:n=5② [Fe(CN)6]3-:低自旋,(t2g)5; [FeF6]3-:高自旋,(t2g)3(e g)2③[Fe(CN)6]3-:强场; [FeF6]3-:弱场25、(D)26、高自旋态的离子半径大于低自旋态。
