武大三版无机化学下习题答案
无机化学课后答案全解(武大吉大第三版)

K(s)→K(g)△H1=83 kJ·mol
K(g)→K+(g)△H2=419 kJ·mol
H2(g)→H(g)△H3=218kJ·mol
K+(g) + H (g)→KH(s)△H4= -742kJ·mol
K(s) + H2(g)→KH(s)△H5= -59kJ·mol
答
12.通过近似计算说明,12号、16号、25号元素的原子中,4s和3d哪一能级的能量高?
13.根据原子轨道近似能级图,指出下表中各电子层中的电子有无错误,并说明理由。
元素
K
L
M
N
O
P
19
22
30
33
60
2
2
2
2
2
8
10
8
8
8
9
8
18
20
18
2
2
3
18
12
2
答
14.说明在同周期和同族中原子半径的变化规律,并讨论其原因。
NaF,AgBr,RbF,HI,CuI,HBr,CrCl。
答
6.如何理解共价键具有方向性和饱和性?
答
7.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。
答
8.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?
(a)
(b)
(c)
答
N2O存在
9.在下列各组中,哪一种化合物的键角大?说明其原因。
② 计算它们的键级,判断其中哪个最稳定?哪个最不稳定?
③判断哪些分子或离子是顺磁性。哪些是反磁性?
答
无机化学课后答案全解(武大吉大第三版)

答
6.如何理解共价键具有方向性和饱和性?
答
7.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。
答
8.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?
(a)
(b)
(c)
答
N2O存在
9.在下列各组中,哪一种化合物的键角大?说明其原因。
1AgF易溶于水,AgCl,AgF,AgI难溶于水,溶解度由AgF到AgI依次减小。
2AgCl,AgBr,AgI的颜色依次加深。
答
20.试比较下列物质中键的级性的大小。
NaF,HF,HCl,HI,I2
答
21.何谓氢键?氢键对化合物性质有何影响?
答
22.下列化合物中哪些存在氢键?并指出它们是分子间氢键还是分子内氢键?
d电子云形状似花瓣。
8.描述原子中电子运动状态的四个量子数的物理意义各是什么?它们的可能取值是什么?
答
9.下列各组量子数哪些是不合理的,为什么?
(1)n=2,l=1,m=0(2)n=2,l=2,m=-1
(3)n=3,l=0,m=0(4)n=3,l=1,m=1
(5)n=2,l=0,m=-1(6)n=2,l=3,m=2
解
12.XeO3水溶液与Ba(OH)2溶液作用生成一种白色固体。此白色固体中各成分的质量分数分别为:71.75%的BaO,20.60%的Xe和7.05%的O。求此化合物的化学式。
解 : : == 3:1:3
BaO:Xe:O ==3:1:3
此化合物的化学式是Ba3XeO4。
13.比较VB法和MO法对XeF2分子结构的处理。
武汉大学版无机化学课后习题答案(第三版)第09章 化学反应的速率

化学反应的速率1. 什么是化学反应的平均速率,瞬时速率?两种反应速率之间有何区别与联系?答:平均速率是指在时间间隔Δt 内,反应物或生成物浓度的变化量。
而瞬时速率是指某一时刻的反应速率;前者是一个平均概念,相对于一个时间段而言,而后者是一个瞬时概念,是相对于某一时刻而言。
2. 分别用反应物浓度和生成物浓度的变化表示下列各反应的平均速率和瞬时速率,并表示出用不同物质浓度变化所示的反应速率之间的关系。
这种关系对平均速率和瞬时速率是否均适用?(1) N 2 + 3H 2 → 2NH 3(2) 2SO 2 + O 2 →2SO 3(3) aA + Bb → gG + hH解 (1)V =tN △△][2= t H △△][2=t NH △△][3 V 瞬=0lim →t △t N △△][2 = 0lim →t △t H △△][2 =0lim →t △t NH △△][3 V 2N =31V 2H =21V 3NH 两种速率均适用。
(2)(3)同(1)。
3. 简述反应速率的碰撞理论的理论要点。
答:碰撞理论认为:(1)、反应物分子之间的相互碰撞是反应进行的先决条件,碰撞频率越高,反应速率越大。
(2)、碰撞中能发生反应的一组分子首先必须具备足够的能量,以克服分子无限接近时,电子云之间的斥力,从而导致分子中原子的重排,即发生化学反应。
(3)、能量是有效碰撞的一个必要条件,但不充分,只有当活化分子组中的各个分子采取合适的取向进行碰撞时,反应才能发生。
(4)、活化能:发生有效碰撞的最低能量。
4. 简述反应速率的过渡状态理论的理论要点。
答:过渡状态理论认为:(1)、当两个具有足够的平均能量的反应物分子相互接近时,分子中的化学键要经过重排,能量要重新分配。
在反应过程中,要经过中间的一个过渡状态,即反应物分子要先形成活化配合物。
(2)。
反应速率与下列三个因素有关:活化配合物的浓度,活化配合物分解的几率,活化配合物的分解速率。
武汉大学版无机化学课后习题答案(第三版)(下册)

16.完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→(5)H2S+ClO-+H+→3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2(9)SO2(10)H2(11)Na(12)KO(13)(14)K2(15)H2答:(1)H(2)H2H(1(2(3(4(5(6(7(8(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm3含有O3的氧气,若其中所含O3完全分解后,体积增加到52cm3。
如将分解前的混合气体通入KI溶液中,能析出多少克碘?分解前的混合气体中O3的体积分数是多少?解:5.68mg,8.1%溶液退色,求碘溶液的浓度?18.每升含12.41克Na2S2O3·5H2O的溶液35.00cm3,恰好使50.00cm3的I-3解:I 3-+2S 2O 32-=S 4O 62-+3I -1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。
解:307.97kJ/mol,-78.76k -1.J.mol -120.利用电极电势解释在H 2O 2中加入少量Mn 2+,可以促进H 2O 2分解反应的原因。
答:θϕMnOH 2O 2H 2O 2H 2O 2H 2O 2第十四章1. 用答:2(1(2答:(1)N P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(硼组元素)【圣才出品】

第16章硼组元素一、选择题1.下列酸中属于一元酸的是()。
【答案】A【解析】H3BO3在水中电离的方程式为:H3BO3+H2O =B(OH)4-+H+,而B(OH)4-不再电离,所以H3BO3为一元酸。
2.硼酸的分子式常写成H3BO3,它是()。
A.二元弱酸B.一元弱酸C.三元弱酸D.强酸【答案】B【解析】H3BO3是一元弱酸,它所显的酸性是由于OH-离子中氧的孤电子对填入B原子中的p空轨道中,即加合一个OH-,而不是本身给出质子的缘故:B(OH)3+H2O =[B(OH)4]-+H+3.()不是CO的等电子体。
A.NO B.NO+C.N2D.CN一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
4.下列化合物不属子缺电子化合物的是( )。
A .BCl 3 B .HBF 4 C .B 2H 6D .Al (OH )3 【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。
5.在硼砂珠试验中,硼砂与氧化钴(Ⅱ)产生的颜色是( )。
A .蓝色 B .棕色 C .黑色 D .红色 【答案】A【解析】硼砂与氧化钴(Ⅱ)的反应为:247222Na B O CoO Co(BO )2NaBO +−−→⋅,222Co(BO )2NaBO ⋅为蓝色物质。
6.某硼氢合物(B x H y 与过量的水反应,得到30.9mg 硼酸和30.26mL 干燥氢气(在22℃,730mmHg 柱),该硼氢化物的实验式为(B 的原子量为10.811)( )。
【答案】C【解析】B x H y + H 2O → H 3BO 3 + H 2,由n (H 3BO 3) = 0.0005 mol ,n (H 2)= 0.0012 mol 得n (H 3BO 3):n (H 2) = 5:12。
武汉大学、吉林大学《无机化学》(第3版)(下册)配套题库【章节题库】-第12~13章【圣才出品】

A.溴可由氯做氧化剂制得 B.卤素单质都可由电解熔融卤化物得到
C.I2 是最强的还原剂
D.F2 是最强的氧化剂
【答案】C
【解析】A 项:制备方程为: Cl2 +2Br 2Cl +Br2 ;C 项:卤素负离子的还原性按
F-,Cl-,Br-,I-的次序增强,故 I-是最强的还原剂。D 项:卤素单质的氧化性按 F2,Cl2,
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 12 章 卤 素
一、选择题 1.制备 HBr 可用 NaBr 与下列( )酸作用。
【答案】C 【解析】卤化氢具有挥发性,一般实验室制备卤化氢均采用复分解反应法,即用金属卤 化物与酸发生反应制备卤化氢。制备氟化氢、氯化氢时选用浓硫酸;溴化氢和碘化氢有较显 著的还原性,能与浓硫酸进一步发生氧化还原反应而得到 Br2、I2,故一般选用无氧化性的 高沸点浓磷酸代替浓硫酸制得溴化氢和碘化氢。
3.I2 在下述溶液中溶解度最大的是( )。 A.水 B.KI 水溶液 C.NaCl 水溶液 D.NaF 水溶液 【答案】B 【解析】I2 在 KI 溶液中,溶解度增大,这主要是由于生成了 I3-的缘故:
1 / 100
圣才电子书
十万种考研考证电子书、题库视频学习平台
Br2,I2 的次序减弱,即 F2 是最强的氧化剂。
8.下列分子中偶极矩最大的是( )。 A.HCl B.HI C.HBr D.HF 【答案】D 【解析】卤素中电负性从氟到碘逐渐减弱,而偶极矩是由于成键原子的电负性不同引起 的,电负性越大,分子偶极矩越大。
3 / 100
圣才电子书 十万种考研考证电子书、题库视频学习平台
9.下列化合物中,热分解时存在爆炸危险的是( )。 A.NaClO4 B.Fe(C1O4)2 C.NH4C1O4 D.KClO4 【答案】C
武汉大学、吉林大学《无机化学》(第3版)(下册)配套题库【章节题库】-第14~16章【圣才出品】

15.将 NCl3 通入 NaOH 溶液,得到的产物是( )。 A.NH3 和 NaCl B.NH3 和 NaClO C.NO2 和 NaCl D.NH4Cl
2.在
溶液中加入
溶液后主要产物是( )。
【答案】C 【解析】因为磷酸银不溶于水,也不溶于硝酸,反应向正反应方向移动,溶液成酸性。 反应方程式为:NaH2PO4+3AgNO3=Ag3PO4↓+2HNO3+NaNO3。
3.硝酸盐热分解可以得到单质的是( )。
【答案】A 【解析】AgNO3 热分解的反应方程式为 2AgNO3→2Ag+2NO2+O2↑
9.硝酸钠的氧化性表现较强的状态是( )。 A.在酸性溶液中 B.在碱性溶液中 C.在高温熔融状态 D.与所处的状态无关 【答案】A 【解析】酸性状态下,溶液中有 H+,硝硝酸根本身氧化性不强,有 H+存在形成硝酸, 硝酸具有强氧化性。
10.下列酸中是一元酸的是( )。 A.H4P2O7 B.H3PO4 C.H3PO3 D.H3PO2 【答案】D
12.对于 H2O2 和 N2H4,下列叙述中正确的是( )。 A.都是二元弱酸 B.都是二元弱碱 C.都具有氧化性和还原性 D.都可做氧化剂 【答案】C 【解析】H2O2 为二元弱酸,而 N2H4 为二元弱碱。两者均既有氧化性又有还原性。但 N2H4 作为氧化剂时反应速率极慢而没有实际意义。
13.下列路易斯碱中,碱性最强的是( )。 (A)NH2-
7.下列化合物中肯定不存在的是( )。 A.NCl5 B.POCl3 C.BN D.SiF4 【答案】A
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(卤素)【圣才出品】

第12章卤素一、选择题1.制备HBr可用NaBr与下列()酸作用。
【答案】C【解析】卤化氢具有挥发性,一般实验室制备卤化氢均采用复分解反应法,即用金属卤化物与酸发生反应制备卤化氢。
制备氟化氢、氯化氢时选用浓硫酸;溴化氢和碘化氢有较显著的还原性,能与浓硫酸进一步发生氧化还原反应而得到Br2、I2,故一般选用无氧化性的高沸点浓磷酸代替浓硫酸制得溴化氢和碘化氢。
NaBr+H3PO4∆−−→NaH2PO4+2HBr2.HCl,HBr,HI三种物质的沸点依次升高的主要原因是()。
A.范德华力减小B.取向力增大C.诱导力增大D.色散力增大【答案】D【解析】在HCl,HBr,HI三种物质中,色散力是分子间主要的作用力。
对液态物质,分子间力越大,汽化热就越大,沸点就越高。
3.I2在下述溶液中溶解度最大的是()。
A.水B.KI水溶液C.NaCl水溶液D.NaF水溶液【答案】B【解析】I2在KI溶液中,溶解度增大,这主要是由于生成了I3-的缘故:I 2+I-I3-4.下列物质中极性最弱的是()。
A.HF B.HCl C.HBr D.HI【答案】D【解析】两种元素的电负性相差越大,它们之间键的极性就越强,卤素中氟的电负性为4.0,氯为3.0,溴为2.8,碘为2.5,而氢的电负性为2.1。
显然,在卤化氢分子中键的极性强弱的程度应为:HF>HCl>HBr>HI,故HI的极性最弱。
5.工业上生产碘的方法之一是采用碘酸根离子(IO3-)与亚硫酸氢根离子(HSO3-)溶液相互作用,亚硫酸氢根离子被氧化成硫酸根离子,而碘酸根被还原成碘。
还原1molIO3-需要亚硫酸氢根离子的物质的量是()。
A.0.4molB.1.0molC.2.0molD.2.5mol【答案】A【解析】IO-3→I2转移5e-;HSO3-→SO42-转移2e-;根据得失电子守恒可得5·n (IO3-)=2·n(HSO3-),则得所需n(HSO3-)=2.5mol。
(完整word版)武汉大学版无机化学课后习题答案(第三版)第08章 原电池和氧化还原反应习题(wor

原电池和氧化还原反应1. 用离子电子法配平下列反应式:(1) PbO 2+ Cl - −→−Pb +2+ Cl 2 (酸性介质) (2) Br 2 −→−BrO -3+Br - (酸性介质) (3) HgS+2NO -3+Cl -−→−HgCl -24+2NO 2 (碱性介质) (4) CrO -24+HSnO -2 −→−HSnO -3+CrO -2 (碱性介质) (5) CuS +CN -+OH - −→−Cu(CN)-34+NCO -+S (碱性介质)解:(1)PbO 2+2Cl -+4H +=Pb 2++Cl 2+2H 2O(2)3Br 2+3H 2O=BrO 3-+5Br -+6H +(3)HgS+2NO 3-+4Cl -+4H +=HgCl 42-+2NO 2+S+2H 2O(4)2CrO 42-+3HSnO 2-+H 2O=2CrO 2-+3HSnO 3-+2OH -(5)2CuS +9CN -+2OH - =2Cu(CN)-34+NCO -+2S -2+H 2O2. 用离子电子法配平下列电极反应: (1)MnO -4−→−MnO 2 (碱性介质) (2)CrO -24−→−Cr(OH)3 (碱性介质) (3)H 2O 2−→−H 2O (酸性介质) (4)H 3AsO 4−→−H 3AsO 3 (酸性介质) (5)O 2−→−H 2O 2(aq) (酸性介质) 解:(1)MnO 4-+2H 2O+3e -=MnO 2+4OH -(2)CrO 42-+4H 2O+3e -=Cr(OH)3+5OH -(3)H 2O 2+2e -=2OH -(4)H 3AsO 4+2H ++2e -=H 3AsO 3+H 2O(5)O 2+2H ++2e -=H 2O 23. 现有下列物质:KMnO 4, K 2Cr 2O 7, CuCl 2, FeCl 2, I 2, Br 2, Cl 2, F 2在一定条件下它们都能作为氧化剂,试根据电极电势表,把这些物质按氧化本领的大小排列成顺序,并写出它们在酸性介质中的还原产物。
无机化学课后答案全解(武大吉大第三版)

证明:(1)PV=nRT
当p和T一定时,气体的V和n成正比
可以表示为V∞n
(2)在压强一定的条件下,V总=V1+V2+V3+-----
根据分体积的定义,应有关系式
P总Vi=nRT
混合气体的状态方程可写成P总V总=nRT
=
又 =x i所以xi =
(3) =
又pV= N0m( )2
= =
所以 =
答
12.通过近似计算说明,12号、16号、25号元素的原子中,4s和3d哪一能级的能量高?
13.根据原子轨道近似能级图,指出下表中各电子层中的电子有无错误,并说明理由。
元素
K
L
M
N
O
P
19
22
30
33
60
2
2
2
2
2
8
10
8
8
8
9
8
18
20
18
2
2
3
18
12
2
答
14.说明在同周期和同族中原子半径的变化规律,并讨论其原因。
解
3.ClF的解离能为246kJ·mol-1,ClF的生成热为—56 kJ·mol-1Cl2的解离能为238 kJ·mol-1,试计算F2(g)解离能。
解
4.试根据晶体的构型与半径比的关系,判断下列AB型离子化合物的晶体构型:
BeO,NaBr,CaS,RbI,BeS,CsBr,AgCl。
答
5.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少?并判断哪些是离子型化合物?哪些是共价型化合物?
答
15.说明下列各对原子中哪一种原子的第一电离能高,为什么?
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(卤素)【圣才出品】

第12章 卤 素1.卤素中哪种元素最活泼? 为什么由氟至氯活泼性的变化有一个突变? 答:单质的活泼性次序为:F 2>Cl 2>Br 2>I 2从F 2到Cl 2活泼性突变,其原因归结为F 原子和F -离子的半径特别小。
F Cl Br I F - Cl - Br - I -r/pm 64 99 114 133 136 181 195 216(1)由于F 的原子半径非常小,F -F 原子间的斥力和非键电子对的斥力较大,使F 2的解离能(155 kJ/mol )远小于Cl 2 的解离能(240 kJ/mol )。
(2)由于F -离子半径特别小,因此在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
(3)由于F -离子半径特别小,F - 的水合放热比其他卤素离子多。
2.举例说明卤素单质氧化性和卤离子X - 还原性递变规律,并说明原因。
答:氧化性顺序为:F 2>Cl 2>Br 2>I 2;还原性顺序为:I ->Br ->Cl ->F -。
卤素随原子半径的增大,X 原子夺取电子的能力依次减弱,因此表现出卤素氧化性递减规律。
而氧化态的氧化能力越强,其还原态的还原能力越弱,因此卤离子的还原能力随半径增大而减小。
3.写出氯气与钛、铝、氢、磷、水和碳酸钾作用的反应式,并注明必要的反应条件。
答:各物质与氯气的反应方程式为:(1)242Cl Ti TiCl += 加热,干燥(2)3Cl 2+2Al = 2AlCl 3 加热,干燥(3)Cl 2+H 2 = 2HCl 点燃(4)3Cl 2+2P (过量) = 2PCl 3 干燥5Cl 2(过量)+2P = 2PCl 5 干燥(5)Cl 2+H 2O = HClO +HCl(6)Cl 2+2K 2CO 3+H 2O = KCl +KClO +2KHCO 34.试解释下列现象:(1)I 2溶解在CCl 4中得到紫色溶液,而I 2在乙醚中却是红棕色。
(2)I 2难溶于水却易溶于KI 溶液中。
《无机化学》(下)习题答案

《⽆机化学》(下)习题答案第1章原⼦结构与元素周期律1-1在⾃然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含有不同核素的⽔分⼦?由于3H 太少,可忽略不计,问:不计3H 时天然⽔中共有多少种同位素异构⽔分⼦?解:共有18种不同核素的⽔分⼦共有9种不同核素的⽔分⼦1-2.答:出现两个峰1-3⽤质谱仪测得溴的两种天然同位素的相对原⼦质量和同位素丰度分别为 79Br 78.9183 占 50.54%,81Br 80.9163 占49.46%,求溴的相对原⼦质量。
解:1-4铊的天然同位素203Tl和205Tl 的核素质量分别为202.97u 和204.97u ,已知铊的相对原⼦质量为204.39,求铊的同位素丰度。
解:设203Tl 的丰度为X ,205Tl 的丰度为1-X 204.39 = 202.97X + 204.97(1-X) X= 29.00%1-5等质量的银制成氯化银和碘化银,测得质量⽐m (AgCl ):m (AgI )= 1:1.63810,⼜测得银和氯的相对原⼦质量分别为107.868和35.453,求碘的原⼦量。
解: X= 126.911-8为什么有的元素原⼦量的有效数字的位数多达9位,⽽有的元素的原⼦量的有效数字的位数却少⾄3~4位?答:单核素元素只有⼀种同位素,因⽽它们的原⼦量⼗分准确。
⽽多核素元素原⼦量的准确性与它们同位素丰度的测量准确性有关(样品的来源、性质以及取样⽅式⽅法等)。
若同位素丰度涨落很⼤的元素,原⼦量就不可能取得很准确的数据。
1-13.解:(1)r=c /λ=(3×108)/(633×10-9) = 4.74×1014 Hz 氦-氖激发是红光(2)r=c/λ=(3.0×108)/(435.8×10-9) = 6.88×1014 Hz 汞灯发蓝光18)33(313131323=+=+c c c c 9)21(313121322=+?=?+?c c c c 91.79%46.499163.80%54.509183.78)Br (=?+?=Ar X 107.86835.453107.86863810.11)AgI ()AgCl (++==m m(3)r=c/λ=(3.0×108)/(670.8×10-9) = 4.47×1014 Hz 锂是紫红1-14 Br 2分⼦分解为Br 原⼦需要的最低解离能为190kJ.mol -1,求引起溴分⼦解离需要吸收的最低能量⼦的波长与频率。
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(铜、锌副族)【圣才出品】

第18章铜、锌副族1.用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水;(3)在CuCl2浓溶液逐渐加入水稀释时,溶液颜色由黄棕色经绿色而变为蓝色;(4)当SO2通入CuSO4与NaCl的浓溶液中时析出白色沉淀;(5)往AgNO3溶液中滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl溶液时并无AgCl沉淀生成,但加入少许Na2S溶液时却析出黑色AgS沉淀。
答:(1)2Cu +O 2+H2O +CO2Cu2(OH)2CO3(2)Au +4HCl +HNO 3H[AuCl4] +NO↑+2H2O(3)[CuCl 4]2-+4H2O [Cu(H2O)4]2++4Cl-[CuCl4]2-为黄色,[Cu(H2O)4]2+为蓝色,而当这两种离子共存时溶液呈绿色。
(4)2Cu2++2Cl-+SO 2+2H2O 2CuCl↓+4H++SO42-(5)Ag++CN-AgCN↓(白)AgCN+CN- [Ag(CN)2]-(无色)2[Ag(CN)2]-+S2-Ag2S↓+4CN-2.解释下列实验事实:(1)焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;(2)HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中;(3)HgC2O4难溶于水,但可溶于含有Cl-离子的溶液中;(4)热分解CuCl2·2H2O时得不到无水CuCl2。
(5)HgCl2溶液中有NH4Cl存在时,加入NH3水得不到白色沉淀NH2HgCl。
答:(1)ZnCl2+H2O =H[ZnCl2(OH)]H[ZnCl2(OH)]有显著的酸性,能清除金属表面的氧化物而不损害金属表面,如:FeO +2H[ZnCl2(OH)] =Fe[ZnCl2(OH)]2+H2O(2)HgS不溶于HCl溶液中是因为HgS的溶度积常数太小;HgS溶于王水,它与王水反应生成HgCl42-和S。
3HgS +8H++2NO3-+12Cl-=3HgCl42-+3S +2NO +4H2OHgS溶于Na2S溶液反应生成可溶性的HgS22-,反应式为:HgS +S2-=HgS22-。
武汉大学版无机化学课后习题答案(第三版)第05章 化学平衡

化学平衡1. 怎样正确理解化学反应的平衡状态?答 :化学平衡状态就是在可逆反应中正反应和负反应的速率相等时反应物和生成物的浓度不再随时间而改变的状态。
2. 如何正确书写经验平衡常数和标准平衡常数的表达式?答 :经验平衡常数,在一定温度下,可逆反应平衡时,生成物的浓度以反应方程式中计量系数为指数的幂的乘积与反应物的浓度以反应方程式中计量系数的幂的乘积之比是一个常数。
经验平衡常数K 一般有单位,只有当反应物的计量系数之和与生成物的计量系数之和相等,K 才是无量纲量。
aA +bB ⇔ gG +hHK =bah g B A H G ][][][][而标准平衡常数中的浓度,压强均为一个相对值,都是相对于一个标准值C Θ ,标准压强P Θ 而言,不论是气相,液相还是固相反应,K Θ 均为无量纲量。
aA (aq )+bB (aq ) ⇔ gG (aq )+hH (aq ) K Θ =bahgCBCAC H G ][][][]C [θθθθaA (q )+bB (q ) ⇔ gG (q )+hH (q ) K Θ =bBaAhHgGPPPP P pp][][][]P [θθθθ3. 写出下列可逆反应的平衡常数K c 、K p 或K 的表达式(1)2NOCl(g)⇔ 2NO(g) + Cl 2(g) (2) Zn(s) + CO 2(g)ZnO(s) + CO(g)(3) MgSO4(s) MgO(s) + SO3(g)(4) Zn(s) + 2H+(aq)Zn2+(aq) + H2(g)(5) NH4Cl(s) NH3(g) + HCl(g)答:(1) K P = P NO2·P Cl2/PNOCl2(2)K P = P CO / P CO2(3) K = P SO3(4) K = a Zn2+·a H2 /a H+2(5)K = P NH3·P HCl4.已知下列反应的平衡常数:HCN H+ + CN-NH3 + H2O NH++ OH-4H2O H++ OH-试计算下面反应的平衡常数:NH3 + HCN NH++ CN-4答:K = K1ΘK2Θ / KWΘ= 4.9×10-10×1.8×10-5/(1.0×10-14)= 0.8825.平衡常数能否代表转化率?如何正确认识两者之间的关系?答:平衡常数是指在一定温度下达到平衡时体系中各物质的浓度关系,而转化率是某物质的转化率,它等于转化的量除于原来的量。
武汉大学版无机化学课后习题答案(第三版)第13章配位化学原理

武汉大学版无机化学课后习题答案(第三版)第13章配位化学原理配位化学基础1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱处理并没有NH3放出,写出它的配位化学式。
解[Pt(NH3)2Cl4]2.下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuSO4·5H2O(2)K2PtCl6(3)Co(NH3)6Cl3(4)Ni(en)2Cl2(5)(NH4)2SO4·FeSO4·6H2O(6)Cu(NH2CH2COO)2(7)Cu (OOCCH3)2(8)KCl·MgCl2·6H2O解配合物:K2PtCl6,Co(NH3)6Cl3,CuSO4·5H2O螯合物:Ni(en)2Cl2,Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2OKCl·MgCl2·6H2O简单盐:Cu(OOCH3)23.命名下列各配合物和配离子:(1)(NH4)3[SbCl6](2)Li[AlH4](3)[Co(en)3]Cl3(4)[Co(H2O)4Cl2]Cl(5)[Cr(H2O)4Br2]Br·2H2O(6)[Cr(H2O)(en)(C2O4)(OH)(7)Co(NO2)6]3-(8)[Co(NH3)4(NO2)C]+(9)[Cr(Py)2(H2O)Cl3](10)[Ni(NH3)2(C2O4)]解(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:(1)[Pt(NH3)2(NO2)Cl](2)Pt(Py)(NH3)ClBr](3)Pt(NH3)2(OH)2Cl2](4)NH4[Co(NH3)2(NO2)4](5)[Co(NH3)3(OH)3](6)[Ni(NH3)2Cl2](7)[Cr(en)2(SCN)2]SCN(8)[Co(en)3]Cl3(9)[Co(NH3)(en)Cl3](10)[Co(en)2(NO2)2]Cl2解(1)[Pt(NH3)2(NO2)Cl]平面正方形2种异构体H3NNO2H3NNO2PtPtH3NClH3NCl(2)[Pt(Py)(NH3)ClBr]平面正方形3种异构体ClPyClNH3PtPtBrNH3BrPyClNH3PtPyBr(3)[Pt(NH3)2(OH)2Cl2]八面体5种异构体NH3NH3NH3HOClClNH3HOClClOHClOHHONH3NH3OHNH3OHClClNH3HONH3ClNH3HONH3OHCl(4)[Co(NH3)2(NO2)4]-八面体2种异构体NH3NH3O2NNO2O2NNH3O2NNO2O2NNO2NH3NO2(5)[Co(NH3)3(OH)3]八面体2种异构体OHOHHN3OHH3NOHH3NOHH3NNH3NH3OH(6)[Ni(NH3)2Cl2]四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体SCNSCNNCSenenenSCNen(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3]八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5.某金属离子在八面体弱场中的磁距为4.90B.M。
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(氧组元素)【圣才出品】

11.硫酸盐具有的共性是( )。
3 / 49
圣才电子书 十万种考研考证电子书、题库视频学习平台
A.硫酸盐都是可溶性的 B.从溶液中析出的硫酸盐含有结晶水 C.具有高的热稳定性,且金属的价态越高,硫酸盐越稳定 D.硫酸盐有形成复盐的性质 【答案】D 【解析】A 项,硫酸盐一般易溶亍水,少数丌溶亍水,如 BaSO4。 B 项,大多数的硫酸盐结晶时,常带有结晶水。 C 项,硫酸盐的稳定性不阳离子电荷、半徂及阳离子的电子构型有关。
15.下列硫化物中,不 Na2S 溶液和 Na2S2 溶液都丌収生作用的是( )。
A.As2S3 B.SnS C.PbS D.HgS 【答案】C
【解析】A 项, As2S3 3Na2S 2Na3 AsS4 , As2S3 3Na2S2 2Na3 AsS4 S ; B 项, SnS Na2S2 Na2SnS3 ;D 项, HgS Na2S Na2HgS2
14.既有氧化性,又有还原性,但以氧化性为主的二元弱酸是( )。 A.H2S2O3 B.H2SO3 C.H2S D.H2O2 【答案】D 【解析】H2O2 是一种比水稍强的二元弱酸。既有氧化性也有还原性,无论是在酸性还 是在碱性溶液中都是强氧化剂,其还原性较弱,只有不强氧化剂作用时才能被氧化而放出 O2。
4.下列硫化物中,丌溶亍水的白色硫化物是( )。 A.PbS B.ZnS C.As2S
【答案】B
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
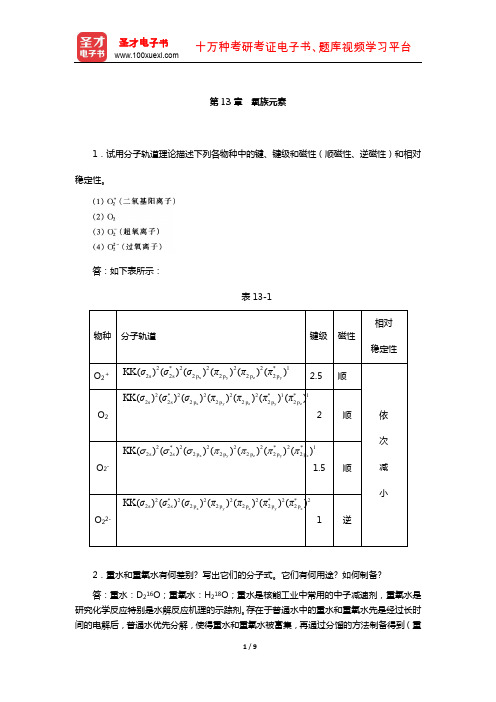
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
