羧酸的还原和脱羧反应.
羧酸的反应1

LiAlH4不能还原碳碳双键,但羰基、氰基等能同时被还原。
CH2
CHCH2COOH
① LiAlH4 ② H2O
CH2
CHCH2CH2OH
Hale Waihona Puke 2 乙硼烷的还原作用 CH2
用B2H6还原羧酸时,碳碳双键同时被还原。 ① B2H6
CHCH2COOH
② H2O
CH3CH2CH2CH2OH
基团的反应性能排序: —COOH> >—CN—COOR—COCl
羧酸的还原
羧酸很难被一般的催化加氢还原, 羧酸很难被一般的催化加氢还原,但与氢化铝锂 或者乙硼烷反应时可以被顺利还原成一级醇: 1 氢化铝锂的还原作用
CH2=CH—CH2—COOH→CH2=CH—CH2—CH2OH (保留了碳碳双键) O2N—C6H5—COOH→O2N—C6H5—CH2OH (保留了苯环) 氢化铝锂还原羧酸分两个阶段:第一阶段是把羧酸还原成 醛;第二阶段是把醛与氢化铝锂反应,再在稀酸环境中水 解得醇。 反应环境:非极性溶剂(多用THF与Et2O) 反应特色:还原羰基结构
脱羧反应
引入:实验室制备甲烷 CH3COONa+NaOH→Na2CO3+CH4↑
脱羧反应的机理
在适合的条件下,羧酸一般都能发生失羧反应。
∆,碱
A-CH2COOH → A-CH3+CO2↑
当A为吸电子基团,如:A=COOH, CN, C=O, 为吸电子基团, A=COOH, CN, C=O, 失羧反应极易进行。 NO2, CX3,C6H5等时。失羧反应极易进行。
环 状 过 渡 态 机 理
O O
RCCH2COH
互变异构
≡
O
R
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
羧酸反应总结

.精品羧酸反应总结PCl 3PCl 5 POCl 3 + HClSOCl 2SO 2 + HClH 3PO 3回流C O HO R'C O R O C 25C OR NH 2H NH 2H OR'C OR OR'+ H 2OH C OR OH+O R'COCl R+羧酸与氨或胺作用生成羧酸铵,加热后脱水得酰胺或N-取代酰胺。
R C O OH+NH 3R C OONH 4R C ONH 2+H 2O+CH 3C O OHNH 2OHOH-H 2O ΔCH 3C O NH羧基难还原,需用强还原剂LiAlH4可见,LiAlH4不还原孤立的>C=C<,B2H6能还原孤立的>C=C<。
脱羧反应(1)羧酸盐脱羧(2)α-碳原子上连有吸电子基的羧酸,受热易脱羧(3) Kolbe 反应电解羧酸盐溶液,在阳极发生烷基的偶合,生成烃。
(4)汉斯狄克法(5)二元酸加热后的变化规律Blanc 规则:在可能成环时总是较易形成较稳定的五元或六元环状化合物。
α-氢原子的卤代反应生成的α-卤代酸可以转化成各种取代酸:羧酸的制法伯醇或醛的氧化烃的氧化腈的水解由格氏试剂制备(CH 3)3C COOH(CH 3)3C CH 2OH LiAlH 4H 3O+Cl 3C COOH△CHCl 3 + CO 2C=O CH 2COOHC=O CH 3△+ CO 22 CH 3(CH 2)12COONa 电 解CH 3(CH 2)24CH 3CH 3Cl 2P Cl2P CH 2CHCOOH ClCCOOHClClCl Cl 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2COOHCH 3CH 2CH 2KMnO 4H SO 4KMnO 4H SO 4KMnO 4CO 2H RCH 2+RCOOH H 2O++精品RCOOHH 2ORC OMgClO CO 2+RMgCl C 2H 5OC 2H 5甲基酮氧化羧酸衍生物酯与醇作用,仍生成酯,故又称为酯交换反应。
脱羧反应

脱酸反应羧酸分子脱去羧基 (一COOH)放出二氧化碳的反应叫脱羧反应:R-COOH→RH+CO₂脱羧反应是有机化学的一类重要反应,随着研究的不断深入 , 对不同脱羧反应的机理与调控途径有了更细微的了解 ,脱羧反应的应用也越来越广,现已广泛地应用于化工、生物、医药、食品等领域。
脱羧反应之所以能够发生 ,是由其分子结构决定的。
一般情况下 ,羧酸中的羧基较为稳定 ,不易发生脱羧反应 ,但在特殊条件下 ,羧酸能脱去羧基(失去二氧化碳) 而生成烃。
一、从分子结构来分析脱羧反应为什么能够发生在羧酸分子中,羧基中的碳原子是 SP2杂化的,它的三个 SP2杂化轨道分别与烃基及两个氧原子形成三个σ键,这三个σ键同在一个平面上,碳原子剩下的一个 P电子与氧原子的一个 P电子形成了羰基 ( )中的π键,羧基中的一OH的氧上有一对孤电子,可与羰基上的π键形成 P一π共轭体系。
羧基的结构羧基负离子的结构由于 P一π共轭效应,OH的氧原子的电子云向羰基移动,增强了0一H键的极性,有利于氢原子的离解,使羧酸比醇酸性强。
当羧基上的H离解后,P一π共轭作用更加完全,两个C一0键的键长完全平均化,羧酸根负离子更加稳定。
从上可见,羧酸分子结构的一个特点是:具有 P一π共轭效应的是比较稳定的部分,当受热时可以作为CO2整体脱去。
CO2脱去后,中心碳原子转为SP杂化,碳原子的两个SP杂化轨道分别与两个氧原子形成两个σ键,分子呈直线型,碳原子以未参与杂化的两个P轨道,分别与两个氧原子的 P轨道形成两个四电子三中心大π键(π43)。
这是一个非常稳定的结构。
从热力学的观点看,越稳定的越容易形成,所以脱羧反应能够发生。
脱羧反应的共价键断裂有两种方式:一种是异裂,即反应按离子型反应历程进行;一种是均裂,即反应按游离基型反应历程进行。
1、离子型反应历程大多数脱羧反应属于离子型反应历程。
有实验表明:这类脱羧反应属于单分子反应。
反应过程大致为:羧酸先离解生成羧酸根负离子和氢离子,羧基负离子()具有一个π43键一并且是一个供电的基团,使共价键发生异裂,生成烃基负离子并释放出CO2 ,最后烃基负离子获得氢离子使反应完成。
脱羧反应(参照材料)

脱酸反应羧酸分子脱去羧基 (一COOH)放出二氧化碳的反应叫脱羧反应:R-COOH→RH+CO₂脱羧反应是有机化学的一类重要反应,随着研究的不断深入 , 对不同脱羧反应的机理与调控途径有了更细微的了解 ,脱羧反应的应用也越来越广,现已广泛地应用于化工、生物、医药、食品等领域。
脱羧反应之所以能够发生 ,是由其分子结构决定的。
一般情况下 ,羧酸中的羧基较为稳定 ,不易发生脱羧反应 ,但在特殊条件下 ,羧酸能脱去羧基(失去二氧化碳) 而生成烃。
一、从分子结构来分析脱羧反应为什么能够发生在羧酸分子中,羧基中的碳原子是 SP2杂化的,它的三个 SP2杂化轨道分别与烃基及两个氧原子形成三个σ键,这三个σ键同在一个平面上,碳原子剩下的一个 P电子与氧原子的一个 P电子形成了羰基 ( )中的π键,羧基中的一OH的氧上有一对孤电子,可与羰基上的π键形成 P一π共轭体系。
羧基的结构羧基负离子的结构由于 P一π共轭效应,OH的氧原子的电子云向羰基移动,增强了0一H键的极性,有利于氢原子的离解,使羧酸比醇酸性强。
当羧基上的H离解后,P一π共轭作用更加完全,两个C一0键的键长完全平均化,羧酸根负离子更加稳定。
从上可见,羧酸分子结构的一个特点是:具有 P一π共轭效应的是比较稳定的部分,当受热时可以作为CO2整体脱去。
CO2脱去后,中心碳原子转为SP杂化,碳原子的两个SP杂化轨道分别与两个氧原子形成两个σ键,分子呈直线型,碳原子以未参与杂化的两个P轨道,分别与两个氧原子的 P轨道形成两个四电子三中心大π键(π43)。
这是一个非常稳定的结构。
从热力学的观点看,越稳定的越容易形成,所以脱羧反应能够发生。
脱羧反应的共价键断裂有两种方式:一种是异裂,即反应按离子型反应历程进行;一种是均裂,即反应按游离基型反应历程进行。
1、离子型反应历程大多数脱羧反应属于离子型反应历程。
有实验表明:这类脱羧反应属于单分子反应。
反应过程大致为:羧酸先离解生成羧酸根负离子和氢离子,羧基负离子()具有一个π43键一并且是一个供电的基团,使共价键发生异裂,生成烃基负离子并释放出CO2 ,最后烃基负离子获得氢离子使反应完成。
脱羧反应

均相络合催化脱羧
以过渡金属为中心构成的络合物, 在均相下进行催化反应脱羧。
脱 羧 反 应 的 现 状
多相催化脱羧
多相催化反应体系由流体主体、催 化剂颗粒和它们之间的滞留层组成。反应 物分子和产物分子通过滞留层的传质,内 扩散到催化剂内表面的反应物分子,进行 包括吸附、表面化学反应和产物分子脱附 的一系列表面化学过程。
脱 羧 反 应 的 现 状
热化学脱羧
羧酸负离子机理
三氯乙酸的钠盐在水中完全离解成负离 子,由于三个氯原子具有强的吸电子作用,使 得碳-碳之间的电子云偏向于有氯取代的碳 一边,这样形成的负碳离子就更加稳定,然后 和质子结合形成氯仿,而羧基负离子上的电 子则转移到碳氧之间而形成二氧化碳。
脱 羧 反 应 的 现 状
其它催化脱羧
杂环胺类 杂环碱
脱 羧 反 应 结 合 0305
α-羰基酸脱羧
α-羰基酸脱羧的反应原理与三氯乙酸类似,在α羰基酸分子中,由于氧原子的吸电子效应,羰基与羧基 间的电子云密度较低,碳-碳键易于断裂,从而发生脱羧 反应。2-羟基戊烷乙酸在浓硫酸下脱羧则遵循脱羧反 应的环状过渡态机理。通过六元环过渡态,首先是醇 羟基形成钅羊盐,然后失水成烯,β,γ-不饱和烯酸经六 元环过渡态失羧。
光-电化学脱羧
催 化 作 用
光化学脱羧
电化学脱羧
脱 羧 反 应 的 现 状
催化脱羧
酶催化脱羧
均相络合催化脱羧 多相催化脱羧 其它催化脱羧
脱 羧 反 应 的 现 状
酶催化脱羧
天然酶:乙酰乳酸脱羧酶、丙酮酸 脱羧酶、OMP脱羧酶等 人工酶:模拟酶又称仿酶,是根据酶的结构、 功能以及催化机制,用化学合成法合成的具 有酶催化活性的人工酶制剂。
有机化学学习笔记 第十三章羧酸

CH2CH2COOH CH2 (CH3CO)2O CH2CH2COOH
O + CO2 + H 2O
如何将环己酮转化为环戊酮?
O HNO3 CH2CH2COOH CH2CH2COOH (CH3CO)2O O
3.羧酸的脱羧卤代反应
A. Hunsdiecker反应
O R-C-OH Ag2O
O R-C-O Ag O
O CH3 CH3C-C H CH3
COOH CH2 COOH
CH3COOH + CO2
O CH2COOH
n=2,3
CH2COOH (CH3CO)2O
O + H 2O O
CH2COOH CH2 (CH3CO)2O CH2COOH
O O + H2O O
n=4,5
O CH2CH2COOH CH2CH2COOH (CH3CO)2O + CO2 + H2O
BrCH2COOH 2.90
0.64
ICH2COOH 3.18
FCH2COOH ClCH2COOH 2.66 2.88
羧酸 pKa
羧酸 pKa
HCOOH CH3COOH CH3CH2COOH (CH3)2CHCOOH (CH3)3CCOOH 3.77 4.76 4.87 4.86
Cl CH2CH2CH2COOH 4.70
5.05
n-C3H7COOH 4.80
Cl Cl CH3CH2CHCOOH CH3CHCH2COOH 2.82 4.41
羧酸 pKa
CH=CCH2COOH 3.30
CH2COOH 4.31
CH2=CHCH2COOH 4.35
n-C3H7COOH 4.82
脱羧反应

脱酸反应羧酸分子脱去羧基(一 COOH 放出二氧化碳的反应叫脱羧反应:R-COO H RH+CO ?脱羧反应是有机化学的一类重要反应,随着研究的不断深入 , 对不同脱羧反应的机理与调控途径有了更细微的了解 ,脱羧反应的 应用也越来越广,现已广泛地应用于化工、生物、医药、食品等领域。
脱羧反应之所以能够发生,是由其分子结构决定的。
一般情况 下,羧酸中的羧基较为稳定,不易发生脱羧反应,但在特殊条件下, 羧酸能脱去羧基(失去二氧化碳)而生成烃。
一、从分子结构来分析脱羧反应为什么能够发生在羧酸分子中,羧基中的碳原子是 SP 2杂化的,它的三个SP 2杂化轨道分别与烃基及两个氧原子形成三个 (T 键,这三个(T 键同在一 个平面上,碳原子剩下的一个P 电子与氧原子的一个P 电子形成了 羰基(')中的n 键,羧基中的一 0H 的氧上有一对孤电子,可 与羰基上的n 键形成P 一 n 共轭体系。
由于P 一 n 共轭效应,0H 的氧原子的电子云向羰基移动,增强 了 0一H 键的极性,有利于氢原子的离解,使羧酸比醇酸性强。
当羧羧基的结构羧基负离子的结构基上的H 离解后,P 一n 共轭作用更加完全,两个C 一0键的键长完 全平均化,羧酸根负离子更加稳定。
从上可见,羧酸分子结构 的一个特点是:具有P 一n 共轭效应 —0的 是比较稳定的部分,当受热时可以作为 CQ 整体脱去。
CO 脱去后,中心碳原子转为 SP 杂化,碳原子的两个SP 杂化轨 道分别与两个氧原子形成两个。
键,分子呈直线型,碳原子以未参 与杂化的两个P 轨道,分别与两个氧原子的P 轨道形成两个四电子 三中心大n键(n 43)。
这是一个非常稳定的结构。
从热力学的观点看, 越稳定的越容易形成,所以脱羧反应能够发生。
脱羧反应的共价键断裂有两种方式: 一种是异裂,即反应按离子型反应历程进行;一种是均裂,即反应按游离基型反应历程进行。
1、离子型反应历程大多数脱羧反应属于离子型反应历程。
有机羧酸知识点总结

一、有机羧酸的结构有机羧酸(carboxylic acid)是由羧基(-COOH)和与之相连的有机基团组成的一类有机物。
羧基由一个碳原子与一个氧原子以及一个氢原子组成,形式上可以表示为-COOH。
常见的有机羧酸的结构如下所示:甲酸 HCOOH醋酸 CH3COOH丙酸 C2H5COOH草酸 HOOC-COOH苹果酸 HOOC-CH2-C(OH)(COOH)-CH2-COOH乙酰水杨酸 CH3CO-OC6H4COOH肉豆蔻酸 CH3(CH2)7CH=CH(CH2)7COOH二、有机羧酸的性质1. 物理性质有机羧酸大多为无色或淡黄色的液体,具有刺激性气味。
它们可以溶解在水中,生成羧酸离子(-COO-)和氢离子(H+)。
2. 化学性质(1)酸性有机羧酸具有明显的酸性,可以与碱反应生成盐和水。
它们还可以和醇发生酯化反应,生成酯。
(2)氧化性有机羧酸可以被氧化成相应的一元醛或二元醛。
(3)脱羧反应在适当的条件下,有机羧酸可以发生脱羧反应,生成相应的烯烃。
(4)其它反应有机羧酸还可以发生取代反应、缩合反应等。
有机羧酸的合成方法主要有以下几种:1. 从烷烃氧化得到有机醛,再通过氧化得到有机羧酸。
2. 从烯烃发生羟基化反应得到β-羟基酰基,再进行氧化得到有机羧酸。
3. 从酮发生氰基化反应得到羰基氰化物,再水解得到有机羧酸。
4. 从卤代烷发生碱催化的羧基化反应。
四、有机羧酸的应用有机羧酸在食品、医药、化工等领域有着广泛的应用。
1. 食品添加剂有机羧酸可以用作食品的酸味增强剂、抗氧化剂等。
2. 医药领域有机羧酸可以制备药物原料,也可以用作药物的中间体。
3. 化工领域有机羧酸可以用作溶剂、助剂等。
五、有机羧酸的生物学功能有机羧酸在生物体内具有重要的生理功能,常见的有机羧酸如乙酸、柠檬酸、苹果酸等在生物体内作为代谢产物参与到某些代谢途径中,起着重要的生理作用。
在生命体内,有机羧酸不仅作为营养物质存在,而且还作为一种代谢产物,参与能量代谢、脂肪代谢等重要的生物学过程。
脱羧反应

7
脱
羧
光-电化学脱羧
反
应
热化学脱羧
的
现
状
催化脱羧
8
脱
热化学脱羧
羧 反
一般的脱羧反应不需要特殊的催 化剂,而是在以下的条件下进行的:
应
1.加热
的
2.碱性条件 3.加热和碱性条件共存
现
状
9
脱 羧 反 应 的 现 状
热化学脱羧
羧酸负离子机理 三氯乙酸的钠盐在水中完全离解成负离 子,由于三个氯原子具有强的吸电子作用,使 得碳-碳之间的电子云偏向于有氯取代的碳 一边,这样形成的负碳离子就更加稳定,然后 和质子结合形成氯仿,而羧基负离子上的电 子则转移到碳氧之间而形成二氧化碳。
如果羧酸的a- 碳上连有卤素、硝基、羰基、羧 基等吸电子基团,生成的负离子中间体由于负电荷 得到分散而趋于稳定,脱梭反应便容易发生;
如果羧酸的a- 碳上连有供电子基团,负离子中 间体便更不稳定,脱羧反应更难发生。
6
共价键断裂方式:
脱
羧
2.均裂:反应按游离基型反 应历程进行。
反
反应历程:
应
的
介 绍
一般是羧酸根游离基一旦生成,便立即放出C02。
可以促进脱羧反应,因此脱羧反应在酸性条件下可 以进行。
0305
16
的
与两个氧原子形成两个σ键,分子呈直
介
线型,碳原子以未参与杂化的两个P轨 道,分别与两个氧原子的P轨道形成两
绍
个四电子三中心大π键(π34)。这是一个 非常稳定的结构。从热力学的观点看,
越稳定的越容易形成,所以脱梭反应能
够发生。
5
脱 羧 反 应 的 介 绍
共价键断裂方式: 1.异裂:反应按离子型反应 历程进行。 反应历程:
脱羧反应

介
,这三个σ键同在一个平面上,碳原 子剩下的一个P电子与氧原子的一个P
绍
电子形成了羰基中的π键,羧基中的 –OH 的氧上有一对孤电子,可与羰基
上的π键形成P-π共扼体系。
精品课件
脱
脱羧反应机理:
羧
具有P-π共扼效应的 -COO- 是 比较稳定的部分,当受热时可以作为
反
CO2整体脱去。
应
CO2脱去后,中心碳原子转为 SP杂化,碳原子的两个SP杂化轨道分别
如果羧酸的a- 碳上连有卤素、硝基、羰基 、羧基等吸电子基团,生成的负离子中间体由于负 电荷得到分散而趋于稳定,脱梭反应便容易发生;
如果羧酸的a- 碳上连有供电子基团,负离 子中间体便更不稳定,脱羧反应更难发生。
精品课件
共价键断裂方式:
脱
羧
2.均裂:反应按游离基型反 应历程进行。
反
反应历程:
Hale Waihona Puke 应的介 绍
一般是羧酸根游离基一旦生成,便立即放出C02。
精品课件
脱
羧
光-电化学脱羧
反
应
热化学脱羧
的
现
状
催化脱羧
精品课件
脱
热化学脱羧
羧 反
一般的脱羧反应不需要特殊的 催化剂,而是在以下的条件下进行的
应
: 1.加热
的
2.碱性条件 3.加热和碱性条件共存
现
状
精品课件
脱 羧 反 应 的 现 状
热化学脱羧
羧酸负离子机理 三氯乙酸的钠盐在水中完全离解成
α-羰基酸脱羧
α-羰基酸脱羧的反应原理与三氯乙酸类似, 在α-羰基酸分子中,由于氧原子的吸电子效应,羰基 与羧基间的电子云密度较低,碳-碳键易于断裂,从而 发生脱羧反应。2-羟基戊烷乙酸在浓硫酸下脱羧则遵 循脱羧反应的环状过渡态机理。通过六元环过渡态, 首先是醇羟基形成钅羊盐,然后失水成烯,β,γ-不饱 和烯酸经六元环过渡态失羧。
羧酸取代羧酸的分类命名、性质

Br2 / P
3
-H活性:羧酸小于醛酮。 PCl3、PBr3 或红磷(P)等催化。 催化量 PBr
CH3CH2CHCOOH Br CH3CHCOOH Br
5. 羧酸的脱羧反应
HOOCCOOH HOOCCH2COOH HCOOH + CO2 CH3COOH + CO2
CH3(CH2)16COOH 二元酸
HOOCCOOH HOOCCH2COOH
十八酸
硬脂酸
乙二酸 丙二酸
草酸
系 统 命 名 法
4
3
CH3
2
1
CH3CHCH2COOH
CH3CH2 C COOH CH2
3–甲基丁酸
HOOCCHCH2COOH CH3
3–乙基–2–丙烯酸
HOOCC CHCOOH
CH2CH3
CH2 COOH
CH3 C
CH2 COOH
丙醛酸或 3-羰基丙酸
3–丁酮酸或β–羰基丁酸
1. 卤代酸
卤代酸的水解反应
R CH COOH + H2O X R CH OH COOH + HX
OH-
RCH2COOH + Br2
PBr3
RCHCOOH Br
H2O OH-
RCHCOOH OH
2.羟基酸(醇酸、酚酸)
180—190oC -H2O DCC/THF 0C
o
PhCONHPh (84%)
CH3CON(CH3)2
3. 羧基被还原
LiAlH4是还原羧酸为醇的最好试剂 LiAlH (醚) HO
RCOOH
COOH
脱羧反应

脱酸反应羧酸分子脱去羧基 (一COOH)放出二氧化碳的反应叫脱羧反应:R-COOH→RH+CO₂脱羧反应是有机化学的一类重要反应,随着研究的不断深入 , 对不同脱羧反应的机理与调控途径有了更细微的了解 ,脱羧反应的应用也越来越广,现已广泛地应用于化工、生物、医药、食品等领域。
脱羧反应之所以能够发生 ,是由其分子结构决定的。
一般情况下 ,羧酸中的羧基较为稳定 ,不易发生脱羧反应 ,但在特殊条件下 ,羧酸能脱去羧基(失去二氧化碳) 而生成烃。
一、从分子结构来分析脱羧反应为什么能够发生在羧酸分子中,羧基中的碳原子是 SP2杂化的,它的三个 SP2杂化轨道分别与烃基及两个氧原子形成三个σ键,这三个σ键同在一个平面上,碳原子剩下的一个 P电子与氧原子的一个 P电子形成了羰基 ( )中的π键,羧基中的一OH的氧上有一对孤电子,可与羰基上的π键形成 P一π共轭体系。
羧基的结构羧基负离子的结构由于 P一π共轭效应,OH的氧原子的电子云向羰基移动,增强了0一H键的极性,有利于氢原子的离解,使羧酸比醇酸性强。
当羧基上的H离解后,P一π共轭作用更加完全,两个C一0键的键长完全平均化,羧酸根负离子更加稳定。
从上可见,羧酸分子结构的一个特点是:具有 P一π共轭效应的是比较稳定的部分,当受热时可以作为CO2整体脱去。
CO2脱去后,中心碳原子转为SP杂化,碳原子的两个SP杂化轨道分别与两个氧原子形成两个σ键,分子呈直线型,碳原子以未参与杂化的两个P轨道,分别与两个氧原子的 P轨道形成两个四电子三中心大π键(π43)。
这是一个非常稳定的结构。
从热力学的观点看,越稳定的越容易形成,所以脱羧反应能够发生。
脱羧反应的共价键断裂有两种方式:一种是异裂,即反应按离子型反应历程进行;一种是均裂,即反应按游离基型反应历程进行。
1、离子型反应历程大多数脱羧反应属于离子型反应历程。
有实验表明:这类脱羧反应属于单分子反应。
反应过程大致为:羧酸先离解生成羧酸根负离子和氢离子,羧基负离子()具有一个π43键一并且是一个供电的基团,使共价键发生异裂,生成烃基负离子并释放出CO2 ,最后烃基负离子获得氢离子使反应完成。
三羧酸循环过程
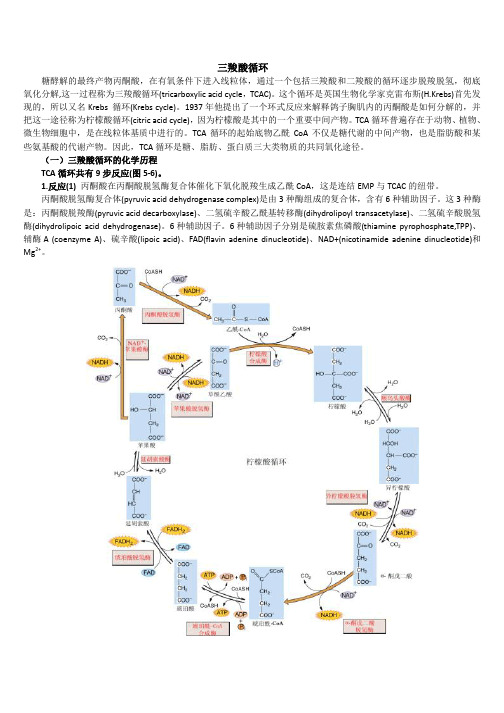
三羧酸循环糖酵解的最终产物丙酮酸,在有氧条件下进入线粒体,通过一个包括三羧酸和二羧酸的循环逐步脱羧脱氢,彻底氧化分解,这一过程称为三羧酸循环(tricarboxylic acid cycle,TCAC)。
这个循环是英国生物化学家克雷布斯(H.Krebs)首先发现的,所以又名Krebs 循环(Krebs cycle)。
1937年他提出了一个环式反应来解释鸽子胸肌内的丙酮酸是如何分解的,并把这一途径称为柠檬酸循环(citric acid cycle),因为柠檬酸是其中的一个重要中间产物。
TCA循环普遍存在于动物、植物、微生物细胞中,是在线粒体基质中进行的。
TCA循环的起始底物乙酰CoA不仅是糖代谢的中间产物,也是脂肪酸和某些氨基酸的代谢产物。
因此,TCA循环是糖、脂肪、蛋白质三大类物质的共同氧化途径。
(一)三羧酸循环的化学历程TCA循环共有9步反应(图5-6)。
1.反应(1)丙酮酸在丙酮酸脱氢酶复合体催化下氧化脱羧生成乙酰CoA,这是连结EMP与TCAC的纽带。
丙酮酸脱氢酶复合体(pyruvic acid dehydrogenase complex)是由3种酶组成的复合体,含有6种辅助因子。
这3种酶是:丙酮酸脱羧酶(pyruvic acid decarboxylase)、二氢硫辛酸乙酰基转移酶(dihydrolipoyl transacetylase)、二氢硫辛酸脱氢酶(dihydrolipoic acid dehydrogenase)。
6种辅助因子。
6种辅助因子分别是硫胺素焦磷酸(thiamine pyrophosphate,TPP)、辅酶A (coenzyme A)、硫辛酸(lipoic acid)、FAD(flavin adenine dinucleotide)、NAD+(nicotinamide adenine dinucleotide)和Mg2+。
图5-6 三羧酸循环的反应过程上述反应中从底物上脱下的氢是经FAD→FADH2传到NAD+再生成NADH+H+。
有机化学——羧酸

酯化和酯水解反应历程
+ O
R-C-OH
H-O18-R' -H2O H+
O R-C-O18-R'
O
H+
O+H R'-O:-H
R-C-OH
R-C-OH
OH
R-C-O-H H-O+-R'
O
- H+
R-C-O-R'
OH
-H2O
R-C+-O-R'
OH R-C-O+H2
O-R'
②还原反应(比羧酸易还原)
酰卤的还原:
+ CH3-CO-CH2-C-O-C2H5 C2H5OH
乙酰乙酸乙酯 O
其历程类似于羟醛缩合反应。P232
Ⅲ、取代酸:
羧酸分子中烃基上的H原子被其它原子 或基团取代后的产物,如卤代酸、羟基酸、 羰基酸等。含多个官能团,称复合官能团化 合物。
R-CH-COOH R-CH-COOH R-C-COOH R-CH-COOH
己内酰胺
CH3 H-C N
O
CH3
N,N-二甲基甲酰胺 (DMF)
2、化学性质
①水解、醇解和氨解反应(活性:酰卤>酸酐>酯)
O
R-C-Z +
H-O-H H-O-R'
O
R-C-OH + H-Z
O
R-C-OR' + H-Z
O
H-NH2
R-C-NH2 + H-Z
Z = -X、 -O-CO-R’、 -O-R’
(4)羧酸的还原反应
羧基是有机物中碳的最高氧化态,用催 化氢化或金属加酸方法都不能将羧基还 原,但用氢化铝锂可将羧基还原。
脱羧反应

脱酸反应羧酸分子脱去羧基 (一COOH)放出二氧化碳的反应叫脱羧反应:R-COOH→RH+CO₂脱羧反应是有机化学的一类重要反应,随着研究的不断深入 , 对不同脱羧反应的机理与调控途径有了更细微的了解 ,脱羧反应的应用也越来越广,现已广泛地应用于化工、生物、医药、食品等领域。
脱羧反应之所以能够发生 ,是由其分子结构决定的。
一般情况下 ,羧酸中的羧基较为稳定 ,不易发生脱羧反应 ,但在特殊条件下 ,羧酸能脱去羧基(失去二氧化碳) 而生成烃。
一、从分子结构来分析脱羧反应为什么能够发生在羧酸分子中,羧基中的碳原子是 SP2杂化的,它的三个 SP2杂化轨道分别与烃基及两个氧原子形成三个σ键,这三个σ键同在一个平面上,碳原子剩下的一个 P电子与氧原子的一个 P电子形成了羰基 ( )中的π键,羧基中的一OH的氧上有一对孤电子,可与羰基上的π键形成 P一π共轭体系。
羧基的结构羧基负离子的结构由于 P一π共轭效应,OH的氧原子的电子云向羰基移动,增强了0一H键的极性,有利于氢原子的离解,使羧酸比醇酸性强。
当羧基上的H离解后,P一π共轭作用更加完全,两个C一0键的键长完全平均化,羧酸根负离子更加稳定。
从上可见,羧酸分子结构的一个特点是:具有 P一π共轭效应的是比较稳定的部分,当受热时可以作为CO2整体脱去。
CO2脱去后,中心碳原子转为SP杂化,碳原子的两个SP杂化轨道分别与两个氧原子形成两个σ键,分子呈直线型,碳原子以未参与杂化的两个P轨道,分别与两个氧原子的 P轨道形成两个四电子三中心大π键(π43)。
这是一个非常稳定的结构。
从热力学的观点看,越稳定的越容易形成,所以脱羧反应能够发生。
脱羧反应的共价键断裂有两种方式:一种是异裂,即反应按离子型反应历程进行;一种是均裂,即反应按游离基型反应历程进行。
1、离子型反应历程大多数脱羧反应属于离子型反应历程。
有实验表明:这类脱羧反应属于单分子反应。
反应过程大致为:羧酸先离解生成羧酸根负离子和氢离子,羧基负离子()具有一个π43键一并且是一个供电的基团,使共价键发生异裂,生成烃基负离子并释放出CO2 ,最后烃基负离子获得氢离子使反应完成。
羧酸的还原和脱羧反应.

羧酸的还原和脱羧反应
一、还原反应
羧酸能被强还原剂----氢化铝锂(LiAlH4)还 原成醇。分子中的碳碳不饱和键不受影响,只 还原羧基而生成不饱和醇。
二、脱羧反应 羧酸分子中脱去羧基放出二氧化碳的反应。 不同的羧酸,脱羧的方式、难易程度不同。
一元羧酸难脱羧,只适用于低级的羧酸盐。
当两个羧基相隔4或5个碳原子时则发生脱羧脱水 反应,如已二酸:
谢
制作人:
谢
杨宏芳
一元羧酸的-碳上连有吸电子基时,脱羧较容 易进行。
芳香羧酸的脱羧反应比脂肪羧酸容易。
二元羧酸的受热分解反应,由于两个羧基Biblioteka 对 位置不同,会发生失水或脱羧反应。
两个羧基直接相连或间隔1个碳原子时,发生 脱羧反应。如乙二酸和丙二酸脱羧:
当两个羧基相隔2或3个碳原子时则发生脱水反应 ,如丁二酸脱水:
羧酸及羧酸衍生物的重要反应及重要反应机理

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载羧酸及羧酸衍生物的重要反应及重要反应机理地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容第六章羧酸及羧酸衍生物的性质及重要反应机理一、羧酸的化学性质1.酸性羧酸具有酸性,诱导、共轭、场效应等对酸性强弱有影响。
利用羧酸的酸性可以制备羧酸酯和羧酸盐。
2.亲核取代反应这是羧酸在一定条件下转变成羧酸生物的反应。
大多数亲核取代反应是通过加成-消除历程完成的。
3.还原反应羧酸能被LiAlH4和B2H6还原成相应的伯醇。
4.α-H的卤化(Hell-Volhard-Zelinsky反应)通过控制卤素的用量可以制备一元或多元的卤代羧酸,并进一步制备羟基酸和氨基酸。
5.脱羧反应羧酸在适当的条件下,一般都能发生脱羧反应,这是缩短碳链的反应。
通常的脱羧反应表示如下:A为-COOH、-CN、-(C=O)R、-NO2、-CX3、-C=O、C6H5-等吸电子基团时,脱羧反应相当容易进行。
此外还有一些特殊的脱羧方法。
二元羧酸的脱羧规律是:乙二酸、丙二酸、加热失羧,丁二酸、戊二酸加热是水生成分子内酸酐,己二酸、庚二酸加热是水、失羧生成环酮。
根据以上反应可以得出一个结论,在有机反应中有成环可能时,一般易形成五元环或六元环。
这称为布朗克(Blanc)规则。
二、羧酸衍生物的化学性质1.亲核取代反应这是羧酸衍生物的转换反应。
转换的活性顺序为:RCOX>CRCOOOCR>RCOOR′>RCONR2酸和碱都能催化反应。
2.与有机金属化合物的反应选用空阻大的酰卤,反应能控制在酮的阶段。
选用甲酸酯,可以制备对称二级醇。
选用碳酸酯,可制备三个烃基相同的三级醇。
二元酸的环状酸酐可用来制备酮酸。
大学有机化学性质总结

有机化学复习资料—化学性质烷烃及环烷烃的化学性质:1.烷烃卤代反应2.环烷烃加成反应(加氢,加卤素,加卤化氢)烯烃的化学性质:1.加成反应(加氢,加水,加卤素,加次卤酸反式加成,自由基加成ROOR )马氏规则的应用(形成稳定的正碳离子);个别化合物,要考虑甲基、氢的重排。
在过氧化物存在下,与HBr的自由基加成,反马氏规则。
烯烃的硼氢化-氧化反应条件:BH3或B2H6 →H2O2/OH-→H2O反马氏规则, 顺型加成,产物是醇。
2.氧化反应1.KMnO4溶液(碱性或中性) 产物邻二醇,顺式;KMnO4溶液(酸性) 产物双键发生断裂。
(烯烃C=C 氧化为C=O; C=C 上的氢被氧化成羟基(-OH)。
)2.臭氧化反应:反应条件:O3→Zn/H2O 产物是醛、酮炔烃的化学性质:1.酸性(炔化银和炔化亚酮的生成与复原)2.加成反应(加卤素,加卤化氢,加水H2O, HgSO4-H2SO4<互变异构>)炔键在中间,生成反式加成产物。
在过氧化物存在下,与HBr的自由基加成,反马氏规则。
3. 氧化反应(KMnO4溶液(酸性),臭氧化反应)炔烃的硼氢化-氧化反马氏规则, 顺型加成,产物是醛酮。
炔烃的加氢1)Lindlar Pd (顺式烯烃) 2)Na, NH3(反式烯烃)共轭二烯烃性质:1.1,2加成-80°C 优势和1,4加成40°C 优势2.狄尔斯-阿尔德反应共轭二烯烃与含有碳碳双键或三键的化合物作用形成六元环产物的反应。
芳香烃的化学性质:1.亲电取代反应(卤化FeCl3/Fe,硝化浓H2SO4,磺化<可逆,增加水溶性>,F-C反应<烷基化无水AlCl3,酰基化AlCl3>)。
2. 苯及其同系物的氧化反应(具有α-H 的苯同系物——苯甲酸)3. 苯环侧链的氧化反应(主要产物是α-H被取代的卤代芳香烃)、卤代烃的化学性质:1.各种亲核取代反应(生成醇,醚,硫醇,氰(多一个c羧酸),胺,硝酸酯)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸的还原和脱羧反应一来自还原反应羧酸能被强还原剂----氢化铝锂(LiAlH4)还 原成醇。分子中的碳碳不饱和键不受影响,只 还原羧基而生成不饱和醇。
二、脱羧反应 羧酸分子中脱去羧基放出二氧化碳的反应。 不同的羧酸,脱羧的方式、难易程度不同。
一元羧酸难脱羧,只适用于低级的羧酸盐。
一元羧酸的-碳上连有吸电子基时,脱羧较容 易进行。
芳香羧酸的脱羧反应比脂肪羧酸容易。
二元羧酸的受热分解反应,由于两个羧基相对 位置不同,会发生失水或脱羧反应。
两个羧基直接相连或间隔1个碳原子时,发生 脱羧反应。如乙二酸和丙二酸脱羧:
当两个羧基相隔2或3个碳原子时则发生脱水反应 ,如丁二酸脱水:
当两个羧基相隔4或5个碳原子时则发生脱羧脱水 反应,如已二酸:
谢
制作人:
谢
杨宏芳
