2-制药用水
制药用水有哪些分类和水质标准

制药用水分类和水质标准:制药用水(加工用水:药品制造过程中使用的水,如饮用水,纯净水和注射用水)分类1.饮用水:自来水或深井水,通常由自来水公司提供,也称为原水,其水质必须符合国家标准GB5749-85“饮用水卫生标准”。
有。
根据《2010年中国药典》,饮用水不能直接用于制备或测试。
2.纯化水(Purified Water):制药用水,由原水通过蒸馏,离子交换,反渗透或任何其他合适的方法制成,无任何添加剂。
纯化水可用作制备普通药物制剂的溶剂或测试水。
它不能用于准备注射剂。
通过非热处理(例如离子交换,反渗透和超滤)制备的纯净水通常也称为去离子水。
通过使用特殊设计的蒸馏器蒸馏制备的纯净水通常称为蒸馏水。
3. 注射用水:通过将水纯化为原水,再用专门设计的蒸馏水蒸馏,冷凝和冷却后通过膜过滤得到的水。
注射用水可以用作注射溶剂。
4. 无菌注射用水:根据注射液的生产工艺准备注射用水。
注射用无菌水是用于粉末消毒的溶剂或稀释剂。
制药用水的水质标准:1.饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2.纯化水:应符合《2010中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3.注射用水:应符合2010中国药典所收载的注射用水标准二:2010年中国药典对纯水、注射用水、灭菌注射用水的pH、电导率、总有机碳(TOC)的检测提出如下要求:1. 药典对pH检测的新要求:pH值应处在5.0~7.0。
2.药典对电导率检测的新要求:调节待测样品的温度至25℃。
标示装量为10ml或10ml以下时,电导率限度为25μS/cm;标示装量为10ml以上时,电导率限度为5μS/cm。
测定的电导率值不大于限度值,则判为符合规定;如电导率值大于限度值,则判为不符合规定。
WHO_TRS970_annex2(制药用水-对照版)

Annex 2 附件2WHO good manufacturing practices: water for pharmaceutical useWHO GMP:制药用水1. Introduction 介绍1.1 Scope of the document文件范围1.2 Background to water requirements and uses 水的要求和使用背景1.3 Applicable guides 适用的指南2. General principles for pharmaceutical water systems 制药用水系统的一般原则3. Water quality specifications 水质量标准3.1 General 概述3.2 Drinking-water 饮用水3.3 Bulk purified water散装纯化水3.4 Bulk highly purified water散装高纯水3.5 Bulk water for injections散装注射用水3.6 Other grades of water 其它类型水4. Application of specific types of water to processes and dosage forms 不同类型水在工艺和剂型中的应用5. Water purification systems 水纯化系统5.1 General considerations 一般考虑5.2 Production of drinking-water 饮用水的制备5.3 Production of purified water 纯化水的制备5.4 Production of highly purified water高纯水的制备5.5 Production of water for injection(s) 注射用水的制备6. Water storage and distribution systems 水存贮和分配系统6.1 General 概述6.2 Materials that come into contact with systems for water for pharmaceutical use 与制药用水系统接触的材质6.3 System sanitization and bioburden control 系统消毒和微生物控制6.4 Storage vessel requirements 贮罐要求6.5 Requirements for water distribution pipework 水分配管道要求7. Operational considerations 运行时的考虑7.1 Start-up and commissioning of water systems 水系统开机和运行7.2 Qualification 确认7.3 Continuous system monitoring 对系统的持续监控7.4 Maintenance of water systems 水系统维护7.5 System reviews 系统回顾8. Inspection of water systems 水系统检查Further reading 扩展阅读1. Introduction 介绍1.1 Scope of the document 文件范围1.1.1 The guidance contained in this document is intended to provide information about the available specifications for water for pharmaceutical use (WPU), guidance about which quality of water to use for specific applications, such as the manufacture of active pharmaceutical ingredients (APIs) and dosage forms, and to provide guidance on good manufacturing practices (GMP) regarding the design, installation and operation of pharmaceutical water systems. Although the focus of this document is on water for pharmaceutical applications, the guidelines may also be relevant to other industrial or specific uses where the specifications and practices can be applied.本文件中包括的本指南目的在于提供以下信息,关于制药用水(WPU)的可获得的质量标准,哪种质量的水适用于特定用途,例如活性药用物质(API)生产和制剂生产,提供关于药用水系统设计、安装和运行GMP指南。
制药用水的用途

制药用水的用途
制药用水是用于制药工艺中的一种特殊的水源。
它具有高纯度和特定的物理化学特性,适用于多种制药工艺中的不同用途。
以下是制药用水的一些常见用途:
1. 清洗和冲洗:制药用水常用于清洗和冲洗设备和容器,以确保制药过程中的卫生和安全。
2. 配制药剂:制药用水用于配制药剂,如溶解、稀释和调配药物成分。
3. 蒸馏和制备:制药用水在某些制药工艺中作为蒸馏水或制备原料的基础。
4. 注射用水:制药用水用于制备和稀释注射用药物,以确保其纯度和安全。
5. 灭菌和消毒:制药用水在灭菌和消毒过程中发挥重要作用,以确保制剂和容器的无菌性。
6. 分析和检测:制药用水用于制备样品和试剂,以进行分析和检测,确保产品质量和符合要求。
7. 药物质量控制:制药用水在药物质量控制中使用,如药物溶解度、稳定性测试等。
8. 实验室研究:制药用水在实验室中用于生物、化学和物理实
验,支持药物研发和新药探索。
总之,制药用水是制药行业中不可或缺的重要资源,用于满足制药工艺中多个环节的需求,确保制药过程的安全、卫生和质量。
中国药典(GMP)制药用水要求详解

中国药典(GMP)制药用水要求详解制药企业的生产工艺用水,涉及到的是制剂生产过程当中容器清洗、配液及原料药精制纯化等所需要使用的水,此类用水一般分成纯化水和注射用水两大类。
中国药典对此两类制药用水的制备工艺有具体的一个要求。
对于注射用水,中国药典要求使用蒸馏的方法制备,通常是使用多效蒸馏器。
此要求与FDA、UP和JP的要求差别较大,本文在此就不详谈制备方面的差别,下文主要谈一谈中国药典(GMP)对制药用水的各方面要求,尤其对纯化水和注射用水的TOC检测要求.一、同制药用水的用途差别1.1纯化水的用途:1、制备注射用水(纯蒸汽)的水源2、非无菌药品直接接触药品的设备、器具和包装材料最后一次洗涤用水3、注射剂、无菌药品瓶子的初洗4、非无菌药品的配料5、非无菌药品原料精制1.2注射用水的的用途1、无菌产品直接接触药品的包装材料最后一次精洗用水2、注射剂、无菌冲洗剂配料3、无菌原料药精制4、无菌原料药直接接触无菌原料的包装材料的最后洗涤用水1.3纯蒸汽的用途1、无菌药品物料、容器、设备、无菌衣或其他物品需进入无菌作业区的湿热无菌处理2、培养基的湿热灭菌二、2010年版中国药典(GMP)对注射用水中总有机碳(TOC)的新要求2.1为什么需要检测总有机碳(TOC)微生物超标纠正标准是指微生物污染达到某一数值,表明注射用水系统已经偏离了正常运行的条件,应采取纠偏措施,使系统回到正常的运行状态。
“热原”通常是由细菌产生的,是那些能致热的微生物的代谢产物,以“细菌内霉素”指标来表示。
大多数细菌和许多霉菌都能产生热,致热能力最强的是革兰阴性杆菌的产物。
微生物代谢产物中的内毒素是造成热原反应的最主要因素。
细菌内毒素耐热性强,其尺寸大小约在1-50μm之间,故可通过一般滤器进入滤液中,但能被活性炭、硅藻土滤器等吸附。
热原本身不挥发,但能在蒸馏时被汽化的水滴带入蒸馏水中。
总有机碳TOC=TC(总碳)-IC(无机碳)。
总有机碳的指标在一定意义上说明的是对水污染的监控。
《药典》关于制药用水的要求

《药典》关于制药用水的要求制药用水是指在制药生产过程中所使用的水,其质量要求直接关系到制药产品的质量和安全性。
因此,制药用水的质量标准是制药行业中非常重要的一部分,并且在《药典》中也有详细的规定。
本文将从四个方面介绍《药典》对制药用水的要求。
首先,《药典》对制药用水的纯净度要求非常高。
水中不能含有任何对人体有害的有机物、无机物和微生物。
《药典》规定,制药用水应该经过以下处理:澄清、加热、活性炭吸附、离子交换、消毒等。
其中,消毒是必不可少的一步,制药用水在消毒前应该达到指定的化学和物理性质标准,并且在制药过程中,应该定期进行微生物检测。
其次,《药典》对制药用水的纯度要求也非常高。
在制药过程中,制药用水应该自由或部分离子化,以达到特定纯度要求。
水中的离子含量对制药过程中的化学反应和药物稳定性有着重要影响。
《药典》规定了不同等级水的特定离子限制,包括铝、铁、锰、氨和重金属离子等。
制药用水的纯度要求还包括溶解氧、总有机碳、总有机物等。
再次,《药典》对制药用水的温度和pH值也有明确的规定。
制药用水的温度应当适宜,以确保制药过程的正常进行。
同时,《药典》还规定了制药用水的pH值应符合特定要求,以确保药物在制药过程中的稳定性和溶解度。
最后,《药典》还规定了制药用水的微生物标准。
制药用水应该是微生物无菌的或者微生物菌落数应该低于特定的限制。
这是因为微生物对药物的品质和安全性有着重要影响。
《药典》指定了不同类型的制药用水的微生物限制,包括各种细菌和真菌。
总结起来,《药典》对制药用水的要求主要包括纯净度、纯度、温度和pH值、微生物标准等。
这些要求保证了制药用水的质量和安全。
同时,制药企业在生产过程中应该严格遵守《药典》的要求,确保制药用水的质量符合相关标准,以保证制药产品的质量和安全性。
制药用水的标准和解释说、使用和解释说明
关于制药用水的标准、使用和解释说明(一)一、关于制药用水的分类及概述:首先,制药工艺用水分为饮用水、纯化水和注射用水。
由于水的微生物检验需要培养一段时间,检验结果是滞后于水的使用的,所以日常的清洁消毒以及防止微生物滋生繁殖对水系统是最重要的。
因此,,应当始终如一的保持水的质量符合相关标准。
1、饮用水:世界各国都有规定,我国,饮用水符合《中华人民共和国国家标准生活饮用水卫生标准》,自然水经过简单的处理包括软化、去离子、消毒、过滤等。
2、纯化水:至少由饮用水经过去离子、反渗透、蒸馏等合适的方法制备,符合国家药典要求,并保护其不再被污染和微生物繁殖。
3、注射用水:中国药典规定,注射用水通过纯化水蒸馏的方法制备,它不是无菌水,也不是最终的制剂,只是一种中间产品。
二、制药工艺用;水的使用要求1、饮用水:生产原料药和设备清洁的最低要求用水,如果有要求,使用高于饮用水的水质也可以。
2、纯化水:用于非无菌制剂,如果没有特别规定要使用注射用水的时候,产品的配方至少采用纯化水。
3、注射用水:用于注射剂的生产,或者用于制备无菌的注射用水。
如果蒸汽与注射剂生产设备直接接触,冷凝水要符合WFI的质量。
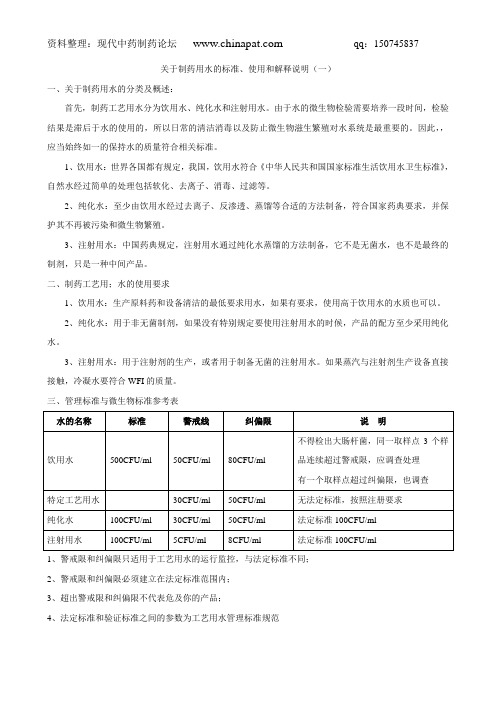
三、管理标准与微生物标准参考表水的名称标准警戒线纠偏限说明饮用水500CFU/ml 50CFU/ml 80CFU/ml 不得检出大肠杆菌,同一取样点3个样品连续超过警戒限,应调查处理有一个取样点超过纠偏限,也调查特定工艺用水30CFU/ml 50CFU/ml 无法定标准,按照注册要求纯化水100CFU/ml 30CFU/ml 50CFU/ml 法定标准100CFU/ml注射用水100CFU/ml 5CFU/ml 8CFU/ml 法定标准100CFU/ml1、警戒限和纠偏限只适用于工艺用水的运行监控,与法定标准不同;2、警戒限和纠偏限必须建立在法定标准范围内;3、超出警戒限和纠偏限不代表危及你的产品;4、法定标准和验证标准之间的参数为工艺用水管理标准规范以上对于制药工艺用水的初步描述关于制药工艺用水的设计、日常监控、取样、管理、维护等问题将在以后逐步完善请各位批评指正,或登录现代中药制药论坛参与讨论本资料为整理,拥有版权及解释权。
《制药用水》课件

01
监控系统组成
制药用水监控系统包括传感器、数据采集模块、监控主机等组成部分,
能够实时监测水质的各项指标。
02 03
监控系统功能
监控系统具有实时监测、数据存储、报警提示等功能,能够及时发现水 质异常情况,并采取相应的处理措施,保证制药用水的质量和药品的安 全性。
监控系统的维护与管理
为了保证监控系统的正常运行,需要定期对系统进行校准、清洁和维护 ,同时建立完善的管理制度,确保监控数据的准确性和可靠性。
通过培养基培养和显微镜检查等 方法,检测水中微生物的数量和 种类,确保水质无菌或符合规定
标准。
理化检测
利用化学分析、光谱分析、电导率 仪等方法,检测水的pH值、总有 机碳、重金属离子等指标,确保水 质符合工艺要求。
痕量物质检测
采用高效液相色谱、气相色谱等精 密仪器,检测水中痕量有机物、农 药残留等微量物质,保证药品生产 的安全性。
制药用水应储存在清洁、干燥、通风 良好的地方,避免阳光直射和高温。
储存容器应定期清洗和消毒,确保水 质安全。
制药用水的输送
制药用水的输送管道应采用优 质不锈钢或其他高耐腐蚀材料 制成。
输送管道应定期进行清洗和消 毒,确保管道内无残留物。
制药用水在输送过程中应保持 一定的压力和温度,以保证水 质的稳定性和安全性。
确保清洗和消毒过程符合相关法 规和标准,保证设备的安全性和
有效性。
制药用水系统的故障排除与应对措施
建立制药用水系统故障的应急预案,确保故障发生时能够及时处理。
对制药用水系统进行定期的维护和保养,预防故障的发生。
当制药用水系统出现故障时,及时采取应对措施,如关闭系统、隔离故障部位等, 以防止问题扩大。
GMP对制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
3、设备内外壁表面,要求光滑平整、无死角,容易清洗、灭菌。
制药用医药用水设备制水标准

制药用医药用水设备制水标准一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直截了当用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制一般药物制剂的溶剂或试验用水,不得用于注射剂的配制。
采纳离子交换法、反渗透法、超滤法等非热水处理设备的纯化水一样又称去离子水。
采纳专门设计的蒸馏器用蒸馏法制备的纯化水一样又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经专门设计的蒸馏器蒸馏冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采纳在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,关于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采纳的标准化、通用化、系统化零部件。
3、设备内外壁表面,要求光滑平坦、无死角,容易清洗、灭菌。
GMP认证制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection ):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection ):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85 )2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应> 0.5M Q .CM/25 C ,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应> 1M Q .CM/2&。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
典型行业的水处理工艺 第二节 制药用水

5 氨:取本品50ml,加碱性碘化汞钾试液2ml,放置15 分钟;如显色,与氯化铵溶液(取氯化铵 31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml 与碱性碘化汞钾试液2ml 制成的 对照液比较,不得更深(0.00003%)。
6 二氧化碳:取本品25ml,置50ml 具塞量筒中,加氢氧化钙试液25ml,密塞振摇,放置,1 小时内 不得发生浑浊。
法处理后的颜色比较,不得更深(0.000002%)。
7 二氧化碳:取本品25ml,置50ml 具塞量筒中,加氢氧化钙试液25ml,密塞振摇,放置,1 小时 内不得发生浑浊。
8 易氧化物:取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再
煮沸10 分钟,粉红色不得完全消失。
再精密量取10ml加水稀释成100ml摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水
4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
6 亚硝酸盐:取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸 萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品 计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml, 加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方
二:注射用水
检查
1 pH值:应为5.0~7.0。
2 氨:取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化 铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1ml,加无氨水48ml与碱性碘化汞钾试液2ml制 成的对照液比较,不得更深(0.00002%)。
制药用水管理制度

制药用水管理制度有限公司管理标准类文件目的:建立制药用水管理制度,确保制药用水质量符合规定。
适用范围:本公司所有的制药用水。
责任人:质量部、制造部、工程部制药用水的监护、制水、使用、检测相关人员。
内容:1. 制药用水分类1.1制药用水是指制药工艺过程中用到的各种质量标准的水。
制药用水至少应当采用饮用水。
1.2按水质分为饮用水、纯化水、注射用水、灭菌注射用水。
1.3本公司制药用水为饮用水、纯化水、注射用水。
2. 制药用水的定义及适用范围2.1饮用水:为天然水经净化处理所得的水,其质量应符合卫生部生活饮用水标准(GB/T5750-2006)。
饮用水可作为药材净制时的漂洗、制药用具的粗洗用水。
除另有规定处,也可作为药材的提取溶剂。
2.2纯化水:为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
水质应符合中国药典2010年版纯化水标准;纯化水可作为配制普通药物制剂用的溶剂或试验用水;可作为中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂;口服、外用制剂配制用溶剂或稀释剂;非灭菌制剂用器具的精洗用水。
也用作灭菌制剂所用药材的提取溶剂。
纯化水不得用于注射剂的配制与稀释。
2.3注射用水:为纯化水经蒸馏所得的水,应符合细菌内毒素试验要求。
注射用水必须在防止内毒素产生的设计条件下生产、贮藏及分装。
其质量应符合中国药典2010年版注射用水标准。
注射用水可作为配制注射剂、滴眼剂等的溶剂或稀释剂及注射用容器的精洗。
3.纯化水和注射用水贮存与输送:3.1纯化水在室温下用优质不锈钢罐密封贮存,贮存周期不宜大于36小时。
3.2注射用水,应在80℃以上保温、70℃以上循环保温或4℃以下的无菌状态下贮存。
注射用水需在24小时内使用,超过时间,严禁使用。
3.3纯化水、注射用水储罐和输送管道、管件、阀门应采用无毒、耐腐蚀的优质低碳不锈钢;储罐的通气口应当安装不脱落纤维的疏水性除菌滤器;管道的设计和安装应避免死角、盲管,并尽量减少支管和阀门,分配管线宜采用环形干线,防止死角滞留。
GMP认证制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
3、设备内外壁表面,要求光滑平整、无死角,容易清洗、灭菌。
各类制药用水的用途和质量要求 解释说明

各类制药用水的用途和质量要求解释说明1. 引言1.1 概述制药过程中所使用的水被称为制药用水,根据不同的用途和要求,制药用水可分为注射用水、灭菌用水和清洗用水等多种类型。
这些不同类型的制药用水在制药工艺中发挥着各自重要的作用。
1.2 文章结构本文将对各类制药用水的用途和质量要求进行详细介绍。
首先,我们将探讨注射用水的用途和相关质量要求。
随后,我们将重点讨论灭菌用水及其质量要求。
最后,我们将阐述清洗用水在制药过程中的应用及其相应的质量要求。
1.3 目的本文旨在向读者全面介绍各类制药用水在制药工艺中的重要性以及相应的质量要求。
深入了解各类制药用水及其质量标准对于确保生产出符合药品质量标准且无风险的制剂至关重要。
通过学习本文内容,读者将能够更好地理解和掌握制药行业中不同类型制药用水的特点和应用,并为制药生产提供参考和指导。
2. 各类制药用水的用途和质量要求2.1 注射用水:注射用水是制药过程中最关键的一种用水,主要用于稀释和溶解药物、制备各种注射剂。
由于直接进入人体,注射用水必须具备高纯度和无菌性。
其质量要求如下:- 纯度要求:注射用水应不含任何有毒有害物质,如重金属离子、有机物污染等。
- 微生物限度:注射用水必须通过灭菌处理,确保微生物数量符合标准,以防止感染。
- pH值要求:注射用水的pH值应接近人体生理状态,通常介于5.0至7.0之间。
2.2 灭菌用水:灭菌用水主要是指在制药过程中对设备、容器、工具等进行灭菌处理所使用的水。
其主要目的是消除潜在的病原菌和细菌,以保证产品的无菌性。
灭菌用水的质量要求如下:- 杀菌效果:灭菌用水必须具有强大的杀菌能力,能够有效灭活各类细菌、真菌和病毒。
- 无毒性:灭菌用水不能对药物和制剂产生任何毒性影响,以确保产品的安全性。
- 物理性质:灭菌用水在温度、压力等物理参数上要符合特定的要求,以确保灭菌过程的有效进行。
2.3 清洗用水:清洗用水主要用于清洗设备、容器、管道等制药设施,以去除附着在表面上的有机杂质和其他污染物。
制药用水-PPT

1
制药用水
药学系
2
学习目标
知识目标 ☆熟悉纯化水、
注射用水的定义和 质量要求
☆了解电渗析
法、掌握反渗透法 制备纯化水的原 理
能力目标 ☆能掌握制药
用水工艺流程 以及相应制备
3
一、概 述
• 1、制药工艺用水的定义 • 2、纯化水与注射用水的区别 • 3、GMP对工艺用水系统的要求
4
1、制药工艺用水的定义(2010年版中国药典)
26
(二)电渗析法 成本更低 化学纯度不如离子交换法,电阻率10万•cm 原理:
盐水
阳
负
+
离
极 + +子 —— 膜
淡水
阴
盐水
— +
离 子
—
膜
——
+
+
正 极
27
(三)反渗透法_x000b_ 半透膜:膜材为醋酸纤
维素膜和聚酰胺膜 浓度差:两侧分别为盐溶液和纯水 外压力:大于渗透压,达到盐、水分离
施加的外压力
GMP第七十一条
– 根据产品工艺规程选用工艺用水 – 工艺用水应符合质量标准,并定期检验,检验有记录 – 应根据验证结果,规定检验周期
» 接下页
9
3、GMP对工艺用水系统的要求(3)
GMP附录一,第5条 • 水处理及其配套系统的设计、安装和维护应能确保供水
达到设定的质量标准。 GMP附录一,第4条
44
控制面板
冷凝器
蒸馏塔 设备固定架
多效蒸馏水机
45
注射用水贮存与输送
注射用水的贮存
• 应在80C以上密 封保存或65 C以 上循环或4 C以 下保存
制药用水分类及水质标准

制药用水分类及水质标准水是药物生产中用量最大,使用最广的一种原料,用于生产过程及药物制剂的制备,而且生产过程中的用水量很大,其中工艺用水量占相当比例。
水在药品生产中是保证药品质量的关键因素之一,尤其是输液生产中工艺用水显得更为重要。
对于一家申报GMP认证的制药企业,其生产厂房所能达到的洁净级别及制药用水所能达到的标准,是制药企业在GMP认证中将要重点检查的两个主要项目。
一、制药用水分类及水质标准1、制药用水分类制药用水通常可分为:饮用水、纯化水、注射用水。
按《中华人民共和国药典(2000年版)》(以下简称2000中国药典)所收载的制药用水中又另列“杀菌注射用水"一项。
它们的含义是:1.l饮用水(Potable-Water):通常为自来水公司供应的自来水,又称原水。
按2000中国药典规定;饮用水不能直接用作制剂和制备或试验用水。
1.2纯化水(Purifide Water):为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水,不含任何附加剂。
采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水,一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水,一般又称蒸馏水。
纯化水可作为配制普通药物制剂用的溶剂或试验用水,不得用于注射剂的配制。
1.3注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
目前一般的蒸馏器有多效蒸馏水机和气压式蒸馏水机等。
经蒸馏后的水需再经徽孔过滤方可作注射用水,徽孔过滤膜的孔径应为≤0.45μm。
注射用水可作为配制注射剂用的溶剂。
1.4 灭菌注射用水(Sterile Water for Injec-tion):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准2.l 饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FDA 在1993 年的《高纯水检查指南》中的论述, 工艺用水系统的验证一般可分为以下3 个阶段。 ⑴初始验证阶段 当确认所有设备和管路均已正确安装并能按要求 运 行,则可以进入水系统的初始验证阶段。
⑵运行阶段 也称同步验证阶段。应能证明,按SOP 运行, 系统始终能稳定地产出符合质量标准的水。 ⑶长期考察阶段 通过系统验证的第三阶段证明,按SOP 运行, 系统能在相当长的时间内始终产生符合质量要 求的水。
制药用水的制备与质量保证的控制
杜平华
前 言 药品生产用水的质量直接影响药品的质量。 因此,制药用水的质量控制,特别是其微生物 学指标的控制是极其重要的。 合理的操作规程、水系统的日常监测策略以进 一步降低系统的风险指数。
制药用水的分类、定义及用途
定义 制药用水 是药物生产用量大,使用广的一种辅料用 于生产过程及药物制剂的制备。 分类 2010版药典收载的制药用水,根据使用的范围不同 分为饮用水、纯化水 、注射用水及灭菌注射用水。
GMP 对制药用水制备装置的要求
⒈结构设计应简单、可靠、拆装简便。 ⒉为便于拆装、更换、清洗零件,执行机构的设计尽量采用标准 化、通用化、系统化零部件。 ⒊设备内外壁表面,要求光滑平整、无死角,易清洗、灭菌。零件 表面应做镀铬等表面处理,以耐腐蚀,防止生锈,设备外表面避 免用油漆,以防剥落。 ⒋制备纯化水设备应采用低碳不锈钢或其他经验证不污染水质 的的材料,制备纯化水的设备应定期清洗,并对清洗效果进行 验证。
GMP 对制药用水输送的要求
⒈纯化水和制药用水宜采用易拆卸、易清洗消毒的不锈钢泵输送。 在需用压缩空气或氮气压送的纯化水和制药用水的场合,压缩 空气和氮气需净化处理。 ⒉纯化水宜采用循环管路输送。管路设计应简洁,应避免盲管和 死角。管路应采用不锈钢管或经验证无毒、无腐蚀、不渗出 污染粒子的其他管材。阀门宜采用无死角的卫生级阀门,输 送纯化水应表明流向。 ⒊输送纯化水和注射用水的管道和输送泵应定期清洗、消毒灭菌, 并对清洗、灭菌效果进行验证,验证合格后方可使用。
大肠菌群检验方法 国际上对大肠菌群检验有3中不同体系 ⒈直接检查大肠埃希菌,一步到位。 ⒉检查大肠菌群。 ⒊只要是发酵型细菌便可认为是大肠菌群。采用了葡萄 糖发酵试验,包括 了肠杆菌科所有细菌。 1964年我国食品卫生是直接检查大肠埃希菌,一步到位, 为了与国际接轨。 1974年开始采用国际上通用的检查大肠菌群。
制药工艺用水的污染
水是一种良好的溶剂,能溶解各种固态、液态和气态的物质; ⑴含有各种盐类和化合物,溶有CO2。 ⑵胶体和大量的非溶解性物质如腐殖质胶体、 黏土、沙石、 微生物、浮游生物等。 ⑶排放的废水、废气和废渣等有害物质。
制药用水系统的污染
大体上可分为外源性污染和内源性污染两种。 外源性污染 主要指原水及系统外部原因所致 的污染。 内源性污染 指制药用水系统运行过程中所致 的污染。
水系统的内源性污染
内源性污染的影响因素 ⑴ 制水系统的设计 ⑵ 选材 ⑶ 运行 ⑷ 维护 ⑸ 贮存 ⑹ 使用
水系统的内源性污染
水系统的组成单元均可能成为微生物内源性污 染源。 原水中的微生物被吸附于活性炭、去离子树脂、 过滤膜或其它 设备的表面上,可形成生物膜。
细菌内毒素
热原 药学上通常是指那些能致热的微生物代谢产物。 革兰阴性杆菌的代谢产物,致热能力强是造成热原反 应的最主要因素。内毒素除了引起高烧外,还有凝血、 致代谢紊乱、血小板积聚、骨髓坏死等毒副作用,这 是各国重视控制细菌内毒素污染的重要原因。
GMP 对制药用水设备清洗的要求
设备清洗的规程应遵循以下原则 ⒈有明确的清洗方法和清洗周期。 ⒉明确关键设备的清洗验证方法。 ⒊清洗过程和清洗后检查的数据记录应存档保存。 ⒋无菌设备的清洗,尤其是直接接触药品的部位和部件必须灭菌,并 表明灭菌日期,必要时进行无菌验证。经灭菌的设备在3天内使用。 ⒌某些可移动的设备可移到清洁区进行清洗、消毒和灭菌。 ⒍同一设备连续加工同一无菌产品时,每批之间要清洗灭菌,同一设 备加工同一非灭菌产品时,至少每周或每生产三批后进行全面的 清洗。
易氧化物 不挥发物(1mg/100ml) 重金属(0.1ppm) 电导率
Байду номын сангаас
细菌内毒素(0.25Eu/ml) 细菌内毒素(0.25Eu/ml) 细菌内毒素(0.25Eu/ml) 细菌内毒素(0.25Eu/ml)
无菌,可见异物, 不溶性微粒 无菌,可见异物, 不溶性微粒
无菌,可见异物
无菌,可见异物
制药用水的质量标准
工艺用水系统的验证 我国 1998 版《药品生产质量管理规范》(GMP)的 第十四章第八十五条将“验证”定义为“证明任何程序、 生产过程、设备、物料、活动或系统确实能导致预期 结果的有文件证明的一系列活动”。 验证是药品生产及质量管理中一个全方位的质量活动, 它是实施GMP 的基础。工艺用水系统同样也存在验证 工作。
制药用水的质量标准
3、灭菌注射用水
ChP2005
pH5.0-7.0 氯化物 硫酸盐
BP2008/EP6.2
酸碱度 氯化物 硫酸盐
USP2009
pH5.0-7.0(加KCL) 氯化物 硫酸盐
ChP2010
pH5.0-7.0(加KCL) 氯化物 硫酸盐
钙盐
硝酸盐(60ppb) 亚硝酸盐(20ppb) 氨(0.2ppm)
新版中国药典关于制药用水的质量标准,除适当减少 了某些化学检查项外,主要是增加了两项检查: ⑴电导率检查:用于控制各种阴阳离子的污染程度。 ⑵总有机碳检查:控制有机污染(有机小分子,微生物) 上述两项的在线检测可对制水系统进行实时流程监控。
我国制药用水质量标准概况
1980 年 电子工业的高纯水试行标准 。 1994 年电子机械工业部制定了高纯水JB/T7621-1994 行业标准。 制药行业参照电子机械工业部行业标准的个别项目。 2000 版《中国药典》收载了纯化水和注射用水的标准并规定了使用范 围。 2005 版《中国药典》在纯化水和注射用水项下增加了微生物限度标准 和检验方法。 以上发展可可以看出我国对制药用水的质量规定在不断加强 , GMP对制药企业制水系统的要求也逐渐加强。 2010 版《中国药典》
制药用水的质量标准
1、纯化水
ChP2005 酸碱度 氯化物 硫酸盐 钙盐 硝酸盐(60ppb) 亚硝酸盐(20ppb) 氨(0.3ppm) 硝酸盐(2ppm) 硝酸盐(60ppb) 亚硝酸盐(20ppb) 氨(0.3ppm) BP2008/EP6.2 USP2009 ChP2010 酸碱度
电导率
易氧化物 不挥发物(1mg/100ml) 重金属(0.3ppm) 重金属(0.1ppm) 铝盐(10ppb) 微生物总数不得过100个 /1ml 微生物总数不得过100个 /1ml TOC或易氧化物
电导率
TOC
电导率
TOC或易氧化物 不挥发物(1mg/100ml) 重金属(0.1ppm)
微生物总数不得过100个 /1ml
制药用水的质量标准
2、注射用水 USP200 9
ChP2005
BP2008/EP6.2
ChP2010
pH5.0-7.0
氯化物、硫酸盐、 钙盐、硝酸盐、亚 硝酸盐、二氧化碳、 易氧化物、不挥发 硝酸盐(2ppm) 物与重金属均同纯 化水、电导率 铝盐(10ppb)、电导率
钙盐和镁盐
硝酸盐(2ppm) 氨(0.2ppm) 易氧化物 不挥发物(1mg/100ml) 重金属(0.1ppm) 电导率
钙盐
钙盐
硝酸盐(60ppb) 亚硝酸盐(20ppb)
氨(0.2ppm)
氨(0.2ppm)
二氧化碳
易氧化物 不挥发物(1mg/100ml) 重金属(0.3ppm)
二氧化碳
易氧化物
二氧化碳
制药用水的原水通常为饮用水。
制药用水的用途
制药用水的选择 应根据生产工序或使用目的与要求选用适宜的制药 用水。 药品生产企业应确保制药用水的质量符合预期用途 的要求。
制药用水的用途
饮用水 纯化水 注射用水 灭菌注射用水 用途
新版GMP 对制药企业水系统的验证与监控
条 款 规 定 第一百零四条 药品生产用水应适合其用途,应至少采用饮用水。 各类 药品生产选用的制药用水应符合《中国药典的相 关要求》。 第一百零五条 饮用水应符合国家有关的质量标准,纯化水、注 射用 水 应符合中国药典的质量标准。 第一百零六条 水处理设备及其输送系统的设计,安装和维护应能确保 制药用水达到设定的质量标准。水处理设备的运行不得 超出其设计性能 。 第一百零七条 纯化水、注射用水储罐和输送管道所用材料应无毒、耐 腐蚀,储 罐的通气口应安装不脱落纤维的疏水性除菌滤 器;管道的设计和安装避免死角、盲管。
新版GMP 对制药企业水系统的验证与监控
第一百零八条 应对制药用水及原水水质进行定期检测,并有相应的记 录。 第一百零九条 纯化水、注射用水的制备,储存和分配应能防止微生物 的滋生,如注射用水可采用70℃以上保温循环。 第一百一十条 应按照书面规程定期消毒纯化水、注射用水管道、储罐以 及其它必要的辅助管道(如清洁、消毒用的管道,生产用 临时连接管道),并有相关的记录,书面规程还应详细规 定制药用水微生物污染的警戒限度,纠偏限度和采取的措 施。
GMP 对制药用水制备装置的要求
⒌注射用水接触的材料必须是优质低碳不锈钢(例如316L不锈钢) 或其他经验证不对水质产生污染的材料。制备注射用水的设备 应定期清洗,并对清洗效果进行验证。 ⒍纯化水储备周期不易大于24h,起储罐易采用不锈钢材料或经验 证无毒耐腐蚀,不渗出污染粒子的其他材料制作。保护其通气口 应按装不脱落纤维的疏水性除菌滤器。储罐内壁应光滑,接管和 焊缝不应有死角和沙眼。应采用不会形成滞水污染的显示液面、 温度压力等参数的传感器。对储罐定期清洗、消毒灭菌,并对清 洗、灭菌效果进行验证。
我国现行制药用水微生物质量标准及检验方法
