制药用水指南
制药用水指南范文

制药用水指南范文引言:制药用水是指在制药、生物制剂和生产过程中使用的一种特殊的水质。
由于制药工艺的特殊性,制药用水的要求相对较高,对水质的纯净度、无菌性、稳定性等有严格的要求。
本文将就制药用水的纯净度、水质要求、处理工艺等方面进行详细介绍。
一、制药用水的纯净度要求制药用水需要具备高度纯净度,以确保生产出的药品的质量和安全性。
主要包括以下几方面的要求:1. 电导率:制药用水的电导率一般要求高于0.2μs/cm,以确保水中痕量的离子杂质浓度低于0.1ppm。
2. TOC(总有机碳):TOC是衡量水中有机污染物含量的指标,制药用水的TOC应低于0.5ppm,以确保水中的有机污染物对药品生产的影响最小化。
3. 细菌总数:制药用水应满足无菌要求,细菌总数应低于10cfu/mL,以避免细菌的感染和繁殖。
4. 重金属:制药用水中的重金属含量应低于0.1ppm,以避免对药品质量和人体健康的影响。
二、制药用水的水质要求除了纯净度要求外,制药用水还需要满足各类药品的生产工艺和要求。
主要包括以下几个方面:1. 微生物限度:制药用水的微生物限度要符合药典要求,例如美国药典(USP)规定制药用水的大肠杆菌限度应低于10cfu/100mL,霉菌限度应低于10cfu/100mL。
对于注射用水等应用更严苛的药品,微生物限度要求更高。
2.pH值:制药用水的pH值应在5至7之间,以确保对药品生产无不良影响。
3.温度:制药用水的温度应根据不同的工艺要求进行调整,一般应保持在20-30摄氏度之间。
4.色度、气味和味道:制药用水应无色、无异味,无明显的化学味道。
三、制药用水处理工艺制药用水的处理工艺一般包括预处理和后处理两个环节,预处理主要用于去除水中的悬浮物、溶解性无机盐和部分有机物,后处理主要用于去除水中的溶解性有机物和微生物。
1.预处理:预处理一般包括净水、软化和过滤等步骤。
净水主要通过去除杂质和部分溶解性离子来提高水的纯净度;软化主要是通过去除水中的镁、钙离子等硬度物质,以防止在后续处理工艺中产生沉淀和结垢;过滤主要用于去除水中的悬浮物和颗粒物。
GMP认证制药用水要求

GMP认证制药用水要求
GMP认证制药用水要求
一:制药用水分类及水质标
1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类
1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制
采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准
1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)
2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
欧盟《制药用水质量指南》2020版(中英文对照)

欧盟《制药⽤⽔质量指南》2020版(中英⽂对照)Guidelineon the quality of water for pharmaceutical use制药⽤⽔质量指南This guideline replaces the Note for guidanceon quality of water for pharmaceutical use (CPMP/QWP/158/01 EMEA/CVMP/115/01)and CPMP Position Statement on the Quality of Water used in the production ofVaccines for parenteral use (EMEA/CPMP/BWP/1571/02 Rev.1).本指南取代“制药⽤⽔质量指南说明”(CPMP/QWP/158/01 EMEA/CVMP/115/01)和CPMP《注射疫苗⽣产⽤⽔质量⽴场声明》(EMEA/CPMP/BWP/1571/02 rev.1)。
Executive summary 执⾏摘要This guideline replaces the Note for Guidanceon quality of water for pharmaceutical use (CPMP/QWP/158/01, EMEA/CVMP/115/01)originally adopted in May 2002, and the CPMP Position Statement on the Qualityof Water used in the production of Vaccines for parenteral use(EMEA/CPMP/BWP/1571/02 rev.1).本指南取代2002 年5 ⽉⽣效的《制药⽤⽔质量指南说明》(CPMP/QWP/158/01, EMEA/CVMP/115/01),和CPMP《注射疫苗⽣产⽤⽔质量⽴场声明》(EMEA/CPMP/BWP/1571/02 rev.1)。
制药用水分类及水质标准

1、制药用水分类制药用水通常可分为:饮用水、纯化水、注射用水。
按《中华人民共和国药典(2000年版)》(以下简称2000中国药典)所收载的制药用水中又另列“杀菌注射用水"一项。
它们的含义是:1.l饮用水(Potable-Water):通常为自来水公司供应的自来水,又称原水。
按2000中国药典规定;饮用水不能直接用作制剂和制备或试验用水。
1.2纯化水(Purifide Water):为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水,不含任何附加剂。
采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水,一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水,一般又称蒸馏水。
纯化水可作为配制普通药物制剂用的溶剂或试验用水,不得用于注射剂的配制。
1.3注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
目前一般的蒸馏器有多效蒸馏水机和气压式蒸馏水机等。
经蒸馏后的水需再经徽孔过滤方可作注射用水,徽孔过滤膜的孔径应为≤0.45μm。
注射用水可作为配制注射剂用的溶剂。
1.4 灭菌注射用水(Sterile Water for Injec-tion):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准2.l 饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)。
需定期检测饮用水水质,在当前原水水质遭受有机物等污染日益加剧的情况下,应针对不同的污染物,采取有效措施,不使因饮用水水质波动而影响药品质量。
2.2 纯化水:应符合2000中国药典所收载的纯化水标准。
2000中国药典对纯化水在酸碱度、氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、氨、二氧化碳、易氧化物、不挥发物、重金属等项均提出了具体的检验方法及要求。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药用水及蒸汽指南1

---
“确认”的不同阶段
中国医药设备工程协会 北京嘉华特咨询服务有限公司 2009.02.北京
中国医药设备工程协会
目录
引言 适用范围 水的质量标准 不同级别的水在药品生产中的应用 制水系统的设计 储罐及环路的设计 制药用水材料及安装工艺要求 水系统的试运行与验证 水系统的日常监控 水系统日常运行及维护保养 实验室用水 取样 制药用蒸汽
Operational Check运 行检查 Installation Check安 装检查
FAT & SAT
Design Review and ApprovalProgramming控制 系统编程 Operating Interface Build操作界面建立 Mechanical and Electrical Build构建机电 中国医药设备工程协会 系统 7
2 - 设备及组件文件
设备及组件的清单和标准 厂家技术资料及证书
中国医药设备工程协会
23
设计确认
中国医药设备工程协会
20
验证的生命周期
初始验证
• 设计确认 • 安装确认 • 仪器校验 • 运行确认 • 性能确认 (工艺验证)
目的在于确保水系统从设计到使用的各个阶段是在 GMP的规范下完成的
中国医药设备工程协会
21
设计确认
或者称EDR-进一步的设计审核
I这是一个设计文件包的审核过程,目的在于检查设计的完整性和 与用户需求和法规要求的符合性
ASME
GAMP ISPE -
ASME BPE - 2007 - “Bioprocessing Equipment”
GAMP Guide: “Validation of Automated Systems in Pharmaceutical Manufacture - V 3.0”
GMP对制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
3、设备内外壁表面,要求光滑平整、无死角,容易清洗、灭菌。
制药用水—认识制药用水(药物制剂技术)
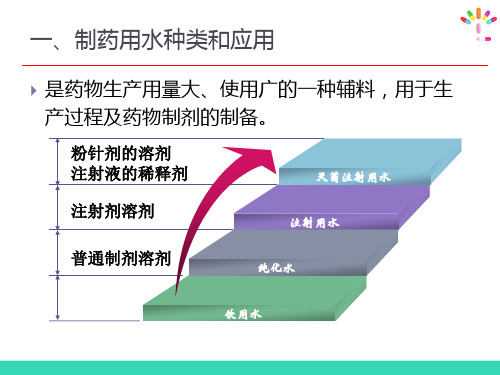
是药物生产用量大、使用广的一种辅料,用于生 产过程及药物制剂的制备。
粉针剂的溶剂 注射液的稀释剂
灭菌注射用水
注射剂溶剂
注射用水
普通制剂溶剂
纯化水
饮用水
饮用水
为天然水经净化处理所得的水,可作制药用具的 粗洗用水,也可作为药材的提取溶剂
纯化水
用饮用水经蒸馏法、离子交换法、反渗透法或其 它适宜方法制得的供药用的水,可作为配制普通 药物制剂的溶剂或试验用水,不得用于注射剂的 配制。
≤0.00003% <0.06µg/ml <0.02µg/ml <0.1µg/ml
注射水
5.0~7.0 ≤0.00002%
≤100个/ml
≤100个/100ml
―
<0.25EU/ml
注射用水的质量要求
酸碱度、氯化物、硫酸盐、钙盐、铵盐、二氧化 碳、易氧化物、不挥发物及重金属等均应符合规 定。
pH:5.0-7.0,氨浓度不超过 0.00002% 通过热原检查,细菌内毒素 ﹤0.25EU/ml 制备后12小时内使用
灭菌注射用水
项目
色
感官
臭味
性状
澄明度 肉眼可见
化学
pH 电导率 总有机碳(TOC)
指标
易氧化物 不挥发物
氨
毒理学 指标
硝酸盐﹙以N计﹚ 亚硝酸盐﹙以N计﹚
重金属
微生物 学指标
细菌总数
细菌内毒素含量 (热原)
质量标准定 依法检查符合规定
≤0.50mg/L 依法检查符合规定 依法检查符合规定
注射用水
为纯化水经蒸馏所得的蒸馏水,作为配制注射剂 用的溶剂或稀释剂,直接接触药品的设备、容器 及用具的最后清洗。
GMP认证制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection ):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection ):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85 )2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应> 0.5M Q .CM/25 C ,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应> 1M Q .CM/2&。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
制药用水及制药用蒸汽指南最新

GMP制药用水及制药用蒸汽技术指南(讨论稿)2009-10-29GMP工程技术中心发布目录一、引言二、适用范围三、水的质量标准(一)饮用水(二)纯化水(三)注射用水(四)其他级别的水四、不同级别的水在药品生产中的应用五、制水系统的设计(一)总体设计要求(二)纯化水系统(三)纯蒸汽发生器及蒸馏水机六、储罐和环路的设计(一)总体设计要求(二)典型的纯化水储存及分配环路模式(三)典型的注射用水储存及分配环路模式(四)储罐(五)呼吸滤器(六)管道(七)循环泵(八)热交换器(九)使用点(十)过程检测与控制七、制药用水材料及安装工艺要求(一)接触材料(二)保温(三)清洁与钝化(四)其他八、工艺用水管理九、水系统运行与验证(一)试运行(二)系统确认文件(三)系统确认及其取样程序(四)验收标准与确认报告十、水系统的日常监控(一)水系统的日常监测(二)特定工艺用水系统(三)纯化水与注射用水(四)制药用水常见问题十一、制药用水系统的消毒和灭菌(一)部分细菌和真菌在不同温度条件下的生长情况(二)常见细菌的致死时间(三)制药用水中热源的去除(四)紫外线杀菌在水处理中的应用(五)臭氧灭菌在水处理中的应用十二、水系统日常运行及维护保养十三、实验室用水十四、取样(一)取样规程(二)纯化水和WFI监控点阀门的选用(三)取样和检测十五、制药用蒸汽(一)引言(二)蒸汽的制备和分配(三)蒸汽质量属性及其检测(四)纯蒸汽系统的性能确认(五)纯蒸汽系统的常规监测与再确认十六、术语十七、参考文献一、引言水是药物生产中用量最大、使用最广的一种原料,用于生产过程及药物制剂的制备。
不同要求的药品,决定了对水的不同质量的需求。
Water is the most widely used substances, raw material, or ingredient in the production, processing, and formulation of compendial articles. (USP General Informationsection 1231)在水的处理、储存和分配的过程中,水的质量(包括微生物学和化学质量)控制是人们关注的焦点。
中国药典(GMP)制药用水要求详解(精选5篇)

中国药典(GMP)制药用水要求详解(精选5篇)第一篇:中国药典(GMP)制药用水要求详解中国药典(GMP)制药用水要求详解制药企业的生产工艺用水,涉及到的是制剂生产过程当中容器清洗、配液及原料药精制纯化等所需要使用的水,此类用水一般分成纯化水和注射用水两大类。
中国药典对此两类制药用水的制备工艺有具体的一个要求。
对于注射用水,中国药典要求使用蒸馏的方法制备,通常是使用多效蒸馏器。
此要求与FDA、UP和JP的要求差别较大,本文在此就不详谈制备方面的差别,下文主要谈一谈中国药典(GMP)对制药用水的各方面要求,尤其对纯化水和注射用水的TOC检测要求.一、同制药用水的用途差别 1.1纯化水的用途:1、制备注射用水(纯蒸汽)的水源2、非无菌药品直接接触药品的设备、器具和包装材料最后一次洗涤用水3、注射剂、无菌药品瓶子的初洗4、非无菌药品的配料5、非无菌药品原料精制 1.2注射用水的的用途1、无菌产品直接接触药品的包装材料最后一次精洗用水2、注射剂、无菌冲洗剂配料3、无菌原料药精制4、无菌原料药直接接触无菌原料的包装材料的最后洗涤用水1.3纯蒸汽的用途1、无菌药品物料、容器、设备、无菌衣或其他物品需进入无菌作业区的湿热无菌处理2、培养基的湿热灭菌二、2010年版中国药典(GMP)对注射用水中总有机碳(TOC)的新要求2.1为什么需要检测总有机碳(TOC)微生物超标纠正标准是指微生物污染达到某一数值,表明注射用水系统已经偏离了正常运行的条件,应采取纠偏措施,使系统回到正常的运行状态。
“热原”通常是由细菌产生的,是那些能致热的微生物的代谢产物,以“细菌内霉素”指标来表示。
大多数细菌和许多霉菌都能产生热,致热能力最强的是革兰阴性杆菌的产物。
微生物代谢产物中的内毒素是造成热原反应的最主要因素。
细菌内毒素耐热性强,其尺寸大小约在1-50μm之间,故可通过一般滤器进入滤液中,但能被活性炭、硅藻土滤器等吸附。
热原本身不挥发,但能在蒸馏时被汽化的水滴带入蒸馏水中。
WHO《制药用水GMP指南》-2020草案(中英文对照版)

Working document QAS/20.842工作文件QAS/20.842May 2020二零二零年五月DRAFT WORKING DOCUMENT FOR COMMENTS:征求意见草案:Good manufacturing practices:优良制造规范(GMP):water for pharmaceutical use制药用水Background背景The control of water quality, including microbiological and chemical quality, throughout production, storage and distribution processes is a major concern. Unlike other product and process ingredients, water is usually drawn from an on-demand system and is not subject to testing and batch or lot release prior to use. The assurance of water quality to meet the on-demand expectation is, therefore, essential.水的制备、存贮和分配过程中对水质的控制,包括微生物和化学质量,是一个重要关注点。
与其它产品和工艺成分不同,水通常是来自一个按需运行的系统,在使用之前不会进行检测,也不会进行批放行,因此确保水质符合所需要求就至关重要了。
In recent years, following extensive consultation with stakeholders, several pharmacopoeias have adopted revised monographs on water for injection (WFI) that allow for production by non-distillation technologies, such as reverse osmosis (RO). In 2017, the World Health Organization (WHO) Expert Committee on Specifications for Pharmaceutical Preparations (ECSPP) recommended that the WHO Secretariat collect feedback on whether or not they should revise the WHO specifications and good manufacturing practices (GMP) on WFI, and how to do so. Following discussions during several consultations, the ECSPP agreed that the monograph in The International Pharmacopoeia (Water for injections) and the guideline WHO Good manufacturing practices: water for pharmaceutical use (1) should both be revised to allow for technologies other than distillation for the production of WFI. In early 2019, the WHO Secretariat commissioned the preparation of a draft guidance text for the production of WFI by means other than distillation. Following several public consultations, the text was presented to the Fifty-fourth ECSPP. The Expert Committee adopted the Production of water for injection by means other than distillation guideline and recommended that it should also be integrated into WHO’s existing guideline on Good manufacturing practices: water for pharmaceutical use.近年来,由于干系人提出非常多的建议,几部药典均对注射用水(WFI)进行了修订,允许采用非蒸馏技术如反渗透(RO)制备 WFI。
GMP认证制药用水要求

GMP认证制药用水要求一:制药用水分类及水质标1、制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》。
按2000中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
2)纯化水(Purified Water):为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。
纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称去离子水。
采用特殊设计的蒸馏器用蒸馏法制备的纯化水一般又称蒸馏水。
3)注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
注射用水可作为配制注射剂用的溶剂。
4)灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。
2、制药用水的水质标准1)饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2)纯化水:应符合《2000中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3)注射用水:应符合2000中国药典所收载的注射用水标准。
二:GMP对制药用水制备装置的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
3、设备内外壁表面,要求光滑平整、无死角,容易清洗、灭菌。
中国药典纯化水制药用水标准

中国药典纯化水(制药用水)标准本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【总有机碳】不得过0.50mg/L。
【易氧化物】取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
以上总有机碳和易氧化物两项可选做一项。
【重金属】取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
【电导率】应符合规定(附录)【铝盐】(供透析液生产用水需检查)取本品400ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水100ml ,用0.5% 8-羟基喹啉三氯甲烷溶液提取3次(20ml,20ml,10ml),合并三氯甲烷提取液于50ml量瓶中,加三氯甲烷至刻度,摇匀,即得供试品溶液;另取标准铝盐溶液[称取硫酸铝钾0.352g,置100ml量瓶中,加1mol/L硫酸溶液10ml溶解后,用水稀释至刻度,摇匀,作为贮备液。
临用前,精密量取贮备液1ml,置100ml量瓶中,用水稀释至刻度,摇匀,即得(每1ml相当于2μg的Al)]2.0ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水98ml,同法操作,即得标准溶液;取醋酸盐缓冲液(pH 6.0)10ml和水100ml,置分液漏斗中,同法操作,作为空白溶液。
取上述溶液,照荧光分析法(附录ⅣE),在激发光波长392nm与发射光波长518nm处分别测定荧光强度。
供试品溶液的荧光强度不得大于标准溶液的荧光强度(0.000 001%)。
制药用水质量指南

制药用水质量指南下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!随着制药行业发展的不断壮大,制药用水的质量成为了行业关注的焦点。
制药用水的标准和解释说、使用和解释说明
关于制药用水的标准、使用和解释说明(一)一、关于制药用水的分类及概述:首先,制药工艺用水分为饮用水、纯化水和注射用水。
由于水的微生物检验需要培养一段时间,检验结果是滞后于水的使用的,所以日常的清洁消毒以及防止微生物滋生繁殖对水系统是最重要的。
因此,,应当始终如一的保持水的质量符合相关标准。
1、饮用水:世界各国都有规定,我国,饮用水符合《中华人民共和国国家标准生活饮用水卫生标准》,自然水经过简单的处理包括软化、去离子、消毒、过滤等。
2、纯化水:至少由饮用水经过去离子、反渗透、蒸馏等合适的方法制备,符合国家药典要求,并保护其不再被污染和微生物繁殖。
3、注射用水:中国药典规定,注射用水通过纯化水蒸馏的方法制备,它不是无菌水,也不是最终的制剂,只是一种中间产品。
二、制药工艺用;水的使用要求1、饮用水:生产原料药和设备清洁的最低要求用水,如果有要求,使用高于饮用水的水质也可以。
2、纯化水:用于非无菌制剂,如果没有特别规定要使用注射用水的时候,产品的配方至少采用纯化水。
3、注射用水:用于注射剂的生产,或者用于制备无菌的注射用水。
如果蒸汽与注射剂生产设备直接接触,冷凝水要符合WFI的质量。
三、管理标准与微生物标准参考表水的名称标准警戒线纠偏限说明饮用水500CFU/ml 50CFU/ml 80CFU/ml 不得检出大肠杆菌,同一取样点3个样品连续超过警戒限,应调查处理有一个取样点超过纠偏限,也调查特定工艺用水30CFU/ml 50CFU/ml 无法定标准,按照注册要求纯化水100CFU/ml 30CFU/ml 50CFU/ml 法定标准100CFU/ml注射用水100CFU/ml 5CFU/ml 8CFU/ml 法定标准100CFU/ml1、警戒限和纠偏限只适用于工艺用水的运行监控,与法定标准不同;2、警戒限和纠偏限必须建立在法定标准范围内;3、超出警戒限和纠偏限不代表危及你的产品;4、法定标准和验证标准之间的参数为工艺用水管理标准规范以上对于制药工艺用水的初步描述关于制药工艺用水的设计、日常监控、取样、管理、维护等问题将在以后逐步完善请各位批评指正,或登录现代中药制药论坛参与讨论本资料为整理,拥有版权及解释权。
制药用水指南

制药用水指南目录一.综述(一)制药用水(二)水系统二.定义三.水的质量标准(一)饮用水(二)纯化水(三)注射用水(四)非药典要求用水四.饮用水、非药典要求用水及药典要求用水的使用(一)饮用水(二)非药典要求用水(三)药典要求用水五.药典要求用水制造系统的设计(一)水纯化方法(二)总设计(三)纯化水(四)注射用水六.水系统储罐及环路的设计(一)总体要求(二)典型的纯化水储存及分配环路模式(三)典型的注射用水储存及分配环路模式(四)储罐(五)呼吸滤器(六)管道(七)循环泵(八)热交换器(九)使用点(十)过程测量与控制七.建材及方法(一)纯化水与注射用水(二)绝热(三)其它八.水系统的试运行与验证(一)试运行(二)系统确认文件(三)系统确认及其取样程序(四)验收标准及验证报告(五)变更控制与再确认九.水系统的日常监控(一)饮用水(二)工艺水系统(三)纯化水与注射用水十.水系统日常运行及维护保养(一)清洁与钝化十一.实验室用水十二.取样(一)取样规程(二)纯化水系统代表性取样点的选择(三)取样操作和检测十三.参考文献一.综述(一)制药用水在药品制造过程不同阶段的工艺用水及其检测过程中,水是使用最广泛的物质、原料或起始物料。
药品的不同给药方式,决定了水的不同质量等级需求。
用于药品制造过程不同阶段的工艺用水及实验室用水均需满足各自的要求。
在整个处理、储存和分配过程中,水的质量(包括微生物学和化学质量)控制是人们关注的焦点。
与其他产品和组份不同,水通常根据需要从水系统中获得,使用前不经过质量检验或批质量评价程序。
因此,应当保证其质量符合特定的标准。
另外,某些微生物检验可能需要一段培养时间,因此,其检验结果很可能滞后于水的使用。
应优先考虑控制制药用水的微生物学质量。
某些微生物可能在水处理单元、储存和分配环节繁殖。
通过日常的消毒和各种防止微生物繁殖的方法以尽量避免生物污染至关重要。
(二)水系统制药用水的生产、储存和分配系统的设计、选材、建设、安装、试运行、验证和维护,应能确保其能够可靠地生产具有相应质量的水。
制药用水知识

总有机碳
制药用水的有机物质一般来源于水源、供水 系统以及水系统中菌膜的生长。通常用总有 机碳(TOC)测定仪或化学耗氧量法分析此 类物质在水中的含量。
2、用作微生物检查用的容器瓶口及塞子用锡 纸包裹,避免与空气直接接触,置121℃湿热 灭菌20min,或者160-180℃干热灭菌2小时 以上,烘干备用,可在两天内使用。
取样容器的处理
3、用作细菌内毒素检查的容器必须经250℃ 干烤至少1小时,在不开启容器的情况下,可 在三天内使用。否则需再次加热除去可能存 在的外源性内毒素。
新的制水系统、制水工艺发生变更或制水系 统停止运行超过6个月等情况,需要重新启动 水系统验证。
思考
1、制药用水分为几类? 2、原料药直接接触药品的包装材料的最后一次精
洗用水为何种工艺用水? 3、ZQA100代表什么意思。 4、用作细菌内毒素检查的容器如何处理? 5、纯化水和注射用水的检测关键项目分别是什么? 6、纯化水和注射用水有何区别?
介质代码:C为纯化水、Z为注射用水 作用代码:Y为使用点、Q为取样点 系统代码:A至Z代表各套系统 顺序号:001-999
取样用具
供微生物限度检查用:无菌具塞硬质玻璃瓶 供细菌内毒素检查用:无菌具塞硬质玻璃瓶 供物理和化学检查用:干净具塞硬质玻璃瓶
取样容器的处理
1、按照《实验室玻璃仪器清洗规程5-00038》 清洁。
注意事项
3、进行理化性质、感观性状检查的水样,应 在取样后3小时内检查,否则应在3-7℃保存, 并在8小时内检查。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制药用水指南目录1.综述(1)制药用水(2)水系统2.定义3.水的质量标准(1)饮用水(2)纯化水(3)注射用水(4)非药典要求用水4.饮用水、非药典要求用水及药典要求用水的使用(1)饮用水(2)非药典要求用水(3)药典要求用水5.药典要求用水制造系统的设计(1)水纯化方法(2)总设计(3)纯化水(4)注射用水6.水系统储罐及环路的设计(1)总体要求(2)典型的纯化水储存及分配环路模式(3)典型的注射用水储存及分配环路模式(4)储罐(5)呼吸滤器(6)管道(7)循环泵(8)热交换器(9)使用点(10)过程测量与控制7.建材及方法(1)纯化水与注射用水(2)绝热(3)其它8.水系统的试运行与验证(1)试运行(2)系统确认文件(3)系统确认及其取样程序(4)验收标准及验证报告(5)变更控制与再确认9.水系统的日常监控(1)饮用水(2)工艺水系统(3)纯化水与注射用水10.水系统日常运行及维护保养(一)清洁与钝化11.实验室用水12.取样(1)取样规程(2)纯化水系统代表性取样点的选择(3)取样操作和检测13.参考文献一.综述(1)制药用水在药品制造过程不同阶段的工艺用水及其检测过程中,水是使用最广泛的物质、原料或起始物料。
药品的不同给药方式,决定了水的不同质量等级需求。
用于药品制造过程不同阶段的工艺用水及实验室用水均需满足各自的要求。
在整个处理、储存和分配过程中,水的质量(包括微生物学和化学质量)控制是人们关注的焦点。
与其他产品和组份不同,水通常根据需要从水系统中获得,使用前不经过质量检验或批质量评价程序。
因此,应当保证其质量符合特定的标准。
另外,某些微生物检验可能需要一段培养时间,因此,其检验结果很可能滞后于水的使用。
应优先考虑控制制药用水的微生物学质量。
某些微生物可能在水处理单元、储存和分配环节繁殖。
通过日常的消毒和各种防止微生物繁殖的方法以尽量避免生物污染至关重要。
(二)水系统制药用水的生产、储存和分配系统的设计、选材、建设、安装、试运行、验证和维护,应能确保其能够可靠地生产具有相应质量的水。
水系统不应超设计负荷生产。
水的生产、储存和分配方式应能防止超出允许范围的微生物、化学和物理(如灰尘和脏物)污染。
在安装、试运行、验证和计划外维护、变更后,水系统应经过质量保证部门的批准方可使用。
按预先批准的计划进行预防性维护后,不必经批准即可使用。
应该定期监测原水和产水的质量,其化学、微生物、必要时细菌内毒素污染。
应监控水纯化、储存和分配系统的性能。
监测结果和所采取的措施应予记录并保存规定的时间。
水系统进行化学消毒之后,应有经过验证的冲洗程序,以确保消毒剂被有效去除。
二.定义生物膜指附着在表面的微生物集团,多以有机复合体的形式出现。
冷点指在对水系统进行热处理灭菌或消毒时,系统中温度最低的位置。
它是无菌保证中最为关键的位置。
在热消毒环路中,冷点通常位于消毒用热交换器的入口。
在热灭菌环路中,冷点通常位于灭菌用热交换器的入口、呼吸滤器的出口以及与空气衔接的位点。
药典要求用水指通过蒸馏或其它纯化工艺制备的水,其理化和微生物学指标相当于或高于蒸馏处理过的水。
电导率指水系统中离子引起的电子流动。
死角指在水系统中的某一位置,它限制或阻断了局部的水流。
通常死角位于支路,其长度超过主管道外径的三倍。
主管道到中心阀的距离,必须小于支路直径的三倍。
饮用水指由集中式供水单位直接供给居民作为饮用和生活的水,该水的水质必须确保居民终生饮用安全。
原水(原料水,二次供水)指用水单位将来自城市集中式供水系统的生活饮用水加压、储存、再处理(如过滤、软化、矿化、消毒等)后,经管道输送给用户的供水方式。
功能组合指具有相似结构与目的的使用点的组合,如一系列组合管道、结晶装置、离心机等。
功能组合的安装应尽可能接近,在与总环路和次级环路接合处不留死角。
纯化水指一般情况下,用以制备非无菌及热原制剂的水,在药典中对纯化水进行了定义。
符合内毒素测试的纯化水可用于生产透析液。
监控点指一个取样阀,用来对水系统进行验证或日常监控。
通常从该阀中可以得到具有代表性的样品。
离线取样指从储罐和分配系统中通过取样阀人工取水,送至实验室进行水质分析。
在线记录指水系统中配备的检测及记录装置,如电导率仪、总有机碳(TOC)检测器。
这些在线装置可以取代实验室检测,它须在完全符合GMP的要求下操作使用,定期校验和维护。
验证在线记录和离线检测是必要的。
生产工艺用水指用于包括原料药在内的药品,在生产、检测、加工、配制过程中用到的水。
采样点指水系统内部在一个装置,应设计成能从中能得到非污染的、有代表性的水样。
消毒指通过累积加热、化学物质或其它有效手段对关键设备及分配接触表面进行适当的处理,以达到有效破坏微生物活细胞,即而降低有害微生物的数量为目的。
有效方法选择的理论评估值为微生物下降5个LOG值,相当于99.999%。
超热水指超过沸点的水。
从物理学角度,超热(有时指沸腾延迟)是指一个液体加热到超过其标准沸点而没有实际沸腾的现象。
总有机碳(TOC)指以碳为检测值,间接检测水中有机物分子存在的指标。
无菌指没有活的微生物体存在。
一个产品的无菌性不能由检测结果作担保,而应通过有效的生产工艺验证为保障。
使用点指水的应用点。
使用点通常位于水系统的边缘。
注射用水指用于溶解或稀释注射用的药物或制剂,或者用于制备无菌的注射用水的水。
在药典中对注射用水进行了定义。
最差位置指水系统中容易出现异常情况的位置,在这个位置可能是制水的最远端、温度或流速最低点以及死角的末端。
警戒限是指微生物某一污染水平,监控结果超过它时,表明制药用水系统有偏离正常运行条件的趋势。
警戒水平的涵意是报警,尚不要求采取特别的纠偏措施。
行动限纠偏限是指微生物污染的某一限度,监控结果超过此限度时,表明制药用水系统已经偏离了正常的运行条件,应当采取纠偏措施,使系统回到正常的运行状态。
3.水的质量标准(1)饮用水饮用水应在没有可致产品污染的缺陷的管道系统中连续正压供应。
自然水或储备水除做了有限的处理外,直接形成饮用水。
自然水源包括泉水、井水、河水、湖水和海水。
水源的状态和条件决定了所需的处理方法,以供人员安全消费(饮用)。
典型的处理包括软化,某些离子的去除,减少微粒,以及抗菌处理。
公共饮用水系统的水源,通常来自于多种上述所列自然水源。
市政供水机构通常承担质量检查工作,保证供水符合饮用水标准。
饮用水的质量,在WHO的饮用水指南、ISO的标准,各国和地区标准中都有规定。
在我国,饮用水应该符合《中华人民共和国国家标准生活饮用水卫生标准》的相关规定。
③CFU为菌落形成单位。
④放射性指标规定数值不是限值,而是参考水平。
放射性指标超过表1中所规定的数值时,必须进行核素分析和评价,以决定能否饮用。
若饮用水直接用于药品生产的某些阶段,或用作生产较高质量的制药用水,应在使用点定期检验以确认其质量符合饮用水的标准。
(2)纯化水纯化水至少由饮用水通过去离子、反渗透、蒸馏及其它合适的方法制备。
应该所在国家药典关于化学和微生物限度的质量标准,应保护其不被再次污染和微生物繁殖。
表 3.2 纯化水欧、美、中现行药典规定对比表中国药典2005欧洲药典第5版**USP31*来源本品为蒸馏法、离子交换法、反渗透法或其他适宜方法制得为符合法定标准的饮用水经蒸馏、离子交换或其它适宜方法制得。
由符合美国环境保护协会或欧共体或日本法定要求的饮用水经适宜方法制得。
性状无色澄清液体,无臭,无味无色澄清液体,无臭,无味/酸碱度符合规定//氨≤0.3μg/ml//氯化物、硫酸盐与钙盐、亚硝酸盐、二氧化碳、不挥发物符合规定//硝酸盐≤0.06μg/ml≤0.2μg/ml/重金属≤0.3μg/ml≤0.1μg/ml/铝盐/用于生产渗析液时方控制此项/易氧化物符合规定符合规定/总有机碳(TOC)/≤0.5mg/L (≤500ppb碳 )≤0.5mg/L(≤500ppb碳 )电导率/≤4.3μS/cm(20℃)符合规定细菌内毒菌/≤0.25EU/ml/无菌检查//符合规定(用于制备无菌制剂时控制)微生物纠偏限度(actionlimit)≤100CFU/ml***≤100CFU/ml≤100CFU/ml*美国药典中规定:(1)企业自用的纯水监测TOC和电导率,供商用的纯水,应符合无菌纯水的试验要求。
上表中所列为企业自用纯水的监测项目。
(2)纯水不得用于制备肠外制剂(注射剂)。
**欧洲药典中TOC和易氧化物项目,可任选一项监控;电导率按温度与电导率要求表确定,上表中仅列出了20℃时对应的电导率值。
***中国药典中只有一限度,未区分纠偏限度与其它限度。
纯化水生产和储存期间,应有适当措施保证对总好氧菌数进行有效的控制及监控。
应建立适当的警戒限及行动限以便及时发现不良趋势。
一般情况下,纠偏限度为好氧菌总数<100CFU/ml(欧洲药典2.6.12节),采用过滤法,用琼脂培养基培养。
采样量根据预计的结果来定。
欧洲药典还规定:纯化水储存及分配系统的设计应能防止微生物生长和免遭其它污染物污染。
此外,对于总有机碳的检测,最好采用在线仪器,以为≤0.5mg/L (≤500 ppb碳)限度;条件不允许时,可以用可氧化物质的检测在代替,即在100毫升水样中加及稀硫酸R10毫升和0.02M的高锰酸钾0.1毫升,加热5分钟,溶液始终保持弱粉红色。
应按照药典中描述的温度补偿方法对电导率进行离线或者可能的话在线检测。
如下表所示,在相应温度下对应的电导率值不应超过表中的数值。
不在表中的所例温度值的温度对应电导率值,应在表中相邻两温度对应电导率值之间。
制药企业可以根据内部源流程进行规定当水质检测结果超过警戒限及行动限时应采取的措施。
如,电导率超过行动限,则启动第二级取样及检测(同药典要求),生成偏差报告,必要时物料报废。
表 3.3 水的电导率温度范围(℃)温度(℃)电导率限度(μS/cm)<0 至5<00.6<5 至10<50.8<10 至15<100.9<15 至20<15 1.0<20 至25<20 1.1<25 至30<25 1.3<30 至35<30 1.4<35 至40<35 1.5<40 至45<40 1.7<45 至50<45 1.8<50 至55<50 1.9<55 至60<55 2.1<60 至65<60 2.2<65 至70<65 2.4<70 至75<70 2.5<75 至80<75 2.7<80 至85<80 2.7<85 至90<85 2.7<90 至95<90 2.7<95 至100<95 2.9<100 至105<100 3.1(3)注射用水注射用水(WFI)至少由饮用水制备。
