体外诊断试剂经营企业筹建申请表9页word
武汉体外诊断试剂项目申请报告模板

武汉体外诊断试剂项目申请报告模板
一、项目背景
武汉市体外诊断试剂(IVD)市场潜力极大,近年来,IVD行业发展快速,受到众多的企业和投资机构的关注。
由于体外诊断市场规模大,科学技术水平不断提高,体外诊断试剂项目的申请越来越受到重视与认可。
二、申请目的
申请的目的是在武汉市开设体外诊断试剂项目,发展体外诊断产品,为市民提供安全、可靠、快速的体外诊断服务,推动武汉市IVD行业健康发展。
三、项目规划
1、项目概况
本项目拟在武汉市建立体外诊断试剂研发、生产及临床应用技术服务平台,包括试剂制备技术、诊断试剂生产技术、体外诊断试剂检测技术、诊断技术支持等内容。
2、项目建设内容
(1)试剂制备技术:主要是以蛋白质、抗原抗体、核酸或由各种蛋白质、抗原、抗体、核酸等共价键合而成的抗原和抗体组合,以及生物标志物和毒理学技术等制备技术。
(2)生产技术:主要是微生物培养、分子生物学技术、生物技术工艺、生物材料技术、生物芯片技术等。
(3)体外诊断试剂检测技术:主要是抗原抗体检测技术、免疫技术、荧光技术、放射性技术等。
(4)技术支持:主要是向客户提供关于诊断试剂的理论、临床。
体外诊断试剂(批发)《药品经营许可证》申报材料指南

体外诊断试剂(批发)《药品经营许可证》申报材料指南第一篇:体外诊断试剂(批发)《药品经营许可证》申报材料指南体外诊断试剂(批发)《药品经营许可证》申报材料指南一、筹建1、筹建申请书;1.1关于申请体外诊断试剂(专营)筹建的请示应写成公文格式1.2申请书内容应包括依据的相应法规文件、拟建公司法人、经营范围等2.填写《体外诊断试剂(批发)企业筹建申请表》2.1拟配置设施设备从经营场所配置、恒温仓库配置和冷库配置等方面分别写3、拟办企业法定代表人、企业负责人、质量管理负责人的身份证、学历证明原件、职称证复印件及个人简历;3.1个人简历应包括专业、学历、曾经任职公司、职务等项3.2个人简历应从参加工作时开始写起,时间连续3.3个人简历中的专业应与毕业证中的专业一致3.4企业法定代表人、企业负责人应为大专以上学历;质量管理负责人应为药学相关专业、大专以上学历或具有中级以上的技术职称4、执业药师执业证书、身份证、毕业证、职称证复印件及个人简历; 4.1执业药师个人简历参考2.1、2.2、2.3中的要求5、主管检验师证书、身份证、毕业证、职称证复印件及人个简历;5.1主管检验师个人简历参考2.1、2.2、2.3中的要求6、拟经营产品的范围;6.1 拟经营产品范围为体外诊断试剂(专营)7、拟设营业场所街区图、仓库街区图、平面布置图(注明面积)、设备、仓储设施及周边卫生环境等情况;7.1对拟设的营业场所街区图、仓库街区图、平面布置图(注明面积)、设备、仓储设施及周边卫生环境等进行文字性的说明,要求经营场所和仓库非住宅、非地下室8、具有专用计算机管理信息系统的规划书,能覆盖企业内体外诊断试剂等产品的购进、储存、销售以及经营和质量控制的全过程、全面记录企业经营管理及实施《药品经营质量管理规范》方面的信息,对质量情况能够进行及时准确的记录,并有可以实现接受当地药品监督管理部门监管的条件;8.1规划书要求详细叙述关于首营产品以及产品的购进、储存、销售等内容9、法律法规、规章和规范性文件规定的其它材料;10、申请材料真实性的自我保证声明,并对所提交材料做出如有虚假承担法律责任的承诺;11、申办人身份证复印件,申办人不是法定代表人的,还应提交法定代表人授权书。
药品经营企业筹建申请表格

企业名称
注册地址
经营性质
个体经营
经营方式
零售
注册资金
10万元
仓库地址
无此项
经营范围
中成药、化学药制剂、抗生素、生物制剂等
法定代表人
职务
技术职称
企业负责人职务企业ຫໍສະໝຸດ 责人技术职称质量负责人
职务
质量负责人
技术职称
驻店药师
质量管理部门负责人
从事药品经营管理工作年限
技术职称
驻店药师
人
员
情
况
职工总数
从事质量管理、验收、养护人员总数
药学技术人员
执业药师
主管药师
药师
其他
主要设施设备
货架、柜台、空调、计算机、温湿度计等
营业场所及辅助办公用房
营业厅
辅助用房面积
办公用房面积
备注
拟法定代表人签字:
联系电话:
年月日
被委托人签字:
年月日
企业编码:核对码:
药品经营企业筹建申请表

药品经营企业筹建申请表
拟办企业名称:
隶属部门(盖章):
企业法定代表人(签章):
企业负责人(签章):____________联系人及联系电话:
填报日期:年月日
德阳市食品药品监督管理局制
填表说明
1、申请企业将本表报拟申办企业所在县(市、区)食品药监局审查后报德阳市食品药品监督管理局。
2、各申请企业必须按照要求填表,并对所填内容的真实性负责。
3、所填从业人员应为在岗人员。
4、申请表内容填写应准确、完整,不得涂改。
5、本表所列各项内容填写不下时均可另附页。
6、申请表应统一使用A4纸打印,标明页码。
第二类医疗器械注册(含体外诊断试剂)申请表

第二类医疗器械注册申请表产品名称:申请人(企业名称):分类编码:结构特征:□有源□无源□体外诊断试剂□临床检验设备注册形式:□首次注册□许可事项变更□延续注册□登记事项变更山西省药品监督管理局填表说明1.按照《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》及相关文件的规定报送资料。
2.本申请表应打印。
填写内容应完整、清楚、整洁,不得涂改。
3.“申请人名称”、“住所”应与工商营业执照相同。
4.申报产品名称、规格型号应与所提交的产品技术要求、检测报告等申报材料中所用名称、规格型号一致。
5.如申报材料中有需要特别加以说明的问题,请在本表“其它需要说明的问题”栏中说明6.请在“注册申请应附资料及顺序”栏对应项目左侧方框内划“√”。
如根据有关规定,某项材料不需提交,请在该项目左侧的方框内划“#”,并在本表“其它需要说明的问题”栏中写明理由。
7.申请人基本信息中法定代表人、负责人、联系人的联系方式(手机、座机)以及电子邮箱等联络信息用于注册过程中体系考核、补充材料、专家评审会告知等联络,务必填写准确清晰,确保通讯畅通。
8.申请表应有法定代表人或负责人签字并加盖企业公章。
9.延续注册时,如有注册证变更文件,本申请表中对应内容应填写信息变更后信息。
填表前,请详细阅读填表说明首次注册适用:填表前,请详细阅读填表说明延续注册适用:填表前,请详细阅读填表说明登记事项变更适用:填表前,请详细阅读填表说明许可事项变更适用:1医疗器械许可事项变更适用:2体外诊断试剂注册申请应附材料及顺序注:请在对应项目左侧方框内划√。
如根据有关规定,某项材料不需提交,请在该项目左侧的方框内划#,并在本表“其它需要说明的问题”栏中写明理由。
体外诊断试剂注册申报资料模板-辅助原材料的研究资料

体外诊断试剂注册申报资料模板-辅助原
材料的研究资料
以下是体外诊断试剂注册申报所需的辅助原材料的研究资料模板:
1. 辅助原材料的基本信息
- 原材料名称:
- 原材料供应商:
- 供应商联系方式:
2. 原材料的生产工艺
请提供辅助原材料的生产工艺描述,包括原材料的制备过程和关键步骤。
3. 原材料的质量控制
请提供辅助原材料的质量控制方法和标准,包括但不限于以下内容:
- 物理性质测试方法(如颜色、溶解性等);
- 化学性质测试方法(如酸碱度、纯度等);
- 微生物污染检测方法。
4. 与辅助原材料相关的安全性评估
请提供辅助原材料安全性评估报告,包括但不限于以下内容:- 对人体的毒性研究结果;
- 对环境的影响评估结果;
- 储存和运输的安全指导。
5. 原材料在体外诊断试剂中的作用
请提供关于辅助原材料在体外诊断试剂中的作用的研究资料,包括但不限于以下内容:
- 原材料的功能和作用机制;
- 原材料在试剂中的适用范围和使用条件。
以上是体外诊断试剂注册申报所需的辅助原材料的研究资料模板,供参考使用。
根据具体情况,您可以根据需要添加或修改相关内容。
体外诊断试剂经营企业开办

体外诊断试剂经营企业开办申请程序一、项目名称:体外诊断试剂类经营(企业)许可二、设定和实施许可的法律依据:(一)《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》(二)《药品经营许可证管理办法》(局令第6号)三、收费:不收费四、申请程序:(一)筹建:1、申办人向省局提出筹建申请并提交以下材料,一式两份:(1)拟办企业的筹建申请(简要说明公司机构人员、设施设备、制度管理等方面的基本筹建情况)(2)已有《医疗器械经营企业许可证》的须提供《医疗器械经营企业许可证》正副本和公司法人《营业执照》原件及复印件;(3)拟办企业法定代表人、企业负责人、质量负责人身份证、学历证明原件及复印印件和个人简历;(4)执业药师身份证和资格证书原件、复印件;(5)主管检验师身份证和资格证书原件、复印件;(曾在外单位工作的须提供离职证明)(6)拟经营产品的范围;(提供的内容包括:授权单位、经营产品类别及品名、生产企业许可证号、产品注册证号)(7)拟设营业场所、设备、仓储设施及周边卫生环境等情况。
(8)拟办企业法定代表人和企业负责人、质量负责人无《药品管理法》第76条、第83条规定情形的自我保证声明及企业所在地市药品监督管理部门的考核证明材料。
2、药品监督管理部门对申办人提出的申请,应当根据下列情况分别做出处理:(1)申请事项不属于本部门职权范围的,应当即时做出不予受理的决定,发给《不予受理通知书》,并告知申办人向有关(食品)药品监督管理部门申请;(2)申请材料存在可以当场更正错误的,应当允许申办人当场更正;(3)申请材料不齐或者不符合法定形式的,应当当场或者在5个工作日内发给申办人《补正材料通知书》,一次性告知需要补正的全部内容。
逾期不告知的,自收到申请材料之日起即为受理;(4)申请事项属于本部门职权范围,材料齐全、符合法定形式,或者申办人按要求提交全部补正材料的,发给申办人《受理通知书》。
《受理通知书》中注明的日期为受理日期。
福建省体外诊断试剂经营企业(批发)开办申请程序

福建省食品药品监督管理局体外诊断试剂经营企业(批发)开办申请程序开办体外诊断试剂经营企业(批发)按照以下程序办理《药品经营许可证》、《医疗器械经营企业许可证》:1234567上场所如无详细地址、无具体门牌号码或因地名变更致使现地址名称与房产证不一致的,应提供经当地地名管理机构(民政局地名办公室)确认的详细地址;地名管理机构确认的地址仍不够详细的,应提供以上场所所在位置平面示意图。
(二)设区市食品药品监督管理局药品市场监督管理科(处)对申请人提出的申请,应当根据下列情况分别做出处理:1.申请事项不属于本部门职权范围的,应当及时做出不予受理的决定,发给《不予受理通知书》,并告知申请人向有关部门申请;2.申请材料存在可以当场更正错误的,应当允许申请人当场更正;3.申请材料不齐或者不符合法定形式的,应当当场或者在5个工作日内发给申请人《补正材料通知书》,一次性告知需要补正的全部内容。
逾期不告知的,自4.起15(以6市食品药品监督管理局药品市场监督管理科(处),由设区市食品药品监督管理局药品市场监督管理科(处)通知申请人。
(四)申请人完成筹建后,向受理申请的设区市食品药品监督管理局医疗器械科(处)提出验收申请,并提交以下材料:1.体外诊断试剂经营企业(批发)申请审查表;(附表5);2、福建省食品药品监督管理局筹建体外诊断试剂经营企业(批发)许可决定书原件;3、工商行政管理部门出具的拟办企业名称核准证明文件;4、注册场所、仓库等所用房屋合法使用证明(房产证、租赁合同等)复印件,注册地址、仓库地址的地理位置图、平面图(注明面积)。
如果以上场所地56/789(五)设区市食品药品监督管理局医疗器械科(处)对申请人提出的申请,应当根据下列情况分别做出处理:1.申请事项不属于本部门职权范围的,应当及时做出不予受理的决定,发给《不予受理通知书》,并告知申请人向有关食品药品监督管理部门申请;2.申请材料存在可以当场更正错误的,应当允许申办人当场更正;3.申请材料不齐或者不符合法定形式的,应当当场或者在5个工作日内发给申办人《补正材料通知书》,一次性告知需要补正的全部内容。
药品经营企业筹建申请表
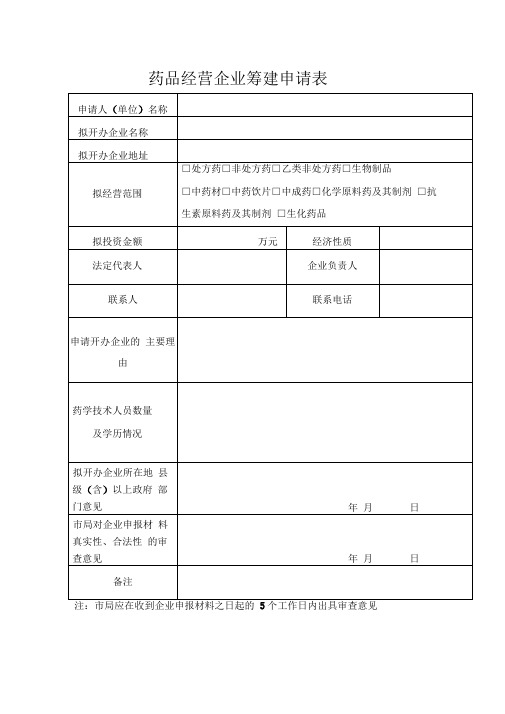
药品经营企业筹建申请表注:市局应在收到企业申报材料之日起的5个工作日内出具审查意见受理编号:药品经营企业验收申请表拟办企业名称:报日期:理日期:填报说明1 、申办人完成企业筹建后,填写封面和表格,报受理的药品监督管理部门(机构)2、内容填写应准确、完整,不得涂改;3、申请表以及其他申报材料,复印,标应统一使用A4 纸打印或明目录、页码并装订成册。
企业名称注册地址经营方式仓库地址经营范围法定代表人负责人质量负责人质量管理部门负责人联系人职工总数业基本情况□批发□零售□零售连锁经济性质□处方药□非处方药□生物制品□中药材□化学原料药及其制剂□生化药品从事质量管理、验收、养护人员总数□乙类非处方药□中药饮片□中成药□抗生素原料药及其制剂执业药师执业药师从事药品经营管理工作年限电话手机□是□否□是□否执业主任副主任主管药药从业药师药师药师药师师士药师药学技术人员数□显微镜□其他:服务器中央数据处理系统情况GSP认证申报资料初审表申请认证企业审查项目审查结果一、药品经营质量管理规范认证申请表二、药品经营许可证和营业执照复印件三、实施GSP自查报告四、企业负责人员和质量管理人员情况表五、企业验收、养护人员情况表六、企业经营场所、仓储等设施设备情况表七、企业所属药品经营单位情况表八、企业药品经营质量管理制度目录九、企业管理组织、机构设置与职能框图十、企业经营场所和仓库平面布局图审查人签字:年月日注:本表由初审部门根据审查结果填写。
“审查结果”栏根据实际情况填写“合格”或“合理缺项”字样。
近一年内有无违规经营或经销假劣有(填下栏),无药品问题省辖市药品监督管理局初审情况违规经营或经销假劣药品问题以及审查结果的说明市局主管领导(签字)受理编号: (公章)初审意见药品经营质量管理规范认证申请表安徽省药品监督管理局印制日日(公章)1、2、3、填表说明认证申请表应使用原件,用钢笔填写,内容应准确、完整,不得涂改和复印。
药品经营企业筹建申请表
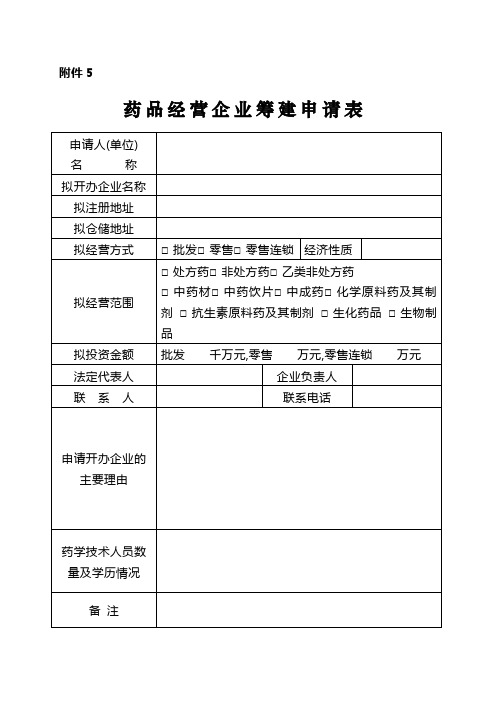
药品经营企业筹建申请表药品经营企业验收申请表拟办企业名称:申请人:填报日期:年月日受理部门:受理日期:年月日填报说明1、申办人完成企业筹建后,填写封面和表格,报受理的药品监督管理部门(机构);2、内容填写应准确、完整,不得涂改;3、申请表以及其他申报材料,应统一使用A4纸打印或复印,标明目录、页码并装订成册。
企业基本情况附件7企业负责人员、质量管理人员和验收养护人员情况表填报单位或个人: 填表日期: 年月日注: 本表应填写企业法定代表人、企业负责人、分管质量负责人、质量管理部门负责人、质量管理人员、验收养护人员情况,填写本表时,应将执业药师证明或专业技术职称证书的复印件附后。
附件8药品经营企业验收审查表筹建企业名称:申请人:填报日期:年月日审查部门:审查日期:年月日药品经营许可证现场验收纪律现场验收记录审批意见附件9药品经营企业验收整改通知书:根据你(单位)向我局提出的开办药品经营企业(□批发□零售□零售连锁)验收申请,按照□国家食品药品监督管理局《开办药品批发企业验收实施标准(试行)》河南省食品药品监督管理局□《开办药品零售连锁企业验收实施标准(试行)》、□《开办药品零售企业验收实施标准(试行)》组织验收,判定以下项目不符合标准,你(单位)需在________年________月________日内完成整改,并向我局申请复验,我局将对整改情况再行验收,逾期未提出复验申请的视为自动放弃。
()药品监督管理局年月日附件10药品经营许可证变更申请表填表单位:______________________________(盖章)填表日期:年月日填表说明一、《药品经营许可证》变更申请表一律用钢笔填写或打印,字迹工整、清晰;二、“企业名称、经济性质、法定代表人、企业负责人、质量负责人、注册地址、仓库地址、隶属单位、经营范围”等栏目应填写变更前内容;三、“申请变更事项”一栏填写拟变更的事项(不变更的不填);四、变更所附材料名称分别按照要求填写,缺一不可;五、本表填写一式三份;六、变更所附材料均采用A4纸打印或复印。
体外诊断试剂项目立项申请报告

体外诊断试剂项目立项申请报告Title: Project Proposal for the Development of In-vitro Diagnostic ReagentsIntroduction:Objectives:1. Develop a new set of in-vitro diagnostic reagents that can accurately detect a wide range of diseases.2. Improve the sensitivity and specificity of disease diagnosis using these reagents.3. Ensure cost-effectiveness, allowing for broader access to diagnostic services.5. Conduct rigorous clinical studies to validate the effectiveness and reliability of the reagents.6. Establish collaborations with healthcare providers, laboratories, and relevant regulatory agencies.Scope of Work:1. Research and Development: Conduct extensive research on the existing diagnostic reagents and identify key areas for improvement. Develop a prototype set of diagnostic reagents with improved accuracy and broader disease detection capability.2. Manufacturing and Quality Control: Establish a production line for manufacturing the diagnostic reagents. Implementquality control measures to ensure consistency and reliability across batches.3. Clinical Studies: Collaborate with healthcare providers to conduct clinical studies to validate the effectiveness and reliability of the diagnostic reagents. Monitor and analyze the performance of the reagents in real-world scenarios.5. Distribution and Market Penetration: Develop a strategy to distribute the diagnostic reagents to healthcare providers, laboratories, and other potential users. Collaborate with distributors for efficient and widespread market penetration.6. Capacity Building: Promote capacity building among healthcare providers and laboratory staff on the proper use and interpretation of the diagnostic reagents. Conduct training workshops and educational programs to enhance capabilities in disease diagnosis.Budget Estimation:Timeline:1. Research and Development: 6 months2. Manufacturing and Quality Control: 3 months3. Clinical Studies: 12 months5. Distribution and Market Penetration: Ongoing6. Capacity Building: OngoingConclusion:。
体外诊断试剂临床试验申请表

体外诊断试剂临床试验申请表
申请单位信息:
申请单位名称:
电子邮件:
通信地址:
申请试验试剂信息:
试剂名称:
试剂生产商:
试剂批号:
试剂规格:
使用目的:
试剂特性:
申请试验地点:
试验时间:
试验人数:
申请试验目的与原因:
(请详细描述为什么需要开展此试验,试验的科学性、创新性和重要性)
试验内容与方法:
(请详细描述试验的具体内容和方法,包括试验的设计、分组、采样
和分析方法等)
试验安全与伦理:
(请说明试验过程中对被试对象的安全保障措施,遵循的道德伦理准则,如获得伦理委员会批准的情况)
试验预期结果及数据分析:
(请详细描述试验的预期结果以及数据的收集、统计和分析方法)
申请试验所需的人员和设备:
(请说明进行试验所需的专业人员、实验技术人员及相关设备)
试验计划执行时间及流程:
(请详细描述试验的计划执行时间表和流程)
其他申请补充材料:
(可附加其他需要提交的材料,如试剂说明书、申请单位资质证明等)本申请材料属实,申请人同意依据相关法律、法规和伦理准则,承担
因试验过程中可能出现的责任和风险。
申请单位签名:
日期:
审批意见:
审批单位:
审批人姓名:
日期:
注意事项:
1.本申请表为示范模板,请根据实际情况填写;
2.申请试验应遵循国家相关法律法规和伦理准则,严格按照规定程序提交材料;
3.申请试验前应充分考虑试验的科学性、安全性和伦理道德问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
受理编号:体外诊断试剂经营企业(批发)
筹建申请审查表
拟经营企业名称:
申请人:
填报日期:年月日
受理部门:新疆维吾尔自治区食品药品监督管理局
受理日期:年月日
新疆维吾尔自治区食品药品监督管理局制
填报说明
一、申办人填写封面和表1、表2、表3报受理审查的食品药品监督管理部门。
二、其他申报材料或者证明文件随本表一并报送,主要包括:
(一)由当地地、州、市级食品药品监督管理部门出具的拟经营体外诊断试剂企业、企业法定代表人、企业负责人、质量管理人员(分别担任质量负责人和质量管理机构负责人的主管检验师或其他符合担任质量负责人条件的人员和执业药师)无《药品管理法》第76条、83条和《医疗器械监督条例》第40条规定情形的证明。
(二)拟经营体外诊断试剂企业法定代表人、企业负责人、质量管理人员身份证复印件、学历(职称)证明原件、复印件及个人简历。
相关人员的简历应包括下列基本内容:姓名、性别、族别、出生年月、所学专业、学历、职称、主要工作经历(包括自参加工作以来至现在的工作经历,按
照自何年何月至何年何月在何单位任何职的方式详细填写)、受教育情况(指接受大中专教育、有关法律法规及其他相关专业技术培训等)。
(三)执业药师资格证书复印件;原在其他单位从业的,须由原单位出具调离或者停职的证明原件。
(四)主管检验师证书复印件;原在其他单位从业的,须由原单位出具调离或者停职的证明原件。
(五)拟设办公营业、仓储场所及周边卫生环境等情况。
主要包括:拟设办公营业场所、仓储场所地理位置图(注明方位)、平面布置图(注明面积和具体的功能场所划分情况);拟设办公营业、仓储场所房屋设计用途和周边卫生环境情况的说明。
(六)拟建经营质量管理计算机信息系统(网络版)的实施方案。
主要包括:拟使用的计算机质量管理软件系统,软件系统的主要功能(对体外诊断试剂采购、入库验收、在库养护、出库复核、销售、不良反应监测与管理等环节实施质量控制的过程)。
(七)经营质量管理制度的目录。
(八)人员培训计划和实施方案。
(九)已取得《医疗器械经营企业许可证》或者《营业执照》的企业,拟增加体外诊断试剂的经营范围,应提交相应证照正副本的原件和复印件(查验原件,留存复印件)。
(十)药品、医疗器械经营许可证管理系统企业端“企业筹建申请”(U盘)。
三、申请企业应按照要求填表,内容应准确、完整,并使用钢笔(碳素笔)填写,不得涂改。
四、申请企业人员花名册应将企业所有员工按照拟定的职务和岗位的配置填写。
五、企业申请日期应填写向食品药品监督管理部门报送的日期。
六、本表及所附申报材料、证明文件均应加盖企业公章或者由拟办企业申请人签字并附手印,复印件还应标注“与原件相符”。
七、申请书及其他申报资料,应统一使用A4纸,标明目录、页码并按顺序装订成册。
八、办理人员身份证原件。
非法定代表人(申请人)前来办理,应由拟经营体外诊断试剂企业法定代表人亲自提交由企业加盖公章或者法定代表人(申请人)签发并注明授权事项的《授权委托书》原件。
表1
拟经营体外诊断试剂企业基本情况
表2
拟经营体外诊断试剂企业人员花名册
表3
表4
希望以上资料对你有所帮助,附励志名3条:
1、积金遗于子孙,子孙未必能守;积书于子孙,子孙未必能读。
不如积阴德于冥冥之中,此乃万世传家之宝训也。
2、积德为产业,强胜于美宅良田。
3、能付出爱心就是福,能消除烦恼就是慧。
