实验一_极化曲线测定
极化曲线的测定讲解

二 极化曲线的的测定的原理
2. 极化曲线的测定 (1) 恒电位法 恒电位法就是将研究电极依次恒定在不同的数值 上,然后测量对应于各电位下的电流。极化曲线 的测量应尽可能接近体系稳态。稳态体系指被研 究体系的极化电流、电极电势、电极表面状态等 基本上不随时间而改变。在实际测量中,常用的 控制电位测量方法有以下两种:
物理化学实验
实验一 极化曲线的测定
指导教师: 单 云
2019/6/9
2019/6/9
一 、极化曲线的的测定目的要求
【目的要求】 1.掌握稳态恒电位法测定金属极化曲线的基本 原理和测试方法。 2.了解极化曲线的意义和应用。 3.掌握恒电位仪的使用方法。
2019/6/9
二 极化曲线的的测定的原理
或人为自行规定每次电流恒定的时间。
2019/6/9
三、 仪器试剂
【仪器试剂】 恒电位仪一台;饱和甘汞电极1支;碳钢电极1 支;铂电极1支;三室电解槽1只。 2 mol·dm-3 (NH4)2CO3溶液;丙酮溶液
2019/6/9
三 仪器试剂
2019/6/9
图2-19-2三室电解槽 1.研究电极; 2.参比电极; 3.辅助电极
电流密度随电势增加迅速减至最小,这是因为在 金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B点对应的电势称为临界钝化电势,对应的电流
பைடு நூலகம்称为临界钝化电流。
2019/6/9
二 极化曲线的的测定的原理
电势到达C点以后,随着电势的继续增加, 电流却保持在一个基本不变的很小的数值上, 该电流称为维钝电流,直到电势升到D点, 电流才有随着电势的上升而增大,表示阳极 又发生了氧化过程,可能是高价金属离子产 生也可能是水分子放电析出氧气,DE段称为 过钝化区。
极化曲线测定实验报告

极化曲线测定实验报告实验目的:1. 了解极化现象的基本原理;2. 学会使用电位-电流(极化)曲线进行电极的极化特性测定;3. 掌握不同电位下的极化电流的测定方法;4. 确定电极极化的过电位。
实验仪器:1. 极化曲线测定装置2. 电源3. 电位计4. 电流计5. 电阻箱6. 试样电极实验原理:当一个电化学电池在工作时,如果将工作电极的电位进行变化,会引起极化现象。
极化现象产生的原因是工作电极上电子转移反应的速率受到了限制,从而导致了整个反应速率的下降。
极化曲线实验可以通过测量电流与电位之间的关系,来推断电化学电池的反应机理和动力学参数。
实验步骤:1. 将试样电极插入极化曲线测定装置中的电极槽中;2. 连接电源、电位计、电流计和电阻箱,组成电路;3. 打开电源,调整电压,并记录不同电位下的电流值;4. 根据测得的数据绘制极化曲线。
实验结果及讨论:根据实验测得的数据,我们可以绘制出试样电极在不同电位下的极化曲线。
通常极化曲线图呈现出一个曲线,在某一电位附近极化电流达到峰值,然后随着电位的进一步增加而逐渐减小。
这个峰值电位即为电极的极化过电位。
通过极化曲线,我们可以得到一些有关试样电极的信息。
例如,当电位接近峰值电位时,电极上的电子转移反应受到限制,电极表面可能会形成一层非电活性的物质膜。
此时,电极上的电流主要通过扩散过程来传递。
当电位进一步增加时,电子转移反应的限制逐渐解除,电流通过电活性物质的表面反应来转移。
根据极化曲线还可以计算电极的极化电阻、极化电流密度等参数。
实验结果的准确性受到多种因素的影响,如实验操作的精确性、试样电极的质量等。
在进行实验时应尽量控制这些因素,提高实验结果的准确性。
结论:通过极化曲线测定实验,我们可以了解电极的极化特性和极化过电位,并可以推断电极的反应机理和动力学参数。
该实验方法可以在电化学过程研究和电化学工程中提供有价值的信息。
电化学工作站测极化曲线

应用电化学实验本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。
自编实验讲义。
实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。
实验1:极化曲线的测定实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。
一、 实验目的1.掌握三电极体系装置和电化学工作站的应用。
2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。
2.测定金属电沉积的阴极极化曲线。
3.学会数据的分析和处理。
二、 实验原理研究电极过程的基本方法是测定极化曲线。
电极上电势随电流密度变化的关系曲线称为极化曲线。
极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。
在某一电流密度下极化曲线的斜率i ∆∆ϕ称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。
极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。
从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。
被控制的变量电极电位是随时间连续线性变化的。
随时间连续线性变化的电位可用线性方程表示:Vt i +=ϕϕ;其中:ϕ——扫描电位,t ——扫描时间,V ——扫描速度,i ϕ——扫描起点电位。
常以研究电极相对于参比电极的开路电位作为扫描的起点电位。
扫描电位与时间的关系如图1所示。
图1 电位与时间的关系三、实验仪器、测量线路及试剂1. 实验主要仪器:电化学工作站、计算机、H电解槽,铜丝电极(研究电极),箔片(辅助电极),饱和甘汞电极(参比电极)、Luggin毛细管。
极化曲线的测定
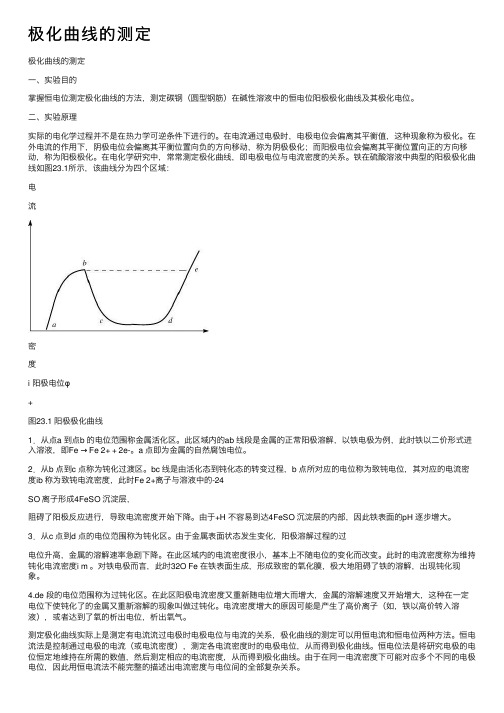
极化曲线的测定极化曲线的测定⼀、实验⽬的掌握恒电位测定极化曲线的⽅法,测定碳钢(圆型钢筋)在碱性溶液中的恒电位阳极极化曲线及其极化电位。
⼆、实验原理实际的电化学过程并不是在热⼒学可逆条件下进⾏的。
在电流通过电极时,电极电位会偏离其平衡值,这种现象称为极化。
在外电流的作⽤下,阴极电位会偏离其平衡位置向负的⽅向移动,称为阴极极化;⽽阳极电位会偏离其平衡位置向正的⽅向移动,称为阳极极化。
在电化学研究中,常常测定极化曲线,即电极电位与电流密度的关系。
铁在硫酸溶液中典型的阳极极化曲线如图23.1所⽰,该曲线分为四个区域:电流密度i 阳极电位φ+图23.1 阳极极化曲线1.从点a 到点b 的电位范围称⾦属活化区。
此区域内的ab 线段是⾦属的正常阳极溶解,以铁电极为例,此时铁以⼆价形式进⼊溶液,即Fe → Fe 2+ + 2e-。
a 点即为⾦属的⾃然腐蚀电位。
2.从b 点到c 点称为钝化过渡区。
bc 线是由活化态到钝化态的转变过程,b 点所对应的电位称为致钝电位,其对应的电流密度ib 称为致钝电流密度,此时Fe 2+离⼦与溶液中的-24SO 离⼦形成4FeSO 沉淀层,阻碍了阳极反应进⾏,导致电流密度开始下降。
由于+H 不容易到达4FeSO 沉淀层的内部,因此铁表⾯的pH 逐步增⼤。
3.从c 点到d 点的电位范围称为钝化区。
由于⾦属表⾯状态发⽣变化,阳极溶解过程的过电位升⾼,⾦属的溶解速率急剧下降。
在此区域内的电流密度很⼩,基本上不随电位的变化⽽改变。
此时的电流密度称为维持钝化电流密度i m 。
对铁电极⽽⾔,此时32O Fe 在铁表⾯⽣成,形成致密的氧化膜,极⼤地阻碍了铁的溶解,出现钝化现象。
4.de 段的电位范围称为过钝化区。
在此区阳极电流密度⼜重新随电位增⼤⽽增⼤,⾦属的溶解速度⼜开始增⼤,这种在⼀定电位下使钝化了的⾦属⼜重新溶解的现象叫做过钝化。
电流密度增⼤的原因可能是产⽣了⾼价离⼦(如,铁以⾼价转⼊溶液),或者达到了氧的析出电位,析出氧⽓。
极化曲线的测定
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
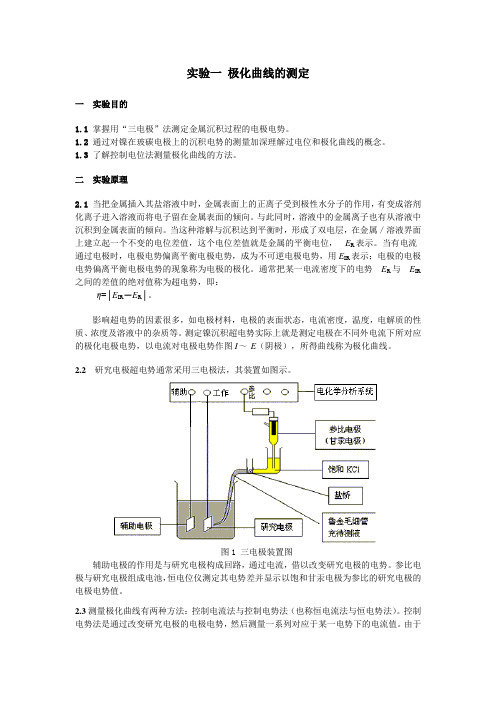
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。
金属腐蚀与防护实验指导书

金属腐蚀与防护实验指导书课程编号:03030101适用专业:金属材料工程专业课程类别:专业教育课程郝小军徐宏妍编实验一 金属极化曲线测试一、目的要求1、掌握恒电位法测定阳极极化曲线的原理和方法。
2、绘制并比较一般金属(镁合金)和有钝化性能(铝合金、不锈钢)的金属的阳极极化曲线的异同,初步掌握有钝化性能的金属在腐蚀体系中的临界孔蚀电位的测定方法。
3、通过阳极极化曲线的测定,判定实施阳极保护的可能性,初步选取阳极保护的技术参数,了解击穿电位和保护电位的意义。
4、掌握恒电位仪的使用方法,了解恒电位技术在腐蚀研究中的重要作用。
二、基本原理阳极电位和电流的关系曲线叫做阳极极化曲线。
为了判定金属在电解质溶液中采取阳极保护的可能性,选择阳极保护的三个主要技术参数——致钝电流密度、维钝电流密度和钝化区的电位范围,需要测定阳极极化曲线。
阳极极化曲线可以用恒电位法和恒电流法测定。
图1是一条较典型的阳极极化曲线。
一般金属(镁合金)的阳极极化曲线为ax 曲线。
对有钝化性能的金属(铝合金、不锈钢),曲线abcdef 是恒电位法(即维持电位恒定,测定相应的电流值)测得的阳极极化曲线。
当电位从a 逐渐向正移动到到b 点时,电流也随之增加到b 点,当电位过b 点以后,电流反而急剧减小,这是因为在金属表面上生成了一层高电阻耐腐蚀的钝化膜,钝化开始发生。
人为控制电位的增高,电流逐渐衰减到c 。
在c 点之后,电位若继续增高,由于金属完全进入了钝态,电流维持在一个基本不变的很小的值——维钝电流。
当使电位增高到d 点以后,金属进入了过钝化状态,电流又重新增大。
从a 点到b 点的范围叫活性溶解区,从b 点到c 点叫钝化过渡区,从c 点到d 点叫钝化稳定区,过d 点以后叫过钝化区。
对应于b 点的电流密度叫致钝电流密度,对应于cd 段的电流密度叫维钝电流密度。
若把金属作为阳极,通以致钝电流使之钝化,再用维钝电流去保护其表面的钠化膜,可使金属的腐蚀速度大大降低,这就是阳极保护的原理。
极化曲线的测定与分析

极化曲线的测定与分析极化曲线是指在电化学反应中,电极电势随着电流密度的变化而发生的变化规律,是研究电极反应动力学和电化学测量的基础。
极化曲线的测定和分析是电化学实验中的一项重要内容。
测定方法1. 构建电化学池:将工作电极和参比电极用电极线连接起来,并将它们放置在电解液中,形成电化学池。
2. 测量参比电极的电位:使用电位计对参比电极进行电位测量,并将参比电极作为电位的基准来测量工作电极的电势差。
3. 测量工作电极的电势差:在电极上施加一个小的电压,然后通过电位计测量电极上的电势差,以确定电势差和电流密度之间的关系。
在测量中应尽量控制电极的电流密度,因为过大的电流密度会使电极受到极化和电化学反应速率增加,导致实验结果出现误差。
4. 计算电极反应的动力学参数:在测定的极化曲线中,可以根据电极电势的变化来计算电极反应的动力学参数,如电极动力学参数、反应速率常数等。
这些参数对于优化电化学反应条件、设计电化学反应器和研究电化学反应机理都有重要的实际应用。
分析方法1. 极化曲线分析法:将极化曲线按照电势和电流密度的变化趋势进行分析,可判断电极反应的状态,包括电极未极化状态、极化状态和过极化状态。
在极化状态下,电极电势始终低于理论电势,电极表面存在大量的无法逆反应的电荷,电极反应速率与电流密度成非线性关系。
2. 填充曲线分析法:在填充曲线中,电极电位随着电流密度的增加而上升,然后在某一电流密度上达到峰值,再随着电流密度的增加而下降。
通过分析填充曲线,可以确定电极反应的动力学参数,如电极氧化还原反应的标准电位、反应速率常数、传递系数等。
3. 动力学分析法:动力学分析法是通过测量电极电势与时间的变化来研究电极反应的速率和机制。
在实验中,通过改变反应物浓度、电极的表面积和温度等条件,探究电极反应速率的变化规律,确定电极反应的反应级数、反应速率常数和反应机理等。
金属腐蚀与防护实验指导书

共享知识分享快乐金属腐蚀与防护实验指导书课程编号:03030101适用专业:金属材料工程专业课程类别:专业教育课程郝小军徐宏妍编共享知识 分享快乐实验一金属极化曲线测试、目的要求1、 掌握恒电位法测定阳极极化曲线的原理和方法。
2、 绘制并比较一般金属(镁合金)和有钝化性能(铝合金、不锈钢)的金属的阳极极 化曲线的异同,初步掌握有钝化性能的金属在腐蚀体系中的临界孔蚀电位的测定方法。
3、 通过阳极极化曲线的测定,判定实施阳极保护的可能性,初步选取阳极保护的技术 参数,了解击穿电位和保护电位的意义。
4、 掌握恒电位仪的使用方法,了解恒电位技术在腐蚀研究中的重要作用。
二、基本原理阳极电位和电流的关系曲线叫做阳极极化曲线。
保护的可能性,选择阳极保护的三个主要技术参数 区的电位范围,需要测定阳极极化曲线。
阳极极化曲线可以用恒电位法和恒电流法测定。
般金属(镁合金)的阳极极化曲线为 ax 曲线。
对有钝化性能的金属(铝合金、不锈钢),曲线abcdef 是恒电位法(即维持电位恒定, 测定 相应的电流值)测得的阳极极化曲线。
当电位 从a 逐渐向正移动到到 b 点时,电流也随之增 加到b 点,当电位过b 点以后,电流反而急剧 减小,这是因为在金属表面上生成了一层高电 阻耐腐蚀的钝化膜,钝化开始发生。
人为控制 电位的增高,电流逐渐衰减到c 。
在c 点之后, 电位若继续增高,由于金属完全进入了钝态, 电流维持在一个基本不变的很小的值 ——维钝电流。
当使电位增高到 d 点以后,金属进入 了过钝化状态,电流又重新增大。
从a 点到b点的范围叫活性溶解区,从 b 点到c 点叫钝化 过渡区,从c 点到d 点叫钝化稳定区,过 d 点 以后叫过钝化区。
对应于b 点的电流密度叫致 钝电流密度,对应于 cd 段的电流密度叫维钝 电流密度。
使金属的腐蚀速度大大降低,这就是阳极保护的原理。
用恒电流法测不出上述曲线的 bcde 段。
在金属受到阳极极化时其表面发生了复杂的变 化,电极电位成为电流密度的多值函数, 因此当电流增加到 b 点时,电位即由b 点跃增到很正的e 点,金届进入了过钝化状态,反映不出金属进入钝化区的情况。
电化学工作站测极化曲线

应用电化学实验本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。
自编实验讲义。
实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。
实验1:极化曲线的测定实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。
一、 实验目的1.掌握三电极体系装置和电化学工作站的应用。
2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。
2.测定金属电沉积的阴极极化曲线。
3.学会数据的分析和处理。
二、 实验原理研究电极过程的基本方法是测定极化曲线。
电极上电势随电流密度变化的关系曲线称为极化曲线。
极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。
在某一电流密度下极化曲线的斜率i ∆∆ϕ称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。
极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。
从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。
被控制的变量电极电位是随时间连续线性变化的。
随时间连续线性变化的电位可用线性方程表示:Vt i +=ϕϕ;其中:ϕ——扫描电位,t ——扫描时间,V ——扫描速度,i ϕ——扫描起点电位。
常以研究电极相对于参比电极的开路电位作为扫描的起点电位。
扫描电位与时间的关系如图1所示。
图1 电位与时间的关系三、实验仪器、测量线路及试剂1. 实验主要仪器:电化学工作站、计算机、H电解槽,铜丝电极(研究电极),箔片(辅助电极),饱和甘汞电极(参比电极)、Luggin毛细管。
实验一:恒电位法测定阳极极化曲线

实验一:恒电位法测定阳极极化曲线一.实验目的1. 熟悉恒电位仪测定极化曲线的方法;2. 了解金属钝化现象及活化钝化转变过程二.基本原理极化曲线测量是金属电化学腐蚀和保护中一种重要的研究手段。
测量腐蚀体系的极化曲线,实际就是测量在外加电流作用下,金属在腐蚀介质中的电极电位与外加电流密度之间的关系。
某些金属在特定介质中存在钝化现象,表面生成一层具有保护作用的钝化膜,其阳极极化曲线如图所示:图1-1. 具有活化钝化转变的阳极极化曲线图中Ⅰ区为活化区,Ⅱ区为钝化过渡区,Ⅲ区为钝化区,此时金属表面生成一层具有保护性的钝化膜,Ⅳ区为过钝化区,钝化膜破裂,极化电流增大。
图中a 点所对应的电流密度为维钝电流密度,b 点所对应的电流密度为致钝电流密度。
为了判定金属在电解质溶液中采用阳极保护的可能性,选择阳极保护的三个主要技术参数——致钝电流密度、维钝电流密度和钝化电位,必须测定阳极极化曲线。
三.实验仪器及用品恒电位仪,极化池,参比电极,辅助电极,工作电极,天平,量筒,水浴锅,温度计,搅拌棒,碳酸氢铵,氨水,无水酒精棉,水砂纸,四.实验步骤1. 配制实验溶液350毫升去离子水在水浴中加热至40度左右,放入80克碳酸氢铵,用玻璃棒搅拌至完全溶解,再加入32毫升氨水;2. 测定阳极极化曲线用水砂纸打磨工作电极至光亮,用无水酒精棉擦干待用;按照仪器要求连线,盐桥尖端距离研究电极表面为1—2毫米,经教师确认无误方可开始实验;lgi a b五.试验结果及数据处理1.在表中列出实验数据,并作E-lgi曲线图;2.在图中标明致钝电流密度、维钝电流密度及钝化电位区间,并附表列出。
六.分析及结论要求对所得的试验结果进行讨论分析,得出最终结论,文中引用参考文献处用上角标[1]的格式标明,并在试验报告后列出所引用的文献。
参考文献格式如下:References:1. Liu, J., X. Liang and S. Li, Effect of sulphate-reducing bacteria on the electrochemical impedancespectroscopy characteristics of 1Cr18Ni9Ti. 2007. 14(5): p. 425-430.。
极化曲线测量

极化曲线测量极化曲线测量董泽华为了探索电极过程的机理及影响电极过程的各种因素,包括各种⽔处理剂,缓蚀剂的评价和机理研究,都必须对电极过程进⾏研究,⽽在该研究过程中极化曲线的测定⼜是重要的⽅法之⼀。
⼀般进⾏进化曲线测量1.实验⽅法(⼀)碳钢在弱酸性溶液中的极化曲线(1)⼯作电极为PTFE或环氧树脂镶嵌的A3钢,⾯积为0.5cm2,⼯作电极⽤200,600,800号⾦相砂纸逐级打磨⾄光亮,以⽆⽔⼄醇和丙酮脱脂后,再⽤蒸馏⽔进⾏冲洗,放⼊⼲燥器内⼲燥30mins,然后浸⼊被测溶液中15~50mins, 待电位稳定后进⾏测量。
试验采⽤密闭的玻璃电解池,并置于恒温⽔浴中,试验过程中溶液未除氧。
放在丙酮中除去油污,⽤⽯腊涂抹剩余⾯积,备⽤。
(2)试验介质分别为1000 mg/l H2S+1000 mg/l HCl和1000 mg/l H2S+100 mg/l HCl。
温度为25℃和85℃。
缓蚀剂为某⽯油化⼯⼚提供的”HT-1”和”WS-1”,主要成分为咪唑啉酰胺为1mmol·L-1的盐酸溶液(pH=3),采⽤Pt⽚作为辅助电极,饱和⽢汞电极为参⽐电极。
将⼯作电极安装到装有250mL介质的四⼝烧瓶,与Pt辅助电极、饱和⽢汞电极组成三电极体系。
电解池的连接参见附件⼀。
(3)仪器采⽤华中科技⼤学研制的CS300型电化学测试系统进⾏极化曲线测量,测量控制和数据分析才采⽤corrTest进⾏。
从主菜单中选择“稳态测试”——“动电位扫描”或者直接按“F4”即可进⼊如下窗⼝,其参数设置如下图1所⽰。
温度控制在80℃(恒温⽔浴),扫描速率为0.5mv/s,极化范围为+/-100mV(相对开路电位),曲线采⽤⾮线性三参数⽅法来计算阴阳极Tafel斜率以及腐蚀速率、极化电阻等值。
图1极化曲线参数设置窗⼝电解池参数设置如下图2所⽰,⽤于设定⼯作电极的⾯积,材料化学当量,参⽐电极类型等,这些参数将⽤于腐蚀参数的计算。
图2.电极与电解池参数设置窗⼝此外,恒电位仪的参数设置⼀般可以依照下图3所⽰的参数进⾏,没有特殊需要⽆需修改。
极化曲线的测定
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
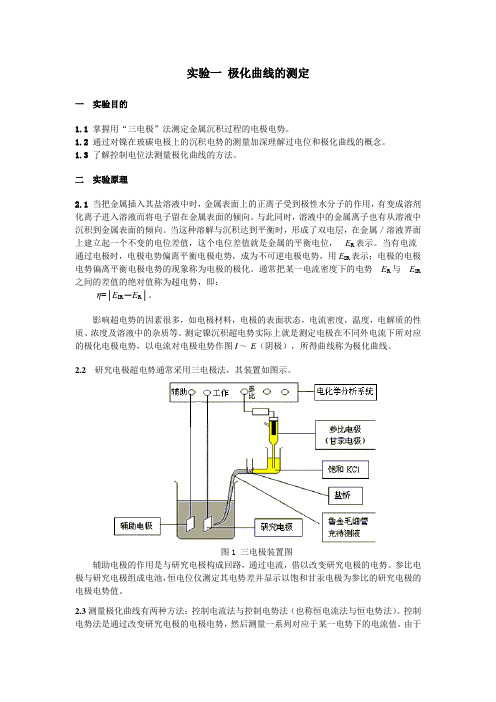
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。
极化曲线的测定实验报告

极化曲线的测定实验报告极化曲线的测定实验报告引言:极化曲线是研究电化学系统中电流与电势之间关系的重要工具。
本实验旨在通过测定极化曲线,探究电化学系统的电流-电势特性,并分析其对电极表面的影响。
实验方法:1. 实验仪器与试剂准备:本实验使用了电化学工作站、电化学池、铂电极、参比电极、电流计、电位计等仪器。
试剂方面,我们使用了硫酸铜溶液作为电解质。
2. 实验步骤:a. 将电解质溶液倒入电化学池中,保证液面高度适中。
b. 将铂电极和参比电极分别插入电化学池中,并连接电流计和电位计。
c. 开始实验前,先进行电极的清洗和预处理。
d. 通过改变电位计的电势,记录电流计的读数,并绘制电流-电势曲线。
实验结果与讨论:通过实验,我们得到了一条典型的极化曲线。
该曲线呈现出三个不同的区域:阳极极化区、平台区和阴极极化区。
在阳极极化区,电流随电势的增加而迅速增加。
这是因为在阳极极化区,电极表面发生了氧化反应,电子从电极流出,形成阳极电流。
此时,电极表面的活性物质浓度较高,反应速率较快,导致电流迅速增加。
在平台区,电流基本保持稳定。
这是因为在平台区,阳极和阴极反应的速率相等,电流达到了稳定状态。
此时,电极表面的活性物质浓度趋于稳定,电流不再显著变化。
在阴极极化区,电流随电势的增加而逐渐减小。
这是因为在阴极极化区,电极表面发生了还原反应,电子流入电极,形成阴极电流。
与阳极极化区不同的是,阴极极化区的反应速率较慢,导致电流逐渐减小。
通过分析极化曲线,我们可以得到一些有关电化学系统的重要信息。
例如,极化曲线的斜率可以反映电极表面反应速率的变化情况。
斜率越大,反应速率越快。
此外,平台区的电势值可以反映电化学系统的平衡状态。
结论:本实验通过测定极化曲线,成功地探究了电化学系统的电流-电势特性。
通过分析极化曲线,我们了解到阳极极化区、平台区和阴极极化区的特点,并得到了有关电化学系统的重要信息。
这些结果对于深入研究电化学领域的相关问题具有重要意义。
极化曲线的测定与分析

极化曲线的测定与分析主讲教师:一、实验目的1.掌握恒电位法测定阳极极化曲线的原理和方法。
2.通过阳极极化曲线的测定,判定实施阳极保护的可能性,初步选取阳极保护的技术参数。
3.掌握恒电位仪的使用方法。
二、实验原理阳极电位和电流的关系曲线叫做阳极极化曲线。
为了判定金属在电解质溶液中采取阳极保护的可能性,选择阳极保护的3个主要技术参数—致钝电流密度、维钝电流密度和钝化区的电位范围,需要测定阳极极化曲线。
阳极极化曲线可以用恒电位法和恒电流法测定。
图1是一条较典型的阳极极化曲线。
曲线ABCDE是恒电位法(即维持电位恒定,测定相对应的电流值)测得的阳极极化曲线。
当电位从A逐渐正向移动到B点时,电流也随之增加到B点,当电位过B点以后,电流反面急剧减小,这是因为在金属表面上生成了一层高电阻耐腐蚀的钝化膜,钝化开始图1 可钝化金属的阳极极化曲线发生。
人为控制电位的增高,电流逐渐衰减到C。
在C点之后,电位若继续增高,由于金属完全进入钝态,电流维持在一个基本不变的很小的值——维钝电流i p 。
当电位增高到D 点以后,金属进入了过钝化状态,电流又重新增大。
从A 点到B 点的范围叫活化区,从B 点到C 点叫活化-钝化过渡区,从C 点到D 点叫钝化稳定区,过D 点以后叫过钝化区。
对应于B 点的电流密度叫致钝电流密度i pp ,对应于C 点或D 点的电流密度叫维钝电流密度i p 。
若把金属作为阳极,通过致钝电流使之钝化,再用维钝电流去保护其表面的钝化膜,可使金属的腐蚀速度大大降低,这是阳极保护原理。
用恒电流法测不出上述曲线的BCDE段。
在金属受到阳极极化时,其表面发生了复杂的变化,电极电位成为电流密度的多值函数,因此当电流增加到B点时,电位即由B点跃增到E点,金属进入了过钝化状态,反映不出金属进入钝化区的情况。
由此可见,只有用恒电位法才能测量出完整的阳极极化曲线。
本实验采用恒电位仪逐点恒定阳极电位,同时测定对应的电流值,并在半对数坐标系上绘成曲线,即为恒电位阳极极化曲线。
实验一 极化曲线的测定

八讨论
(2) 金属的化学组成和结构。各种纯金属的钝 化性能不尽相同,以铁、镍、铬三种金属为例, 铬最容易钝化,镍次之,铁较差些。因此添加 铬、镍可以提高钢铁的钝化能力及钝化的稳定 性。
(3) 外界因素(如温度、搅拌等)。一般来说,温 度升高以及搅拌加剧,可以推迟或防止钝化过 程的发生,这显然与离子的扩散有关。
2021/4/24
二 极化曲线的的测定的原理
图1 极化曲线 A-B:活性溶解区;B:临界钝化点 B-C:过渡钝化区;C-D:稳定钝
化区 D-E:超(过)钝化区
2021/4/24
二 极化曲线的的测定的原理
金属的阳极过程是指金属作为阳极时在一定的外 电势下发生的阳极溶解过程,如下式所示:
M→Mn++ne-
坐标,电极电势(相对饱和甘汞)为横坐标的极化曲线。 3. 讨论所得实验结果及曲线的意义,指出钝化曲线中的
活性溶解区,过渡钝化区,稳定钝化区,过钝化区,并 标出临界钝化电流密度(电势),维钝电流密 度等数值。
2021/4/24
六 注意事项
1 按照实验要求,严格进行电极处理。
2 将研究电极置于电解槽时,要注意 工作电极与参比电极之间的距离每次 应保持一致。研究电极与参比电极应 尽量靠近。
研究工作。影响金属钝化过程及钝化性质的因素,可 以归纳为以下几点: (1) 溶液的组成。溶液中存在的H+、卤素离子以及某些 具有氧化性的的阴离子,对金属的钝化现象起着颇为 显著的影响。在中性溶液中,金属一般比较容易钝化, 而在酸性或某些碱性的溶液中,钝化则困难得多,这 与阳极产物的溶解度有关系。卤素离子,特别是氯离 子的存在,则明显地阻滞了金属的钝化过程,已经钝 化了的金属也容易被它破坏(活化),而使金属的阳极溶 解速度重新增大。溶液中存在的某些具有氧化性的阴 离子(如CrO2-4)则可以促进金属的钝化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八讨论
为减少电极电势测试过程中的溶液电位降, 通常两者之间以鲁金毛细管相连。鲁金毛细 管应尽量但也不能无限制靠近研究电极表面, 以防对研究电极表面的电力线分布造成屏蔽 效应。
2019/8/12
八讨论
3. 影响金属钝化过程的几个因素 金属的钝化现象是常见的,人们已对它进行了大量的
2019/8/12
八讨论
(2) 金属的化学组成和结构。各种纯金属的钝 化性能不尽相同,以铁、镍、铬三种金属为例, 铬最容易钝化,镍次之,铁较差些。因此添加 铬、镍可以提高钢铁的钝化能力及钝化的稳定 性。
(3) 外界因素(如温度、搅拌等)。一般来说,温 度升高以及搅拌加剧,可以推迟或防止钝化过 程的发生,这显然与离子的扩散有关。
或人为自行规定每次电流恒定的时间。
2019/8/12
三、 仪器试剂
【仪器试剂】 恒电位仪一台;饱和甘汞电极1支;碳钢电极1 支;铂电极1支;三室电解槽1只。 2 mol·dm-3 (NH4)2CO3溶液;丙酮溶液
2019/8/12
三 仪器试剂
2019/8/12
图2-19-2三室电解槽 1.研究电极; 2.参比电极; 3.辅助电极
2019/8/12
二 极化曲线的的测定的原理
(2) 恒电流法 恒电流法就是控制研究电极上的电流密度依次恒定在不 同的数值下,同时测定相应的稳定电极电势值。采用恒 电流法测定极化曲线时,由于种种原因,给定电流后, 电极电势往往不能立即达到稳态,不同的体系,电势趋 于稳态所需要的时间也不相同,因此在实际测量时一般 电势接近稳定(如1min~3min内无大的变化)即可读值,
二 极化曲线的的测定的原理
动态法:控制电极电势以较慢的速度连续地改变(扫描),
并测量对应电位下的瞬时电流值,以瞬时电流与对应的电极 电势作图,获得整个的极化曲线。一般来说,电极表面建立 稳态的速度愈慢,则电位扫描速度也应愈慢。因此对不同的 电极体系,扫描速度也不相同。为测得稳态极化曲线,人们 通常依次减小扫描速度测定若干条极化曲线,当测至极化曲 线不再明显变化时,可确定此扫描速度下测得的极化曲线即 为稳态极化曲线。同样,为节省时间,对于那些只是为了比 较不同因素对电极过程影响的极化曲线,则选取适当的扫描 速度绘制准稳态极化曲线就可以了。
四 实验步骤
B 通电 插上电源,打开恒电位仪的电源开关,开启电脑,点击 打开电化学工作站。 C 在电解池中,倒入约40mL的碳酸铵电解溶液,依次将 处理好的碳钢电极、饱和甘汞电极(参比电极)和铂电 极(对电极)按仪器上的指示依次连接好。
2019/8/12
四 实验步骤
D 在电化学工作站的界面上选择实验技术为线性电位扫 描,按书中所给参数进行设定。扫描线性范围设定为0.2-1.0V。
1. 极化现象与极化曲线 为了探索电极过程机理及影响电极过程的各种因素,必须 对电极过程进行研究,其中极化曲线的测定是重要方法之 一。我们知道在研究可逆电池的电动势和电池反应时,电 极上几乎没有电流通过,每个电极反应都是在接近于平衡 状态下进行的,因此电极反应是可逆的。但当有电流明显 地通过电池时,电极的平衡状态被破坏,电极电势偏离平 衡值,电极反应处于不可逆状态,而且随着电极上电流密 度的增加,电极反应的不可逆程度也随之增大。由于电流 通过电极而导致电极电势偏离平衡值的现象称为电极的极 化,描述电流密度与电极电势之间关系的曲线称作极化曲 线,如图1所示。
三 仪器试剂
2019/8/12
恒电位仪
四 实验步骤
1. 碳钢预处理:分别用6#和2#金相砂纸将碳钢研究电极打 磨至镜面光亮,面积固定为1cm2,然后在丙酮中除油。打 磨时,工作电极一定要平磨。
2. 线性电位扫描法测定极化曲线的步骤: A 准备工作 仪器开启前,“工作电源”置于“关”。
2019/8/12
2019/8/12
二 极化曲线的的测定的原理
图1 极化曲线 A-B:活性溶解区;B:临界钝化点 B-C:过渡钝化区;C-D:稳定钝
化区 D-E:超(过)钝化区
2019/8/12
二 极化曲线的的测定的原理
金属的阳极过程是指金属作为阳极时在一定的外 电势下发生的阳极溶解过程,如下式所示:
M→Mn++ne-
坐标,电极电势(相对饱和甘汞)为横坐标的极化曲线。 3. 讨论所得实验结果及曲线的意义,指出钝化曲线中的
活性溶解区,过渡钝化区,稳定钝化区,过钝化区,并 标出临界钝化电流密度(电势),维钝电流密 度等数值。
2019/8/12
六 注意事项
1 按照实验要求,严格进行电极处理。
2 将研究电极置于电解槽时,要注意 工作电极与参比电极之间的距离每次 应保持一致。研究电极与参比电极应 尽量靠近。
2019/8/12
二 极化曲线的的测定的原理
2. 极化曲线的测定 (1) 恒电位法 恒电位法就是将研究电极依次恒定在不同的数值 上,然后测能接近体系稳态。稳态体系指被研 究体系的极化电流、电极电势、电极表面状态等 基本上不随时间而改变。在实际测量中,常用的 控制电位测量方法有以下两种:
电流密度随电势增加迅速减至最小,这是因为在 金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B点对应的电势称为临界钝化电势,对应的电流
称为临界钝化电流。
2019/8/12
二 极化曲线的的测定的原理
电势到达C点以后,随着电势的继续增加, 电流却保持在一个基本不变的很小的数值上, 该电流称为维钝电流,直到电势升到D点, 电流才有随着电势的上升而增大,表示阳极 又发生了氧化过程,可能是高价金属离子产 生也可能是水分子放电析出氧气,DE段称为 过钝化区。
2019/8/12
八讨论
2. 三电极体系 极化曲线描述的是电极电势与电流密度之间的 关系。被研究电极过程的电极被称为研究电极 或工作电极。与工作电极构成电流回路,以形 成对研究电极极化的电极称为辅助电极,也叫 对电极。其面积通常要较研究电极为大,以降 低该电极上的极化。参比电极是测量研究电极 电势的比较标准,与研究电极组成测量电池。 参比电极应是一个电极电势已知且稳定的可逆 电极,该电极的稳定性和重现性要好。
E 电极开始按钮,仪器自动记录电流-电势曲线。
F 实验完成,依次拆除电极,洗净电解池和各个电极。 将仪器中记录的电流-电极电势曲线转化成文本格式后 导出,用于进行数据处理。
2019/8/12
五 数据处理
1. 对线性电位扫描法测试的数据进行处理。 2. 用作图软件将仪器所给的曲线转换成以电流密度为纵
2019/8/12
二 极化曲线的的测定的原理
静态法:将电极电势恒定在某一数值,测定相
应的稳定电流值,如此逐点地测量一系列各个 电极电势下的稳定电流值,以获得完整的极化 曲线。对某些体系,达到稳态可能需要很长时 间,为节省时间,提高测量重现性,往往人们 自行规定每次电势恒定的时间。
2019/8/12
八讨论
1. 电化学稳态的含义 指定的时间内,被研究的电化学系统的参量,包括电极 电势,极化电流,电极表面状态,电极周围反应物和产 物的浓度分布等,随时间变化甚微,该状态通常被称为 电化学稳态。电化学稳态不是电化学平衡态。实际上, 真正的稳态并不存在,稳态只具有相对的含义。到达稳 态之前的状态被称为暂态。在稳态极化曲线的测试中, 由于要达到稳态需要很长的时间,而且不同的测试者对 稳态的认定标准也不相同,因此人们通常人为界定电极 电势的恒定时间或扫描速度,此法尤其适用于考察不同 因素对极化曲线的影响时。
研究工作。影响金属钝化过程及钝化性质的因素,可 以归纳为以下几点: (1) 溶液的组成。溶液中存在的H+、卤素离子以及某些 具有氧化性的的阴离子,对金属的钝化现象起着颇为 显著的影响。在中性溶液中,金属一般比较容易钝化, 而在酸性或某些碱性的溶液中,钝化则困难得多,这 与阳极产物的溶解度有关系。卤素离子,特别是氯离 子的存在,则明显地阻滞了金属的钝化过程,已经钝 化了的金属也容易被它破坏(活化),而使金属的阳极溶 解速度重新增大。溶液中存在的某些具有氧化性的阴 离子(如CrO2-4)则可以促进金属的钝化。
2019/8/12
谢谢!
2019/8/12
此过程只有在电极电势正于其热力学电势时才能 发生。阳极的溶解速度随电位变正而逐渐增大, 这是正常的阳极溶出,但当阳极电势正到某一数 值时,其溶解速度达到最大值,此后阳极溶解速 度随电势变正反而大幅度降低,这种现象称为金 属的钝化现象。
2019/8/12
二 极化曲线的的测定的原理
图1中曲线表明,从A点开始,随着电位向正方向 移动,电流密度也随之增加,电势超过B点后,
3 每次做完测试后,应在确认恒电位 仪或电化学综合测试系统在非工作的 状态下,关闭电源,取出电极。
2019/8/12
七思 考 题
1. 用线性电位扫描法测定极化曲线时,为 何要使用比较慢的扫描速度,说明原因。
2. 测定阳极钝化曲线为何要用恒电位法? 3. 做好本实验的关键有哪些?
2019/8/12
物理化学实验
实验一 极化曲线的测定
指导教师: 单 云
2019/8/12
2019/8/12
一 、极化曲线的的测定目的要求
【目的要求】 1.掌握稳态恒电位法测定金属极化曲线的基本 原理和测试方法。 2.了解极化曲线的意义和应用。 3.掌握恒电位仪的使用方法。
2019/8/12
二 极化曲线的的测定的原理
