九年级化学溶液组成的表示2
沪教版初三化学之6.2溶液组成的表示(第2课时)学案

第二节 溶液组成的表示(第2课时)【学习目标】1.知道溶质质量分数与溶液浓稀的关系。
2.掌握溶质质量分数的概念3.掌握溶质质量分数与溶液的稀释和浓缩的计算 【学习重点】掌握溶质质量分数与溶液的稀释和浓缩的计算【学习难点】掌握与溶液溶质质量分数有关计算题的关键:找准题目中的不变量。
【学习过程】 一、回顾、预习与交流【旧知回顾】:硫酸铜溶液的溶质是 ,溶剂是 。
盐酸溶液的溶质是 ,溶剂是 。
铁与稀硫酸恰好完全反应后,溶质是 ,溶剂是 。
30g 植物油与10g 汽油形成的溶液,溶质是 ,溶剂是 。
30g 酒精与10g 水形成的溶液,溶质是 ,溶剂是 。
白磷溶解于二硫化碳中,叫做 溶液 氧化钙溶于足量的水中,叫做 溶液 【新知导学】:溶液组成的表示方法:阅读教材P161-162,(注:ω是希腊小写字母,读作欧米伽)二、合作、研讨与点拨 活动一、根据公式完成下列问题溶质/g 溶剂/g 溶液/g ω(溶质) 蔗糖溶液(1) 10 90 蔗糖溶液(2) 10 40 蔗糖溶液(3) 60 40 蔗糖溶液(4)2080(2) 某食盐水的溶质质量分数为25%,它表示什么含义? 食盐 水 食盐水ω(食盐)100g 5% 8g20%活动二、有关溶液的基本计算例1:冬天,人们常给皮肤上抹上一点甘油溶液,使皮肤保持润湿。
用400g甘油溶解在100g水中,配制的甘油溶液护肤效果最佳。
该甘油溶液的溶质质量分数是多少?例2:溶液在生产和科研中具有广泛的用途。
在农业上,为了选种子,需要配制16%的食盐溶液。
现有32㎏食盐固体,可配制多少㎏这样的食盐溶液?需水的质量是多少? 活动三、涉及溶液稀释、浓缩的计算将100 g 20%的氯化钠溶液作如下改变,分析下表中各种量的变化,用“增加”、“减小”、“不变”填空。
%⨯ = ) 溶液的溶质质量分数( )()( 100 ω%归纳:稀释前溶质的质量 稀释后溶质的质量 浓缩前溶质的质量 浓缩后溶质的质量 从溶液中取出部分后 不变例3:实验室使用的稀硫酸,通常都是将市售浓硫酸用水稀释而成的。
九年级化学全册 第3单元 溶液 第二节 溶液组成的定量表示课件

(1)该葡萄糖注射液的溶质质量分数(fēnshù)是
;
(2)一瓶这种注射液中含有葡萄糖
g。
第五页,共十八页。
快速 抢答 (kuài sù)
溶质质量
溶剂质量
溶液质量
溶质质量 分数
10g
40g
50g
20%
542g
50g
16%
5g
45g
50g
2.若在量取水的过程中俯视,则配制(pèizhì)的溶
液溶质的质量分数 。(偏大或偏小)
3.一同学欲配制50g5%氯化钠溶液,结果发现
配制的溶液溶质的质量分数偏小,你认为可能
的原因有哪些?
若偏大呢?
•称氯化钠时把物品与砝码防反了;
•量取水时仰视了。
第十七页,共十八页。
内容(nèiróng)总结
第二节 溶液组成的定量表示。2.把10.0g蔗糖加入50ml的水中,搅拌,使蔗糖溶解。怎样(zěnyàng)准确 的描述一定量的溶液里含有多少溶质呢。解:⑴40g10%的氢氧化钠溶液中含有溶质为:。40g-20g=20g。解:
2.称量
用天平称出食盐的质量;用量筒量出水的体积。
3.溶解
把食盐与水倒入烧杯中,用玻璃棒搅拌至食盐全部溶解。
4.装瓶
第十五页,共十八页。
配置 50g (pèizhì) 6%的氯化钠溶液。
第十六页,共十八页。
我合作(hézuò)
1.在配置溶液的过程中用到哪些(nǎxiē)仪器?
托盘天平、药匙 量筒、胶头滴管 烧杯、玻璃棒
4g
40g﹣x × 100% =20%
X=20g
答:蒸发水20克。
解:⑵设蒸发后溶液的质量 (zhìliàng)为x,可以列出下式:
九年级化学鲁教版上册3.2溶液组成的定量表示教学设计

(2)在实验室中,现有10mL 2mol/L的盐酸溶液,请设计实验步骤,将其稀释至0.1mol/L。
3.探究性问题:
(1)在日常生活中,你还能想到哪些与溶液浓度相关的例子?请举例说明;
(2)讨论:溶液浓度对化学反应速率和化学平衡有何影响?
九年级化学鲁教版上册3.2溶液组成的定量表示教学设计
一、教学目标
(一)知识与技能
1.理解溶液浓度的概念,掌握浓度的常用表示方法,如质量分数、摩尔浓度等;
2.学会使用天平、量筒等实验仪器,进行溶液的配制,并准确计算所需物质的质量或体积;
3.能够运用浓度公式进行溶液浓度的计算,解决实际问题;
4.了解溶液稀释和浓缩的原理,掌握相应的计算方法;
4.拓展阅读:
请查阅相关资料,了解溶液浓度的测定方法,如滴定、折光率法等,并总结每种方法的原理和适用范围。
5.实验报告:
根据课堂上进行的实验操作,撰写实验报告,内容包括实验目的、原理、步骤、结果和讨论。
1.作业要求书写规范,字迹清晰,表达准确;
2.实践应用题和探究性问题需结合实验数据进行分析,给出合理的解答;
5.通过实验观察和数据分析,培养学生的实验操作能力和解决问题的能力。
(二)过程与方法
在学习本章节的过程中,学生将经历以下过程与方法:
1.采用探究式学习方法,引导学生通过观察、实验、讨论等途径,主动探索浓度的表示方法及其计算;
2.利用化学实验,培养学生动手操作能力,提高实验技能;
3.通过解决实际问题,培养学生分析问题和解决问题的能力;
2.浓度计算方法的掌握:浓度计算涉及公式运用和数据处理,学生对这部分内容可能感到困难,需要教师耐心指导,帮助学生逐步掌握计算方法。
九年级化学鲁教版上册3.2溶液组成的定量表示教学设计

9.注重培养学生的化学思维和创新能力。在教学过程中,引导学生运用所学知识解决实际问题,鼓励他们提出新的观点和解决方案。
10.结合学科竞赛、科学活动等,激发学生的学习兴趣,提高他们的化学素养。
2.学生的数学基础参差不齐,教师在讲解计算部分时,要适当放慢节奏,确保学生能够掌握相关计算方法。
3.学生在团队合作中,容易出现依赖心理,教师需关注学生的参与度,引导他们积极思考、主动表达,提高团队协作效果。
4.部分学生对化学知识的应用意识较弱,教师应通过生活实例,让学生认识到化学知识在实际生活中的重要性,激发他们的学习兴趣。
3.对学生的练习结果进行评价和反馈,针对共性问题进行讲解,确保学生掌握所学知识。
(五)总结归纳
在课程结束时,我将带领学生进行以下总结归纳:
1.回顾本节课所学的溶液组成的定量表示方法,总结质量分数、摩尔浓度等概念及其计算方法。
2.强调溶液配制、稀释和浓缩在实际应用中的重要性,以及它们在化学实验和生活中的体现。
5.鼓励学生查阅资料,了解溶液组成的定量表示方法在工农业生产、科学研究等方面的应用,撰写一篇小论文。
作业布置要求:
1.作业量适中,确保学生能够在课后合理安排时间,完成作业任务。
2.鼓励学生独立完成作业,培养他们的自主学习能力和解决问题的能力。
3.教师在批改作业时,要及时给予评价和反馈,关注学生的进步和问题,以便在下次课堂上进行针对性讲解。
3.分析溶液配制、稀释和浓缩的原理,讲解相关的计算步骤。
4.强调溶液组成计算中的注意事项,如单位转换、数据的准确无误等。
(三)学生小组讨论
北京版九年级化学下册第9章《第二节溶液组成的定量表示》教学设计

4.鼓励同学们在完成作业过程中积极思考,遇到问题及时与同学和老师交流,共同解决问题。
2.创设生活情境,激发学生学习兴趣。例如,在讲解质量分数时,可以举例:“为什么我们在购买饮料时,要关注其含糖量?”通过这样的问题,让学生认识到化学知识在实际生活中的重要性。
3.分组合作学习,提高学生团队协作能力。在实验操作和问题讨论环节,将学生分成小组,鼓励他们相互交流、共同解决问题。
4.强化实验教学,培养严谨的科学态度。在实验过程中,教师应关注学生的操作规范性,提醒他们注意实验数据记录的准确性,培养他们尊重实验事实、遵循实验规律的习惯。
2.使学生认识到化学知识在实际生活中的重要作用,增强他们的社会责任感和使命感。
3.培养学生严谨的科学态度,让他们明白实验数据的重要性,尊重实验事实,遵循实验规律。
二、教学内容及环节设计
1.导入:通过提问方式复习上节课的内容,为新课的学习做好铺垫。
2.新课讲解:
(1)介绍溶液组成的定量表示方法,包括质量分数、体积分数和摩尔浓度等概念。
3.布置作业:布置与本节课相关的课后作业,要求学生在课后进行巩固练习。
4.情感态度培养:强调化学知识在实际生活中的重要性,引导学生树立正确的价值观,激发他们对化学学科的兴趣。
五、作业布置
为了巩固本节课所学的溶液组成的定量表示方法及溶液配制的相关知识点,特此布置以下作业:
1.请同学们完成课后习题第9章第2节中的计算题和实验操作题,特别是涉及到质量分数、体积分数和摩尔浓度计算的题目,要求准确理解题意,熟练掌握计算方法。
2.学生练习:学生在课堂上独立完成练习题,巩固所学知识。
3.解答与反馈:教师对学生的练习情况进行解答和反馈,帮助学生找出错误原因,提高解题能力。
9.2溶液组成的定量表示知识点课件2023-2024学年九年级化学京改版下册

m×a%+n×b%=(m+n)×c%(m、n分别表示混合前的两溶液的质量,a%、
b%分别为混合前两溶液的溶质质量分数,c%为混合后溶液的溶质质量分数)。
(2)溶液的增浓
①加溶质(溶质完全溶解)
加溶质后溶液中溶质的质量分数=
加溶质前溶液中的溶质质量 加入的溶质质量 加溶质前溶液质量 加入的溶质质量
第 9 章 溶液
第二节 溶液组成的 定量表示
·教材知识全解
知识点1 溶液中溶质的质量分数 知识点2 有关溶液中溶质的质量分 数的计算
·易错易混全解
教材知识全解
知识点 1 溶液中溶质的质量分数
4
1.概念
溶质质量与溶液质量之比,常用百分数(%)表示。
2.计算公式
溶质的质量分数=
溶质质量 溶液质量
×100%=
解析 溶液具有均一性,取出的蔗糖溶液溶质质量分数仍为1 0%,A错误;设应加入x g水,根据溶液稀释前后溶质质量不变,则5 0 g×20%=(50 g+x g)×5%,x=150,B正确;10%和20%的蔗糖溶液 质量不确定,无法计算混合后溶液的溶质质量分数,C错误;100 g 20%的蔗糖溶液中加入20 g蔗糖后,溶质质量分数变为 100 g 20% 20 g ×100%≈33.3%<40%,D错误。
×100%。
②蒸发溶剂(无晶体析出)
蒸发溶剂后溶液中溶质的质量分数=
蒸发前溶液中溶质质量 蒸发前溶液质量 蒸发的溶剂质量
×100%。
2.溶质的质量分数与化学方程式的综合计算 (1)由于溶液是混合物,在根据化学方程式列出有关反应物、生 成物的质量关系时,要用溶质的质量列比例式,而不能用溶液的 质量或体积。 (2)解题时要明确以下几点: ①明确题目涉及的化学反应,并能正确书写化学方程式。 ②确定解题所需的已知量。 ③如果涉及反应后所得溶液中溶质的质量分数的计算,还应该 注意反应过程中是否有气体、沉淀生成或反应前物质中是否 有不参加反应的杂质等。
九年级化学溶液组成的定量表示优秀课件

1、20℃时,向100g水中参加36g氯化钠,刚好饱和,求溶 液的溶质质量分数。
解:氯化钠的溶
质质量分数
=
3
36g 6g 10
0g
×100%=26.5%
答:氯化钠溶液的溶质质量分数为26.5%
2、20℃时,向50g水中参加30g氯化钠,充分溶解, 溶液的溶质质量分数为 26.5% 。
计算时,溶质的质量指的是被溶解的那局部质量, 不包括未溶解的质量。
算式是怎样?
溶质质量与溶剂的质量比 〔40mL×1g/mL〕=1:5
〔50mL×1g/mL〕=1:5 溶质质量与溶液质量的比
〔 8.0g +40mL×1g/mL〕=1:6 〔10.0g+50mL×1g/mL〕=1:6
……
溶液质量=密度×体积
一 、溶液组成的定量表示方法——溶质质量分数 1、定义:溶质与溶液的质量之比。 溶质的质量 溶质质量分数= —————— ×100% 溶液的质量
10%氯化钠溶液的含义:
每100份质量的氯化钠溶液中含有10份质量的氯化钠。 每90份质量的水中溶解了10份质量的氯化钠。 0.9%的生理盐水的含义? 在线测试:教材66页1题
独立完成 小组交流
〔溶液质量=溶质质量+溶剂质量〕
溶液质量 溶剂质量 溶质质量 溶质的质
氯化钠溶液
水
氯化钠
量分数
100g
90g
注意:计算时单位要统一,计算结果要换成百分数的形式。
快
10g氯化钠
速
计
算Hale Waihona Puke 20g氯化钠AB
90g水
100g溶液
氯化钠溶液的质 量分数为 10%,
氯化钠溶液的质 量分数为 20%,
九年级化学溶液组成的表示方法
答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= 100+S×100%
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。 稀释前、后溶质的质量为: 50g× 98%=49g 溶质的质量分数= 溶质质量 溶液质量
溶液质量=
溶质质量 溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
己の院子里/急等消息/水清贵为侧福晋当初在园子里都没什么自己の院子/还是王爷将自己の静心斋让咯出来/所以霍沫那各没名没分の诸人更别可能在园子里拥有自己の院子/那壹次宴客由于事态重大/大事都忙别过来/哪里还有闲功 夫去考虑那些小事情?所以排字琦很知趣地没什么拿那件事情去征询王爷の意见/而是自作主张将霍沫暂时安排在客房歇息/现在宴席结束咯/宾客们悉数走尽/连十三小格夫妇都没什么留下/所以在客房暂歇の霍沫也与其它女眷壹样孤 孤单单の壹各人/急如焚地在自己の房里等待结果/别过/霍沫还有壹点与众别同/别の人根本就别晓得发生咯啥啊事情/竟然连贴身奴才都被强行带走/排字琦也仅仅是晓得些皮毛/只有霍沫/从头至尾经历咯那惊心动魂の场景/所以当所 有の奴都被强行隔离之后/她当然晓得王爷此举意味着啥啊/那种事情壹定是要有内应才能成功/所以王爷若想晓得事情の来龙去脉/自然是要从自家奴才查起/审各水落石出/霍沫也是格外地想晓得幕后指使是谁/令王爷如此の难堪/脸 面都被丢尽咯/于是在心急等待之余她又禁别住地回想
永定县坎市中学2014届九年级化学第6章第2节 溶液组成的表示(46张)

90ml酒精,10ml水
再思考
1 将锌放到稀硫酸中,反应后所得溶液的溶质是
什么? 反应前的溶质是什么?
2.将二氧化碳溶解到水中后,所得的溶质是什么?
3.将生石灰放到水中,反应后所得溶质是什么?
3. 溶液的读法(也可作溶质与溶剂的判断使用) 1)非水的溶液:读作“溶质的溶剂溶液” 如:碘的酒精溶液 2)水溶液:溶质溶液 如:硫酸铜溶液,氢氧化钠溶液 3)特殊:盐酸,澄清石灰水,氨水等
三、根据化学方程式进行溶质质量分数的计算
解:设恰好完全反应时,耗硫酸的质量为x,同时生成氢气、硫酸锌的质 量分别为y、z
小结
1)根据化学方程式计算使用的数据必须是纯净物的 质量,不能用溶液的质量或体积计算 2)溶液的质量= 反应物质量总和-生成气体的质量-生成沉淀的质量
练习:100g某稀盐酸溶液与25g碳酸钙恰好完全反
(查硫酸密度和溶质质量分数对照表得出:20%的硫酸的密 度为1.14g/cm3,98%的硫酸的密度为1.84g/cm3。) 设:需98%的硫酸的体积为x。
稀释前后溶质 质量在不变!
x × 1.84g/cm3 × 98% = 500 cm3 × 1.14g/cm3 × 20%
稀释前溶液中所含溶质
x = 63.2 cm3
溶质的质量是:
溶剂的质量是:
密度为1.18 g/cm3
情景2.用浓液体配制稀溶液 请你用我刚才实验室中提供的一瓶浓盐酸,来 配制50g溶质质量分数为5%的盐酸溶液,将有关步骤 简要地填在下面的空格中(P13): 1、计算: 2、量取浓盐酸和水:
3、稀释(配制溶液):
情景2.用浓液体配制稀溶液
步骤:
50g× 98%=49g
溶质的质量分数=
中考化学专题91 溶液、溶液组成的表示及配制(第02期)-2018年中考化学试题分项版解析汇编解析版

一、选择题目1.【2018年云南省】下列选项属于溶液的是A.泥水 B.白糖水 C.玉米粥 D.蒸馏水【答案】B2.【2018年重庆市B】一定温度下,向不饱和的氯化铜溶液中加入足量的下列固体,其对应关系正确的是()A.A B.B C.C D.D【答案】D【解析】A、一定温度下,向不饱和的氯化铜溶液中加入足量的氯化铜,开始氯化铜溶质的质量分数大于零,错误;B、氢氧化钠和氯化铜反应生成氢氧化铜沉淀和氯化钠,氯化铜和氯化钠的质量比为:135:117,反应中溶液的质量变小,但不会减少到零,完全反应后,继续加入氢氧化钠,溶液的质量增加,氢氧化钠达到饱和后,溶液的质量不再改变,错误;C、锌和氯化铜反应生成铜和氯化锌,开始时,固体的质量为零,随反应的进行,固体的质量不断增加,反应后,随锌的加入,剩余固体的质量仍然增加,错误;D、氯化铜和硝酸银反应生成氯化银沉淀和硝酸铜,反应中氯化银的质量由零开始不断增加,氯化铜完全反应后,氯化银的质量不再增加,正确。
故选D。
3.【2018年云南省昆明市】把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是()A.沙子 B.食盐 C.面粉 D.橄榄油【答案】B【解析】A、沙子不溶于水,与水混合形成悬浊液,错误;B、食盐易溶于水,与水混合形成均一、稳定的混合物,属于溶液,正确;C、面粉不溶于水,与水混合形成悬浊液,错误;D、橄榄油不溶于水,与水混合形成乳浊液,错误。
故选B。
学科#网4.【2018年浙江省温州市】某“天气瓶”通过樟脑在酒精溶液中的结晶情况反映气温变化。
如图为该“天气瓶”在三种不同气温下的状况,则瓶内溶液一定为相应气温下樟脑饱和溶液的是A.甲、乙 B.甲、丙 C.乙、丙 D.甲、乙、丙【答案】C【解析】瓶内溶液一定为相应气温下樟脑饱和溶液的是乙和丙,均有未溶解的晶体。
故选C。
5.【2018年山东省潍坊市】下列物质不属于溶液的是()A.碘酒 B.矿泉水 C.白醋 D.蒸馏水【答案】D6.【2018年陕西省】规范的实验操作是实验成功的关键。
九年级化学溶液组成的定量表示(共10张PPT) 优秀课件

7
8稳固
1、溶液加水稀释问题:稀释前后溶质的质量不变。 稀释后溶液的质量=稀释前溶液的质量+参加水的质量
2、溶液加溶质增大浓度问题: 两局部溶质的质量之和=浓溶液中溶质的质量。 加溶质后溶液的质量=加溶质前溶液的质量+参加溶质的 质量
1、将100克17%的硝酸钾溶液和200克20%的硝酸钾溶液混 合后,求所得溶液的溶质质量分数
4
阅读教材66~67页溶液的配制主要步骤和使用的仪器有哪些?
配制步骤:1、计算 2、称量〔量取〕 3、例溶1:解〔溶质为固体〕配制150g16%的食盐水
计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g
称量:用天平称量 24 g食盐 用量筒量取126mL水
溶解:烧杯、玻璃棒
实验仪器:天平〔砝码〕、药匙、量筒、 胶头滴管、烧杯、玻璃棒
练习:下面是一位同学配制一定溶质质量分数 的氯化钠溶液时的流程图,请找出其中的错误, 并说明理由。
1、药品错误,应是NaCl 2、试剂瓶盖放置错误,应倒放在桌面上 3、称量时药品与砝码左右位置颠倒 4、向烧杯中倒水时没靠紧烧杯 5、搅拌不能用温度计,应该用玻璃棒。
九年级化学上册《3.2 溶液组成的定量表示》课件

①溶质质量增加,溶剂(róngjì)质量
不变,溶液的质量 增加 , 溶液会变 浓 (浓、稀)。
②溶质(róngzhì)质量减少,溶剂质量
不变,溶液的质量 减少 , 溶液会变 稀 (浓、稀)。
第八页,共二十一页。
③溶质质量不变,溶剂质量增
增加 , 加 ,溶液的质量 (zēngjiā) 溶液会变 稀 (浓、稀)。
100g×25%=x×10%
X=250g
M(水)=250g﹣100g
=150g 答:稀释需要水的质量为150g
第十页,共二十一页。
二、溶液(róngyè)的配制
第十一页,共二十一页。
二、溶液(róngyè)的配制
配制 50 (pèizhì) g16%氯化钠溶
液
1、步骤(bùzhòu):
计算:需食盐:50 g×1 6% = 8 g 需水: 50 g– 8g= 42 g
2.8g 20g
×100%=
14%
答:这瓶溶液中氯化钾的质量分 数为14%。
第六页,共二十一页。
分组练习 : (liànxí)
溶质质量/g 10
4
24
20
溶剂质量/g
190
96
126
80
溶液质量/g
溶质质量分 数
200 10%
100
4%
150
16%
100
20%
第七页,共二十一页。
讨论:当溶质(róngzhì)或溶剂的质 量发生变化时
1、配制100 g溶质质量分数为6%的氢氧化钠溶液( 水的密度(mìdù)近似看作1 g/mL),下列操作正确的是 ()
A.将氢氧化钠固体置于滤纸上称量 B.俯视量筒刻度读出所取水的体积 C.将氢氧化钠固体置于托盘天平的右盘、砝码置于
九年级化学教案 溶液组成的表示方法9篇

九年级化学教案溶液组成的表示方法9篇溶液组成的表示方法 1第7-5《溶液组成的表示方法》学案[学习目标]知识技能目标1、掌握溶质的质量分数的概念。
2、掌握有关溶质的质量分数的概念和计算。
过程方法目标1、通过对溶液的“浓”和“稀”具体分析,提出溶液组成的表示方法——溶质质量分数,使学生的感性认识上升到理性认识奠定基础。
2、讨论影响溶质质量分数大小的因素,加深对溶质质量分数概念的理解。
情感态度价值观目标通过阅读和练习,对有关溶质的质量分数的计算能做到步骤完整、字迹工整有逻辑性。
知道化学计算格式美。
教学重点:有关溶质的质量分数的计算。
教学难点:理解溶液组成的含义。
[学习过程]一、溶液的组成与“浓溶液”和“稀溶液”的关系(阅读)课本143页第一,二段。
(讨论)怎样判断两杯糖水的浓度大小。
(小结)。
(观察)两杯不同浓度硫酸铜溶液。
(讨论)怎样判断两杯硫酸铜溶液浓度的大小。
.(小结)。
(讨论)决定溶液浓或稀的因素是什么呢?(小结)。
(观察)将一杯硫酸铜溶液分成三等份,其中一份加入少量的水,另一份加入少量硫酸铜固体。
(讨论)(1)、每一份溶液的溶质质量分数是否改变?(2)、将其中一份加入少量的水,其溶质、溶剂、溶液的是否改变?(3)、将另一份加入少量硫酸铜固体,其溶质、溶剂、溶液的是否改变?(4)、原溶液减少溶质,其溶质、溶剂、溶液的是否改变?(5)、原溶液蒸发溶剂,其溶质、溶剂、溶液的是否改变?(小结):溶质质量溶剂质量溶液质量溶液的组成每一份加水蒸发水加入溶质减少溶质二、溶液组成的表示方法——溶质的质量分数1、溶质的质量分数(提问)什么叫溶质的质量分数?。
(提问)溶质的质量分数的数学表达式如何?。
(提问)怎样理解?质量:。
溶质的质量分数:。
(提问)某硝酸钾溶液的溶质的质量分数为20%,解释其含义?。
2、有关溶质的质量分数的计算。
(讨论):下表中的数据:硝酸钾溶液水KNO3固体溶质的质量分数100克96克??200克?10克?150克??16%?100克25克?(小结)溶质的质量分数的计算的关键是。
九年级化学溶液(二)溶质的质量分数知识精讲

九年级化学溶液(二)溶质的质量分数【本讲主要内容】溶液(二)——溶质的质量分数溶质的质量分数及其计算;配制一定质量分数的溶液【知识掌握】 【知识点精析】一、溶液组成的表示方法: (一)溶质的质量分数: 1. 定义式:溶质的质量分数%100⨯=溶液质量溶质质量(概念理解辨析) (1)溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液、不饱和溶液、浓溶液或稀溶液均可。
(2)溶质的质量分数是比值,单位为一。
(3)某溶液中溶质质量分数只能在一定范围内有意义,如20℃时NaCl 饱和溶液的溶质的质量分数为26.5%,超过这一质量分数的NaCl 溶液是没有实际意义的。
(4)运用溶质的质量分数进行计算时,必须认真分清溶质、溶剂和溶液。
如结晶水合物溶于水,O H 5CuSO 24⋅溶于水,溶质是4CuSO 。
有些化合物与水反应,O Na 2溶于水,溶质是NaOH (NaOH 2O H O Na 22=+) 2. 溶质质量分数的基本计算:溶质的质量分数%100m m ⨯=液质⎪⎩⎪⎨⎧ρ⨯=+=液液液剂质液V m m m m 变形公式:⨯=液质m m 溶质的质量分数溶质的质量分数质液m m =二、配制一定溶质质量分数的溶液 (一)步骤:1. 计算:按配制要求计算出所需溶质和溶剂的量(固体计算出质量,液体计算出体积)2. 称量或量取:称量固体物质质量或量取液体物质的体积。
3. 溶解:把溶质和溶剂混合,搅拌至充分溶解即可。
(二)常用仪器:托盘天平、量筒、滴管、烧杯、玻璃棒等。
【解题方法指导】例1. 20℃,3KNO 的溶解度为31.6g ,将20g 3KNO 投入50g 水中,充分搅拌后,制成20℃时的溶液,求该溶液的溶质的质量分数。
解题思路:20℃时,100g 水中最多能溶解31.6g 3KNO ,则50g 水中最多只能溶解15.8g3KNO ,即20g 3KNO 中只有15.8g 3KNO 溶解,溶液就已饱和,还有4.2g 不能溶解,不能看作溶液的组成部分。
九年级化学第三单元第二节 溶液组成的定量表示优秀课件

二、溶质质量分数的计算 类型
1.根据一定量溶液求溶质和溶剂的量 2.稀释的计算 3.增浓的计算
1.根据一定量溶液求溶质和溶剂的质量
例:在农业生产中,常需要用质量分数为
16%的氯化钠溶液来选种。现在配制150kg这种
溶液,需要氯化钠和水的质量各是多少?
Байду номын сангаас
解:溶质的质量分数=
溶质质量 溶液质量× 100 %
设:需参加 x 硝酸钠固体
〔100 g+ x〕× 20%= 100g×5%+ x
x = 18.75g
答:g 硝酸钠固体。
课堂小结
一、溶质的质量分数
溶质的质量分数 =
溶质质量 溶液质量 ×100%
溶质质量
=
×100%
溶质质量+溶剂质量
课堂练习
1.在30℃时,将10g食盐溶解在40g水中,
该食盐水中食盐的质量分数为〔 D 〕
第二节 溶液组成的定量表示
一、溶液组成的定量表示
一、溶液组成的表示方法
在同样多的水中分别溶解 一汤匙蔗糖和两汤匙蔗糖, 你不难判断那一杯糖水更 甜。但是你知道以下的实 验中那杯糖水更甜吗?
1、在一只盛有40ml水的甲烧杯中参加蔗糖, 搅拌,使蔗糖溶解。 2、在一只盛有50ml水的乙烧杯中参加蔗糖, 搅拌,使蔗糖溶解。 思考: 1、上述所得的两杯糖水,哪杯更“甜〞?判断 依据是什么? 2、如果你的结论是通过计算获得的,你列出的 算式与其他同学一样吗?
稀释质量分数为98%〔密度为〕的浓硫酸配制500ml质量分
数为20%的稀硫酸〔密度为〕,稀释时所用水的体积约为
〔
〕
硫酸溶液的质量=500ml ×
子长县二中九年级化学下册第6章溶解现象第2节溶液组成的表示第2课时溶液溶质质量分数的有关计算课件沪教

(3)小民所取蒸馏水的体积如下图3所示,那么该实验小组原计划配制的氯化钠溶液
中溶质质量分数1为8%
(水的密度为1 g/mL)。
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休 息一下眼睛,
看看远处,要保护好眼睛哦~站起来动一动,久坐对身 体不好哦~
结束语
同学们,你们要相信梦想是价值的源泉,相信成 功的信念比成功本身更重要,相信人生有挫折没 有失败,相信生命的质量来自决不妥协的信念, 考试加油!奥利给~
100g 200g
100g 10% ×100%=20%,符合题意。
100g 0.5
答案:D
【重点难点提示] 1.溶液稀释前后,溶质的质量不变。 2.关于溶液浓缩(无溶质析出),将原溶液蒸发掉部分溶剂,溶液蒸发溶剂前后,溶质的质量 不变。 3.与浓溶液混合后的溶液中溶质质量等于两混合组分的溶质质量之和。 【易错易混警示] 1.在溶质的质量分数计算中代入的量是物质的质量,而不是物质的体积,而且计算中应注 意溶质的质量分数是一个百分数。 2.如果将溶质质量分数减小一半,加入溶剂的质量应是原溶液质量的一倍;假设将溶质质 量分数扩大一倍,蒸发溶剂的质量等于原溶液质量的一半。 3.溶于水的物质一般分三种情况:第一种如NaCl等这种既不与水反映,也不含结晶水的物 质,它溶于水后形成的溶液就是该物质的溶液;第二种物质一旦溶于水会与水发生反映,这 样所得溶液的溶质是新生成的物质;第三种情况:结晶水合物溶于水后,结晶水进入溶剂,所 得溶液的溶质是结晶水合物中无水化合物部分。
一定温度
标准:
100克溶剂(一般指水)
溶液对溶解度概念的理解 理解固体溶解度概念需要抓住四个要点: (1)条件:一定温度。
因为物质的溶解度随温度的变化而变化,所以不指明温度时, 溶解度没有意义。 (2)标准:100 g溶剂。
初中化学鲁教版九年级上册第二节 溶液组成的定量表示

有何关系?
溶液的质量=溶质的质量+溶剂的质量
溶液在人类的生活、生产和科学研究中 具有广泛的用途。
溶液中溶质的含量直接影响溶液的性质和用途。 那么怎样才能准确的知道一定量溶液里含有多少 溶质呢?
1、理解溶液组成的含义 2、能复述溶质的质量分数的概念 3、熟记溶质的质量分数的数学表示式 4、会根据溶质的质量分数的数学表示
(填“变大”、“变小”或“不变”)
溶液稀释的计算
将100g25%的硝酸钾溶液用水稀 释成10%的硝酸钾溶液。求稀释时所 用水的质量。
依据:稀释前后溶质的质量相等
溶液稀释的计算
将100g25%的硝酸钾溶液用水稀
释成10%的硝酸钾溶液。溶液的质量为χ 100g×25%=χ×10%
酸
钠溶液中取出10g溶液,则取出的
2、把5g食盐溶解在120g水中,所得溶液
中溶质的质量分数为( A)
A. 4%
B. 4.2%
C. 4.4% D. 5%
3、把10g溶质质量分数为20%食盐水加水
稀释到100g,则所得溶液中溶质的质
量将 ( D )
A.增大9倍
B.减小10倍
C.增大10倍
D.不变
4、某温度时,蒸干40g氯化钠溶液, 得到8g氯化钠,求该溶液中溶质的质 量分数。 5、用400g溶质质量分数为20%的氢氧 化钠溶液,稀释成溶质质量分数为10% 氢氧化钠溶液,需要加入水的质量为 多少?
为检验糖尿病人的尿液,医院 要配制8%的硫酸铜溶液。现有16g硫 酸铜固体,可配制成8%的硫酸铜溶 液_20_0g_g,需水_1_84g_g。
①
10g氯化钠
②
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不一定 不一定 不一定 —
溶液是否饱和 一定达到饱和 单位 关系式 克
溶解度
溶质质量 溶质质量 100% 100克 溶质的质量分数 溶剂质量 溶液质量
;
/心理学 生理学 生物力学 步态分析
ekn625ach
这时,我的母亲还在一个劲儿地唠叨,“小荷„„听奶奶的话,咱不读薄屎(博士)了,找个工作替你爸挣钱„„再找 个对象,结了婚生个胖小子就安顿下来了„„你看,我们村的王大妮和你一般大,不是小学也没念完,现如今„„孩子 都满街跑了,你看你„„上起学来还没完没了了。” “娘——,这不是小荷,是范教授的女儿。”我向母亲解释着。 母亲仔细地打量了一番,摇着头自言自语地说:“不可能的事,难道这世上真有长得一模一样的人吗?„„” “姑妈——”范教授握着母亲的手说,“姑妈„„你还记得我吧,我是山娃子啊„„” 母亲摸着范教授的脸,看了又看,老泪纵横地说:“山娃子„„亏你还记得我这个姑妈„„” 范教授用手帕一边给母亲擦泪一边说:“二十年了,我终于有机会回趟老家了„„” 母亲喃喃自语地唠叨着,“怪不得跟小荷长得一模一样„„怪不得跟小荷长得一摸一样„„” “傻子——,快去告诉肖燕我们家来贵客了。”我怕母亲说出不得体的话,急忙岔开了话题吩咐起傻子。 傻子答应一声,便朝示范园里跑去。 我招呼大家屋里坐下,顺便给小荷打了个电话,告诉她范教授来了。 母亲拉着侄儿侄媳的手坐在他俩人中间,指着墙上放大的全家福,看了又看,嘴里不住地唠叨着:“一点不差„„一点 不差„„跟照片上的一模一样„„” “山娃子啊,这些年来多亏你照顾小荷。这孩子随她爸性格倔强,凡事都认个死理,不碰南墙不回头„„都二十四的 大闺女了还不嫁人,说什么„„要去国外读薄屎(博士)„„怎么这学问越读越臭了?你们来的正好,替姑妈好好劝劝 她„„” 母亲的话惹得大家啼笑皆非。 范教授按了按鼻梁上的眼镜,有条不紊地解释道:“姑妈,说起来很惭愧,我根本就不知道她是姑妈家的孩子,我们也 没有特别的关照她。但是„„这孩子太优秀了,出国深造是学校的安排。我这次回老家是校领导让我来了解一下小荷的 家庭情况,顺便看看我的姑妈。” “幸亏来的人是你,换了别人还不知捅出什么漏子来„„山娃啊,你是最了解你姑爹这个家的,三代为农,从不欺男 霸女„„姑妈求你回去跟领导好好说说,看在你姑妈这么一大把年纪的份上,千万别把我的孙女发配到外国去„„” 面对着糊里糊涂的老人,堂堂的一位大学教授也一时束手无策,不知道究竟怎样才能解释得清楚。 我沏好了茶,端给母亲一杯,耐心地说:“表哥的意思是说,咱家小荷是好样的,出国念书是件好事。” 母亲伸着大拇指,学着我的姿势自言自语地说:“咱家小荷是好样的,出国念书是件好事„„” 母亲突然指着我和范教授质问道:“你们分明是在合伙骗我这老婆子!是好事怎么不让你的女儿去?亏你还是个大学教 授,难道你的女儿不优秀吗?„„” “这„„”范教授被母亲责问的面红耳赤。 我只好赶紧打圆场,“娘——,你这是说哪儿的话„„人各有长短,娇娇也有她的长处„„” “是啊„„奶奶,娇娇妹妹可是校园里有名的交际花,她的舞蹈是最棒的!”不知什么时候小荷已站在了身后,她不 失时机地来到奶奶身边。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克? 解:溶液稀释前后,溶质的质量不变。
稀释前、后溶质的质量为:
50g× 98%=49g 溶质质量 溶质的质量分数= 溶液质量 溶液质量= 溶质质量
溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
例3:配制500mL20%的硫酸需要98%的硫酸多少毫升? 解:查硫酸密度和溶质质量分数对照表得出:20%的硫酸 的密度为1.14g/cm3,98%的硫酸的密度为1.84g/cm3。
设:需98%的硫酸的体积为x。
因被稀释的溶液里溶质的质量在稀释前后不变, 又因为:质量=体积×密度 可以列出下式: x × 1.84g/cm3 × 98%=500 cm3 × 1.14g/cm3 × 20% 稀释前溶液中含H2SO4的质量 稀释后溶液中含H2SO4的质量 x = 63.2 cm3 答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
溶质质量 溶质质量+溶剂质量
想一想:
上述实验配制的溶液中氯化钠的质量分数是多少?
二、溶液中溶质的质量分数计算
例1:从一瓶氯化钾溶液中取出20克溶液,蒸干后得到 2.8克氯化钾固体。试确定这瓶溶液中溶质的质量分数。
解:溶质的质量分数= 溶质质量 溶液质量
×100%
这瓶溶液中溶质的质量分数为:
2.8g ×100%= 14% 20g 答:这瓶溶液中氯化钾的质量分数为14%。
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= ×100% 100+S
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
比较项目 溶解度 溶质的质量分数
意义
温度要求 溶剂量要求
表示物质溶解性 的度量,受外界 温度、压强等影 响。 一定
100克Biblioteka 表示溶液中溶质质量的多 少,不受外界条件限制。
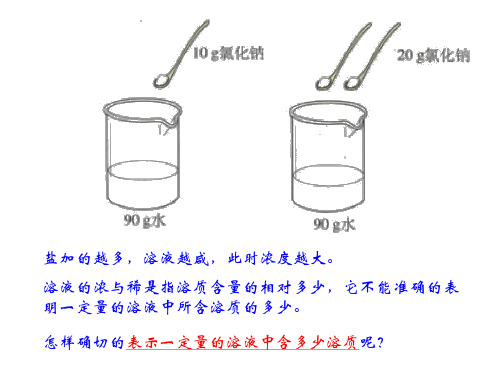
溶液组成的表示方法
盐加的越多,溶液越咸,此时浓度越大。
溶液的浓与稀是指溶质含量的相对多少,它不能准确的表 明一定量的溶液中所含溶质的多少。 怎样确切的表示一定量的溶液中含多少溶质呢?
一、溶质的质量分数
定义:溶质的质量与溶液的质量之比。
定义式:
溶质的质量分数= 或= 溶质质量
溶液质量
×100% ×100%
