高中化学选修三课件配合物.pdf
合集下载
高中化学 选修三 第二章 第二节 配合物理论

(2) 配合物的组成
(配离子或内界)
Cu(H2O)4
SO4
配 位 数 外界
中 配配 位 心 体原 子 读作:硫酸四水合铜离 子
(3)配合物的命名 1 内界命名: 配体数--配体名称—“合”字— —中心离子名称—中心离子化合价(利用化合 价代数和原理计算,用带圆括号的罗马数字 表示)。
[Co(NH3)5(H2O)]3+ 一水五氨合钴(Ⅲ) 离子
[Cu(H2O)4]2+
Cu2+与H2O是如何结合的呢?
H2O
H+
提供孤电子对
提供空轨道接 受孤对电子
H2O Cu2+
H O H
H
配位键
H2O H2O Cu OH2 H2O
2+
2、配合物 (1) 定义 通常把接受孤电子对的金属离子
(或原子)与某些提供孤电子对的 分子或离子以配位键结合形成的化 合物称为配位化合物,简称配合物
1、配位键
(1)定义 提供孤电子对的原子与接受孤电 子对的原子之间形成的共价键, 注意: 配位键与共价键性质完全相同 (2)配位键的形成条件 一方提供孤电子对(配位体)
一方提供空轨道
常见的配位体 H2O NH3 X- CO CN SCN-
(3)配位键的表示方法
A B
电子对给予体 —电子对接受体” H O H H
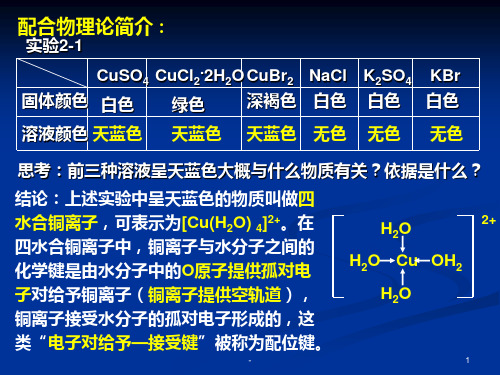
天蓝色 溶液
H 2O H 2O Cu OH2 H 2O
蓝色 沉淀
2+
深蓝色 溶液
H 3N
+乙醇 静置 2+
深蓝色 晶体
[Cu(NH3) 4 ] SO4•H2O
Cu(OH)2
NH3 Cu NH3 NH3
高中选修三配合物

离子位于中心,六个氨分子作为配体通过配位键与铁离子相连。
02 03
铜(II)与乙二胺的配合物
铜(II)离子可以与乙二胺形成四乙二胺合铜(II)配合物([Cu(en)2]2+),其 中铜离子位于中心,四个乙二胺分子作为配体通过配位键与铜离子相连 。
钴(II)与氯离子的配合物
钴(II)离子可以与氯离子形成四氯合钴(II)配合物([CoCl4]2-),其中钴离 子位于中心,四个氯离子作为配体通过配位键与钴离子相连。
B
溶液的性质
溶液的pH值、离子强度、溶剂性质等也会 影响配合物的稳定性。例如,在强酸性溶液 中,一些配合物可能会发生解离;在强碱性
D
溶液中,一些配合物可能会发生沉淀。
03 配合物在化学反应中作用
氧化还原反应中作用
配合物作为氧化剂
01
某些配合物中的中心原子可以接受电子,从而作为氧化剂参与
氧化还原反应。
以中心原子的元素符号表示,其氧化态用 罗马数字标明。
配合物结构与性质
02
配合物空间构型
01
直线型
配合物中心原子与配体以直线方式排列,如 [Cu(NH3)2]+。
02
平面型
配合物中心原子与配体在同一平面上,形成平面构型, 如[PtCl4]2-。
03
四面体型
配合物中心原子位于四面体中心,四个配体位于四面体 的顶点,如[Ni(CO)4]。
谢谢聆听
稀土金属离子
如镧系和锕系元素,具有 特殊的电子构型和化学性 质,能与多种配体形成稳 定的配合物。
常见配体类型及其性质
氨和胺类配体
具有孤对电子的氮原子可以与 金属离子形成配位键,如氨 (NH3)、乙二胺(en)等。
高中化学选修三全套课件(共201张PPT)

99.7%
2、地球中的元素
绝大多数为金属元素 包括稀有气体在内的非金属仅22种 地壳中含量在前五位:O、Si、Al、Fe、Ca
3、原子的认识过程
古希腊哲学家留基伯和德谟克立特 思辨精神
原子:源自古希腊语Atom,不可再分的微粒
1803年 道尔顿(英) 原子是微小的不可分割的实心球体
1897年,英国科学家汤姆生 枣糕模型
5.了解原子结构的构造原理,能用构造原理认识 原子的核外电子排布
6.能用电子排布式表示常见元素(1~36号)原子 核外电子的排布
一、开天辟地——原子的诞生
1、原子的诞生
宇宙大爆炸2小时:大量氢原子、少量氦原子 极少量锂原子
140亿年后的今天: 氢原子占88.6% 氦原子为氢原子数1/8 其他原子总数不到1%
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1s2 2s2
2p4
O原子
六、能量最低原理、基态与激发态、光谱
1、能量最低原理
能量最低原理:原子电子排布遵循构造原理 能使整个原子的能量处于最低
ndxy轨道 ndxz轨道 ndyz轨道
同一能级中的轨道能量相等,称为简并轨道
③原子轨道的电子云轮廓图 s轨道的电子云轮廓图
npx轨道电 npy轨道电 子云轮廓图 子云轮廓图
npz轨道电 子云轮廓图
nd轨道电子云轮廓图
五、泡利原理和洪特规则
核外电子的基本特征
量 主量子数
子 化
角量子数
描 磁量子数 述
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述
小黑点:概率密度 单位体积内出现的概率 小黑点越密概率密度越大
高中化学苏教版选修三 4.2 配合物的形成和应用 课件 (共19张PPT)

配位体具有孤电子对
内界
外界(或无外界) 外界和内界可完全电离
内界很难继续电离。
巩固提升 1.指出下列各配合物中的内界(配离子)、 中心原子、配位体、配位数及配位原子。
(1) [Co(NH3)5Cl] Cl2
(2) Na3[AlF6]
(3) K2[Pt(NH3)2(OH)2Cl2]
内界为
内界为
[Co(NH3)5Cl]2+ 中心原子 Co3+
(1)中心原子是提供空轨道 接受孤电子对的金属离子 (或原子),一般是带正电荷的阳离子,常见的有 过渡金属离子Fe3+、Ag+、Cu2+、Zn2+等。 (2)配位体是提供孤电子对的分子或阴离子,如 NH3、H2O、CO、Cl-、F-、SCN-、CN-等。 直接提供孤电子对的原子叫做配位原子,如NH3 中的N、H2O分子中的O、CO分子中的C等。 (3)配位数是中心原子形成的配位键的数目。 (4)内界和外界:配离子称为内界,与内界电性匹 配的离子称为外界。
内界为[AlF6]3中心原子 Al3+
[Pt(NH3)2(OH)2Cl2]2中心原子 Pt2+
配位体 NH3、Cl配位数 6
配位体 F配位数 6
配位体 NH3、OH-、Cl配位数 6
配位原子 N、Cl 配位原子 F 配位原子 N、O、Cl
巩固提升
2.向下列配合物的水溶液中加入AgNO3溶 液,不能生成AgCl沉淀的是( B )
孤电子对的:H+、
NH3、H2O、CO、Cl-、配位键的形成条件:部分过渡金属离
F-、CN-、SCN-
子(Ag+、Zn2+、
一个原子单方面提供孤电子对, Cu2+、Fe3+等)
另一个原子有能接受孤电子对的“空轨道”。
内界
外界(或无外界) 外界和内界可完全电离
内界很难继续电离。
巩固提升 1.指出下列各配合物中的内界(配离子)、 中心原子、配位体、配位数及配位原子。
(1) [Co(NH3)5Cl] Cl2
(2) Na3[AlF6]
(3) K2[Pt(NH3)2(OH)2Cl2]
内界为
内界为
[Co(NH3)5Cl]2+ 中心原子 Co3+
(1)中心原子是提供空轨道 接受孤电子对的金属离子 (或原子),一般是带正电荷的阳离子,常见的有 过渡金属离子Fe3+、Ag+、Cu2+、Zn2+等。 (2)配位体是提供孤电子对的分子或阴离子,如 NH3、H2O、CO、Cl-、F-、SCN-、CN-等。 直接提供孤电子对的原子叫做配位原子,如NH3 中的N、H2O分子中的O、CO分子中的C等。 (3)配位数是中心原子形成的配位键的数目。 (4)内界和外界:配离子称为内界,与内界电性匹 配的离子称为外界。
内界为[AlF6]3中心原子 Al3+
[Pt(NH3)2(OH)2Cl2]2中心原子 Pt2+
配位体 NH3、Cl配位数 6
配位体 F配位数 6
配位体 NH3、OH-、Cl配位数 6
配位原子 N、Cl 配位原子 F 配位原子 N、O、Cl
巩固提升
2.向下列配合物的水溶液中加入AgNO3溶 液,不能生成AgCl沉淀的是( B )
孤电子对的:H+、
NH3、H2O、CO、Cl-、配位键的形成条件:部分过渡金属离
F-、CN-、SCN-
子(Ag+、Zn2+、
一个原子单方面提供孤电子对, Cu2+、Fe3+等)
另一个原子有能接受孤电子对的“空轨道”。
高中化学 第2章 第2节 第2课时 杂化轨道理论、配合物理论课件高二选修3化学课件

蓝色沉淀,氨水过 Cu2++2NH3·H2O===Cu色溶
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH- [Cu(NH3)4]2++SO24-+H2O=乙==醇==
,
[Cu(NH3)4]SO4·H2O↓
液,滴加乙醇后析
出深蓝色晶体
第二章 分子结构 与性质 (fēn zǐ jié ɡòu)
第二节 分子的立体构型 第2课时(kèshí) 杂化轨道理论、配合物理论
12/11/2021
第一页,共四十五页。
栏目导航
目标与素养:1.了解杂化轨道理论、杂化类型对立体构型的解释及判 断。(微观探析与模型认知)2.了解配位键的特点及形成,了解配合物的理 论及其成键特征。(微观探析与科学探究)
12/11/2021
第十八页,共四十五页。
栏目导航
(2)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化 的原子轨道数目相等。
(3)杂化过程中,轨道的形状发生变化,但杂化轨道的形状相同,能 量相等。
(4)杂化轨道只用于形成 σ 键或用来容纳未参与成键的孤电子对,且 杂化轨道之间要满足最小排斥原理。
④配合物离子的电荷数:等于中心原子或离子与配位体总电荷数的代 数和。如[Co(NH3)5Cl]n+中,中心离子为 Co3+,则 n=2。
(2)形成配合物的条件 ①配体有孤电子对。
②中心原子有空轨道。
12/11/2021
第二十九页,共四十五页。
栏目导航
(3)配合物的稳定性 配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。 当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。 (4)配合物形成时性质的改变 ①颜色的改变,如 Fe(SCN)3 的形成。 ②溶解度的改变,如 AgCl―→[Ag(NH3)2]+。
选修三配合物PPT课件
-
2
实验2-2 已知氢氧化铜与足量氨水反应 后溶解是因为生成了[Cu(NH3) 4]2+ ,其 结构简式为:
NH3
2+
H3N Cu NH3
NH3
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O
Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
[Cu(NH3) 4]2+ +2OH—+4H2O
[Co(NH3)2(en)2](NO3)3 配位数6
*中心离子的电荷高,对配位体的吸引力较强,有 利于形成配位数较高的配合物。 *中心离子半径越大,其周围可容纳配体就越多, 配位数越大。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 2
+3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
用二、三、四等数字表示配位体数。不同配位名 称之间用圆点“·”分开。 阴离子次序为:简单 离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
-
11
1.配位阴离子配合物--配位阴离子“酸”外
界K2[SiF6]
六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)]
五氯·一氨合铂(Ⅳ)酸钾
-
13
形成配合物时性质的改变
1、颜色的改变 Fe3+ + nNCS- == [Fe(NCS)n](n-3)-
2、溶解度的改变: AgCl + HCl =[AgCl2]- + H+ AgCl + 2NH3 == [Ag(NH3)2]+ + ClAu + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
选修三配位化合物课件

6. 配合物的应用
叶绿素—含镁的化合物 血红蛋白——含亚铁的配合物
a 在生命体中的应用 酶 含锌的配合物
含锌酶有80多种 维生素B12 钴配合物
b 在医药中的应用 抗癌药物二代铂类抗癌药
c 配合物与生物固氮 固氮酶
王照水相溶技金术的定H影[AuCl4]
d 在生产生活中的应用 电解氧化铝的助熔剂
Na3[AlF6]
中心原子 配位体 配位数 相关说明: ①中心原子:也称配位体的形成体,一般是带 正电荷的阳离子,主要是过渡金属的阳离子, 但也有中性原子。如:Ni(CO)5、Fe(CO)5中的 Ni和Fe都是中性原子
②配位体:配位体可以是阴离子,如X-、OH-、SCN-、 CN-、C2O42-、PO43-等;也可以是中性分子,如H2O、 NH3、CO、醇、胺、醚等。配位体中直接同中心原子 配合的原子叫做配位原子。配位原子是必须含有孤对电 子的原子,如NH3中的N原子,H2O分子中的O原子,配 位原子常是VA、VIA、VIIA主族元素的原子。
B CaOCl2 D Mg2(OH)2CO3
5.配合物的命名
内界命名顺序:自右向左
[Zn配(N位H3体)2]数SO(4即内配界位名体称右为下:角的数字)——配位体名 ,
K3称中[F心—e(离—CN子“合)6的]”内化字界合或名价“称。络为”字——中心离子的名称——
,
二氨合锌离子
[Zn(NH3)4]Cl2 命名为
③配位数:直接同中心原子(或离子)配位的原子(离 子或分子)总的数目。一般中心原子(或离子)的配位 数为2、4、6、8。在计算中心离子的配位数时,一般 是先在配离子中找出中心离子和配位体,接着找出配位 原子数目。如: [Co(NH3)4Cl2]Cl配位数是6。
选修三 配位化合物共41页文档

选修三 配位化合物
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个பைடு நூலகம்代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
