Friedel-Crafts
傅克反应资料讲解

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
第一节 碳原子上的酰基化反应一芳环上的碳酰基化1 Fried.

另一种方法是用一氧化碳和氯化氢在催化 剂三氯化铝、氯化亚酮存在下,与芳环反 应,使芳环上引入一甲酰基。此法被称作 一氧化碳法,或称Cattermann---Koch 反应。
该反应主要用于烷基苯、烷基联苯等具推 电子基取代的芳甲醛的合成。胺基取代苯, 基化学性质太活泼,易在该反应条件下与 生成的芳醛缩合成三芳基甲烷衍生物[63]。 单取代的烷基苯在进行甲酰化时,几乎全 部生成对位产物。该法不适用于酚及酚醚 的甲酰化。
与烷基化反应不同的是酰基化反应在进行 一元取代后,就可以停止下来(烷基化反 应很容易生成多元取代物)。所以, Friedel—Crafts反应合成芳酮比合成芳烃 更为有利,产品易纯化。 多π电子的杂环,如呋喃、噻吩、吡咯等, 容易进行酰基化反应:缺π电子的杂环`, 如吡啶、嘧啶等,则很难进行酰化反应。
反应所用催化剂除以AlCl3作主催化剂,还 要加辅助催化剂如CuCl、NiCl2、CoCl2、 TiCl4等。反应一般在常压下进行,产率在 30~50%之间,若在加压[以 3.5Mpa(35大气压)左右为宜]下进行, 产率可提高到80~90%。温度一般以 25~30℃为宜。
(2) Vilsmeier反应
二元酸酐可制备芳酰脂肪酸,该 酸经锌汞齐—盐酸还原可得芳基 长链羧酸,接着进行分子内酰化 即得环酮。
羧酸可以直接用作酰化剂,但不 宜用三氯化铝作催化剂,一般用 硫酸、磷酸,最好是氟化氢。 酯也可以用作酰化剂,但用得较 少。
B. 被酰化物的结构
取代芳环的酰基化反应定位按下列规律进 行:当芳环上具有邻、对位定位基时,酰 基主要进入原有取代基的对位,若对位被 占据,则进入邻位。
Vilsmeier反应最常用的催化剂是POCl3 其它如 CoCl2、ZnCl2、SOCl2、Ac2O、 (COCl)2等也可用作催化剂。氮取代甲酰 胺可以是单取代或双取代烷基衍生物、其 烃基衍生物、N-甲基甲酰基苯胺、N-甲 酰基哌啶等。
傅克反应与聚芳醚-砜-酮

傅-克反应,又称傅列德尔-克拉夫茨反应(Friedel –Crafts reaction ),由法国化学家查尔斯•傅列德尔与美国化学家詹姆斯•克拉夫茨于1877年,共同发现,是一类针对芳香族的亲电取代反应。
根据取代物的不同,该反应主要分为傅列德尔-克拉夫茨烷基化反应和傅列德尔-克拉夫茨酰基化反应。
由于傅-克反应是实现碳碳成键的最有效方式之一,并且是制备各种芳基酮, 杂环芳烃酮等的重要手段, 所以它在医药、农药、染料、香料等工业生产中具有非常广泛的应用。
在聚合物合成上与之相关的是一类高性能工程材料,聚(醚)砜和聚(醚)酮。
1962年,Dupont 公司的Bonner ,首次采用傅克反应合成了聚醚酮酮(PEKK )。
傅克反应机理如下所示:S O OCl CO ClO O AlCl 4+CO AlCl 3O -HS O O聚(醚)砜和聚(醚)酮类聚合物按傅克亲电取代路线合成时,由于所用单体大多来源方便、价格低廉,而且合成反应容易控制,不需要高温和真空条件,反应条件温和,因此聚合物大多成本低,容易得到推广应用。
一般反应条件为在无水AlCl 3和N ,N-二甲基甲酰胺(DMF )存在下,于1,2-二氯乙烷(DCE )中进行低温(冰水浴)共缩聚反应。
然而,聚合过程中被带正电荷的亲电试剂进攻的苯环上的5个氢具有相等的活性,尽管由于空间位阻的作用对位的氢最易于脱去,然而其他的氢仍有可能被亲电试剂进攻,这样就必然得到有一定程度支化和交联的聚合物。
支化、交联反应一般会降低树脂的性能,导致高温流动性差,冲击强度低,脆性大,后加工困难等。
在支化、交联严重时,将得不到具有使用价值的反应产物。
名称结构式醚/酮Tg Tm PEEEK 3/1 129 342 PEEK 2/1 145 335 PEEKEK 3/2 148 345 PEK 1/1 152 365 PEEKK 1/1 150 365 PEKK 1/2 165 388 PEKEKK 1/3 160 384羰基较之醚键更不易旋转,当羰基含量增加使得聚合物的链段运动受阻程度增加,因此,在可加工允许的温度范围内增加羰基含量,可以提高聚合物的使用温度。
傅克反应-PPT

注意几点
(1)当使用含三个或三个以上碳原子的烷基化试剂时,会生成多种 异构产物,主要原因是烷基正离子发生重排的结果。例如苯与1-氯 丙烷反应,得到的主产物是异丙苯而不是正丙苯。
(2)烷基化反应不容易停留在一取代阶段,通常在反应中有多烷基 苯生成。这是因为取代的烷基使苯环上的电子云密度增大,增强了 苯环的反应活性。
三、Friedel–Crafts 酰基化反应
定义:羧酸和羧酸衍生物在Lewis酸或质子酸的催化下,对芳烃进行亲电取 代生成芳酮的反应,称为Friedel–Crafts 酰基化反应。 酰化剂:常用的酰基化试剂是酰卤(主要为酰氯、酰溴)和酸酐。 ①酰卤的反应活性顺序如下: R-CO-I˃R-CO-Br˃R-CO-Cl ②酸酐也是很好的酰化剂,但是它需要比酰卤多50%的氯化铝。 ③羧酸也可以直接用作酰化剂,但是催化剂不宜选用氯化铝,而要用硫酸, 磷酸,最好是氟化氢。
HF˃H2SO4˃P2O5˃H3PO4 ③当用烯类、醇类作为烷基化试剂时,催化剂用BF3和HF效果最 好。
④在某些反应中,不同催化剂,产生不同的产物。 例如,3-氯丙烯,由于有两个不同的反应基团,催化剂对这两个基 团的活泼性,各不相同,它们能产生不同的产物:
大家应该也有点累了,稍作休息
大家有疑问的,可以询问和交流
被酰化物:包括各种电子云密度较高的取代芳环、芳杂环类化 合物。 催化剂:包括Lewis酸(如AlCl3、SnCl4、BF3、ZnCl2)或质子酸。 反应的溶剂:一般为醚类、卤代烷类、苯及其同系物、乙酸乙 酯等。
反应机理
酰化剂在催化剂的作用下生成活性中间体-碳正离子,由正离子攻 击电子密度较大的芳环,取代氢原子,形成芳酮和氢离子。
催化剂:常用的催化剂可分为两大类。 一类是Lewis酸,主要为金属卤化物,其中AlCl3最常用,也是催化活
傅克酰基化反应基理

傅克酰基化反应基理
Friedel-Crafts酰基化反应,简称傅-克酰基化反应,是一种傅-克反应。
在质子酸或路易斯酸(如三氯化铝)催化下,芳香性化合物与酰卤或酸酐发生的亲电子取代反应,为一改良的亲电子取代反应。
傅-克酰基化反应的出现,主要是为了合成的用途,因为烷基在进行取代反应形成碳阳离子容易进行重排,但是酰化反应中形成的酰阳离子(acylium ion)并不会发生重排现象,因为酰阳离子有个很重要的共振结构,而酰阳离子就会借着共振来稳定,才不会形成碳阳离子重排,因此傅-克酰化反应有个很重要的用途就是避免碳阳离子发生重排,再经由Clemmensen还原反应或Wolff-Kishner还原反应,消除酰基上的氧得到烷基,此过程也称傅-克烷基化反应。
傅克反应

傅克反应傅-克反应傅-克(傅瑞德尔-克拉夫茨)反应:芳香烃在无水AlCl3作用下,环上的氢原子也能被烷基和酰基所取代。
这是一个制备烷基烃和芳香酮的方法,称为Friedel —Crafts反应,简称傅-克反应。
苯环上有强吸电子基(如-NO2 、-SO3H 、-COR)时,不发生傅-克反应。
a、烷基化反应:卤代烷在AlCl3的作用下生成C+,C+在进攻苯环之前会发生重排成稳定的C+(三个C以上)烷基化反应的缺点是副反应的发生b、硝基化反应:常用的硝基化试剂是酰卤,此外还可以用酸酐。
优点是产物较纯。
一般用Clemmensen还原法可以得到丙苯。
济南盛信达科技有限公司燕山学院工作室最新招聘信息加入时间:2008-3-13 11:24:44单位信息单位名称:济南盛信达科技有限公司单位所在地:山东省济南市高新区成立时间:单位性质:其他企业所属行业:制造业单位简介济南盛信达科技有限公司,国家重点高新技术企业,具有自营进出口权。
为外向型科集研发、外贸、营销于一体.公司几大产品均为国内首创或专利产品。
公司先后获得“国省高新技术企业”等荣誉称号。
---------------------------------------------------------------------------职位信息职位名称:其它科研人员类职位招聘时间: 2008-03-13 至 2008-05-20招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:家在济南优先专业要求:应用化学------------------------------------------------------------------------职位名称:企业后勤管理招聘时间: 2008-03-13 至 2008-04-10招聘人数: 1 工作经验:工作地点:山东省济南市职位描述:专业要求:工商企业管理------------------------------------------------------------------------职位名称:企业/业务发展经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:专业要求:植物保护------------------------------------------------------------------------职位名称:客户经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 3 工作经验:工作地点:山东省济南市职位描述:专业要求:农学山东先达化工(集团)有限公司成立于1998年,系国家农药生产定点企业,国家重点高新技术企业,已通过ISO9001:2000国际质量管理体系认证,具有自营进出口权,为外向型科技型企业,也是亚洲最大的咪唑啉酮类除草剂(咪草烟、灭草喹、灭草烟)生产厂家。
傅克反应

傅克反应傅-克反应傅-克(傅瑞德尔-克拉夫茨)反应:芳香烃在无水AlCl3作用下,环上的氢原子也能被烷基和酰基所取代。
这是一个制备烷基烃和芳香酮的方法,称为Friedel—Crafts反应,简称傅-克反应。
苯环上有强吸电子基(如-NO2 、-SO3H 、-COR)时,不发生傅-克反应。
a、烷基化反应:卤代烷在 AlCl3的作用下生成C+, C+在进攻苯环之前会发生重排成稳定的C+(三个C以上)烷基化反应的缺点是副反应的发生b、硝基化反应:常用的硝基化试剂是酰卤,此外还可以用酸酐。
优点是产物较纯。
一般用Clemmensen还原法可以得到丙苯。
济南盛信达科技有限公司燕山学院工作室最新招聘信息加入时间:2008-3-13 11:24:44单位信息单位名称:济南盛信达科技有限公司单位所在地:山东省济南市高新区成立时间:单位性质:其他企业所属行业:制造业单位简介济南盛信达科技有限公司,国家重点高新技术企业,具有自营进出口权。
为外向型集研发、外贸、营销于一体.公司几大产品均为国内首创或专利产品。
公司先后获得“国高新技术企业”等荣誉称号。
---------------------------------------------------------------------------职位信息职位名称:其它科研人员类职位招聘时间: 2008-03-13 至 2008-05-20招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:家在济南优先专业要求:应用化学----------------------------------------------------------------------职位名称:企业后勤管理招聘时间: 2008-03-13 至 2008-04-10招聘人数: 1 工作经验:工作地点:山东省济南市职位描述:专业要求:工商企业管理----------------------------------------------------------------------职位名称:企业/业务发展经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:专业要求:植物保护----------------------------------------------------------------------职位名称:客户经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 3 工作经验:工作地点:山东省济南市职位描述:专业要求:农学山东先达化工(集团)有限公司成立于1998年,系国家农药生产定点企业,国家重点高新技术企业,已通过ISO9001:2000国际质量管理体系认证,具有自营进出口权,为外向型科技型企业,也是亚洲最大的咪唑啉酮类除草剂(咪草烟、灭草喹、灭草烟)生产厂家。
苯丙酮的合成

苯丙酮的合成
苯丙酮是一种常用的有机化合物,广泛应用于药物、香料、染料等领域。
它的合成方法有多种,以下是其中几种常见的方法:
1. Friedel-Crafts反应法:将苯和丙酮在氯化铝催化下反应,生成苯丙酮。
这种方法简单易行,但是需要使用氯化铝等有毒物质,同时产生大量的废弃物,对环境有较大的污染。
2. Wacker氧化法:将苯乙烯在氧气和PdCl2催化下氧化,生成苯丙酮。
这种方法需要使用昂贵的催化剂,同时反应条件比较苛刻,需要高压高温,反应后需要进行复杂的分离和提纯。
3. 芳香族羰基化反应法:将苯和丙酮在铜催化下反应,生成苯丙酮。
这种方法不需要高压高温,且催化剂易得,但是反应选择性不高,产物往往混杂有其他杂质。
4. 异丙酮羧酸酯法:将苯和异丙酮羧酸酯在碱催化下反应,生成苯丙酮。
这种方法反应条件温和,反应产物纯度高,但是需要使用异丙酮羧酸酯这种不太常见的试剂。
除了以上几种方法,还有一些新型的合成方法正在不断研究和发展,如光催化合成、电化学合成等。
总的来说,苯丙酮的合成方法多种多样,不同的方法适用于不同的实际应用场景,需要根据实际情况进行选择。
- 1 -。
friedel-crafts反应

friedel-crafts反应
傅克反应即为Friedel-Crafts 反应,是1877年指由法国化学家Friede 和美国化学家Crafts 发现的制备烷基苯和芳酮的的反应。
卤代烷在催化剂路易斯酸[ AlX3,FeX3 ]的存在下,与芳烃发生取代反应,生成烷基苯的反应,统称为傅克烷基化反应。
反应要求
不同的烷基化试剂和酰基化试剂需要不同的催化剂,其活性也有变化;同样,芳香性化合物的结构不同,需要的催化剂也不同。
也就是说,试剂、芳香性化合物、催化剂三者要匹配才是一个好的催化反应。
三氯化铝是常用的有效的催化剂。
不同的反应需要催化剂的量也不同,取决于烷基化试剂和酰基化试剂的种类。
在酰基化反应中,酰基化试剂和产物芳酮中都含有羰基,能与催化剂配合,形成稳定的配合物,因此需要催化剂的量至少比酰基化试剂的量多才行。
有的副产物还需要消耗催化剂,进行制备反应时必须考虑催化剂的合理用量。
此外,这类催化剂极易吸水、水解或形成配合物而失去催化作用。
有机化学基础知识点整理芳香化合物的合成方法

有机化学基础知识点整理芳香化合物的合成方法芳香化合物是有机化学中重要的一类化合物,广泛应用于药物、农药、染料等领域。
本文将对芳香化合物的合成方法进行整理,包括苯环的合成、雪碧儿反应、Friedel-Crafts反应等。
一、苯环的合成苯环是芳香化合物的基础结构,其合成方法多种多样。
常见的合成方法有以下几种:1. 从底物脱水合成:通过脱水反应,使得两个官能团之间的氢、氧、氮等原子失去,形成苯环结构。
2. 芳香亲电取代反应:芳香化合物可以与亲电试剂发生反应,将亲电试剂中的部分原子或基团取代苯环中的氢原子。
3. 氧化合成:通过氧化反应,将芳烴类化合物氧化形成苯环结构。
4. 加成反应:将烯烃或炔烃与合适的试剂反应,发生加成反应生成苯环。
二、雪碧儿反应雪碧儿反应是一种典型的芳香化合物合成方法,常用于合成带有芳香环的物质。
雪碧儿反应的步骤如下:1. 首先,将甲苯或苯胺与硝酸混合,在硝化剂的催化下发生硝化反应,生成硝基苯或硝基苯胺。
2. 然后,将硝基苯或硝基苯胺与浓硫酸混合,发生亲电取代反应,生成间位取代的硝化芳香化合物。
3. 最后,将硝基芳香化合物与亲电试剂反应,发生脱氧反应,生成目标芳香化合物。
三、Friedel-Crafts反应Friedel-Crafts反应是另一种常用的芳香化合物合成方法,适用于含有活泼氢的底物。
Friedel-Crafts反应的步骤如下:1. 将底物与卤代烷或酰卤发生作用,生成碳正离子。
2. 碳正离子与阴离子反应,发生亲电取代反应,生成取代的芳香化合物。
3. 通过水解或其他方法,将引入的基团转化为需要的功能基团。
四、其他合成方法除了以上介绍的合成方法,还有许多其他合成芳香化合物的方法,例如:1. Ullmann偶联反应:通过铜催化剂催化,将两个取代芳香环反应合成新的芳香环。
2. 甲基化反应:通过亲电试剂甲基化芳香化合物,引入甲基基团。
3. 还原反应:通过还原剂将含有杂原子的芳香化合物进行还原,得到目标分子。
吲哚啉结构式-概述说明以及解释

吲哚啉结构式-概述说明以及解释1.引言1.1 概述吲哚啉是一种含氮杂环化合物,其分子结构中包含有一个五元杂环,由四个碳原子和一个氮原子组成。
它是一种非常重要和广泛存在于天然产物和药物中的化合物。
吲哚啉具有独特的化学性质和生物活性,因此备受研究人员的关注。
吲哚啉的结构特点主要体现在其分子的稳定性和反应活性上。
其分子中的杂环结构赋予了它较高的稳定性,使吲哚啉在化学反应中表现出良好的抗干扰性。
同时,吲哚啉还含有一对孤对电子,使其能够与其他化合物形成氢键、配位键等相互作用,从而参与多种反应过程。
吲哚啉的合成方法主要包括氮杂二环化合物的合成和气相碳-氮烯的环化反应。
其中,氮杂二环化合物的合成通过氮杂二环化合物的氨基化和硝化反应来实现。
而气相碳-氮烯的环化反应则能够通过合适的催化剂和反应条件来实现吲哚啉的高效合成。
吲哚啉在许多领域具有广泛的应用价值。
首先,在医药领域,吲哚啉及其衍生物被广泛应用于药物的合成和药效的研究中。
其特殊的结构和活性使其成为药物研发中不可或缺的重要组成部分。
其次,在有机合成领域,吲哚啉作为一个重要的中间体,被广泛用于有机化合物的构建和合成过程中。
此外,吲哚啉还被应用于光学材料、配合物合成和生物标记等领域。
基于吲哚啉的特殊结构和广泛的应用前景,未来吲哚啉的研究发展前景广阔。
通过进一步的研究和改进合成方法,可以提高吲哚啉的产率和纯度,从而扩大其应用范围。
同时,研究人员还可以利用吲哚啉的结构来设计和合成新的功能化合物,为多个领域的科学研究和应用提供有力支持。
综上所述,吲哚啉作为一种重要的含氮杂环化合物,在化学和生物领域具有广泛的应用价值。
通过深入研究其合成方法和性质特点,可以为其应用开发提供更多的可能性,为人类社会的发展做出更多的贡献。
1.2文章结构1.2 文章结构本文主要围绕吲哚啉的定义、结构特点和合成方法展开,旨在全面介绍吲哚啉这一化学物质的基本知识。
具体来说,本文分为三个部分,即引言、正文和结论。
friedel crafts反应机理

friedel crafts反应机理摘要:1.Friedel-Crafts反应简介2.Friedel-Crafts酰化反应机理3.反应条件及试剂作用4.应用及实例5.总结与学习建议正文:Friedel-Crafts反应是一种有机化学中的重要反应类型,主要包括Friedel-Crafts酰化反应、Friedel-Crafts烷基化反应和Friedel-Crafts芳香烃合成反应。
其中,Friedel-Crafts酰化反应在有机合成领域具有广泛的应用。
Friedel-Crafts酰化反应是指在催化剂的作用下,烷基或芳香基与酰氯或酸酐发生反应,生成相应的酰基化合物的过程。
反应机理主要包括以下步骤:1.催化剂的活化:催化剂(如铝卤化物)与反应物分子发生作用,形成活性中间体。
2.酰基正离子的生成:在催化剂的作用下,酰氯或酸酐分子失去Cl或CO2,形成酰基正离子。
3.烷基或芳香基与酰基正离子的反应:在适当的条件下,烷基或芳香基与酰基正离子发生反应,生成酰基化合物。
4.产物的形成:反应生成的酰基化合物经过进一步的转化,最终形成目标产物。
在Friedel-Crafts酰化反应中,反应条件及试剂的作用至关重要。
催化剂如铝卤化物可以提高反应的速率和选择性;反应溶剂可以影响反应的活性和产物的溶解度;反应温度和压力也会影响反应的进行。
Friedel-Crafts酰化反应在有机合成中的应用十分广泛,例如,通过该反应可以合成具有重要生物活性的化合物,如药物、香料等。
此外,该反应还可以用于制备高分子材料、涂料等。
在学习Friedel-Crafts反应时,我们需要掌握以下几点:1.了解反应的反应物、生成物和催化剂。
2.熟悉反应的反应条件和试剂作用。
3.掌握反应机理,特别是酰基正离子的生成和反应过程。
4.学会运用Friedel-Crafts反应进行有机合成。
总之,Friedel-Crafts反应是一种具有重要应用价值的有机化学反应。
傅克烷基化反应

傅克烷基化反应
傅克反应烷基化反应机理:首先在催化剂的作用下产生烷基碳正离子,它作为亲和试剂向苯环进攻,形成碳正离子,然后失去一个质子生成烷基苯。
该反应的缺点是经常会生成多取代以及重排的副产物。
在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应,称为傅列德尔一克拉夫茨烷基化反应(friedel-crafts alkylation);芳烃与酰卤或酸酐作用,芳环上的氢原子被酰基取代,生成芳酮的反应,称为傅列德尔~克拉夫茨酰基化反应(friedel-crafts acylation)。
傅列德尔克拉夫茨反应,是烷基化与酰基化反应,统称傅列德尔克拉夫茨反应简称傅克反应。
在烷基化反应中,反应并不暂停在一烷基化阶段,由于分解成的烷基苯比苯不易烷基化,还可以分解成多烷基替代的芳烃。
以苯的乙基化成基准,除乙苯外,还分解成二乙苯和三乙苯等。
如果重新加入过量的苯,则可以提升乙苯的产率,遏制多乙苯的分解成,这是因为傅列德尔-克拉夫茨烷基化反应就是可逆反应。
傅克反应

傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅克反应
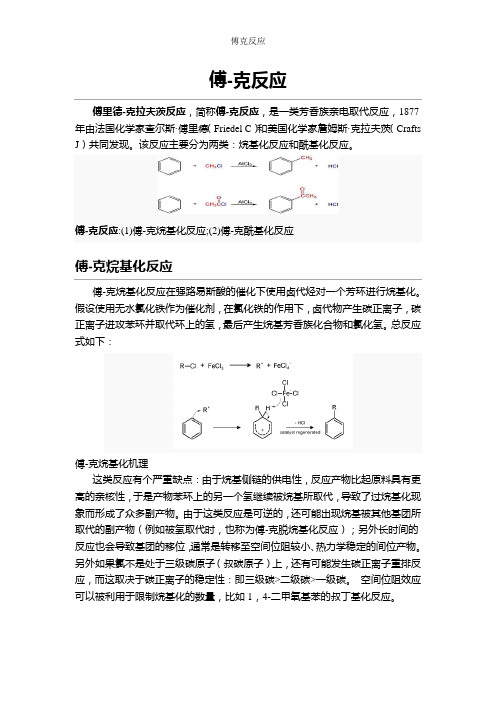
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
friedel-crafts烷基化反应的特点

friedel-crafts烷基化反应的特点
Friedel-Crafts烷基化反应是一种重要的有机合成反应,其特点如下:
1. Friedel-Crafts烷基化反应是一种亲电取代反应,其中一个
芳香环上的氢被一个烷基基团取代。
2. 该反应需有路易斯酸(如氯化铝或氯化铁)的催化,以激活亲电体(如烷基卤化物)。
3. 芳香环必须是反应中的活性基质,因为亲电体在反应中被路易斯酸
活化后,会与活性芳香化合物发生烷基化反应。
4. Friedel-Crafts烷基化反应可以在常温下进行,相当容易控制反应的条件,但反应速度较慢。
5. 该反应可在惰性溶剂中进行,如氯代烃、二氯甲烷等。
6. Friedel-Crafts烷基化反应适用于多种芳香化合物,包括苯、甲苯、醛和酮等。
7. 该反应可选择性地进行单烷基化或多烷基化,取决于所使用的亲电
体和反应条件。
8. Friedel-Crafts烷基化反应常用于合成药物、香料和染料等有机化合物。
friedel-crafts酰化反应机理

friedel-crafts酰化反应机理
Friedel-Crafts酰化反应是一种芳香族化学反应,用于合成芳香酰基化合物。
通常,该反应由芳香化合物和酸氯化物(如卤化铝)在芳烃溶液中反应而成。
反应过程中,酸氯化物作为路易斯酸催化剂,帮助加速反应。
机理:
1. 卤化铝作为Lewis酸接受芳香化合物中的π键上的一个电子对形成芳香质子。
2. 酸中的C=O键中的δ+电子受到芳香质子的引力而向里收缩,形成求核碳原子,开始进攻π键,形成了中间体(中间产物)。
3. 与中间体发生反应的质子从酸中引起离去,重新形成了路易斯酸,循环起来作为反应的催化剂。
4. 中间体通过质子化裂解得到酰基芳香化合物,并释放路易斯酸。
总反应:
Ar-H + R-COCl → Ar-COR + HCl
其中Ar代表芳香环,R代表一种电子富集的基团(如甲基、叔丁基等)。
傅克反应
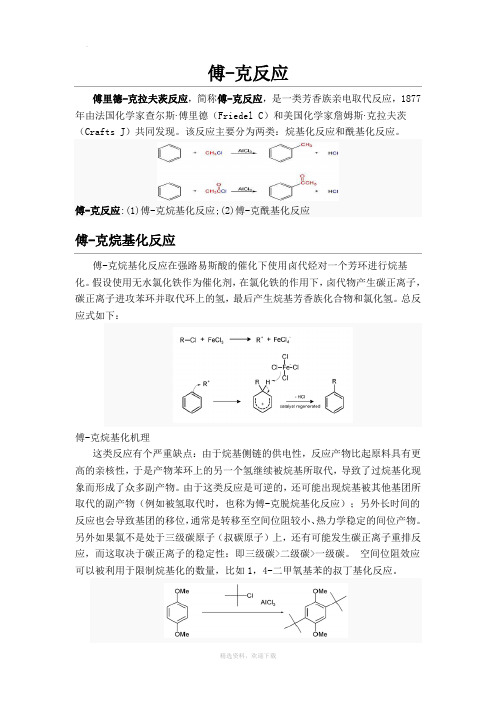
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
苯甲醛的合成方法

苯甲醛的合成方法
苯甲醛的合成方法有多种,以下列举一种常见的方法:
1. Friedel-Crafts酰基化反应:将苯和甲酸酐在Lewis酸存在下进行反应,生成苯甲酰氯。
然后,将苯甲酰氯与碱反应,生成苯甲醛。
2. Rosenmund反应:首先以氯化钯或其它钯盐为催化剂,将苯硼酸与卤代酸酐在氢气存在下加热反应,生成苯甲醛。
3. 氧化反应:苯甲醛可以通过氧化苯甲烷或苯甲醚来合成。
常用的氧化剂有氯化银、氯化铜等。
4. Rosenmund-Von Braun反应:将氯甲酸铂作为催化剂,用氢气加热催化下使三苯甲腈氢化成苯甲醛。
这些方法仅为常用的一些方法,还有其他合成方法可以得到苯甲醛。
不同合成方法的选择取决于实际需求和条件。
傅克酰基化 危险工艺

傅克酰基化危险工艺傅克酰基化(Friedel-Crafts acylation)是一种危险工艺,用于合成化合物中的酰基衍生物。
它是由法国化学家Charles Friedel和James Crafts于1877年首次提出的一种重要的有机合成方法。
傅克酰基化通常使用强酸作为催化剂,如氯化铝或氯化亚铁,并且需要高温和高压条件下进行。
虽然这种化学反应在有机合成中具有广泛应用,并且可以用于制备各种重要的化学物质,但它也存在一定的危险性。
首先,傅克酰基化涉及使用强酸作为催化剂。
这些强酸具有腐蚀性,并且对皮肤和眼睛有害。
如果在操作过程中发生泄漏或溅入皮肤和眼睛,可能会导致灼伤和严重的伤害。
因此,在进行傅克酰基化反应时,必须采取适当的安全措施,如佩戴防护眼镜和手套,并确保实验室通风良好以避免酸性腐蚀物的吸入。
其次,傅克酰基化通常需要高温和高压条件下进行。
在这些条件下,反应体系可能会产生高压气体。
如果控制不当,压力可能会突然升高,导致容器爆炸。
此外,高温条件下的反应还可能引发火灾风险。
因此,在进行傅克酰基化实验时,必须选择适用的反应器和操作条件,并严格控制反应体系的温度和压力。
此外,傅克酰基化反应还涉及使用有机溶剂。
有机溶剂在高温下易燃,且对人体有一定的毒性。
因此,在进行傅克酰基化反应时,必须采取防火措施,并确保实验室通风良好以避免有机溶剂蒸气的积聚。
另一个需要注意的是,傅克酰基化反应的产物可能对人体具有一定的毒性。
例如,苯乙酸衍生物是常见的傅克酰基化产物之一。
这些化合物在接触时可以引起过敏反应,甚至对某些人可能导致严重的健康问题。
因此,在操作傅克酰基化反应时,必须采取适当的个人防护措施,如佩戴呼吸器和防护服,以减少对危险化合物的接触。
综上所述,傅克酰基化是一种危险的工艺,需要在严格的安全条件下进行。
操作者必须具备相应的安全知识和技能,并且必须严格遵守实验室安全规程。
只有在经过适当的培训和指导后,才能安全地进行傅克酰基化过程,以保证实验的顺利进行,并确保人员和环境的安全。
