140711 miR21 Realtime PCR 检测报告
pcr技术实验报告结果分析

pcr技术实验报告结果分析PCR 技术实验报告结果分析PCR 技术,即聚合酶链式反应(Polymerase Chain Reaction),是一种在分子生物学领域广泛应用的强大工具。
通过这一技术,我们能够在短时间内大量扩增特定的 DNA 片段,从而为各种研究和应用提供了极大的便利。
在本次实验中,我们运用 PCR 技术对特定的基因片段进行了扩增,并对实验结果进行了详细的分析。
一、实验目的本次PCR 实验的主要目的是检测样本中是否存在特定的基因序列,并对其进行定量分析。
二、实验材料与方法(一)实验材料1、样本 DNA:从_____中提取的基因组 DNA。
2、引物:根据目标基因序列设计的特异性引物。
3、 PCR 试剂:包括 DNA 聚合酶、dNTPs、缓冲液等。
(二)实验方法1、 PCR 反应体系的配制:按照试剂说明书,将样本 DNA、引物、PCR 试剂等加入到反应管中,配制成总体积为_____μL 的反应体系。
2、 PCR 反应条件的设置:经过多次预实验优化,确定了以下反应条件:95°C 预变性_____分钟;95°C 变性_____秒,_____°C 退火_____秒,72°C 延伸_____秒,共进行_____个循环;72°C 终延伸_____分钟。
三、实验结果(一)琼脂糖凝胶电泳结果将 PCR 产物进行琼脂糖凝胶电泳,在紫外灯下观察到了明显的条带。
其中,阳性对照样本显示出了预期大小的条带,而阴性对照样本则没有条带出现。
实验样本中,部分样本出现了与阳性对照相同大小的条带,表明这些样本中存在目标基因序列;而另一些样本则未出现条带,说明其不含目标基因或含量极低。
(二)定量 PCR 结果对于进行定量 PCR 的样本,通过仪器分析得到了每个样本中目标基因的拷贝数。
结果显示,不同样本中目标基因的含量存在显著差异,这可能与样本的来源、处理方式等因素有关。
四、结果分析(一)琼脂糖凝胶电泳结果分析1、阳性对照出现预期条带,说明 PCR 反应体系和反应条件设置正确,实验操作有效。
real time PCR 数据分析

real time PCR 数据分析real-timepcr数据分析无论所使用的real-timepcr是何种型号,正确的数据分析对于获得有效的实验结果都是至关重要的。
这里介绍有关real-timepcr数据分析的知识。
在探讨基本分析过程之前,先了解如何设计一个不好的实验。
如果你就是自己设计的引物和探针,那有利于下一步的工作。
但是在有些情况下,人们采用出版发行文献上的序列可以更便利。
忘记,即便就是出版物提供更多的序列也无法确保可以获得优化的实验结果。
而且排印错误的可能性也须要考量在内。
所以步入实验室之前采用blast对全部序列展开核实保证他们就是恰当的。
下订单前先检察引物和探针的序列和tm值就是实验设计的基本建议。
标准曲线是判断实验质量的重要手段。
使用一个已知的模板,pcr产物,合成的寡核苷酸或转录的rna做个标准曲线能够确定pcr的效率,敏感性,动态范围和其他的参数。
建立标准曲线时使用od260的模板样本。
模板的总量以dna分子的数量来描述,把质量转化为dna含量的公式如下:(质量(克)*阿伏伽德罗常数)每个碱基的平均值质量*模板的长度。
例如,合成70-mer的单链dna,样本质量为0.8*10?-11gm。
代入公式得:(0.8*10?-11*6.023*10?23molecules/mole)330gm/mole/base*70base。
如果使用双链的模板,则碱基的平均质量为660gm/mole/base。
标准曲线采用的模板含量从1*10?7已经开始已连续吸收7次每次吸收10倍,最终获得10个模板拷贝。
这样的浓度有利于获得最低的δrn和最高的ct。
用excel画曲线时以模板数量的对数值为x,ct(cyclethreshold)值y轴。
标准曲线的计算公式如下:y=mx+b。
y就是ct,m是斜率,x=log10templateamount,b=y-intercept。
用斜率排序出来实验效率efficiency【10?(-1/斜率)】-1。
pcr检测实验报告

pcr检测实验报告PCR检测实验报告引言:PCR(聚合酶链式反应)是一种在分子生物学中广泛应用的技术,通过扩增目标DNA片段,使其数量增加到可以被检测的水平。
本实验旨在利用PCR技术对特定基因进行检测,并分析其在不同样本中的表达情况。
实验方法:1. 样本收集:从不同来源的细胞或组织中提取DNA。
本实验选择了人体血液样本,采用血液抽取器获取血液样本。
2. DNA提取:使用商业DNA提取试剂盒,按照说明书的步骤进行DNA提取。
通过离心和洗涤等步骤,获得高质量的DNA样本。
3. PCR反应体系准备:根据实验需要,制备PCR反应液。
反应液中包含DNA 模板、引物、酶和缓冲液等成分。
确保反应体系中各组分的浓度和比例正确。
4. PCR扩增:将PCR反应体系加入PCR仪器中,按照设定的温度和时间程序进行扩增。
PCR反应过程包括变性、退火和延伸等阶段,使目标DNA片段得到扩增。
5. PCR产物检测:将PCR产物进行凝胶电泳分析。
将PCR产物与DNA分子量标准品一同加载到琼脂糖凝胶上,通过电泳分离,观察PCR产物的大小和带电性。
使用紫外线照射,观察凝胶上的DNA条带。
实验结果:通过PCR反应和凝胶电泳分析,我们成功扩增了目标基因的DNA片段,并观察到了相应的DNA条带。
根据凝胶上的条带大小,我们可以初步判断目标基因在不同样本中的表达情况。
讨论:PCR技术在分子生物学研究中具有广泛的应用前景。
通过PCR扩增,可以快速、高效地获取目标基因的大量DNA片段,为后续的测序、克隆和表达研究提供了基础。
本实验中,我们选择了血液样本作为PCR反应的起始材料,这是因为血液中含有丰富的DNA,且采集较为方便。
然而,不同样本的DNA提取过程会存在一定的差异,可能会对PCR反应的结果产生影响。
因此,在实际应用中,需要根据具体样本的特点和实验目的,进行合适的DNA提取方法选择和优化。
此外,在PCR反应中,引物的选择也是至关重要的。
引物的设计应考虑目标基因的特异性,避免与其他非目标基因发生扩增。
RealtimePCR(从原理到实验方法及数据分析)

SYBR Green I作用机理
数量关系
1. 每形成一个DNA双链,就有一定数量的染料结合上去 2. 染料一结合,就产生荧光信号 3. 信号强度与DNA分子总数目成正比
TaqMan探针的FRET
E
TaqMan® Probe R
E
Q
E
R
E
Q
TaqMan作用机理
数量关系
上游引物
3’ 5’
3’ 5’
线性图谱
对数图谱
基线 阈值 Ct值 [DNA]0
什么是阈值?
1. 基线(空白)信号的产生是由于测量的偶然误差引起的。 2. 偶然误差的结果满足对数分布。 3. 阈值 = 基线(背景)信号标准偏差 x 10。 4. 由于测量的偶然误差而导致测得的荧光信号大于阈值的概率小于10-5。 5. 当荧光信号大于阈值时,可以肯定是由于PCR的扩增使得荧光强度得以测量。
实实时时PPCCRR分分析析
绝绝对对定定量量
相相对对定定量量
根据标准曲线 提供数量测量
提供精确的起始材料 相对数量差异
绝对定量与相对定量的定义
• 绝对定量分析用于确定未知样本中某个核酸序列的绝对量值,即通常 所说的拷贝数。
• 相对定量用于测定一个测试样本中目标核酸序列与校正样本中同一序 列表达的相对变化。校正样本可以是一个未经处理的对照或者是在一 个时程研究中处于零时的样本。
T=24hr
IL-2 18S ΔCt 24 9 15 24 10 14 23 11 12
28 10 18
ΔΔCt 0 -1 -3
3
2-ΔΔCt 1.0 2.0 8.0
0.1
Relative Quantity of Expression
pcr检测行业报告

pcr检测行业报告PCR检测行业报告。
PCR(聚合酶链式反应)检测是一种生物技术方法,用于复制DNA片段,从而可以检测和识别特定的基因序列。
PCR检测在医学、生物学、农业等领域有着广泛的应用,成为了现代生物技术领域的重要工具。
本文将对PCR检测行业进行深入分析,包括市场规模、发展趋势、技术革新等方面的内容。
市场规模分析。
PCR检测市场在过去几年中呈现出稳步增长的趋势。
随着生物技术的不断发展和应用领域的不断扩大,对PCR检测的需求也在不断增加。
根据市场研究机构的数据显示,全球PCR检测市场规模在过去几年中保持着每年约5%的增长率,预计未来几年市场规模还将继续扩大。
其中,医学领域对PCR检测的需求最为旺盛,包括临床诊断、疾病筛查、基因检测等方面。
技术革新与发展趋势。
PCR检测技术在过去几十年中得到了快速发展,不断涌现出新的技术和方法。
例如,实时定量PCR(qPCR)技术的应用使得PCR检测结果更加准确和快速,大大提高了检测效率。
此外,高通量PCR技术的出现也使得PCR检测可以同时处理大批样本,满足了高通量检测的需求。
未来,随着基因组学、生物信息学等领域的快速发展,PCR检测技术将会不断向着更快、更准确、更便捷的方向发展。
市场竞争格局分析。
PCR检测市场竞争激烈,主要的竞争者包括生物技术公司、医疗器械公司、实验室设备供应商等。
这些公司不断进行技术创新和产品升级,以满足市场的需求。
此外,全球范围内的市场竞争也在加剧,国际品牌和本土企业之间的竞争愈发激烈。
在这种情况下,企业需要不断提升自身的技术实力和市场竞争力,以在激烈的市场竞争中立于不败之地。
市场发展前景分析。
随着生物技术的不断发展和应用领域的不断扩大,PCR检测市场的发展前景十分广阔。
特别是在医学领域,随着个性化医疗的兴起,对PCR检测的需求将会持续增加。
此外,在农业、环境监测、食品安全等领域,PCR检测也将有着广阔的应用前景。
随着技术的不断创新和市场需求的不断增加,PCR检测市场有望继续保持稳步增长的态势。
PCR的种类及其应用实验报告

PCR的种类及其应用实验报告简介聚合酶链式反应(Polymerase Chain Reaction,PCR)是一种分子生物学技术,可在体外合成大量特定DNA片段。
PCR技术广泛应用于生物医学研究、疾病诊断以及生物工程领域。
本实验旨在探究PCR技术的种类及其应用。
PCR的种类传统PCR传统PCR包括三个主要步骤:变性、引物结合和延伸。
首先,通过高温变性将DNA 双链分离为两条单链DNA。
然后,引物与目标DNA序列的两端结合。
最后,通过DNA 聚合酶的作用,在引物的起始点上合成新的DNA链。
实时定量PCR实时定量PCR(Real-time Quantitative PCR,qPCR)是PCR的一种改进形式,可快速、准确地定量测定 DNA的相对数量。
qPCR使用荧光探针或染料实时监测PCR反应的进程,从而实时测定DNA产物的累积量。
qPCR技术广泛应用于基因表达研究和疾病诊断等领域。
反转录PCR反转录PCR(Reverse Transcription PCR,RT-PCR)是一种结合了反转录和PCR的技术,可将RNA转录成DNA,并进一步进行PCR扩增。
RT-PCR技术常用于研究基因表达,可以测定特定基因的转录水平。
数字PCR数字PCR(Digital PCR,dPCR)是一种对DNA分子进行数字化处理的PCR技术。
这种技术能够准确计算起始DNA分子的数量,而不依赖于外部标准曲线。
dPCR常用于检测低拷贝基因、测定突变频率等。
PCR的应用基因克隆PCR技术在基因克隆中起着关键作用。
通过合成引物,选择性扩增所需基因片段,可以获得大量特定目标DNA。
这些扩增的DNA片段可以用于构建基因表达载体、插入突变或其他基因编辑等实验操作。
疾病诊断PCR技术在疾病诊断中具有重要意义。
通过特定引物扩增病原微生物的DNA或RNA,可以快速检测出疾病的存在。
例如,PCR在检测病毒、细菌感染和遗传疾病等方面广泛应用。
法医学鉴定PCR技术在法医学领域有着重要应用,可以通过扩增可疑样本中目标基因的DNA片段,进行罪犯的DNA鉴定。
医学实验pcr检验实验报告

医学实验pcr检验实验报告标题:PCR检验实验报告引言:PCR(聚合酶链式反应)是一种常用的分子生物学实验技术,用于扩增DNA片段,并能够在非常小的样本中检测RNA或DNA的存在。
本报告旨在介绍PCR 检验实验的原理、步骤和结果分析。
一、实验原理:PCR是通过不断重复三个步骤来扩增DNA片段的方法。
这三个步骤是变性、退火和延伸。
首先将待扩增的DNA样本变性,使其双链DNA分离为两个单链DNA。
然后,通过引物(primer)与DNA单链的互补序列结合,使引物与DNA序列配对。
最后,使用DNA聚合酶在引物的指导下合成新的DNA链。
通过不断重复这三个步骤,可以在很短的时间内扩增出大量的特定DNA片段。
二、实验步骤:1. DNA提取:从待检测的样本中提取DNA,常用的DNA提取方法包括酚/氯仿法、热沉淀法等。
2. 反应体系配置:根据实验需求,在试管中配置PCR反应体系,包括DNA模板、引物、酶、缓冲液等。
3. PCR反应:使用热循环仪进行PCR反应,设置好反应的温度和时间,常见的PCR程序一般包括初始变性、循环变性、退火和延伸等步骤。
4. 凝胶电泳:将PCR反应体系中的产物进行凝胶电泳分析,以确定扩增的DNA 片段大小和纯度。
三、实验结果分析:1. 扩增曲线分析:观察PCR反应的扩增曲线,根据曲线形状和峰值大小判断PCR反应的效果。
2. 凝胶电泳结果分析:通过凝胶电泳分析PCR产物,可以确定扩增的DNA片段的大小和数量。
3. 阳性对照和阴性对照:设置阳性对照和阴性对照可以判断PCR反应体系的可靠性和准确性。
结论:PCR是一种常用的分子生物学技术,可以迅速高效地扩增DNA片段。
通过实验原理的介绍和实验步骤的详细说明,我们可以掌握PCR实验的基本操作方法。
实验结果的分析和结论部分,可以根据实际实验情况进行详细的阐述,包括扩增曲线、凝胶电泳结果等。
实验报告的撰写应该科学准确、简明扼要,以便他人能够理解和重复实验。
Real-time PCR数据分析

由于Real-time qPCR 的众多优点,现在已是生命科学领域的一项常规技术。
越来越多的研究文章中涉及RT-PCR 的实验,也基本上被real-time qPCR 所代替。
由于real-time aPCR 输出的数据不同于常规的PCR 电泳检测,不少没有做过real-time qPCR 的研究者往往感到高深莫测,不知从何入手;甚至一些做过次实验的研究者也会对数据处理分析感到迷惑,不知所措。
本文就从real-time qPCR 的发展史说起,包括real-time qPCR 的原理,实验设计,实际操作,数据分析,常见问题解答五个方面,手把手教你从各个方面了解real-time qPCR,彻底的从菜鸟到高手!一、Real-time qPCR 发展史Real-time qPCR 就是在PCR 扩增过程中,通过荧光信号,对PCR 进程进行实时检测。
由于在PCR 扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
由于常规的PCR 的缺点,real-time qPCR 由于其操作简便,灵敏度高,重复性好等优点发展非常迅速。
现在已经涉及到生命科学研究的各个领域,比如基因的差异表达分析,SNP 检测,等位基因的检测,药物开辟,临床诊断,转基因研究等。
在Real-time qPCR 技术的发展过程中,定量PCR 仪的发展起了至关重要的作用。
1995 年,美国PE 公司(已经并入Invitrogen 公司)成功研制了Taqman 技术,1996 年推出了首台荧光定量PCR 检测系统,通过检测每一个循环的荧光强度,通过Ct 值进行数据分析。
从而荧光定量PCR 获得广泛应用。
现在的定量PCR 仪有ABI7000、7300、7500,7700、7900HT、StepOnePlusTM、StepOneTM、PRISM@StepOneTM 系列;BIO-RAD 的CFX96、iCycler iQ5@、MyiQ@、MJ Research Chromo4TM Opticon 系列;Stratagene MxTM 系列;Roche LightCycler@ 系列;Eppendorf Masercycler@;Corbett Rotor-GeneTM;Cepheid SmartCycler@和BIOER 的LineGene 系列。
pcr实验报告结论与心得

pcr实验报告结论与心得
PCR实验报告结论与心得
PCR是分子生物学中非常重要的一项技术,能够在短时间内扩增
目标DNA片段,是很多研究的基础。
在这次实验中,我们学习了PCR
技术的基本原理和实验操作,并通过实验体验了PCR扩增技术的优越性。
一、实验步骤
1.组织细胞诱捕DNA提取
2.PCR扩增反应体系的配置
3.PCR反应程序设定
4.PCR产物分析
二、实验结果
1.获得组织细胞DNA
2.成功扩增目标基因片段
3.得到目标产物,通过凝胶电泳进行分析,并确定所扩增片段的大小。
三、实验结论
1.成功获得组织细胞DNA。
2.通过PCR技术成功扩增目标片段,证明PCR技术的可靠性。
3.凝胶电泳分析结果显示,所扩增片段大小符合预期,且PCR产物的
纯度良好。
4.因此,我们可以得出结论,在本次PCR实验中,我们成功地扩增了
目标片段,并获得了目标产物。
四、实验心得
PCR技术是现代生物学中一项十分重要的技术,它可以在较短时
间内用非常高的灵敏度检测到极低浓度的DNA序列,是分子生物学中
最具实用性的技术之一。
在本次实验中,我们对PCR技术的原理有了
更深入的了解,并且通过实验操作,更真正地认识到PCR技术的优越性。
同时,对PCR实验操作的注意点和技巧也有了更深刻的认识和理
解,这将对今后的科研和实验工作有着重要的参考价值。
总之,本次PCR实验是非常有意义的一次实践活动,能够更好地促进我们对PCR技术的学习和理解,使我们在今后的实验研究中更加得心应手,获得更好的实验结果。
PCR扩增仪校准报告
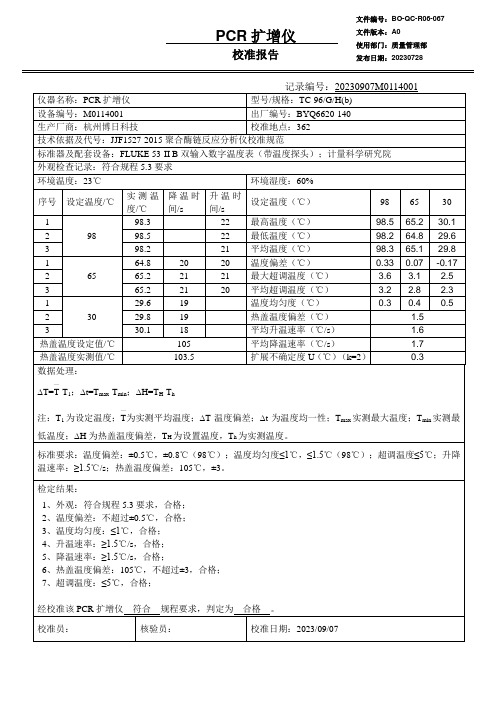
经校准该 PCR 扩增仪 符合 规程要求,判定为 合格 。
校准员:
核验员:
校准日期:2023/09/07
校准地点:362
技术依据及代号:JJF1527-2015 聚合酶链反应分析仪校准规范
标准器及配套设备:FLUKE 53-II B 双输入数字温度表(带温度探头);计量科学研究院
外观检查记录:符合规程 5.3 要求
环境温度:23℃
环境湿度:60%
序号 设定温度/℃
实测温 度/℃
降温时 间/s
升温时 间/s
—
∆T=T-T1;∆t=Tmax-Tmin;∆H=TH-Th
30
30.1 29.6 29.8 -0.17 2.5 2.3 0.5
—
注:T1 为设定温度;T为实测平均温度;∆T 温度偏差;∆t 为温度均一性;Tmax 实测最大温度;Tmin 实测最
低温度;∆H 为热盖温度偏差,TH 为设置温度,Th 为实测温度。
标准要求:温度偏差:±0.5℃,±0.8℃(98℃);温度均匀度≤1℃,≤1.5℃(98℃);超调温度≤5℃;升降 温速率:≥1.5℃/s;热盖温度偏差:105℃,±3。
检定结果:
1、外观:符合规程 5.3 要求,合格; 2、温度偏差:不超过±0.5℃,合格; 3、温度均匀度:≤1℃,合格; 4、升温速率:≥1.5℃/s,合格; 5、降温速率:≥1.5℃/s,合格; 6、热盖温度偏差:105℃,不超过±3,合格; 7、超调温度:≤5℃,合格;
20 平均超调温度(℃)
3.2 2.8
1
29.6
19
-
温度均匀度(℃)
0.3 0.4
2
30
29.8
19
-
谈谈如何分析RealtimePCR的结果

谈谈如何分析RealtimePCR的结果一直瞎白话,作为一名知识分子,好歹也得干点儿正经事,既然做科研,就得严谨,就得实事求是。
言归正传,写点儿如何分析Realtime PCR结果的体会。
为什么想这个呢?我们实验室现在做这个的越来越多,但是看到他们做Presentation时的结果分析的统计图就知道,他们没踏实搞清楚如何去分析结果,就上去糊弄老板了,我曾严肃的当场指出过,但是师姐气得直瞪眼,丫就不明白我是真为她好,我也就懒得跟她纠缠了。
但是作为当代,我国,世界级著名学府(校领导自称的),一流专业(就是没什么人报名,一半是调剂的),牛B 教授(这个是实话)的不用心学生,我还是忍不住要说一说。
关于Realtime PCR的所有情况的结果如何分析,我不都懂,也不想都懂,但是我需要的关于基因表达差异的2-ΔΔCt分析方法,这一点我还是比较清楚的。
原理:其实就是这个公式:X n=X o× (1+E x)nX n,表示n个循环后的分子数;X o,表示初始模板分子数;E x,表示分子扩增效率;n,表示循环数。
首先我们要明白,Realtime PCR的终极目的是要检测其初始模板的量的相对或绝对量(这就是半定量或定量Realtime PCR的区别)。
还有一个最为重要的概念就是Ct值,是指目标扩增产物达到所设定的阈值时所经历循环数。
再回到刚才的公式中,我们可以得到下面的式子:X t = X o× (1+E x)Ctx = K x (1)X t,表示到达阈值时的分子数;K x,是个常数,因为这是人为设定的。
其他同前式。
那么,同理,内参也有一个这样的式子:R t = R o× (1+E x)CtR = K R (2)把结果均一化,所谓均一化就是通过内参的比较,去除加入模板时的人为差异,即(1)除以(2)得出,X t / R t = X o / R o × (1+E x)CtX- CtR = K x / K R进一步推出我们关注的初始模板均一化值:X o / R o = K x / K R × (1+E x)-(CtX - CtR),令CtX - CtR =ΔCt,因此,可得X o / R o = K x / K R × (1+E x)ΔCt(3)至此,我们得到了组内的模板的均一化相对或绝对值,下一步是组间的差异比较。
Realtime PCR检测原理和问题处理

实例1:没有标准曲线
标准品没有填写相应的数值
实例2:没有扩增曲线
原因1:PCR参数设置错误 −数据收集步骤只有一个循环,只收集了一个数据点。
实例2:没有扩增曲线
原因2:硬盘休眠,数据采集中断
实从原例始数3据:找基原因线下滑
−1-9循环,ROX的信号下降
−基线设定4-13范围内,ROX信号值变化,FAM的信号值基本固定; FAM/ROX的校正后,基线不是水平的直线;
一次提取DNA/RNA、一次反应、定量多个基因 要保证信号之间互不干扰
常用的荧光染料
Dye
FAM SGI TET VIC JOE HEX CY3 TAMRA ROX Texas Red CY5
Excitation Maxima (nm)
495 497 521 530 526 540 552 552 585 595 643
Taqman原理
Taqman荧光定量技术是以Taqman荧光探针为 基础,Taqman荧光探针为一寡核苷酸,两端分别标 记一个荧光报告基团和一个荧光淬灭基团。探针完 整时,发射基团发射的荧光信号被淬灭基团吸收; PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切 降解,使荧光发射基团和荧光淬灭基团分离,从而 荧光监测系统可接收到荧光信号,即每扩增一条 DNA链,就有一个荧光分子形成,实现了荧光信号 的累积与PCR产物形成完全同步,从而实现定量。
3、Threshold Cycle (CT值)
4、[DNA]0 (初始模板)
Threshold Cycle (CT值)
Threshold (阈值)
[DNA]0 (初始模板)
基线
反应荧光明显增加前的背景荧光值。默认为 3-15 cycles的信号值
Real-Time_PCR实验流程

Real-Time_PCR实验流程一、RNA 的提取详见 RNA 提取及反转录不同组织样本的 RNA 提取适用不同的提取方法,因为 Real-Time PCR 对 RNA 样品的质量要求较高,所以,正式实验前要选择一款适合自己样品的提取方法,在实验过程中要防止 RNA的降解,保持 RNA 的完整性。
在总 RNA 的提取过程中,注意避免 mRNA 的断裂;取 2ug 进行 RNA 的甲醛变性胶电泳检测,如果存在 DNA 污染时,要用 DNase I 进行消化(因为在处理过程中 RNA 极易降解,建议体系中加入适量 RNA 酶抑制剂)。
二、DNase I 消化样品 RNA 中的 DNA用 DNase I 消化 DNA组份加量模板RNA 10ugRNase Inhibitor 4ulDNase I buffer 10ulDNase I 10ulDEPC 处理 H2O 至 100ul混匀,37℃ 90min三、RNA 琼脂糖凝胶电泳1.1的琼脂糖凝胶电泳凝胶的配制:1)称取琼脂糖 0.45g 放入三角瓶中,向其中加入 4.5ml 的10×MOPS 缓冲液和 39.5ml 的DEPC 水,放微波炉里溶化。
2)待冷却到 60 摄氏度左右时,加入 1ml 甲醛,摇匀(避免产生气泡)。
倒入凝胶板上凝固 30min。
2.取各个 RNA 样品 4l,加入6×RNA 电泳上样缓冲液 2l 混匀,加入变性胶加样孔中。
3.120V 电压下电泳 25min。
用凝胶紫外分析仪观察,照相保存。
4.RNA 电泳结果如下图所示。
可见 28S 和 18S 两条明亮条带,无 DNA 条带污染。
四.RNA 反转录为 cDNA反转录程序以 MBI 的 M-MLV 为例组份加量20ul 体系加量40ul 体系模板RNA 0.12.5ug 3ug根据条带的亮度适当调整引物 T1850uM或其他引物 2.0ul 4.0ulDEPC 处理 H2O 至 12.5ul 至25ul混匀,70℃ 5min,立即冰浴5buffer 4.0ul 8.0uldNTP10mM 2.0ul 4.0ulRNase Inhibitor 0.5ul 1.0ul混匀,37℃ 5minM-MLV 1.0ul 2.0ul42℃ 60mi n ,70℃ 10min反转录引物的选择与 Real-Time PCR 引物设计的要求1)随机六聚体引物:当特定 mRNA 由于含有使反转录酶终止的序列而难以拷贝其全长序列时,可采用随机六聚体引物这一不特异的引物来拷贝全长 mRNA。
Real-Time qPCR实验教程和结果问题分析

Real-Time qPCR实验流程一、①实验前准备,每天早上到实验室后,先把超净工作台的紫外灯打开15-20分钟。
②超净台前做实验,需佩戴干净的橡胶手套/一次性薄膜手套,RNA抽提需带口罩。
③取EP管/枪头时需用镊子,不可以用使用过的手套直接取用。
取完EP管/枪头后,袋子及时封好。
④橡胶手套须放入超净台照射紫外,实验操作过程中不得带出超净台,移液器在一天工作结束后调至最大量程,并用75%乙醇清洁移液器,枪头盒及超净台面。
⑤实验进行的过程中或观看实验时,没有带口罩不要在超净台前讲话。
二、总RNA抽提1)细胞培养皿中细胞样品用1*PBS洗两次后,用1ml枪将PBS吸干净,加入1ml Trizol (invitrogen)溶液,吹打混匀,并吸至1.5ml RNase free EP管中使细胞充分裂解,室温静置5min;组织样品用液氮充分研磨,加入1ml Trizol (Invitro gen)溶液,混匀,室温放置5min使其充分裂解;(管盖与管壁都需标记样品名称)2)加入200μl氯仿,剧烈振荡混匀30s,使水相和有机相充分接触,室温静置3-5min;(离心时离心管按顺序排放,离心完毕,离心管的顺序也按顺序排好,与第一步的顺序一致)3) 4℃下,14,000g离心15min,可见分为三层,RNA在上层水相,移至另一个新的RNase free EP管;(用20-200ul的枪吸取上清,吸上清时,枪头应沿着液面上层吸取上清,枪头不可碰到、吸到中间层)4)沉淀RNA:加入等体积异丙醇,轻柔地充分混匀(颠倒6-8次)(不应用振荡器混匀),室温静置10min;5)4℃下,14,000g离心10min,收集RNA沉淀(如离心后仍不见EP管底部有沉淀,应将EP管放置在-80度冰箱过夜,继续在4℃下,14,000g离心10min,收集RNA 沉淀),去上清;6)用75%乙醇洗涤两次(12,000g离心5min)(加入乙醇后只需轻轻颠倒EP管即可,不用振荡器震荡或枪头吸打沉淀),超净台风干;沉淀不能过干或过湿,过干则不易溶解,过湿则乙醇残留。
PCR验收通过报告

PCR验收通过报告一、项目背景根据贵公司的要求,我们完成了PCR验收通过的工作。
PCR (Polymerase Chain Reaction)是一种在分子生物学和遗传学研究中非常重要的技术,可以在短时间内从少量的DNA样本中扩增出大量的目的DNA片段。
本次验收通过的项目是针对其中一种疾病的检测方法的开发,通过PCR技术能够有效地检测该疾病的患病情况。
二、项目目标本项目的目标是开发一种高效准确的PCR检测方法,能够在短时间内检测出目标疾病的患者。
通过本次项目,我们希望能够提供一种方便、快速、灵敏的PCR检测方法,为疾病的早期诊断和治疗提供可靠的依据。
三、项目内容本项目的主要内容包括PCR方法的优化与建立、试剂的筛选与使用、样本的处理与检测、结果的分析与验证等几个方面。
我们团队通过不断的实验和调整,最终建立了一套有效的PCR检测流程,并且通过大量的样本测试,验证了该方法的准确性和可靠性。
四、方法优化与建立为了提高PCR反应的灵敏度和效率,我们通过调整反应体系的各种因素,如引物浓度、模板DNA浓度、Mg2+浓度等参数,最终确定了最优的反应条件。
我们还优化了PCR循环温度和时间,以确保反应能够在合适的温度和时间范围内进行。
通过这些优化,我们成功地建立了一套高效的PCR 检测方法。
五、试剂的筛选与使用在PCR反应中,试剂的选择对反应的灵敏度和准确性有很大影响。
我们进行了多次试剂的对比实验,最终选择了最适合本项目的试剂,以保证PCR反应的可靠性。
在试剂的使用过程中,我们严格按照厂家提供的说明书进行操作,确保试剂的稳定性和准确性。
六、样本的处理与检测为了确保PCR反应的准确性,对样本的处理十分重要。
我们采集了一定数量的样本,并进行了DNA提取和纯化工作,确保样本中的DNA质量和浓度达到PCR检测的要求。
通过对这些样本的PCR反应和数据分析,我们成功地检测出了目标疾病的患者。
七、结果的分析与验证通过对PCR反应的结果进行分析,我们可以得到一系列数据,包括阳性样本、阴性样本以及对照样本的PCR扩增曲线和结果。
mir报告解读

mir报告解读
MIR报告(Magnetic Resonance Imaging Report,磁共振成像报告)是医学影像检查的一种重要报告,用于帮助医生了解患者体内结构和病变情况。
以下是对MIR报告的一般解读:
报告概述:首先,MIR报告会提供一个概述,简要介绍患者的信息、检查部位和目的。
图像质量:报告中会提及图像的质量,如分辨率、噪声、伪影等。
这些信息有助于医生判断图像的准确性和可靠性。
正常结构描述:在描述病变之前,报告会先描述正常结构的表现,以便与病变进行对比。
病变描述:这是MIR报告的核心部分,会详细描述病变的位置、大小、形状、信号强度等特征。
这些信息有助于医生判断病变的性质和严重程度。
鉴别诊断:基于病变的特征,报告中可能会提出几种可能的诊断,并按照可能性大小进行排序。
医生会根据这些信息,结合患者的临床病史和其他检查结果进行综合判断。
建议和结论:最后,报告会给出针对该病变的建议和结论,如是否需要进一步检查、治疗方案建议等。
需要注意的是,MIR报告只是医生进行诊断的参考依据之一,最终的诊断和治疗方案还需要结合患者的具体情况和医生的临床经验来制定。
因此,患者在收到MIR报告后,应及时向专业医生咨询,以获得准确的诊断和治疗建议。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Realtime PCR 检测技术
一、实验用品:
【实验耗材】
1、移液枪:1mL、100μL、10μL。
酒精擦拭,头部重点,紫外线照射。
2、吸头:1mL、100μL、10μL
3、EP管:1.5mL、100μL
4、铝制饭盒
【实验仪器】
天平、振荡器、高速离心机、0.5~10uL、10~200uL、100~1000uL加样器。
【自备试剂】
DEPC(焦碳酸二乙酯),二甲苯,无水乙醇,0.1%DEPC-H2O。
实验准备:
【器具处理与准备】
先将DEPC水从容量瓶中倒入瓷缸中,将塑料制品逐个浸泡其中,小枪头需打入DEPC水,室温过夜,高压,烤干备用。
二、样品的miRNA抽提
样品中miRNA抽提参照QIAGEN说明书(miRNeasy FFPE Handbook)
三、 RT (All-One miRNA qRT-PCR Reagent Kits,广州复能基因)
1、按下列组份配制RT反应液
5×PAP/RT Buffer 5 μL
RTase Mix 1μL
2.5U/ul Poly A Polymerase 1μL
Total RNA 18μL
Total Up to 25μL
2、反转录反应条件如下: 37℃ 60 min,85℃ 5 min。
3、反应结束后,将其放在冰上待用或-20℃保存。
四、 qPCR (All-One miRNA qRT-PCR Reagent Kits,广州复能基因)
1、按下列组份分别配制Realtime PCR反应体系,以下是每一孔20μL 。
2×All-in-One qPCR Mix 10μL
All-in-One miRNA qPCR Primer(2μM) 2μL
Universal Adaptor PCR Primer(2μM) 2μL
DNA模板(1:5稀释) 2μL
50×ROX Reference Dye 0.4μL
dH2O(灭菌蒸馏水) 3.6μL
Total 20μL
用漩涡振荡器将管中溶液彻底混合均匀,短暂低速离心。
2、点样,将步骤1中混合好的液体加入孔板中,每个样本的每个基因保证3个复孔,点完样之后将PCR板置于离心机中2000rpm、2min,然后用锡箔纸将板包好,置于4℃冰箱中备用。
引物设计。
