蛋白质三级结构预测
5.3蛋白质的三级结构

《生物信息学》第五章:蛋白质结构预测与分析(第一部分)蛋白质的三级结构蛋白质的三级结构是指整条多肽链的三维空间结构,也就是包括碳骨架和侧链在内的所有原子的空间排列。
第一个蛋白质的三维空间结构于 1958年用 X-射线衍射法(X-ray Crystallography)测定。
这种方法目前仍然是获取蛋白质三级结构的主要方法。
PDB数据库中绝大多数蛋白质结构都是用这种方法测定的。
另一个测定蛋白质三维空间结构的方法是核磁共振法(Nuclear Magnetic Resonance, NMR)。
无法结晶的蛋白质,可以利用核磁共振法在液体环境中进行结构测定。
但是核磁共振法只能用于质量小于70千道尔顿的分子,大约对应200个氨基酸的长度。
除此之外,还有一些不太常用的方法也可以测定分子的三维空间结图1. PDB首页搜索结构如图1所示,从PDB首页的搜索条里,可以通过搜索PDB ID、分子名称、作者姓名等关键词来查找蛋白质三级结构。
此外,利用高级搜索工具,可以通过序列相似性搜索获得与输入序列在序列水平上相似的蛋白质的三级结构(图2)。
搜索方法选BLAST,输入序列(示例文件:pdb_search.fasta),点击“Result Count”。
此次搜索一共找到108个在序列水平上和输入序列相似的蛋白质。
点击链接“108 PDB Entities”。
图2. 高级搜索工具BLAST搜索搜索结果中,排在第一位结构是人的dUTPase蛋白的三维结构,PDB ID为2HQU(图3)。
这个结构所对应的序列与输入序列中黄色片段之间的一致度是100%。
输入的序列中蓝色区域是信号肽。
信号肽在蛋白质到达亚细胞定位之后就被切掉了,所以解析的成熟蛋白质结构里不会有这一段。
此外,成熟肽段N端的一小部分,由于实验技术等原因,也没有被解析出来,这在PDB结构中是很常见的。
有时,在序列中间也会有未解析出的断口。
甚至有时,为了得到稳定的晶体状态,需要突变个别的氨基酸或者删除一截肽段。
蛋白质的序列分析及结构预测
ratio of an ion.
精品课件
Peptide Fragmentation
Collision Induced Dissociation
H+
H...-HN-CH-CO . . . NH-CH-CO-NH-CH-CO-…OH
(1)直接测序
e.g. Protein Sequencing and Identification by Tandem Mass Spectrometry,
即用串联质谱仪测序
精品课件
串联质谱及其作用
• 两个或更多的质谱连接在一起,称为串联质谱。 •最简单的串联质谱(MS|MS)由两个质谱串联而 成,其中第一个质量分析器(MS1)将离子预分离 或加能量修饰,由第二级质量分析器(MS2)分析 结果。
蛋白质的序列分析及结构预测
精品课件
DNA sequence Protein sequence
Protein structure
精品课件
Protein function
一、蛋白质数据库介绍 二、蛋白质序列分析 三、蛋白质结构预测 四、应用 分子设计
精品课件
一、蛋白质数据库介绍
蛋白质的结构主要分为四级, 一级结构、二级结构、三级结构 以及四级结构。依据这种结构层次, 将蛋白质数据库分为: 1. 蛋白质序列数据库:如PIR、SWISS-PROT、NCBI , 这些 数据库的数据主要以蛋白质的序列为主, 并赋予相应的注释; 2. 蛋白质模体及结构域数据库:如PROSITE、Pfam, 这些数 据库主要收集了蛋白质的保守结构域和功能域的特征序列; 3. 蛋白质结构数据库: 如PDB 等, 这些数据库主要以蛋白质 的结构测量数据为主; 4. 蛋白质分类数据库:如SCOP、CATH、FSSP 等, 这其中有 以序列比较为基础的序列分类数据库以及以结构比较为基础的 结构分类数据库之分。
蛋白质三级结构molprobity score

蛋白质三级结构molprobity score【摘要】蛋白质结构的质量对于生物学研究具有重要意义,而molprobity score作为评估蛋白质结构质量的指标,在这一领域发挥着至关重要的作用。
本文将从计算方法、与蛋白质结构质量的关系、改善蛋白质结构质量的方法、蛋白质工程中的应用以及在蛋白质结构研究的前沿等方面对molprobity score进行详细探讨。
通过对molprobity score的研究,可以更好地理解蛋白质结构,并且为蛋白质工程及相关领域的研究提供重要的参考。
探讨molprobity score未来的发展方向,以期为蛋白质结构研究提供更加准确和有效的评估工具。
molprobity score的意义将随着技术的进步和研究的深入而不断得到强化和发展。
【关键词】蛋白质三级结构,molprobity score,计算方法,蛋白质结构质量,蛋白质工程,前沿研究,蛋白质结构研究,质量改善,意义,发展方向1. 引言1.1 蛋白质三级结构molprobity score的重要性蛋白质是生物体中起着重要作用的分子,其功能和结构密切相关。
蛋白质的结构可以分为四个层次,分别是一级结构、二级结构、三级结构和四级结构。
三级结构是指蛋白质分子中氨基酸残基之间的空间排布。
蛋白质的三级结构对其功能起着至关重要的作用,因此对蛋白质三级结构的研究具有重要意义。
molprobity score是评估蛋白质三级结构质量的一种方法,它通过计算蛋白质结构模型中构象的几何参数来评估其是否符合实验数据和生物化学原理。
molprobity score可以帮助研究人员及时发现和纠正蛋白质结构中的错误,提高结构模型的准确性和可靠性。
蛋白质三级结构molprobity score的重要性在于它可以帮助研究人员评估和优化蛋白质结构模型,提高结构的精确度和可靠性。
通过对molprobity score的分析,可以及时发现蛋白质结构中存在的问题,并采取相应的措施进行修正。
蛋白质三级结构的预测和分析方法

蛋白质三级结构的预测和分析方法蛋白质是由氨基酸组成的多肽链,是生命体中重要的组成部分。
蛋白质的功能由其三级结构决定,因此蛋白质三级结构的预测和分析是生物学研究的重要课题之一。
本文将介绍蛋白质三级结构的预测和分析方法。
一、蛋白质序列的预测蛋白质的三级结构是由其氨基酸序列决定的,因此蛋白质序列的预测是蛋白质三级结构预测的第一步。
蛋白质序列的预测分为两种方法:直接预测和间接预测。
直接预测方法是通过实验手段对蛋白质进行测定,并得到其序列。
其中,蛋白质测序是最常用的方法之一,目前已经非常成熟,在实验过程中准确率很高。
但是该方法耗时长、成本高,适用性窄。
间接预测方法则基于蛋白质序列的相似性进行预测,即通过基因组学、区域同源性、数据库、机器学习算法等,对已知的蛋白质序列进行比对和分析,得出未知蛋白质的序列。
其中,BLAST、PSI-BLAST等比对方法,能够在较短时间内对蛋白质序列进行预测,并在很大程度上提高了预测准确率。
此外,还有一些基于机器学习算法的预测方法,如SVM和神经网络方法等。
二、蛋白质结构预测蛋白质结构预测是指通过已知的蛋白质序列,预测出其原子级别的三维结构。
蛋白质结构预测目前主要分为三种方法:实验法、遗传算法和分子动力学模拟法。
实验法主要是通过分析蛋白质结晶体、核磁共振法和质谱分析等实验手段来预测蛋白质的空间结构。
这种方法具有实验数据来源充足、准确性高等特点,但是往往耗时长且成本高昂。
遗传算法是利用生物进化过程的基本原理,在计算机模拟中模拟蛋白质分子构象变化的过程,最终找到能够形成最稳定结构的构象。
这种方法通过逐代优化,逐渐提高预测蛋白质结构的准确度,但是也存在时间复杂度高、无法解释性和结果可重复性差等问题。
分子动力学模拟法是运用牛顿力学原理和一些计算模型,对蛋白质分子的运动进行数值模拟,从而得到蛋白质的三维结构。
这种方法的优点在于可以对蛋白质分子动力学过程进行模拟,具有可重复性高、得出结果的信息较多等特点,但是计算时间较长,计算机模拟结果的可信度也需要进一步验证。
蛋白质结构预测

6.picornaviral蛋白上的酶切位点(NetPicoRNA) 7.叶绿体传递蛋白(ChoroP) 8.跨膜螺旋(TMHMM) 9.跨膜螺旋的位臵(TOPPRED) 10.跨膜螺旋的位臵和方向(DAS) 数据库搜索: 1.基于预测的线程方法与完全基于序列的数据库搜 索(FRSVR) 2.查找远源同源蛋白序列的Markov model method (SAMT98)
评估: 1.二级结构预测准确性评估(EvalSec) 2. EVA:预测方法自动评估
PP工作原理
• PredictProtein是一项在因特网上提供氨 基酸序列分析,蛋白质结构和功能预测的服 务。通过电邮或因特网,您可以提交单一 蛋白序列或序列比对,PP将返回结果.
1.PP总流程
2. 序 列 分 析 流 程
• SWISS-MODEL反馈的第1封邮件 (Welcome to SwissModel) • SWISS-MODEL反馈的第2封邮件 (SwissModel-Fold-Recognition) • SWISS-MODEL反馈的第3封邮件 (SwissModelSecondaryStructureP...) • SWISS-MODEL反馈的第4封邮件 (SwissModel_TraceLog_AAAa06Zd K) • SWISS-MODEL反馈的第5封邮件 (SwissModel-Model-AAAa06ZdK) 中附有可用大分子结构展示软件 显示的文件AAAa06ZdK.pdb: • SWISS-MODEL反馈的第6封邮件 (SwissModel WhatCheck AAAa06ZdK...) • SWISS-MODEL反馈的第7封邮件 (PredictProtein results)
• META-PP提供单页界面,发送预测查询,到其他蛋白结 构预测服务器。在此界面提交待分析序列,选择所需要 的服务,您将以电子邮件的形式收到答复。在META-PP 提供的序列分析服务包括预测内容: 1.二级结构(JPRED) 2.模拟三维结构(automated modelling,SWISS-MODEL) 3.通过一系列方法和数据库推导三级结构(CPHmodels) 4.信号肽的剪切位点(SignalP) 5.哺乳动物体内黏蛋白的O-GalNAc(突变型)糖基化作用 位臵(NetOglyc)
蛋白质三级结构测定

蛋白质三级结构测定引言蛋白质是生命体中的重要组成部分,它们在细胞功能和调节过程中起着关键的作用。
蛋白质的结构可以分为四级,其中包括一级结构(氨基酸序列)、二级结构(α-螺旋、β-折叠等)、三级结构(立体构型)和四级结构(多个蛋白质相互作用形成的复合物)。
三级结构是蛋白质结构中的最高级别,它描述了蛋白质中不同氨基酸残基之间的空间排列方式。
三级结构的测定对于了解蛋白质的功能和调控机制具有重要意义。
蛋白质的三级结构测定方法1. X射线晶体学X射线晶体学是目前最常用的蛋白质三级结构测定方法之一。
该方法通过将纯化的蛋白质溶液结晶,并利用X射线穿过晶体的原理测定蛋白质的结构。
X射线在晶体中的衍射图样可以提供有关蛋白质结构的详细信息,包括原子的位置和排列方式。
通过对衍射图样进行数学计算和模拟,可以重建蛋白质的三维结构。
2. 核磁共振(NMR)技术核磁共振技术是另一种常用的蛋白质三级结构测定方法。
该方法基于核磁共振现象,通过对蛋白质溶液进行核磁共振实验,可以获得蛋白质的三维结构信息。
与X射线晶体学相比,核磁共振技术可以测定较大分子量的蛋白质,并且对于动态结构的研究更为适用。
3. 电子显微镜(EM)技术电子显微镜技术是一种直接观察蛋白质结构的方法。
通过将蛋白质溶液制备成冷冻样品,并利用电子束穿过样品的原理,可以观察到蛋白质的三维形状和结构。
电子显微镜技术对于研究蛋白质复合物的结构和功能具有重要意义。
蛋白质三级结构测定的挑战和突破1. 蛋白质表达和纯化在进行蛋白质三级结构测定之前,首先需要克服蛋白质的表达和纯化难题。
蛋白质的表达和纯化是蛋白质学研究中的关键步骤,缺乏高效、稳定的表达和纯化方法是制约蛋白质三级结构测定的一个重要因素。
2. 复杂性和动态性许多蛋白质具有复杂的结构和动态的特性,这给蛋白质三级结构测定带来了挑战。
传统的测定方法往往难以揭示蛋白质的复杂结构和动态变化,因此需要开发新的技术和方法来应对这些挑战。
SWISS-MODEL 蛋白质结构预测

SWISS-MODEL 蛋白质结构预测SWISS-MODEL是一项预测蛋白质三级结构的服务,它利用同源建模的方法实现对一段未知序列的三级结构的预测。
该服务创建于1993年,开创了自动建模的先河,并且它是讫今为止应用最广泛的免费服务之一。
同源建模法预测蛋白质三级结构一般由四步完成:1.从待测蛋白质序列出发,搜索蛋白质结构数据库(如PDB,SWISS-PROT等),得到许多相似序列(同源序列),选定其中一个(或几个)作为待测蛋白质序列的模板;2.待测蛋白质序列与选定的模板进行再次比对,插入各种可能的空位使两者的保守位置尽量对齐;3.建模:调整待测蛋白序列中主链各个原子的位置,产生与模板相同或相似的空间结构——待测蛋白质空间结构模型;4.利用能量最小化原理,使待测蛋白质侧链基团处于能量最小的位置。
最后提供给用户的是经过如上四步(或重复其中某几步)后得到的蛋白质三级结构。
SWISS-MODEL工作模式SWISS-MODEL服务器是以用户输入信息的最小化为目的设计的,即在最简单的情况下,用户仅提供一条目标蛋白的氨基酸序列。
由于比较建模程序可以具有不同的复杂性,用户输入一些额外信息对建模程序的运行有时是有必要的,比如,选择不同的模板或者调整目标模板序列比对。
该服务主要有以下三种方式:First Approach mode(简捷模式):这种模式提供一个简捷的用户介面:用户只需要输入一条氨基酸序列,服务器就会自动选择合适的模板。
或者,用户也可以自己指定模板(最多5条),这些模板可以来自ExPDB模板数据库(也可以是用户选择的含坐标参数的模板文件)。
如果一条模板与提交的目标序列相似度大于25%,建模程序就会自动开始运行。
但是,模板的可靠性会随着模板与目标序列之间的相似度的降低而降低,如果相似度不到50%往往就需要用手工来调整序列比对。
这种模式只能进行大于25个残基的单链蛋白三维结构预测。
∙Alignment Interface(比对界面):这种模式要求用户提供两条已经比对好的序列,并指定哪一条是目标序列,哪一条是模板序列(模板序列应该对应于ExPDB模板数据库中一条已经知道其空间结构的蛋白序列)。
5.5计算方法预测三级结构-02-同源建模法SWISS-MODEL

《生物信息学》第五章:蛋白质结构预测与分析(第二部分) 计算方法预测三级结构:同源建模法SWISS-MODEL预测蛋白质三级结构的首选方法是同源建模法(homolog modeling)。
该方法基于原理:相似的氨基酸序列对应着相似的蛋白质结构。
比如三个蛋白质,它们在序列水平上十分相似,解析出的结构也十分相似。
第四个蛋白质的序列和前面三个也高度相似,那么就可以比着前三个结构的样子“画”出第四个的样子。
所以同源建模法的关键就是找到一个好的模板。
好的模板要求,在序列水平上模板(template)要与目标(target)蛋白质具有超过30%的一致度。
同源建模法操作流程如下(图1):图1. 同源建模法操作流程1. 确定模板:找到与目标蛋白质同源的已知蛋白质结构作为模版(目标序列与模版序列间的一致度要≥30%)。
2. 序列比对:为目标序列与模板序列创建序列对比。
模板可以选取多个,通过做多序列比对,各取所长,让模板序列中与目标序列相似的片段尽可能多的覆盖整个目标序列,同时要尽量避免没有模板参考的断口。
3. 计算模型:通过序列比对,将目标序列里的氨基酸替换到模板结构里对应的氨基酸所在的空间位置上。
这一步通过同源建模软件来实现。
4.换模板或修正序列比对,重新构建模型,再次评估。
SWISS-MODEL()它能帮助完成上述步骤中从模板选取到创建序列比对,再到计算模型,以及最后的质量评估的全部过程。
你需要做的只是:输入目标序列,点Build Model(创建模型)(图2左)。
大约三到五分钟之后就会返回结果。
如果这种自动挡模式不能满足你的要求,可以通过点击Search For Templates切换成手动挡,以便指定模板。
也可以直接把做好的目标序列与模板序列之间的序列比对按照指定格式黏贴到输入框里,再点击Build Model(创建模型)(图2右)。
这时,SWISS-MODEL会根据输入的特定格式的序列比对,识别出哪个是目标序列,哪个是模板,并自动从PDB数据库下载模板结构,最后根据输入的比对计算结构模型。
蛋白质三级结构预测(swiss-model同源建模)
利用同源建模预测蛋白质的三级结构首先声明一下,以下纯属个人观点,方法步骤仅供参考,不可作为规范标准,结果出来之后请自行分析结果。
我用的是SWISS-MODEL同源建模的方法进行的蛋白质高级结构预测,其实这个方法是有限制条件的,不过作为一个选修课作业,我们不用深入探究,所以有时不够严谨,大家知道就行!对于一个未知结构的蛋白质,白质建立结构模型。
那么,我们首先要做的就是找到和我们空格和“—”的氨基酸序列,例如:【字母大小写没有影响】vlqdsigyirilsmmdpvvdefdrayqqvkdfpdlmvdvrengggnsgngkkiceylihkpqphcvspdweiiprkd)同源的、相似度最高的、已知三级结构的蛋白质作为模版。
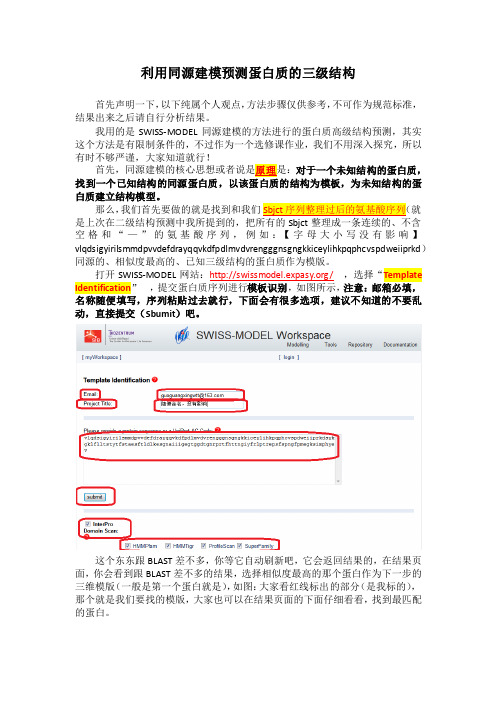
打开SWISS-MODEL网站:/,选择“Template Identification,提交蛋白质序列进行模板识别,如图所示,注意:邮箱必填,名称随便填写,序列粘贴过去就行,下面会有很多选项,建议不知道的不要乱动,直接提交(Sbumit)吧。
这个东东跟BLAST差不多,你等它自动刷新吧,它会返回结果的,在结果页面,你会看到跟BLAST差不多的结果,选择相似度最高的那个蛋白作为下一步的三维模版(一般是第一个蛋白就是),如图:大家看红线标出的部分(是我标的),那个就是我们要找的模版,大家也可以在结果页面的下面仔细看看,找到最匹配的蛋白。
这里还有一点要作说明,就是上图标出的代码是PDB编号,前四个表示PDB- Code,最后一位表示Chain-ID,具体什么意思,大家有兴趣就去了解一些吧。
接下来,去NCBI串串门吧,在NCBI中搜索上面查到的蛋白的PDB号,一般输入前四位就行啦,注意:搜索蛋白库(Protein)。
找到以后,以FASTA格式显示。
接下来,我们再回到SWISS-MODEL,接下来就是重点和难点啦,在线提交序列进行同源建模分析,这个在线提交不是大家想象的那么容易,这个耗费了我大部分的时间,说到这里我就想画个圈圈诅咒它,大家注意啦~~~~~~~~~~~SWISS-MODEL 是一个自动化的蛋白质比较建模服务器,该服务器提供用户三种模式可选择:Automatic mode(简捷模式): 用于建模的氨基酸序列或是Swiss-Prot/TrEMBL (/sprot )编目号(accession)可以直接通过web界面提交。
蛋白质结构的测定、预测和转换

蛋白质结构:蛋白质分子是由氨基酸首尾相连缩合而成的共价多肽链,但是天然蛋白质分子并不是走向随机的松散多肽链。
每一种天然蛋白质都有自己特有的空间结构或称三维结构,这种三维结构通常被称为蛋白质的构象,即蛋白质的结构。
蛋白质结构现在的研究动态每一种天然蛋白质都有自己特定的空间结构,而研究蛋白质的特定空间结构及结构的特定运动与其生物学功能的关系对阐述生命现象具有重要意义!蛋白质的序列结构的研究测定经典的蛋白质的氨基酸序列分析方法有两种:1液相蛋白质序列仪2固相和气相的蛋白质序列分析仪利用以上分析仪方法可分析一段DNA的核苷酸序列,从而转译出与之对应的氨基酸序列,此法现已成为研究含量微的蛋白质的主要方法[1]。
质谱对蛋白质(肽)氨基酸序列的分析通过串联质谱技术(MS/MS)和源后衰减基质辅助的激光解吸/离子化(PSD-MALDI-MS),人们就可以从质谱分析中获得肽及蛋白质的结构信息[2]。
蛋白质三维结构的研究X射线单晶衍射分析X射线单晶衍射分析一直是蛋白质三维空间结构测定的主要方法, X射线衍射法的分辨率可达单个原子的水平,使它可以测定亚基的空间结构、各亚基间的相对拓扑布局,还可清楚的描述配体存在与否对蛋白质的影响。
核磁共振技术(NMR)分析多维核磁共振波谱技术已成为确定蛋白质和核酸等生物分子溶液三维空间结构的唯一有效手段[3],而且它能对在溶液中和非晶态的蛋白质进行测量。
蛋白质二维结晶及其电子晶体学的结构分析蛋白质二维结晶及其电子晶体学的结构分析是目前结构生物学最活跃的领域之一。
此法既适用于水溶性蛋白质,也适用于脂溶性膜蛋白的研究。
电子晶体学已发展为X射线晶体学所不能替代的生物大分子空间结构分析的有效手段[4]。
蛋白质溶液构象的光谱技术紫外-可见差光谱蛋白质在紫外区的光吸收是由于芳香族氨基酸侧链吸收光引起的,而在可见区的研究则限于蛋白质-蛋白质、酶-辅酶、酶-底物的相互作用以及入生色团等.差光谱的产生是基于生色团经受一定的环境变化时,吸收峰发生位移,吸光度和谱带半宽度也有改变。
SWISS-MODEL蛋白质结构预测教程

SWISS-MODEL 蛋白质结构预测SWISS-MODEL是一项预测蛋白质三级结构的服务,它利用同源建模的方法实现对一段未知序列的三级结构的预测。
该服务创建于1993年,开创了自动建模的先河,并且它是讫今为止应用最广泛的免费服务之一。
同源建模法预测蛋白质三级结构一般由四步完成:1.从待测蛋白质序列出发,搜索蛋白质结构数据库(如PDB,SWISS-PROT等),得到许多相似序列(同源序列),选定其中一个(或几个)作为待测蛋白质序列的模板;2.待测蛋白质序列与选定的模板进行再次比对,插入各种可能的空位使两者的保守位置尽量对齐;3.建模:调整待测蛋白序列中主链各个原子的位置,产生与模板相同或相似的空间结构——待测蛋白质空间结构模型;4.利用能量最小化原理,使待测蛋白质侧链基团处于能量最小的位置。
最后提供给用户的是经过如上四步(或重复其中某几步)后得到的蛋白质三级结构。
SWISS-MODEL工作模式SWISS-MODEL服务器是以用户输入信息的最小化为目的设计的,即在最简单的情况下,用户仅提供一条目标蛋白的氨基酸序列。
由于比较建模程序可以具有不同的复杂性,用户输入一些额外信息对建模程序的运行有时是有必要的,比如,选择不同的模板或者调整目标模板序列比对。
该服务主要有以下三种方式:?First Approach mode(简捷模式):这种模式提供一个简捷的用户介面:用户只需要输入一条氨基酸序列,服务器就会自动选择合适的模板。
或者,用户也可以自己指定模板(最多5条),这些模板可以来自ExPDB模板数据库(也可以是用户选择的含坐标参数的模板文件)。
如果一条模板与提交的目标序列相似度大于25%,建模程序就会自动开始运行。
但是,模板的可靠性会随着模板与目标序列之间的相似度的降低而降低,如果相似度不到50%往往就需要用手工来调整序列比对。
这种模式只能进行大于25个残基的单链蛋白三维结构预测。
?Alignment Interface(比对界面):这种模式要求用户提供两条已经比对好的序列,并指定哪一条是目标序列,哪一条是模板序列(模板序列应该对应于ExPDB模板数据库中一条已经知道其空间结构的蛋白序列)。
测定蛋白质三级结构的方法

测定蛋白质三级结构的方法
蛋白质的三级结构是指它的空间构象,通常包括α-螺旋、β-折叠和无规卷曲等结构。
了解蛋白质的三级结构对于深入探究蛋白质的功能、性质和相互作用等方面具有重要意义。
目前,测定蛋白质三级结构的方法主要包括X射线晶体学、核磁共振、电子显微镜和质谱等技术。
X射线晶体学是目前最常用的测定蛋白质三级结构的方法。
该方法利用蛋白质经过结晶后,通过测量X射线的散射图案来确定蛋白质的空间结构。
这种方法能够提供高分辨率的结构信息,但是对于一些难以结晶的蛋白质则有限制。
核磁共振是一种无损测定蛋白质三级结构的方法。
该方法利用蛋白质分子中的原子核之间相互作用的信号来确定蛋白质的结构。
与X 射线晶体学相比,核磁共振可以测定大分子的结构,但是分辨率相对较低。
电子显微镜是一种直接观察蛋白质分子的三维结构的方法。
该方法通过将蛋白质在低温下固定在网格上,并利用电子束的散射图案来重建蛋白质的三维图像。
这种方法适用于大分子和非晶态样品的结构测定,但是分辨率相对较低。
质谱是一种在气态下测定蛋白质结构的方法。
该方法利用蛋白质分子在质谱仪中的荷质比来确定蛋白质的结构。
这种方法适用于小分子的结构测定,但是对于大分子则有限制。
除了以上方法,还有一些新兴的技术,如单颗粒冷冻电子显微镜
和光学显微镜,也被广泛应用于测定蛋白质的三级结构。
这些方法的出现将会进一步推动蛋白质结构研究的发展。
生物信息学课程复习题(南医大)

⽣物信息学课程复习题(南医⼤)⽣物信息学课程习题第⼀章绪论⼀、填空1、在年,美国国会批准启动⼈类基因组计划,拟⽤年时间测定⼈类全部条染⾊体上共个碱基序列的测定。
2、是遗传信息的携带者。
3、蛋⽩质三维结构测定主要⽅法有和。
4、理想的抗⽣素靶标应为微⽣物细胞所必须,在病原体中⾼度,且在⼈体中或与⼈类基因有。
5、下图例举了⼀个计算机辅助药物设计的实例,从a图中我们得到了配体上R基团附近的受体上有和残基,具有性,因此可以将R基团设计为性基团,如图b中所⽰的基团,使得抑制活性⽐改造前提⾼了近5000倍。
⼆、名词HGP(human genome project),EST(expressed sequence tag), SNP(single nucleotide polymorphism),⽣物信息学(Bioinformatics),药物基因组学(Pharmacogenomics),intron,“Junk DNA”,⽐较基因组学,蛋⽩质组学,分⼦进化树(evolutionary tree),基因组,基因组药物三、简答1、简述⽣物信息学在药物研究开发领域的应⽤可体现在哪些⽅⾯?2、如何利⽤基因组信息寻找新的药物作⽤靶标?3、如何利⽤⼈类基因组信息实现个性化治疗,其基于的原理是什么?4、试叙述基因芯⽚⽤于疾病诊断的原理,并说明其优缺点。
5、最近甲型流感流⾏,请设计甲型流感的分⼦诊断⽅法,说明其原理。
第⼆、三章数据库⼀、单选题1、以下数据库不能⽤于检索核酸序列的是( B )A. GenBankB. PDBC. EMBLD.DDBJ2、蛋⽩质结构数据常保存为下⾯哪⼀种格式为后缀的⽂件()A. PDBB. txtC. SeqD. mdb3、下列格式属于FASTA格式的是()A. >seq1B.C. ATGCCATAD. > ATGCCATAATGCCATA ATGCCATA⼆、填空题1、阅读以下数据格式,写出以下标注的含义:LOCUS是,DEFINITION是,ACCESSION是,VERSION是,SOURCE是在论⽂中使⽤了NCBI数据库中的该序列,应标注该序列的编号,应填。
蛋白质三级结构的分析和预测

蛋白质三级结构的分析和预测蛋白质是构成生命的重要物质之一。
其三级结构包括原生结构、二级结构和三级结构。
这些结构决定了蛋白质的功能和性质。
目前,已有许多方法可以分析和预测蛋白质的三级结构。
本文将就这些方法进行探讨。
一、蛋白质二级结构的分析和预测蛋白质的二级结构包括α-螺旋、β-折叠、无规卷曲等。
分析和预测蛋白质二级结构的方法主要有以下几种:1. X射线晶体衍射:通过对蛋白质的晶体进行X射线衍射,可以确定蛋白质的三维原子结构,进而得到蛋白质的二级结构。
2. 核磁共振:该方法通过将蛋白质放入强磁场中,利用不同原子核的不同磁共振信号来确定蛋白质的二级结构。
3. 红外光谱:该方法可以检测蛋白质样品和红外光的相互作用,从而确定蛋白质的二级结构。
4. 桥水铝质谱:该方法可以通过测量蛋白质分子离子化后的质荷比和分子碎片的相互作用来确定蛋白质的二级结构。
以上方法虽然可以准确测定蛋白质的二级结构,但需要高昂的成本和耗时的操作。
而预测蛋白质二级结构的方法主要有以下几种:1. 基于相似性比对的方法:该方法利用已知二级结构的蛋白质序列与待预测蛋白质序列进行比对,从而预测其二级结构。
缺点是需要已知的蛋白质序列作为比对对象。
2. 基于机器学习的方法:该方法利用已知蛋白质序列和其二级结构的数据集进行机器学习,从而预测未知蛋白质的二级结构。
缺点是需要大量的数据集。
3. 基于物理和化学性质的方法:该方法利用蛋白质分子内部的物理和化学性质,如氨基酸的电荷、氢键等,从而推断蛋白质的二级结构。
缺点是准确性有限。
二、蛋白质原生结构的分析和预测蛋白质的原生结构决定了其完整三级结构的构建和稳定性。
分析和预测蛋白质原生结构的方法主要有以下几种:1. X射线晶体衍射:该方法已经成为分析蛋白质原生结构的黄金标准。
通过分析蛋白质晶体的衍射图,可以精确地确定蛋白质分子的原生结构。
2. 高分辨率电子显微镜:该方法可以直接观察蛋白质分子的三维结构,从而确定其原生结构。
蛋白质三级结构预测的主要方法

蛋白质是生命体内的重要组成成分,它们具有多种功能,包括传递信号、催化化学反应和提供结构支持。
蛋白质的功能与其三维结构密切相关,因此对蛋白质三维结构的预测成为生物信息学中的重要课题之一。
在蛋白质三维结构预测领域,主要方法包括以下几种:1. 基于序列比对的模板建模方法这是目前蛋白质结构预测中最准确和最常用的方法之一。
它利用已知结构的蛋白质作为模板,通过序列比对找到与待预测蛋白质相似的结构,然后用模板蛋白质的结构作为预测结果。
这种方法在已知结构蛋白质序列与待预测蛋白质序列非常相似的情况下效果最好,但是对于没有已知结构模板的蛋白质来说,预测结果可能不够准确。
2. 基于物理模型的能量函数方法这种方法是通过物理化学原理,利用分子力学模拟蛋白质的结构,通过计算能量最低的构型来预测蛋白质的三维结构。
这种方法的优势在于能够考虑到蛋白质内部的相互作用力和构象约束,从而提高了预测的准确性。
但是这种方法需要耗费大量的计算资源和时间,并且对蛋白质的结构特征有一定的要求,对于大蛋白质的结构预测会面临更大的挑战。
3. 基于机器学习的方法随着人工智能和机器学习技术的发展,越来越多的研究开始尝试利用机器学习算法来预测蛋白质的三维结构。
这种方法通过训练大量的蛋白质序列和结构数据,使得计算机能够通过学习蛋白质序列和其对应结构的关联性,从而对新的蛋白质序列进行结构预测。
由于机器学习方法的高效性和灵活性,这种方法在蛋白质结构预测领域具有广阔的应用前景。
总结起来,蛋白质的三维结构预测是一个复杂而困难的课题,在不同的方法中各有优势和局限性。
未来随着生物信息学和计算机科学的不断发展,相信会有更多更准确的蛋白质结构预测方法涌现出来,为人类揭开蛋白质奥秘提供更多可能。
4. 强化学习在蛋白质三维结构预测中的应用强化学习是一种重要的机器学习方法,近年来开始在蛋白质三维结构预测中得到应用。
强化学习通过与环境的交互学习来寻找最优的决策策略,其优势在于能够在不断的试验中进行优化,可以有效应对蛋白质结构预测中的复杂问题。
生物信息学第七章蛋白质结构分析和预测

提交氨基酸序列
/~phyre/
五、蛋白质跨膜区预测
膜蛋白结构
脂双层
1
2
3
6 NH3
P
P
胞质
COOH
4
5
7
五、蛋白质跨膜区预测
跨膜区特点
➢ 膜蛋白跨膜区氨基酸具有极强疏水性 ➢ 跨膜区的二级结构一般为α螺旋和β筒状结构
20-30个连续高度疏水氨基酸可以α螺旋形式穿越 脂双层;β筒跨膜区的氨基酸只有20个左右。
构象分布概率、氨基酸在蛋白质中的相对出现 概率以及残基出现在结构中的频率,最后得到 构想参数,根据此参数得出氨基酸形成二级结 构的倾向性,从而预测二级结构。
Chou-Fasman二级结构预测经验规则
α螺旋规则
➢ 相邻的6个残基中如果有至少4个残基倾向于形 成α螺旋,则认为是螺旋核。
➢ 然后从螺旋核向两端延伸,直至四肽α螺旋倾 向性因子的平均值pα<1.0为止。此外,不容许 脯氨酸在螺旋内部出现,但可出现在C末端以 及N端的前三位。
蛋白质的结构层次:
一级结构(氨基酸序列) 二级结构 三级结构 四级结构
采用ProtParam软件[1] (/tools/protpa ram.html)分析蛋白质的分子量、理论 等电点、氨基酸组成、带正负电荷的氨 基酸残基数目、消光系数、吸光系数、 疏水系数和半衰期等基本理化性质。
信号肽预测
分泌蛋白新生肽链N端的一段20~30氨 基酸残基组成的肽段。将分泌蛋白引导 进入内质网,同时这个肽段被切除。现 这一概念已扩大到决定新生肽链在细胞 中的定位或决定某些氨基酸残基修饰的 一些肽段。
信号肽预测
预测给定的氨基酸序列中是否存在潜在 的信号肽剪切位点及其所在
蛋白质三维结构预测及其功能鉴定

蛋白质三维结构预测及其功能鉴定蛋白质是生命的基本组成部分,具有多种生物学功能,如催化酶、结构蛋白、运输蛋白等。
了解蛋白质的结构和功能对于理解生命活动和研究相关疾病具有重要意义。
然而,实验方法获得蛋白质的三维结构所需的时间和资源较多,因此发展一种高效的蛋白质结构预测方法变得尤为重要。
蛋白质的结构主要由其氨基酸序列决定,即一维的氨基酸序列通过折叠作用形成其三维结构。
蛋白质折叠过程包括形成二级结构(α-螺旋、β-折叠)、三级结构(折叠成具有特定空间构象的形状)和四级结构(多个蛋白质相互作用形成的复合物)。
蛋白质预测的关键是预测其三级结构。
蛋白质三维结构预测有两种主要方法:实验方法和计算模型。
实验方法包括X射线晶体学、核磁共振和电子显微镜等,它们能够直接测定蛋白质的结构,但需要昂贵的设备和大量的时间。
相反,计算模型通过计算机算法估计蛋白质的结构,是一种高效的方式。
计算模型可以分为抽象建模和模拟折叠两种方法。
抽象建模方法根据已知的蛋白质结构去预测新蛋白质的结构,其中常用的方法是比对和比较。
比对方法根据已知的蛋白质结构和氨基酸序列的相似度进行预测。
比较方法则通过比较待测蛋白质的氨基酸序列与已知蛋白质结构数据库中的序列进行预测。
而模拟折叠方法则根据物理原理模拟蛋白质的折叠过程。
这些方法使用力场、动力学模拟和蒙特卡洛方法等来模拟蛋白质分子的运动和相互作用。
然而,模拟折叠方法仍然有许多挑战,例如计算复杂度高、时间和空间的限制以及准确性的限制。
在预测蛋白质结构的同时,功能鉴定也是重要的。
蛋白质的结构决定其功能,因此通过预测结构可以间接预测蛋白质的功能。
功能鉴定可以通过计算方法、结构比对和基因敲除等实验方法来实现。
计算方法利用统计学和模式识别来鉴定蛋白质的功能,例如通过分析氨基酸序列中的保守区域和功能域来预测。
结构比对方法则通过比较目标蛋白质的结构与已知功能蛋白质的结构相似性来预测功能。
基因敲除实验方法则通过对目标蛋白质基因进行敲除,观察蛋白质缺失后生物体的表型变化,从而推测其功能。
蛋白质三级结构预测方法原理

蛋白质三级结构预测方法原理
蛋白质三级结构预测是指在蛋白质氨基酸序列已知的情况下,根据各种算法和模型预测出蛋白质的空间结构。
常用的预测方法包括构象搜索、分子动力学模拟、能量优化和机器学习等。
其中,构象搜索的思路是将空间构象看作是一系列的节点,搜索最稳定的构象;分子动力学模拟通过模拟蛋白质分子在一定温度、压力下的运动过程,逐渐寻找最稳定的构象;能量优化则是基于各种力场函数对蛋白质进行优化,最终得到最稳定的构象;机器学习的方法则是基于已知蛋白质的三级结构信息,通过大量数据训练预测模型,从而对新的蛋白质结构进行预测。
总的来说,蛋白质三级结构预测方法涉及到物理化学,生物信息学,计算机科学等领域,需要综合运用多种算法和模型,结合实验数据和生物学知识进行分析,不断改进和提升预测准确率。
