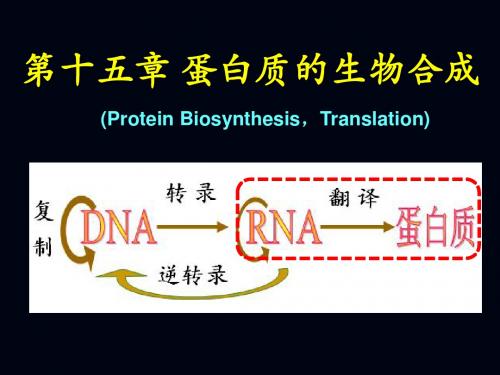
蛋白质的生物合成
第十一章 蛋白质的生物合成

氨基酸活化的总反应式是:
氨基酰-tRNA 合成酶 氨基酸 + ATP + tRNA + H2O 酰-tRNA + AMP + PPi
氨基
2.在核糖体上合成肽链
氨基酰-tRNA通过反密码臂上的三联体反密码 子识别mRNA上相应的遗传密码,并将所携带的 氨基酸按mRNA遗传密码的顺序安臵在特定的位 臵,最后在核糖体中合成肽链。
四、mRNA
是蛋白质合成的直接模板,指导肽链的合 成。 mRNA分子上的核苷酸顺序决定蛋白质分子 的氨基酸顺序。
第二节 遗传密码
mRNA分子中所存储的蛋白质合成信息,是由组成 它的四种碱基(A、G、C和U)以特定顺序排列成 三个一组的三联体代表的,即每三个碱基代表一 个氨基酸信息。 这种代表遗传信息的三联体称为密码子,或三联 体密码子。 因此 mRNA 分子的碱基顺序即表示了所合成蛋白 质的氨基酸顺序。
转肽
肽酰转移酶
肽基转移酶
延长过程中肽链的生成
移位
肽链合成的终止与释放
识别mRNA的终止密码子,水解所 合成肽链与tRNA间的酯键,释放 肽链 R1识别UAA、UAG R2识别UAA、UGA R3影响肽链的释放速度 RR帮助P位点的tRNA残基脱落,而 后核糖体脱落
终止
多核糖体
在细胞内一条mRNA链上结合着多 个核糖体,甚至可多到几百个。 蛋白质开始合成时,第一个核糖 体在mRNA的起始部位结合,引入 第一个蛋氨酸,然后核糖体向 mRNA的3’端移动一定距离后,第 二个核糖体又在mRNA的起始部位 结合,现向前移动一定的距离后, 在起始部位又结合第三个核糖体, 依次下去,直至终止。每个核糖 体都独立完成一条多肽链的合成, 所以这种多核糖体可以在一条 mRNA链上同时合成多条相同的多 肽链,这就大大提高了翻译的效 率
大学生物化学课件蛋白质的生物合成

核糖体结合的分子伴侣
非核糖体结合性分子伴侣— 热休克蛋白 伴侣蛋白
(1)热休克蛋白(heat shock protein, HSP ):
属于应激反应性蛋白,高温应激可诱导该蛋白 合成增加。
在大肠杆菌中包括HSP70, HSP40和GrpE三族
Peptidyl site (P Site)
E位
Aminoacyl site (A Site)
mRNA
肽链合成需要酶类和蛋白质因子
• 蛋白质因子: • (1)起始因子 • 原核生物 IF; 真核生物 eIF • (2)延长因子 • 原核生物 EF; 真核生物 eEF • (3)释放因子 • 原核生物 RF; 真核生物 eRF
第二节 蛋白质生物合成的过程
翻译过程从阅读框架的5’-AUG开始,按mRNA 模板三联体密码的顺序延长肽链,直至终止密码 出现。
整个翻译过程可分为三个阶段:
起始(initiation)
延长(elongation)
终止(termination)
一、肽键合成的起始(Initiation)
多肽链合成后需要逐步折叠成天然空间构象才成为有 功能的蛋白质。
时间: 新生肽链N端在核蛋白体上一出现,肽链的折叠
即开始,折叠在肽链合成中、合成后完成。
细胞中大多数天然蛋白质折叠都不是自动完 成,而需要其他酶、蛋白质辅助 :
•
分子伴侣
•
蛋白二硫键异构酶
•
肽-脯氨酰顺反异构酶
1.分子伴侣*(molecular chaperon)
需要:
转位酶(原核生物中是EFG,真核生物中是eEF-2), GTP 结果:
蛋白质生物合成的方式

蛋白质生物合成的方式
蛋白质生物合成是生物体内制造蛋白质的过程,它是生物体内的重要生化反应之一。
下面介绍蛋白质生物合成的方式:
1. 氨基酸活化:在蛋白质生物合成中,首先需要将氨基酸激活。
这个过程由特定的酶催化,称为氨基酸激酶。
被激活的氨基酸随后会与另一种分子——核糖磷酸结合,形成称为氨酰-tRNA的化合物。
2. 起始复合物形成:第二个步骤是形成起始复合物。
这个过程涉及氨酰-tRNA 与mRNA的结合,其中mRNA是包含蛋白质序列信息的分子。
这个过程需要核糖体起始因子(eIF)的帮助。
3. 肽链合成:一旦起始复合物形成,蛋白质合成就可以开始了。
每个氨基酸通过肽键连接在一起,形成一个连续的肽链。
这个过程由转录延长因子(eEF)和核糖体来催化。
4. 蛋白质折叠:当肽链合成完成后,蛋白质就会开始折叠成其最终的三维形状。
这个过程需要帮助,包括来自分子伴侣蛋白和折叠酶的帮助。
5. 蛋白质修饰:在某些情况下,还需要对蛋白质进行进一步修饰,例如添加糖基或脂质,或者进行磷酸化或乙酰化等化学修饰。
总的来说,蛋白质生物合成是一个复杂的过程,需要多个酶和分子的协同作用。
通过这个过程,生物体能够制造出其生命活动中所需的蛋白质。
【生物化学】蛋白质的生物合成

嘌 呤 霉 素
酯键
(3)转位(translocation)
•转位酶 (translocase): •原核:延长因子G(EF-G),真核:EF-2 • GTP
可结合并水解1分子GTP,促进核 蛋白体向mRNA的3’侧移动
进 位
成肽 转 位
合成
3、肽链终止阶段:
核蛋白体沿mRNA链滑动,不断使多 肽链延长,直到终止信号进入受位。
四、蛋白质生物合成的干扰和抑制
1、抗生素(antibiotics)
名称
作用机制
四环素类 氯霉素类 链霉素类 嘌呤霉素
抑制氨酰-tRNA与原核生物核糖体结合,抑制细菌 蛋白质合成
结合原核生物核糖体大亚基,阻断翻译延长过。高 浓度时,对真核生物线粒体内的蛋白质合成也有阻 断作用 结合原核生物核糖体小亚基,改变其构象,引起读 码错误
,IF)
有抗病毒作
用的蛋白质
1、诱导一种蛋白激酶,使eIF2磷酸 化,从而抑制病毒蛋白质的生物合 成。
2、诱导生成一种寡核苷酸(2’5’A),活化核酸内切酶RNaseL, 可降解病毒RNA。
谢 谢!
(1)识别:释放因子(RF)识别终 止密码,进入核蛋白体的受位。
(2)水解:RF使转肽酶变为水解酶, 多肽链与tRNA之间的酯键被水解, 多肽链释放。
(3)解离:通过水解GTP,使核蛋 白体与mRNA分离,tRNA、RF脱落, 核蛋白体解离为大、小亚基。
进位
肽链的形成 移位
蛋白质 合成过程
肽链合成终止
结构与Tyr-tRNAtyr相似,阻止肽链正常合成
放线菌酮 抑制核糖体转肽酶。且只对真核生物有特异性作用
2、干扰蛋白质生物合成的生物活性物质
名称
分子生物学第十五章 蛋白质的生物合成

1.遗传密码种类:
• mRNA 分子有4种碱基:A、G、C、U,可组合成64个密 码子,其中61个分别代表20种不同氨基酸
• 遗传密码共有43=64种, 64: UAA、UAG、UGA 终止密码 61: AUG 起始密码 代表Met 60: 代表19种氨基酸
9
遗传密码表 第一碱基
(5/-端)
第二碱基
43
一、起始阶段
(一)原核生物翻译起始复合物的形成
参与的物质: 核糖体50S和30S大小两类亚基 mRNA 起始作用的fMet-tRNAfMet GTP供能 起始因子(IF1、IF2、IF3)
44
起始过程:
• 核糖体大小亚基解离 • 小亚基与mRNA结合:
16sRNA识别mRNA的SD序列
• fMet-tRNAfMet与mRNA起始密码子AUG结合 • 核糖体大小亚基形成起始复合物
tRNAphe Phe-tRNAphe
• 肽链起始和延长的甲硫氨酰-tRNA:
真核生物:起始: Met-tRNAiMet 延长: Met-tRNAMet
原核生物: 起始:fMet-tRNAfMet 延长:Met-tRNAMet
39
40
第三节 肽链的合成过程
41
整个翻译过程可分为 :
• 翻译的起始 • 翻译的延长 • 翻译的终止
tRNA反密码子 第1位碱基
mRNA密码子 第3位碱基
I
U
G AC
U, C, A A, G U, C U G
17
摆 动 配 对
32 1
U
123
18
• ⑤遗传密码的通用性
从原核生物到人类都共用同一套遗传密码,被称为遗传密码的通用性。 密码的通用性进一步证明各种生物进化自同一祖先。
生物化学第十二章-蛋白质的生物合成

第十二章蛋白质的生物合成一、蛋白质生物合成体系:生物体内的各种蛋白质都是生物体利用约20种氨基酸为原料自行合成的。
蛋白质的生物合成过程,就是将DNA传递给mRNA的遗传信息,再具体的解译为蛋白质中氨基酸排列顺序的过程,这一过程被称为翻译(translation)。
参与蛋白质生物合成的各种因素构成了蛋白质合成体系,该体系包括:1.mRNA:作为指导蛋白质生物合成的模板。
mRNA中每三个相邻的核苷酸组成三联体,代表一个氨基酸的信息,此三联体就称为密码。
共有64种不同的密码。
遗传密码具有以下特点:①连续性;②简并性;③通用性;④方向性;⑤摆动性;⑥起始密码:AUG;终止密码:UAA、UAG、UGA。
2.tRNA:在氨基酸tRNA合成酶催化下,特定的tRNA可与相应的氨基酸结合,生成氨基酰tRNA,从而携带氨基酸参与蛋白质的生物合成。
tRNA反密码环中部的三个核苷酸构成三联体,可以识别mRNA上相应的密码,此三联体就称为反密码。
反密码对密码的识别,通常也是根据碱基互补原则,即A—U,G—C配对。
但反密码的第一个核苷酸与第三核苷酸之间的配对,并不严格遵循碱基互补原则,这种配对称为不稳定配对。
能够识别mRNA中5′端起动密码AUG的tRNA称为起动tRNA。
在原核生物中,起动tRNA是tRNAfmet;而在真核生物中,起动tRNA是tRNAmet。
3.rRNA和核蛋白体:原核生物中的核蛋白体大小为70S,可分为30S小亚基和50S大亚基。
真核生物中的核蛋白体大小为80S,也分为40S小亚基和60S大亚基。
核蛋白体的大、小亚基分别有不同的功能:⑴小亚基:可与mRNA、GTP和起动tRNA结合。
⑵大亚基:①具有两个不同的tRNA结合点。
A位——受位或氨酰基位,可与新进入的氨基酰tRNA 结合;P位——给位或肽酰基位,可与延伸中的肽酰基tRNA结合。
②具有转肽酶活性。
在蛋白质生物合成过程中,常常由若干核蛋白体结合在同一mRNA分子上,同时进行翻译。
蛋白质生物合成体系

核糖体的结构
核糖体是一种高度复杂的超分子结构,由多个蛋白质和RNA分子组装而成。
大、小亚基的形状类似于扁平的椭圆形或球形,大亚基的直径约为70-80 埃,小亚基的直径约为40-50埃。
核糖体中的蛋白质和RNA分子通过相互作用形成了一个稳定的结构,使得 核糖体能够作为一个整体来执行功能。
02
每种氨基酸都有特定的氨酰tRNA合成酶,该酶具有高度的 专一性,只对一种氨基酸起作 用。
03
活化后的氨基酸通过酯键与 tRNA结合,形成氨酰-tRNA, 为接下来的蛋白质合成做准备。
氨基酸在细胞内的转运
氨基酸在细胞内的转运主要依靠细胞内不同的 转运体系来完成,这些转运体系能够识别和结 合相应的氨基酸,并将其转运到需要的地方。
通过调节翻译延长因子EF-Tu、EF-G等,可以影响蛋 白质合成的速率。
调节翻译终止
通过调节翻译终止因子eRFs的活性,可以控制蛋白质 合成的终止。
蛋白质生物合成与疾病的关系
疾病发生
01
当蛋白质生物合成体系出现异常时,可能导致某些疾病的发生,
如癌症、感染性疾病等。
疾病发展
02
蛋白质生物合成体系的变化可能影响疾病的发展进程,如肿瘤
蛋白质的折叠
1
蛋白质折叠是指蛋白质合成后,通过一系列复杂 的化学和物理过程,将其由线性肽链折叠成具有 特定三维结构的构象。
2
蛋白质折叠是一个自发的、动态的过程,需要依 靠分子伴侣、折叠酶等辅助因子来完成。
3
正确的蛋白质折叠对于维持细胞正常功能和生物 体的健康至关重要,而错误的折叠会导致多种疾 病的发生。
核糖体的功能
蛋白质的生物合成

密码子与反密码子除通过碱基互补结合外, 还具有摆动性,即密码子的第3位碱基与反 密码子的第1位碱基配对不严格,称为摆动 配对。
密码子、反密码子配对的摆动现象
tRNA反密码子 第1位碱基
I
U G AC
mRNA密码子 第3位碱基
U, C, A A, G U, C U G
密码子的第3位碱基发生突变时,并不影响tRNA带入 正确的氨基酸。
踏实肯干,努力奋斗。2020年12月18 日上午1 2时58 分20.12. 1820.1 2.18
追求至善凭技术开拓市场,凭管理增 创效益 ,凭服 务树立 形象。2 020年1 2月18 日星期 五上午1 2时58 分18秒0 0:58:18 20.12.1 8
严格把控质量关,让生产更加有保障 。2020 年12月 上午12 时58分2 0.12.18 00:58D ecember 18, 2020
码子,称为三联体。 4种碱基一共可以组成64个密码子。 AUG代表甲硫氨酸,在5’ -端时代表启动信
号,称为起始密码子。 UAA、UAG和UGA:称为终止密码子。 代表氨基酸的密码子只有61个。
载脂蛋白B-100的一段mRNA的 密码子序列
(三)遗传密码的特点
1.通用性(universal): 蛋白质生物合成的整套密码,从原核生
多核糖体循环
蛋白质的生物合成耗能
AA活化消耗2ATP,肽链延长进 位和转位各消耗1GTP,所以,蛋 白质的生物合成启动以后,每形成 1个肽键,需要消耗4ATP。
合成一条n个肽键组成的多肽链 所需能量为4×n+1 ATP
蛋白质合成过程小结
以mRNA的5’ 3’方向阅读遗传密码
肽链合成方向N
18SrRNA
蛋白质生物合成

目录
目录
Tu TGsTP
Tu GDP
Ts GTP
5'
AUG
3'
目录
(二)成肽
是由转肽酶(transpeptidase)催化的肽键 形成过程。
目录
(三)转位
延长因子EF-G有转位酶( translocase ) 活性,可结合并水解1分子GTP,促进核蛋 白体向mRNA的3'侧移动 。
目录
fMet fMet
目录
原核、真核生物各种起始因子的生物功能
原核 生物
真核 生物
起始因子 IF-1 EIF-2 EIF-3 eIF-2
eIF-2B,eIF-3
IF-4A
eIF--4B eIF-4E eIF-4G eIF-5 eIF-6
生物功能 占据A位防止结合其他tRNA 促进起始tRNA与小亚基结合 促进大小亚基分离,提高P位对结合起始tRNA敏感性 促进起始tRNA与小亚基结合 最先结合小亚基促进大小亚基分离 eIF-4F复合物成分,有解螺旋酶活性,促进mRNA结
目录
遗传密码的特点
1. 连续性(commaless)
编码蛋白质氨基酸序列的各个三联体密 码连续阅读,密码间既无间断也无交叉。
目录
• 基因损伤引起mRNA阅读框架内的碱基发生 插入或缺失,可能导致框移突变(frameshift mutation)。
目录
2. 简并性(degeneracy)
遗传密码中,除色氨酸和甲硫氨酸仅 有一个密码子外,其余氨基酸有2、3、4 个或多至6个三联体为其编码。
目录
1. 核蛋白体大小亚基分离
IF-1 IF-3
目录
2. mRNA在小亚基定位结合
第15章 蛋白质的生物合成
进 位
成肽 转 位
成肽
成肽是由转肽酶催化形成肽键的过程。
Tu GTP
Tu GDP
5'
AUG
3'
fMet fMet
Tu GTP
5'
AUG
3'
(三) 原核生物翻译终止
当mRNA上的终止密码子出现后,多肽链合成 停止,肽链从肽酰-tRNA中脱落,mRNA、核糖体 等解体,此时翻译过程终止。 终止密码子不被任何氨基酰-tRNA识别,只有 释放因子(RF)能够识别它并进入核糖体的A位。 1. 释放因子可引起转肽酶活性的改变,从而使 肽链从tRNA上脱落。 2. 释放因子可引起核糖体结构的改变,从而使 复合体趋于解体。
解码
反密码子(anti-codon) 反密码子是位于tRNA、可与mRNA的三联体密 码子配对的三个相邻核苷酸。在蛋白质的合成中, 起解读密码、辅助将特异的氨基酸引入合成位点。 tRNA
5'
AUG
反密码子
3'
mRNA
密码子
遗传密码的特点
翻译时遗传密码的阅读方向是 5’→3’,即读 码从mRNA的起始密码子AUG开始,按5’→3’ 的方向逐一阅读,直至终止密码子。
COORF
5'
UAG
3'
第四节
蛋白质翻译后加工和靶向输送
Posttranslational Modification and Targeting Transfer of Protein
蛋白质翻译后加工
生物化学蛋白质的生物合成

的作用
伴侣素的主要作用—— 为非自发性折叠蛋白质提供能折叠形成天然 空间构象的微环境。
伴侣素GroEL/GroES系统促进蛋白质折叠过程
(二)蛋白二硫键异构酶 (protein disulfide isomerase, PDI) 在内质网腔活性很高,可在较大区 段肽链中催化错配二硫键断裂并形成正 确二硫键连接,最终使蛋白质形成热力 学最稳定的天然构象。
第一步:活化反应 氨基酸 +ATP+E → 氨基酰-AMP-E + PPi
第二步:转移反应
氨基酰-AMP-E + tRNA
↓
氨基酰-tRNA + AMP + E
氨基酰-tRNA的表示方法
Ala-tRNAAla
Ser-tRNASer Met-tRNAMet 起始肽链合成的氨基酰-tRNA
真核生物: Met-tRNAiMet
每增加一个氨基酸就按 进位→成肽→转 位 这三步不断重复,直到肽链增长到必要的长 度。
移位反应过程
核糖体循环的反应过程
进 位
转肽 移 位
三、蛋白质多肽链合成的终止和释放
蛋白质多肽链合成的终止过程
• 核糖体沿mRNA链滑动,不断使多肽链延长,
直到终止信号进入A位。
识别:RF识别终止密码,进入核糖体的A位。 水解:RF使转肽酶变为酯酶,多肽链与tRNA之间的 酯 键被水解,多肽链释放。 脱离:模板mRNA、RF以及空载tRNA与核糖体脱离 ,
四、蛋白质合成所需的能量
原核生物
氨基酸活化:2个~P
起始: 延长: 1个 2个 GTP GTP
ATP
终止:
1个
GTP
结论:每合成一个肽键至少消耗4个~P。
蛋白质生物合成的特点
蛋白质的生物合成

密码子
AGA,AGG,CGA,CGG TGT,TGC GAG,GGG ATA CTA,CTC CCC,CCT,CCA TCA,AGT,TCG,TCC ACA
编码的氨基酸
精氨酸(Arg) 半胱氨酸(Cys) 甘氨酸(Gly) 异亮氨酸(Ile) 亮氨酸(Leu) 脯氨酸(Pro) 丝氨酸(Ser) 苏氨酸(Thr)
殖、凋亡、分化等 – RP表达异常会引发贫血、肿瘤等严重疾病
• 核糖体核酸(rRNA):
– 构成翻译进行的空间构象,定位并结合mRNA – 肽基转移酶(转肽酶),催化肽键形成
34
第二节 蛋白质生物合成过程
• 蛋白质的合成需要其他许多物质的参与, 包括: 蛋白质因子——IF,EF,RF ATP,GTP 无机离子 20种氨基酸 等
37
* 氨基酸的活化
• AA + tRNA → 氨酰-tRNA • 细胞中一般只有二十种氨酰-tRNA合成酶,不同tRNA
与同一氨基酸的结合均由同一个酶催化。合成酶有很强 的校对功能。
黄色碱基为识 别必需位点38
• 原核生物肽链合成的起始
首先IF3、IF1帮助30S小亚基
与mRNA结合,IF2和GTP帮助
4
第一节 RNA在蛋白质生物合成中的作用
5
6
mRNA代表蛋白质的核 苷酸序列
tRNA运送氨基酸到 对应的mRNA密码子 上
rRNA和蛋白质提供了一 个将特定的氨基酸聚合成 肽链的装置
7
1.mRNA
• 含有从DNA转录来的遗传信息,是蛋白质合成的模 板
• mRNA的结构组成一般包括: -5’非翻译区 (5’-untranslated region, 5’-UTR) -开放阅读框架 (open reading frame, ORF) -3’非翻译区 (3’-untranslated region, 3’-UTR)
十三蛋白质的生物合成

转位(移位)
转位酶
5′→3′
5′
AUG
3′
AUG
EFG,GTP
A
OH 21
21
OH
AUG
转位
AUG
进位
3 12
AUG
N→C延
成肽
编辑2p1pt
3
3
21
成肽
四、肽链合成终止
• 需终止因子RF、RR和IF3参与。终止信号 出现,释放因子(release factor,RF, RR) 与其结合。RF有三种RF1,RF2,RF3
编辑ppt
密码子的特点
(1)连续性:两个密码子之间无任何核苷酸加以 隔开和重叠,如插入/删除碱基,可发生移 码突变或框移
5′…. UACGGACAUCUG….3′ 酪甘 组 蛋
插入 缺失
5′….UACCGGACAUCUG….3′ 酪 精 苏 半胱
5′…. UACGACAUCUG….3′ 酪 天 异亮 编辑ppt
编辑ppt
一、氨基酸的活化与转运
氨基酸活化→活化氨基酸的搬运→活化氨 基酸与核蛋白体结合 1.参与活化转运的酶
氨基酰-tRNA合成酶:特异性强,催化特定 的氨基酸与特异的tRNA结合,每种氨基酸 有特异的合成酶催化,此种特异性保证了 遗传信息准确翻译
编辑ppt
氨基酰tRNA的生成--- 氨基酸的活化
编辑ppt
密码子的特点
(四)摆动性:一种氨基酸可有多个密码子
反密码子与mRNA的第三个核苷酸配对时,不 严格遵从碱基配对原则,可出现U-G,I-C,I-A,此种 配对为不稳定配对,又称摇摆性。一般前两个碱 基决定其专一性,第三位碱基可有变异
mRNA5′ ACG
蛋白质的生物合成

六. 核糖体
核糖体像一个能沿mRNA模板移动的工厂, 执行着蛋白质合成的功能。它是由几十种蛋 白质和几种核糖体RNA(ribosomal RNA, rRNA)组成的亚细胞颗粒。一个细菌细胞内 约有20000个核糖体,而真核细胞内可达106 个,在未成熟的蟾蜍卵细胞内则高达1012。 核糖体和它的辅助因子为蛋白质合成提供了 必要条件。
蛋白质的生物合成
一. 基因与基因表达的一般概念 二. 遗传密码——三联子 三.密码子和反密码子的相互作用 四.tRNA 五.AA- tRNA合成酶 六. 核糖体 七. 信使核糖核酸 八、蛋白质的生物合成 九、氨基酸及功能蛋白质合成后的修饰 十、蛋白质的运输和降解
AA-tRNA合成酶及其它蛋白质因子的细胞抽提物中加入 mRNA或人工合成的均聚物作为模板以及ATP、GTP、氨基 酸等成分时又能合成新的肽链,新生肽链的氨基酸顺序由外 加的模板来决定。
1961年,Nirenberg等以poly(U)作模板时发现合成了多 聚苯丙氨酸,从而推出UUU代表苯丙氨酸(Phe)。以poly (C)及poly(A)做模板分别得到多聚脯氨酸和多聚赖氨酸。
三.密码子和反密码子的相互作用
蛋白质生物合成过程中,tRNA的反密码子通 过碱基的反向配对与mRNA的密码子相互作 用。1966年,Crick根据立体化学原理提出摆 动假说(wobble hypothesis),解释了反密 码子中某些稀有成分如I以及许多有2个以上 同源密码子的配对问题。
1、tRNA的三叶草型二级结构
受体臂(acceptor arm)主要由链两端序列碱基配对 形成的杆状结构和3’端末配对的3-4个碱基所组成,其3’ 端的最后3个碱基序列永远是CCA,最后一个碱基的3’或 2’自由羟基(—OH)可以被氨酰化。TφC臂是根据3个核 苷酸命名的,其中φ表示拟尿嘧啶,是tRNA分子所拥有 的不常见核苷酸。反密码子臂是根据位于套索中央的三 联反密码子命名的。D臂是根据它含有二氢尿嘧啶 (dihydrouracil)命名的。 最常见的tRNA分子有76个碱基,相对分子质量约为 2.5×104。不同的tRNA分子可有74-95个核苷酸不等, tRNA分子长度的不同主要是由其中的两条手臂引起的。 tRNA的稀有碱基含量非常丰富,约有70余种。每个 tRNA分子至少含有2个稀有碱基,最多有19个,多数分 布在非配对区,特别是在反密码子3'端邻近部位出现的频 率最高,且大多为嘌呤核苷酸。这对于维持反密码子环 的稳定性及密码子、反密码子之间的配对是很重要的。
蛋白质的生物合成

蛋白质的生物合成1、参与蛋白质生物合成的物质:RNA有mRNA、tRNA和rRNA、2、原核细胞蛋白质合成的具体过程:氨基酸的活化与搬运、肽链合成的起始、肽链的延长、肽链的终止3、蛋白质的靶向运输:所有靶向转运的蛋白质结构中都存在分选信号,主要为N末端特异氨基酸序列,可引导蛋白质转运到细胞的适当部位,这类序列称为信号序列。
信号序列是决定靶向转运特性的中药元件,因此,知道蛋白质靶向转运的信息存在于它的一级结构中。
分泌蛋白:N端信号肽;内质网腔蛋白:N端信号肽,C端-Lys-Asp-Glu-Leu-COO-;线粒体蛋白:N端信号序列;核蛋白:核定位序列;过氧化体蛋白:C端-Ser-Lys-Leu-;溶酶体蛋白:Man-6-P4、蛋白质合成抑制剂的作用机理:白喉毒素——催化Eef2的ADP-核糖基化,导致EEF2的失活,抑制移位反应;四环素——抑制起始氨基酰-tRNA与原核生物小亚基结合;氯霉素——抑制原核生物大亚基上的肽酰转移酶活性,抑制转肽反应;链霉素——导致mRNA 误读,抑制起始反应;卡那霉素——红霉素——作用于原核生物的大亚基,抑制移位反应;嘌呤霉素——氨酰-tRNA的类似物,可导致原核生物或真核生物肽链合成的提前释放;干扰素——由真核生物细胞感染病毒后分,抗病毒作用的蛋白质,作用于起始阶段,活化RNA酶;放线菌酮——抑制真核生物核糖体大亚基的肽酰转移酶活性,抑制转肽反应。
转录与基因表达调控1、RNA转录的一般特征:1)转录的不对称性:双链DNA中的一条链作为模板进行转录,从而将遗传信息由DNA传递给RNA。
能够转录RNA的那条DNA链称为模板链,而与之互补的另一条DNA链称为编码链。
2)转录的连续性:RNA转录合成时,在RNA聚合酶的催化下,连续合成一段RNA链,RNA链之间无需再进行连接。
3)转录的单向性:RNA 转录合成只能向一个方向聚合,RNA链合成的方向为5’-3’。
4)有特定的起始和终止位点:RNA转录合成时,只能以DNA分子中的某一段作为模板,有其特定的其实位点和终点。
分子生物学 第五章 蛋白质的生物合成

密码利用率(codon usage)
从一般规律看,当密码子的第1、2碱基 为嘧啶碱基,生物在进化过程中往往选择 第3碱基为嘌呤碱基的密码子来编码结构基 因的氨基酸信息。
了解不同生物的密码子使用率对实施遗 传转化,基因表达,基因工程以及蛋白质 工程研究具有重要的理论指导意义。
(三)rRNA和核蛋白体
蛋白质生物合成的 场所。
核糖体的主要作用
一是提供tRNA,mRNA和相关蛋白质因子的 结合位置,使它们在核糖体上保持正确的相对位 置;
二是包括rRNA在内的组分具有催化功能,能 执行翻译中许多关键的化学反应。
核糖体在胞内除了以多聚核糖体形式参 与蛋白质合成外,还有一部分以游离状态 存在,游离状态的核糖体占总核糖体20% 左右。
当第2661个核苷酸由G突变为C后,氨 基酰tRNA-EF-Tu-GTP复合体进入A位的速 度明显减慢,当第2252、第2253位的G双 突变为C,将对转肽酶的活性产生抑制。
核 糖 体 的 组 装
• 大肠杆菌核糖体的
空间结构为一椭圆 球体,其30S亚基 呈哑铃状,50S亚 基带有三角,中间
凹陷形成空穴,将 30S小亚基抱住, 两亚基的结合面为
遗传密码的连续性
遗传密码的摆动配对
密码的简并性具有的生物学意义
它允许生物体的DNA碱基有较大变异 的余地,使基因突变可能造成的为害降至 最低程度,而不影响物种形状的表达,对 环境的适应和物种遗传的稳定。
例如细菌DNA中G+C含量变动很大, 但不同G+C含量的细菌却可以编码出相同 的多肽链。
这归因于同义密码子的分布规则。
除了少数例外(如脊椎动物线粒体基 因组编码的tRNA),所有tRNA分子都有三 叶草式的二级结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
与靶向输送
一、肽链合成后的加工
• 新生多肽链不具备蛋白质生物活性,须经过翻译后加工才 转变为天然构象的功能蛋白。 • 主要包括: ①折叠成正确的生理构象(需分子伴侣); ②蛋白酶水解,去除某些肽段,形成活性蛋白或功能肽; ③肽链中氨基酸残基的修饰(磷酸化、糖基化、羟基化、 甲基化、乙酰化、硒化等),及二硫键的形成; ④亚基聚合开成功能性蛋白质复合物。
• 氨基酰-tRNA合成酶(aminoacyl-tRNA synthetase) • 氨基酸的α-羧基与tRNA的3´-CCA-OH以酯键相 连形成氨基酰-tRNA。
氨基酰-tRNA合成酶
氨基酸 + tRNA
氨基酰- RNA
ATP AMP+PPi
氨基酰-tRNA表示法
• 氨基酰-tRNA的表示方法: Ala-tRNAAla Ser-tRNASer Met-tRNAMet • 起始肽链合成的氨基酰-tRNA: 真核生物: Met-tRNAiMet 原核生物: fMet-tRNAifMet
mRNA分子上从一个起始密码子到其下游第一个终 止密码子所界定的一段序列。 一个mRNA分子中可能有多个阅读框,但只有一个 阅读框真正编码蛋白质多肽链,称为开放阅读框 (open reading frame,ORF)。
③ 遗传密码的简并性(degeneracy)
——指一种氨基酸具有2个或2个以上密码子的现象。 ——编码同一种氨基酸的不同密码子称为: 简并密码子(degenerate codon) 或同义密码子(synonymous codon)
mRNA 分子有4种核苷酸碱基:A、G、C、U,可
组合成64个密码子,其中61个分别代表20种不同氨 基酸。
UAA,UAG,UGA :终止密码子(termination coden) 无义密码子( nonsense code) 其他61个:有义密码子(sense coden) AUG:①甲硫氨酸;②起始密码子(initiation coden)。
遗 传 密 码 表
密码子的特点
① 阅读的方向性(5′→3′)
mRNA:5′端起始密码子AUG到3′端终止密码子 蛋白质多肽链:N端→C端。
② 阅读的连续性(commaless)
沿5′→3′方向连续阅读密码子,既无间隔也无重叠。 插入或缺失一个碱基均可致蛋白质突变:
阅读框(reading frame)
E1:泛素活化酶 E2:泛素结合酶 E3:泛素连接酶(底 物识别蛋白)
ubiquitin-proteasome system(UPS)
各种类泛素蛋白
• SUMO (small ubiquitin-related modifier)、NEDD8 (neural precursor cell-expressed developmentally downregulated 8)、Atg8(autophagy gene 8)和Atg12 等
Shine-Dalgarno序列(S-D序列 )
——核糖体结合位点(ribosomal binding site, RBS)
原核生物翻译过程中核糖体结构模式
第二节 蛋白质生物合成的过程(原核)
“火车”——核糖体 “铁轨”——mRNA “专车”——tRNA “乘客”——氨基酸 前门进
A位:氨酰位(aminoacyl site) P位:肽酰位(peptidyl site)
③ 遗传密码的简并性(degeneracy)
④ 遗传密码的通用性(universal)
从原核生物到人类都共用同一套遗传密码的现象。
已发现的少数例外: 线粒体(动物细胞)、叶绿体(植物细胞)。
二、tRNA的作用
——tRNA是氨基酸与密码子之间的“特异接头”。
①
作为运输工具——氨基酸的负载(“活化”)
– 真核生物单顺反子mRNA(只有一个编码区):
一、mRNA是合成蛋白质的直接模板
原核生物多顺反子mRNA:
真核生物单顺反子mRNA:
mRNA分子的编码区,从5′→3′方向,每3个相 邻的核苷酸为一组,构成一个遗传密码,称为密 码子(coden)或三联体密码(triplet coden)。
(3)SUMO化修饰相关的酶
① SUMO特异性蛋白酶(sentrin/SUMO-specific protease, SENP):SUMO前体在该酶的作用下切除C 端数个 氨基酸,从而暴露出双甘氨酸残基, 成为成熟的 SUMO。
SUMO-GGXXXX
SENP
SUMO-GG
② E1 激活酶(SUMO-activating enzyme):是一种异源二 聚体(人SAE1/SAE2)。成熟SUMO 的C 末端甘氨酸 通过硫脂键与E1 激活酶的半胱氨酸残基相连,此激 活过程需要ATP 的参与。
SAE1 SUMO-GG SAE2 SAE1 SUMO-GG-S-C- SAE2
(3)SUMO化修饰相关的酶
③ E2结合酶(SUMO-conjugating enzyme):目前仅发现一 种E2 结合酶,即Ubc9。SUMO被转移到Ubc9的半胱 氨酸残基上。 Ubc9 可以直接识别底物,从而最终将 SUMO通过异肽键偶联到底物蛋白的赖氨酸残基上。
(1)SUMO的分布
• 组织分布:SUMO-1、-2 和-3 在大部分组织中表达, 而SUMO-4主要在肾脏、淋巴结和脾脏中表达。 • 细胞分布:SUMO-1 主要分布在细胞核核膜和有丝分 裂的纺锤体上,而SUMO-2/3 主要聚集在着丝粒和染 色质中。
(2)SUMO的作用方式
• SUMO-1 主要是以与底物蛋白质结合的形式存在; • SUMO-2/3 则主要是以游离的形式存在。当机体受到 外界的刺激后,游离的SUMO-2/3 便会结合到底物蛋 白上;当刺激消除后,SUMO-2/3 又会从底物蛋白上 解离下来,从而保证了机体能够对外界刺激作出快速 应答。
① 进位(或注册):
——特定的氨基酰-tRNA进入核糖体A位。
② 成肽:
——P 位的肽酰 -tRNA (或甲酰甲硫氨酰 -tRNA ) 与A位的氨基酰-tRNA形成肽键。
③ 转位(或移位):
——核糖体沿mRNA 5’ →3’方向移动一个密码子。
进 位
成肽 转 位
3. 翻译终止
• 当终止密码子UAA、UAG或UGA出现在核糖 体的A位时,没有相应的氨基酰-tRNA 能与之 结合,RF识别终止密码子而进入A位。 • RF的结合触发核糖体构象改,将转肽酶活性 转变为酯酶活性,水解肽酰tRNA酯键,释放 出合成的肽,促使mRNA、tRNA、RF从核糖 体脱离。
SAE1 SUMO-GG-S-C- SAE2 Ubc9 SAE1 SAE2 SUMO-GG-S-C- Ubc9
(3)SUMO化修饰相关的酶
④ 连接酶(SUMO-ligating enzyme):主要包括三类: PIAS(protein inhibitor of activated STAT)家族成员、 RanBP2 和Pc2。 • E3 连接酶可以增强Ubc9 转移 SUMO 到底物蛋白的效 率及特异性。——可能是由于E3 连接酶能够活化 Ubc9 或拉近Ubc9 与底物蛋白的距离。
② 作为译码器——密码子与反密码子的识别 (存在摆动性)
摆动配对:
• mRNA密码子的第3个碱基与tRNA反密码子中的 第1个碱基在识别时不严格遵守A=U、G≡C配对 原则。
自由度大小由tRNA反密码子第一位碱基的种类决定: tRNA反密码子 第1位碱基 mRNA密码子 第3位碱基 I U G A C
E3(泛素连接酶,
Ubqiuitin ligase)
• E3分子量较大,约100-300 kDa。 • E3是泛素蛋白酶体途径中种类最多的一种酶,是在底物 的特异性选择降解过程中作用最为关键成员。 • 主要功能:(1)识别泛素结合酶E2;(2)识别应该被 泛素化的靶蛋白,然后使活化的泛素接近特异靶蛋白的 Lys,从而将泛素连接到靶蛋白上。
泛素广泛存在于真核生物 (目前尚未发现泛素存在于原 核生物中)的一类调节蛋白, 含有76个氨基酸残基 ,高度保 守。
泛素基因主要编码两种泛素 前体蛋白质:一种是多聚泛素, 另一种是泛素融合蛋白。
E1(泛素活化酶,
ubqiuitin-activating enzyme)
• 催化泛素与底物结合所需的第一个酶。 • 分子量110-130kDa,由1100个左右氨基酸残基组 成,对靶蛋白的识别几乎没有特异性。 • E1活性很高,低浓度即可激活泛素。
多核糖体(polysome)
• 在蛋白质生物 合成过程中, 一条mRNA同 时与多个核糖 体结合所形成 的念珠状聚合 物。
• 意义:使蛋白质合成高速、高效进行。
第五节 蛋白质的翻译后修饰
Posttranslational Modification and Targeting Transfer of Protein
1. SUMO
• SUMO是一类在物种进化过程中高度保守的小蛋白。 • 在哺乳动物中,目前已发现四种SUMO 基因,分别为 SUMO-1,-2,-3 和-4。人的SUMO-1 与泛素的氨基酸 序列只有18%的相似性(其N 端有一个21 个氨基酸的 延伸,在泛素中由不存在),但是它们的三级结构却 非常的相似。此外,SUMO 蛋白表面的电荷分布与泛 素也明显不同。
“车厢”——
E位:出口位(exit site)
后门出
整个翻译过程可分为三个阶段 :
起始(initiation)
延伸(elongation) 终止(termination)
GDP GTP IF-2 Pi
5'
A U G
IF-3
IF-1
3'
1. 翻译起始 (翻译起始复合物形成)
2. 翻译延伸
• 在 mRNA 编码区的指导下,核糖体以 20 种氨基酸 为原料、依据密码子的顺序合成肽链(方向: N 端→C端)。 这一阶段包括三个步骤的反复循环:
