2021年高考化学 考前三个月 专项突破 第十二题 物质结构与性质选考(含解析)新人教版
2021届高三化学二轮复习 物质结构与性质(选考)专题突破练12(解析版)

专题突破练12物质结构与性质(选考)非选择题(本题包括6答题,共100分)1.(2020湖南长郡中学第三次适应性考试)(15分)著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。
稀土元素包括钪、钇和镧系元素。
请回答下列问题:(1)写出基态二价钪离子(Sc2+)的核外电子排布式,其中电子占据的轨道数为。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LaCl3+3H2C2O4+n H2O La2(C2O4)3·n H2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为;1 mol H2C2O4分子中含σ键和π键的数目之比为。
②H2O的VSEPR模型为;写出与H2O互为等电子体的一种阴离子的化学式。
③HCl和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl·2H2O,HCl·2H2O中含有H5O2+,其结构为,在该离子中,存在的作用力有。
a.配位键b.极性键c.非极性键d.离子键e.金属键f氢键g.范德华力h.π键i.σ键(3)下表中列出了核电荷数为21~25的元素的最高正化合价:对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是。
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。
假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为g·cm-3(用N A表示阿伏加德罗常数的值,不必计算出结果)。
2.(2020天津南开中学一模)(15分)周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X 原子基态时L层中p轨道电子数与s轨道电子数相同;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。
回答下列问题:(1)X位于元素周期表的第周期族。
2021届高考化学提分宝典(5)物质结构与性质选考题命题分析(含答案

2021届高考化学提分宝典(5)物质结构与性质选考题命题分析(含答案【命题分析】物质结构与性质为选做题,做为“拼盘”命制的题型,各小题之间相对独立,主要考查原子结构与性质、分子结构与性质、晶体结构与性质。
在原子结构部分主要命题点有电子排布式或排布图的书写,电离能、电负性大小的比较与判断。
在分子结构部分主要命题点有化学键类型的判断,分子构型的判断,中心原子杂化方式的判断。
在晶体结构部分主要命题点有晶体类型的判断,晶体结构的计算等。
每年几乎都有电子排布、轨道、键型、杂化类型、空间结构,多数有涉及晶胞的计算,偶尔有共面原子数、电负性或电离能等。
2021年新增波长、几何形状、离子所处晶胞位置,没有对电子排布、单双键形成原因、密度提问。
说明命题组扩大了设问的范围,根据上一年的提问做适当回避。
文字性表述内容增加,得分分值不高。
在备考时,应多关注理论、概念、在解释中的应用方面下功夫,做到文字清楚、条理清晰,答其所问,拿到该拿得分。
第2022年将钾和碘相关化合物应用于化工、医药、材料等领域,研究元素的辐射波长、原子最高能量层的符号、电子云轮廓的形状和低熔点。
2022是一种典型的半导体材料——锗,它广泛地应用于电子材料领域,用于研究电子价电子的排列和锗的未配对电子的数量,并解释了锗原子难以形成双键或三键的原因,卤化锗的熔融沸点2022以自然界中广泛存在的碳及其化合物为材料,考察了C电子云和相对自旋电子数,解释了碳更容易形成共价键、共价键型、杂化轨道型、晶体型判断、等电子体、等分法计算的原因,钻石结构检查内容的原因、粒子几何、变化规律和原因、杂化轨道类型的电负性比、晶体单元中原子位置和原子间距离的计算[问题解决策略]1.基态原子核外电子排布的四方法表达式方法电子排列简化表达式价电子排列电子排列图(或轨道表22626,杂化轨道类型,粒子间作用力,原子坐标参数,已知单元参数,计算密度示例Cr:1S2S2P3S3D3D4SCU:[ar]3d4sfe:3d4s6210151表达式)2。
物质结构与性质(选择题)-2023年新高考化学真题题源解密(解析版)

专题十二物质结构与性质目录:2023年真题展现考向一分子的极性和共价键的极性考向二杂化类型和空间构型考向三电负性和电离能考向四晶胞及其计算考向五晶胞类型判断真题考查解读近年真题对比考向一电离能、电负性的应用考向二 杂化轨道及空间构型考向三 共价键的极性与分子极性的判断考向四 晶体类型判断考向五 晶胞粒子数与晶体化学式判断命题规律解密名校模拟探源易错易混速记考向一分子的极性和共价键的极性1(2023·山东卷第3题)下列分子属于极性分子的是()A.CS 2B.NF 3C.SO 3D.SiF 42(2023·浙江选考第12题)共价化合物Al 2Cl 6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al 2Cl 6+2NH 3=2Al NH 3 Cl 3,下列说法不正确的是()A.Al 2Cl 6的结构式为B.Al 2Cl 6为非极性分子C.该反应中NH 3的配位能力大于氯D.Al 2Br 6比Al 2Cl 6更难与NH 3发生反应3(2023·浙江选考第10题)X 、Y 、Z 、M 、Q 五种短周期元素,原子序数依次增大。
X 的2s 轨道全充满,Y 的s 能级电子数量是p 能级的两倍,M 是地壳中含量最多的元素,Q 是纯碱中的一种元素。
下列说法不正确的是()A.电负性:Z >XB.最高正价:Z <MC.Q 与M 的化合物中可能含有非极性共价键D.最高价氧化物对应水化物的酸性:Z >Y物质结构与性质(选择题)-2023年新高考化学真题题源解密(解析版)4(2023·新课标卷第12题)“肼合成酶”以其中的Fe 2+配合物为催化中心,可将NH 2OH 与NH 3转化为肼(NH 2NH 2),其反应历程如下所示。
下列说法错误的是()A.NH 2OH 、NH 3、H 2O 均为极性分子B.反应涉及N -H 、N -O 键断裂和N -H 键生成C.催化中心的Fe 2+被氧化为Fe 3+,后又被还原为Fe 2+D.将NH 2OH 替换为ND 2OD ,反应可得ND 2ND 2考向二杂化类型和空间构型5(2023·辽宁卷第6题)在光照下,螺呲喃发生开、闭环转换而变色,过程如下。
2021年高考化学最新物质结构大题汇编

2021 年最新物质结构大题汇编(解析版)一、考题分析物质结构与性质为选做题,做为“拼盘”命制的题型,各小题之间相对独立,主要考查原子结构与性质、分子结构与性质、晶体结构与性质。
2017 35 电子排布式、第一电离能比较、未成对电子数杂化形式、沸点高低比较及原因解释、化学键类型计算离子半径Co、Mn CO2、CH3OH、MgO、MnO 2016 35电子排布式、第一电离能、分子立体构型、杂化轨道类型晶体类型解释熔点、晶体类型、微粒间作用力、空间利用率GaAs、AsCl3、GaF3、GaCl3[高考真题]1.(2020 年全国1 卷)Goodenough 等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019 年诺贝尔化学奖。
回答下列问题:(1)基态Fe2+与Fe3+离子中未成对的电子数之比为。
(2)Li 及其周期表中相邻元素的第一电离能(I1)如表所示。
I1(Li)> I1(Na),原因是。
I1(Be)> I1(B)> I1(Li),原因是。
(3)磷酸根离子的空间构型为,其中P 的价层电子对数为、杂化轨道类型为。
(4)LiFePO4的晶胞结构示意图如(a)所示。
其中O 围绕Fe 和P 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
每个晶胞中含有LiFePO4的单元数有个。
电池充电时,LiFeO4脱出部分Li+,形成Li1−x FePO4,结构示意图如(b)所示,则x=,n(Fe2+ )∶n(Fe3+)=。
【答案】4:5 Na 与Li 同主族,Na 的电子层数更多,原子半径更大,故第一电离能更小Li,Be 和B 为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be 原子的s 能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B 的正四面体形 4 sp3 4316或0.1875 13:3【分析】题(1)考查了对基态原子电子排布规律的认识;题(2)考查了第一电离能的周期性变化规律;题(3)考查了分子或离子空间构型判断的两大理论;题(4)重点考查通过陌生晶胞的晶胞结构示意图判断晶胞组成。
新高考化学中“物质的结构与性质专项训练”的类型分析及答案

新高考化学中“物质的结构与性质专项训练”的类型分析及答案一、物质的结构与性质的综合性考察1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K 时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.第Ⅷ族元素Fe 、Co 、Ni 性质相似,称为铁系元素,主要用于制造合金。
回答下列问题:(1)基态Ni 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与Ni 相同的元素名称为______________。
(2)3Fe +与酚类物质的显色反应常用于其离子检验,已知3Fe +遇邻苯二酚()和对苯二酚()均显绿色。
2021届高考化学临考押题训练:物质结构与性质(选考) (解析版)

物质结构与性质(选考)【原卷】1.(2021·广东肇庆市高三二模)硫磷的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛,如O,O′取代基二硫代磷酸在萃取金属中有如下应用。
回答下列问题:(1)P、S、O三种元素中,电负性由大到小的顺序是______。
(2)基态硫原子价电子排布式为______。
(3)物质(A)中的S原子的杂化方式为______,二硫代磷酸根的VSEPR模型为______。
(4)物质(B)中X原子的化合价为______。
(5)将物质(A)在N2气氛中加热至7300C不再失重,得到金属硫化物的无定形粉末,其六方晶胞如下图所示,则晶胞中X的原子坐标有______种。
已知该晶胞参数︒︒的相对原子质量以M表示,阿伏加德罗常数以N A表示,则该晶α=120β=γ=90X,,体的密度为______ g· cm-3 (列出计算式)。
2.(2021·山东德州市高三一模)Fe、Co、Ni 是几种重要的金属元素。
请回答下列问题:(1)基态Ni 原子的价电子排布式为_______。
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。
推测Ni(CO)4是_______分子(填“极性”或“非极性”)。
(3)实验室常用KSCN 溶液或苯酚()检验3Fe+。
①第一电离能:N_______O(填“>”或“<”)②苯酚中碳原子杂化类型为_______。
(4)配位化合物[Co(NH3)5 Cl] Cl 2中心原子Co的配位数为_______,配位原子为_______。
(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中。
则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______。
高考化学临考选择题训练:物质结构与元素周期律(解析版)

高考化学临考选择题训练:物质结构与元素周期律(解析版)物质结构与元素周期律【原卷】 1.(2021·广东高三一模)前20号主族元素W、X、Y、Z的原子序数依次增大,且均不在同一周期。
W与Y的原子序数之和是X原子序数的2倍,化合物Z5(YX4)3XW是牙釉质的主要成分。
下列说法正确的是 A.原子半径:X>Y>Z B.沸点:W2X<YW3 C.化合物ZX2是碱性氧化物 D.氟离子会跟Z5(YX4)3XW 发生沉淀的转化 2.(2021·陕西咸阳市·高三一模)如图所示化合物是一种常用的分析试剂,其中为原子序数依次增大的同一短周期元素,且原子序数依次相差2,元素的阴离子与具有相同的核外电子层结构。
下列叙述正确的是 A.气态氢化物的稳定性: B.的溶液,C.与形成的二元化合物与水反应,元素的化合价不变D.与同族且相邻的元素的最高价氧化物对应的水化物具有两性 3.(2021·安徽池州市·高三二模)短周期元素X、Y、Z、W的原子序数依次增大。
Z 元素原子的最外层电子数是核外电子总数的四分之三,W元素原子的最外层电子数是最内层电子数的一半。
甲是X、Y两种元素形成的最简单化合物,水溶液呈碱性;乙是Z元素的单质。
它们有如下转化关系。
下列叙述正确的是A.YO2是酸性氧化物B.原子半径的大小X<Y<Z<W C.W与Z形成的所有化合物中只存在离子键D.戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2 4.(2021·山东高三一模)已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定错误的是 A.电负性:W>Z>Y>X B.气态氢化物熔沸点:W > Z C.简单离子的半径:W>X>Z D.若X与W原子序数之差为5,则形成化合物的化学式为X3W2 5.(2021·安徽安庆市·高三二模)由同一短周期非金属元素X、Y组成的化合物易水解(结构如图所示),Y的一种单质在空气中易自燃。
高中化学化学物质的结构与性质专项训练试题及解析

高中化学化学物质的结构与性质专项训练试题及解析一、物质的结构与性质的综合性考察1.2020年,自修复材料、自适应材料、新型传感材料等智能材料技术将大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu在元素周期表中位于_____区,M层中核外电子能量最高的电子云在空间有_____个伸展方向。
C、N、O第一电离能由大到小的顺序为_____________(2)氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:还原石墨烯中碳原子的杂化形式是______,上图中氧化石墨烯转化为还原石墨烯时,1号C 与其相邻 C原子间键能的变化是_____________(填“变大”、“变小”或“不变”),二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________(3)砷化硼是近期受到广泛关注一种III—V半导体材料。
砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);(,,0);(,0,);(0,,);……As:(,,);(,,);(,,);(,,)请在图中画出砷化硼晶胞的俯视图...........___________,已知晶体密度为dg/cm3,As半径为a pm,假设As、B原子相切,则B原子的半径为_________pm(写计算表达式)。
2.物质的组成与结构决定了物质的性质与变化。
回答下列问题:(1)基态铁原子简化的电子排布式为[Ar]___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
【原创】(新高考)2021届高考考前冲刺卷 化学(十二) 解析版

A.a分子的核磁共振氢谱有2组峰
B.生成高分子b的反应为加聚反应
C.1mol高分子b最多可与2mol NaOH反应
D.高分子c的水溶性比聚乙烯的水溶性好
13.用如图装置探究Cl2和NO2在NaOH溶液中的反应。通入适当比例的Cl2和NO2,发生的化学反应为Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。下列叙述正确的是
③向烧杯中加入硼酸溶液及指示剂。消化液由样液入口注入反应室,并注入一定量的氢氧化钠溶液,用蒸馏水冲洗后,封闭样液入口。反应室内反应的离子方程式为_______,烧杯中发生反应的化学方程式为_______。
④反应装置使用了双层玻璃,其作用是_______。
⑤检验蒸馏操作中氨已完全蒸出的方法是_______。
19.我国科学家制备了一种高性能Bi@氮掺杂碳纳米笼。其合成过程如图:
回答下列问题:
(1)元素Bi位于第6周期VA族,其基态原子的价电子排布式为_______。
(2)Bi(NO3)3·5H2O中各元素电负性从大到小的顺序为_______。
(3)常温下,1,3,5-苯三甲酸在水中溶解度比苯甲酸大的原因为_______。
A.Si属于p区元素,在SiC中的化合价为+4价
B.X可与氧气反应生成Y,Y分子的中心原子杂化方式为sp杂化
C.在SiC晶体中最小的环上有6个原子
D.已知Si-C键的键能为 ,则理论上分解1molSiC形成气态原子需要的能量为akJ
12.高分子修饰指对高聚物进行处理,接上不同取代基改变其性能。我国高分子科学家对聚乙烯进行胺化修饰,并进一步制备新材料,合成路线如下图。
A.从海水中提取镁的过程属于物理变化
2021届高考化学三轮专项突破《 物质结构与性质(选修)》

返
题型分析
4
【真题示范】
例 (2020年山东省学业水平等级考试,17)CdSnAs2是一种高迁移率的新型热电材料,回答
下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4 空间构型为 正四面体形 ,其固体的晶体类型为 分子晶体 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 NH3>AsH3>PH3(填化学式,下同),还原性由 强到弱的顺序为 AsH3>PH3>NH3,键角由大到小的顺序为 NH3>PH3>AsH3 。
返
常见的等电子体及空间构型
等电子类型 2原子、10电子 2原子、14电子
3原子、16电子 3原子、18电子 4原子、8电子 4原子、24电子 4原子、26电子 5原子、8电子
5原子、32电子
关键能力
常见等电子体 N2、CN-、CO、NO+
22
空间构形 直线形 直线形 直线形
V形 三角锥形 平面三角形 三角锥形 正四面体形 正四面体形
Cr原子
[Ar]3d54s1
Cr3+
[Ar]3d3
Mn2+
[Ar]3d5
Ni原子
[Ar]3d84s2
Cu+
[Ar]3d10
Cu2+
[Ar]3d9
返
关键能力
能力2 常见分子或离子的空间构型及中心原子的杂化方式
化学式
CS2 HCN BeX2 CH2O BX3 SO3 SO2 H2S
中心原子的 杂化方式 sp sp sp sp2 sp2 sp2 sp2 sp3
对物质性 物理性质和 质的影响 化学性质
2021届高考化学重点·难点专练:物质结构与性质(原卷+解析卷)

物质结构与性质【原卷】1.(2021·山东德州市·高三期末)氟及其化合物用途十分广泛,回答下列问题:(1)氟化物OF 2、NF 3、SiF 4、PF 5、SF 6中,中心原子采取sp 3杂化且分子构型为正四面体形的是______。
(2)已知氟锑酸是一种超强酸,基态锑的电子排布式为____________________。
(3)的分子内部存在氢键,画出氢键结构:_____________。
(4)工业上电解Al 2O 3制取单质铝,常利用冰晶石[]36Na AlF 降低Al 2O 3的熔点。
冰晶石的生产原理为()[]23362232Al OH 12HF 3Na CO =2Na AlF 3CO 9H O +++↑+。
①测定气态HF 的摩尔质量时,往往得不到20 g ·mol ˉ1的数据,原因是____________________。
②反应物中元素(氢除外)的第一电离能从大到小的顺序为______(用元素符号表示)。
③冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是______(填具体的微粒符号)。
(5)LiF CsF 、的晶体结构与NaCl 的晶体结构类型相同,其晶胞参数分别为apm bpm、,则LiF与CsF的密度之比为_____________(列出计算式)。
2.(2021·安徽黄山市·高三一模)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
回答下列问题:(1)Co3+的价电子排布图为:_________________;基态磷原子有__________种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:_________________。
物质结构与性质-2021年高考化学三轮题型

物质结构与性质(选3)【高考定位】物质结构与性质的常见题型为综合题,常以元素推断或某一主题两种方式引入,考查学生的归纳推理能力、信息迁移能力以及综合应用能力。
物质结构包括原子结构(原子核外电子排布、原子的杂化方式、元素电负性大小比较、元素金属性、非金属性的强弱)、分子结构(化学键、分子的电子式、结构式、结构简式的书写、化学式的种类、官能团等)、晶体结构(晶体类型的判断、物质熔沸点的高低、影响因素、晶体的密度、均摊方法的应用等)。
【知识讲解】一、原子结构与性质原子结构与性质在高考中常见的命题角度有原子核外电子的排布规律及其表示方法、原子结构与元素电离能和电负性的关系及其应用。
在高考试题中,各考查点相对独立,难度不大。
试题侧重原子核外电子排布式或轨道表示式,未成对电子数判断,电负性、电离能、原子半径和元素金属性与非金属性比较的考查。
高考中考查点主要集中在电子排布的书写及电离能、电负性大小比较上,所以在书写基态原子电子排布时,应避免违反能量最低原理、泡利原理、洪特规则及特例;还需注意同能级的轨道半充满、全充满或全空状态的原子结构稳定如Cr:3d54s1、Mn:3d54s2、Cu:3d104s1、Zn:3d104s2;另外需理解电离能与金属性及金属元素价态的关系,电负性与非金属性及组成化合物所形成的化学键的关系。
二、分子结构与性质分子结构与性质在高考中的常见命题角度有围绕某物质判断共价键的类型和数目,分子的极性、中心原子的杂化方式,微粒的立体构型,氢键的形成及对物质的性质影响等,考查角度较多,但各个角度独立性大,难度不大。
试题侧重微粒构型、杂化方式、中心原子的价层电子对数、配位原子判断与配位数、化学键类型、分子间作用力与氢键、分子极性的考查。
常考点有对σ键和π键判断,要掌握好方法;杂化轨道的判断,要理解常见物质的杂化方式;通过三种作用力对性质的影响解释相关现象及结论。
注意以下三个误区:不要误认为分子的稳定性与分子间作用力和氢键有关,其实分子的稳定性与共价键的强弱有关;不要误认为组成相似的分子,中心原子的杂化类型相同,关键是要看其σ键和孤电子对数是否相同。
2021届高考化学考前大题训练: 物质结构与性质综合题 (解析版)

物质结构与性质综合题【原卷】1.深紫外固体激光器可用于高温超导、催化剂研究领域。
我国自主研发的氟硼铍酸钾()晶体制造深紫外固体激光器技术领先世界。
回答下列问题:(1)基态原子最高能级电子数之比是_______,晶体熔点由高到低的顺序是_______。
(2)在气相中,氯化铍以二聚体的形式存在,原子的杂化方式是_______,中含有_______配位键。
(3)一定条件下,可与铜反应生成氟化剂的,其结构式是_______。
已知在时就发生类似的分解反应,其不稳定的原因是_______。
(4)晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构与相似如图1所示。
O原子的配位数是_______;沿晶胞面对角线投影,图2中能正确描述投影结果的是_______(填序号)。
设O与的最近距离为晶体的密度为,则阿伏加德罗常数的值为_______(用含a和d的式子表示)。
2.2020年12月17日凌晨1时59分,“嫦娥五号”首次实现了我国地外天体采样返回,标志着我国航天事业迈出了一大步。
带回的月壤中包含了H、O、N、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。
回答下列问题:(1)锌(Zn)、镉(Cd)位于同一副族相邻周期,Cd的原子序数更大,则基态Cd原子的价电子轨道表示式(电子排布图)为___。
(2)S与O可形成多种微粒,其中SO的空间构型为__;液态SO3冷却到289.8K 时,能得到一种螺旋状单链结构的固体,其结构如图所示,此固态SO3中S原子的杂化轨道类型是__。
(3)重铬酸铵为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O的结构如图所示。
则1mol重铬酸铵中含σ键与π键个数比为__。
(4)α—Al2O3是“嫦娥五号”中用到的一种耐火材料,具有熔点高(2054℃)、硬度大的特点,主要原因为__。
(5)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为___。
物质结构与性质综合题-2023年新高考化学真题(解析版)

物质结构与性质综合题目录:2023年真题展现考向一考查杂化轨道、空间结构、晶体类型、晶胞计算考向二考查同素异形体、晶体类型、杂化轨道、晶胞计算考向三考查电子排布式、电负性、空间结构、杂化轨道、晶胞计算考向四考查电子排布式、电离能、空间结构、晶胞计算考向五考查电子排布式、杂化轨道、晶胞计算真题考查解读近年真题对比考向一考查电子排布式、杂化轨道、空间构型、晶胞计算考向二考查电子排布式、键角、电负性、杂化轨道、晶胞计算考向三考查轨道表示式、电离能、杂化轨道、晶胞计算考向四考查电子排布式、元素周期表、配位键、氢键、相似相溶考向五考查电子排布式、键角、氢键、晶胞计算考向六考查电离能、几何构型、轨道表示式、顺磁性物质命题规律解密名校模拟探源易错易混速记考向一考查杂化轨道、空间结构、晶体类型、晶胞计算1(2023·浙江选考第17题)硅材料在生活中占有重要地位。
请回答:(1)Si(NH2)4分子的空间结构(以Si为中心)名称为,分子中氮原子的杂化轨道类型是。
Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是。
A.微粒半径:③>①>②B.电子排布属于基态原子(或离子)的是:①②C.电离一个电子所需最低能量:①>②>③D.得电子能力:①>②(3)Si与P形成的某化合物晶体的晶胞如图。
该晶体类型是,该化合物的化学式为。
【答案】(1)四面体sp3Si周围的NH2基团体积较大,受热时斥力较强Si(NH2)4中Si-N键能相对较小;产物中气态分子数显著增多(熵增)(2)AB(3)共价晶体SiP2【解析】(1)Si(NH2)4分子可视为SiH4分子中的4个氢原子被-NH2(氨基)取代形成的,所以Si(NH2)4分子中Si原子轨道的杂化类型是sp3,分子的空间结构(以Si为中心)名称为四面体;氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是sp3;Si周围的NH2基团体积较大,受热时斥力较强Si(NH2)4中Si-N键能相对较小;产物中气态分子数显著增多(熵增),故Si(NH2)4受热不稳定,容易分解生成Si3N4和NH3;(2)电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,可推知分别为基态Si原子、Si+离子、激发态Si原子;激发态Si原子有四层电子,Si+离子失去了一个电子,根据微粒电子层数及各层电子数多少可推知,微粒半径:③>①>②,选项A正确;根据上述分析可知,电子排布属于基态原子(或离子)的是:①②,选项B正确;激发态Si原子不稳定,容易失去电子;基态Si原子失去一个电子是硅的第一电离能,Si+离子失去一个电子是硅的第二电离能,由于I2>I1,可以得出电离一个电子所需最低能量:②>①>③,选项C错误;由C可知②比①更难失电子,则②比①更容易得电子,即得电子能力:②>①,选项D错误;故选AB;(3)Si与P形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有8×18+6×12=4个Si,8个P,故该化合物的化学式为SiP2。
物质结构与性质(选修)-2021年高考真题和模拟题化学分项汇编(原卷版)

专题17 物质结构与性质1.(2021·全国高考真题)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。
该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
回答下列问题:(1)太阳能电池板主要材料为单晶硅或多晶硅。
Si的价电子层的电子排式为________;单晶硅的晶体类型为_________。
SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______。
SiCl4可发生水解反应,机理如下:含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。
(2)CO2分子中存在_______个σ键和______个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。
四方ZrO2晶胞如图所示。
Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为______g·cm-3(写出表达式)。
在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn x Zr1-x O y,则y=________(用x表达)。
2.(2021·吉林长春市·长春外国语学校高二月考)过渡金属元素铬()Cr是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
回答下列问题:(1)对于基态Cr 原子,下列叙述正确的是_______(填标号)。
A .轨道处于半充满时体系总能量低,核外电子排布应为51[Ar]3d 4sB .4s 电子能量较高,总是在比3s 电子离核更远的地方运动C .电负性比钾高,原子对键合电子的吸引力比钾大(2)三价铬离子能形成多种配位化合物。
2021届高考化学三轮考点突破训练 物质的结构与性质(含解析)

2021届高考化学三轮考点突破 物质的结构与性质1.氨硼烷(33NH BH )含氢量高、热稳定性好 , 是一种具有潜力的固体储氢材料。
回答以下问题 : (1)H 、B 、N 中 , 原子半径最大的是______。
根据对角线规那么 , B 的一些化学性质与元素______的相似。
(2)33NH BH 分子中 , N —B 化学键称为____键 , 其电子对由____提供。
氨硼烷在催化剂作用下水解释放氢气 :+3-4363322NH B O 3NH BH +6H O3++9H3-36B O 的结构为。
在该反应中 , B 原子的杂化轨道类型由______变为______。
(3)33NH BH 分子中 , 与N 原子相连的H 呈正电性(δ+H ) , 与B 原子相连的H 呈负电性(δ-H ) , 电负性大小顺序是__________。
与33NH BH 原子总数相等的等电子体是_________(写分子式) , 其熔点比33NH BH ____________(填〞高〞或〞低〞) , 原因是在33NH BH 分子之间 , 存在____________________作用 , 也称〞双氢键〞。
(4)研究发现 , 氨硼烷在低温高压条件下为正交晶系结构 , 晶胞参数分别为pm pm pm a b c 、、 ,90αβγ===︒。
氨硼烷的2×2×2超晶胞结构如下列图。
氨硼烷晶体的密度ρ=___________3g cm -(列出计算式 , 设A N 为阿伏加德罗常数的值)。
2.钙钛矿(3CaTiO )型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料 , 回答以下问题 :(1)基态Ti 原子的核外电子排布式为____________。
(2)Ti 的四卤化物熔点如下表所示 , 4TiF 熔点高于其他三种卤化物 , 自4TiCl 至4TiI 熔点依次升高 , 原因是____________。
2021年高考化学 专项训练题12

2021年高考化学专项训练题12一、选择题1、下列说法正确的是( )A.油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2OD.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间2、下列物质的分类正确是( )A.纯净物:明矾、天然橡胶 B.混合物:蔗糖、水玻璃C.弱电解质:NH4HCO3、H2SiO3 D.非电解质:CO2、CH3CH2OH3、X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。
已知:甲+乙 = 丁+己,甲+丙= 戊+己;0.1 mol·L-1丁溶液的pH为13(25℃)。
下列说法正确的是( )A.原子半径:W>Z>Y>XB.Y元素在周期表中的位置为第三周期第ⅣA族C.1 mol甲与足量的乙完全反应共转移了1 mol电子D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol4、“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )A.加热时,①上部汇集了固体碘,说明碘的热稳定性较差B.加热时,②、③溶液均变红,冷却后又都变为无色C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D.四个“封管实验”中都有可逆反应发生5、下列说法正确的是( )A.按系统命名法,的名称为2,5,6-三甲基-4-乙基庚烷B.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大C.肌醇与葡萄糖的元素组成相同,化学式均为C6H12O6,满足C m(H2O)n,因此,均属于糖类化合物D.1.0 mol的最多能与含5.0 mol NaOH的水溶液完全反应6、下列说法正确的是( )A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)H2O(l) 的ΔH= 40.69 kJ·mol-1B.已知MgCO3的K sp= 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+) · c(CO32-) = 6.82 × 10-6C.已知:共价键C-C C=C C-H H-H键能/ kJ·mol-1348 610 413 436则可以计算出反应的ΔH为-384 kJ·mol-1D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低。
2021-2023北京高考真题化学汇编:物质的结构与性质(选择)
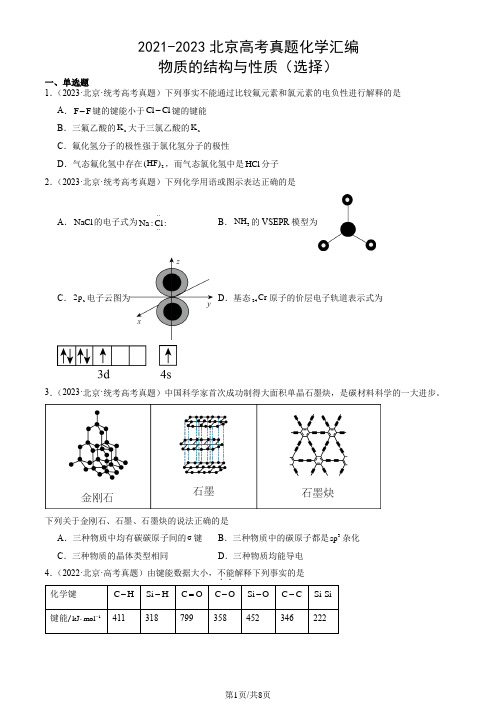
2021-2023北京高考真题化学汇编物质的结构与性质(选择) A .NaCl 的电子式为····Na :Cl : B .3NH 的VSEPR 模型为 C .z 2p 电子云图为 D .基态24Cr 原子的价层电子轨道表示式为3.(2023·北京·统考高考真题)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是A .分子中N 原子有2sp 、3sp 两种杂化方式A .H 分子的共价键是s s σ-键,Cl 分子的共价键是s p σ-键B.顺2--丁烯的分子结构模型:C.基态Si原子的价层电子的轨道表示式:D.22Na O的电子式:9.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。
其中(3Cu NH⎡⎣中溶液的小,Cu缓慢析出,镀层更致密是一种人工合成的多肽,其合成路线如下。
下列说法不正确...的是 A .F 中含有2个酰胺基B .高分子Y 水解可得到E 和GC .高分子X 中存在氢键D .高分子Y 的合成过程中进行了官能团保护12.(2021·北京·高考真题)下列性质的比较,不能用元素周期律解释的是A .酸性:HClO 4>H 2SO 3>H 2SiO 3B .碱性:KOH >NaOH >LiOHC .热稳定性:H 2O >H 2S >PH 3D .非金属性:F >O >N13.(2021·北京·高考真题)下列有关放射性核素氚(31H )的表述不正确的是A .31H 原子核外电子数为1B .31H 原子核内中子数为3C .312H 与H 2化学性质基本相同D .312H O 具有放射性参考答案1.A 【详解】A .F 原子半径小,电子云密度大,两个原子间的斥力较强,F F -键不稳定,因此F F -键的键能小于Cl Cl -键的键能,与电负性无关,A 符合题意;B .氟的电负性大于氯的电负性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021年高考化学考前三个月专项突破第十二题物质结构与性质选考(含解析)新人教版1.元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点。
(1)锗(Ge)可以作半导体材料,写出基态锗原子的电子排布式______________。
(2)环硼氮六烷的结构和物理性质与苯很相似,故称为无机苯,其结构为①第一电离能介于B、N之间的第二周期元素有______种。
②无机苯分子中1个氮原子给有空轨道的硼原子提供1个孤电子对,形成1个________键。
③硼、氮原子的杂化方式是______________。
(3)硅烷的通式为Si n H2n+2,随着硅原子数增多,硅烷的沸点逐渐升高,其主要原因是____________________。
最简单的硅烷是SiH4,其中的氢元素显-1价,其原因为______________。
(4)根据价层电子对互斥理论(VSEPR)推测:AsCl3的VSEPR模型名称:__________;AsO3-4的立体构型:__________。
(5)钋(Po)是一种放射性金属,它的晶胞堆积模型为简单立方堆积,钋的摩尔质量为209 g·mol -1,晶胞的密度为ρg·cm-3,则它晶胞的边长(a)为________ pm。
(NA表示阿伏加德罗常数,用代数式表示晶胞边长)答案(1)1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2(2)①3②配位③sp2(3)相对分子质量增大,分子间作用力增大氢原子的电负性比硅原子电负性大(4)四面体形正四面体形(5) 3209ρN A×1010解析(2)①根据电离能的变化规律,具有半充满和全充满的电子构型元素的稳定性较高,所以第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。
②无机苯类似苯结构,分子存在大π键。
由单方原子提供孤电子对与含空轨道的原子形成配位键。
③类比苯的结构可知,由硼氮原子形成平面六元环结构,所有原子共面,B、N都是sp2杂化。
(3)硅烷相对分子质量随着硅原子数的增多而增大,硅烷分子间作用力增大,硅烷沸点升高;氢原子的电负性大,吸引电子能力比硅强。
(4)三氯化砷分子中砷原子价电子有4对,其中3个成键电子对、1个孤电子对,VSEPR模型包括孤电子对和成键电子对,VSEPR模型为四面体形;AsO3-4中砷原子价电子对数为4(5+0×4+32=4),4个电子对都是成键电子对,它的立体构型为正四面体形。
(5)钋晶胞模型如图所示:1个晶胞含1个钋原子。
1 cm=1×1010 pm,m(Po)=209N Ag;ρ=mV=m Poa3,a3=209N A×ρ,a=3209ρN Acm=3209ρN A×1010 pm。
2.氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等。
氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等。
请回答下列问题:(1)V原子的核外电子排布式为__________。
如图所示为一个完整的CaF2晶胞,则图中空心球表示____(填“F-”或“Ca2+”)。
设晶胞边长为a,则Ca2+与F-之间的最近距离为__________。
(2)OF2分子中氧原子的轨道杂化类型为__________,OF2被称为氟化物而不被称为氧化物的原因是______________________________。
(3)O2F2是一种强氧化剂,由O2和F2在低温下合成,运用VSEPR模型给出O2F2分子的结构式:____________,O2F2是________(填“极性”或“非极性”)分子。
(4)氢氟酸是一种弱酸,但很浓的氢氟酸是一种强酸,其原因是__________________。
答案(1)1s22s22p63s23p63d34s2(或[Ar]3d34s2) Ca2+3a 4(2)sp3氧化物中氧元素的化合价为-2,而在OF2中氧元素的化合价为+2价(3) 极性(4)因为F-有很强的结合质子的能力,与未电离的HF之间以氢键的方式结合,从而有效地降低了溶液中F-的浓度,促使原来的电离平衡向右移动,因此酸性增强解析(1)根据晶胞特点和CaF2中阴、阳离子个数之比为2∶1可知图中空心球表示Ca2+。
晶胞边长即立方体的边长为a,体对角线为3a,则阴、阳离子间的最短距离为34a。
(3)根据价层电子对互斥理论可知O2F2的结构式为,为不对称结构,因此是极性分子。
3.(1)C、N、O三种元素第一电离能从大到小的顺序是____________________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
NH3分子的空间构型是________;与N2H4分子属于等电子体的是________________________________________________________________________。
(写出一种即可)(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
请回答下列问题:①Ni原子的核外电子排布式为_____________________________________________________ ___________________;②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO______FeO(填“<”或“>”);③NiO晶胞中Ni和O的配位数分别为________、_____________________________________ ___________________________________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心位置,Au原子处于顶点位置,则该合金中Cu原子与Au原子个数之比为__________;该晶体中,原子之间的强相互作用是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2晶胞(如图)的结构相似,该晶体储氢后的化学式应为________________________________________________________________________。
答案(1)N>O>C(2)三角锥形CH3OH(或CH3SH)(3)①1s22s22p63s23p63d84s2(或[Ar]3d84s2)②>③6 6(4)5d106s13∶1金属键H8AuCu34.元素周期表第四周期中共有18种元素,请回答下列有关问题。
(1)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为________,第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
但Ga的第一电离能却明显低于Zn的,原因是______________________。
(2)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1 ℃,沸点为186 ℃,则GeBr4晶体的类型为________,中心原子的杂化类型为________。
(3)第四周期ⅤA~ⅦA族的元素中,电负性由大到小的顺序为________(用元素符号表示)。
(4)如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是________(填“a”或“b”)。
图乙为金属铜的晶胞,此晶胞立方体的边长为a pm,金属铜的密度为ρg·cm-3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
答案(1)3d34s2Zn的价电子层处于全充满状态,较稳定(2)分子晶体sp3(3)Br>Se>As(4)b 256ρa3×1030解析(1)Ga的基态原子价电子排布式为4s24p1,锌的为3d104s2,前者的4p1为不稳定结构,而后者的4s2为稳定结构,故前者的第一电离能较小。
(2)由GeBr4的熔、沸点知其晶体类型为分子晶体,GeBr4中锗形成四个单键,故其为sp3杂化。
(3)同周期主族元素的电负性随原子序数的增大而增大。
(4)a图中1个“花球”的周围有6个相邻的“白球”,1个“白球”的周围有3个相邻的“花球”,则“花球”与“白球”的个数比为1∶2;同理可分析b图,其中“花球”与“白球”的个数比为1∶3,则b图所表示的物质的化学式为AX3。
根据均摊法知图乙表示的晶胞中含有4个铜原子,所以1 mol该晶胞含4 mol铜原子,1 mol 该晶胞的体积是N A(a×10-10)3 cm3,则有10-30ρN A a3=4(mol)×64(g·mol-1)。
5.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的核外电子排布式为__________。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式________、__________。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2===CH2、②HC≡CH、③、④HCHO,其中碳原子采取sp2杂化的分子有________(填物质序号),HCHO分子的立体结构为________形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示。
该合金的化学式为______________。
(5)丁二酮肟常用于检验Ni2+。
在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示。
该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
答案(1)1s22s22p63s23p63d84s2(或[Ar]3d84s2)(2)N2CN-(或O2+2、C2-2、NO+)(3)①③④平面三角(4)LaNi5或Ni5La(5)见图6.第ⅢA、ⅤA族元素组成的化合物AlN、AlP、AlAs等是人工合成的半导体材料,它们的晶体结构与单晶硅相似,与NaCl的晶体类型不同。
(1)核电荷数比As小4的原子基态电子排布式为____________________________________。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有________种。
(3)NCl3中心原子杂化方式为________________,NCl3的空间构型为__________。
