Folin-酚法测定蛋白质含量工作曲线的制作
Folin-酚试剂法测定蛋白质含量

Folin-酚试剂法测定蛋白质含量Folin-酚试剂法测定蛋白质含量一、实验目的1,掌握Folin-酚试剂法测定蛋白质含量的原理及其具体实验操作技术;2,掌握制作标准曲线的要领;3,学会通过标准曲线求样品溶液中待测定物质含量的方法。
二、实验原理1,蛋白质分子中含有的肽键在碱性条件下可以与Cu2+螯合形成蛋白质- Cu2+复合物,即发生双缩脲反应。
而此复合物中的含酚羟基的酪氨酸或色氨酸残基可以还原Folin-酚试剂的磷钼酸盐-磷钨酸盐,产生蓝色化合物(钼蓝和钨蓝的混合物),即发生Folin-酚显色反应。
同时,在碱性条件下Folin-酚试剂极不稳定,从而易被蛋白质还原而呈蓝色反应。
2,在一定浓度范围内,蓝色化合物的蓝色深浅与蛋白质浓度呈正比。
故通过测定相应浓度梯度的蛋白质标准溶液吸光度可依其作出标准曲线,以此绘制的标准曲线和供试品中蛋白质溶液吸光度可求出供试品中蛋白质的含量。
三、材料和方法样品:健康人血清(300倍稀释);正常人血清蛋白质含量:60~80 g/L试剂:牛血清白蛋白标准液(200µg/ml);碱性硫酸铜溶液(现配);Folin-酚试剂仪器与器材: V-1100分光光度计;恒温水浴箱;试管6支、试管架;加样枪、加样枪架;坐标纸实验步骤示意详细步骤A ,配置一定浓度梯度溶液: 取6支试管分别编号1至6,按下表加样。
(1作空白对照,2-5作标准,6为待测样品)1,加样时按横向顺序加样,并在加入碱性硫酸铜时:于一号试管加入碱性硫酸铜溶液2ml 后等待一分钟再往下一支试管加入同量的碱性硫酸铜溶液,摇匀。
如此类推混匀并将其静置在室温下。
2,在全部试管加完碱性硫酸铜试剂之至距第一支试管加样10分钟后,于第1支试管立即加入0.20mL Folin-酚试剂,并于2s 内摇匀。
1分钟后第2支试管加入0.20mL Folin-酚试剂,2分钟后加第3支试管,以此类推。
B ,加样完毕后将各试管每隔1min 按1-6顺序放一只试管入水浴箱,分别40℃水浴10min 后取出冷却至室温。
蛋白质浓度测定(folin酚法)

实验目的:
熟悉并掌握福林-酚法测定蛋白质浓度的原理和方法。
实验原理:
蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧 化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,可 用比色法测定蛋白质浓度。
实验器材:
样品血清(稀释200倍) 标准酪蛋白溶液(200ug/ml) Folin-酚甲液:
白 0 0.2 0.4 0.6 0.8 1.0 —— —— —— 血清 —— —— —— —— —— —— 0.2 0.2 0.2
水 1.0 0.8 0.6 0.4 0.2 0 0.8 0.8 0.8
Folin 酚甲
5ml,30摄氏度水浴10min
Folin 酚乙
0.5ml,30摄氏度水浴30min
2、 用可见处的吸光度。
3、 以蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线。 4、 由样品吸光度在标准曲线中找出样品浓度。
实验结果:
试剂 1 2 3 4 5 6 7 8 9
酪蛋 白 0 0.2 0.4 0.6 0.8 1.0 —— —— ——
血清 —— —— —— —— —— —— 0.2 0.2 0.2
水 1.0 0.8 0.6 0.4 0.2 0 0.8 0.8 0.8
Folin 酚甲
5ml,30摄氏度水浴10min
Folin 酚乙
0.5ml,30摄氏度水浴30min
A640 0 0.131 0.234 0.325 0.407 0.515 0.289 0.296 0.272
A 4%Na2CO3:0.2mol/lNaOH=1:1 B 1%CuSO4:2%酒石酸钾钠=1:1 A:B=50:1 混匀 Folin-酚乙液 可见分光光度计、试管(9支)、移液枪、移液管、烧杯、希尔球。
folin酚试剂法测定蛋白质含量

注意事项2
因Lowry反应的显色随时间不断加深,因此各项操 作必须精确控制时间。
– 即第1支试管加入2.0mL碱性硫酸铜试剂后,开始计时 ,1分钟后,第2支试管加入2.0mL碱性硫酸铜试剂,2 分钟后加第3支试管,以此类推。 – 全部试管加完碱性硫酸铜试剂后若已到10分钟,则第1 支试管可立即加入0.20mL Folin-酚试剂,1分钟后第2 支试管加入0.20mL Folin-酚试剂,2分钟后加第3支试 管,以此类推。
生物化学与分子生物学实验教学中心
选择测定方法时应考虑
实验对测定所要求的灵敏度和精确度; 蛋白质的性质;
溶液中存在的干扰物质;
测定所花费的时间等。
生物化学与分子生物学实验教学中心
本法概述
1921年,Folin 首创,利用蛋白质分子中酪氨酸 和色氨酸残基(酚基)与还原酚试剂(磷钨酸 -磷 钼酸)起蓝色反应。 1951年,Lowry对此法进行了改进,先于标本中加 碱性铜试剂,再与酚试剂反应,提高了灵敏度。
试剂
1.牛血清白蛋白标准液(200μg/ml)
2.碱性硫酸铜溶液(当日有效) 3.Folin-酚试剂
仪器与器材
1.V-1100分光光度计
2.恒温水浴箱 3.试管6支、试管架 4.加样枪、加样枪架
生物化学与分子生物学实验教学中心
操作步骤
取6支试管,做好标记,按下表顺序操作:
加入物(ml) 1 2 3 4 5 6
生物化学与分子生物学实验教学中心
V-1100分光光度计操作步骤
开机,预热30分钟 转动波长旋钮,调所需波长。按 将黑体放入光路中,合上盖,按
MODE 0%
键切换到T档 键校零
开盖,将参比液按空白液、标准液、待测液顺序放入比色杯架上,合上 盖,按 键切换到A档 MODE
Folin酚测蛋白质含量实验报告

生物化学实验报告姓名:学号:专业年级: 2014级生物信息学组别:第8实验室生物化学与分子生物学实验教学中心实验名称Folin-酚试剂法测定蛋白质含量实验日期2015-11-2 实验地点第8实验室合作者指导老师评分教师签名批改日期一、实验目的1、掌握Folin-酚试剂法测定蛋白质含量的原理及其实验操作技术。
2、掌握制作标准曲线的要领和通过标准曲线求样品溶液中待测定物质含量的方法。
3.熟悉分光光度计的用法。
二、实验原理1.在碱性溶液中,蛋白质分子中的肽键与碱性铜试剂中的Cu2+作用生成紫红色的蛋白质- Cu2+复合物。
2.蛋白质- Cu2+复合物中所含的酪氨酸或色氨酸残基还原酚试剂中的磷钼酸和磷钨酸,生成蓝色的化合物。
3.在一定浓度范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故与同样处理的蛋白质标准液比色即可求出蛋白质的含量。
三、材料与方法1.实验材料(1)样品健康人血清(300倍稀释);正常人血清蛋白质含量:60~80 g/L(2)试剂牛血清白蛋白标准液(200μg/ml);碱性硫酸铜溶液(现配现用);Folin-酚试剂(3)仪器与器材V-1100分光光度计;恒温水浴箱;试管6支、试管架;加样枪、加样枪架;坐标纸2.实验步骤(1)图示(2)取6支试管做好标记,再按下表加样:(1作空白对照,2-5作标准,6为待测样品)(3)加样时按横向顺序加样,并在加入碱性硫酸铜时:于1号试管加入碱性硫酸铜溶液2ml后等待1分钟再往下一支试管加入等量的碱性硫酸铜溶液,摇匀。
以此类推。
(4)在全部试管加完碱性硫酸铜试剂之至距第一支试管加样10分钟后,于第1支试管立即加入0.20mL Folin-酚试剂,并于2s内摇匀。
1分钟后第2支试管加入0.20mL Folin-酚试剂,2分钟后加第3支试管,以此类推。
(5)加样完毕后将各试管每隔1min按1-6顺序放一只试管入水浴箱,分别40℃水浴10min后取出冷却至室温。
(6)以500nm波长比色,以1号管作空白对照,按2-6顺序每隔一分钟测定一支试管内溶液吸光度并重复测三次,记下读数,求出平均值,记录数据并计算结果。
Folin-酚试剂法测定蛋白质含量

Folin- 酚试剂法测定蛋白质含量实验目的掌握Folin- 酚试剂法测定蛋白质含量的原理、操作技术掌握制作标准曲线的要领,并通过标准曲线求样品溶液中待测定物质含量。
提高在严格时间限定下的实验操作能力。
二、实验原理蛋白质分子中酪氨酸可以和色氨酸残基(酚基)还原酚试剂(磷钨酸- 磷钼酸)起蓝色反应,此法由folin 在1921 年开创。
1951年,Lowry 对此法进行了改进,先于标本中加碱性铜试剂,再与酚试剂反应,提高了灵敏度。
第一步:双缩脲反应在碱性溶液中,双缩脲(H2NOC-NH-CONH2能)与Cu2+作用,形成紫色或紫红色的络合物。
即在碱性溶液中,蛋白质分子中的具有双缩脲结构的肽键与碱性铜试剂中的Cu2+ 作用生成紫红色的蛋白质- Cu2+复合物。
第二步:Folin- 酚显色反应Folin- 酚试剂在碱性条件下极不稳定,其磷钼酸盐- 磷钨酸盐易被酚类化合物还原而呈蓝色反应(钼蓝和钨蓝的混合物)。
蛋白质- Cu2+复合物中所含的带酚羟基的酪氨酸或色氨酸残基还原酚试剂中的磷钼酸和磷钨酸,生成蓝色的化合物。
在一定浓度范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故与同样处理的蛋白质标准液比较即可求出样品中蛋白质的含量。
三、实验材料(一)样品健康人血清(300倍稀释,正常人血清蛋白质含量:60~80 g/L )(二)试剂牛血清白蛋白标准液(200μg/ml ),碱性硫酸铜溶液,Folin- 酚试剂(三)仪器与器材V-1100分光光度计,恒温水浴箱,移液管(2mL),洗耳球,试管6 支,试管架,加样枪,加样枪架四、实验步骤(一)操作步骤见表1-1表1-1 folin- 酚试剂法定量蛋白质实验步骤重复测三次,求平均值用于绘制标准曲线。
二)注意事项1.操作控制:folin- 酚试剂加到碱性铜- 蛋白质溶液中后,必须立即混匀,使还原反应发生在磷钼酸- 磷钨酸被破坏之前2.时间控制:因反应显色随时间不断加深,因此各项操作必须精确控制时间。
蛋白质浓度测定Folin-酚法

蛋白质浓度测定——Folin-酚测定一)实验目的:熟悉并掌握福林-酚法测定蛋白质浓度的原理和方法。
二)实验原理:蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,可用比色法测定蛋白质浓度。
三)实验器材试剂:1、标准酪蛋白:200ug/ml2、Folin-酚乙试剂:乙液:原液:水=1:1:13、Folin-酚甲液:4%Na2CO3:0.2mol/lNaOH=1:1 A1%CuSO4:2%酒石酸钾钠=1:1 BA:B=50:1 混匀4、血清:稀释200倍5、分光光度计试管(9支)吸管0.5ml(1支)、1ml(3支)四)实验操作:1、标准曲线的绘制将9支干净的试管编号,按下表所示顺序加入试剂并操作。
表1 Folin-酚法测定酪氨酸浓度试剂管号 1 2 3 4 5 6 A B C酪氨酸0 0.2 0.4 0.6 0.8 1.0 0 0 0 血清0 0 0 0 0 0 0.2 0.2 0.2 蒸馏水 1.0 0.8 0.6 0.4 0.2 0 0.8 0.8 0.8 分别加入5ml,混匀后放入30℃水中水浴10minFolin-甲Folin-分别加入0.5ml,混匀后放入30℃水中水浴30min乙640nm 0 0.085 0.163 0.223 0.287 0.349 0.216 0.224 0.2122、样液测定将9支试管分别放于分光光度计中测定其吸光度,对照标准曲线求出样液蛋白质浓度。
五)实验结果:1、不同浓度酪氨酸与样液的吸光度表2 不同浓度酪氨酸与样液的吸光度管号 1 2 3 4 5 6 A B C0 0.085 0.163 0.223 0.287 0.349 0.216 0.224 0.212吸光度2、标准蛋白分度曲线:六)结果分析:1、数据分析:最终所得数据与酪氨酸浓度大致呈一正比的关系,血清的吸光度有着一定的波动,但波动不大,些许误差可能是因系统存在误差。
生化实验报告 福林(Folin)-酚试剂法测定蛋白质的浓度

实验三:福林(Folin)-酚试剂法测定蛋白质的浓度一、实验目的1.学会制备无蛋白血滤液。
2.掌握Folin-Wu法测定血糖含量的原理和方法。
3.掌握7200型可见分光光度计的使用方法。
二,实验原理蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。
蓝色的深浅与蛋白质的含量成正比,可用比色法测定。
三.实验仪器1.试管2.移液管3.卵清蛋白片4.7220分光光度计四.实验试剂1、碱性硫酸铜溶液A液:无水碳酸钠35g,酒石酸钠13g及碳酸氢钠11g溶于蒸馏水,稀释定容至1000ml.B液:硫酸铜晶体5g,溶于蒸馏水并定容至100ml。
临用时,A液:B液=9:1混合(体积比),混合液于冰箱中保存(4℃)。
2、标准葡萄糖溶液(0.1mg/ml)(1)1%葡萄糖母液:称取1.000g葡萄糖,溶于蒸馏水,稀释并定容至100ml。
(2)葡萄糖标准液:取1.0ml葡萄糖母液于100ml容量瓶中,加蒸馏水定容。
3、10%钨酸钠溶液:称取钨酸钠10g,溶于蒸馏水并定容至100毫升。
4、0.33mol/LH2SO4溶液:于53ml蒸馏水中加入1ml的浓硫酸。
五.实验步骤1、无蛋白血滤液的制备:用奥氏吸管吸取全血(已加抗凝剂)1ml,缓缓放入100ml锥形瓶中,加蒸馏水7ml,摇匀,溶血后(血液变为红色透明)加10%钨酸钠1ml,摇匀.。
再加0.33mol/L H2SO41ml,边加边摇,加毕充分摇匀,放置5~15分钟,至沉淀变为暗棕色(如不变色可再加0.33mol/L H2SO41-2滴)。
用干滤纸过滤。
先倾入少许,待滤纸湿润后在全部倒入,如滤液不清需重新过滤。
每毫升无蛋白血滤液相当于1/10ml全血。
2、血糖的定量测定:取25ml的血糖管3支,编号。
第一支血糖管中加入2ml蒸馏水(空白管);第二支血糖管中加2ml标准葡萄糖液;用吸管吸取无蛋白血滤液2ml,放入第三支血糖管中。
蛋白质含量的测定(Folin—酚法)
实验报告实验名称:蛋白质含量的测定(Folin-酚法)实验日期:班级:学生姓名:研究背景与目的:蛋白质是生物最重要的基本组成成份之一, 蛋白质的定量分析方法的研究在国际上一直十分活跃,Folin-酚法是一种灵敏度极高,可快速测定蛋白质含量的方法,广泛地应用于蛋白质含量的测定。
本实验培养掌握使用Folin-酚法测定蛋白质含量的原理和操作方法,同时熟练722分光光度计的使用和比色法。
实验原理:Folin-试剂是由两部分组成,甲试剂相当于双缩脲试剂,在碱性条件下,蛋白质中的肽键与铜离子结合生成络合物。
试剂乙是磷钨酸和磷钼酸的混合液,在碱性条件下极不稳定,易被蛋白质和试剂甲生成的络合物还原,生成钼蓝和钨蓝混合物而呈蓝色反应。
根据此试剂与蛋白质的反应以及一定条件下,兰色深度与蛋白的量成正比,可用比色法,使用分光光度计,通过对呈现蓝色的混合物进行浓度测定,再依据比例计算出蛋白质含量。
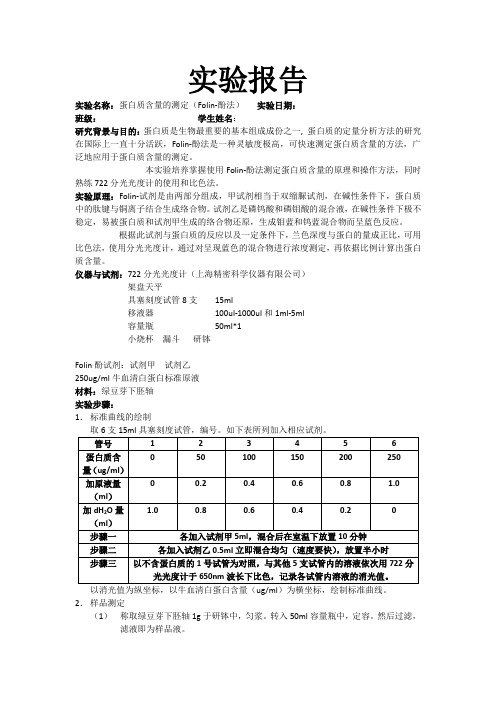
仪器与试剂:722分光光度计(上海精密科学仪器有限公司)架盘天平具塞刻度试管8支15ml移液器100ul-1000ul和1ml-5ml容量瓶50ml*1小烧杯漏斗研钵Folin酚试剂:试剂甲试剂乙250ug/ml牛血清白蛋白标准原液材料:绿豆芽下胚轴实验步骤:1.标准曲线的绘制取6支15ml具塞刻度试管,编号。
如下表所列加入相应试剂。
2.样品测定(1)称取绿豆芽下胚轴1g于研钵中,匀浆。
转入50ml容量瓶中,定容。
然后过滤,滤液即为样品液。
(2)取具塞刻度试管2支,编号8、9,分别加入滤液1ml,分别加入试剂甲5ml,混匀后放置10分钟,然后各加入试剂乙0.5ml,迅速混匀,室温下放置半小时,于650nm波长下比色,记录消光值,取其平均值完成计算。
数据整理与计算:表1Folin-酚法测蛋白质含量的标准曲线图1从标准曲线中查得样品的OD650平均值对应的蛋白质含量X(ug/ml)=71ug/ml,然后按下列公式计算样品中蛋白质的百分含量。
蛋白质浓度测定(folin酚法)

蛋白质浓度测定(Folin-酚法)
实验目的:
熟悉并掌握福林-酚法测定蛋白质浓度的原理和方法。
实验原理:
蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,可用比色法测定蛋白质浓度。
实验器材:
样品血清(稀释200倍)
标准酪蛋白溶液(200ug/ml)
Folin-酚甲液:
A 4%Na2CO3:0.2mol/lNaOH=1:1
B 1%CuSO4:2%酒石酸钾钠=1:1
A:B=50:1 混匀
Folin-酚乙液
可见分光光度计、试管(9支)、移液枪、移液管、烧杯、希尔球。
实验步骤:
1、将九支试管洗净晾干并标号,按照下表内容依次按顺序加入试剂。
2、用可见分光光度计以1号试管溶液为空白测量九个试管溶液在640nm处的吸
光度。
3、以蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线。
4、由样品吸光度在标准曲线中找出样品浓度。
实验结果:
标准曲线:
样品平均吸光度=0.286
由标准曲线得酪蛋白样品浓度为107.04ug/ml
总结分析:
从实验结果数据分析,本次实验结果并不理想,主要问题为标准曲线线性关系不好,部分数据偏离较大,血清样品的三组平行也存在较大方差。
由实验结果可以看出,应该是溶液配制出现问题导致标准曲线线性关系较差。
经分析应该为添加试剂时移液枪操作不当导致配得溶液浓度不准,移液枪活塞有卡顿现象,添加试剂时可能会未按到底导致试剂添加量不准。
Folin-酚法测定蛋白质含量

实验报告综合试验(三Folin-酚法测定蛋白质含量2010年 6 月3日摘要:本实验包括两个步骤,第一个步骤为制作标准曲线,第二个步骤为制备样品(牛奶和酪蛋白粗制品并用Folin —酚法进行蛋白质含量的测定,得到酶原液蛋白含量为8923 (ug/ml;洗脱峰Ⅰ蛋白含量82.692(ug/ml;洗脱峰Ⅱ蛋白含量121.923(ug/ml; 洗脱峰Ⅲ蛋白含量83.077(ug/ml。
此次实验与理论值仍存着一定的偏差。
通过本次实验的操作以及对实验结果的分析,了解Folin —酚法准确测定蛋白含量的原理方法,以及其相关的影响因素。
一、实验目的:1、测定实验中原液和洗脱液中蛋白质的含量2、掌握Folin-酚法测定蛋白质含量的原理和方法。
3、熟悉分光光度计的操作。
二、理论背景:Folin-酚试剂法包括两步反应:第一步是在碱性条件下, 蛋白质与铜作用生成蛋白质-铜络合物; 第二步是此络合物将磷钼酸-磷钨酸试剂(Folin 试剂还原, 产生深蓝色(磷钼蓝和磷钨蓝混合物,颜色深浅与蛋白质含量成正比。
此法操作简便,灵敏度比双缩脲法高100 倍,定量范围为5~100μg蛋白质。
Folin 试剂显色反应由酪氨酸、色氨酸和半胱氨酸引起, 因此样品中若含有酚类、柠檬酸和巯基化合物均有干扰作用。
此外, 不同蛋白质因酪氨酸、色氨酸含量不同而使显色强度稍有不同。
三、实验装置:1. 实验材料原液, 洗脱峰2. 仪器(1移液管(0.5mL 、1mL 、5mL (2量筒(3 分光光度计(4 移液管、移液枪3. 试剂(纯度均为分析纯(1 0. 5mol/L NaOH(2 试剂甲:(A 称取10g Na2CO 3, 2g NaOH和0.25g 酒石酸钾钠,溶解后用蒸馏水定容至500mL 。
(B 称取0.5g CuSO 45·H 2O ,溶解后用蒸馏水定容至100mL 。
每次使用前将(A 液50份与(B 液1份,即为试剂甲,其有效期为1d ,过期失效。
04Folin酚法测定蛋白质含量

04Folin酚法测定蛋白质含量Folin酚法是一种测定蛋白质含量的方法,也被称为Lowry法。
该方法利用一种化学试剂(Folin酚试剂)与蛋白质结合形成复合物,进而产生颜色,利用光度计测量颜色强度,从而间接测定蛋白质的含量。
本文将对Folin酚法的操作流程、原理、注意事项等方面进行介绍。
Folin酚法的操作流程如下:1. 样品制备:将要测定蛋白质含量的样品加入到离心管中,并加入约5倍体积的碳酸氢钠(NaHCO3)溶液,使样品呈弱碱性,再加入NaCl,使浓度为50-100mM。
2. 加入Folin酚试剂:按照试剂的工业需求用水稀释Folin试剂,取样品中的0.1-2.0mL加入到TestTube中,再加入等量的加热后冷却的NaOH(1M) ,然后加入Folin试剂,快速摇匀并放置15分钟至30分钟。
会出现从棕色到蓝色等级变化(酚蓝色)。
3. 加入Na2CO3:在试管中加入5倍浓度的Na2CO3溶液,缓慢滴加并充分混合,使液体呈现深蓝色(如图),在紫外线灯下,黄色到红色颜色具有固定的比色距离和线性使用范围,通常是500-700nm。
4. 测量吸光度:样品和对照体使用小细长试管,在波长下读取吸光度数据。
对每一标准曲线,使用标准品生产的校正硝酸钠或牛清蛋白制备出蛋白标准品。
在制定标准曲线时,使用的标准品范围是0.1-1.0mg / ml因为该范围内蛋白质浓度的吸光度与蛋白质浓度之间的线性关系较好。
对一定量的蛋白质或多肽样品添加到含有Folin试剂和NaOH的试剂中,在碱性条件下,Folin试剂会被蛋白质中的酪氨酸、苯丙氨酸、组氨酸等还原物质还原,形成可被吸收的蓝色化合物。
随着Na2CO3添加,蛋白质中的肽键还原Cu2+为Cu+,与Folin试剂中还原少量的Cu2+形成可吸收的化合物,产生蓝色颜色。
其实质是铜离子作为氧化剂,被蛋白质中的酚类、组氨酸等还原,然后由还原形成的电子捕获剂向Folin试剂中的fosfomolybdate 复合物媒介过渡,形成可吸收的复合物,具体反应方程式如下:a. Cu(II)+RNHCO-R’-R’’ → Cu(I)+R-NH2 + R’CO-R’’(还原)b. Cu(I)+3MeOH+NaF-Fe(III)(CN)5(NO) → Fe(II)(CN)5NO+NaF+Cu(II)+3MeOHc. Folin-Ciocalteu试剂+Copper-chelating(还原Cu2+->Cu1)+MeOH+(±)Na2CO3 → (MeOH的)紫色染料吸收(‘Folin-Ciocalteu’光度分光光度),与Na2CO3浓度成比例注意事项:1.样品的体积或质量应该控制在不同范围内,不宜过多或过少。
folin酚试剂法测蛋白质含量测定实验报告.doc

生物化学实验报告姓名:学号:专业年级:组别:生物化学与分子生物学实验教学中心实验名称Folin-酚试剂法测蛋白质含量测定格式要求:正文请统一用:小四号,宋体,1.5倍行距;数字、英文用Times New Roman;标题用:四号,黑体,加粗。
需强调的地方请用蓝颜色标出。
不得出现多行、多页空白现象。
一、实验目的1、掌握Folin-酚试剂法测定蛋白质含量的原理及其实验操作技术。
2、掌握制作标准曲线的要领和通过标准曲线求样品溶液中待测定物质含量的方法。
二、实验原理Folin-酚反应是利用蛋白质分子中酪氨酸和色氨酸残基(酚基)还原酚试剂(磷钨酸-磷钼酸)起蓝色反应。
为了提高该反应的敏感度,先于标本中加碱性铜试剂,再与酚试剂反应。
1、双缩脲反应:在碱性溶液中,双缩脲(H2NOC-NH-CONH2)能与Cu2+作用,形成紫色或紫红色的络合物,这个反应叫做双缩脲反应。
由于蛋白质分子中含有与双缩脲结构相似的多个肽键,因此有双缩脲反应。
即在碱性溶液中,蛋白质分子中的肽键与碱性铜试剂中的Cu2+作用生成紫红色的蛋白质- Cu2+复合物。
2、Folin-酚显色反应:蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。
在一定浓度范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故与同样处理的蛋白质标准液比色即可求出蛋白质的含量。
即根据预先绘制的标准曲线求出未知样品中蛋白质的含量。
三、材料与方法:以流程图示意1、材料:①样品:健康人的血清(稀释300倍)②试剂:牛血清蛋白标准液(200μg/ml )、碱性的硫酸铜溶液、蒸馏水、Folin-酚试剂③仪器及器材:V-1100型分光光度计、恒温水浴箱、试管6只、试管架、加样枪、加样枪架、加样枪头2① 取6支试管编号1~6,按下表依次加入试剂并混匀,室温放置10min 。
表格 1 Folin-酚试剂定量蛋白质实验步骤② 往6支试管中分别加入Folin-酚试剂0.20ml ,在2s 内立即混匀。
Folin-酚法测定蛋白质含量

实验二 Folin-酚法测定蛋白质含量一、目的要求了解Folin–酚法测定蛋白质的原理,掌握Folin–酚法测定蛋白质含量的分析方法。
二、实验原理用化学法测定蛋白质含量的方法主要有凯氏定氮法、双缩脲比色法、Folin–酚比色法、考马斯亮蓝比色法等。
凯氏定氮法多用于贮存蛋白的测定;后者常用于可溶性蛋白的含量分析,它们具有操作简便,迅速,可适合一般实验要求的特点。
其中Folin–酚法较双缩脲法灵敏100倍,与考马斯亮蓝比色法灵敏度相似,但干扰物对检测方法的影响不相同,选用时应予考虑。
Folin–酚试剂由甲、乙两部分组成。
作用机理是:首先蛋白质中的肽键与碱性铜盐产生双缩脲反应,生成铜—蛋白质复合物;然后该复合物还原磷钼酸—磷钨酸试剂,产生蓝色反应,其呈色强度与蛋白质含量成正比。
所测定蛋白质样品中若含有酚及柠檬酸均对实验有干扰。
浓度较低的尿素(约0.5%),三氯乙酸(约0.5%),乙醇(5%),丙酮(0.5%)等溶液对显色无影响。
若样品酸度较高,需提高碳酸钠—氢氧化钠溶液浓度1–2倍。
三、试剂和仪器(一)试剂1、酪蛋白标准溶液:称取50mg酪蛋白(预先用凯氏定氮法测定蛋白质含量),加30mL 0.05mol/L NaOH ,于磁力搅拌器下溶解,补加0.05mol/L NaOH 至100 mL。
酪蛋白含量0.5 mg/ mL。
2、Folin-酚试剂试剂甲:(1)4% Na2CO3;(2)0.2 mol/L NaOH;(3)1%CuSO4;(4)2%酒石酸钾钠溶液。
使用前,将(1)与(2)以等体积混合配置成Na2CO3–NaOH溶液;(3)与(4)以等体积混合,配成硫酸铜—酒石酸钾钠溶液;然后将这两种溶液以50:1的体积混合,即为Folin–酚试剂甲。
该试剂只能用一天,过期失效。
试剂乙:在1000 mL磨口回流装置内加入50g 钨酸钠(Na2WO4·2H2O),12.5g 钼酸钠(Na2M O O4·2H2O),350 mL 85%磷酸,50 mL浓盐酸,混匀。
生化大实验实验五Folin–酚试剂法测定蛋白质含量

进行测定时,加 Folin氏试剂要特别小心,因为 Folin氏 试剂仅在酸性 pH条件下稳定,但上述还原反应只是在pH 10 的情况下发生,故当Folin氏试剂加到碱性的铜 - 蛋白质溶液 中时,必须立即混匀,以便在磷钼酸 - 磷钨酸试剂被破坏之 前,还原反应即能发生。
【操作步骤】
各管混匀后加入5mL试剂甲,混匀,于37℃放置10分 钟。再加入0.5mL试剂乙(Folin氏试剂),立即振摇均匀, 在37℃保温30分钟,然后于500nm或650nm比色测定。以 吸光度为纵坐标,蛋白质浓度为横坐标绘制标准曲线。
【器材】
1.分光光度计; 2.恒温水浴箱; 3.试管 ; 4.刻度吸管
用于蛋白质测定的用于蛋白质测定的lowrylowry反应是双缩脲方法反应是双缩脲方法的发展蛋白质分子中含有带酚基的酪氨酸在的发展蛋白质分子中含有带酚基的酪氨酸在碱性条件下其肽链与碱性条件下其肽链与cu2cu2螫合形成蛋白质螫合形成蛋白质复合物此复合物中酪氨酸极易使酚试剂中的磷复合物此复合物中酪氨酸极易使酚试剂中的磷钼酸钼酸磷钨酸还原生成蓝色化合物蓝色深浅磷钨酸还原生成蓝色化合2000mL的磨口回 流装置内加入 100g钨酸钠(Na2WO4·2H2O), 25g钼酸钠(Na2MoO4·2H2O),700mL蒸馏水, 再加 50mL85%磷酸及100mL浓盐酸,充分混合 后,以小火回流10 小时。再加入150g硫酸锂 (Li2SO4),50mL蒸馏水及数滴液体溴。然后开 口继续沸腾15分钟,以便驱除过量的溴。冷却后 定容到1000mL。过滤,滤液微呈绿色,置于棕色 试剂瓶中冰箱保存。使用时用标准氢氧化钠溶液 滴定,以酚酞为指示剂,而后适当稀释(约1倍), 使最终[H+]为lN,此为Folin — 酚试剂乙应用液。 贮于冰箱中可长期保存。
高中生物 Folin-酚试剂法(Lowry法)测定蛋白质浓度

(1)4%碳酸钠(Na2CO3)溶液
(2)0.2N氢氧化钠溶液
(3)1%硫酸铜溶液(CuSO4·5H2O)
(4)2%酒石酸钾钠溶液(或酒石酸钾或钠)
在使用前(1)与(2)、(3)与(4)等体积混合,再将两混合液按50:1比例混合,即为试剂甲。该试剂只能用一天,过期失效。
(一)试剂乙:
(1)市售酚试剂在使用前用NaOH滴定,以酚肽为指标剂,根据试剂酸度将其稀释,使最后酸度为1N。
取试管7支、编号、按下表操作:
立即混匀,在20℃~25℃水浴保温30分钟。用660nm比色,测定光密度值。
操作注意事项:
1.按顺序添加试剂
2.试剂乙在酸性条件下稳定,碱性条件下(试剂甲)易被破坏,因此加试剂乙后要立即混匀,加一管混匀一管,使试剂乙(磷目酸)在破坏前即被还原。
[计算]
(一)绘制标准曲线。以浓度为横坐标,光密度值为纵坐标绘制标准曲线。
(二)以测定管光密度值,查找标准曲线,求出待测血清中蛋白质浓度(g/L)。
(三)再从标准管中选择—管与测定管光密度相接近者,求出待测血清中蛋白质浓度(g/L)。
[器材]
(一)721型分光光度计
(--)恒温水浴箱
(三)中试管7支
(四)刻度吸管:1. 0ml二支;0.5Байду номын сангаасl一支;5.0ml一支。
[试剂]
Folin-酚试剂法(Lowry法)测定蛋白质浓度
[目的]
掌握Lowry法测定蛋白质浓度的原理。
[原理]
蛋白质在碱性溶液中其肽键与Cu2+螯合,形成蛋白质一铜复合物,此复合物使酚试剂的磷钼酸还原,产生蓝色化合物,在一定条件下,利用蓝色深浅与蛋白质浓度的线性关系作标准曲线并测定样品中蛋白质的浓度。
福林酚测蛋白质 (1)

• 常见种类 • 0.5~10μl • 5~50μl • 10~100μl • 20~200μl (读数窗显示20~200, 每转1档1μl) • 100~1000μl(读数窗显示100~1000, 每转1档为 5μl)
操作步骤
1:选择量程
根据转移液体的量,选择正确量程的微量移液器
2:调节吸量体积:
操作步骤
4. 更换吸头: 吸取不同的液体,一定要更换枪头,防止试剂 交叉污染,更换枪头时,对着废弃桶,轻轻按下卸 载吸头的弹射器,吸头自然脱落在废弃桶内。 5. 微量移液器的放臵: 实验完毕后,将移液器调回到接近最大量程,使弹 簧处于松弛状态,放到或者悬挂在架子上。
注意事项
1. 吸取不同的液体时,切记要更换吸头, 2. 调节移液器时,动作要轻缓,千万不要将读数的调节超出最大值和最小 值,否则会造成损坏。 3. 吸取液体时,动作要轻缓,防止液体随着气流进入移液器的上部; 4. 带有残余液体吸嘴的移液器不能平放。 5. 每次实验完毕后将微量移液器调至接近最大刻度,使弹簧处于自然伸展 状态。 6. 必须定期让专业人员进行校正,不能火烧灭菌,不能摔。
福林-酚法 测定蛋白质的含量
实验目的
• 学习测定蛋白质浓度的原理和方法 • 熟练分光光度计,微量移液器的操作以及标 准曲线的制作
实验原理
第一步——双缩脲反应(蛋白质与碱性铜试剂反应)
在碱性条件下蛋白质的肽键与Cu2+螯合,成蛋白质-铜复合物
实验原理
第二步——与福林-酚试剂反应
在碱性条件下 ,这种被作用的蛋白质上的酚类基团极不稳定, 很容易还原福林酚试剂中的磷钨酸和磷钼酸,生成钨蓝和钼蓝 的混合物,呈蓝色。 可利用分光光度计测得650nm的OD值,浓度大小跟OD值成 正比y=kx+b
Folin-酚试剂法测蛋白质含量

Folin-酚试剂法测蛋⽩质含量实验1-3 蛋⽩质的定量测定(Folin-酚试剂法)⼀、实验原理1921年,Folin ⾸创Folin-酚试剂法,利⽤蛋⽩质分⼦中酪氨酸和⾊氨酸残基(酚基)还原酚试剂(磷钨酸-磷钼酸)起蓝⾊反应;1951年,Lowry对此法进⾏了改进,先于标本中加碱性铜试剂,再与酚试剂反应,提⾼了灵敏度。
Folin-酚试剂法主要包括两步:第⼀步双缩脲反应在碱性溶液中,双缩脲(H2NOC-NH-CONH2)能与Cu2+作⽤,形成紫⾊或紫红⾊的络合物,这个反应叫做双缩脲反应。
由于蛋⽩质分⼦中含有与双缩脲结构相似的多个肽键, 因此有双缩脲反应。
即在碱性溶液中,蛋⽩质分⼦中的肽键与碱性铜试剂中的Cu2+作⽤⽣成紫红⾊的蛋⽩质- Cu2+复合物。
第⼆步Folin-酚显⾊反应Folin-酚试剂在碱性条件下极不稳定,其磷钼酸盐-磷钨酸盐易被酚类化合物还原⽽呈蓝⾊反应(钼蓝和钨蓝的混合物)。
由于蛋⽩质中含有带酚羟基的酪氨酸( Tyr ) ,故有此显⾊反应。
即蛋⽩质- Cu2+复合物中所含的酪氨酸或⾊氨酸残基还原酚试剂中的磷钼酸和磷钨酸,⽣成蓝⾊的化合物。
在⼀定浓度范围内,蓝⾊的深浅度与蛋⽩质浓度呈线性关系,故与同样处理的蛋⽩质标准液⽐⾊即可求出样品中蛋⽩质的含量。
另外,可以根据预先绘制的标准曲线求出待测样品中蛋⽩质的含量。
⼆、实验材料(⼀)样品健康⼈⾎清(稀释300倍)(⼆)试剂1.⽜⾎清⽩蛋⽩标准液(200 g/ml)准确称取⽜⾎清⽩蛋⽩粉末50.0mg,⽤0.1mol/L NaOH溶液润湿溶解,加蒸馏⽔到250ml。
2.碱性硫酸铜溶液①碱溶液:Na2CO3 2g 溶于100ml 0.1mol/L NaOH中。
②硫酸铜溶液:CuSO4?5H2O 0.5g溶于100ml 35mmol/L(1%)酒⽯酸钾钠中。
使⽤前将①与②按50:1混合即成碱性硫酸铜溶液。
使⽤时新鲜配制。
3.Folin-酚试剂在2L磨⼝回流装置内加钨酸钠(Na2WO4?2H2O)100g,钼酸钠(Na2MoO4?2H2O)25g,蒸馏⽔700ml,14.68mol/L(85%)磷酸50ml,浓盐酸100ml,充分混合后⽤⼩⽕回流10h。
生化实验报告-福林(Folin)-酚试剂法测定蛋白质的浓度
实验:福林(Folin)-酚试剂法测定蛋白质的浓度一、原理蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。
蓝色的深浅与蛋白质的含量成正比,可用比色法测定二、实验仪器1.卵清蛋白片2.7220分光光度计3.试管4.移液管三、实验试剂1.Folin-酚试剂A:碱性铜溶液甲液:取Na2CO32g溶于100ml0.1mol/l氢氧化钠溶液中乙液:取CuSO4.5H2O晶体0.5g,溶于1%酒石酸钾100ml中。
临用时按甲:乙=50:1混合使用。
2.Folin-酚试剂B:将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸继100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回馏10小时,再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。
冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。
临用时,用1mol/l的氢氧化钠溶液滴定,用酚酞作指示剂,根据滴定结果,将试剂稀释至相当于1mol/L的酸。
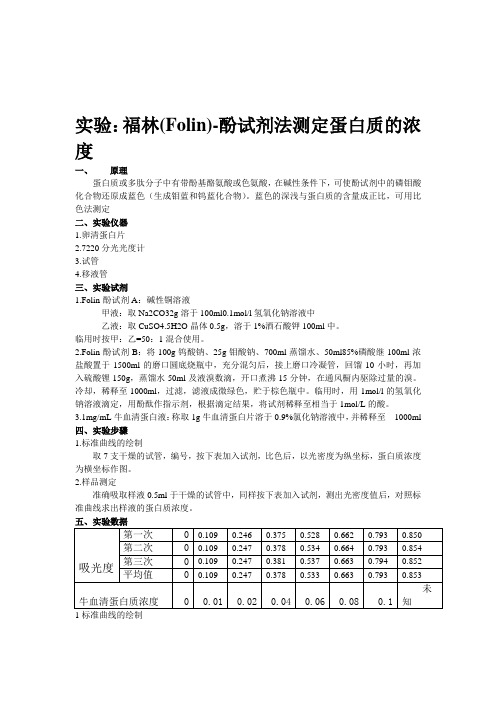
3.1mg/mL牛血清蛋白液:称取1g牛血清蛋白片溶于0.9%氯化钠溶液中,并稀释至1000ml四、实验步骤1.标准曲线的绘制取7支干燥的试管,编号,按下表加入试剂,比色后,以光密度为纵坐标,蛋白质浓度为横坐标作图。
2.样品测定准确吸取样液0.5ml于干燥的试管中,同样按下表加入试剂,测出光密度值后,对照标准曲线求出样液的蛋白质浓度。
五、实验数据1标准曲线的绘制2.样品测定右上表可知待测样液的蛋白质吸光度y=0.853,则由图可知x=0.104mg/ml故待测样液的蛋白质浓度为0.104mg/m l×5ml÷0.5ml=1.04mg/ml六、实验分析注意事项:1.在实验时,不要将牛血清蛋白和样液加反了;2.一定要注意实验的时间,因为溶液的光密度值是随着时间在不断增大的,如果时间超过了30分钟,则测得的光密度值就不准确了;3.由于分光光度计比较精密,所以往试管中加药品的时候要尽量做到准确;4.在使用分光光度计时,那比色皿是要拿它的毛面,不可以用手接触它的光滑面,防止自己手上的油污是测量值不准确;5.在擦拭比色皿时,要顺着一个方向擦;6.在比色皿中装入的液体量大约要是比色皿体积的三分之二。
