化工原理下册答案
化工原理(下)参考卷及答案

A 卷一、单项选择题(每小题2分,共12分)1、在)(*L G G A p p K N -=中,*L p 代表的是( C )。
A 、界面处被吸收组分的分压力;B 、气相主体中被吸收组分的分压力;C 、与液相主体浓度相平衡的气相分压力。
2、 吸收操作的作用是分离( A ) 。
A 、气体混合物;B 、液体均相混合物;C 、气液混合物。
3、全回流时,y 一x 图上精馏段和提馏段两操作线的位置( B )。
A 、在对角线与平衡线之间;B 、与对角线重合;C 、在对角线之下。
4、精馏塔中由塔顶向下的第n-1,n ,n+1层塔板上的液相组成(摩尔分率)关系为( C )A 、x n+1 > x n > x n-1 ;B 、x n+1 = x n = x n-1 ;C 、x n+1 < x n < x n-1 。
5、对于不饱和的湿空气,其露点( C )湿球温度。
A 、大于;B 、等于;C 、小于。
6、恒速干燥阶段,物料表面的温度等于( A )。
A 、湿空气的湿球温度;B 、湿空气的干球温度;C 、湿空气的露点温度。
二、判断题(每小题2分,共12分)1、低浓度逆流吸收操作中,当吸收剂温度降低而其他条件不变时,相平衡常数m 变小。
( √ )2、吸收操作的最小液气比指的是使操作线上某一点与平衡线相遇的液气比。
( √ )3、当精馏操作的回流比减少至最小回流比时,所需理论板数为最小。
( × )4、精馏操作中过冷液体进料将使提馏段的汽流量和液流量都大于精馏段。
( √ )5、某种湿空气的温度t 越高,湿空气的相对湿度φ越低。
( √ )6、在气流干燥过程,热空气的焓值必定减小。
( × )三、简答题(每小题4分,共16分) 1、作示意图解释:吸收操作时,操作线愈靠近平衡线,是愈小。
答:如图所示:操作线为AB ,平衡线为OE 。
在操作线上任取一点P ,从图上可知PQ 、PR 动力y -y ×和x ×-x 。
化工原理下册习题及答案

蒸馏是分离的答案:的一种方法,其分离依据是混合物中各组分,分离的条件是。
均相液体混合物挥发性差异某连续精馏塔中,若精馏段操作线方程的截距等于零,则回流比等于 ,馏出液流量等于 ,操作线方程为 答案: m对于饱和蒸汽进料,则有L ( ) L ,V () V 。
A 等于B 小于C 大于D 不确定答案: AB★习题:精馏塔中由塔顶向下的第n-1,n ,n+1 层塔板,其气相组成关系为()A y n+1>y n >y n-1B y n+1=y n =y n-1C y n+1 <y n <y n-1 D不确定答案: C★习题:若总吸收系数和分吸收系数间的关系可表示为1/K L=1/K L+H/K G,其中1/K L表示____________________ ,当 ____________ 项可忽略时,表示该吸收过程为液膜控制。
答案:液膜阻力H/KG★习题在吸收过程中,由于吸收质不断进入液相,所以混合气体量由塔底至塔顶____________________ 。
在计算塔径时一般应以 _________________ 的气量为依据。
答案:逐渐减少塔底★习题求传质单元数时,对于低浓度气体吸收,当平衡线为直线可用__________________ 法, 当平衡线为弯曲程度不大的曲线时可用法,当平衡线为任意形状曲线时可用法。
答案:解析法梯形图解图解积分★习题有利于吸收操作的条件() )(A)温度下降,总压上升(B)温度上升,总压下降(C)温度、总压均下降(D)温度、总压均上升绝干气。
在一定的温度和总压强下,以湿空气做干燥介质,当所用空气的湿度减少时,则湿物料的平衡水分相应 _______________ ,其自由水分相应 _______________________ 。
恒定的干燥条件是指空气 __________________ , __________________ , ____________________ 均不变的过程。
化工原理(下)参考卷及答案

A 卷一、单项选择题(每小题2分,共12分) 1、在)(*LG G Ap p K N -=中,*L p 代表的是( C )。
A 、界面处被吸收组分的分压力;B 、气相主体中被吸收组分的分压力;C 、与液相主体浓度相平衡的气相分压力。
2、 吸收操作的作用是分离( A ) 。
A 、气体混合物;B 、液体均相混合物;C 、气液混合物。
3、全回流时,y 一x 图上精馏段和提馏段两操作线的位置( B )。
A 、在对角线与平衡线之间;B 、与对角线重合;C 、在对角线之下。
4、精馏塔中由塔顶向下的第n-1,n ,n+1层塔板上的液相组成(摩尔分率)关系为( C ) A 、x n+1 > x n > x n-1 ; B 、x n+1 = x n = x n-1 ; C 、x n+1 < x n < x n-1 。
5、对于不饱和的湿空气,其露点( C )湿球温度。
A 、大于; B 、等于; C 、小于。
6、恒速干燥阶段,物料表面的温度等于( A )。
A 、湿空气的湿球温度;B 、湿空气的干球温度;C 、湿空气的露点温度。
二、判断题(每小题2分,共12分)1、低浓度逆流吸收操作中,当吸收剂温度降低而其他条件不变时,相平衡常数m 变小。
( √ )2、吸收操作的最小液气比指的是使操作线上某一点与平衡线相遇的液气比。
( √ )3、当精馏操作的回流比减少至最小回流比时,所需理论板数为最小。
( × )4、精馏操作中过冷液体进料将使提馏段的汽流量和液流量都大于精馏段。
( √ )5、某种湿空气的温度t 越高,湿空气的相对湿度φ越低。
( √ )6、在气流干燥过程,热空气的焓值必定减小。
( × ) 三、简答题(每小题4分,共16分)1、作示意图解释:吸收操作时,操作线愈靠近平衡线,是愈小。
答:如图所示:操作线为AB ,平衡线为OE 。
在操作线上任取一点P ,从图上可知PQ 、PR 动力y -y ×和x ×-x 。
化工原理下册课后答案

第一章 蒸馏的习题解答1..已知含苯0.5(摩尔分数)的苯—甲苯混合液,若外压为99KPa,试求该搭液的泡点温度。
苯和甲苯的饱和蒸气压数据见例14附表。
解:本题需用试差法确定溶液的饱和温度。
先假设一温度,查苯和甲苯的饱和蒸汽压 0A p 和0B p则000B A B P P x P P -=-,若所求的x 与题给的x 值相等, 则证明假设正确。
设假设温度恰为泡点温度, 否则需修正。
本题外压为99a KP ,据常压下苯~甲苯混合液的t-x-y 图 设该溶液的泡点温度091.5t C =,则查教材附录可知00.141.6,56.8A a B a P KP p KP ==9956.80.4980.5141.656.8x -==≈-故溶液的泡点温度为92C2. .正戊烷 (C 5H 12)和正己烷(C 6H 14)的饱和蒸气压数据列于本题附表,试求p=13.3KPa 下该溶液的平衡数据。
假设该溶液为理想溶液。
习题2附表解:由以下二式求,x y 的数据。
记0000,B AA B P P P x y x P P P-==- 求解本题时应确定温度范围以查取0A P 和0B P .由本题附表可知平衡温度在260.6 K 和289 K 之间,选取以上两温度间的若干温度,求,x y 。
计算过程从略,结果如下表所示:3.利用习题2的数据,计算:(1)平均相对挥发度;(2)在平均相对挥发度下的x-y 数据,并与习题2的结果相比较。
解: α的计算结果处于本题附表的第二列1(4.70+4.94+5.14+5.30+4.04+3.79+3.68)=4.517mα=⨯平衡方程为 4.51(1)1 3.5m m x xy x xαα==+-+计算结果表明:由于α随t 略有变化,故用平均相对挥发度求得的,x y 与习题2 的结果稍有差异。
4.在常压下将某原料液组成为0.6(易挥发组分的摩尔分数)的两组分洛液分别进行简单蒸馏和平衡蒸馏,若汽化率为1/3,试求两种情况下的釜液和馏出液组成。
化工原理下册答案

化工原理下册答案化工原理是化学工程专业的重要基础课程,它涉及到化工工程的基本原理和理论知识,对于学生来说是一门重要的课程。
下面是化工原理下册的答案,希望对大家的学习有所帮助。
第一章热力学基础。
1. 什么是热力学?热力学是研究能量转化和能量传递规律的科学,它是化工工程中不可或缺的基础理论。
2. 热力学第一定律的表达式是什么?热力学第一定律可以表达为ΔU = Q W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做功。
3. 热力学第二定律的内容是什么?热力学第二定律可以表述为热不可能自发地从低温物体传向高温物体,也可以表述为熵增原理。
第二章物质平衡。
1. 什么是物质平衡?物质平衡是指在化工过程中,各种物质在系统内的输入、输出和积累之间的平衡关系。
2. 如何计算物质平衡?计算物质平衡时,需要根据系统的输入和输出物质量来进行计算,确保输入和输出物质量达到平衡。
3. 物质平衡的应用范围有哪些?物质平衡在化工工程中有着广泛的应用,包括化工反应、化工装置设计等方面。
第三章能量平衡。
1. 能量平衡的基本原理是什么?能量平衡的基本原理是能量守恒定律,即能量不能被创造或者消失,只能从一种形式转化为另一种形式。
2. 能量平衡的计算方法有哪些?能量平衡的计算方法包括热平衡法、热效率法、热损失法等多种方法。
3. 能量平衡在化工工程中的应用有哪些?能量平衡在化工工程中有着重要的应用,可以用于热力学系统的分析和设计。
第四章流体力学。
1. 流体力学的基本概念是什么?流体力学是研究流体静力学、流体动力学和流体力学性能的科学。
2. 流体的黏度是什么?流体的黏度是指流体内部分子间相互作用的阻力,它是流体运动阻力的重要参数。
3. 流体的雷诺数是什么?流体的雷诺数是描述流体流动状态的一个重要无量纲参数,它可以用来判断流体流动的稳定性和不稳定性。
第五章传质过程。
1. 传质过程的基本原理是什么?传质过程是指物质在不同相之间传递的过程,它包括质量传递、热量传递和动量传递。
化工原理(下册)答案

化工原理(大学第二版)下册部分答案第8章2. 在温度为25 ℃及总压为101.3 kPa 的条件下,使含二氧化碳为3.0%(体积分数)的混合空气与含二氧化碳为350 g/m 3的水溶液接触。
试判断二氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。
已知操作条件下,亨利系数51066.1⨯=E kPa ,水溶液的密度为997.8 kg/m 3。
解:水溶液中CO 2的浓度为 对于稀水溶液,总浓度为 3t 997.8kmol/m 55.4318c ==kmol/m 3 水溶液中CO 2的摩尔分数为由 54* 1.6610 1.44310kPa 23.954p Ex -==⨯⨯⨯=kPa 气相中CO 2的分压为t 101.30.03kPa 3.039p p y ==⨯=kPa < *p故CO 2必由液相传递到气相,进行解吸。
以CO 2的分压表示的总传质推动力为*(23.954 3.039)kPa 20.915p p p ∆=-=-=kPa3. 在总压为110.5 kPa 的条件下,采用填料塔用清水逆流吸收混于空气中的氨气。
测得在塔的某一截面上,氨的气、液相组成分别为0.032y =、31.06koml/m c =。
气膜吸收系数k G =5.2×10-6 kmol/(m 2·s ·kPa),液膜吸收系数k L =1.55×10-4 m/s 。
假设操作条件下平衡关系服从亨利定律,溶解度系数H =0.725 kmol/(m 3·kPa)。
(1)试计算以p ∆、c ∆表示的总推动力和相应的总吸收系数;(2)试分析该过程的控制因素。
解:(1) 以气相分压差表示的总推动力为 t 1.06*(110.50.032)kPa 2.0740.725c p p p p y H ∆=-=-=⨯-=kPa 其对应的总吸收系数为6G 1097.4-⨯=K kmol/(m 2·s ·kPa)以液相组成差表示的总推动力为 其对应的总吸收系数为 (2)吸收过程的控制因素气膜阻力占总阻力的百分数为气膜阻力占总阻力的绝大部分,故该吸收过程为气膜控制。
化工原理答案下册

化工原理答案下册化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编.化工原理第二版(下册).天津大学出版)社,2011.8.)第1章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃) 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压PB *,PA*,由于总压P = 99kPa,则由x = (P-PB *)/(PA*-PB*)可得出液相组成,这样就可以得到一组绘平衡t-x图数据。
以t = 80.1℃为例 x =(99-40)/(101.33-40)= 0.962 同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P =13.3kPa下该溶液的平衡数据。
温度C5H12223.1 233.0 244.0 251.0 260.6 275.1291.7 309.3K C6H14248.2 259.1 276.9 279.0 289.0 304.8322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3 解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2℃时为例,当t = 248.2℃时 PB* = 1.3kPa查得PA*= 6.843kPa得到其他温度下A?B的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3PA*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300PB*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t= 260.6℃时 x = (P-PB *)/(PA*-PB*)=(13.3-2.826)/(13.3-2.826)= 1 平衡气相组成以260.6℃为例当t= 260.6℃时 y = PA*x/P = 13.3×1/13.3 = 1同理得出其他温度下平衡气液相组成列表如下t(℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2 的结果相比较。
化工原理下册习题与解答

积分后,即可求出扩散速率 。
问:什么是吸收过程的机理,讨论吸收过程的机理的意义是什么?
答:吸收操作是气液两相间的对流传质过程。对于相际间的对流传质问题,其传质机理往往是非常复杂的。为使问题简化,通常对对流传质过程作一定的假定,即所谓的吸收过程的机理,亦称为传质模型。讨论吸收过程的机理的意义是把复杂的对流传质问题化成分子传质问题求解。
问:在推导用传质单元数法计算填料层高度的基本计算式时,为何采用微元填料层高度衡算,式2-76的右侧为何有负号?
答:填料塔是一种连续接触式设备,随着吸收的进行,沿填料层高度气液两相的组成均不断变化,传质推动力也相应地改变,塔内各截面上的吸收速率并不相同。因此,在推导填料层高度的基本计算式时,需要对微元填料层进行物料衡算。
答:从工程的角度讲,塔设备主要有三个参数作为其性能好坏的评价指标,即通量、分离效率和操作弹性。通量是指单位塔截面的生产能力,其表征塔设备的处理能力和允许的空塔气速。分离效率是指单位压力降的分离效果,板式塔以板效率表示,填料塔以等板高度表示。操作弹性即塔的适应能力,表现为对处理物料的适应性和对气液负荷波动的适应性。塔的通量大、分离效率高、操作弹性大,塔的性能就好。
化工原理(下)课后习题解答

由于 1B A =+x x 故 2 B B A A B A A (d A d M x M x x M M w += (2 B B A A AA A M w M w M w x += 2 ( ( AdAdB BAAB AAA BB AA A1 1 ( 1 M w M w M M M w M w M w M w x +-
代入式(7-25,得 AA AAA AA AB A 2d d 2d d N p p z RT p N N y z c D N 总-=-= 分离变量,并积分得 总 总总 p p p z RT p D N A1 AB A 2ln 21+∆= 52521 1.8510101.3101.3222.5ln kmol/(m s 1.01210 kmol/(m s28.3142730.015101.3 --⨯⨯+⨯=⨯⋅ =⨯⋅ ⨯⨯ 5 2 5 2 B A 33 1.01210kmol/(m s 3.03610kmol/(m s N N --=-=-⨯⨯⋅ =-⨯⋅
0.2002 .99233S ⋅ =⋅ ⨯= = EM H ρ 2. 在温度为 25 ℃及总压为 101.3 kPa 的条件下,使含二氧化碳为 3.0%(体积分数的混合空气与含二氧化碳为 350 g/m 3 的水溶液接触。试判断二 氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。已知操作条件 下,亨利系数 5 1066.1⨯=E kPa ,水溶液3350/1000 kmol/m 0.008kmol/m 44 c= = 对于稀水溶液,总浓度为 3t 997.8 k m o l /m 55.4318 c= =kmol/m 3 水溶液中 CO 2 的摩尔分数为
解:设 A -NH 3;B -H 2O 离界面 5 mm 处为点 1、两相界面处为点 2,则氨的摩尔分数为 085.0A1=x ,022.0A2=x 915.0085.01A1 1B1=-=-=x x 978.0022.01A2 1B2=-=-=x x 946.0915.0978 .0ln 915 .0978.0ln B1 B2B1B2 BM =-=-= x x x x x 点 1、点 2 处溶液的平均摩尔质量为 (kmol kg 92.17kmol kg 18915.01785.01=⨯+⨯=M (kmol kg 98.17kmol kg 18978.017022.02=⨯+⨯=M 溶液的平均总物质的量浓度为
化工原理课后习题答案上下册(钟理版)
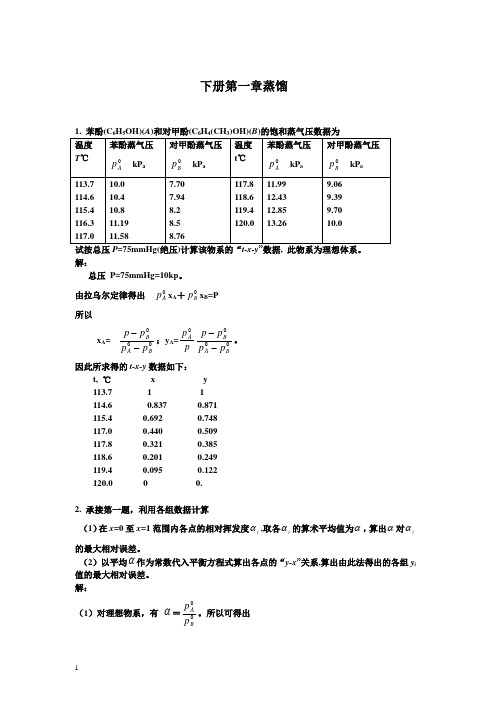
下册第一章蒸馏解:总压 P=75mmHg=10kp 。
由拉乌尔定律得出 0A p x A +0B p x B =P 所以 x A =000B A B p p p p --;y A =p p A 0000BA Bp p p p --。
因此所求得的t-x-y 数据如下:t, ℃ x y 113.7 1 1 114.6 0.837 0.871 115.4 0.692 0.748 117.0 0.440 0.509 117.8 0.321 0.385 118.6 0.201 0.249 119.4 0.095 0.122 120.0 0 0.2. 承接第一题,利用各组数据计算(1)在x=0至x=1范围内各点的相对挥发度i α,取各i α的算术平均值为α,算出α对i α的最大相对误差。
(2)以平均α作为常数代入平衡方程式算出各点的“y-x ”关系,算出由此法得出的各组y i 值的最大相对误差。
解:(1)对理想物系,有 α=00BAp p 。
所以可得出t, ℃ 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0i α 1.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326算术平均值α=9∑iα=1.318。
α对i α的最大相对误差=%6.0%100)(max=⨯-αααi 。
(2)由xxx x y 318.01318.1)1(1+=-+=αα得出如下数据:t, ℃ 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x 1 0.837 0.692 0.558 0.440 0.321 0.201 0.095 0 y 1 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0 各组y i 值的最大相对误差==∇iy y m ax)(0.3%。
化工原理下册课后答案

化工原理下册课后答案1. 简答题。
1.1 请简述化工原理中的物质平衡原理。
物质平衡原理是指在化工过程中,物质的输入量等于输出量,即输入物质的总量等于输出物质的总量。
这是化工过程中保持物质平衡的基本原理,也是保证化工过程正常运行的基础。
1.2 请解释化工原理中的能量平衡原理。
能量平衡原理是指在化工过程中,输入的能量等于输出的能量,即输入的能量总量等于输出的能量总量。
能量平衡原理是保证化工过程能够正常进行的重要原则,也是保证化工过程能够高效运行的基础。
1.3 请说明化工原理中的动量平衡原理。
动量平衡原理是指在化工过程中,输入的动量等于输出的动量,即输入的动量总量等于输出的动量总量。
动量平衡原理是化工过程中保持物质流动平衡的基本原理,也是保证化工设备运行稳定的基础。
2. 计算题。
2.1 在化工反应器中,若反应物A和B按化学方程式A + B → C反应,已知反应物A和B的摩尔质量分别为10g/mol和20g/mol,反应生成物C的摩尔质量为30g/mol,求当A和B的摩尔比为2:1时,生成物C的摩尔质量为多少?解,根据化学方程式A + B → C,可知A和B的摩尔比为2:1,因此A的摩尔质量为10g/mol,B的摩尔质量为20g/mol。
根据摩尔比的定义,可得A的质量为20g,B的质量为10g。
生成物C的摩尔质量为30g/mol,因此生成物C的质量为30g。
因此当A和B的摩尔比为2:1时,生成物C的摩尔质量为30g/mol。
2.2 在化工装置中,液体A和液体B按体积比1:2混合,已知液体A的密度为1g/cm³,液体B的密度为2g/cm³,求混合液体的密度为多少?解,液体A和液体B按体积比1:2混合,因此混合液体的总体积为3。
液体A的密度为1g/cm³,液体B的密度为2g/cm³,根据密度的定义可得混合液体的质量为11g+22g=5g,总体积为3cm³,因此混合液体的密度为5g/3cm³=1.67g/cm³。
化工原理下册课后习题答案

化工原理课后习题解答夏清、陈常贵主编. 化工原理. 天津大学出版社,2005. )田志高第五章蒸馏1. 已知含苯0.5 (摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1 附表。
t (℃) 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11 解:利用拉乌尔定律计算气液平衡数据查例1-1 附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压P B*,P A*,由于总压P = 99kPa ,则由x = (P-P B*)/(P A*-P B*) 可得出液相组成,这样就可以得到一组绘平衡t-x 图数据。
以t = 80.1 ℃为例x = ( 99-40 ) / ( 101.33-40 )= 0.962 同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5 时,相应的温度为92℃2. 正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P = 13.3kPa下该溶液的平衡数据。
温度 C 5H12 223.1 233.0 244.0 251.0 260.6 275.1 291.7 309.3K C 6H14 248.2 259.1 276.9 279.0 289.0 304.8 322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2 ℃时为例,当t = 248.2 ℃时P B* = 1.3kPa查得P A*= 6.843kPa得到其他温度下A?B 的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8309.3P A*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300P B*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250 利用拉乌尔定律计算平衡数据平衡液相组成以260.6 ℃时为例当t= 260.6 ℃时x = (P-P B* )/(P A*-P B*)=(13.3-2.826 )/ (13.3-2.826 )= 1 平衡气相组成以260.6 ℃为例当t= 260.6 ℃时y = P A*x/P = 13.3 × 1/13.3 = 1 同理得出其他温度下平衡气液相组成列表如下t( ℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0根据平衡数据绘出t-x-y 曲线3. 利用习题 2 的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y 数据,并与习题2 的结果相比较。
化工原理下册复习题答案

化工原理下册复习题答案一、选择题1. 化工生产中,下列哪种设备通常用于实现气液相的分离?A. 换热器B. 反应器C. 蒸馏塔D. 蒸发器答案:C2. 在连续操作的化工过程中,以下哪个参数是恒定的?A. 反应物的浓度B. 温度C. 压力D. 流量答案:B3. 根据传质原理,以下哪种情况下传质速率会增大?A. 降低温度B. 增加浓度梯度C. 减小扩散面积D. 降低扩散系数答案:B二、填空题1. 在化工生产中,_______是用于控制化学反应速率和选择性的关键设备。
答案:反应器2. 根据传热的基本方式,化工设备中的热交换主要通过_______、_______和辐射三种方式进行。
答案:导热、对流3. 蒸馏操作中,_______是控制馏出物组成的关键因素。
答案:回流比三、简答题1. 简述蒸馏塔的工作原理。
答案:蒸馏塔是一种用于分离液体混合物的设备,其工作原理基于混合物中各组分的沸点差异。
在蒸馏塔中,混合物被加热至部分蒸发,轻组分随蒸汽上升,而重组分留在塔底。
上升的蒸汽在塔顶冷凝后,通过回流管返回塔内,与上升的蒸汽形成逆流,从而实现组分的分离。
2. 描述传热过程中的三种基本方式,并简述它们的特点。
答案:传热的三种基本方式包括导热、对流和辐射。
导热是指热量通过物体内部分子振动和自由电子运动传递的过程,通常发生在固体中。
对流是指流体中温度不同的各部分之间的热量交换,常见于气体和液体中。
辐射是指热量以电磁波的形式在空间中传递,不需要介质,可以在真空中进行。
四、计算题1. 某化工反应器中,反应物A的初始浓度为1.0 mol/L,反应速率常数k=0.05 min^-1,若反应为一级反应,求10分钟后反应物A的浓度。
答案:首先,一级反应的速率方程为 -d[A]/dt = k[A]。
对时间积分得到[A] = [A]₀e^(-kt)。
将给定的数值代入公式,[A] = 1.0e^(-0.05*10) mol/L。
五、论述题1. 论述化工生产中的节能减排措施及其重要性。
化工原理试题库下册及答案

化工原理试题库下册及答案一、选择题1. 在化工生产中,传热过程主要通过哪种方式进行?A. 对流B. 辐射C. 传导D. 蒸发答案:C2. 下列哪项不是影响液体流动阻力的因素?A. 管道长度B. 管道直径C. 流体密度D. 流体粘度答案:C3. 在化工分离过程中,蒸馏操作主要用于分离哪些混合物?A. 固体与固体B. 液体与液体C. 气体与气体D. 液体与固体答案:B二、填空题4. 化工生产中,_______ 是指在单位时间内通过单位面积的热量。
答案:热通量5. 理想气体状态方程为 \( PV = nRT \),其中 \( P \) 代表_______,\( V \) 代表_______,\( n \) 代表_______,\( R \) 代表_______,\( T \) 代表_______。
答案:压强;体积;摩尔数;气体常数;温度6. 渗透蒸发是一种利用_______ 的分离技术,常用于分离_______。
答案:半透膜;液体混合物三、简答题7. 简述板式塔与填料塔在工业应用中的主要区别。
答案:板式塔和填料塔是两种常见的气液传质设备。
板式塔由一系列平行的塔板组成,每块塔板上有开孔或堰,液体通过这些开口或堰流到下一块塔板上,而气体则通过塔板上升。
板式塔的优点是传质效率高,处理量大,但结构复杂,造价高。
填料塔则由各种形状的填料(如环形、鞍形、波纹形等)组成,气体和液体在填料的空隙中进行传质。
填料塔的优点是结构简单,造价低,适用于处理腐蚀性或高温物料,但传质效率相对较低。
8. 什么是雷诺数?它在化工管道设计中有何作用?答案:雷诺数(Reynolds Number)是一个无量纲数,用于描述流体流动的状态,即它是惯性力与粘性力之比。
在化工管道设计中,雷诺数用于区分流体流动的类型(层流或湍流),这对于预测管道中的压降、热传递和质量传递特性非常重要。
四、计算题9. 某化工企业需要设计一个换热器,已知热流体的进口温度为150℃,出口温度为120℃,冷流体的进口温度为30℃,出口温度为70℃。
化工原理答案下册.

化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编.化工原理第二版(下册).天津大学出版)社,2011.8.)第1章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃) 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压PB *,PA*,由于总压P = 99kPa,则由x = (P-PB *)/(PA*-PB*)可得出液相组成,这样就可以得到一组绘平衡t-x图数据。
以t = 80.1℃为例 x =(99-40)/(101.33-40)= 0.962 同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P =13.3kPa下该溶液的平衡数据。
温度C5H12223.1 233.0 244.0 251.0 260.6 275.1291.7 309.3K C6H14248.2 259.1 276.9 279.0 289.0 304.8322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2℃时为例,当t = 248.2℃时 PB* = 1.3kPa查得PA*= 6.843kPa得到其他温度下A¸B的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3PA*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300PB*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t= 260.6℃时 x = (P-PB *)/(PA*-PB*)=(13.3-2.826)/(13.3-2.826)= 1 平衡气相组成以260.6℃为例当t= 260.6℃时 y = PA*x/P = 13.3×1/13.3 = 1同理得出其他温度下平衡气液相组成列表如下t(℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2 的结果相比较。
化工原理下册答案

—蒸八、、一、选择与填空1、精馏操作的依据是混合液中各组分挥发度的差异。
实现精馏操作的必要条件是塔顶液相回流和塔底上升蒸汽。
2、汽液两相呈平衡状态时,汽液两相温度_相同_,但液相组成_小于-汽相组成。
3、用相对挥发度a表达的汽液平衡方程可写为y X。
根据a的大小,可用1 ( 1)x来判定用蒸馏方法分离的难易程度,若a =1则表示不能用普通的蒸馏方法分离该混合液。
4、在精馏操作中,若降低操作压强,则溶液的相对挥发度增加,塔顶温度降低,塔釜温度降低,从平衡角度分析对该分离过程有利。
5、某二元物系,相对挥发度a =3,在全回流条件下进行精馏操作,对第n、n+1两层理论板,已知y n=0.4,则y n+1二0.182。
全回流通常适用于幵工阶段或实验研亘。
6、精馏和蒸馏的区别在于精馏必须引入回流;平衡蒸馏和简单蒸馏的主要区别在于______ 。
7、精馏塔的塔顶温度总是低于塔底温度,其原因是塔底压强高和塔底难挥发组分含量高8、 在总压为101.33kPa 、温度为85 C 下,苯和甲苯的饱和蒸汽压分别为p A°=116.9kPa,p B °=46 kPa ,则相对挥发度a 二2.54,平衡时液相组成 X A 二0.78 ,气 相组成y A 二0.90 。
9、 某精馏塔的精馏段操作线方程为y=0.72x+0.275,则该精馏塔的操作回流比为_2.371_,馏出液组成为_0.982_ 0 10、 最小回流比的定义是 在特定分离任务下理论板数为无限多时的回流比,适宜回流比通常取1.1〜2.0 R min 精馏塔进料可能有 5种不同的热状况,当进料为气液混合物且气液摩尔比为提馏段上升蒸气量 V 增加、下降液体量L '增加15、 操作中的精馏塔,增大回流比,其他操作条件不变,则精馏段液气比L/V 增大, 提馏段液气比 L ' /V ' 减小,X D 增加,x W 减小。
16、 操作中的精馏塔,保持 F 、X F 、q 、V 不变,增加 W ,则X D 增加,x w 增加, L/V_ 增加_。
化工原理(下册)答案

化工原理(天津大学第二版)下册部分答案第8章2. 在温度为25 ℃及总压为101.3 kPa 的条件下,使含二氧化碳为3.0%(体积分数)的混合空气与含二氧化碳为350 g/m 3的水溶液接触。
试判断二氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。
已知操作条件下,亨利系数51066.1⨯=E kPa ,水溶液的密度为997.8 kg/m 3。
解:水溶液中CO 2的浓度为33350/1000kmol/m 0.008kmol/m 44c == 对于稀水溶液,总浓度为 3t 997.8kmol/m 55.4318c ==kmol/m 3 水溶液中CO 2的摩尔分数为4t 0.008 1.4431055.43c x c -===⨯ 由 54* 1.6610 1.44310kPa 23.954p Ex -==⨯⨯⨯=kPa气相中CO 2的分压为t 101.30.03kPa 3.039p p y ==⨯=kPa < *p故CO 2必由液相传递到气相,进行解吸。
以CO 2的分压表示的总传质推动力为*(23.954 3.039)kPa 20.915p p p ∆=-=-=kPa3. 在总压为110.5 kPa 的条件下,采用填料塔用清水逆流吸收混于空气中的氨气。
测得在塔的某一截面上,氨的气、液相组成分别为0.032y =、31.06koml/m c =。
气膜吸收系数k G =5.2×10-6 kmol/(m 2·s ·kPa),液膜吸收系数k L =1.55×10-4 m/s 。
假设操作条件下平衡关系服从亨利定律,溶解度系数H =0.725 kmol/(m 3·kPa)。
(1)试计算以p ∆、c ∆表示的总推动力和相应的总吸收系数;(2)试分析该过程的控制因素。
解:(1) 以气相分压差表示的总推动力为 t 1.06*(110.50.032)kPa 2.0740.725c p p p p y H ∆=-=-=⨯-=kPa 其对应的总吸收系数为 246G L G 11111()(m s kPa)/kmol 0.725 1.5510 5.210K Hk k --=+=+⋅⋅⨯⨯⨯ 35252(8.89910 1.92310)(m s Pa)/kmol 2.01210(m s Pa)/kmol =⨯+⨯⋅⋅=⨯⋅⋅6G 1097.4-⨯=K kmol/(m 2·s ·kPa)以液相组成差表示的总推动力为33*(110.50.0320.725 1.06)kmol/m 1.504kmol/m c c c pH c ∆=-=-=⨯⨯-=其对应的总吸收系数为 m/s 10855.6m/s 102.5725.01055.11111664G L L ---⨯=⨯+⨯=+=k H k K(2)吸收过程的控制因素气膜阻力占总阻力的百分数为%58.95%100102.51097.4/1/166G G G G =⨯⨯⨯==--k K K k 气膜阻力占总阻力的绝大部分,故该吸收过程为气膜控制。
化工原理(下)参考卷及答案

A 卷一、单项选择题(每小题2分,共12分) 1、在)(*L G G Ap p K N -=中,*L p 代表的是( C )。
A 、界面处被吸收组分的分压力; B 、气相主体中被吸收组分的分压力; C 、与液相主体浓度相平衡的气相分压力。
2、 吸收操作的作用是分离( A ) 。
A 、气体混合物;B 、液体均相混合物;C 、气液混合物。
3、全回流时,y 一x 图上精馏段和提馏段两操作线的位置( B )。
A 、在对角线与平衡线之间;B 、与对角线重合;C 、在对角线之下。
4、精馏塔中由塔顶向下的第n-1,n ,n+1层塔板上的液相组成(摩尔分率)关系为( C ) A 、x n+1 > x n > x n-1 ; B 、x n+1 = x n = x n-1 ; C 、x n+1 < x n < x n-1 。
5、对于不饱和的湿空气,其露点( C )湿球温度。
A 、大于; B 、等于; C 、小于。
6、恒速干燥阶段,物料表面的温度等于( A )。
A 、湿空气的湿球温度;B 、湿空气的干球温度;C 、湿空气的露点温度。
二、判断题(每小题2分,共12分)1、低浓度逆流吸收操作中,当吸收剂温度降低而其他条件不变时,相平衡常数m 变小。
( √ )2、吸收操作的最小液气比指的是使操作线上某一点与平衡线相遇的液气比。
( √ )3、当精馏操作的回流比减少至最小回流比时,所需理论板数为最小。
( × )4、精馏操作中过冷液体进料将使提馏段的汽流量和液流量都大于精馏段。
( √ )5、某种湿空气的温度t 越高,湿空气的相对湿度φ越低。
( √ )6、在气流干燥过程,热空气的焓值必定减小。
( × ) 三、简答题(每小题4分,共16分)1还是愈小。
答:如图所示:操作线为AB ,平衡线为OE 。
在操作线上任取一点P ,从图上可知PQ 、PR 动力y -y ×和x ×-x 。
化工原理下册课后答案

第一章 蒸馏的习题解答1..已知含苯0.5(摩尔分数)的苯—甲苯混合液,若外压为99KPa,试求该搭液的泡点温度。
苯和甲苯的饱和蒸气压数据见例14附表。
解:本题需用试差法确定溶液的饱和温度。
先假设一温度,查苯和甲苯的饱和蒸汽压 0A p 和0B p则000B A B P P x P P -=-,若所求的x 与题给的x 值相等, 则证明假设正确。
设假设温度恰为泡点温度, 否则需修正。
本题外压为99a KP ,据常压下苯~甲苯混合液的t-x-y 图 设该溶液的泡点温度091.5t C =,则查教材附录可知00.141.6,56.8A a B a P KP p KP ==9956.80.4980.5141.656.8x -==≈-故溶液的泡点温度为92C2. .正戊烷 (C 5H 12)和正己烷(C 6H 14)的饱和蒸气压数据列于本题附表,试求p=13.3KPa 下该溶液的平衡数据。
假设该溶液为理想溶液。
习题2附表解:由以下二式求,x y 的数据。
记0000,B AA B P P P x y x P P P-==- 求解本题时应确定温度范围以查取0A P 和0B P .由本题附表可知平衡温度在260.6 K 和289 K 之间,选取以上两温度间的若干温度,求,x y 。
计算过程从略,结果如下表所示:3.利用习题2的数据,计算:(1)平均相对挥发度;(2)在平均相对挥发度下的x-y 数据,并与习题2的结果相比较。
解: α的计算结果处于本题附表的第二列1(4.70+4.94+5.14+5.30+4.04+3.79+3.68)=4.517mα=⨯平衡方程为 4.51(1)1 3.5m m x xy x xαα==+-+计算结果表明:由于α随t 略有变化,故用平均相对挥发度求得的,x y 与习题2 的结果稍有差异。
4.在常压下将某原料液组成为0.6(易挥发组分的摩尔分数)的两组分洛液分别进行简单蒸馏和平衡蒸馏,若汽化率为1/3,试求两种情况下的釜液和馏出液组成。
化工原理下册答案

第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p =107.6 kPa 及*B p =41.85 kPa ,取样测得液面上方气相中组分A 的摩尔分数为0.95。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯0.4(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为 24.22035.1206032.6lg *A +-=t p 58.21994.1343078.6lg *B +-=t p式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa 对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =17.02kPa ,*B p =5.313kPa203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章 蒸馏一、选择与填空1、精馏操作的依据是 混合液中各组分挥发度的差异 。
实现精馏操作的必要条件是 塔顶液相回流 和 塔底上升蒸汽 。
2、汽液两相呈平衡状态时,汽液两相温度_相同_,但液相组成_小于_汽相组成。
3、用相对挥发度α表达的汽液平衡方程可写为1(1)xy xαα=+-。
根据α的大小,可用来 判定用蒸馏方法分离的难易程度 ,若α=1则表示 不能用普通的蒸馏方法分离该混合液 。
4、在精馏操作中,若降低操作压强,则溶液的相对挥发度 增加 ,塔顶温度 降低 ,塔釜温度 降低 ,从平衡角度分析对该分离过程 有利 。
5、某二元物系,相对挥发度α=3,在全回流条件下进行精馏操作,对第n 、n+1两层理论板,已知 y n =0.4,则 y n+1=_0.182_。
全回流通常适用于 开工阶段 或 实验研究 。
6、精馏和蒸馏的区别在于 精馏必须引入回流;平衡蒸馏和简单蒸馏的主要区别在于前者为连续的稳态过程而后者是间歇的非稳态过程 。
7、精馏塔的塔顶温度总是低于塔底温度,其原因是 塔底压强高 和 塔底难挥发组分含量高 。
8、在总压为101.33kPa 、温度为85℃下,苯和甲苯的饱和蒸汽压分别为p A 0=116.9kPa,p B 0=46 kPa ,则相对挥发度α= 2.54,平衡时液相组成x A = 0.78 ,气相组成y A = 0.90 。
9、某精馏塔的精馏段操作线方程为y=0.72x+0.275,则该精馏塔的操作回流比为_2.371_,馏出液组成为_0.982_。
10、最小回流比的定义是 在特定分离任务下理论板数为无限多时的回流比 ,适宜回流比通常取 1.1~2.0 R min11、精馏塔进料可能有 5 种不同的热状况,当进料为气液混合物且气液摩尔比为2:3时,则进料热状况q 值为 0.6 。
注:23()550.6V V L V F V L V LI I I I I q I I I I -+-===-- 12、在塔的精馏段测得 x D =0.96、x 2=0.45、x 3=0.40(均为摩尔分率),已知R=3 ,α=2.5,则第三层塔板的气相默弗里效率 E MV _44.1%_。
注:1*1n n MV n n y y E y y ++-=- 13、在精馏塔设计中,若F 、x F 、q 、D 保持不变,若增加回流比R ,则x D 增加, x W 减小 ,V 增加,L/V 增加 。
14、在精馏塔设计中,若F 、x F 、x D 、x W 及R 一定,进料由原来的饱和蒸气改为饱和液体,则所需理论板数N T 减小 。
精馏段上升蒸气量V 不变 、下降液体量L 不变 ;提馏段上升蒸气量V’增加、下降液体量L’增加。
15、操作中的精馏塔,增大回流比,其他操作条件不变,则精馏段液气比L/V 增大,提馏段液气比L’/V’减小,xD 增加 , xW减小。
16、操作中的精馏塔,保持F、xF 、q、V不变,增加W ,则xD增加 , xW增加,L/V_增加_。
17、在连续精馏塔中,若xF 、xD、R、q、D/F相同,塔釜由直接蒸汽加热改为间接蒸汽加热,则所需的理论板数NT 减小,xW增加。
18、恒沸精馏与萃取精馏的共同点是都需要加入某种添加剂。
两者的主要区别是恒沸精馏时添加剂需与被分离组分形成恒沸物和恒沸精馏的添加剂气化后由塔顶排出,耗能大。
19、某二元混合物,若液相组成xA 为0.45,相应的泡点温度为t1;汽相组成yA为0.45,露点温度为t2,则 A 。
A.t1< t2B.t1=t2C.t1>t2D.不能判断20、两组分物系的相对挥发度越小,则表示分离该物系 B 。
A.容易 B.困难 C.完全D.不完全21、精馏塔的操作线为直线,其原因是 DA.理论板假定 B.理想物系C.塔顶泡点回流 D.恒摩尔流假定22、分离某两组分物系,进料量为10kmol/h,组成xF 为0.6,若要求馏出液组成xD不小于0.9,则最大馏出液量为 AA.6.67kmol/h B.6 kmol/h C.9 kmol/h D.不确定23、精馏塔中由塔顶向下的第n-1、n、n+1层塔板,其汽相组成关系为_B_。
A. yn+1>yn>yn-1; B. yn+1<yn<yn-1; ?C. yn+1=yn=yn-1; D. 不确定。
24、在原料量和组成相同的条件下,用简单蒸馏得的气相总组成为xD1,用平衡蒸馏得的气相总组成为xD2,若两种蒸馏方法所得的气相量相同,则 AA. xD1> xD2; B. xD1= xD2; ?C. xD1<xD2; D. 不能判断25、在精馏塔的图解计算中,若进料热状态变化,将使 B A.平衡线发生变化 B.操作线与q线发生变化C.平衡线与q线变化 D.平衡线与操作线变化26、操作中的精馏塔,若选用的回流比小于最小回流比,则 DA.不能操作 B.xD , xW均增加 C.xD, xW均不变 D.xD减小, xW增加27、操作中的精馏塔,若保持F、q、xD 、xW、V’不变,减小xF,则 CA.D增大、R减小 B.D减小、R不变C .D 减小、R 增大 D .D 不变、R 增大28、用某精馏塔分离两组分溶液,规定产品组成x D 、x W ,当进料组成为x F1时,相应的回流比为R 1;进料组成为x F2时,相应的回流比为R 2。
若x F1< x F2,进料热状况不变,则 CA .R 1< R 2B .R 1=R 2C .R 1> R 2D .无法判断29、用精馏塔完成分离任务所需理论板数N T 为8(包括再沸器)若全塔效率E T 为50%,则实际板数为 CA .16B .12C .14D .无法确定30、在常压下苯的沸点为80.1℃,环己烷的沸点为80.7℃,欲使该两组分混合物得到分离宜采用 CA .恒沸精馏B .普通精馏C .萃取精馏D .水蒸汽精馏吸收复习题一、 对低浓度溶质的气液平衡系统,当总压降低时,亨利系数E 将_不变_, 相平衡常数m 将_增大_, H 将_不变_二、 亨利定律表达式Ex p e , 若气体在水中的亨利系数E 值很小,说明该气体为_易溶_气体三、 在吸收过程中,K y 和k y 是以__y —y *_和_y —y i _为推动力的吸收系数,它们的单位是_kmol/(m 2·s ·Δy)四、 若总吸收系数和分吸收系数的关系可以用LG G Hk k K 111+=, 其中G k 1表示_气膜阻力,当_1/(Hk L )_项可忽略时,表示该吸收过程为气膜控制。
五、 在1atm ,20℃时,某浓度气体被清水吸收,若气膜吸收系数k G =0.1kmol/()2atm h m ⋅⋅, 液膜吸收系数k L =0.25kmol/()/32m kmol h m ⋅⋅, 溶质的亨利系数H=149.3)/(3atm m kmol ⋅, 则该溶质为_易溶_气体,气相总吸收系数K y =_0.0997_kmol/()2h m ⋅六、 一般而言,两组分A ,B 的等摩尔相互扩散体现在__精馏__单元操作当中,而组分A 在B 中单相扩散体现在__吸收__单元操作中。
七、 在吸收过程中,若降低吸收剂用量,对气膜控制物系,体积吸收总系数K Y a值将_不变_, 对液膜控制物系,体积吸收总系数K Y a 值将___减小__八、 双膜理论是将整个相际传质过程简化为_通过气、液两膜层的分子扩散过程__九、 吸收塔的操作线方程和操作线是通过__物料衡算__得到的。
它们与__平衡关系_、_操作温度__和__压强及塔的结构__无关。
十、 吸收因数A 可表示为_L/mG_, 它在Y-X 图中的几何意义是_操作线斜率和平衡线斜率之比_十一、 若分别以S 1、S 2、S 3表示难溶、中等溶解度、易溶气体在吸收过程中的脱吸因数,吸收过程中操作条件相同,则S 1_大于__S 2__大于__S 3十二、 吸收过程中,若减小吸收剂用量,操作线的斜率__变小__,吸收推动力__变小__十三、 吸收过程中,物系平衡关系可以用Y *=mX 表示,最小液气比的计算式min⎪⎭⎫⎝⎛G L = 2121X mY Y Y --第七章 固体物料的干燥一、选择与填空1、对流干燥的必要条件是 湿物料表面的水汽分压大于干燥介质中的水汽分压;干燥过程是 传热与传质 相结合的过程。
2、在101.33kPa 的总压下,在间壁式换热器中将温度为293K ,相对湿度为80%的湿空气加热,则该空气下的下列状态参数变化的趋势是:湿度H 不变 ,相对湿度Φ 减小 ,湿球温度tw 升高 ,露点td 不变 。
3、在101.33kPa 的总压下,将饱和空气的温度由t 1降到t 2,该空气下的下列状态参数变化的趋势是:湿度H 减小,相对湿度Φ100%,湿球温度tw 降低,露点td 降低 。
4、在实际的干燥操作中,常用 干湿球温度计 来测定空气的湿度。
5、测定空气中水汽分压的实验方法是测量 露点 。
6、恒定干燥条件是指空气的 温度 、 湿度 、 流速 均不变的干燥过程。
7、在一定的温度和总压下,以湿空气作干燥介质,当相对湿度Φ较大时,则湿物料的平衡水分相应较高,其自由水分相应较低。
8、恒速干燥又称表面汽化控制阶段,影响该阶段干燥速率的主要因素是干燥介质的状况、流速、与物料的接触方式;降速干燥又称内部迁移控制阶段,影响该阶段干燥速率的主要因素是物料结构、尺寸、与干燥介质的接触方式、物料的温度等。
9、在恒速干燥阶段,湿物料表面的温度近似等于空气的湿球温度。
10、在常压和40℃下,测得湿物料的干基含水量X与空气的相对湿度Φ之间的平衡关系为:当Φ=100%时,平衡含水量X*=0.16kg/kg绝干料,当Φ=40%时,平衡含水=0.23kg/kg绝干料,现让该量X*=0.04kg/kg绝干料。
已知该物料的初始含水量X1物料在40℃下与Φ=40%的空气充分接触,非结合水含量为 0.07 kg/kg绝干料,自由含水量为 0.19 kg/kg绝干料。
11、在恒定干燥条件下测得湿物料的干燥速率曲线如图示,其恒速阶段的干燥速率为 2.0 kg水/m2·h,临界含水量为 0.2 kg/kg绝干料,平衡含水量为0.04 kg/kg绝干料。
12、理想干燥过程(绝热干燥过程)是指不向干燥器补充热量、忽略热损失、忽略加热物料所消耗的热量,干燥介质进入和离开干燥器的焓相等13、写出三种对流干燥器的名称厢式干燥器、流化床干燥器、气流干燥器等。
14、固体颗粒在气流干燥器中经历加速运动和恒速运动两个运动阶段,其中加速运动是最有效的干燥区域。
流化床干燥器适用于热敏性物料的干燥,处理粒径为 30μm~6mm 粉状物料最为适宜。
