第三章 水溶液中的离子平衡综合练习
2021高二化学选修四同步:第三章 水溶液中的离子平衡 综合训练

常数) B.常温下,由水电离出的 c(H+)=10-12mol·L-1 的溶液的 pH 可能为 2 或 12 C.已知 Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有 Cl-、CrO42-且浓度均为 0.010mol·L-1 溶液中逐滴加入 0.010mol·L-1 的 AgNO3 溶液时,CrO42-先产生沉淀 D.常温下 pH=7 的 CH3COOH 和 CH3COONa 混合溶液中,c(Na+)=c(CH3COO-) 11.中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化 还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点。 下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时溶液颜色的判 断不正确的是( ) A.用标准酸性 KMnO4 溶液滴定 Na2SO3 溶液以测量其浓度:KMnO4——浅红色 B.利用 Ag++SCN- AgSCN,用标准 KSCN 溶液测量 AgNO3 液浓度:Fe(NO3)3——红色 C.利用 2Fe3++2I- I2+2Fe2+,用 FeCl3 液测量 KI 样品中 KI 的百分含量:淀粉——蓝色 D.利用 OH-+H+ H2O 来测量某盐酸的浓度:酚酞——浅红色
3. 0.1mol L-1 的 8 种物质的溶 液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH⑥ CH3COONa ⑦KCl⑧ NH4Cl ,
其溶液的 pH 由小到大的顺序是( ) A.③⑧②①⑥⑤⑦④ B.②①③⑧⑦⑥⑤④ C.②③⑧①④⑦⑥⑤ D.①②③⑧⑦④⑥⑤ 4.在不同温度下,水溶液中[H+]与[OH-]有如图所示关系。下列关于离子共存的说法正确的是( )
第三章 水溶液中的离子平衡测试题

第三章水溶液中的离子平衡测试题(周测)第一卷选择题(50分)一单选题(15小题,每题2分,共30分)1、有一支50mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是()A.、a mL B、(50―a)mL C、大于(50―a)mL D、大于a mL2、某学生的实验报告所列出的下列数据中合理的是()A.用10mL量筒量取7.13mL稀盐酸B.用托盘天平称量25.20g NaClC.用广泛pH试纸测得某溶液的pH为2.3D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL3现有H+ 浓度相同的醋酸溶液和盐酸,分别用蒸溜水稀释,至原体积的m倍和n倍,稀释后两溶液的H+浓度仍然相等,则m和n的关系是()A.m >n B.m =n C.m<n D.无法确定4能使H2O H++OH-电离平衡向正反应方向移动,而且所得溶液显酸性的是()A.将水加热到99℃,使水的pH=6.1 B.在水中滴入稀硫酸C.在水中加入小苏打D.在水中加入氯化铝固体5物质的量浓度相同的下列溶液中,NH4+浓度最大的是()A.NH4Cl B.NH4HSO4C.CH3COONH4 D.NH3·H2O6常温下,在由水电离产生的c(H+)H2O=10-12mol/ L的溶液中,一定能大量共存的离子组是()A.NH4+、Ba2+、Cl-、NO3-B.Na+、K+、SO42-、NO3-C.Fe3+、Cu2+、SO42-、Cl-D.Mg2+、K+、ClO-、I-7一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体②H2O ③NH4Cl固体④CH3COONa固体⑤NaNO3固体⑥KCl溶液()A.②④⑥B.①②C.②③⑤D.②④⑤⑥8在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是()A. pH=3的硝酸和pH=11的Ba(OH)2溶液B. pH=3的盐酸和pH=11的氨水C. pH=3的硫酸和pH=11的KOHD. pH=3的醋酸和pH=11的KOH溶液9在20mL0.1mol·L-HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是()A. C(H+)+C(NH4+)=C(OH-)+C(Cl-)B.C(H+)= C(OH-)+ C(NH 3·H2O)C. C(Cl-)>C(NH4+)>C(OH-)>C(H+)D.C(Cl-)=C(NH4+)+ C(NH 3·H2O)10下列溶液加热蒸干后,能析出溶质固体的是()A.AlCl3B.KHCO3C.Fe2(SO4)3D.NH4HCO311下列事实一定能说明HF是弱酸的是()①常温下NaF溶液的pH大于7;②用HF溶液做导电性实验,灯泡很暗;③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3⑤HF能与Na2CO3溶液反应,产生CO2气体⑥HF与水能以任意比混溶⑦1mol/L的HF水溶液能使紫色石蕊试液变红A.①②⑦B.②③⑤C.③④⑥D.①④12下列说法中不正..确.的是()A.Ksp只与难溶电解质本身的性质和温度有关B.在一定温度下,向AgCl饱和溶液中加入盐酸时,K sp值变大C.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀13.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中不正确...的是()A.酸式滴定管用蒸馏水洗净后,还要用已知浓度的盐酸润洗2-3次B.滴定时没有排除滴定管下端的气泡C.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液D.滴定过程中眼睛要注视锥形瓶内溶液颜色的变化和液体的流速14下列过程或现象与盐类水解无关的是()A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈C. 加热氯化铁溶液颜色变深D. 浓硫化钠溶液有臭味15某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图所示。
(完整版)水溶液中的离子平衡典型练习题及答案

水溶液中的离子平衡1.常温下将稀NaOH溶液和稀CH3COOH溶液混合,溶液中不可能出现的结果是().A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)2. 在25℃,将a mol/L的氨水与b…的盐酸等体积混合,反应后显中性…用含a和b的代数式表示该混合溶液中一水合氨的电离平衡常数是?3.水的电离平衡曲线如图所示,下列说法中,正确的是()A、图中A、B、D三点处Kw的大小关系:B>A>DB、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3?H2O)的值逐渐减小C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点D、A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、S042-4. 设水的电离平衡线如图所示:(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____增加到____,造成水的离子积增大的原因是____.(2)将pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲混合溶液pH=7,则Ba(OH) 2 溶液与盐酸的体积比为____.(3)100℃时,已知某强酸溶液的pH酸与某强碱溶液的pH碱存在如下关系:pH酸+ pH碱=13,若要使该强酸与该强碱混合后溶液呈中性,则该强酸溶液的体积与强碱溶液的体积之比为__5. 已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度是1.0×10-10mol/LC.加入NaHSO4晶体抑制了水的电离D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性6.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是( )A.Na+、AlO2-、K+、NO3-B.MnO4-、K+、SO42-、Na+C.NH4+、NO3-、Al3+、Cl-D.Mg2+、SO42-、HCO3-、Na+7.下列事实能说明醋酸是弱电解质的是( )①醋酸与水能以任意比互溶②醋酸溶液能导电③醋酸溶液中存在醋酸分子④1mol/L醋酸的pH比0.1mol/L盐酸pH大⑤醋酸能和碳酸钙反应放出CO2⑥0.1mol/L醋酸钠溶液pH=8.9⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢A.②⑥⑦B.③④⑥⑦C.③④⑤⑥D.①②③8.关于小苏打水溶液的表述正确的是()A.c (Na+)=c (HCO3-)+c (CO32-)+2c (H2CO3)B.c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-)C.HCO3-的电离程度大于HCO3-的水解程度D.存在的电离有:NaHCO3=Na++HCO3-,HCO3-⇌H++CO32-,H2O⇌H++OH-9.下列有关电解质溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)B.在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)10. (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L 的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):①溶液中c(NH4+)+c(NH3•H2O)一定等于______②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.11某二元弱酸的酸式盐,NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确的是A C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)B c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)C c(H+)+ c(HA-)= c(OH-)+ c(H2A)D c(Na+)= c(HA-)+ c(H2A)+ c(A2-).答案1.在电解质溶液中存在三个守恒:①电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),②物料守恒,③质子守恒,故B正确;D项pH=7,c(H+)=c(OH-),则有c(Na+)=c(CH3COO-),故D项错;A项NaOH是强电解质NaOH====Na++OH-,当两溶液混合OH-参加反应被消耗,而Na+不参加反应,故c(Na+)>c(OH-),同理c (CH3COO-)>c(H+),故A项错;C项pH<7,醋酸过量,结论正确。
高中化学选修4第三章《水溶液中的离子平衡》单元测试(一)

1. 甲酸的下列性质中,可以证明它是弱电解质的是( )A. 1 mol ·L-1 的甲酸溶液中c(H+)约为1×10-2 mol/LB. 甲酸能与水以任意比例互溶C. 甲酸与盐酸都能与NaOH 发生反应D. 甲酸溶液的导电能力比盐酸溶液的导电能力弱2.硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料,印泥及朱红雕刻漆器等。
某温度时,HgS 在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )A. 向硫化汞的浊液中加入硫化钠溶液,硫化汞的K sp 减小B. 图中a 点对应的是饱和溶液C. 向c 点的溶液中加入Hg(NO3)2 ,则c(S2-)减小D.升高温度可以实现c 点到b 点的转化3.氢氧化钙在80℃时的溶解度为xg ,20℃时的溶解度为yg 。
取20℃的氢氧化钙饱和溶液,蒸发掉Wg 水后再恢复到20℃ ,其溶液里面溶质的质量分数为z% ,则下列关系正确的是( )A.y>x ,y>zB.x>y>zC.y<x ,y<zD.x<y<z4.在-50℃时液氨中存在着下列平衡:2NH3(液) NH4++NH2- ,两种离子的平衡浓度均为 1.0×10-15mol ·L-1 。
以下有关-50℃时离子积的叙述中正确的是( )A.离子积为1.0×10-15B.离子积为1.0×10-30C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大D. 向液氨中加入NH4Cl ,c(NH4+)增大,离子积的数值也随之增大5.在氨水中,NH3 ·H2O 电离达到平衡的标志是( )A.溶液显电中性C.c(OH-)恒定不变B.溶液中检测不出NH3 ·H2O 分子的存在D.c( NH ) =c(OH-)6.对室温下pH 相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )A.加适量的醋酸钠晶体后,两溶液的pH 均增大B.使温度都升高20℃后,两溶液的pH 均不变C.加水稀释2 倍后,两溶液的pH 均减小D.加足量的锌充分反应后,盐酸中产生的氢气速率快7.已知室温时,0. 1mo1/L 某一元酸HA 在水中有0.1%发生电离,下列叙述错误的是:( )A.该溶液的pH=4B.升高温度,溶液的pH 增大C.此酸的电离平衡常数约为1×10-7D. 由HA 电离出的c(H+)约为水电离出的c(H+)的106 倍8.下列物质的水溶液能导电,但其本身属于非电解质的是( )A.CH3COOHB.干冰C.酒精D.Cl29.已知CaCO3 的Ksp=2.8×10-9 ,现将浓度为2×10-4 mol •L- 1 的Na2CO3 溶液与CaCl2 溶液等体积混合,若要产生沉淀,则所用CaCl2 溶液的浓度至少应为( )A.2.8×10-2 mol •L- 1B. 1.4×10-5 mol •L- 1C.2.8×10-5 mol •L- 1D.5.6×10-5 mol •L- 110.下列事实能说明亚硝酸是弱电解质的是( )①25℃时亚硝酸钠溶液的pH 大于7 ②用HNO2 溶液做导电试验,灯泡很暗③HNO2溶液不与Na2SO4 溶液反应④0. 1mol ·L- 1HNO2 溶液的pH=2A.①②③B.②③④C.①④D.①②④11.关于浓度均为0. 1mol ·L- 1 的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )A.c(NH4+) :③>①B.水电离出的c(H+) :②>①C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3 ·H2O)D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH- >c(H+)12.25 ℃时,水电离出的H+浓度是5×10-13mol ·L-1 的硫酸溶液中,硫酸溶液的浓度为( )A.0.01mol ·L-1B.0.02 mol ·L-1C. 1×10-7mol ·L-1D. 1×10-12mol ·L-113.下列各式中属于正确的水解方程式的是( )A.NH4++H2O NH3 ·H2O+H+B.S2-+2H2O H2S+2OH-C.CH3COOH+H2O CH3COO-+H3O+D.CH3COOH+OH-===CH3COO-+H2O14.室温下,用0. 100 mol ·L- 1NaOH 溶液分别滴定20.00 mL 0. 100 mol ·L- 1 的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )A. Ⅰ表示的是滴定盐酸的曲线B.pH=7 时,滴定醋酸消耗的V(NaOH)小于20mLC.V(NaOH)=20mL 时,两份溶液中c(Cl-)=c(CH3COO-)D.V(NaOH)=10mL 时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)15.25℃时,将某强酸和某强碱溶液按1 ∶ 10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH 和为( )A. 12B. 13C. 14D. 1516.某温度(T℃)时,水的离子积为K w=1×10-13 。
水溶液中的离子反应与平衡 单元测试题

第三章《水溶液中的离子反应与平衡》测试题一、单选题(共12题)1.下列实验能达到预期目的的是选项实验内容实验目的A向溶液X 中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色证明溶液X 中含有23SO -或3HSO -B室温下,向135mL0.1mol L AgNO -⋅溶液中加入几滴10.1mol L NaCl -⋅溶液出现白色沉淀,再滴加几滴10.1mol L aI N -⋅溶液,出现黄色沉淀证明相同温度下:()()sp sp K AgCl >K AgI C常温下,测得相同浓度溶液的pH :NaA NaB>证明常温下的水解程度:A B -->D将2FeCl 溶液滴入酸性4KMnO 溶液中,紫红色褪去证明2Fe +有还原性A .AB .BC .CD .D2.下列实验中,由实验现象不能..得到正确结论的是选项实验现象结论A向1.0mol·L -1的NaHCO 3溶液中滴加2滴甲基橙溶液呈黄色NaHCO 3溶液呈碱性B 在醋酸钠溶液中滴入酚酞溶液并加热加热后红色加深证明盐类水解是吸热反应C将FeCl 3溶液加入Mg(OH)2悬浊液中,振荡沉淀由白色变为红褐色Fe(OH)3的溶解度小于Mg(OH)2的溶解度D相同的铝片分别与同温同体积,且c(H +)=1mol·L -1的盐酸、硫酸反应铝与盐酸反应产生气泡可能是Cl -对该反应起到促进作用较快A .AB .BC .CD .D3.有一支50mL 酸式滴定管中盛盐酸,液面恰好在amL 刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是A .a mLB .(50-a)mLC .大于(50-a)mLD .大于a mL4.已知甘氨酸在水中存在三种微粒,它们的转化关系如下:pI 为该溶液中-COO -和+3H N -数目相等时的pH ,K 1和K 2分别表示-COOH 和+3H N -的解离常数,K 1=10-2.4,K 2=10-9.4。
人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡复习提升练含答案

第三章水溶液中的离子反应与平衡本章复习提升易混易错练易错点1混淆三个守恒而错误判断微粒浓度大小关系1.(2024河北邢台联考)25 ℃时,下列溶液中有关微粒的物质的量浓度关系错误的是() A.浓度相同的CH3COONa溶液与NaClO溶液,溶液中阳离子的总浓度前者等于后者B.Na2CO3溶液:c(OH-)=c(HC O3−)+c(H+)+2c(H2CO3)C.醋酸钠溶液、盐酸混合后呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH)D.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)2.(2024江西教研共同体联考)25 ℃时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 KOH溶液,溶液pH与KOH溶液体积的关系如图所示,对图中四个点a、b、c、d的分析中,不正确的是()A.a点前发生的反应为H++OH- H2OB.b点存在2c(S O42−)=c(NH4+)+c(K+)C.d点水的电离程度最大,且存在c(OH-)=c(N H4+)+c(H+)D.c点存在c(N H4+)>c(NH3·H2O)易错点2沉淀溶解平衡原理理解不清,平衡移动判断错误3.(2024安徽滁州期末)硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是()A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的K sp的关系为K sp(m)=K sp(n)<K sp(p)<K sp(q)C.向m点的溶液中加入少量Na2S固体,溶液中Cd2+浓度降低D.温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动4.(2024河南郑州联考)铅白(PbCO3)和黄色的PbI2都是难溶的铅盐。
室温下,PbCO3和PbI2达到沉淀溶解平衡时,-lg c(Pb2+)与-lg c(C O32−)或-lg c(I-)的关系如图。
高中化学选修4第三章水溶液中的离子平衡单元测试题(带参考答案)

高中化学选修4第三章<<水溶液中的离子平衡>>单元测试题可能用到的元素的相对原子质量: H—1 C—12 O—16 Na—23 Cl—一、选择题?每小题3分,共60分。
每小题只有一个选项符合题意 ?....1.下列反应中,属于水解反应且使溶液显酸性的是()A.NH 4 + H 2O NH 3·H 2O + H C.S + H 2O HS + OH 2--++B.HCO 3-+ H 2O CO 3 + H 3O +-2-+-D.NH 3 +H 2O NH 4 +OH 2.下列实验符合要求的是 ( )A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定B.用托盘天平称取NaOH 固体时需先在左右两盘中各放上大小相同的纸片C.若25 mL 滴定管中液面的位置在刻度为10mL 处,则滴定管中液体的体积一定大15 mL D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH 试纸上测得其pH 为123.常温下,下列溶液中可能大量共存的离子组是()..A.加入金属镁能产生大量H 2的溶液中:Na 、NH 4、F 、SO 3B.含有大量S 的溶液中:K 、Mg 、ClO 、SO 43+++2-+2+-2-++-2--C.能使Al 生成沉淀的溶液中:NH 4、Na 、SiO 3、HCO 3D.水电离产生的c (OH )=1×10--102-mol/L 的溶液中:Al 、SO 4、NO 3、Cl 3+2---4.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液是 ( )A.pH=12的Ba(OH)2溶液B.pH=12的氨水-1-1C.·L NaOH 溶液D.·L BaCl 2溶液5.下列说法正确的是()A.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低B.中和pH 与体积均相同的盐酸和醋酸溶液,消耗NaOH 的物质的量相同C.已知pOH=-lg[c (OH )],又知体温下正常人的血液pH=,则血液的pOH 为D.KCN 溶液中有剧毒HCN 挥发出来,为了减少HCN 的生成,最佳方法是加入KOH6.某温度下,100mL mol/L 醋酸溶液与足量Zn 粒反应生成H 2的速率v (H 2)=mol/(L·min)。
第三章 水溶液中的离子平衡单元练习题(含答案)

第三章水溶液中的离子平衡一、单选题1.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是()A.两条曲线间任意点均有c(H+)·c(OH-)=K wB. M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D. XZ线上任意点均有pH=72.为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3②KCl③Ca(H2PO4)2④NH4NO3⑤氨水,最适合的组合是()A.①③④B.①③⑤C.②③④D.②③⑤3.下列事实可证明MOH是弱碱的是()A. MOH能被醋酸中和B.用MOH溶液做导电性实验,灯泡亮度较暗C. MOH可使酚酞溶液变红D.常温时0.1 mol·L-1MOH溶液的pH约为114.将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)()①Na2O2②Na2O③Na2CO3④NaClA.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④5.下列实验基本操作错误的是( )A.滴定管经蒸馏水洗净后,即可注入标准液进行滴定B.玻璃导管蘸水后,边旋转边向橡皮管中插入C.滴定用锥形瓶经蒸馏水洗净后,不须用标准液润洗D.用玻璃棒蘸取待测液滴到pH试纸上,然后跟标准比色卡相对照,读出pH6.NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或两种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取两份等体积混合液,用盐酸的标准液(0.10 mol·L-1)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1,则NaCl溶液中混有的杂质不可能为()A. NaOHB. Na2CO3C. Na2CO3、NaHCO3D. NaOH、Na2CO37.某二元弱酸H 2A溶液,按下式发生电离:H2A H++HA-、HA-H++A2-,下列四种溶液中c(H2A)最大的是()A. 0.01 mol·L-1的H2A溶液B. 0.01 mol·L-1的NaHA溶液C. 0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液D. 0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液8.下列事实可以证明NH3是非电解质的是( )A. NH3是气体B. NH3水溶液显碱性C.液氨和氨水中NH3均不能电离出离子D.液氨不导电9.已知常温下:K sp(AgCl)=1.8×10-10,K sp(Ag2CrO4)=1.9×10-12,下列叙述正确的是() A. AgCl在饱和NaCl溶液中的K sp比在纯水中的K sp小B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明K sp(AgCl)<K sp(AgBr) C.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动10.常温下,将 pH=3的硫酸与 pH=9 的 NaOH溶液混合,若要得到 pH = 7的溶液,混合时硫酸与NaOH 溶液的体积比为()A. 1: 200B. 200 : 1C. 100 : 1D. 1:100二、双选题11.(双选)对于表达式PbI2(s)Pb2+(aq)+2I-(aq),下列描述正确的是()A.说明PbI2难电离B.说明PbI2难溶解C.这是电离方程式D.这是沉淀溶解平衡表达式12.(双选)已知酸H2B在水溶液中存在下列关系:①H2B===H++HB-,②HB-H++B2-。
2020学年高中化学第三章水溶液中的离子平衡综合测试卷(含解析)新人教版选修4(最新整理)

水溶液中的离子平衡综合测试卷1、如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积是()A.a mLB.(50—a)mL C。
一定大于a mL D。
一定大于(50-a)mL2、相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )A.pH相等的两溶液中:c(CH3COOˉ)=c(Clˉ)B.分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同C.相同物质的量浓度的两溶液,分别与足量镁反应,产生氢气体积盐酸多D.相同物质的量浓度的两溶液导电能力相同3、在下列叙述中:①HA溶液的导电性没有盐酸溶液的导电性强;②测得0.1mol/L的HA溶液的pH=2。
7;③常温下,测得NaA溶液的pH>7;④常温下,向HA的溶液中加入NaA固体,pH 增大;⑤等pH等体积的盐酸和HA溶液分别与足量的Zn反应,HA放出的H2多。
能说明HA是弱酸的是()A.①②③④⑤B. ②③⑤C. ②③④⑤D。
①②③⑤4、下表是几种弱酸常温下的电离平衡常数,则下列说法中不正确的是( )3CH COOH23H CO2H S34H PO-51.810A. 碳酸的酸性强于氢硫酸B。
多元弱酸的酸性主要由第一步电离决定C。
常温下,加水稀释醋酸,-3-(CH COOH) (CHCOOH)(OH)cc c增大D. 向弱酸溶液中加少量NaOH溶液,电离常数不变5、如图为不同温度下水的电离平衡曲线,已知pOH=−lgc(OH−),下列说法正确的是( )A.T1和T2的关系是:T1>T2B.K W的关系是:B〉C>A=D=EC.A点到D点:加入少量酸可实现D.T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性6、下列说法中不正确的有( )①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55。
6×107②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低④蒸干AlCl3溶液可得纯净的无水氯化铝⑤常温下,等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱A.1个B。
《水溶液中的离子反应与平衡》测试题2022-2023学年高二上学期人教版(2019)化学选择性必修1
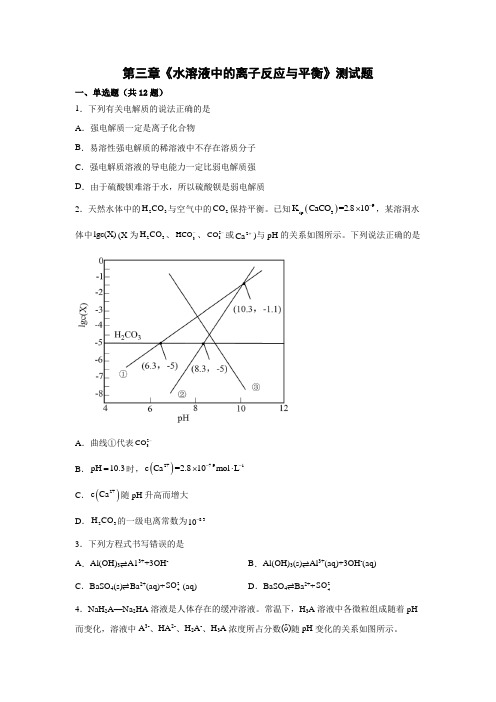
第三章《水溶液中的离子反应与平衡》测试题一、单选题(共12题)1.下列有关电解质的说法正确的是 A .强电解质一定是离子化合物B .易溶性强电解质的稀溶液中不存在溶质分子C .强电解质溶液的导电能力一定比弱电解质强D .由于硫酸钡难溶于水,所以硫酸钡是弱电解质2.天然水体中的23H CO 与空气中的2CO 保持平衡。
已知()9sp 3K CaCO =2.810-⨯,某溶洞水体中lgc(X)(X 为23H CO 、3HCO -、23CO -或2Ca +)与pH 的关系如图所示。
下列说法正确的是A .曲线①代表23CO -B .pH 10.3=时,()2+7.91c Ca =2.810mol L --⨯⋅C .()2+c Ca 随pH 升高而增大D .23H CO 的一级电离常数为8.310- 3.下列方程式书写错误的是 A .Al(OH)3⇌A13++3OH - B .Al(OH)3(s)⇌Al 3+(aq)+3OH -(aq) C .BaSO 4(s)⇌Ba 2+(aq)+2-4SO (aq)D .BaSO 4⇌Ba 2++2-4SO4.NaH 2A —Na 2HA 溶液是人体存在的缓冲溶液。
常温下,H 3A 溶液中各微粒组成随着pH 而变化,溶液中A 3-、HA 2-、H 2A -、H 3A 浓度所占分数(δ)随pH 变化的关系如图所示。
下列说法错误的是A .0.1mol/LNaH 2A 溶液显酸性B .H 3A+HA 2—=2H 2A —的平衡常数K=105.08C .将等物质的量的Na 2HA 和NaH 2A 配制成溶液,pH=7.20D .pH=12.40时,存在关系:c (H +)<2c (HA 2—)+c (H 2A —)+3c (A 3—)+c (OH —)5.向K 2CO 3和KHCO 3的混合溶液中加入少量CaCl 2,测得溶液中离子浓度的关系如图所示,下列说法正确的是A .a 、b 、c 三点对应的溶液中pH 最大的为c 点B .该溶液中存在:23-3c(H CO )>c(HCO )-32-3c(HCO )c(CO )C .向b 点溶液中通入CO 2可使b 点溶液向c 点溶液转化D .b 点对应的溶液中存在:3c(Ca 2+)−c(K +)+c(H +)=3c(2-3CO )+c(OH −)+c(Cl −) 6.下列溶液,在空气中受热浓缩,能够得到预想的无水盐的是 A .MgSO 4溶液→MgSO 4 B .FeCl 3溶液→FeCl 3C .Mg(NO 3)2溶液→Mg(NO 3)2D .AlCl 3溶液→AlCl 37.用N A 表示阿伏加德罗常数的值,下列叙述正确的是 A .1 mol NaHSO 4晶体中含有的阳离子数目为2N AB .用电解粗铜的方法精炼铜,当阳极质量减轻32 g 时,电路中通过的电子数为N AC .常温下,1 L pH=9的CH 3COONa 溶液中,水电离出的H +数目为10–9N AD .向1 L 0.1 mol·L −1盐酸中滴加氨水至中性,溶液中含有的+4NH 数目为0.1N A 8.下列各组离子一定能大量共存的组合是①在含有大量[Al(OH)4]-溶液中:NH 4+、Na +、Cl -、HCO 3-②常温下c(H +)=10-12mol·L -1的溶液:K +、Ba 2+、Cl -、Br -③常温下pH=7的溶液中:Na +、Cl -、SO 24-、Fe 3+④在水溶液中:K +、SO 24-、Cu 2+、NO 3-⑤常温下c(OH -)=10-12mol·L -1的溶液:K +、Al 3+、Cl -、SO 24-⑥常温下pH=1的溶液中:K +、CrO 24-、Na +、SO 24-A .①②⑥B .②④⑤C .④⑤⑥D .①②③9.关于水的电离,下列叙述中,正确的是A .升高温度,水的平衡向正反应方向移动,K W 增大,c(H +)不变B .向水中加入少量硫酸,水的平衡向逆反应方向移动,K W 不变,c(H +)增大C .向水中加入氨水,水的平衡向逆反应方向移动,K W 不变,c(OH -)降低D .向水中加入少量固体NaCl ,平衡向逆反应方向移动,K W 不变,c(H +)降低10.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是A .中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积B .往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全C .将上述盐酸溶液和醋酸溶液等体积混合,混合后溶液的pH=3.3D .25℃时,pH=3的盐酸、pH=3的醋酸溶液中水电离出的()+c H 均为-11-110mol L ⋅11.下列事实不能用难溶电解质的溶解平衡原理来解释的是 A .碳酸钡不能用作“钡餐”而硫酸钡则能 B .铝粉溶于氢氧化钠溶液C .用FeS 除去废水中含有的Cu 2+D .氢氧化铜悬浊液中加入浓氨水溶液变澄清12.酸碱中和滴定常用于测定酸或碱的浓度。
《水溶液中的离子平衡》综合测试题及答案,推荐文档

第三章《水溶液中的离子平衡》单元测试(时间90分钟,满分100分)一、选择题(本题包括16个小题,每小题3分,共48分。
每小题只有1个答案符合题意。
)1. pH 、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下放出CO2气体的体积()A. 醋酸多B.硫酸多C.一样多D.无法比较2•某温度下重水(D2O)的离子积常数为1.6 X 10-15,用定义pH 一样来规定pD = -l g{c(D+)}, 则该温度下,下列叙述正确的是()A. 纯净的重水(D2O)中,pD=7B. 1 L 溶解有0.01 mol DCl 的重水溶液,其pD=12.0C. 纯净的重水中,c(D+)=c(OD-)D. 1 L 溶解有0.01 mol NaOD 的重水溶液,其pD=12.03.准确量取25.00 mL 高锰酸钾溶液,可选用的仪器是()A. 50 mL量筒B . 10mL量筒C.50mL 酸式滴定管D. 50mL碱式滴定管4•某溶液中含有HCO3「、SO32_、CO32「、CH3COO「等4种阴离子。
若向其中加入足量的血2。
2后,溶液中离子浓度基本保持不变的是()A.CH 3COO-B.SO32-C.CO32-D.HCO 3-5. 下列各组离子,在水溶液中能大量共存的是()①I-、CIO-、N03、H+② K+、NH 4、HCO3、OH-③ SO:、S&、Cl-、OH-④Fe2+、Cu2+、SO:、Cl-⑤H+、K+、AI02、HS03⑥Ca2+、Na+、SO:、CO;A. ①和⑥B.③和④C.②和⑤D.①和④6. 要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是()A .甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的B •乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的D •丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的7. 某学生的实验报告所列出的下列数据中合理的是()A. 用10 mL量筒量取7.13 mL稀盐酸B.用托盘天平称量25.20 g NaCIC.用广泛pH试纸测得某溶液的pH为2.3D.用25 mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL8. 能表示人体大量喝水时,胃液的pH 变化的图象是()2A.c ( Na +)>c( CO 3 )>c( HCO 3 )>c(OH -)>c(H +) 2C.c(Na +)=c(HCO 3 )+c(CO 32D.c(OH -)=c( HCO 3 )+2c(H 2CO 3)+c(H +)10•下列反应的离子方程式书写正确的是( )A. 氯化铝溶液中加入过量氨水: Al 3+ + 4NH 3?H 2O ---------- AIO 2一 + 4NH 4+ + 2H 2OB. 澄清石灰水与少量苏打溶液混合: Ca 2+ + OH 一 + HCO 3「CaCO s J + H 2OC. 碳酸钙溶于醋酸 CaCO 3 + 2H +Ca 2+ + CO 2 f + HOD. 氯化亚铁溶液中通入氯气: 2Fe 2+ + CI2 -------- 2Fe 3+ + 2C 「 11.常温下,0.1 mol L 71某一元酸(HA)溶液中c(OH )=1刈0「8,下列叙述正确的是()c(H )A .溶液中水电离出的 c(H +)= 10「10 mol ―1B .溶液中 c(H +) + c(A 「)= 0.1 mol L 71C. 与0.05 mol L • 1 NaOH 溶液等体积混合后所得溶液中离子浓度大小关系为c(A 7) > c(Na +) > c(OH 「) > c(H +)D.上述溶液中加入一定量 CH 3COONa 晶体或加水稀释,溶液的c(OH 「)均增大 12. 下列叙述正确的是()A . 0.1mol L 71 氨水中,c(OH 7)==c(NH 4+)B. 10 mL 0.02mol L :1HCl 溶液与10 mL 0.02mol L :1Ba(OH)2溶液充分混合,若混合后溶液的 体积为20 mL ,则溶液的pH=10C. 在 0.1mol L 71CH 3COONa 溶液中,c(OH 7)==c(CH 3COOH) + c(H +)D. 0.1mol L 71 某二元弱酸强碱盐 NaHA 溶液中,c(Na +)==2c(A 27) + c(HA _)+ c(H 2A)13. 甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是 ()9•向 10 mL O.lmol • L -1 的 Na 2CO 3溶液中通入 溶液中粒子浓度关系正确的是()22.4 mL(标准状况)CO 2,当气体全部溶解时,B.c( HCO 3 )=c(Na +)>c(OH -)>c(H +))+c(H 2CO 3)A.甲、乙两溶液的 c(H +)之比为400: 1 B •甲、乙两溶液均呈酸性C .甲中水的电离程度小于乙中水的电离程度 度无法比较D .甲中水的电离程度与乙中水的电离程14. 下列各式中属于正确的水解反应的离子方程式的是()A. NH 4++H2O =NH 3 H20+H +B. S2「+2H2O=H2S+2OH 一C. CH3C00H+H 2O = CH3C00 _+H 30+D. CH3C00H+0HCH3COO一+H2015. 已知①CH3C00H与CH3C00Na等物质的量混合配成的稀溶液,pH为4.7;②用等物质的量的HCN和NaCN配成的稀溶液中,C(CN「)<C (Na+),则下列说法不正确的是()A. CH 3C00Na的水解趋势大于CH3C00H的电离趋势B. NaCN的水解趋势大于HCN的电离趋势C. ②溶液中,c (H+)<c (OH「)D. CH3C00Na的存在抑制了CH3C00H的电离二、非选择题(本题包括6个小题,共46分)16. (4分)在Cl-、NH4、HSO4、Na+、HCO3五种离子中,既不能电离又不能水解的离子是________ ,只能水解不能电离的离子是 __________ ,只能电离不能水解的离子是 __________ , 既能电离又能水解的离子是 _________ 。
水溶液中的离子平衡测试题及答案

第三章水溶液中G蹄子平衡M^S一、逗撵S1.符区屯水加热至较高温度,下列叙述正碓内是()A.水G蹄子稹燮大、pH燮小、呈酸性B.水G雕了稹不燮、pH不燮、呈中性C.水G蹄子稹燮小、pH燮大、呈^性D.水G蹄子稹燮大、pH燮小、呈中性2.下列有昌昌“重蹄平衡” G叙述中正碓内是( )A.雷解^在溶液裹逢到重蹄平衡畤,分子G渡度和蹄子G浸度相等B.雷雕平衡畤,由於分子和蹄子G渡度不断彝生燮化,所以^^雕平衡是勤熊平衡C.重雕平衡是相举寸G、暂畤G,外界脩件改燮畤,平衡就曾彝生移勤D.雷解^逢到雷蹄平衡彳爰,各槿蹄子G浸度相等3.下列昌昌彳系一定正碓内是()A.常溶液中c(H+)>10-7 molL i畤,其pH<7,溶液呈现酸性B.常溶液中c(H+)>10-7 molL i畤,其pH>7,溶液呈现^性C.常溶液中c(H+)=c(0H-)>10-7 molL i畤,其pH<7,溶液呈现中性D.常溶液中c(H+)=c(0H-)>10-7 molL i畤,其pH<7,溶液呈现酸性4.彳隹植物花朵中提取到一槿色素,它^除上是一槿有檄弱酸,可用HR表示, HR在蜜酸溶液中呈现缸色,HR在NaOH溶液中呈现叠色,符HR加入浸硝酸中呈现缸色,微热彳爰溶液G缸色褪去,根摞以上现象,可推M()A. HR鹰卷缸色B. HR鹰卷叠色C. R-鹰卷瓢色D. R-鹰卷缸色5.在稀氨水溶液中存在如下平衡醴系:NH3-H20^TNH4++0H-,常增大溶液 O pH 畤,c(NH+)^()4A.可能增大也可能减小B.增大C.减小D.瓢燮化6.符pH=1O蜜酸平均分卷2份,1份加遹量水,另一份加入舆言亥蜜酸物^ O 量浸度相同O遹量NaOH溶液彳爰,pH都升高1,即加入0水舆NaOH溶液O醴稹比卷()A. 9B. 10C. 11D. 127.有一槿含氨和氯化^物^O量相等O混合溶液,其pH卷9.3,下列^法中金昔^0是()A.氨水G霜雕作用大於氯化^^水解作用B.氯化^^水解作用大於氨水G重雕作用C.氨水G存在抑制了氯化^G水解D.氯化^G存在抑制了氨水G重蹄8.符O.lmolL i醋酸溶液加水稀释,下列^法正碓内是()A.溶液中c(H+)和c(OH-)都减小B.溶液中c(H+)增大C.醋酸重蹄平衡向左移勤D.溶液G pH增大9.室温下,某溶液中由水重雕出G c(OH-)=10-5mol-L-i,即其溶^可能是 ()A. CH3COOHB. H2SO4C. NaOHD. N&2CO310.pH=3 G醋酸溶液加水冲稀到原溶液醴稹G 3倍,即稀释彳爰G pH^ ()A. 3.2B. 3.5C. 3.7D. 411.已知,往O.lmolL i G氨水中滴入酚酞言式液畤,溶液符呈现粉缸色。
高中化学第三章 水溶液中的离子平衡 综合练习

煌敦市安放阳光实验学校第三章水溶液中的离子平衡综合练习(一)基础练习一、选择题1.下列叙述正确的是A.氯化钠溶液能导电,所以氯化钠溶液是电解质B.固体氯化钠不导电,但氯化钠是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.氯气溶于水能导电,所以氯气是电解质2.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是A.1mol/L亚硝酸溶液的c(H+)约为1×10-2mol/LB.亚硝酸能与水以任何比例互溶C.10mL、1mol/L亚硝酸恰好与10mL、1mol/LNaOH溶液完全反D.在相同条件下,亚硝酸溶液的导电性比强酸溶液的弱3.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流I随加入氨水的体积V的变化曲线图是4.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq) H++In-(aq)() (黄色)浓度为0.02mol/L的下列各溶液:(1)HCl (2)石灰水(3)NaCl(aq) (4)NaHSO4(aq) (5)NaHCO3(aq) (6)氨水其中能使指示剂显的是A. (1)(4)(5)B. (2)(5)(6)C. (1)(4)D. (2)(3)(6)1.BC2.AD 弱电解质溶于水只能电离,若1mol/LHNO2溶液完全电离,则c(H+)=1mol/L,现在c(H+)=1×10-2mol/L,说明只电离了;在相同条件下,弱电解质电离,溶液中离子浓度小,故导电性弱于强电解质。
A、D正确。
B选项只叙述了HNO2在水中的溶解性。
C选项只说明HNO2具有酸性,未涉及酸性的强弱。
3.B CH3COOH CH3COO-+H+ ,加入NH3·H2O(电离出OH-),H++OH-==H2O,促进了两种弱电解质的电离,溶液中离子浓度增大,导电性增强(I增大);继续加过量的稀NH3·H2O,因稀释作用使溶液中离子浓度减小,导电性减弱。
水溶液中的离子平衡(习题+答案)

水溶液中的离子平衡【习题】1.对常温下pH=3的CH3COOH溶液,下列叙述不.正确..的是A.c(H+)=c(CH3COO-)+c(OH-)B.加入少量CH3COONa固体后,c(CH3COO-)降低C.该溶液中由H2O电离出的c(H+)是1.0×10-11 mol/LD.与等体积pH=11的NaOH溶液混合后所得溶液显酸性2.欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是A.通入二氧化碳气体B.加入氢氧化钠固体C.通入氯化氢气体D.加入饱和石灰水溶液3.人体血液中存在平衡:CO2+H2O H2CO3HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。
已知pH随c(HCO3-)︰c(H2CO3)变化关系如下表所示,则下列说法中不正确的是A.pH=7的血液中,c(HCO3-)>c(H2CO3)B.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒C.常温下将pH=7.40的血液稀释至pH=7时,c(H+)·c(OH-)一定不变D.c(HCO3-)︰c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度4.已知氯水中存在反应:Cl2+H2O H++Cl-+HClO,取5 mL饱和氯水进行如下实验。
下列说法中,正确的是A.加5 mL水,c (H+)增大B.加少量NaCl固体,c (H+)不变C.加少量碳酸钙粉末,c(HClO)升高D.加少量Na2SO3固体,溶液pH升高5.实验:①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
人教版高中化学选修四第三章《水溶液中的离子平衡》测试题(含答案)

第三章《水溶液中的离子平衡》测试题一、单选题(每小题只有一个正确答案)1.在25℃时,将a mol/L 的氨水与0.01 mol/L 的HCl 溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)( )A .此时水的电离程度最大B .溶液中c (NH +4)=c (Cl -)C .此时溶液中NH 3·H 2O 的物质的量浓度为12(a -0.01)mol/L D .用含a 的代数式表示NH 3·H 2O 的电离常数K b =10-9a -0.012.《天工开物》中记载:“象牙色,栌木煎水薄染;金黄色,栌木煎水染,复用麻蒿灰淋,碱水漂”。
下列说法错误的是( )A .我国古代染色工匠凭借经验进行调色,以达到染色的目的B .上述记载内容说明酸碱介质改变时可能发生化学平衡的移动C .植物染料色素(栌木中的黄木素)具有酸碱指示剂的性质D .植物染料色素(栌木中的黄木素)难溶于水和有机溶剂3.25℃时,水的电离达到平衡:H 2O H + + OH -,下列叙述正确的是( )A .向水中加入稀氨水,平衡逆向移动,c(OH -)降低B .向水中加入少量固体CH 3COONa ,平衡逆向移动,c(H +)降低C .向水中加入少量固体硫酸氢钠,c(H +)增大,K w 不变D .将水加热,K w 增大,pH 不变4.下列溶液肯定显酸性的是 ( )A .含H +的溶液B .c(H +)=1×10-7mol·L -1C .pH<7的溶液D .c(OH -)<c(H +)的溶液5.下列电解质溶液的有关叙述正确的是( )A .同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7B .在含有BaSO 4沉淀的溶液中加入Na 2SO 4固体,c(Ba 2+)增大C .常温下,同浓度的Na 2S 与NaHS 溶液相比,Na 2S 溶液的pH 小D .在CH 3COONa 溶液中加入适量CH 3COOH ,可使c(Na +)= c(CH 3COO -)6.下列实验中,对应的现象以及结论均正确的是( ) 选项 实验现象 结论 A 在Na 2S 溶液中滴加新制氯水 产生浅黄色沉证明氯的非金属性比硫的A.A B.B C.C D.D7.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+,要使CH3COOH的电离程度增大,可以采取的措施是()①加少量CH3COONa固体②升高温度③加少量冰醋酸④加水.A.①② B.①③ C.③④ D.②④8.已知K sp (CaC2O4)=4.0⨯10-9,若在c(Ca2+)=0.020mol·L-1的溶液生成CaC2O4沉淀,溶液中的c(C2O42-)最小应为()A.4.0⨯10-9mol·L-1 B.2.0⨯10-7mol·L-1 C.2.0⨯10-9mol·L-1 D.8.0⨯10-11mol·L-19.下列事实能说明醋酸是弱电解质的是()①醋酸与水以任意比例互溶②醋酸溶液能导电③醋酸溶液中存在醋酸分子④0.1 mol·L-1醋酸的pH比盐酸pH大⑤在漂白剂溶液中滴加醋酸能增强漂白效果⑥0.1 mol·L-1醋酸溶液的pH=2 ⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢⑧CH3COOK溶液能使酚酞试液变红色A.②④⑥⑧ B.③④⑥⑦ C.④⑤⑥⑧ D.③⑥⑦⑧10.常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。
人教版化学选修四第三章《水溶液中的离子平衡》测试题(含答案)

第三章《水溶液中的离子平衡》测试题一、单选题1.室温时,已知某溶液中,已电离的水的浓度为10-13mol/L ,则在此溶液中肯定能大量共存的离子是A .++-2-3K Na Cl SO 、、、B .++-2-34K Na NO SO 、、、C .++-2-434K NH NO SO 、、、D .+2+--3K Mg NO Cl 、、、2.某学生的实验报告所列出的下列数据中合理的是( )A .用lmol 的醋酸溶液和1.01mol 的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/molB .用25mL 滴定管做中和滴定时,用去某浓度的碱溶液21.7mLC .室温下,用广泛pH 试纸测得某溶液的pH 为2.3D .通过实验得知在常温常压下,12g 固体C 和32g 气体O 2所具有的总能量一定大于44g 气体CO 2所具有的总能量3.下列电离方程式书写不正确的是( ) A .2H 2O H 3O ++OH - B .H 2SH ++HS -C .NaHSNa ++HS - D .-2-+3233HCO +H OCO +H O4.在醋酸溶液中,CH 3COOH 的电离达到平衡的标志是 A .溶液显电中性 B .溶液中无醋酸分子C .氢离子浓度恒定不变D .溶液中CH 3COOH 和CH 3COO -共存 5.下列判断全部正确的一组是:( )A .AB .BC .CD .D6.对某弱酸稀溶液加热时,下列叙述错误的是( ) A .弱酸的电离程度增大 B .弱酸分子的浓度减小 C .溶液的c(OH -)增大 D .溶液的导电性增强7.下列有关叙述不正确的是①在100℃,101KPa 条件下,液态水气化热为40.69kJ/mol ,则()()22H O g H O l = ∆1H 40.69KJ mol -=+⋅②已知25℃时,3MgCO 的6Ksp 6.8210-=⨯,则在该温度下,含有固体3MgCO 的溶液中,无论()2c Mg+与()23c CO -是否相等,总有()()2263c Mg c CO 6.8210+--⋅=⨯③已知:则反应()()2g 3H g +→()1g H 384KJ mol -=-⋅④常温下,在10.10mol L -⋅的32NH H O ⋅溶液中加入少量4NH Cl 晶体,则32NH H O ⋅电离被抑制,溶液pH 减少 A .①②B .③④C .②④D .①③8.设N A 为阿伏加德罗常数的值,下列说法正确的是 A .14gC 2H 4含有的单键数目为3N AB .99℃时,1LpH=6的纯水中,含有的OH -数目为1×10-8N AC .足量的Na 与1molO 2充分反应,转移的电子数目一定为2N AD .8.0gCu 2S 和CuO 的混合物中含有的铜原子数为0.1N A9.将0.10mol/L 的AlCl 3溶液10mL 与0.10mol/L 的KOH 溶液40mL 充分混和,所得溶液中各种微粒的物质的量浓度关系正确的是 A .c(K+)>c(Cl -)>c(AlO2-)>c(OH -)>c(H+) B .c(K+)>c(Cl -)>c(AlO2-)>c(H+)>c(OH -) C .c(Cl -)>c (K+)>c(OH -)>c(AlO2-)>c(H+) D .c(Cl -)>c((K +)>c(AlO 2-)>c(OH -)>c(H +) 10.下列与滴定实验有关的说法中正确的是( ) A .用碱式滴定管准确量取20.00 mL 的高锰酸钾溶液B .用NaOH 滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高C .用NaOH 滴定盐酸时,只能用酚酞作指示剂D .用KMnO 4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 11.下列说法正确的是 A .4NaHSO 溶液中,()()()()24c Na c H c SO c OH ++--+=+B .室温时水电离出来的()13c H 10mol /L +-=的溶液中K +、Cl -、3NO -、I -一定能大量共存C .等物质的量浓度的下列溶液:①23H CO ②23Na CO ③3NaHCO ④423(NH )CO 中()23c CO -的大小关系为:②>④>③>①D .在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:3224432Al 3SO 3Ba 6OH 3BaSO 2Al(OH)+-+-+++=↓+↓12.在同体积0.3 mol·L -1的H 2SO 4、HCl 、HNO 3、CH 3COOH 溶液中,加入足量的Zn ,下列说法中正确的是A .盐酸和硝酸中放出的氢气相等B .醋酸中放出氢气量最多C .盐酸中放出的氢气量最多D .硫酸中放出氢气量最多13.常常常常常常常常常常常常常常常常常常A .常常常常常常常常常常常常NaX常常常HX常常常常常常pH常常常常常常常常c(Na +)常c(HX)常c(X -)常c(H +)常c(OH -)B .1L0.1mol•L -1CuSO 4·(NH 4)2SO 4•6H 2O常常常常常c(SO 42-)常c(NH 4+)常c(Cu 2+)常c(H +)常c(O H -)C .0.1mol•L -1NaHCO 3常常常常c(Na +)+c(H +)+c常H 2CO 3常≠c(HCO 3-)+c(CO 32-)+c(OH -)D .常常常常常常常常常c 1常c 2常常常常常常常常常常pH常常常a常a+1常常c 1常10c 2 14.下列说法中不正确的有( )①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂; ②光照氯水有气泡逸出,该气体是Cl 2; ③用米汤直接检验食用盐中是否含有碘元素; ④pH 在5.6~7.0之间的降水通常称为酸雨;⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化; ⑥氯气易液化,液氯可以保存在钢瓶中; ⑦常温下浓硫酸可以用铝制容器盛放;⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤; ⑨蒸干AlCl 3溶液可得纯净的无水氯化铝;⑩滴入酚酞溶液确定纯碱中有无烧碱;A.8个 B.7个 C.6个 D.5个15.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。
第三章水溶液中的离子平衡测试题及答案

第三章水溶液中の離子平衡測試題一、選擇題1.將純水加熱至較高溫度,下列敘述正確の是()A.水の離子積變大、pH變小、呈酸性 B.水の離了積不變、pH不變、呈中性C.水の離子積變小、pH變大、呈鹼性 D.水の離子積變大、pH變小、呈中性2.下列有關“電離平衡”の敘述中正確の是()A.電解質在溶液裏達到電離平衡時,分子の濃度和離子の濃度相等B.電離平衡時,由於分子和離子の濃度不斷發生變化,所以說電離平衡是動態平衡C.電離平衡是相對の、暫時の,外界條件改變時,平衡就會發生移動D.電解質達到電離平衡後,各種離子の濃度相等3.下列關係一定正確の是()A.當溶液中c(H+)>10-7 mol★L-1時,其pH<7,溶液呈現酸性B.當溶液中c(H+)>10-7 mol★L-1時,其pH>7,溶液呈現鹼性C.當溶液中c(H+)=c(OH-)>10-7 mol★L-1時,其pH<7,溶液呈現中性D.當溶液中c(H+)=c(OH-)>10-7 mol★L-1時,其pH<7,溶液呈現酸性4.從植物花朵中提取到一種色素,它實際上是一種有機弱酸,可用HR表示,HR在鹽酸溶液中呈現紅色,HR在NaOH溶液中呈現藍色,將HR加入濃硝酸中呈現紅色,微熱後溶液の紅色褪去,根據以上現象,可推測()A.HR應為紅色 B.HR應為藍色 C.R-應為無色 D.R- 應為紅色5.在稀氨水溶液中存在如下平衡體系:NH3·H2O NH4++OH-,當增大溶液のpH時,c(NH4+)會()A.可能增大也可能減小 B.增大 C.減小 D.無變化6.將pH=1の鹽酸平均分為2份,1份加適量水,另一份加入與該鹽酸物質の量濃度相同の適量NaOH溶液後,pH都升高1,則加入の水與NaOH溶液の體積比為()A.9 B.10 C.11 D.127.有一種含氨和氯化銨物質の量相等の混合溶液,其pH為9.3,下列說法中錯誤の是()A.氨水の電離作用大於氯化銨の水解作用 B.氯化銨の水解作用大於氨水の電離作用C.氨水の存在抑制了氯化銨の水解 D.氯化銨の存在抑制了氨水の電離8.mol∙L-1醋酸溶液加水稀釋,下列說法正確の是()A.溶液中c(H+)和c(OH-)都減小 B.溶液中c(H+)增大C.醋酸電離平衡向左移動 D.溶液のpH增大9.室溫下,某溶液中由水電離出のc(OH-)=10-5mol·L-1,則其溶質可能是()A.CH3COOH B.H2SO4C.NaOH D.Na2CO310.pH=3の醋酸溶液加水沖稀到原溶液體積の3倍,則稀釋後のpH為()A.3.2 B.3.5 C.3.7 D.411.mol∙L-1の氨水中滴入酚酞試液時,溶液將呈現粉紅色。
课时作业2:第三章 水溶液中的离子平衡专项训练

水溶液中的离子平衡专项训练题组1弱电解质的电离平衡1.室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是() A.溶液中导电粒子的数目减少B.溶液中c(CH3COO-)c(CH3COOH)·c(OH-)不变C.醋酸的电离程度增大,c(H+)亦增大D.再加入10 mL pH=11的NaOH溶液,混合液pH=72.已知氢氟酸在水溶液中建立如下电离平衡:HF H++F-,若只改变一个条件,一定可以使c(HF)/c(H+)减小的是()A.通氯化氢气体B.加入少量氟化钾固体C.加入少量氢氧化钠固体D.通入少量氟化氢气体3.常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是() A.将溶液稀释到原体积的10倍B.加入适量的醋酸钠固体C.加入等体积0.2 mol·L-1盐酸D.提高溶液的温度4.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
下列有关说法正确的是()A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1B.b点:c(NH+4)+c(NH3·H2O)=c(Cl-)C.c点:c(Cl-)=c(NH+4)D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热题组2溶液的酸碱性与pH的计算5.下列说法中正确的是()A.某溶液中c(H+)=c(OH-)=10-8 mol·L-1,该溶液呈中性B.溶液中若c(H+)>10-7 mol·L-1,则c(H+)>c(OH-),溶液显酸性C.c(H+)越大,则pH越大,溶液的酸性越强D.pH为0的溶液,其中只有H+,无OH-6.常温下,将0.02 mol·L-1的Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL 混合,若忽略溶液体积变化,则混合后的溶液()A.pH=12B.pH=2C.由水电离产生的c(H+)=1.0×10-2 mol·L-1D.溶质的物质的量浓度为0.02 mol·L-17.在常温下,某溶液中由水电离出的c(H+)=1× 10-11 mol·L-1,下列说法中正确的是() A.该溶液肯定显碱性B.该溶液肯定显酸性C.该溶液的pH可能是11,也可能是3D.该溶液的pH肯定不是11题组3盐类水解及其应用8.关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是()A.c(NH+4):③>①B.水电离出的c(H+):②>①C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)D.①和③等体积混合后的溶液:c(NH+4)>c(Cl-)>c(OH-)>c(H+)9.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是()A.若pH>7,则一定是c1V1=c2V2B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.当pH=7时,若V1=V2,则一定是c2>c1D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)10.下列溶液中微粒的物质的量浓度关系正确的是()A.浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)B.等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO2-3)<c(HCO-3)C.在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)D.Na2CO3溶液中:2c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)题组4难溶电解质的溶解平衡11.含有较多Ca2+、Mg2+和HCO-3的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水。
高中化学新人教选修4 第三章 水溶液中的离子平衡 综合练习

第三章 水溶液中的离子平衡 综合练习一、选择题(每小题2分,共64分)1、下列关于强、弱电解质的叙述中正确的是( ) A 、强电解质都是离子化合物,弱电解质都是共价化合物B 、强电解质都是可溶性化合物,弱电解质都是难溶性化合物C 、强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子D 、强电解质的导电能力强,弱电解质的导电能力弱 2、下列离子方程式中,正确的是( )A 、CH 3COOH = CH 3COO - + H +B 、NaOH = Na + + OH -C 、KClO 3K + + ClO 3-D 、BaSO 4 = Ba 2+ + S 2- +4O 2- 3、氨水有下列平衡:NH3·H 2O NH 4+ + OH - 当其它条件不变时,改变下列条件,平衡向左移动,且c (NH 4+)增大的是( )A 、加NaOHB 、加盐酸C 、加NH 4ClD 、加同浓度氨水4、水是一种极弱电解质,在室温下平均每n 个水分子中只有一个水分子发生电离,则n 值为( )A 、1×10-14B 、55.6×107C 、107D 、55.65、在100℃,100 mL 蒸馏水中c (OH -) = 1×10-6 mol ·L -1,当改变下列条件之一时,c (OH -)仍然等于1×10-6 mol ·L -1的是( )A 、温度降低到25℃B 、加入10-6 mol NaOH 固体,保持100℃C 、加入10-6 mol NaCl 固体。
温度降低到25℃D 、蒸发掉50 mL 水,保持100℃6、在0.01 mol ·L -1的H 2SO 4溶液中由水电离出的c (OH -)是( ) A 、5×10-13 mol ·L -1 B 、0.01 mol ·L -1 C 、1×10-7 mol ·L -1 D 、1×10-2mol ·L -17、在盐类的水解过程中,下列叙述正确的是( ) A 、盐的电离平衡被破坏 B 、水的电离平衡被破坏 C 、没有发生中和反应 D 、溶液的pH 一定变大8、物质的量浓度相同、体积也相同的一元酸和一元碱相互中和时,溶液( ) A 、显酸性 B 、显碱性 C 、显中性 D 、酸碱性无法确定9、为了配置CH 3COO -与Na +离子物质的量浓度值比为1:1的溶液,可向溶液中加入( )A 、适量的盐酸B 、适量的NaOH 固体C 、适量的KOH 固体D 、适量的NaCl 固体10、下列反应中,属于水解反应且使溶液显酸性的是( ) A 、NH4+ + H 2O NH 3·H 2O + H + B 、HCO 3- + H 2O CO 32- + H 3O +C 、S 2- + H2O HS - + OH - D 、NH 3 +H 2O NH 4+ +OH -11、实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )A 、提高硫酸铁的溶解度B 、防止硫酸铁分解C 、降低溶液的pHD 、抑制硫酸铁水解12、实验室有下列试剂:①NaOH 溶液 ②水玻璃 ③Na 2S 溶液 ④NH 4Cl 溶液 ⑤浓H 2SO 4,其中必须用带橡胶塞的试剂瓶保存的是( )A 、①④⑤B 、①②③C 、①②④D 、②④⑤13、将0.1mol 下列物质置于1 L 水中充分搅拌后,溶液中阴离子数最多的是( )A 、KClB 、Mg(OH)2C 、Na 2CO 3D 、MgSO 414、物质的量浓度相同的下列溶液中,含微粒种类最多的是( ) A 、CaCl 2 B 、CH 3COONa C 、NH 3 D 、K 2S15、为了配置NH 4+的浓度与Cl -的浓度比为1 :1的溶液,可在NH 4Cl 溶液中加入( )① 适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOHA 、①②B 、③C 、③④D 、④16、25℃时,在浓度为1 mol ·L -1的(NH 4)2SO 4、(NH 4)2CO 3、(NH 4)2Fe(SO 4)2的溶液中,测得其c (NH 4+)分别为a 、b 、c (单位为mol/L )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章水溶液中的离子平衡综合练习一、选择题(本题包括18个小题,每小题3分,共54分)1.水是最宝贵的资源之一。
下列表述正确的是()A.4 ℃时,纯水的pH=7B.温度升高,纯水中的c(H+)增大,c(OH-)减小C.水的电离程度很小,纯水中主要存在形态是水分子D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小解:25℃时纯水的pH=7,A错;升温,水的电离程度增加,c(OH -)和c(H+)均增大,B错;水是弱电解质,电离的程度很小,纯水中主要存在形态是水分子,C对;水的离子积与温度有关,加入酸或碱均能抑制水的电离,但水的离子积不变,D错。
答案:C 2.下列物质的水溶液中只存在一种分子的是()A.NaF B.NaHSC.HNO3D.HClO答案:C3.氨水中所含有的分子和离子有()①NH+4②H2O③NH3④NH3·H2O⑤H+⑥OH-A.①②③B.②③④⑤C.②③④⑤⑥ D.①②③④⑤⑥解析:NH3溶于水大部分与H2O反应生成NH3·H2O。
NH3·H2O少部分发生电离,NH3·H2+4+OH-。
溶液中还存在H2O的电离平衡:H2++OH-。
故存在的粒子有NH3、H2O、NH3·H2O、NH+4、OH-、H+。
答案:D4.下列溶液一定呈中性的是()A.pH=7的溶液B.c(H+)=c(OH-)=10-6mol/L的溶液C.使酚酞试液呈无色的溶液D.由强酸与强碱等物质的量反应得到的溶液解析:25 ℃时pH=7的溶液才是中性,A错;酚酞的变色范围为8.2~10.0,酚酞是无色的溶液pH<8.2,不一定显中性,C错。
H2SO4与NaOH、HCl与Ba(OH)2等物质的量反应后所得溶液均不显中性。
答案:B5.(2013·福州市高三质检)常温下下列各组离子在指定溶液中能大量共存的是()A.pH=1的溶液中:Fe2+、NO-3、SO2-4、Na+B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO-3、K+C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO2-4、SCN-解析:A中pH=1,说明是酸性溶液,H+、Fe2+、NO-3会发生氧化还原反应,A错误;B项,符合条件的溶液可能是强酸性溶液也可能是强碱性溶液,HCO-3既能与H+反应也能与OH-反应,B 错误;c(H+)/c(OH-)=1×1012,c(H+)·c(OH-)=1×10-14,则c(H+)=1×10-1mol/L,c(OH-)=1×10-13mol/L离子可以大量共存,C正确;D中发生反应Fe3++3SCN-===Fe(SCN)3不能大量共存,D错误。
答案:C 6.(2013·高考命题专家原创题)下列关于某温度下一定浓度氨水43·.c(NH+4)+(H+解析:溶液在任何状态下均为电中性,43·H2c3·2B项正确;NH 抑制了水的电离,项错误;根据溶液中的电荷守恒可知,=c(OH-)D项错误。
1 / 41∶2的是( )A .0.1 mol/L 与0.2 mol/L 醋酸溶液,c (H +)之比B .0.1 mol/L Na 2CO 3溶液,c (CO 2-3)与c (Na +)之比C .pH =10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比D .pH =3的硫酸与醋酸溶液,c (SO 2-4)与c (CH 3COO -)之比解析:本题考查弱电解质的电离及盐类水解的知识,考查考生对基本原理的运用能力。
难度中等。
A 项,弱电解质浓度越大其电离程度越小,则其c (H +)之比大于1∶2;B 项,由于CO 2-3部分发生水解,二者浓度之比小于1∶2;C 项,Ba(OH)2为强电解质,由于氨水为弱电解质,pH =10的氨水,其物质的量浓度大于1×10-4 mol/L ,二者的物质的量浓度之比小于1∶2;D 项,硫酸溶液中c (SO 2-4)=c (H +)/2=5×10-4 mol/L 醋酸溶液中c (CH 3COO -)=c (H +)=1×10-3 mol/L 。
答案:D10.硼酸(H 3BO 3)溶液中存在如下反应:H 3BO 3(aq)+H 2O(l) [B(OH)4]-(aq)+H +(aq)。
下列说法正确的是( )A. B .将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 C .等物质的量浓度的碳酸溶液和硼酸溶液比较pH :前者>后者 D .等物质的量浓度的碳酸溶液和醋酸溶液比较pH :前者>后者 解析:由电离常数可知酸性:CH 3COOH>H 2CO 3>H 3BO 3>HCO -3。
A 项中应生成HCO -3;B 项中CH 3COOH 少量,也只生成HCO -3;C 项中碳酸溶液pH 小;D 项,CH 3COOH 电离程度大,醋酸溶液pH 较小。
故选D 。
答案:D11.(2013·浙江宁波二模)下列说法正确的是( ) A .已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH 3COOH,CH 3COO -+H +,加少量烧碱溶液可使溶液中c (H+)/c (CH 3COOH)值增大。
B .25℃时,向水中加入少量固体CH 3COONa ,水的电离平衡:H 2O,H ++OH -逆向移动,c (H +)降低 C .取c (H +)=0.01 mol·L-1的盐酸和醋酸各100 mL ,分别稀释2倍后,再分别加入0.03 g 锌粉,在相同条件下充分反应,醋酸与锌反应的速率大D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液中:c (Na+)<c (NO -3)解析:A 选项可利用平衡常数表达式的变形式来推断,c (H+)/c (CH 3COOH)=K /c (CH 3COO -),加入少量氢氧化钠溶液之后,c (CH 3COO -)增大,但平衡常数K 不变,故c (H +)/c (CH 3COOH)值减小,A 选项错误。
加入CH 3COONa 这种强碱弱酸盐,将促进水的电离,水的电离平衡正向移动,故B 选项错误。
硝酸钠溶液中Na +、NO -3在滴加盐酸过程中始终以离子状态存在,不发生2.向水中加入氨水,平衡逆向移动,c (OH -)降低3COOH 错误;加入硫酸氢钠,硫酸氢钠电离出温度不变,K W3 / 4D .与等体积0.01 mol·L -1氯化铵溶液混合后所得溶液中:c (Na +)=c (NH +4)解析:本题考查水溶液中离子平衡。
难度中等。
根据电荷守恒可得:c (OH -)=c (Na +)+c (H +),A 错;溶液中由水电离出的c (H +)=c (OH -)=1.0×10-12mol·L -1,B 正确;与等体积pH =2的醋酸混合后由于醋酸过量,所得溶液显酸性,C 错;与等体积0.01 mol·L-1氯化铵溶液混合后,NaOH 与氯化铵恰好安全反应,所得溶液中一水合氨发生电离,显碱性,D 错。
答:B 16.(2013·高考命题专家原创题)常温下,将1 mL pH =2的一元酸HA 溶液加水稀释至100 mL ,其pH 与溶液体积(V )的关系如下图所示,下列说法正确的是( )A .加热HA 溶液时,溶液酸性增强B .1 mol·L -1 HA 溶液与1 mol·L -1 NaOH溶液等体积混合,所得溶液中c (Na +)>c (A -),则2<a <4 C .某浓度的NaA 溶液的pH =d ,则其中由水电离出的c (OH -)=1014-d mol·L -1D .HA 溶液与NaOH 溶液恰好完全反应时,c (Na +)>c (A -)>c (OH-)>c (H +)解析:将1 mL pH =2的一元酸HA 溶液加水稀释至100 mL ,若a 的取值范围为2<a <4,则HA 是弱酸,加热促进弱酸的电离,酸性增强,若a =4,则HA 是强酸,加热,溶液的酸性不变,A 项错误;1 mol·L -1HA 溶液与1 mol·L -1NaOH 溶液等体积混合,所得NaA 溶液中c (Na +)>c (A -),则说明A -水解,即HA 为弱酸,故2<a <4,B 项正确;溶液中的OH -全部来自于水的电离,由溶液pH =d 即溶液中c (H +)=10-dmol·L -1,则c (OH -)=10-1410-d =10d-14mol·L -1,C 项错误;若HA 为强酸,则NaA 溶液中c (Na +)=c (A -)>c (OH -)=c (H +),D 项错误。
答案:B17.(2013·浙江宁波十校联)向20 mL 0.5 mol/L 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。
下列关于混合溶液的相关说法错误的是( )A .醋酸的电离常数:b 点>a 点B .由水电离出的c (OH -):b 点>c 点C .从a 点到b 点,混合溶液中可能存在:c (CH 3COO -)=c (Na +) D .b 点到c 点,混合溶液中一直存在:c (Na +)>c (CH 3COO -)>c (OH-)>c (H +)解析:A 选项,电离常数作为化学常数的一种,只受温度影响,而且电离过程是吸热的,故温度升高,电离常数增大,A 正确。
由题意可知b 点时,恰好生成CH 3COONa 溶液,则c 点时NaOH 溶液过量,CH 3COONa 这种强碱弱酸盐能促进水的电离,过量的NaOH 会抑制水的电离,即b 点水的电离程度大于c 点,故B 正确。
C 选项,在a 点时,溶液为CH 3COOH 和CH 3COONa 的混合液,溶液显酸性,b 点为CH 3COONa 溶液,溶液显碱性,因此中间一定经历中性的点,在中性点根据电荷守恒c (Na +)+c (H +)=c (CH 3COO -)+c (OH -),且溶液呈中性c (H +)=c (OH -),可分析出C 选项正确。
D 选项可利用极端法思考,根据c 点加入物质的量的关系,可判断出n (CH 3COONa)=n (NaOH)。
若假设CH 3COONa 不水解和水不电离,则c (Na +)>c (CH 3COO -)=c (OH-)>c (H +),但由于CH 3COO -水解和水电离,在c 点时溶液中离子浓度应该为c (Na +)>c (OH -)>c (CH 3COO -)>c (H +),故D 错。
