蛋白质与核酸的区别与联系60588
蛋白质和核酸的异同点

蛋白质和核酸的异同点
蛋白质和核酸是生命体中最基本的分子,它们在细胞中扮演着重要的
角色。
虽然它们都是由氨基酸组成的,但它们在结构和功能上有很大
的不同。
首先,蛋白质和核酸的结构不同。
蛋白质是由氨基酸通过肽键连接而
成的线性聚合物,而核酸则是由核苷酸通过磷酸二酯键连接而成的线
性聚合物。
蛋白质的氨基酸有20种,而核酸的核苷酸只有4种。
此外,蛋白质的结构可以分为四级结构,即原生、二级、三级和四级结构,
而核酸只有原生和二级结构。
其次,蛋白质和核酸的功能也不同。
蛋白质是细胞中最重要的功能分
子之一,它们可以作为酶、激素、抗体、运输分子等。
蛋白质的功能
与它们的结构密切相关,不同的结构决定了不同的功能。
而核酸则主
要负责存储和传递遗传信息,包括DNA和RNA。
DNA是细胞中的遗传物质,它存储了生物的遗传信息,而RNA则负责将这些信息转录成蛋白质。
最后,蛋白质和核酸的合成方式也不同。
蛋白质的合成是通过翻译过
程完成的,即将mRNA上的信息转化为氨基酸序列。
而核酸的合成是通过复制过程完成的,即将DNA上的信息复制到新的DNA分子中。
综上所述,蛋白质和核酸在结构、功能和合成方式上都有很大的不同。
虽然它们都是由氨基酸组成的,但它们在生命体中扮演着不同的角色,是生命体中不可或缺的分子。
蛋白质与核酸的异同点

蛋白质与核酸的异同点
蛋白质和核酸是生命体内两种重要的生物大分子。
它们在结构、
功能、组成和作用等方面各有不同。
1.结构异同点:蛋白质是由氨基酸通过肽键连接而成的长链,三
级结构多种多样;核酸则是由核苷酸经过磷酸二酯键连接而成的长链,具有双螺旋结构。
2.功能异同点:蛋白质是细胞内的重要功能分子,具有运输物质、催化反应、结构支持等多种功能;核酸则是存储和传递遗传信息的分子,主要负责生命遗传信息的传递和转录。
3.组成异同点:蛋白质的氨基酸种类较少,共有20种;核酸则
包括腺嘌呤、鸟嘌呤、胸腺嘧啶、尿嘧啶等四种碱基。
总之,蛋白质和核酸在生命体内起着不同的作用,其结构、功能
和组成等方面也有很多不同之处。
蛋白质跟核酸

基因表达的调控
核酸通过与蛋白质的相互作用, 调控基因的表达,影响细胞功能 和发育。
细胞信号转导
某些核酸可以作为信号分子,参 与细胞信号转导过程,影响细胞 生长、分化和凋亡。
03
蛋白质与核酸的比较
组成上的比较
01
蛋白质是由氨基酸组成的生物大 分子,具有复杂的空间结构和功 能,是生命活动中不可或缺的物 质。
核酸分子通常以单链形式存在, 但在特定情况下可以形成双链结
构。
双螺旋结构
DNA通常以双螺旋结构存在,这 种结构由两条反向平行的链和碱基 之间的氢键形成。
三螺旋结构
某些情况下,DNA可以形成三螺旋 结构,这种结构由三条链和碱基之 间的氢键形成。
核酸的功能
遗传信息的载体
核酸是遗传信息的载体,通过 DNA的复制、转录和翻译过程, 将遗传信息传递给下一代或合成 蛋白质。
蛋白质跟核酸
• 蛋白质 • 核酸 • 蛋白质与核酸的比较 • 蛋白质与核酸的相互关系 • 蛋白质的组成
01
02
03
氨基酸
蛋白质是由氨基酸组成的 大分子化合物,常见的有 20种氨基酸,通过肽键连 接成肽链。
肽键
连接氨基酸的化学键,具 有极性,是蛋白质一级结 构的主要化学键。
生物检测
蛋白质和核酸具有高度的特异性和灵敏度,可以用于生物 检测中的标记和识别,为食品安全、环境监测等领域提供 技术支持。
THANKS
感谢观看
04
蛋白质与核酸的相互关系
蛋白质对核酸的影响
蛋白质是核酸的合成和复制过程中的 重要调节因子,可以影响核酸的转录 和复制过程,从而影响基因的表达。
蛋白质可以与核酸结合,形成复合物 ,对核酸的结构和稳定性产生影响, 从而影响核酸的功能。
蛋白质与核酸的区别与联系

鉴定试剂
二苯胺(呈蓝色)
甲基绿(呈绿色)
吡罗红(呈红色)
双缩脲试剂(呈紫色)
水解产物
脱氧核苷酸
核糖核苷酸
氨基酸
彻底水解产物
磷酸、脱氧核糖、含氮碱基
磷酸、核糖、含氮碱基
氨基酸
氧化产物
CO2、H2O、含氮代谢产物
CO2、H2O、含氮代谢产物
主要在细胞核中合成
均在核糖体合成
反应名称
聚合(DNA复制、逆转录)
聚合(转录、RNA复制)
缩合反应(翻译)
可能参与的酶
DNA解旋酶、DNA聚合酶、DNA连接酶、逆转录酶等
DNA解旋酶、RNA聚合酶
酶ቤተ መጻሕፍቲ ባይዱ
种类
核DNA、质DNA
mRNA、tRNA、rRNA
结构蛋白、功能蛋白等
多样性
DNA分子上脱氧核苷酸的数量、排列顺序不同
RNA分子上核糖核苷酸的数量、排列顺序不同
氨基酸的种类、数量、排列顺序及肽链的空间结构不同
主要功能
细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用
蛋白质是生命活动的主要承担者
生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物质;mRNA是蛋白质合成的模板,tRNA是氨基酸的转运工具,rRNA是核糖体的组成成分。少量RNA具有催化功能。
胸腺嘧啶(T)
尿嘧啶(U)
单
体
名称
脱氧核苷酸
核糖核苷酸
氨基酸
种类
4种
4种
20种
结构简式
蛋白质和核酸在化学组成上的异同

蛋白质和核酸在化学组成上的异同
蛋白质和核酸是生物体内两种重要的大分子,它们在生物体内扮演着不同的角色。
蛋白质主要参与构成细胞和组织,是生命体内最重要的组成成分之一;而核酸则是DNA和RNA的主要组成部分,是生物遗传信息的媒介。
虽然蛋白质和核酸在功能和作用上有很大的区别,但它们在化学组成上也存在一些异同。
首先,它们都是由氨基酸构成的。
蛋白质是由20种不同的氨基酸组成的,而核酸则是由4种核苷酸组成的。
其次,它们的结构也有所不同。
蛋白质是由氨基酸通过连接成链状结构而形成的,而核酸则是由核苷酸通过磷酸二酯键连接成链状结构而形成的。
此外,蛋白质和核酸在化学性质上也存在一些差异。
蛋白质具有一定的酸碱性质,可以通过酸碱反应发生变化,而核酸则不具备酸碱性质。
另外,由于核酸中存在磷酸基团,因此它们在电性质上与蛋白质也有所不同。
总之,虽然蛋白质和核酸在功能和作用上有很大的不同,但它们在化学组成上也有着一些共同点和不同点,这些差异直接影响着它们的性质和功能。
- 1 -。
蛋白质与核酸的区别与联系

蛋白质与核酸的区别与联系比较项目核酸蛋白质DNA RNA组成元素基本元素C、H、O、N、P C、H、O、N、P C、H、O、N 特征元素P P S(一般)相对分子量几十万~几百万几千~几百万组成成分磷酸磷酸磷酸氨基酸五碳糖脱氧核糖核糖含氮碱基共有腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)特有胸腺嘧啶(T)尿嘧啶(U)单体名称脱氧核苷酸核糖核苷酸氨基酸种类4种4种20种结构简式分子结构一般是反向平行的双螺旋结构一般为单链结构氨基酸→多肽链→空间结构→蛋白质分子分布主要在细胞核中,线粒体、叶绿体、质粒中也有分布主要在细胞质中,叶绿体、线粒体、核糖体中也有分布广泛分布在细胞中合成主要场所主要在细胞核中合成主要在细胞核中合成均在核糖体合成反应名称聚合(DNA复制、逆转录)聚合(转录、RNA复制)缩合反应(翻译)可能参与的酶DNA解旋酶、DNA聚合酶、DNA连接酶、逆转录酶等DNA解旋酶、RNA聚酶种类核DNA、质DNA mRNA、tRNA、rRNA结构蛋白、功能蛋白等多样性DNA分子上脱氧核苷酸的数量、排列顺序不同RNA分子上核糖核苷酸的数量、排列顺序不同氨基酸的种类、数量、排列顺序及肽链的空间结构不同主要功能细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用蛋白质是生命活动的主要承担者生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物质;mRNA是蛋白质合成的模板,tRNA是氨基酸的转运工具,rRNA是核糖体的组成成组成生物体的重要结构物质,催化功能、免疫功能、调节功能、运输功能等。
分。
少量RNA具有催化功能。
鉴定试剂二苯胺(呈蓝色)甲基绿(呈绿色)吡罗红(呈红色)双缩脲试剂(呈紫色)水解产物脱氧核苷酸核糖核苷酸氨基酸彻底水解产物磷酸、脱氧核糖、含氮碱基磷酸、核糖、含氮碱基氨基酸氧化产物CO2、H2O、含氮代谢产物CO2、H2O、含氮代谢产物CO2、H2O、尿素特异性均具有特异性mRNA具有特异性,tRNA、rRNA没有特异性均具有特异性联三者之间的关系有关计算系DNA多样性、蛋白质多样性、生物多样性的关系。
蛋白质与核酸的区别与联系
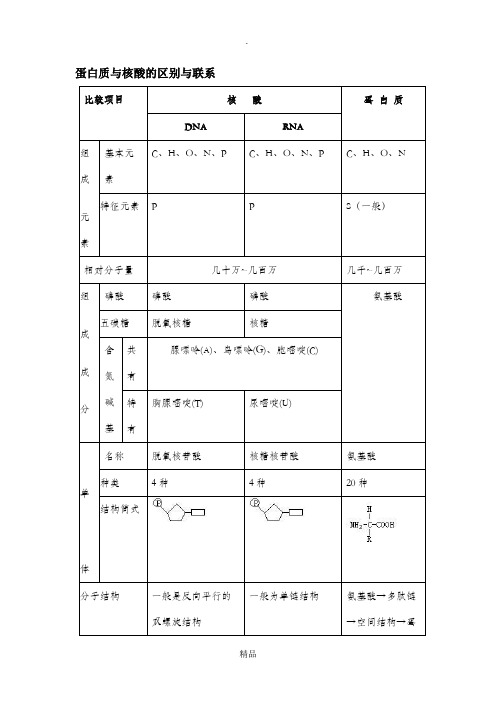
蛋白质与核酸的区别与联系
比较项目核酸蛋白质
DNA RNA
组成元素
基本元
素
C、H、O、N、P C、H、O、N、P C、H、O、N 特征元素P P S(一般)
相对分子量几十万~几百万几千~几百万
组成成分
磷酸磷酸磷酸氨基酸五碳糖脱氧核糖核糖
含
氮
碱
基
共
有
腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)
特
有
胸腺嘧啶(T)尿嘧啶(U)
单体
名称脱氧核苷酸核糖核苷酸氨基酸种类4种4种20种结构简式
分子结构一般是反向平行的
双螺旋结构一般为单链结构氨基酸→多肽链
→空间结构→蛋
系有关计算
DNA多样性、蛋白质多样性、生物多样性的关系
如有侵权请联系告知删除,感谢你们的配合!。
蛋白质和核酸的异同点

蛋白质和核酸的异同点
蛋白质和核酸是生命体中两种重要的大分子。
它们有许多相似之处,也有很多不同之处。
相似点:
1. 组成:蛋白质和核酸都是由小分子单元(氨基酸和核苷酸)组成的。
2. 功能:蛋白质和核酸都扮演着生物体内重要的功能角色。
蛋白质可以起到酶、结构蛋白、激素等多种生物学作用;核酸则是负责存储和传递遗传信息。
3. 二级结构:蛋白质和核酸都有二级结构,即由氢键、范德华力等相互作用力形成的空间结构。
蛋白质的二级结构有α-螺旋和β-折叠等;核酸的二级结构有双螺旋结构。
不同点:
1. 化学组成:蛋白质的单元是氨基酸,而核酸的单元是核苷酸。
氨基酸由氨基、羧基和侧链组成,而核苷酸由磷酸、五碳糖和碱基组成。
2. 功能:蛋白质和核酸的功能不同。
蛋白质通常参与代谢、调节、传递信号等细胞活动,核酸则通常用于存储和传递遗传信息。
3. 三级结构:蛋白质和核酸的三级结构也不同。
蛋白质的三级结构是由各种化学键和相互作用力组成的,而核酸的三级结构则是由双螺旋结构和其他形态如发夹环和三维结构等组成的。
总之,蛋白质和核酸虽然都是由小分子单元组成的大分子,但它
们有很多不同的特点和功能,是生命体中不可或缺的重要分子。
蛋白质与核酸

研究意义
揭示生命本质
蛋白质和核酸是构成生物体的基 本物质,研究它们有助于深入了 解生命的本质和生物体的代谢过
程。
疾病诊断和治疗
蛋白质和核酸的异常表达与许多 疾病的发生和发展密切相关。通 过研究,可以发现新的疾病标志 物和药物靶点,有助于疾病的早
期诊断和治疗。
生物技术应用
蛋白质和核酸的研究对于生物技 术的进步具有重要意义,如基因 工程、蛋白质工程和酶工程等领
学键。
一级结构
03
指蛋白质中氨基酸的排列顺序,决定蛋白质的生物活性和功能。
蛋白质的构
二级结构
肽链局部的折叠和转角,主要由氢键维持。
三级结构
整条肽链的折叠和盘绕,形成特定的空间构象,主要由疏水键和 盐键维持。
四级结构
多个蛋白质分子聚集在一起形成的复合物,决定蛋白质的生物学 功能。
蛋白质的功能
结构蛋白
03 蛋白质与核酸的比较
组成上的比较
总结词
蛋白质和核酸在组成上存在显著差异。
详细描述
蛋白质是由氨基酸组成的,而核酸是由核苷酸组成的。氨基酸的种类有20种左 右,而核苷酸有四种,分别是腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶。
结构上的比较
总结词
蛋白质和核酸在结构上也有所不同。
详细描述
蛋白质的结构可以分为一级、二级、三级和四级结构。一级结构是指蛋白质中氨 基酸的排列顺序,决定了蛋白质的生物活性和功能。而核酸的一级结构是指核苷 酸的排列顺序,决定了核酸的信息储存和表达功能。
域的应用。
应用领域
医学领域
农业领域
蛋白质和核酸的研究在医学领域的应用广 泛,如诊断试剂、药物研发和个性化医疗 等方面。
蛋白质和核酸的研究有助于培育抗逆、抗 病和高产的农作物新品种,提高农业生产 效益。
蛋白质与核酸的区别与联系

蛋白质与核酸的区别与联系比较项目核酸蛋白质DNA RNA组成元素基本元素C、H、O、N、P C、H、O、N、P C、H、O、N 特征元素P P S(一般)相对分子量几十万~几百万几千~几百万组成成分磷酸磷酸磷酸氨基酸五碳糖脱氧核糖核糖含氮碱基共有腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)特有胸腺嘧啶(T)尿嘧啶(U)单体名称脱氧核苷酸核糖核苷酸氨基酸种类4种4种20种结构简式分子结构一般是反向平行的双螺旋结构一般为单链结构氨基酸→多肽链→空间结构→蛋白质分子分布主要在细胞核中,线粒体、叶绿体、质粒中也有分布主要在细胞质中,叶绿体、线粒体、核糖体中也有分布广泛分布在细胞中合成主要场所主要在细胞核中合成主要在细胞核中合成均在核糖体合成反应名称聚合(DNA复制、逆转录)聚合(转录、RNA复制)缩合反应(翻译)可能参与的酶DNA解旋酶、DNA聚合酶、DNA连接酶、逆转录酶等DNA解旋酶、RNA聚酶种类核DNA、质DNA mRNA、tRNA、rRNA结构蛋白、功能蛋白等多样性DNA分子上脱氧核苷酸的数量、排列顺序不同RNA分子上核糖核苷酸的数量、排列顺序不同氨基酸的种类、数量、排列顺序及肽链的空间结构不同主要功能细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用蛋白质是生命活动的主要承担者生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物质;mRNA是蛋白质合成的模板,tRNA是氨基酸的转运工具,rRNA是核糖体的组成成组成生物体的重要结构物质,催化功能、免疫功能、调节功能、运输功能等。
分。
少量RNA具有催化功能。
鉴定试剂二苯胺(呈蓝色)甲基绿(呈绿色)吡罗红(呈红色)双缩脲试剂(呈紫色)水解产物脱氧核苷酸核糖核苷酸氨基酸彻底水解产物磷酸、脱氧核糖、含氮碱基磷酸、核糖、含氮碱基氨基酸氧化产物CO2、H2O、含氮代谢产物CO2、H2O、含氮代谢产物CO2、H2O、尿素特异性均具有特异性mRNA具有特异性,tRNA、rRNA没有特异性均具有特异性联三者之间的关系系有关计算DNA多样性、蛋白质多样性、生物多样性的关系(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
核酸与蛋白质互作的生物化学解析

核酸与蛋白质互作的生物化学解析核酸与蛋白质互作是生物学领域中一个重要的研究课题。
核酸是DNA和RNA的总称,是生物体内保存遗传信息的重要分子。
而蛋白质则是构成细胞的主要成分,承担着多种生物学功能。
核酸与蛋白质之间的相互作用对于细胞的生长、分化、代谢等过程起着至关重要的调控作用。
本文将对核酸与蛋白质之间的互作进行生物化学解析。
一、核酸与蛋白质的结构特点核酸的结构主要由磷酸、五碳糖和碱基组成。
DNA的碱基包括腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧唑(C)四种。
RNA 的碱基包括腺嘌呤(A)、鸟嘌呤(G)、尿嘧啶(U)和胞嘧唑(C)四种。
蛋白质是由氨基酸通过肽键连接而成,具有复杂的三维结构。
蛋白质的功能主要取决于其特定的三维构象。
二、核酸与蛋白质的相互作用机制1. DNA与蛋白质的相互作用DNA和蛋白质之间的相互作用主要包括DNA结合蛋白、转录因子等。
DNA结合蛋白主要与DNA发生非特异性或特异性结合,参与DNA的复制、修复和重组等过程。
转录因子则在转录调控中发挥重要作用,通过与DNA特定序列结合,启动或抑制基因的转录。
2. RNA与蛋白质的相互作用RNA与蛋白质之间的相互作用主要包括RNA结合蛋白和RNA酶等。
RNA结合蛋白参与RNA的合成、修饰和稳定等过程,调控基因的表达水平。
RNA酶则参与RNA的降解过程,维持细胞内RNA的稳态。
三、核酸与蛋白质互作在生物学过程中的作用1. 转录调控核酸与蛋白质互作在转录调控中发挥重要作用。
转录因子与DNA特定序列结合,激活或抑制基因的转录,调控基因表达水平。
RNA结合蛋白则参与RNA的合成和修饰过程,影响基因的翻译和表达。
2. 蛋白质合成RNA酶参与RNA的降解过程,维持细胞内RNA的稳态。
蛋白合成依赖于RNA的翻译过程,RNA与核糖体、转运RNA等蛋白质协同作用,完成蛋白合成过程。
结语综上所述,核酸与蛋白质之间的互作在生物学过程中具有重要的生物化学意义。
蛋白质与核酸的区别与联系

蛋白质与核酸的区别与联系比较项目核酸蛋白质DNA RNA组成元素基本元素C、H、O、N、P C、H、O、N、P C、H、O、N 特征元素P P S(一般)相对分子量几十万~几百万几千~几百万组成成分磷酸磷酸磷酸氨基酸五碳糖脱氧核糖核糖含氮碱基共有腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)特有胸腺嘧啶(T) 尿嘧啶(U)单体名称脱氧核苷酸核糖核苷酸氨基酸种类4种4种20种结构简式分子结构一般是反向平行的双螺旋结构一般为单链结构氨基酸→多肽链→空间结构→蛋白质分子分布主要在细胞核中,线粒体、叶绿体、质粒中也有分布主要在细胞质中,叶绿体、线粒体、核糖体中也有分布广泛分布在细胞中合成主要场所主要在细胞核中合成主要在细胞核中合成均在核糖体合成反应名称聚合(DNA复制、逆转录)聚合(转录、RNA复制)缩合反应(翻译)可能参与的酶DNA解旋酶、DNA聚合酶、DNA连接酶、逆转录酶等DNA解旋酶、RNA聚合酶酶种类核DNA、质DNA mRNA、tRNA、rRNA 结构蛋白、功能蛋白等多样性DNA分子上脱氧核苷酸的数量、排列顺序不同RNA分子上核糖核苷酸的数量、排列顺序不同氨基酸的种类、数量、排列顺序及肽链的空间结构不同主要功能细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用蛋白质是生命活动的主要承担者生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物质;mRNA是蛋白质合成的模板,tRNA是氨基酸的转运工具,rRNA是核糖体的组成成分。
少量RNA具有催化功能。
组成生物体的重要结构物质,催化功能、免疫功能、调节功能、运输功能等。
鉴定试剂二苯胺(呈蓝色)甲基绿(呈绿色)吡罗红(呈红色)双缩脲试剂(呈紫色)水解产物脱氧核苷酸核糖核苷酸氨基酸彻底水解产物磷酸、脱氧核糖、含氮碱基磷酸、核糖、含氮碱基氨基酸氧化产物CO2、H2O、含氮代谢产物CO2、H2O、含氮代谢产物CO2、H2O、尿素特异性均具有特异性mRNA具有特异性,tRNA、rRNA没有特异性均具有特异性联系三者之间的关系有关计算DNA多样性、蛋白质多样性、生物多样性的关系。
蛋白质和核酸结构和功能的比较

蛋白质和核酸结构和功能的比较蛋白质和核酸是生命体内两类重要的生物大分子,它们在维持生命活动、传递遗传信息以及调节生物体内功能上扮演着关键角色。
虽然蛋白质和核酸在分子结构和功能上存在许多不同,但它们又存在一些共同之处。
下面将分别从结构和功能的角度比较蛋白质和核酸。
一、结构比较:1.蛋白质的结构:蛋白质是由氨基酸组成的长链多肽,通过肽键连接在一起。
蛋白质的结构包括四个不同层次:一级结构是氨基酸序列的线性顺序;二级结构包括α-螺旋、β-折叠等常见的二级结构元素;三级结构是蛋白质链的三维折叠结构;四级结构是由两个或多个蛋白质相互组合而成的复合体。
2.核酸的结构:核酸是由核苷酸组成的长链聚合物,通过磷酸二酯键连接在一起。
核酸的结构包括两个不同层次:一级结构是核苷酸序列的线性顺序;二级结构是DNA的双螺旋结构和RNA的单链结构。
二、功能比较:1.蛋白质的功能:蛋白质在细胞中的功能非常多样化,包括酶催化、结构支持、运输、免疫机制、代谢调节等。
例如,酶是一类高度特异性的蛋白质,可以参与化学反应的催化;结构蛋白质如胶原蛋白则提供细胞和组织的支持;运输蛋白质如载脂蛋白可在血液中运输脂类;免疫球蛋白可以识别入侵生物体内的病毒和细菌等。
2.核酸的功能:核酸主要参与遗传信息的传递和转录、翻译过程。
DNA持有生物体的遗传信息,可通过自身复制维持和传递;RNA则具有将DNA指导的信息转化为蛋白质的功能。
在转录过程中,DNA会被转录成RNA;在翻译过程中,RNA会被翻译成蛋白质。
三、相互作用:综上所述,蛋白质和核酸在分子结构和功能上存在着很大的差异。
蛋白质在细胞功能中的多样性比核酸更加广泛,而核酸则在传递遗传信息和转化为蛋白质的过程中起到重要的作用。
然而,蛋白质和核酸之间也相互作用、相互依赖,共同参与维持生物体的正常功能。
高一蛋白质核酸知识点归纳

高一蛋白质核酸知识点归纳蛋白质和核酸是生物体中非常重要的有机分子,它们在维持细胞结构和功能中起着至关重要的作用。
在高一生物课程中,我们学习了蛋白质和核酸的基本知识,下面我将对这些知识点进行归纳总结。
1. 蛋白质的结构蛋白质是由氨基酸组成的。
氨基酸是生命的基本单位,共有20种不同的氨基酸。
蛋白质的结构可以分为四个级别:一级结构是通过氨基酸的序列确定的,二级结构是由氢键形成的α-螺旋和β-折叠,三级结构是由多肽链的局部折叠确定的,而四级结构则是由多个多肽链相互作用形成的复合物。
2. 蛋白质的功能蛋白质在生物体内发挥着多种多样的功能。
例如,酶是一类能够加速化学反应速率的蛋白质;抗体是免疫系统中用于识别和抵抗病原体的蛋白质;激素是调节生物体内各种生理过程的信号分子。
此外,蛋白质还参与细胞结构的组成,如肌肉组织中的肌动蛋白和微管蛋白等。
3. DNA和RNA的结构与功能DNA和RNA是两种重要的核酸类分子。
DNA是带有遗传信息的生物大分子,它以双螺旋结构存在于细胞核中。
DNA的单位是核苷酸,包括脱氧核糖和碱基(腺嘌呤、鸟嘌呤、胸腺嘧啶和胞嘧啶)组成。
RNA与DNA结构相似,但脱氧核糖被核糖取代,胞嘧啶被尿嘧啶取代。
RNA具有多种功能,包括信息传递、蛋白质合成和调节基因表达等。
4. DNA的复制和RNA的转录DNA的复制和RNA的转录是生物体中两个重要的遗传过程。
DNA的复制是指在细胞分裂前将DNA分子复制一份,保证下一代细胞获得完整的遗传信息。
DNA复制是由酶类分子在两条DNA 链上进行的,每条DNA链作为模板合成新的DNA链。
而RNA的转录是将DNA上的遗传信息转录成RNA分子,进行信息传递和蛋白质合成的过程。
转录是由RNA聚合酶酶在DNA模板上合成RNA分子。
5. 蛋白质合成蛋白质的合成是细胞中的一个重要过程。
这个过程包括转录和翻译两个步骤。
转录是将DNA上的遗传信息转录成RNA分子,而翻译是将RNA分子翻译成蛋白质。
蛋白质一级结构和核酸一级结构的异同

蛋白质一级结构和核酸一级结构的异同蛋白质和核酸,这两位“生物界明星”,真的是各有千秋啊!蛋白质的一级结构就是那条长长的氨基酸链。
就像是你心爱的手链,每个氨基酸就是一颗珠子,串在一起形成了独一无二的风格。
氨基酸的排列顺序可真重要,像是调配一道美食,少了一个配料,味道就大打折扣了。
每种蛋白质都有它独特的序列,决定了它的功能。
有人可能会问,这个蛋白质和核酸有什么关系呢?好吧,咱们再看看核酸。
核酸的一级结构,哦,真是个奇妙的家伙!它主要有DNA和RNA。
想象一下,DNA就像是一个双螺旋楼梯,而RNA则是单螺旋,像条细长的绳子。
它们的构成单位是核苷酸,每个核苷酸就像是楼梯上的一个台阶。
虽然它们的结构形式各有不同,但在信息传递上却是同舟共济。
DNA储存着遗传信息,而RNA则是把这个信息传递到蛋白质合成的“工厂”。
所以说,它们在生物体内的角色,就像是一场完美的合作演出,缺一不可。
好啦,说到相同点,蛋白质和核酸的一级结构都是由小单位构成的,都是通过化学键连接在一起的。
就像咱们的朋友聚会,每个人都是独立的个体,但合起来却能形成一个欢乐的团队。
无论是氨基酸还是核苷酸,它们的排列顺序都影响着整个结构的功能。
要是顺序搞错了,那可就糟了,蛋白质可能变成“呆滞大叔”,核酸也可能变得“无所作为”。
不同点也是很明显的。
蛋白质的构成单位是氨基酸,而核酸则是核苷酸。
这就像你在厨房里做饭,主料和辅料完全不同。
蛋白质的功能大多是执行的,比如酶的催化、细胞结构的支持等。
而核酸的主要任务则是储存和传递信息,像是公司里的秘书,负责把信息整理得明明白白。
哎,你说,这个角色分配简直就是天生的。
蛋白质的结构还会经过二级、三级和四级的折叠,变得更加复杂。
想象一下,一条简单的链子经过捏合、扭转,最后变成一件精美的艺术品。
而核酸呢,它相对来说就简单多了,基本上就维持着它的长条形状。
虽然它们的一级结构都是“简单”的基础,但二者在功能上却是复杂得让人咋舌。
核酸与蛋白质的相互作用

核酸与蛋白质的相互作用
咱今儿就来唠唠核酸与蛋白质的相互作用,这可真是个奇妙又重要的事儿啊!
你想啊,核酸就好比是一个大导演,它手里有剧本,指挥着蛋白质这个演员该怎么演。
蛋白质呢,就像是个听话的演员,乖乖按照核酸的指示来行动。
核酸里面的基因啊,那可是包含了各种信息,就像菜谱一样,告诉蛋白质该长成啥样,该有啥功能。
蛋白质呢,就得根据这个菜谱,精确地折叠、组装自己,变成有特定形状和功能的家伙。
比如说吧,在咱们身体里,有一种蛋白质叫酶。
酶就像是个小工人,能帮忙加快各种化学反应的速度。
那酶是怎么知道自己该干啥的呢?这就得靠核酸给它的指示啦!核酸告诉酶,你去这儿,干这个活儿,酶就得乖乖听话,跑去发挥作用。
这就好像是一场精彩的舞台剧,核酸是编剧兼导演,蛋白质就是舞台上的演员。
没有核酸这个导演的指挥,蛋白质演员可就不知道该怎么演啦,这场舞台剧也就没法精彩上演。
再想想,要是核酸和蛋白质之间配合不好,那会咋样?那不就乱套啦!就好比导演和演员意见不合,这戏还怎么演得下去?身体里要是这样,那可不得了,各种生理功能都会出问题。
还有啊,核酸和蛋白质的相互作用可不仅仅是这么简单。
它们之间的关系那是相当紧密,互相影响。
蛋白质也不是完全被动的,有时候它也能反过来影响核酸呢!就像是演员也能给导演提提意见,让戏变得更好。
咱们身体里的这么多复杂的过程,不都是靠核酸和蛋白质的完美配合嘛。
它们就像一对默契的搭档,一起为了我们的健康和生命活动努力着。
所以说啊,核酸和蛋白质的相互作用可真是太重要啦!我们得好好爱护我们的身体,让它们能一直好好地合作下去,这样我们才能健康快乐地生活呀,难道不是吗?。
蛋白质与核酸的区别与联系
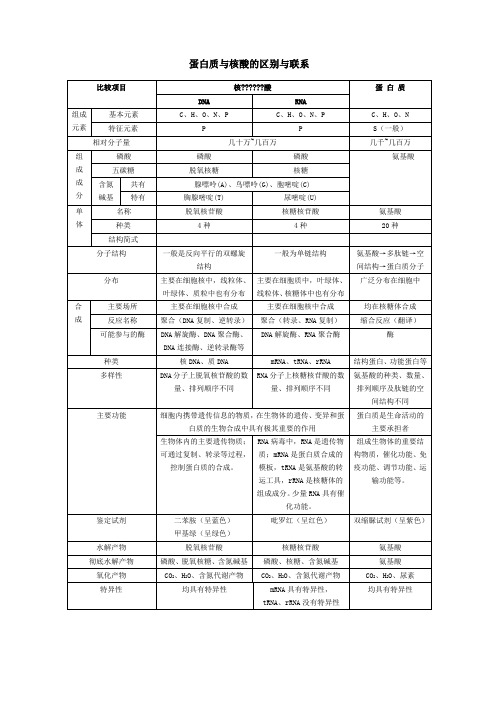
均在核糖体合成
反应名称
聚合(DNA复制、逆转录)
聚合(转录、RNA复制)
缩合反应(翻译)
可能参与的酶
DNA解旋酶、DNA聚合酶、DNA连接酶、逆转录酶等
DNA解旋酶、RNA聚合酶
酶
种类
核DNA、质DNA
mRNA、tRNA、rRNA
结构蛋白、功能蛋白等
多样性
DNA分子上脱氧核苷酸的数量、排列顺序不同
蛋白质与核酸的区别与联系
比较项目
核??????酸
蛋 白 质
DNA
RNA
组成
元素
基本元素
C、H、O、N、P
C、H、O、N、P
C、H、O、N
特征元素
P
P
S(一般)
相对分子量
几十万~几百万
几千~几百万
组
成
成
分
磷酸
磷酸
磷酸
氨基酸
五碳糖
脱氧核糖
核糖
含氮碱基
共有
腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)
特有
胸腺嘧啶(T)
RNA分子上核糖核苷酸的数量、排列顺序不同
氨基酸的种类、数量、排列顺序及肽链的空间结构不同
主要功能
细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用
蛋白质是生命活动的主要承担者
生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物质;mRNA是蛋白质合成的模板,tRNA是氨基酸的转运工具,rRNA是核糖体的组成成分。少量RNA具有催化功能。
尿嘧啶(U)
单
4种
4种
20种
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质与核酸的区别与联系
比较项目核酸蛋白质
DNA RNA
组成元素
基本元
素
C、H、O、N、P C、H、O、N、P C、H、O、N 特征元素P P S(一般)
相对分子量几十万~几百万几千~几百万
组成成分
磷酸磷酸磷酸氨基酸五碳糖脱氧核糖核糖
含
氮
碱
基
共
有
腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)
特
有
胸腺嘧啶(T) 尿嘧啶(U)
单体
名称脱氧核苷酸核糖核苷酸氨基酸种类4种4种20种结构简式
分子结构一般是反向平行的双螺旋
结构一般为单链结构氨基酸→多肽链→空
间结构→蛋白质分子
分布主要在细胞核中,线粒体、
叶绿体、质粒中也有分布主要在细胞质中,叶绿体、
线粒体、核糖体中也有分
布
广泛分布在细胞中
合成
主要场所主要在细胞核中合成主要在细胞核中合成均在核糖体合成
反应名称聚合(DNA复制、逆转录)聚合(转录、RNA复制)缩合反应(翻译)
可能参与
的酶
DNA解旋酶、DNA聚合酶、
DNA连接酶、逆转录酶等
DNA解旋酶、RNA聚合酶酶
种类核DNA、质DNA mRNA、tRNA、rRNA 结构蛋白、功能蛋白等多样性DNA分子上脱氧核苷酸的
数量、排列顺序不同
RNA分子上核糖核苷酸的
数量、排列顺序不同
氨基酸的种类、数量、
排列顺序及肽链的空
间结构不同
主要功能细胞内携带遗传信息的物质,在生物体的遗传、变异和
蛋白质的生物合成中具有极其重要的作用蛋白质是生命活动的主要承担者
生物体内的主要遗传物质;可通过复制、转录等过程,控制蛋白质的合成。
RNA病毒中,RNA是遗传物
质;mRNA是蛋白质合成的
模板,tRNA是氨基酸的转
运工具,rRNA是核糖体的
组成成分。
少量RNA具有
催化功能。
组成生物体的重要结
构物质,催化功能、免
疫功能、调节功能、运
输功能等。
鉴定试剂二苯胺(呈蓝色)
甲基绿(呈绿色)
吡罗红(呈红色)双缩脲试剂(呈紫色)
水解产物脱氧核苷酸核糖核苷酸氨基酸
彻底水解产物磷酸、脱氧核糖、含氮碱
基
磷酸、核糖、含氮碱基氨基酸
氧化产物CO2、H2O、含氮代谢产物CO2、H2O、含氮代谢产物CO2、H2O、尿素特异性均具有特异性mRNA具有特异性,
tRNA、rRNA没有特异性
均具有特异性
联系
三者之间的关
系
有关计
算
DNA多样性、蛋白质多样性、生物多样性的关
系。
