物化实验报告_综合实验二B-Z振荡
物理化学实验报告 BZ振荡反应

物理化学实验报告BZ 振荡反应1.实验报告(1)了解BZ 反应的基本原理。
(2)观察化学振荡现象。
(3)练习用微机处理实验数据和作图。
2. 实验原理化学振荡:反应系统中某些物理量随时间作周期性的变化。
BZ 体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂作用下构成的体系。
有苏联科学家Belousov 发现,后经Zhabotinski 发现而得名。
本实验以BrO -3 ~ Ce +4~ CH 2(COOH)2 ~ H 2SO 4作为反映体系。
该体系的总反应为:()()O 4H 3CO COOH 2BrCH COOH 2CH 2BrO 2H 222223++−→−++-+ 1体系中存在着下面的反应过程。
过程A :HOBr HBrO 2H Br BrO 2K 32+−→−+++--2 2HOBr H Br HBrO 3K 2−→−+++-3过程B :O H 2BrO H HBrO BrO 22K 234+−→−+++-4 42K 32Ce HBrO H Ce BrO 5++++−→−++5 +++−→−H HOBr BrO 2HBrO -3K 266Br -的再生过程:()++-++++−→−+++6H3CO 4Ce2Br HOBr O H COOH BrCH 4Ce 23K 2247当[Br -]足够高时,主要发生过程A ,2反应是速率控制步骤。
研究表明,当达到准定态时,有[][][]+-=H BrO K K HBrO 3322。
当[Br -]低时,发生过程B ,Ce +3被氧化。
4反应是速率控制步骤。
4.5反应将自催化产生达到准定态时,有[][][]+-≈H BrO 2K K HBrO 3642。
可以看出:Br -和BrO -3是竞争HbrO 2的。
当K 3 [Br -]>K 4[BrO -3]时,自催化过程不可能发生。
自催化是BZ 振荡反应中必不可少的步骤,否则该振荡不能发生。
bz化学振荡反应实验报告

bz化学振荡反应实验报告实验目的:1.了解化学振荡反应的基本原理;2.熟悉化学实验室的基本操作;3.观察化学振荡反应过程,探究其变化规律。
实验原理:化学振荡反应是指反应物不断出现和消失的循环过程。
其中,自催化反应是实现化学振荡反应的典型反应。
在自催化反应中,反应产物可以促进反应进行,因此反应可以在产物的作用下不断进行和停止,从而形成化学振荡反应。
实验仪器:量筒、滴定管、烧杯、试管、热水槽、移液管、计时器等。
实验步骤:1.将首先将60ml水倒入一个烧杯中,加入0.6g淀粉,在淀粉溶解的同时加入2ml硫酸稀溶液和2ml钾碘溶液。
2.将50ml的1.0mol/L的NaOH 溶液分别倒入两个不同的烧杯中。
3.在第一烧杯中加入少量硫酸混合溶液,用探棒轻轻搅拌,使其颜色变为深褐色大约30秒,然后加入几滴这种混合溶液,使其颜色变为深蓝色并开始异变。
4.将第二烧杯中的NaOH 溶液用移液管慢慢加到第一烧杯中,观察反应过程。
5.记录反应过程中出现和消失的颜色和时间。
实验结果:1.在加入混合溶液之前,淀粉水是无色透明的;2.加入混合溶液后,淀粉水变为深褐色,在加入几滴混合溶液后,变为深蓝色,并开始异变;3.当加入NaOH 溶液时,深蓝色的溶液会发生颜色变化,有时会变为黄色或橙色;4.出现这种变化的时间间隔不固定,而是在不同的实验中有所不同。
实验结论:通过本次实验,我们了解了化学振荡反应基本原理,以及如何通过实验观察,探究化学振荡反应的变化规律。
实验结果证明,化学振荡反应是反应物出现和消失的循环过程,其中自催化反应常常是实现化学振荡反应的典型反应。
在自催化反应中,反应产物可以促进反应进行,因此反应可以在产物的作用下不断进行和停止,从而形成化学振荡反应。
bz振荡反应实验报告

bz振荡反应实验报告bz振荡反应实验报告引言:振荡反应是化学中一种非常有趣且复杂的现象,它常常表现出周期性的变化。
本实验旨在通过观察和研究bz振荡反应,深入了解其机理和特性。
实验目的:1. 观察bz振荡反应的现象和规律;2. 探究影响bz振荡反应的因素;3. 分析振荡反应的动力学特性。
实验材料和方法:材料:甲醛、硫酸、硫酸铁、碘化钾、硫酸铜、稀硫酸、蒸馏水等;方法:按照实验步骤进行操作。
实验步骤:1. 准备工作:清洗实验器材,准备所需试剂;2. 液体A的制备:将甲醛、硫酸和硫酸铁按一定比例混合,得到液体A;3. 液体B的制备:将碘化钾、硫酸铜和稀硫酸按一定比例混合,得到液体B;4. 实验装置的搭建:将液体A和液体B分别倒入两个烧瓶中,通过U型管将两个烧瓶连接起来;5. 观察实验现象:观察烧瓶中液体颜色的变化,记录变化的时间和规律。
实验结果与分析:在实验过程中,我们观察到了bz振荡反应的明显现象。
起初,液体A和液体B 分别呈现深蓝色和黄色。
当两者混合后,液体的颜色会发生周期性的变化,从深蓝色到无色,再到深蓝色,如此往复。
通过记录实验过程中颜色变化的时间和规律,我们发现了一些有趣的现象。
首先,颜色变化的周期并不固定,有时短暂,有时较长。
其次,液体颜色变化的速度也存在差异,有时快速,有时缓慢。
这些现象表明,bz振荡反应受到多种因素的影响。
为了更好地理解bz振荡反应的机理,我们进一步探究了影响反应速率的因素。
实验中我们改变了液体A和液体B的浓度、温度和pH值等条件。
结果显示,液体A和液体B的浓度越高,反应速率越快;温度升高也会加快反应速率;而pH值的变化则对反应速率影响较小。
此外,我们还对bz振荡反应的动力学特性进行了分析。
通过实验数据的处理和计算,我们得到了反应速率与浓度的关系曲线,发现其呈现非线性的特点。
这表明bz振荡反应可能涉及到多个中间物质的生成和消耗,反应过程较为复杂。
结论:通过本次实验,我们深入了解了bz振荡反应的特性和机理。
bz振荡实验报告

bz振荡实验报告
《bz振荡实验报告》
实验目的:通过对bz振荡实验的观察和分析,探究化学反应中的振荡现象,并深入了解反应动力学和化学动力学的相关知识。
实验材料和方法:实验中所需材料包括苯乙烯、溴化钾、硫酸、硫酸铁、甲酸和氢氧化钠等化学试剂,以及玻璃容器、计时器和温度计等实验仪器。
实验步骤包括将苯乙烯、溴化钾和硫酸铁依次加入玻璃容器中,然后加入甲酸和氢氧化钠,观察反应过程中的颜色变化和振荡现象,并记录实验数据。
实验结果:在实验过程中,观察到了反应溶液由无色到黄色再到蓝色的变化,同时伴随着溶液的振荡现象,呈现出周期性的颜色变化。
通过记录实验数据,得出了反应物浓度、温度和反应速率等因素对振荡现象的影响规律,从而深入探讨了化学反应动力学的相关知识。
实验结论:通过对bz振荡实验的观察和分析,我们深入了解了化学反应中的振荡现象及其规律,加深了对反应动力学和化学动力学的理解。
这对于进一步研究化学反应机理和应用化学反应于工业生产等方面具有重要意义。
总结:bz振荡实验是一项具有重要意义的化学实验,通过实验我们不仅可以观察到化学反应中的振荡现象,还可以深入了解反应动力学和化学动力学的相关知识。
希望通过本次实验报告的分享,能够对化学爱好者和学习者有所帮助,激发大家对化学科学的兴趣和热爱。
物理化学实验报告-BZ振荡反应

物理化学实验报告-BZ振荡反应
BZ振荡反应是一种经典的化学振荡反应,其特点在于反应体系呈现周期性的颜色变化。
本实验通过观察和分析BZ振荡反应的颜色变化规律,探究了振荡反应机制以及影响反应速率的因素。
实验步骤:
1. 准备工作:准备好测量药品、试管、电子秤等实验装置。
2. 实验操作:将准备好的药品按比例加入试管中,同时加入适量的稀盐酸,用玻璃
棒搅拌均匀。
观察试管液体的颜色变化,当液体呈现蓝色时加入适量的碘离子,不断观察
颜色变化。
3. 观察结果:当反应发生时,液体的颜色会出现周期性变化,从蓝色开始逐渐变为
无色、黄色、橙色、红色等颜色,然后再逐渐回到蓝色。
4. 分析结果:在反应过程中,反应物和产物的浓度随时间而变化,从而导致反应速
率的变化。
此外,碘离子的加入可促进反应的发生,同时稀盐酸的存在也可能影响反应速率。
5. 实验探究:改变反应物的浓度、温度等因素,可以对BZ振荡反应进行更深入的探究,以了解其反应机制和影响因素。
结论:
BZ振荡反应是一种周期性的化学振荡反应,其反应速率随着反应物和产物的浓度变化而变化。
碘离子的加入可促进反应的发生,而稀盐酸的存在也可能影响反应速率。
通过改
变反应物的浓度、温度等因素,可以进一步探究BZ振荡反应的反应机制及影响因素。
B-Z震荡反应实验报告

B-Z 振荡反应条件与机理探究Research of B-Z oscillationreaction conditions and mechanism摘要:本实验对CH2(COOH)2-KBrO3化学振荡体系进行研究,通过对实验条件的控制和反应物质的选取,探讨化学振荡反应的起振条件和机理,加深对振荡反应的理解和对体系远离平衡状态下的复杂行为的认识。
关键词:B-Z振荡起振条件振荡周期Abstract:In this study, B-Z chemical oscillating reaction Of CH2(COOH)2-KBrO3system was exploited to study the Chemical Oscillating Reaction. By controlling the experimental conditions and the selection of reaction materials, studying the mechanism of oscillating chemical reaction,to deepen the cognition of oscillating reactions and the understanding of the complex behavior of the system far from equilibrium state.Keywords:B-Z oscillating; Oscillation condition; Oscillation period;前言化学振荡即化学反应系统中的某些物理量随时间周期变化,是一个十分复杂的反应,包含了大量的化学反应物质,如反应物、生成物、中间体和催化剂,属于非线性动力学范畴。
B-Z 化学振荡是一类机理非常复杂的化学过程,Field、Koros、Noyes三位科学家经过四年的共同努力,于1972年提出著名的FKN机理用来解释B-Z振荡反应的具体反应历程,随后又简化出Oregonator模型。
化学振荡反应实验报告

一、实验目的1. 了解Belousov-Zhabotinski(B-Z)反应的基本原理和FKN机理。
2. 观察B-Z振荡反应的化学振荡现象。
3. 学习使用铂电极和甘汞电极进行电位-时间曲线的测定。
4. 练习用微机处理实验数据并绘制曲线。
二、实验原理B-Z振荡反应是一种典型的化学振荡现象,其机理由Field、Koros和Noyes在1972年提出的FKN机理所描述。
该反应由以下三个过程组成:过程A:中间体的生成与消耗A1:2BrO3- + 2CH2(COOH)2 + 4H+ → 2Br- + 2HBrO2 + 2CO2 + 2H2OA2:HBrO2 → Br- + H2O + BrO过程B:自催化过程B1:HBrO2 → Br- + H2O + BrOB2:BrO + Ce3+ → HBrO2 + Ce4+B3:2HBrO2 → Br2O + H2O + BrO2过程C:Br-的再生C1:4Ce4+ + BrCH(COOH)2 + 6H2O → 4Ce3+ + 2Br- + 3CO2 + 12H+当反应体系中Br-的浓度足够高时,主要发生过程A,其中反应A2是速率控制步骤。
当Br-的浓度较低时,发生过程B,其中反应B2是速率控制步骤。
反应C1对化学振荡现象至关重要,因为它使得Br-得以再生,维持反应的持续进行。
三、实验仪器与试剂1. 仪器:铂电极、217型甘汞电极、微电极、微机、搅拌器、烧杯、移液管、pH计等。
2. 试剂:溴酸盐、丙二酸、硫酸、硫酸铜、氯仿等。
四、实验步骤1. 配制B-Z反应溶液:将一定量的溴酸盐、丙二酸、硫酸和硫酸铜溶解于水中,搅拌均匀。
2. 将铂电极和甘汞电极插入反应溶液中,用pH计测量溶液的pH值,调节至实验所需的pH值。
3. 开启搅拌器,观察反应溶液的颜色变化,记录化学振荡现象。
4. 使用微电极测定电位-时间曲线,记录数据。
5. 关闭搅拌器,将反应溶液取出,进行数据处理和分析。
bz振荡反应实验报告

bz振荡反应实验报告
实验目的,通过实验观察bz振荡反应的过程及其特点,了解振荡反应的基本
原理。
实验仪器与试剂:
1. 反应器,玻璃容器。
2. 试剂,溴化钾、溴化铵、硫酸亚铁、硫酸、水。
实验步骤:
1. 在玻璃容器中加入一定量的溴化钾和溴化铵溶液。
2. 向容器中加入适量的硫酸亚铁和硫酸,使反应混合物均匀。
3. 观察反应过程中的颜色变化和气泡产生情况。
实验结果:
在实验过程中,我们观察到了bz振荡反应的特点,首先是反应混合物由无色
逐渐变为黄色,然后变为蓝色,接着又变为无色,如此往复循环。
在颜色变化的同时,反应混合物中也产生了气泡,整个过程呈现出周期性的振荡变化。
实验分析:
bz振荡反应是一种典型的化学振荡反应,其发生的原理是由于反应物浓度的周期性变化所导致的。
在反应过程中,溴化钾和溴化铵的浓度会随着反应进行而周期性地变化,从而引起反应混合物颜色和气泡产生的周期性变化。
这种振荡反应在化学动力学中具有重要的意义,也为我们理解化学反应动力学提供了一个生动的实例。
实验总结:
通过本次实验,我们深入了解了bz振荡反应的特点和原理,也对化学振荡反应的周期性变化有了更深入的认识。
振荡反应的研究不仅有助于我们理解化学反应动力学的基本原理,也在化工生产和生物医学领域具有重要的应用价值。
希望通过今后的实验和学习,能够进一步深化对化学振荡反应的理解,为化学领域的发展做出更大的贡献。
以上就是本次bz振荡反应实验的报告内容,希望能对大家有所帮助。
B-Z振荡反应实验报告

B-Z振荡反应姓名:何一白学号:2012011908 班级:化22实验日期:2014年11月6日提交报告日期:2014年11月22日带实验的老师姓名:王振华1引言(简明的实验目的/原理)1.1 实验目的了解Belousov-Zhabotinski反应的机理通过测定电位-时间曲线球的振荡反应的表观活化能1.2实验原理化学震荡:反映系统中某些物理量(如组分浓度)随时间做周期性变化B-Z反应机理:在硫酸介质中以金属铈离子做催化剂的条件下,丙二酸被溴酸氧化——FKN机理(共十步)系统中[Br-]、[HBrO2],[Ce4+]/[Ce3+]都随时间做周期性的变化。
测量及数据:我们用溴离子选择电极和铂丝电极分别测定[Br-]和[Ce4+]/[Ce3+]随时间变化的曲线,处理数据得到诱导期时间及震荡周期。
由1/t诱,1/t振分别衡量诱导期和振荡周期反应速率的快慢,综合不同温度下的t诱和t振,估算表观活化能E诱,E振。
2 实验操作2.1 实验药品、仪器型号及测试装置示意图2.1.1 实验仪器计算机及接口一套;HS-4 型精密恒温浴槽;电磁搅拌器;反应器1 个;铂电极1 个;饱和甘汞电极1 个;滴瓶3 个;量筒3 个;2ml 移液管1 支;洗瓶1 个;镊子1 把;2.1.2 实验药品0.02 mol/L 硝酸铈铵;0.5 mol/L 丙二酸;0.2 mol/L 溴酸钾; 0.8 mol/L 硫酸。
2.2 实验条件(实验温度、湿度、压力等)实验室温度16.3℃,大气压102.19kPa2.3 实验操作步骤及方法要点1.检查仪器药品。
2.按装置图(如图1 所示)接好线路。
图1 . B-Z振荡反应实验装置图3.接通相应设备电源,准备数据采集。
4.调节恒温槽温度为20℃。
分别取7ml丙二酸、15ml溴酸钾、18ml硫酸溶液于干净的反应器中,开动搅拌。
打开数据记录设备,开始数据采集,待基线走稳后,用移液管加入2ml硝酸铈铵溶液。
bz振荡实验报告

bz振荡实验报告一、实验目的1.了解BZ振荡反应的基本原理;体会自催化过程是产生振荡反应的必要条件。
2.初步理解耗散结构系统远离平衡的非线性动力学机制。
3.掌握测定反应系统中电势变化的方法;了解溶液配制要求及反应物投放顺序。
二.仪器与试剂:仪器 NDM-1电压测量仪;数据采集接口装置;计算机;反应器100ml;SYC-15B超级恒温水浴;磁力搅拌器;217型甘汞电极;213型铂电极;药品溴酸钾(GR);硝酸铈铵(AR);丙二酸(AR);浓硫酸(AR)。
三、实验步骤:1.用1.00硫酸作217型甘汞电极液接;2.按图连接好仪器,打开超级恒温水浴,将温度调节至30.0±0.1℃;3.配制0.45丙二酸250ml、0.25溴化钾250ml、3.00硫酸250ml;在0.20硫酸介质中配制的硫酸铈铵250ml。
4.在反应器中加入已配好的丙二酸溶液、溴酸钾溶液、硫酸溶液各15ml;5.打开磁力搅拌器,调节合适速度;6.将精密数字电压测量仪置于分辨率为0.1mV档(即电压测量仪的2V档),且为“手动”状态,甘汞电极接负极,铂电极接正极;7.恒温5min后,加入硫酸铈铵溶液15ml,观察溶液颜色的变化,同时开始计时并记录相应的变化电势;8.电势变化首次到最低时,记下时间;9.用上述方法将温度设置为30℃、35℃、40℃、45℃、50℃重复实验,并记下;10.根据与温度数据作图。
四、原始数据记录及处理五、问题及讨论1.试述影响诱导期的主要因素。
答:中间体的生成速率。
2.初步说明BZ振荡反应的特征及本质。
答:BZ振荡反应的特征如下:(1)反应必须是敞开系统,且远离平衡态;(2)反应历程中应包含自催化的步骤;(3)系统具有双稳定性。
BZ振荡反应的本质是必然是耗散结构,化学振荡的动力学具有非线形的微分速率公式。
3.说明实验中测得的电势的含义。
答:说明离子的浓度随时间的周期性变化情况从而导致电势周期性的发生变化。
BZ震荡反应

实验报告课程名称:物理化学实验Ⅱ实验项目名称:B—Z震荡反应学院:化学与化工学院专业:指导教师:报告人:学号:2007140157 班级:07(3)实验时间:2009.6.9实验报告提交时间:2009.6.16教务处制B-Z振荡反应一.目的要求1.了解Belousov-Zhabotinskii反应的基本原理,掌握研究化学振荡反应的一般方法,初步认识体系远离平衡态下的复杂行为;2. 设计丙二酸-硫酸-溴酸钾-硫酸铈铵化学振荡体系的实验方案,并对其诱导期及振荡特征进行研究。
三、仪器药品仪器: 2D-BZ振荡实验装置,100ml电解池,光亮铂丝电极,217型双盐桥甘汞电极(用 H2SO4作液接盐桥),SYC-15B超级恒温槽,移液管,洗耳球。
试剂:0.05mol/L硫酸铈铵溶液(在0.2mol/L硫酸介质中配制)。
0.2mol/L溴酸钾溶液,0.4mol/L丙二酸溶液,3mol/L硫酸溶液四、实验步骤按图17-1连接好仪器装置,开启电脑,打开超级恒温槽,将温度恒定在25.0±0.1℃。
在100ml的反应器中加入浓度为0.4mol/L的丙二酸、浓度为0.05mol/L 硫酸铈铵溶液、浓度为 3mol/L的硫酸各10 mL混合,开启电磁搅拌使溶液在设定温度下恒温至少10min(调节调速旋钮约3圈半)。
打开BZ振荡2.0软件,设置纵坐标0-1.5V,横坐标0-30min。
待电压稳定后,开始绘图,绘图约5min 后加入10mL浓度为 0.2mol/L的KBrO3,观察溶液颜色变化,图18-1 B-Z反应实验装置示意图图18-2 B-Z反应的电势振荡曲线经过一段时间后,此后的曲线呈现有规律性周期变化。
图像出现10个周期以后,停止绘图。
从电脑屏幕上读取本振荡反应的诱导时间tu 和振荡周期tz。
拷贝屏幕。
用“画图”软件存储屏幕图像。
取出电极洗净电解池和所用电极。
五、数据处理ln(1/ t u) ―1/Tln(1/ t z) ―1/TK=E/R K u=5.642 K z=7.8039 E u= K u R=5.642*8.314 = 46.907E z= K z R=7.8039*8.314=64.881六、思考题影响诱导期和振荡周期的主要因素有哪些? 答,影响诱导期的和振荡周期的因素有:①温度。
BZ震荡清华大学物理化学实验报告

计算机及接口一套;HS-4 型精密恒温浴槽;电磁搅拌器;反应器1个;铂电极1个; 饱和甘汞电极1个;滴瓶3个;量筒3个;2ml 移液管1 支;洗瓶1个;镊子1 把; 0.02mol/L硝酸铈铵;0.5mol/L丙二酸;0.2mol/L溴酸钾; 0.8mol/L硫酸。
3.2 计算的数据、结果
实验中我们从开始加入溶液后开始计时,因而诱导期时间是从计时开始到电位曲线出现明显下降结束。
对于化学振荡的取峰值进行分析,则可以得到振荡周期,所得实验结果如下表所示:
温度/℃
诱导期/S
振荡周期/S
20
671.2
113.9
25
523.1
69.6
31
297.1
46.5
37
207.0
同时发生的反应为(5)+(6)
2������������3+ + ������������������������2 + ������������������3− + 3������+ → 2������������4+ + 2������������������������2 + ������2������
k3 2.1mol 3 dm9 s 1 k4 4 107 mol 1 dm3 s 1 k5 1.0 104 mol 2 dm6 s 1 k5 2 107 mol 1 dm3 s 1
快速
k7 1.3102[H ][MA]
这两个反应的特点是整体上来说维持铈离子在+4 价,转化了一部分 BrO3-为 HBrO2,同时由于反应(4) 的存在,随着 HBrO2 的增加,一部分 HBrO2 也会转化为 HOBr:
B-Z振荡-物化实验报告
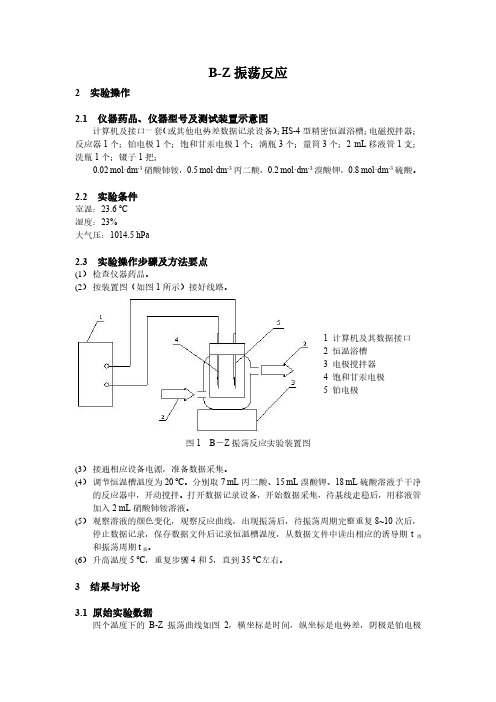
B-Z 振荡反应2 实验操作2.1 仪器药品、仪器型号及测试装置示意图计算机及接口一套(或其他电势差数据记录设备);HS-4型精密恒温浴槽;电磁搅拌器;反应器1个;铂电极1个;饱和甘汞电极1个;滴瓶3个;量筒3个;2 mL 移液管1支;洗瓶1个;镊子1把;0.02 mol·dm -3硝酸铈铵,0.5 mol·dm -3丙二酸,0.2 mol·dm -3溴酸钾,0.8 mol·dm -3硫酸。
2.2 实验条件室温:23.6 ℃ 湿度:23%大气压:1014.5 hPa2.3 实验操作步骤及方法要点(1) 检查仪器药品。
(2) 按装置图(如图1所示)接好线路。
图1 B -Z 振荡反应实验装置图(3) 接通相应设备电源,准备数据采集。
(4) 调节恒温槽温度为20 ℃。
分别取7 mL 丙二酸、15 mL 溴酸钾、18 mL 硫酸溶液于干净的反应器中,开动搅拌。
打开数据记录设备,开始数据采集,待基线走稳后,用移液管加入2 mL 硝酸铈铵溶液。
(5) 观察溶液的颜色变化,观察反应曲线,出现振荡后,待振荡周期完整重复8~10次后,停止数据记录,保存数据文件后记录恒温槽温度,从数据文件中读出相应的诱导期t 诱和振荡周期t 振。
(6) 升高温度5 ℃,重复步骤4和5,直到35 ℃左右。
3 结果与讨论3.1 原始实验数据四个温度下的B-Z 振荡曲线如图2,横坐标是时间,纵坐标是电势差,阴极是铂电极1 计算机及其数据接口2 恒温浴槽3 电极搅拌器4 饱和甘汞电极5 铂电极(Ce 4+/Ce 3+的反应),阳极是甘汞电极。
图2 不同温度下的B-Z 振荡曲线注:T=20 ℃的图中,振荡周期中有两个异常的尖峰,是导线接触不良导致的。
以基线第一次出现一个小峰的时刻为时间零点(视为混合均匀的时刻),至第一次观察到振荡的时刻为诱导期t 诱导。
振荡期t 振荡是8个震荡周期的同一个位置对应的7个时间间隔的平均值。
振荡反应实验报告范文(3篇)

第1篇一、实验目的1. 了解Belousov-Zhabotinski(B-Z)振荡反应的基本原理及其化学振荡现象。
2. 通过实验,掌握B-Z振荡反应的条件控制,观察并记录反应过程中的颜色变化和电位变化。
3. 分析B-Z振荡反应的周期性规律,探究影响反应周期的因素。
4. 理解自催化过程在振荡反应中的作用,加深对非线性动力学机制的认识。
二、实验原理B-Z振荡反应是一种典型的化学振荡现象,它是由有机物在酸性介质中被催化溴氧化的一类反应。
该反应体系主要由以下几种物质组成:丙二酸(MA)、溴酸钾(KBrO3)、硫酸(H2SO4)和催化剂(Ce4+)。
反应过程中,丙二酸被溴酸钾氧化生成溴代丙二酸,同时生成Ce4+离子。
Ce4+离子作为催化剂,参与反应的氧化还原过程,使得反应系统产生周期性的振荡。
B-Z振荡反应的机理可以概括为以下三个过程:1. 过程A:丙二酸与溴酸钾反应生成溴代丙二酸和Ce4+离子。
\[ 2MA + 2BrO3^- + 2H^+ \rightarrow 2BrMA + Ce4^+ + 2H2O \]2. 过程B:溴代丙二酸在Ce4+离子的催化下,再次被溴酸钾氧化,生成Br2和Ce4+离子。
\[ BrMA + BrO3^- + H^+ \rightarrow Br2 + Ce4^+ + 2H2O \]3. 过程C:Ce4+离子在反应过程中被还原为Ce3+离子,Ce3+离子与溴酸钾反应生成Ce4+离子,从而维持反应的持续进行。
\[ Ce4^+ + e^- \rightarrow Ce3^+ \]\[ Ce3^+ + BrO3^- + 2H^+ \rightarrow Ce4^+ + Br2 + H2O \]三、实验材料与仪器材料:- 丙二酸(MA)- 溴酸钾(KBrO3)- 硫酸(H2SO4)- 硫酸铜(CuSO4)- 硫氰酸钾(KSCN)- 0.1mol/L pH缓冲溶液- 蒸馏水- 铂电极- 217型甘汞电极- 饱和甘汞电极- 电位计- 秒表- 容量瓶- 烧杯- 玻璃棒- 滴定管仪器:- 酸度计- 离子色谱仪- 恒温水浴- 镜子四、实验步骤1. 溶液配制:- 配制0.1mol/L的MA溶液。
《物理化学实验报告》b—z振荡反应

B-Z振荡反应2011年10月17日实验,2011年10月20日提交报告助教:曹中林1 引言所谓振荡反应是指体系中某些物理量(如浓度)随时间发生周期性变化的反应。
1958年,Belousov首次报道在以Ce n+为催化剂的条件下,柠檬酸被溴酸氧化的均相系统可呈现此种化学振荡现象。
随后Zhabotinsky继续了该反应的研究。
到目前,该反应已经拓展到一类金属离子催化的溴酸(盐)氧化有机酸的反应体系,被统称为B-Z振荡反应。
1972年, Field等人经过大量的研究, 提出了著名的FKN机理[1]。
该机理认为引起体系振荡行为的关键组分是中间产物HBrO2,、Br—和Ce4+及Ce3+。
其中Br—起到控制过程的作用,通过(5)、(6)两步耦合形成自催化过程的HBrO2起到切换开关的作用, 而Ce4+起到再生Br—的作用。
该机理包括两个主要过程:过程A和过程B, 而过程C起到连接过程A和B的作用(见表1)。
表1 FKN机理*过程反应速率常数AHOBr + Br- + H+Br2 + H2Ok1 = 8×109 mol-2∙L2∙s-1k-1 = 110 s HBrO2 + Br- + H+→2HOBr k2 = 2×109 mol-2∙L2∙s-1 BrO3- + Br- +2H+→HBrO2 + HOBr k3 = 2.1 mol-3∙L3∙s-1B2HBrO2→BrO3- + HOBr + H+ k4 = 4×107 mol-1∙L∙s-1 BrO3- + HBrO2 + H+2BrO2 + H2Ok5 = 1.0×104 mol-2∙L2∙s-1k-5 = 2×107 mol-1∙L∙s-1 BrO2 + Ce3+ + H+→HBrO2 + Ce4+快速CBr2 + MA →BrMA + Br- + H+k7 = 1.3×10-2[H+][MA] 6Ce4+ + MA + 2H2O →6Ce3+ + HCOOH + 2CO2 + 6H+4Ce4+ + BrMA + 2H2O →4Ce3+ + Br- + HCOOH + 2CO2 + 5H+Br2 + HCOOH →2Br- + CO2 + 2H+* 表中MA和BrMA分别为CH2(COOH)2和BrCH(COOH)2的缩写。
物理化学实验报告:B-Z振荡

B-Z振荡反应姓名:杨岳洋学号:2015012012(同组实验同学:张知行)学号:2015012012 班级:材54实验日期:2016年9月26日助教:袁倩1 引言1.1 实验目的1.了解Belousov-Zhabotinski反应(简称B-Z反应)的机理。
2.通过测定电位——时间曲线求得振荡反应的表观活化能。
1.2 实验原理所谓化学振荡就是反应系统中某些物理量如组分的浓度随时间作周期性的变化。
许多有机酸(如丙二酸、苹果酸、丁酮二酸等)的溴酸氧化反应系统能出现振荡现象,而且所用的催化剂也不限于金属铈离子,铁和锰等金属离子可起同样的作用。
后来,人们笼统地称这类反应为B-Z反应。
由实验测得的B-Z体系典型铈离子和溴离子浓度的振荡曲线如图1所示。
图1 B-Z体系典型铈离子和溴离子浓度的振荡曲线关于B-Z反应的机理,目前为人们普遍接受的是关于在硫酸介质中以金属铈离子作催化剂的条件下,丙二酸被溴酸氧化的机理,简称为FKN机理。
其主要的反应步骤及各步骤的速率或速率系数归纳如下:表1 FKN 机理注:k i 代表第i 个反应步骤的速率,MA 和BrMA 分别为CH 2(COOH)2和BrCH(COOH)2的缩写。
按照FKN 机理,可对化学振荡现象解释如下:当[Br -]较大时,反应主要按表中的(1)、(2)、(3)进行,总反应为:(11)生成的Br 2按步骤(7)消耗掉。
步骤(1)、(2)、(3)、(7)组成了一条反应链,称为过程A ,其总反应为:(12)当[Br -]较小时,反应按步骤(5)和(6)进行,总反应为:(13)步骤(5)为该反应的速度控制步骤((5)的逆反应速率可忽略),这样有2Br H +HOBr k 22−→−HBrO −→23O H Br H Br BrO 2233365+→+++--O H COOH BrCH H COOH CH Br BrO 222233)(33)(32+→++++--O H HBrO Ce H HBrO BrO Ce 2242332232++→+++++-+(14)上式表明HBrO 2的生成具有自催化的特点,但HBrO 2的增长要受到步骤(4)的限制。
bz振荡实验报告

bz振荡实验报告bz振荡实验报告引言:振荡是物理学中重要的现象之一,它在许多领域都有广泛的应用。
本实验旨在研究Belousov-Zhabotinsky反应(简称BZ反应)中的振荡现象,并探究其背后的化学动力学机制。
通过实验观察和数据分析,我们希望能够深入了解BZ 反应的振荡特性以及相关的变化规律。
实验材料和方法:实验所需材料包括BZ反应试剂、试管、显微镜、计时器等。
首先,我们准备了一定浓度的BZ反应试剂,并将其倒入试管中。
然后,通过加入适量的催化剂,观察试管中的颜色变化并记录时间。
实验过程中,我们使用显微镜对试管内的反应进行观察,并记录下振荡的频率和振幅。
实验结果和讨论:在实验过程中,我们观察到了明显的振荡现象。
BZ反应开始时,试管内的液体呈现淡黄色,随着时间的推移,液体的颜色逐渐变为深蓝色,然后又逐渐恢复为淡黄色。
这种周期性的颜色变化正是BZ反应振荡的表现。
通过对实验数据的分析,我们发现BZ反应的振荡频率与催化剂的浓度密切相关。
当催化剂的浓度较低时,振荡频率较低;而当催化剂的浓度较高时,振荡频率较高。
这一结果与化学动力学理论相吻合,催化剂的浓度越高,反应速率越快,振荡频率也就越高。
此外,我们还发现BZ反应的振荡振幅也受到催化剂浓度的影响。
当催化剂浓度较低时,振荡振幅较小;而当催化剂浓度较高时,振荡振幅较大。
这表明催化剂的浓度对BZ反应的稳定性有着重要的影响。
通过进一步实验和数据分析,我们发现BZ反应的振荡特性还受到其他因素的影响,如温度、pH值等。
在一定的温度范围内,振荡频率随温度的升高而增加;而在过高或过低的温度下,振荡频率则会下降。
此外,pH值的变化也会对BZ反应的振荡特性产生影响,具体的变化规律需要进一步的研究。
结论:通过本次实验,我们深入了解了BZ反应的振荡特性以及相关的化学动力学机制。
实验结果表明,BZ反应的振荡频率和振幅受到催化剂浓度、温度和pH值等因素的影响。
这些发现对于进一步研究BZ反应的振荡现象以及应用于其他领域具有重要的意义。
物理化学B-Z震荡实验

物理化学B-Z震荡实验B-Z振荡反应一、实验目的:1、了解振荡反应的基本原理,体会产生振荡反应必备的条件。
2、初步理解耗散结构系统远离平衡的非线性动力学机制。
3、了解反应溶液的投放顺序以及观察颜色变化。
二、实验原理:有机物在酸性介质中被催化溴氧化的一类反应。
经典热力学熵增原理难以说明生命现象,普里高津提出了耗散结构理论,也提出了一个开放体系在达到远离平衡态的的非线性区域时,一旦体系的某个参量达到一定打得阀值后,通过涨落就可以使体系发生突变,从无序走向有序,产生化学振荡一类的自组织现象。
实验试剂:A溶液:3g丙二酸+6ml 1:1,2SO4+0.2硝酸铵+44mlH2O B溶液:2.5g溴酸钾+50mlH2O邻菲啰啉:0.7gFeSO4+0.5g邻菲啰啉三、实验步骤:1( 在小烧杯中加入8mlA溶液和8mlB溶液混匀观察颜色变化(无黄?无)记录变化周期,再加入1ml邻菲啰啉混匀,观察其颜色变化,记录五个周期。
2( 空间化学波现象观察在培养皿中加入6mlA和6mlB混匀后,再加入2ml邻菲啰啉混匀,下衬白纸,水平放在桌上,静置一段时间,观察同心圆样图案。
四、实验数据处理:实验一:实验现象无色?黄色黄色?无色实验时间 10秒 3分12秒实验一中加入1ml邻菲啰啉混匀:实验现象红色?紫色紫色?朱红色1 50秒 20秒2 49秒 21秒3 45秒 18秒4 50秒 16秒5 40秒 20秒五、实验二照片:附:实验名词解释:(1)开放系统热力学第二定律告诉我们,一个孤立系统的熵一定会随时间增大,熵达到极大值,系统达到最无序的平衡态,所以孤立系统绝不会出现耗散结构。
那么开放系统为什么会出现本质上不同于孤立系统的行为呢,其实,在开放的条件下,系统的熵增量dS是由系统与外界的熵交换deS和系统内的熵产生diS两部分组成的,即:dS=deS+diS 热力学第二定律只要求系统内的熵产生非负,即diS>=0,然而外界给系统注入的熵deS可为正、零或负,这要根据系统与其外界的相互作用而定,在deS<0的情况下,只要这个负熵流足够强,它就除了抵消掉系统内部的熵产生diS外,还能使系统的总熵增量dS为负,总熵S减小,从而使系统进入相对有序的状态。
BZ振荡反应-实验报告

B-Z 振荡反应一、实验目的1. 了解Belousov-Zhabotinski 反应的机理,自催化过程中产生振荡反应的条件2. 耗散系统远离平衡的非线性动力学机制3. 测定电势的变化的方法,了解溶液配制要求及反应物的投放顺序。
二、 实验原理对于以B-Z 反应为代表的化学振荡现象,目前被普遍认同的是Field ,kooros 和Noyes 在1972年提出的FKN 机理,,他们提出了该反应由萨那个主过程组成:过程A ①②式中为中间体,过程特点是大量消耗。
反应中产生的能进一步反应,使有机物MA 如丙二酸按下式被溴化为BrMA,(A1)(A2)过程B ③④这是一个自催化过程,在消耗到一定程度后,才转化到按以上③、④两式进行反应,并使反应不断加速,与此同时,催化剂氧化为。
在过程B 的③和④中,③的正反应是速率控制步骤。
此外,的累积还受到下面歧化反应的制约。
⑤过程C MA 和使离子还原为,并产生(由)和其他产物。
这一过程目前了解得还不够,反应可大致表达为:⑥2++f +2+其他产物式中f 为系数,它是每两个离子反应所产生的数,随着与MA 参加反应的不同比例而异。
过程C 对化学振荡非常重要。
如果只有A 和B ,那就是一般的自催化反应或时钟反应,进行一次就完成。
正是由于过程C ,以有机物MA 的消耗为代价,重新得到和,反应得以重新启动,形成周期性的振荡。
322BrO Br H HBrO HOBr --+++→+22HBrO Br H HOBr -+++→2HBrO Br -HOBr 22HOBr Br H Br H O -+++→+2Br MA BrMA Br H -++→++32222BrO HBrO H BrO H O -++++342222222BrO Ce H HBrO Ce ++++→+Br -2HBrO 3Ce +4Ce +2HBrO 232HBrO BrO HOBr H -+→++BrMA 4Ce +3Ce +Br -BrMA 4Ce +MA BrMA→Br -3Ce +4Ce +Br -BrMA Br -3Ce +丙二酸的B-Z 反应,MA 为,即为,总反应为:它是由①+②+4×③+4×④+2×⑤+5×(A1)+5×(A2),再加上⑥的特征,组合而成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B-Z振荡反应的研究【摘要】本实验通过丙二酸-溴酸钾-硫酸-硫酸铈铵体系,对B-Z振荡的发生条件如温度、浓度、添加顺序和改变某种物质,影响因素和机理,进行了一些研究,并发现了另外几种能发生振荡的体系。
【关键词】非线性振荡诱导时间起振条件自催化振荡周期Research of the B-Z Chemical VibrationAbstract:This experiment explores the chemical vibration in the system of KBrO3 reacting with CH2(COOH)2. We changed some of the reagent, the temperature of the reaction, the concentration of the solution and the order of adding the reagents then compared the vibration cycle and the inducement time in different conditions, that we can analyze the reacting mechanism of the chemical vibration.Keyword:Non-linear Chemistry, Vibration, Abduction Time, Conditions for Vibration, Self-catalysis, Vibration Period1. 前言非平衡非线性问题是自然界普遍存在的问题,大量研究工作正在进行。
研究的主要问题是:体系在远离平衡态下,由于本身的非线性动力学机制而产生宏观时空有序结构,称为耗散结构。
最典型的耗散结构是BZ 体系的时空有序结构,所谓BZ 体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂催化下构成的体系,它是由苏联科学家Belousov 发现,后经Zhabotingski 发现而得名。
1959年在均相体系中发现的化学振荡现象,使人们的认识发生了根本性转变。
当时苏联化学家Belousov B P 用硫酸铈盐(Ce 3+和Ce 4+)的溶液为催化剂,在25℃时,以溴酸钾氧化柠檬酸。
当把反应物和生成物的浓度控制在远离平衡态的浓度时发现,溶液中四价铈离子的黄色时而出现,时而消失。
在两种状态之间振荡,时间也极准确,周期为30s ,呈现出具有一定节奏的“化学钟”现象。
如果能够不断加入反应物和排出生成物即保持体系的远离平衡态,则“化学钟”可长期保持,否则只能维持50min ,在达到化学平衡后消失。
非平衡非线性问题是自然界普遍存在的问题,大量研究工作正在进行。
研究的主要问题是:体系在远离平衡态下,由于本身的非线性动力学机制而产生宏观时空有序结构,称为耗散结构。
最典型的耗散结构是BZ 体系的时空有序结构,所谓BZ 体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂催化下构成的体系,它是由苏联科学家Belousov 发现,后经Zhabotingski 发现而得名。
含有KBrO 3, CH 2(COOH)2和溶于H 2SO 4的硫酸铈铵的反应混合物,在30℃恒温条件下搅拌之,则有持续的振荡反应发生,丙二酸在催化剂Ce 4+/ Ce 3+存在下被溴酸根氧化,其化学反应方程式为: 3BrO 3-+5CH 2(COOH)2+3H+>++34/Ce Ce 3BrCH(COOH)2+2HCOOH +4CO 2+5H 2O根据FKN 原理,在此反应体系中,由于[BrO 3-/ Br —]比值的不同可分为两个反应过程:过程A 和过程B 。
过程A :当[Br —]足够大时,体系按这个过程进行:(1) BrO 3-+Br —+2H +—→ HBrO 2+HBrO (慢)(2) HBrO 2+Br —+H +—→ 2HBrO (快) (注:HBrO 一旦出现,立即被丙二酸消耗掉)过程B :当只剩少量[Br —]时,Ce 3+按下式被氧化:(3) BrO 3-+HBrO 2+H +—→ 2BrO 2*+H 2O (慢)(4) BrO 2+Ce 3++H + —→ HBrO 2+Ce 4+(快) (注:BrO 2*是自由基,反应(4)是瞬间完成的)(5) 2HBrO 2—→BrO 3-+HBrO +H +(6) 4Ce 4++BrCH(COOH)2+H 2O +HBrO —→2Br —+4Ce 3++3CO 2+6H +在A 过程中,慢反应(1)是决定速度的步骤,反应(2)是快反应,k 1/k 2=10-9,当k 2[HBrO 2]A [Br —] +[H +]= k 1[BrO 3-] [Br —] [H +]2,即[HBrO 2]A =( k 1/k 2) [BrO 3-] [H +]= 10-9[BrO 3-] [H +]时,反应达准定态。
在 B 过程中,慢反应(3)是决定速度的步骤,反应(3)和反应(4)的联合效果是: BrO 3-+2Ce 3++2H ++HBrO 2—→2BrO 2*+2Ce 4++H 2O ,等于一个产生HBrO 2的自催化反应。
随着HBrO 2的产生,反应会越来越快,在B 过程中,k 3/k 5=104,当2k 5[HBrO 2]B 2= k 3[BrO 3-] [HBrO 2]B [H +],即[HBrO 2]B =( k 3/2k 5) [BrO 3-] [H +] =10-4[BrO 3-] [H +]时,反应又达新的准定态,[HBrO 2]B 是[HBrO 2]A 的约105倍。
从[HBrO 2]A 和HBrO 2的自催化反应以及[HBrO 2]B可看出[HBrO 2]的“开关”作用。
从反应(2)和(3)可以看出:Br —和BrO 3-对HBrO 2存在着竞争作用,故当k2[HBrO2][ Br—][ H+]> k3[BrO3-][ HBrO2][ H+],即当k2 [ Br—]> k3[BrO3-]时,自催化反应(3)和(4)就不可能发生,所以从过程A转到过程B的条件是:k2 [ Br—]>k3[BrO3-],因此[ Br—]的临界浓度是[ Br—]临界= k3/ k2[BrO3-]=5*10-6[BrO3-],这就是Br—的“控制”作用。
所以能发生振荡现象,是由于存在一个反应(6),Ce4+又使Br—再生,这就是Ce4+的“再生”作用。
2. 实验部分2.1 仪器与试剂JB—1B型磁力搅拌器(包括磁子)一台CS501恒温槽一台N—2000双通道色谱工作站一个10ml移液管若干洗耳球一个0.2M溴酸钾、0.45M丙二酸、3M浓硫酸、0.004M硫酸铈铵、蒸馏水草酸、硫酸铁(II)铵、氢氧化钠、氯酸钾(分析纯)2.2实验步骤1)不同的反应物加入顺序对反应的影响调节恒温槽使温度恒定在一定温度,通恒温水于玻璃恒温夹套反应皿中,将丙二酸(10mL)、溴酸钾(10mL)、浓硫酸(10mL)、蒸馏水(10mL)、硫酸铈铵(10mL)中的三种物质先移入,开动搅拌器,恒温10分钟。
再将剩下的一种物质迅速加入反应皿中,从刚加入时开始采集数据。
观察是否产生振荡,测出振荡周期和诱导时间。
2)反应物浓度对振荡反应的影响在恒温条件以及相同的加入顺序下,分别改变丙二酸、溴酸钾、浓硫酸、硫酸铈铵的浓度(体积用量按4mL,7mL,10mL,13mL,16mL变化,水体积做相应变化),考察诱导时间和振荡周期的变化。
3) 温度对振荡反应的影响固定反应物加入顺序和用量,改变体系的温度(25、30、35、40),考察其对诱导时间和振荡周期的影响。
4)反应机理的探讨改变反应体系的反应物,催化剂,用其它物质替代,观察实验现象,探讨BZ 振荡反应的机理。
用0.45M 顺丁烯二酸代替丙二酸,用0.20M 氯酸钾代替溴酸钾,用硫酸亚铁铵溶液代替硫酸铈铵,用6M 盐酸代替硫酸,分别进行实验,观察是否发生振荡。
2.2注意事项1)在加入最后一项反应物时,注意加到一半开始计时。
2)务必注意使电极被溶液浸没,溶液不够可以加蒸馏水。
3)注意采集作图时峰数要达到4-5 个,作出图和数据才有说服力。
4)加入前三种溶液后,停留7-10 分钟待溶液充分反应且恒温。
5)加入的最后一种溶液要先放置于恒温槽中恒温,防止因其加入引起的温度变化造成对反应过程的影响。
3.结果与讨论1)不同的反应物加入顺序对反应的影响试剂按不同顺序加入,测量得到相应的诱导时间(t)和振荡周期(T)记录如下表:Table 1. 不同的反应物加入顺序对反应的影响加入顺序Group1 Group2 Group31 蒸馏水蒸馏水蒸馏水2 浓硫酸浓硫酸浓硫酸3 溴酸钾溴酸钾丙二酸4 丙二酸硫酸铈铵硫酸铈铵5 硫酸铈铵丙二酸溴酸钾诱导时间t/min 5.686 5.704 5.419振荡周期t/min 1.172 1.179 1.180Fig1. 各组实验顺序下测得的振荡曲线最后加丙二酸最后加溴酸钾最后加硫酸铈铵Fig1的数据显示,不同添加顺序下反应体系的诱导期及平均振荡周期略有变化,但变化不是很明显,其中第一组(最后加硫酸铈铵)的诱导时间最长,振荡周期最短,因此,在以后的实验中将采用第一组的加入顺序进行研究,即蒸馏水、浓硫酸、溴酸钾、丙二酸、硫酸铈铵;图1中的三组图像进一步显示,在上述不同的试剂添加顺序下,体系的振荡行为相似。
2)反应物浓度对振荡反应的影响选用蒸馏水、浓硫酸、溴酸钾、丙二酸、硫酸铈铵的加入顺序,通过控制蒸馏水的体积保持反应体系的总体积不变,采用单变量法逐个改变各反应物的浓度,测得对应的数据及振荡图像如下:Table 2. 硫酸铈铵浓度对振荡周期和诱导时间的影响硫酸铈铵体积/ml 2 5 10 15 18 诱导时间t/min 22.772 9.678 5.647 4.229 3.757 振荡周期t/min0.8661.1011.1601.1061.190Fig 2. 不同硫酸铈铵浓度条件下的振荡曲线Table 3. 丙二酸浓度对振荡周期和诱导时间的影响丙二酸体积/ml 4 7 10 13 16 诱导时间t/min 9.834 6.965 5.647 5.138 4.809 振荡周期t/min1.8231.3751.1600.9940.884Fig 3不同丙二酸浓度条件下的振荡曲线10mL5mL18mL15mL 2mLFig4 溴酸钾浓度对振荡周期和诱导时间的影响溴酸钾体积/ml 4 7 10 13 16 诱导时间t/min 4.905 5.432 5.647 6.106 6.403 振荡周期t/min2.5181.3861.1600.9710.882Table 4 不同溴酸钾浓度条件下的振荡曲线c:\PROGRA~1\N2000\实验二\变浓度实验\溴酸钾\16水 4溴酸钾.org c:\PROGRA~1\N2000\实验二\变浓度实验\溴酸钾\13水 7溴酸钾.org c:\PROGRA~1\N2000\实验二\变浓度实验\溴酸钾\7水 13溴酸钾.org c:\PROGRA~1\N2000\实验二\变浓度实验\溴酸钾\4水 16溴酸钾.orgc:\PROGRA~1\N2000\实验二\顺序实验\最后加硫酸铈铵-巫嘉德.org19181716151413121110987654321940930920910900890880870860850840830820810800790780770760750740730720710700690680670660650640630620610600590580570560550540530图4不同溴酸钾浓度条件下的振荡曲线10mL18mLTable5. 硫酸浓度对振荡周期和诱导时间的影响硫酸体积/ml 4 7 10 13 16 诱导时间t/min 5.303 5.664 5.647 5.913 5.969 振荡周期t/min5.6055.6911.1600.9310.798图5不同硫酸浓度条件下的振荡曲线c:\PROGRA~1\N2000\实验二\变浓度实验\硫酸\16水 4硫酸.org c:\PROGRA~1\N2000\实验二\变浓度实验\硫酸\13水 7硫酸.org c:\PROGRA~1\N2000\实验二\变浓度实验\硫酸\7水 13硫酸.org c:\PROGRA~1\N2000\实验二\变浓度实验\硫酸\4水 16硫酸.orgc:\PROGRA~1\N2000\实验二\顺序实验\最后加硫酸铈铵-巫嘉德.org3231302928272625242322212019181716151413121110987654321980960940920900880860840820800780760740720700680660640620600580560540520500480从上述结果可以看出,物质浓度对诱导期及振荡周期均有影响。
