离子鉴定总结
常见离子的定性鉴定方法完整版

常见离子的定性鉴定方法Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】阳离子的鉴定方法Na+1.取2滴Na+试液,加8滴醋酸铀酰试剂:UO2(Ac)2+Zn(Ac)2+HAc,放置数分钟,用玻璃棒摩擦器壁,淡黄色的晶状沉淀出现,示有Na+:3UO22++Zn2++Na++9Ac-+9H2O=3UO2(Ac)2·Zn(Ac)2·NaAc·9H2O 1.在中性或醋酸酸性溶液中进行,强酸强碱均能使试剂分解。
需加入大量试剂,用玻璃棒摩擦器壁 2.大量K+存在时,可能生成KAc·UO2(Ac)2的针状结晶。
如试液中有大量K+时用水冲稀3倍后试验。
Ag+、Hg2+、Sb3+有干扰, PO43-、AsO43-能使试剂分解,应预先除去μg250μg·g-1(250ppm)+试液与等体积的·L-1KSb(OH)6试液混合,用玻璃棒摩擦器壁,放置后产生白色晶形沉淀示有Na+: Na++Sb(OH)6-= NaSb(OH)6↓ Na+浓度大时,立即有沉淀生成,浓度小时因生成过饱和溶液,很久以后(几小时,甚至过夜)才有结晶附在器壁1. 在中性或弱碱性溶液中进行,因酸能分解试剂 2. 低温进行,因沉淀的溶解度随温度的升高而加剧 3. 除碱金属以外的金属离子也能与试剂形成沉淀,需预先除去K+ 1.取2滴K+试液,加3滴六硝基合钴酸钠(Na3[Co(NO2)6])溶液,放置片刻,黄色的K2Na[Co(NO2)6]沉淀析出,示有K+:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓1. 中性微酸性溶液中进行,因酸碱都能分解试剂中的[Co(NO2)6]3- 2. NH4+与试剂生成橙色沉淀(NH4)2Na[Co(NO2)6]而干扰,但在沸水中加热1~2分钟后(NH4)2Na[Co(NO2)6]完全分解,K2Na[Co(NO2)6]无变化,故可在NH4+浓度大于K+浓度100倍时,鉴定K+4μg80μg·g-1(80ppm)2.取2滴K+试液,加2~3滴·L-1四苯硼酸钠Na[B(C6H5)4]溶液,生成白色沉淀示有K+:K++[B(C6H5)4]- = K[B(C6H5)4]↓1. 在碱性中性或稀酸溶液中进行 2.NH4+有类似的反应而干扰,Ag+、Hg2+的影响可加NaCN消除,当PH=5,若有EDTA存在时,其他阳离子不干扰。
高中化学中常见离子检验方法总结

高中化学中常见离子检验方法总结一、常见阴离子的检验1.阴离子的初步检验①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。
②与BaCl2的作用。
试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。
③与AgNO3HNO3作用。
试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。
⑤还原性阴离子检验a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。
b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。
2.个别鉴定反应⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3Ba2SO42-===BaSO4↓⑵SO32-a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2Ba2SO32-===BaSO3↓BaSO32H===Ba2H2O SO2↑b、加入少量I2-淀粉溶液,蓝色褪去SO32-I2H2O===SO42-2I-2H⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2OAgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O⑷Br-a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。
阴离子鉴定实验报告

一、实验目的通过本实验,掌握常见阴离子的鉴定方法,学会利用化学试剂和仪器对溶液中的阴离子进行鉴定,提高实验操作技能和化学分析能力。
二、实验原理阴离子鉴定实验主要是利用各种阴离子与特定试剂反应产生的颜色变化、沉淀生成、气体产生等现象来识别和鉴定阴离子。
常见的鉴定方法有沉淀反应、颜色反应、气体生成等。
三、实验用品1. 试管:若干2. 试管夹:若干3. 胶头滴管:若干4. 烧杯:若干5. 玻璃棒:若干6. 酚酞试液:1%7. 氢氧化钠溶液:1%8. 氯化钡溶液:1%9. 硫酸钡溶液:1%10. 碳酸钠溶液:1%11. 稀硝酸:1mol/L12. 稀盐酸:1mol/L13. 酒精灯:1个14. 滤纸:若干15. 漏斗(含铁圈):1个四、实验步骤1. 取少量待测溶液于试管中,滴加酚酞试液,观察溶液颜色变化。
2. 若溶液变红,继续滴加稀硝酸,观察红色是否消失。
若红色消失,则可能含有OH-离子。
3. 另取少量待测溶液于试管中,滴加氯化钡溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有CO32-离子。
4. 另取少量待测溶液于试管中,滴加硫酸钡溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有SO42-离子。
5. 另取少量待测溶液于试管中,滴加稀盐酸,观察是否有气体产生。
若有,继续滴加氯化钡溶液,观察是否有白色沉淀生成。
若生成白色沉淀,则可能含有Cl-离子。
6. 另取少量待测溶液于试管中,滴加碳酸钠溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有Ag+离子。
五、实验现象1. 加入酚酞试液后,溶液变红,继续滴加稀硝酸后红色消失,可能含有OH-离子。
2. 加入氯化钡溶液后,生成白色沉淀,继续滴加稀硝酸后沉淀溶解,可能含有CO32-离子。
3. 加入硫酸钡溶液后,生成白色沉淀,继续滴加稀硝酸后沉淀溶解,可能含有SO42-离子。
阴离子鉴定实验报告

阴离子鉴定实验报告阴离子鉴定实验报告引言:阴离子是化学中一类带负电荷的离子,其在化学反应和实验中起着重要的作用。
为了准确鉴定不同的阴离子,我们进行了一系列实验。
本报告将详细介绍实验的目的、原理、实验步骤、结果和结论。
实验目的:本实验的目的是通过一系列实验方法,准确鉴定给定溶液中的阴离子种类。
实验原理:阴离子鉴定主要依靠其与特定试剂反应所产生的沉淀、颜色变化或气体释放等特征。
根据这些特征,我们可以确定阴离子的存在与否。
实验步骤:1. 首先,准备一系列已知阴离子的溶液,如氯离子、硫酸根离子、碳酸根离子等。
2. 取一小部分待测溶液,加入氯化银试剂。
若产生白色沉淀,则表明溶液中存在氯离子。
3. 取另一小部分待测溶液,加入硝酸银试剂。
若产生黄色沉淀,则表明溶液中存在硫酸根离子。
4. 取第三个待测溶液,加入盐酸试剂。
若产生气泡,则表明溶液中存在碳酸根离子。
5. 根据以上实验结果,结合颜色变化、沉淀形成等特征,可以准确鉴定待测溶液中的阴离子种类。
实验结果:通过以上实验步骤,我们得到了以下结果:1. 待测溶液A加入氯化银试剂后,产生白色沉淀,表明溶液A中存在氯离子。
2. 待测溶液B加入硝酸银试剂后,产生黄色沉淀,表明溶液B中存在硫酸根离子。
3. 待测溶液C加入盐酸试剂后,产生气泡,表明溶液C中存在碳酸根离子。
结论:根据实验结果,我们可以得出以下结论:1. 待测溶液A中存在氯离子。
2. 待测溶液B中存在硫酸根离子。
3. 待测溶液C中存在碳酸根离子。
实验的目的是通过一系列实验方法,准确鉴定给定溶液中的阴离子种类。
通过实验步骤,我们成功地鉴定了待测溶液中的氯离子、硫酸根离子和碳酸根离子。
这些实验结果对于进一步的化学分析和研究具有重要意义。
结语:阴离子鉴定实验是化学实验中常见的一种实验方法。
通过实验,我们可以准确鉴定给定溶液中的阴离子种类。
本实验报告详细介绍了实验的目的、原理、步骤、结果和结论。
通过这样的实验,我们可以更好地理解阴离子的特性和鉴定方法,并将其应用于实际化学分析中。
各种离子的鉴定方法

1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3.硫酸根离子:1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)5.氢离子:1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)3)金属氧化物:如带锈的铁钉(铁锈会退去)6.氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7.铁离子:1)溶液中呈淡黄色2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8.亚铁离子:溶液中呈浅绿色9.铜离子:1)溶液中呈蓝色2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10.铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11.钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+ AgI↓Cl2+2I- I2+2Cl-S2-的检验采用试剂:Pb(NO3)2或Pb(Ac)2操作步骤和反应现象:用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象:向被测溶液滴加BaCl2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象:取含SO32-的溶液,滴加HCl溶液(少量)出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+ SO2↑+H2OSO32-+Ba2+ BaSO3↓BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl溶液、Ca(OH)2溶液操作步骤和反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入Ca(OH)2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+ CO2↑+H2OCO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象:在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀HNO3操作步骤和反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+ Ag3PO4↓Ag3PO4+3H+ 3Ag++H3PO4。
各种离子的鉴定方法

1、碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳与水,有气体生成时,所检验物质中就含碳酸根离子了)2、氯离子:用硝酸银与稀硝酸(银离子会与氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3、硫酸根离子:1)用硝酸钡与稀硝酸(钡离子会与硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)2)用稀盐酸与氯化钡(钡离子会与硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会与氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4、银离子:用氯化钠(银离子会与氯离子结合成氯化银,生成沉淀)5、氢离子:1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)3)金属氧化物:如带锈的铁钉(铁锈会退去)6、氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7、铁离子:1)溶液中呈淡黄色2)用氢氧化钠(铁离子与氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8、亚铁离子:溶液中呈浅绿色9、铜离子:1)溶液中呈蓝色2)用氢氧化钠(铜离子会与氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10、铵根离子:用碱与与湿润的红色石蕊试纸(铵根离子与碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11、钡离子:用稀硫酸(钡离子会与硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞与甲基橙操作步骤与反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤与反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤与反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤与反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+ AgI↓Cl2+2I- I2+2Cl-S2-的检验采用试剂:Pb(NO3)2或Pb(Ac)2操作步骤与反应现象:用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤与反应现象:向被测溶液滴加BaCl2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤与反应现象:取含SO32-的溶液,滴加HCl溶液(少量)出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+ SO2↑+H2OSO32-+Ba2+ BaSO3↓BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl溶液、Ca(OH)2溶液操作步骤与反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入Ca(OH)2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+ CO2↑+H2OCO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓H2SO4操作步骤与反应现象:在Cu屑与浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀HNO3操作步骤与反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+ Ag3PO4↓Ag3PO4+3H+ 3Ag++H3PO4。
高中化学中常见离子的分析与鉴定方法总结

高中化学中常见离子的分析与鉴定方法总结化学是一门研究物质组成、性质和变化规律的科学,而离子则是化学反应中不可或缺的重要角色。
在高中化学教学中,学生需要了解常见离子的分析与鉴定方法,以便能够准确判断和分析不同物质中的离子成分。
本文将总结一些常见离子的分析与鉴定方法,帮助学生更好地理解和掌握这一知识点。
一、阳离子的分析与鉴定方法1. 铵离子的分析与鉴定:铵离子是一类带正电荷的离子,常见的有氨根离子(NH4+)。
铵离子可以通过加热试样并用红色湿润的红石蕊试纸接近试样蒸发处,如果试纸变蓝,则可以判断存在铵离子。
2. 钠离子的分析与鉴定:钠离子(Na+)是一种常见的碱金属离子,可以通过火焰试验进行鉴定。
将待测溶液滴在铂丝环上,然后放入蓝色火焰中加热,如果火焰变成黄色,则可以判断存在钠离子。
3. 铜离子的分析与鉴定:铜离子(Cu2+)是一种常见的过渡金属离子,可以通过加入氨水进行鉴定。
当氨水加入含铜离子的溶液中时,溶液会由蓝色变为深蓝色,这是因为铜离子与氨水形成了配合物。
二、阴离子的分析与鉴定方法1. 硫酸根离子的分析与鉴定:硫酸根离子(SO42-)是一种常见的阴离子,可以通过加入钡离子进行鉴定。
当钡离子与硫酸根离子反应时,会生成白色沉淀,这是硫酸钡(BaSO4)的产物。
2. 氯离子的分析与鉴定:氯离子(Cl-)是一种常见的阴离子,可以通过加入银离子进行鉴定。
当银离子与氯离子反应时,会生成白色沉淀,这是氯化银(AgCl)的产物。
3. 碳酸根离子的分析与鉴定:碳酸根离子(CO32-)是一种常见的阴离子,可以通过加入酸进行鉴定。
当碳酸根离子与酸反应时,会产生气体释放,这是因为碳酸根离子分解产生二氧化碳气体。
三、其他离子的分析与鉴定方法1. 硝酸根离子的分析与鉴定:硝酸根离子(NO3-)可以通过加入铁离子进行鉴定。
当硝酸根离子与铁离子反应时,会生成棕色沉淀,这是亚硝酸铁(Fe(NO2)3)的产物。
2. 硫酸根离子的分析与鉴定:硫酸根离子(HSO3-)可以通过加入酸进行鉴定。
几种离子的鉴别方法

几种离子的鉴别方法离子的鉴别方法是化学分析中常用的重要手段之一,可以根据其特定的物理化学性质进行判断和鉴别。
以下介绍几种常见的离子鉴别方法:一、常用的离子鉴别方法之一是溶液的反应性质。
1.阴阳离子的反应鉴别:阴离子通过与阳离子的反应形成沉淀或溶解现象来区分。
例如,将待鉴定离子添加到已知阳离子的溶液中,观察是否出现沉淀现象,通过沉淀的形成、颜色、形态等特征来判断鉴定离子的种类。
2.气体的反应鉴别:一些离子在接触特定的试剂时,会产生气体。
例如,CO3^2-与酸反应产生CO2气体,通过检测气体的产生来鉴别CO3^2-离子。
3.氧化还原反应鉴别:一些离子在氧化还原反应中具有特殊的性质。
例如,Fe3+在还原条件下可以被还原为Fe2+,通过观察颜色的变化来鉴别Fe3+离子。
二、离子鉴别的另一种方法是通过离子的酸碱性质进行鉴定。
1.酸碱反应鉴别:根据酸碱滴定的原理,向待鉴定离子溶液中逐滴加入已知浓度的酸或碱,通过观察溶液的酸碱指示剂的颜色变化,确定待鉴定离子的酸碱性质。
2.氢氧化物的沉淀鉴别:一些阳离子与氢氧化物反应时会生成沉淀。
例如,溴化铵试剂可以与Ba2+、Pb2+形成沉淀,通过沉淀的特征来鉴别阳离子的种类。
三、光谱分析是离子鉴别的又一重要方法。
1.紫外可见光谱:一些离子在紫外可见光谱中具有特定的吸收和发射特征,通过检测溶液在紫外可见光谱下的吸收曲线或发射光谱特征来鉴定离子。
2.火焰光谱:通过加热一些元素或化合物的溶液,利用其产生的特定颜色的火焰光谱线来鉴别元素或离子的种类。
3.原子吸收光谱:通过测量溶液中特定离子在特定波长处光的吸收程度,从而确定溶液中对应离子的浓度或存在状态。
以上是几种常见的离子鉴别方法,通过这些方法,在化学分析实验中可以根据不同离子的特性进行鉴定和分析。
离子鉴定方法

离子鉴定方法离子鉴定方法Cl-在含有氯离子的溶液中加入AgNO3溶液,立即生成白色AgCl沉淀。
沉淀不溶于稀硝酸和其它无机酸中,而易溶于氨水和(NH4)2CO3溶液。
Ag+ + Cl- ===AgCl(沉淀)AgCl+2NH3.H2O===[Ag(NH3)2]ClBr-方法一:加入AgNO3溶液,有溴离子存在,即生成淡黄色AgBr沉淀,沉淀不溶于硝酸和(NH4)2CO3溶液,只是部分溶于氨水。
Br- + Ag+===AgBr(沉淀)方法二:加入氯水,再加入氯仿,摇荡,氯仿层显黄色或红棕色,且加入淀粉试剂不变蓝,示有Br-。
2Br- + Cl2===2Cl- + Br2SCN-加入FeCl3溶液1-2滴,有硫氰化物,溶液出现血红色。
3SCN- + Fe3+===Fe(SCN)3S2-方法一:硫化物与稀酸作用放出H2S气体,有臭鸡蛋气味,并能使乙酸铅试纸出现黑色。
S2- + 2H+===H2S(气体)H2S + Pb(Ac)2===2HAc + PbS(沉淀)方法二:硫化物与某些金属离子作用,产生不同颜色的沉淀。
S2- + Cd2+===CdS(沉淀) (黄色)S2- + Mn2+===MnS(沉淀) (粉红色)S2- + Zn2+===ZnS(沉淀) (白色)SO42-方法一:硫酸盐遇可溶性钡盐,生成白色沉淀BaSO4,不溶于酸。
氟离子和氟硅酸根离子对此有干扰。
SO42- + Ba2+===BaSO4(沉淀)方法二:在硫酸盐溶液中加入Pb(Ac)2,即生成白色沉淀,能在NaOH溶液和NH4Ac中溶解。
SO42- + Pb(Ac)2===2Ac- + PbSO4(沉淀)PbSO4 + 3OH-===HPbO2- + H2O + SO42-PbSO4 + 4Ac-===[Pb(Ac)4]2- + SO42-Ba2+钡盐溶液遇硫酸,即生成不溶于酸的白色沉淀。
Ba2+ + SO42-===BaSO4(沉淀)Fe3+三价铁盐遇硫氰化物溶液,能生成血红色Fe(SCN)3。
各种离子的鉴定方法

各种离子的鉴定方法集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3.硫酸根离子:1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)5.氢离子:1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)3)金属氧化物:如带锈的铁钉(铁锈会退去)6.氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7.铁离子:1)溶液中呈淡黄色2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8.亚铁离子:溶液中呈浅绿色9.铜离子:1)溶液中呈蓝色2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10.铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11.钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+ AgI↓Cl2+2I- I2+2Cl-S2-的检验采用试剂:Pb(NO3)2或Pb(Ac)2操作步骤和反应现象:用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象:向被测溶液滴加BaCl2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象:取含SO32-的溶液,滴加HCl溶液(少量)出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+ SO2↑+H2OSO32-+Ba2+ BaSO3↓BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl溶液、Ca(OH)2溶液操作步骤和反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入Ca(OH)2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+ CO2↑+H2OCO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象:在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀HNO3操作步骤和反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+ Ag3PO4↓Ag3PO4+3H+ 3Ag++H3PO4。
高二离子检验知识点归纳总结

高二离子检验知识点归纳总结离子检验是化学实验中的一项重要内容,通过特定的试剂和反应条件,可以对离子溶液中的阳离子和阴离子进行检验和鉴定。
本文将对高二离子检验的知识点进行归纳总结,以便帮助同学们更好地掌握相关内容。
一、阳离子的检验1. 铵离子(NH4+)检验铵离子的常见检验方法有氯铵试验、氢氧化铜试验和铂纸试验等。
其中,氯铵试验是最常用的检验方法。
当氯铵试液与铵离子存在时,会产生白色烟雾。
2. 钠离子(Na+)检验钠离子的常见检验方法有火焰试验和红外光谱分析等。
火焰试验是一种简便的方法,当钠离子存在时,在钠盐试样中加热后,火焰呈现出黄色。
3. 铜离子(Cu2+)检验铜离子的常见检验方法有氢氧化钠试验和氨水试验等。
氢氧化钠试验是常用的方法,当铜离子与氢氧化钠溶液反应时,生成蓝色沉淀。
4. 铁离子(Fe2+和Fe3+)检验铁离子的检验方法有硫氰酸盐试验、硫化氢试验和硝酸盐试验等。
硫氰酸盐试验是最常用的方法,当铁离子与硫氰酸钾溶液反应时,生成红色沉淀。
5. 铅离子(Pb2+)检验铅离子的常见检验方法有碘盐试验和硫化氢试验等。
碘盐试验是一种简单的方法,当铅离子与碘化钠试液反应时,会生成黄色沉淀。
二、阴离子的检验1. 碳酸根离子(CO32-)检验碳酸根离子的常见检验方法有盐酸试验和酸性硅酸钠试验等。
盐酸试验是最常用的方法,当碳酸根离子与盐酸反应时,会产生气泡。
2. 硫酸根离子(SO42-)检验硫酸根离子的常见检验方法有钡盐试验和银盐试验等。
钡盐试验是最常用的方法,当硫酸根离子与氯化钡溶液反应时,会生成白色沉淀。
3. 氯离子(Cl-)检验氯离子的常见检验方法有硝酸银试验和亚硝酸银试验等。
硝酸银试验是最常用的方法,当氯离子与硝酸银溶液反应时,会生成白色沉淀。
4. 硝酸根离子(NO3-)检验硝酸根离子的常见检验方法有铁离子试验和银离子试验等。
铁离子试验是一种简单的方法,当硝酸根离子与亚铁离子反应时,会生成棕褐色沉淀。
高中化学离子检验总结

高中化学离子检验总结前言离子检验是高中化学实验中非常重要的内容之一。
通过离子检验,我们可以准确地鉴定不同离子的存在与否,从而帮助我们确定未知物质的组成。
在进行离子检验实验时,我们需要熟悉不同离子的特性和检验方法,以及实验中常用的反应方程式。
本文将对常见的离子检验方法进行总结,帮助同学们更好地进行离子检验实验。
阳离子的检验铵离子铵离子是一类氨基阳离子,常见的有NH4+。
我们可以通过加入碱溶液,例如NaOH溶液,在产生氨气的同时,将溶液浓度较小的酸酸化,出现白烟的特性来判断铵离子的存在。
反应方程式:NH4+ + NaOH → NH3↑ + H2O钠离子钠离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钠离子存在时,会发出明亮的黄色光。
沉淀法将待测溶液加入氯化银溶液(AgNO3),如果出现白色沉淀,则表明溶液中含有钠离子。
反应方程式:Na+ + AgNO3 → AgCl↓ + NaNO3钾离子钾离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钾离子存在时,会发出紫色光。
钡氯化物法将待测溶液加入氯化钡溶液(BaCl2),如果出现白色沉淀,则表明溶液中含有钾离子。
反应方程式:2 K+ + BaCl2 → 2 KCl + Ba↓阴离子的检验硝酸根离子硝酸根离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
铁氰化钾法将待测溶液加入铁氰化钾溶液(K4[Fe(CN)6]),如果出现深蓝色溶液或沉淀,则表明溶液中含有硝酸根离子。
反应方程式:NO3- + 3 K4[Fe(CN)6] → KNO3 + K[Fe(CN)6]↓氯离子氯离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
银镜反应法将待测溶液加入硝酸银溶液(AgNO3),如果溶液变黑或出现黑色沉淀,则表明溶液中含有氯离子。
离子鉴定实验报告

一、实验目的1. 理解并掌握常见阳离子和阴离子的鉴定原理和方法。
2. 通过实验操作,学会正确使用实验仪器和试剂。
3. 培养观察、记录、分析和解决问题的能力。
二、实验原理在无机化学中,离子鉴定是研究无机化合物的重要手段。
根据不同离子的特性,我们可以采用一系列特定的试剂和方法来鉴定它们。
常见的鉴定方法包括沉淀反应、颜色反应、气体产生反应等。
三、实验器材与试剂1. 实验器材:试管、试管架、滴管、酒精灯、烧杯、石棉网、玻璃棒、pH试纸等。
2. 试剂:NaCl、KNO3、BaCl2、AgNO3、HCl、NaOH、NH4OH、H2SO4、Na2CO3、FeCl3、K2CrO4、CuSO4、FeSO4、Na2S等。
四、实验步骤1. 鉴定Na+、K+- 取少量待测液于试管中,加入少量稀硝酸酸化。
- 滴加少量AgNO3溶液,观察是否产生白色沉淀。
- 若产生白色沉淀,则可能含有Na+、K+。
2. 鉴定Cl-、Br-、I-- 取少量待测液于试管中,加入少量稀硝酸酸化。
- 滴加少量AgNO3溶液,观察是否产生白色沉淀。
- 若产生白色沉淀,则可能含有Cl-。
- 若产生浅黄色沉淀,则可能含有Br-。
- 若产生黄色沉淀,则可能含有I-。
3. 鉴定SO42-- 取少量待测液于试管中,加入少量稀盐酸酸化。
- 滴加少量BaCl2溶液,观察是否产生白色沉淀。
- 若产生白色沉淀,则可能含有SO42-。
4. 鉴定CO32-- 取少量待测液于试管中,加入少量稀盐酸。
- 观察是否有气泡产生。
- 若有气泡产生,则可能含有CO32-。
5. 鉴定Fe2+、Fe3+- 取少量待测液于试管中,加入少量KSCN溶液。
- 观察溶液颜色变化。
- 若溶液变红,则可能含有Fe3+。
- 若溶液无明显变化,则可能含有Fe2+。
6. 鉴定Cu2+- 取少量待测液于试管中,加入少量NaOH溶液。
- 观察是否产生蓝色沉淀。
- 若产生蓝色沉淀,则可能含有Cu2+。
五、实验结果与分析通过上述实验步骤,我们可以鉴定出待测液中的常见阳离子和阴离子。
离子鉴定

高考中涉及物质检验的题目几乎每年都有,离子检验更是重中之重,关于高中化学常见的离子检验,你掌握了多少呢?(1)Na+:实验操作:首先将铂丝用盐酸(不能用硫酸,原因:硫酸是高沸点难挥发性酸.加热后不似盐酸易挥发且硫酸盐大多不易挥发,不能很好的达到完全清洗铂丝的目的,影响焰色反应现象)洗净后在火焰上灼烧至原火焰色相同,然后蘸取待测液,放在火焰上灼烧,观察火焰颜色。
实验现象:火焰呈黄色检验原理:焰色反应(物理变化)扩展:K+的检验方法与Na+类似,不同点是需透过蓝色钴玻璃观察,以排除Na+的干扰,可观察到淡紫色火焰。
(2)NH4+:实验操作:取少量待测溶液于试管中,加入NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口。
实验现象:加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体实验的原理:强碱制备弱碱扩展:也可将蘸有浓盐酸的玻璃棒置于试管口,若观察到有白烟生成,则含有NH4+,反应原理:HC l+ NH3 =NH4Cl。
(3)Fe3+:方法一:取少量待测溶液于试管中,加入KSCN溶液,若溶液变红色(注意:不是红色沉淀),则说明溶液中有Fe3+。
实验原理:Fe3++3SCN-=Fe(SCN)3方法二:取少量待测溶液于试管中,加苯酚,若溶液变为紫色,则说明溶液中有Fe3+(苯酚的显色反应)。
方法三:取少量待测溶液于试管中,加NaOH溶液,若出现红褐色沉淀,则说明溶液中有Fe3+(Fe3++3OH-=Fe(OH)3↓)。
方法四:加入亚铁氰化钾(K4Fe(CN)6)产生蓝色沉淀。
(4)Fe2+:方法一:取少量待测溶液于试管中,先加入KSCN溶液,再加入新制的氯水。
实验现象:加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色实验原理:2Fe2++ Cl2=2Fe3++ 2Cl-,Fe3++3SCN-=Fe(SCN)3方法二:加入NaOH溶液,先产生白色沉淀,然后迅速变成灰绿色,最后变为红褐色。
方法三:加入铁氰化钾溶液(K3[Fe(CN)6]),产生蓝色沉淀。
常见离子的定性鉴定方法
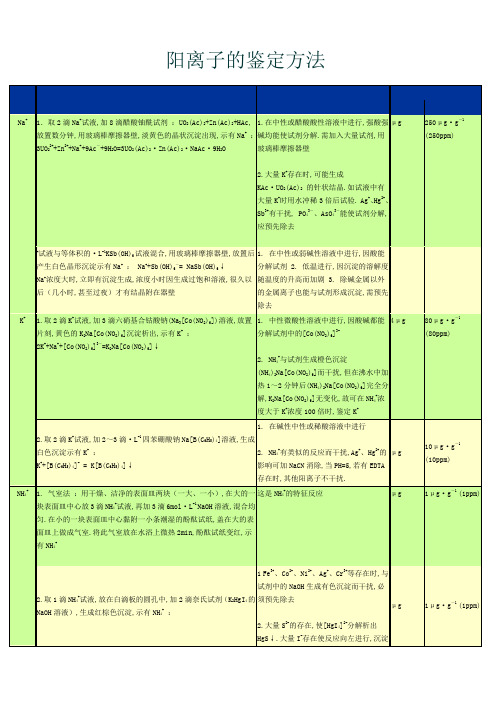
阳离子的鉴定方法或 NH4++OH-=NH3+H2ONH4+浓度低时,没有沉淀产生,但溶液呈黄色或棕色溶解Mg2+ 1.取2滴Mg2+试液,加2滴2mol·L-1NaOH溶液,1滴镁试剂(Ⅰ),沉淀呈天蓝色,示有Mg2+ .对硝基苯偶氮苯二酚俗称镁试剂(Ⅰ),在碱性环境下呈红色或红紫色,被Mg(OH)2吸附后则呈天蓝色.1. 反应必须在碱性溶液中进行,如[NH4+]过大,由于它降低了[OH-].因而妨碍Mg2+的捡出,故在鉴定前需加碱煮沸,以除去大量的NH4+2. Ag+、Hg22+、Hg2+、Cu2+、Co2+、Ni2+、Mn2+、Cr3+、Fe3+及大量Ca2+干扰反应,应预先除去μg10μg·g-1(10ppm)2.取4滴Mg2+试液,加2滴6mol·L-1氨水,2滴2mol·L-1(NH4)2HPO4溶液,摩擦试管内壁,生成白色晶形MgNH4PO4·6H2O沉淀,示有Mg2+:Mg2++HPO42-+NH3·H2O+ 5H2O=MgNH4PO4·6H2O↓1. 反应需在氨缓冲溶液中进行,要有高浓度的PO43-和足够量的NH4+2. 反应的选择性较差,除本组外,其他组很多离子都可能产生干扰30μg10μg·g-1(10ppm)Ca2+ 1.取2滴Ca2+试液,滴加饱和(NH4)2C2O4溶液,有白色的CaC2O4沉淀形成,示有Ca2+1. 反应在HAc酸性、中性、碱性中进行2. Mg2+、Sr2+、Ba2+有干扰,但MgC2O4溶于醋酸,CaC2O4不溶,Sr2+、Ba2+在鉴定前应除去1μg40μg·g-1(40ppm)2.取1~2滴Ca2+试液于一滤纸片上,加1滴6mol·L-1NaOH,1滴GBHA.若有Ca2+存在时,有红色斑点产生,加2滴Na2CO3溶液不褪,示有Ca2+乙二醛双缩[2-羟基苯胺]简称GBHA,与Ca2+在PH=12~的溶液中生成红色螯合物沉淀:1. Ba2+、Sr2+在相同条件下生成橙色、红色沉淀,但加入Na2CO3后,形成碳酸盐沉淀,螯合物颜色变浅,而钙的螯合物颜色基本不变2. Cu2+、Cd2+、Co2+、Ni2+、Mn2+、UO22+等也与试剂生成有色螯合物而干扰,当用氯仿萃取时,只有Cd2+的产物和Ca2+的产物一起被萃取μg1μg·g-1 (1ppm)Ba2+ 1.取2滴Ba2+试液,加1滴·L-1K2CrO4溶液,有BaCrO4黄色沉淀生成,示有Ba2+在HAc-NH4Ac缓冲溶液中进行反应μg70μg·g-1(70ppm)Al3+ 1.取1滴Al3+试液,加2~3滴水,加2滴3mol·L-1NH4Ac,2滴铝试剂,搅拌,微热片刻,加6mol·L-1氨水至碱性,红色沉淀不消失,示有Al3+:1. 在HAc-NH4Ac的缓冲溶液中进行2. Cr3+、Fe3+、Bi3+、Cu2+、Ca2+等离子在HAc缓冲溶液中也能与铝试剂生成红色化合物而干扰,但加入氨水碱化后,Cr3+、Cu2+的化合物即分解,加入(NH4)2CO3,可使Ca2+的化合物生成CaCO3而分解,Fe3+、Bi3+(包括Cu2+)可预先加NaOH形成沉淀而分离μg2μg·g-1 (2ppm)2.取1滴Al3+试液,加1mol·L-1NaOH溶液,使Al3+以AlO2-的形式存在,加1滴茜素磺酸钠溶液(茜素S),滴加HAc,直至紫色刚刚消失,过量1滴则有红色沉淀生成,示有Al3+.或取1滴Al3+试液于滤纸上,加1滴茜素磺酸钠,用浓氨水熏至出现桃红色斑,此时立即离开氨瓶.如氨熏时间长,则显茜素S的紫色,可在石棉网上,用手拿滤纸烤一下,则紫色褪去,现出红色:1. 茜素磺酸钠在氨性或碱性溶液中为紫色,在醋酸溶液中为黄色,在pH=5~介质中与Al3+生成红色沉淀2. Fe3+,Cr3+,Mn2+及大量Cu2+有干扰,用K4[Fe(CN)6]在纸上分离,由于干扰离子沉淀为难溶亚铁氰酸盐留在斑点的中心,Al3+不被沉淀,扩散到水渍区,分离干扰离子后,于水渍区用茜素磺酸钠鉴定Al3+g3g·g-1 (3ppm)Cr3+ 1.取3滴Cr3+试液,加6mol·L-1NaOH溶液直到生成的沉淀溶解,搅动后加4滴3%的H2O2,水浴加热,溶液颜色由绿变黄,继续加热直至剩余的H2O2分解完,冷却,加6mol·L-1HAc酸化,加2滴·L-1Pb(NO3)2溶液,生成黄色PbCrO4沉淀,示有Cr3+:1. 在强碱性介质中,H2O2将Cr3+氧化为CrO42-Cr3+ + 4OH- == CrO2- + 2H2O2CrO2- + 3H2O2 + 2OH- == 2CrO42- + 4H2O Pb2+ + CrO42-== PbCrO4↓2. 形成PbCrO4的反应必须在弱酸性(HAc)溶液中进行2.按1法将Cr3+氧化成CrO42-,用2mol·L-1H2SO4酸化溶液至pH=2~3,加入戊醇、%H2O2,振荡,有机层显蓝色,示有Cr3+:Cr2O72- + 4H2O2 +2H+ == 2H2CrO6 + 3H2O 1. pH<1,蓝色的H2CrO6分解2. H2CrO6在水中不稳定,故用戊醇萃取,并在冷溶液中进行,其他离子无干扰g50g·g-1 (50ppm)Fe3+1.取1滴Fe3+试液放在白滴板上,加l滴K4[Fe(CN)6]溶液,生成蓝色沉淀,示有Fe3+1.K4[Fe(CN)6]不溶于强酸,但被强碱分解生成氢氧化物,故反应在酸性溶液中进行.2.其他阳离子与试剂生成的有色化合物的颜色不及Fe3+的鲜明,故可在其他离子存在时鉴定Fe3+,如大量存在Cu2+、Co2+、Ni2+等离子,也有干扰,分离后再作鉴定.g1g·g-1 (1ppm)2.取l滴Fe3+试液,加1滴·L-1NH4SCN溶液,形成红色溶液示有Fe3+.1.在酸性溶液中进行,但不能用HNO3.2.F-、H3PO4、H2C2O4、酒石酸、柠檬酸以及含有- 或 -羟基的有机酸都能与Fe3+形成稳定的配合物而干扰.溶液中若有大量汞盐,由于形成[Hg(SCN)4]2-而干扰,钴、镍、铬和铜盐因离子有色,或因与SCN-的反应产物的颜色而降低检出Fe3+的灵敏度.g5g·g-1 (5ppm)Fe2+1.取l滴Fe2+试液在白滴板上,加l滴K3[Fe(CN)6]溶液,出现蓝色沉淀,示有Fe2+.1.本法灵敏度、选择性都很高,仅在大量重金属离子存在而[Fe2+]很低时,现象不明显; 2反应在酸性溶液中进行.g2g·g-1 (2ppm)2.取l滴Fe2+试液,加几滴·L-1的邻菲罗琳溶液,生成桔红色的溶液,示有Fe2+. 1.中性或微酸性溶液中进行;2.Fe3+生成微橙黄色,不干扰,但在Fe3+、Co2+同时存在时不适用.10倍量的Cu2+、40倍量的Co2+、140倍量的C2O42-、6倍量的CN-干扰反应;3.此法比1法选择性高;4.如用1滴NaHSO3先将Fe3+还原,即可用此法检出Fe3+.g g·g-1Mn2+取l滴Mn2+试液,加10滴水,5滴2mol·L-1HNO3溶液,然后加固体NaBiO3,搅拌,水浴加热,形成紫色溶液,示有Mn2+.1. 在HNO3或H2SO4酸性溶液中进行;2.本组其他离子无干扰;g16g·g-1 (16ppm)3.还原剂(Cl-、Br-、I-、H2O2等)有干扰.Zn2+1.取2滴Zn2+试液,用2mol·L-l HAc酸化,加等体积(NH4)2Hg(SCN)4溶液,摩擦器壁,生成白色沉淀,示有Zn2+: Zn2+ + Hg(SCN)42- == ZnHg(SCN)4↓或在极稀的CuSO4溶液(<·L-1)中,加(NH4)2Hg(SCN)4溶液,加Zn2+试液,摩擦器壁,若迅速得到紫色混晶,示有Zn2+也可用极稀的CoCl2(<·L-1)溶液代替Cu2+溶液,则得蓝色混晶.1.在中性或微酸性溶液中进行;2.Cu2+形成CuHg(SCN)4黄绿色沉淀,少量Cu2+存在时,形成铜锌紫色混晶更有利于观察;3.少量Co2+存在时,形成钴锌蓝色混晶,有利于观察;4.Cu2+、Co2+含且大时干扰,Fe3+有干扰.形成铜锌混晶时g10g·g-1 (10ppm)2.取2滴Zn2+试液,调节溶液的pH=l0,加4滴TAA,加热,生成白色沉淀,沉淀不溶于HAc,溶于HCl,示有Zn2+.铜锡组、银组离子应预先分离,本组其它离子也需分离.Co2+1.取1~2滴Co2+试液,加饱和NH4SCN溶液,加5~6滴戊醇溶液,振荡,静置,有机层呈蓝绿色,示有Co2+.1.配合物在水中解离度大,故用浓NH4SCN溶液,并用有机溶剂萃取,增加它的稳定性;2.Fe3+有干扰,加NaF掩蔽.大量Cu2+也干扰.大量Ni2+存在时溶液呈浅蓝色,干扰反应.g10g·g-1 (10ppm)2.取1滴Co2+试液在白滴板上,加l滴钴试剂,有红褐色沉淀生成,示有Co2+.钴试剂为-亚硝基--萘酚,有互变异构体,与Co2+形成螯合物,Co2+转变为Co3+是由于试剂本身起着氧化剂的作用,也可能发生空气氧化.1.中性或弱酸性溶液中进行,沉淀不溶于强酸;2.试剂须新鲜配制;3.Fe3+与试剂生成棕黑色沉淀,溶于强酸,它的干扰也可加Na2HPO4掩蔽,Cu2+、Hg2+及其他金属干扰.g10g·g-1 (10ppm)Ni2+取l滴Ni2+试液放在白滴板上,加1滴6mol·L-l氨水,加1滴丁二酮肟,稍等片刻,在凹槽四周形成红色沉淀示有1.在氨性溶液中进行,但氨不宜太多.沉淀溶于酸、强碱,故合适的酸度pH=5~10;2.Fe2+、Pd2+、Cu2+、Co2+、Fe3+、Cr3+、Mn2+等干扰,可事先把Fe2+氧化成Fe3+,加柠檬酸或酒石酸掩蔽Fe3+和其他离子.g3g·g-1 (3ppm)Ni2+.Cu2+1.取l滴Cu2+试液,加1滴6mol·L-1HAc酸化,加l滴K4[Fe(CN)6]溶液,红棕色沉淀出现,示有Cu2+2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓1.在中性或弱酸性溶液中进行.如试液为强酸性,则用3mol·L-1NaAc调至弱酸性后进行.沉淀不溶于稀酸,溶于氨水,生成Cu(NH3)42+,与强碱生成Cu(OH)2;2.Fe3+以及大量的Co2+、Ni2+会干扰.g g·g-12.取2滴Cu2+试液,加吡啶(C5H5N)使溶液显碱性,首先生成Cu(OH)2沉淀,后溶解得[Cu(C5H5N)2]2+的深蓝色溶液,加几滴·L-1NH4SCN溶液,生成绿色沉淀,加氯仿,振荡,得绿色溶液,示有Cu2+:Cu2+ + 2SCN-+2C5H5N =[Cu(C5H5N)2(SCN)2]↓250g·g-1 (250ppm)Pb2+取2滴Pb2+试液,加2滴·L-1K2CrO4溶液,生成黄色沉淀,示有Pb2+.1.在HAc溶液中进行,沉淀溶于强酸,溶于碱则生成PbO22-;2.Ba2+、Bi3+、Hg2+、Ag+等干扰20g250g·g-1(250ppm)Hg2+1.取l滴Hg2+试液,加1 mol·L-1KI溶液,使生成沉淀后又溶解,加2滴KI-Na2SO3溶液,2~3滴Cu2+溶液,生成桔黄色沉淀,示有Hg2+: Hg2+ + 4I-= HgI42-2Cu2+ + 4I-=2CuI↓+I22CuI+HgI42-= Cu2HgI4 + 2I-反应生成的I2由Na2SO3除去.1.Pd2+因有下面的反应而干扰:2CuI+Pd2+ = PdI2+ 2Cu+产生的PdI2使CuI变黑;2.CuI是还原剂,须考虑到氧化剂的干扰(Ag+、Hg22+、Au3+、Pt IV、Fe3+、Ce IV等).钼酸盐和钨酸盐与Cul反应生成低氧化物(钼蓝、钨蓝)而干扰.g1g·g-1 (1ppm)2.取2滴Hg2+试液,滴加mol·L-1SnCl2溶液,出现白色沉淀,继续加过量SnCl2,不断搅拌,放置2~3min,出现灰色沉淀,示有Hg2+.1.凡与Cl-能形成沉淀的阳离子应先除去;2.能与SnCl2起反应的氧化剂应先除去;3.这一反应同样适用于Sn2+的鉴定.5g200g·g-1(200ppm)阴离子的鉴定方法沉淀,用玻璃棒摩擦器壁,放置片刻,析出白色晶状沉淀MgNH4PO4,示有PO43-淀能溶于酸,但碱性太强可能生成Mg(OH)2沉淀生成相似的沉淀(MgNH4AsO4),浓度不太大时不生成2.取2滴PO43-试液,加入8~10滴钼酸铵试剂,用玻璃棒摩擦器壁,黄色磷钼酸铵生成,示有PO43-PO43-+3NH4++12MoO42-+24H+= (NH4)3PO4·12 MoO3·6H2O↓+6H2O 1.沉淀溶于过量磷酸盐生成配阴离子,需加入大量过量试剂,沉淀溶于碱及氨水中2.还原剂的存在使MoⅥ还原成“钼蓝”而使溶液呈深蓝色.大量Cl-存在会降低灵敏度,可先将试液与浓HNO3一起蒸发.除去过量Cl-和还原剂有类似的反应.SiO32-也与试剂形成黄色的硅钼酸,加酒石酸可消除干扰4.与P2O74-、PO3-的冷溶液无反应,煮沸时由于PO43-的生成而生成黄色沉淀3μg40μg·g-1(40ppm)Cl-取2滴Cl-试液,加6mol·L-1HNO3酸化,加·L-1AgNO3至沉淀完全,离心分离.在沉淀上加5~8滴银氨溶液,搅动,加热,沉淀溶解,再加6mol·L-1HNO3酸化,白色沉淀重又出现,示有Cl-Br-取2滴Br-试液,加入数滴CCl4,滴入氯水,振荡,有机层显红棕色或金黄色,示有Br-如氯水过量,生成BrCl,使有机层显淡黄色50μg50μg·g-1(50ppm)I- 1.取2滴I-试液,加入数滴CCl4,滴加氯水,振荡,有机层显紫色,示有I- 1.在弱碱性、中性或酸性溶液中,氯水将I-→I22.过量氯水将I2→IO3-,有机层紫色褪去40μg40μg·g-1(40ppm)2.在I-试液中,加HAc酸化,加·L-1NaNO2溶液和CCl4,振荡,有机层显紫色,示有I-Cl-、Br-对反应不干扰μg50μg·g-1(50ppm)NO2- 1.取1滴NO2-试液,加6mol·L-1HAc酸化,加1滴对氨基苯磺酸,1滴α-萘胺,溶液显红紫色,示有NO2-1. 反应的灵敏度高,选择性好2. NO2-浓度大时,红紫色很快褪去,生成褐色沉淀或黄色溶液μgμg·g-12.同I-的鉴定方法2.试液用醋酸酸化,加·L-1KI和CCl4振荡,有机层显红紫色,示有NO2-NO3- 1.当NO2-不存在时,取3滴NO3-试液,用6mol·L-1HAc酸化,再加2滴,加少许镁片搅动,NO3-被还原为 NO2-,取2滴上层溶液,照NO2-的鉴定方法进行鉴定2.当NO2-存在时,在12mol·L-1H2SO4溶液中加入α-萘胺,生成淡红紫色化合物,示有NO3-3.棕色环的形成:在小试管中滴加10滴饱和FeSO4溶液,5滴NO3-试液,然后斜持试管,沿着管壁慢慢滴加浓H2SO4,由于浓H2SO4密度比水大,沉到试管NO2-、Br-、I-、CrO42-有干扰,Br-、I-可用AgAc除去,CrO42-用Ba(Ac)2μg40μg·g-1(40ppm)。
离子的鉴定阳离子的鉴定

离子的鉴定阳离子的鉴定一、铵离子的鉴定铵离子的鉴定之一[原理] 铵盐跟碱反应,生成氨气,这是铵盐的共性NH4++OH—==NH3↑+ H2O[用品] 表面皿、铵盐溶液、6mol/L氢氧化钠溶液、红色石蕊试纸[操作]在表面皿的中央滴几滴铵盐溶液,再滴加6mol/L氢氧化钠溶液到碱性。
混均匀后用沾有红色湿润石蕊试纸的表面皿覆盖,放在水浴中微热,石蕊试纸变成蓝色,说明原溶液里有NH4+。
铵离子的鉴定之二[原理] NH3与奈斯勒试剂(K2HgI4)反应,生成橙黄或红棕色(依NH3含量多少)沉淀,NH4+在强碱条件下,能生成NH3。
[用品] 滤纸、毛细吸管、滴管、奈斯勒试剂、10%NaOH溶液[操作]在滤纸片上滴一滴10%NaOH溶液,待液滴渗入滤纸中后,再加一滴试液,使其发生沉淀并等待液滴渗入滤纸中。
用毛细吸管沾少量水垂直放在斑点中心,将NH4+扩散到周围,在外围的水渍区上加K2HgI4溶液一滴,黄橙或红棕色斑点证明NH4+的存在。
[备注] 本法可检出0.3μg(微克)的NH4+。
二、钠离子的鉴定钠离子的鉴定之一[原理] 钠离子的焰色反应为黄色[用品] 试管或点滴盘、铂丝环、煤气灯或酒精灯、1∶1盐酸、蒸馏水[操作] 取试液1滴于试管中,加1∶1盐酸2滴,用约1mL水稀释,以铂丝环沾取进行焰色反应,浓烈的黄色火焰表示Na+存在。
[备注]此反应的灵敏度很大,0.0001μg(微克)的Na+就会使火焰呈浅黄色,因此盐酸、蒸馏水及其它试剂中的微量Na+都有反应,必须做空白试验,并火焰的黄色要浓烈,才能确定Na+的存在。
钠离子的鉴定之二[原理] 锑酸根离子[Sb(OH)6]—和Na+作用,会有白色晶状的锑酸钠沉淀出现Na[Sb(OH)6]。
Na++[Sb(OH)6]—=Na[Sb(OH)6]↓利用这种性质可以检验Na+的存在。
[用品] 试管、试管架、滴管、玻璃棒、0.5mol·L—1NaCl溶液、0.1mol·L—1K[Sb(OH)6]溶液。
