初三化学__化学反应方程式练习[1]
初三化学九下反应方程式所有知识点总结和常考题型练习题

初三化学九下反应方程式所有知识点总结和常考题型练习题一、知识点总结1. 反应方程式的定义和组成部分- 反应方程式是描述化学反应的化学方程式,由反应物、生成物、反应条件和反应箭头组成。
2. 反应方程式的平衡原则- 反应方程式中的原子数目在反应前后保持不变。
3. 反应物和生成物的表示方法- 反应物和生成物可以用化学式或化学名来表示。
4. 反应方程式的平衡调整- 对不平衡的反应方程式,通过调整系数使得反应前后的原子数目平衡。
5. 氧化还原反应方程式的表示- 氧化还原反应方程式通过电子的转移来表示反应过程。
二、常考题型练题1. 平衡下列反应方程式,并指出反应类型:- 铁与氧气反应生成氧化铁:2Fe + 3O2 → 2Fe2O3(合成反应)2. 平衡下列反应方程式,并指出反应类型:- 碘化钠与氯化银反应生成氯化钠和碘:2NaI + AgCl → 2NaCl + I2(置换反应)3. 以下哪个是氧化还原反应方程式:- A. HCl + NaOH → NaCl + H2O- B. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag- C. Zn + HCl → ZnCl2 + H2- D. Fe2O3 + 3CO → 2Fe + 3CO2答案:B4. 平衡下列反应方程式,并指出反应类型:- 硫化铁与氧气反应生成二氧化硫和三氧化二铁:4FeS2 +11O2 → 8SO2 + 2Fe3O4(合成反应)5. 平衡下列反应方程式,并指出反应类型:- 碳酸钙热分解生成氧气和碳酸钙:CaCO3 → CaO + CO2(分解反应)总结:初三化学九下反应方程式的知识点包括反应方程式的定义、组成部分、平衡原则、表示方法以及氧化还原反应方程式。
在复过程中,常见的考题类型包括平衡反应方程式和识别反应类型。
通过不断练和巩固,我们能够更好地理解和掌握反应方程式的相关知识。
初三化学方程式配平经典练习题(含答案)

初三化学方程式配平练习一化学方程式的基础知识:1化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):点燃点燃(1)P+O2P2O5(2)C+O2CO点燃点燃(3)Al+O2Al2O3(4)Fe+O2Fe3O4点燃M nO2H2O+O2↑(5)Mg+O2MgO(6)H2O22观察法:先金属后原子团(1)CuSO4+NaOH—Na2SO4+Cu(OH)2(2)Mg+HCl—MgCl2+H2↑(3)Fe2O3+H2SO4Fe2(SO4)3+H2O(4)Al+H2SO4—Al2(SO4)3+H2↑3配平下列的各个化学反应的方程式:KMnO4—K2MnO4+MnO2+O2↑Al+CuSO4—Al2(SO4)3+CuZn+HCl—ZnCl2+H2↑Al2O3+H2SO4Al2(SO4)3+H2OFe2(SO4)3+NaOH—Na2SO4+Fe(OH)3Fe(OH)3+H2SO4Fe2(SO4)3+H2O点燃高温CH4+O2CO2+H2OC+CO2CONH3+O2催化剂NO+H2OCO+Fe2O3高温Fe+CO2二练习1某纯净物X在空气中完全燃烧,反应式为:X+3O2===2CO2+3H2O,根据质量守恒定律可判断出X 的化学式为:AC2H4BC2H4OCC2H6DC2H6O2在4Cu+10HNO3=4Cu(NO3)3+X+5H2O反应方程式中,X的化学式为:ANOBNO2CN2ODN2O33物质X和B2能发生下列反应:2X+B2=2AB3,则X的化学式是:AAB2BA2B2CAB3DA2B34某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:AR一定含有碳,氢,氧三种元素BR一定含有碳和氢元素,不含有氧元素CR一定含有碳和氢元素,可能含有氧元素DR不一定含有碳和氢元素,但一定不含有氧元素5某物质W在氧气中充分燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素判断正确的是:A一定含有CH元素,不含O元素B一定含有CH元素,可能有O元素C一定含有CHO三种元素D条件不足,不能判断6氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:A1:1B2:1C2:32D4:327白色固体粉末氯酸钾(KClO3)在二氧化锰(MnO2)作催化剂并加热的条件下能较快地生成氯化钾(KCl)和氧气,试写出该反应的化学方程式:8发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成。
初三化学反应方程式整理

初三化学方程式整理一.化合反应1. 镁在空气中燃烧 2Mg+O22MgO高温2. 木炭在空气中燃烧充分 C+O2CO2 二氧化碳被碳还原:C + CO2 === 2CO3. 木炭在氧气中燃烧不充分 2C+O22CO4. 硫在氧气中燃烧 S+O2SO25. 磷在氧气中燃烧 4P+5O22P2O56. 铁丝氧气中燃烧 3Fe+2O2Fe3O47. 氢气氧气中燃烧 2H2+O22H2O==△8. 铜丝空气中加热 2Cu+O2 2CuO9. 金属铝与氧气反应 4Al+3O2===2Al2O310.一氧化碳氧气中燃烧 2CO+O22CO211.二氧化碳溶于水 CO2+H2O===H2CO312.生石灰溶于水 CaO+H2O===Ca(OH)213.二氧化硫溶于水 SO2+H2O=== H2SO314.二氧化硫与氧气反应 2SO2+O2===2SO315.亚硫酸与氧气反应 2H2SO3+O2===2H2SO416.三氧化硫溶于水 SO3+H2O===H2SO4二.分解反应==△17. 加热碱式碳酸铜 Cu2(OH)2CO3 2CuO+H2O+CO2↑MnO218. 二氧化锰与双氧水制氧气2H2O2====2H2O+O2↑19. 水通电 2H2O2H2↑+O2↑==△20. 加热高锰酸钾 2KMnO4 K2MnO4+MnO2+O2↑21. 碳酸分解 H2CO3===H2O+CO2↑22. 高温煅烧石灰石 CaCO3CaO+CO2↑==△23. 碳酸氢铵受热分解 NH4HCO3 NH3↑+H2O+ CO2↑三.置换反应24. 锌与稀硫酸反应 Zn+H2SO4====ZnSO4+H2↑25. 锌与稀盐酸反应 Zn+2HCl====ZnCl2+H2↑26. 镁与稀硫酸反应 Mg+H2SO4====MgSO4+H2↑27. 镁与稀盐酸反应 Mg+2HCl====MgCl2+H2↑28. 铁与稀硫酸反应 Fe+H2SO4====FeSO4+H2↑29. 铁与稀盐酸反应 Fe+2HCl====FeCl2+H2↑30. 铝与稀硫酸反应 2Al+3H2SO4====Al2(SO4)3+3H2↑31. 铝与稀盐酸反应 2Al+6HCl====2AlCl3+3H2↑32. 湿法炼铜 Fe+CuSO4===FeSO4+Cu33. 锌与硫酸铜溶液反应 Zn+CuSO4===ZnSO4+Cu34. 铜与硝酸银溶液反应 Cu+2AgNO3===Cu(NO3)2+2Ag四.复分解反应35. 稀硫酸除锈 Fe2O3+3H2SO4===Fe2(SO4)3+3H2O36. 稀盐酸除锈. Fe2O3+6HCl===2FeCl3+3H2O37. 氧化铜与硫酸反应 CuO+H2SO4===CuSO4+H2O38. 氧化铜与盐酸反应 CuO+2HCl===CuCl2+H2O39. 氢氧化钠中和硫酸 2NaOH+H2SO4===Na2SO4+2H2O40. 氢氧化钠中和盐酸 NaOH+HCl===NaCl+H2O41. 氢氧化钠中和硝酸 NaOH+HNO3===NaNO3+H2O42. 氢氧化铝中和胃酸过多 Al(OH)3+3HCl===AlCl3+3H2O43. 氨水与稀硫酸反应 2NH3·H2O+H2SO4===(NH4)2SO4+2H2O44. 实验室制取二氧化碳 CaCO3+2HCl===CaCl2+H2O+CO2↑45. 碳酸钠和盐酸反应 Na2CO3+2HCl===2NaCl+H2O+CO2↑小苏打治疗胃酸过多 NaHCO3+ HCl===NaCl+H2O+CO2↑46. 硫酸铜溶液与氢氧化钠反应2NaOH+CuSO4===Cu(OH)2↓+Na2SO447. 硫酸铜溶液与氢氧化钙反应Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO448. 工业上制取氢氧化钠 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH49. 氢氧化钙中和硫酸 Ca(OH)2+H2SO4===CaSO4+2H2O50. 氢氧化钙中和盐酸 Ca(OH)2+2HCl=== CaCl2+2H2O51. 氯化钡和硫酸 H2SO4 + BaCl2= BaSO4↓+ 2HCl52. 硝酸银和盐酸 HCl + AgNO3= AgCl↓+ HNO353. 氯化钡和硫酸钾 BaCl2 + K2SO4= BaSO4↓+ 2KCl54. 硝酸银和氯化钠 AgNO3 + NaCl = AgCl↓+ NaNO3五.其它反应55. 检验二氧化碳 CO2 +Ca(OH)2===CaCO3↓+H2O56. 氢氧化钠与二氧化碳反应 CO2+2NaOH===Na2CO3+H2O57. 氢氧化钠与二氧化硫反应 SO2+2NaOH===Na2SO3+H2O58. 氢氧化钠与三氧化硫反应 SO3+2NaOH===Na2SO4+H2O59. 以赤铁矿炼铁 Fe2O3+3CO2Fe+3CO260. 甲烷(天然气)燃烧 CH4+2O2CO2+2H2O61.以磁铁矿炼铁 Fe3O4+4CO3Fe+4CO262. 光合作用 6CO2+6 H2O叶绿体 C6H12O6+6O2酶光照63. 呼吸作用 C6H12O6+6O2 6CO2+6 H2O。
初三化学分子方程式练习题

初三化学分子方程式练习题化学中,分子方程式是指用化学式表示化学反应的方程式。
它可以直观地反映参与反应的化学物质和它们之间的数量关系。
初中化学教学中常常会涉及到分子方程式的练习题,通过掌握和练习分子方程式的写法和应用,可以帮助学生深入理解化学反应的本质,并培养其观察、分析和解决问题的能力。
下面,我们将通过几个典型的练习题,来探讨初中化学分子方程式的应用。
题目1:盐酸与氢氧化钠的中和反应试题描述:盐酸与氢氧化钠发生中和反应,写出化学反应的分子方程式。
解题思路:中和反应是酸和碱反应时产生的一种化学反应,其产物是盐和水。
首先,我们需要识别出反应物和产物的化学式。
盐酸的化学式为HCl,氢氧化钠的化学式为NaOH。
然后,我们利用化学式写出反应方程式,保持反应物和产物的质量守恒。
根据酸碱中和反应产物为盐和水的特点,我们可以得到如下分子方程式:HCl + NaOH → NaCl + H2O题目2:铁与硫的化合反应试题描述:铁与硫发生化合反应,写出化学反应的分子方程式。
解题思路:化合反应是两种或两种以上的物质直接结合形成新的物质的反应。
在这个问题中,铁和硫会发生反应生成化合物。
首先,我们需要识别出反应物和产物的化学式。
铁的化学式为Fe,硫的化学式为S。
根据化合反应的特点,我们可以得到如下分子方程式:Fe + S → FeS题目3:氧化反应试题描述:铁和氧发生氧化反应,写出化学反应的分子方程式。
解题思路:氧化反应是指物质与氧气反应形成氧化物的过程。
在这个问题中,铁和氧会发生反应生成氧化铁。
首先,我们需要识别出反应物和产物的化学式。
铁的化学式为Fe,氧的化学式为O2。
根据氧化反应的特点,我们可以得到如下分子方程式:4Fe + 3O2 → 2Fe2O3通过以上三个例子的分析,我们可以发现分子方程式的写法与所涉及的化学反应类型有关,需要根据题目给出的问题确定出正确的化学式和生成物。
同时,在写分子方程式时,要注意质量守恒的原则,确保反应物和产物的数量关系正确。
(必考题)人教版化学九年级第五章化学方程式经典练习题(培优)(1)

考试范围:xxx;满分:***分;考试时间:100分钟;命题人:xxx 学校:__________ 姓名:__________ 班级:__________ 考号:__________一、选择题1.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法错误的是物质甲乙丙丁反应前质量/g522022反应后质量/g待测11285A.该反应是分解反应B.甲可能该反应的催化剂C.乙、丙变化的质量比为9:8 D.反应后甲的质量为02.《本草纲目拾遗》“人参补气第一,三七补血第一”,三七素(C5H7N2O5)是传统中药三七的主要有效成分,下列有关三七素的叙述正确的是A.三七素属于氧化物B.三七素中碳元素和氮元素的质量比为5:2C.三七素在氧气中完全燃烧只生成二氧化碳和水D.每个三七素分子中含有5个碳原子,7个氢原子,2个氮原子和5个氧原子3.“宏观—微观—符号”之间建立联系,是化学学科特有的思维方式,工业上生产尿素[CO(NH2)2]的微观示意图如下所示,根据图示信息分析不正确的是()A.反应的化学方程式为:2NH3 + CO2一定条件CO(NH2)2 + H2OB.反应物和生成物都是由分子构成C.反应前后分子和原子的种类都发生改变D.化学反应的微观实质是分子分成原子,原子重新组合成新分子的过程4.硝酸制备中会发生反应3224NH+5O=4X+6H O。
下列说法正确的是A.NH3中氮的质量分数为25%B.X的化学式为NO2C.该反应过程中元素化合价均没有发生变化D.反应消耗氧气与生成的水中氧的质量比为5:35.1时刻,在密闭容器内投入SO2、O2、SO3、V2O5(五氧化二钒)四种物质,一定条件下发生反应的化学方程式为:2SO2+O225V OΔ2SO3,在不同时刻测得容器内各物质的质量如表所示,下列说法正确的是甲乙丙丁t180g5g100g5gt2a55g60g bt3c d40g5gA.丙是O2,丁是V2O5B.t3时,共生成80g SO3C.a=70g,c=65gD.参加反应的SO2、O2的质量比为2:16.6.4g某物质在氧气中燃烧,恰好生成2.8g一氧化碳、4.4g二氧化碳和7.2g水,关于该物质有下列判断:①一定含碳元素和氧元素;②一定不含氧元素;③可能含氧元素;④一定含氧元素;⑤分子中C、H原子个数比为1:8;⑥分子中C、H、O原子个数比为1:4:1.其中正确的是A.①②⑤B.①②⑥C.①③⑥D.①④⑥7.构建化学基本观念是学好化学的基础。
(完整)初三化学方程式配平练习题及答案

初三(九年级)化学方程式配平练习题一化学方程式的基础知识:1化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5 (2) C + O2点燃CO(3) Al + O2点燃Al2O3 (4)Fe + O2点燃Fe3O4(5) Mg + O2点燃MgO (6) H2O2MnO2 H2O + O2↑(7) H2O 通电H2↑+ O2↑(8) H2+ O2点燃H2O2观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6某物质W在氧气中充分燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素判断正确的是:A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
初三化学配平方程式练习题

初三化学配平方程式练习题在初三的化学学习中,配平方程式是一个重要的内容。
通过练习配平方程式,不仅可以提高对化学方程式的理解,还能够培养逻辑思维和解决问题的能力。
下面是一些初三化学的配平方程式练习题,供同学们参考和练习。
1. 氢气和氧气反应得到水:___H₂ + ___O₂ → ___H₂O2. 氮气和氢气反应得到氨气:___N₂ + ___H₂ → ___NH₃3. 金属铁和氧气反应得到金属氧化物:___Fe + ___O₂ → ___Fe₂O₃4. 碳酸氢钠和盐酸反应得到二氧化碳、水和盐:___NaHCO₃ + ___HCl → ___CO₂ + ___H₂O + ___NaCl5. 铝和氧气反应得到氧化铝:___Al + ___O₂ → ___Al₂O₃6. 电解水得到氢气和氧气:___H₂O → ___H₂ + ___O₂7. 二氧化硫和氧气反应得到三氧化硫:___SO₂ + ___O₂ → ___SO₃8. 氯气和钠反应得到氯化钠:___Cl₂+ ___Na → ___NaCl这些是一些常见的化学配平方程式练习题,同学们可以根据各个元素的原子数量以及化学反应原理进行配平。
配平方程式的关键在于保持化学方程式左右两边原子的个数相等,同时满足化学反应的平衡。
在解题过程中,可以按照以下步骤进行:1. 首先,观察化学方程式,确定需要配平的化学方程式;2. 掌握各个元素的原子数量,计算出化学方程式左右两边各个元素的原子数目;3. 根据原子数目的差异,选择合适的系数来配平方程式;4. 配平方程式时,可以先从较复杂的分子开始配平,再逐渐配平其它分子;5. 配平时需要注意,同一分子中的原子数量是不可改变的,只能通过调整系数来平衡方程式;6. 配平完成后,检查方程式左右两边每个原子的数量是否相等,确保化学方程式达到平衡状态。
通过不断练习配平方程式,同学们可以逐渐提高对化学反应平衡的理解和应用能力。
同时,也能够通过解决问题的过程,锻炼逻辑思维和分析能力。
初三化学必背的化学方程式

初三化学必背的化学方程式一、有机物1.烷烃的燃烧反应CnH2n+2+(3n+1)/2O2→nCO2+(n+1)H2O2.醇的脱水反应ROH→R+H2O3.醇和酸的酯化反应RCOOH+ROH→RCOOR’+H2O4.醇的氧化反应RCHOH+[O]→RCOOH+H2O5.醛和醇的缩合反应RCHO+R’OH→RCH(OR’)+H2O6.酮和醇的缩合反应R’COR+R’’OH→R’COOR’’+H2O7.酚的取代反应C6H5OH+X2→C6H5X+HX8.酚的酸碱中和反应C6H5OH+NaOH→C6H5ONa+H2O二、无机物1.金属性和非金属性之间的发生氧化还原反应Fe+CuSO4→FeSO4+Cu2.非金属性之间的发生氧化还原反应Zn+2HCl→ZnCl2+H23.碱与酸之间的发生中和反应NaOH+HCl→NaCl+H2O4.金属的碱与水之间的反应2Na+2H2O→2NaOH+H25.碱金属(钠、钾)与非金属的反应2Na+Cl2→2NaCl6.盐之间的双置换反应NaCl+AgNO3→NaNO3+AgCl7.金属与酸之间的反应Mg+2HCl→MgCl2+H28.金属的碱与二氧化碳之间的反应2NaOH+CO2→Na2CO3+H2O三、酸、碱、盐的离解方程式1.酸离子的离解方程式HCl→H++Cl-2.碱离子的离解方程式NaOH→Na++OH-3.盐离子的离解方程式NaCl→Na++Cl-四、酸碱中和反应1.强酸强碱中和反应HCl+NaOH→NaCl+H2O2.弱酸弱碱中和反应CH3COOH+NH4OH→NH4CH3COO+H2O 五、氧化反应1.金属与氧气的氧化反应4Al+3O2→2Al2O32.非金属与氧气的氧化反应C+O2→CO2六、化学分析方程式1.氧化物的鉴别CO2+Ba(OH)2→BaCO3↓+H2O2.氨气的鉴别NH3+HCl→NH4Cl以上是初三化学中常见的化学方程式,记住这些方程式可以方便理解和记忆化学反应的发生过程和化学物质的性质。
(压轴题)初中化学九年级上册第五单元《化学方程式》测试题(有答案解析)(1)
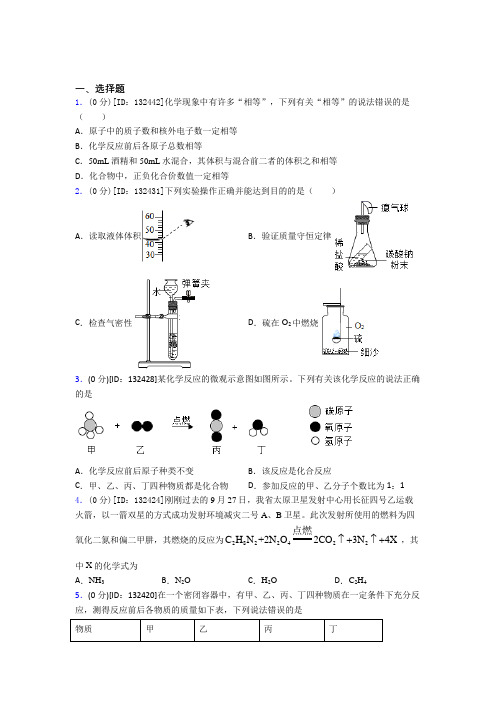
一、选择题1.(0分)[ID :132442]化学现象中有许多“相等”,下列有关“相等”的说法错误的是( )A .原子中的质子数和核外电子数一定相等B .化学反应前后各原子总数相等C .50mL 酒精和50mL 水混合,其体积与混合前二者的体积之和相等D .化合物中,正负化合价数值一定相等2.(0分)[ID :132431]下列实验操作正确并能达到目的的是( )A .读取液体体积B .验证质量守恒定律C .检查气密性D .硫在O 2中燃烧3.(0分)[ID :132428]某化学反应的微观示意图如图所示。
下列有关该化学反应的说法正确的是A .化学反应前后原子种类不变B .该反应是化合反应C .甲、乙、丙、丁四种物质都是化合物D .参加反应的甲、乙分子个数比为1:14.(0分)[ID :132424]刚刚过去的9月27日,我省太原卫星发射中心用长征四号乙运载火箭,以一箭双星的方式成功发射环境减灾二号A 、B 卫星。
此次发射所使用的燃料为四氧化二氮和偏二甲肼,其燃烧的反应为2822422C H N +2N O 2CO 3N 4X ↑+↑+点燃,其中X 的化学式为 A .NH 3B .N 2OC .H 2OD .C 2H 45.(0分)[ID :132420]在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法错误的是 物质甲乙丙丁反应前质量/g522022反应后质量/g待测11285A.该反应是分解反应B.甲可能该反应的催化剂C.乙、丙变化的质量比为9:8 D.反应后甲的质量为06.(0分)[ID:132416]一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是物质甲乙丙丁反应前的质量/g500.500反应后的质量/g23x243A.乙可能是催化剂,x的值等于0B.甲一定是化合物,丙丁可能是单质C.丙和丁的质量变化比为8:1D.该反应是分解反应,反应前后元素化合价可能不变7.(0分)[ID:132392]1时刻,在密闭容器内投入SO2、O2、SO3、V2O5(五氧化二钒)四种物质,一定条件下发生反应的化学方程式为:2SO2+O225V OΔ2SO3,在不同时刻测得容器内各物质的质量如表所示,下列说法正确的是甲乙丙丁t180g5g100g5gt2a55g60g bt3c d40g5gA.丙是O2,丁是V2O5B.t3时,共生成80g SO3C.a=70g,c=65gD.参加反应的SO2、O2的质量比为2:18.(0分)[ID:132380]与图示微观变化相符的化学反应是()A.2CO+O2点燃2CO2B.H2+CuO∆H2O+CuC.2H2+O2点燃2H2O D.H2CO3∆H2O+CO2↑9.(0分)[ID:132378]氨催化氧化是制硝酸的主要反应之一,其反应前后分子种类变化的微观示意图如下图所示。
化学反应方程式练习题

化学反应方程式练习题化学反应方程式是化学反应过程的基本表述形式,能够准确地描述反应物和生成物之间的化学变化。
在学习化学的过程中,掌握化学反应方程式的编写和平衡技巧非常重要。
本文将提供一些化学反应方程式的练习题,帮助读者巩固和提高相关知识。
1. 氢气和氧气反应生成水:答案:2H2 + O2 → 2H2O解析:氢气和氧气反应生成水,反应物中氢气的系数为2,氧气的系数为1,生成物中水的系数为2。
2. 氧化铁与硫化氢反应生成硫化铁和水:答案:4FeO + 6H2S → 4FeS + 6H2O解析:氧化铁与硫化氢反应生成硫化铁和水,反应物中氧化铁的系数为4,硫化氢的系数为6,生成物中硫化铁的系数为4,水的系数为6。
3. 碳酸钙热分解产生氧气和二氧化碳:答案:CaCO3 → CaO + CO2解析:碳酸钙热分解产生氧气和二氧化碳,反应物中碳酸钙的系数为1,生成物中氧化钙的系数为1,二氧化碳的系数为1。
4. 乙醇与氧气燃烧生成二氧化碳和水:答案:C2H5OH + 3O2 → 2CO2 + 3H2O解析:乙醇与氧气燃烧生成二氧化碳和水,反应物中乙醇的系数为1,氧气的系数为3,生成物中二氧化碳的系数为2,水的系数为3。
5. 氨和氧气反应生成氮和水:答案:4NH3 + 5O2 → 4NO + 6H2O解析:氨和氧气反应生成氮和水,反应物中氨的系数为4,氧气的系数为5,生成物中氮的系数为4,水的系数为6。
6. 铜和硝酸反应生成亚硝酸铜和二氧化氮:答案:Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O解析:铜和硝酸反应生成亚硝酸铜和二氧化氮,反应物中铜的系数为1,硝酸的系数为4,生成物中亚硝酸铜的系数为1,二氧化氮的系数为2,水的系数为2。
通过以上练习题,读者可以更好地理解化学反应方程式的编写和平衡过程。
在实际学习和应用中,还需加强反应物和生成物的识别能力,提高对化学反应的理解。
希望本文对读者有所帮助,使其能够在化学学习中更加得心应手。
初三化学方程式配平练习题及答案.

一 化学方程式的基础知识:
1 化学方程式配平常用方法:最小公倍数法、奇数配偶法 (先配奇数大 ):
点燃
(1) P + O2
P2O5
点燃
(2) C + O2
CO
(3) Al + O2
点燃
Al2O3
点燃
(4) Fe + O2
Fe3O4
点燃
(5) Mg + O2
MgO
↑
(6) H2O2 MnO2 H2O + O2
通电
(7) H2O
H2↑+ O2↑
点燃
(8)
H2 + O2
H2O
2 观察法:先金属后原子团
(1) CuSO4 + NaOH — Na2SO4 + Cu(OH)2
(2) Mg + HCl — MgCl2 + H2↑
(3) Fe2O3 + H2SO4
Fe2(SO4) 3 + H2O
(4) Al + H2SO4 — Al2(SO4)3 + H2↑
已知镁在氮气中燃烧,生成一种叫氮化镁(氮显 -3 价)固体的化合物;镁在二氧化碳 中燃烧,生成黑色炭粒与一种白色固体粉末。试写出以上发生的两条化学方程式:
① ②
, 。
14 简答题:镁条在空气中燃烧后生成氧化镁,理论上生成物多一种元素,质量应比
镁条重,但同学们实验后称量收集的氧化镁反而轻,原因是:
___
____
高温
(8) C + CO2
CO
催化剂
(9) NH3 + O2
NO + H2O
初中化学反应式大全

初中化学反应式大全一、氧化还原反应1. 单质氧化反应2Na + Cl2 -> 2NaCl2. 金属与非金属氧化反应4Al + 3O2 -> 2Al2O33. 金属与非金属氧化物还原反应CaO + CO2 -> CaCO34. 金属与酸反应2Al + 6HCl -> 2AlCl3 + 3H25. 元素与化合物氧化还原反应2Mg + O2 -> 2MgO二、酸碱反应1. 酸与金属反应2HCl + Zn -> ZnCl2 + H22. 酸与碱反应2HCl + Na2CO3 -> 2NaCl + H2O + CO2三、置换反应1. 单一置换反应Zn + CuSO4 -> ZnSO4 + Cu2. 双置换反应NaCl + AgNO3 -> AgCl + NaNO3四、脱水反应1. 酸与酒石酸反应2C4H6O6 -> C4H4O6 + 2H2O2. 元素与水反应2Na + 2H2O -> 2NaOH + H2五、水解反应1. 酸酐与水反应CH3CO2C2H5 + H2O -> CH3CO2H + C2H5OH 2. 酸与碱盐水解反应NaCl + H2O -> NaOH + HCl六、酸碱盐的中和反应1. 强酸与强碱中和HCl + NaOH -> NaCl + H2O2. 强酸与弱碱中和HCl + NH4OH -> NH4Cl + H2O七、酸酐与醇酯化反应CH3COOH + C2H5OH -> CH3COOC2H5 + H2O八、聚合反应1. 乙炔聚合反应2C2H2 -> C4H42. 乙烯聚合反应nC2H4 -> (C2H4)n九、燃烧反应1. 碳氢化合物燃烧CH4 + 2O2 -> CO2 + 2H2O2. 硫磺燃烧S + O2 -> SO2十、核反应1. 裂变反应235U + n -> 91Kr + 141Ba + 3n2. 聚变反应2H + 3H -> 4He + n研究和了解化学反应式是理解化学原理和实验过程的基础。
初三方程式配平练习题

初三方程式配平练习题方程式配平是初三数学学习中的一个重要环节,也是一个考察学生逻辑思维和解题能力的重要部分。
下面是一些初三方程式配平练习题,帮助学生熟练掌握配平技巧和方法。
一、简单方程式配平练习题1. 将以下方程式配平:C6H6 + O2 = CO2 + H2O2. 将以下方程式配平:NH3 + O2 = N2 + H2O3. 将以下方程式配平:Fe + O2 = Fe2O34. 将以下方程式配平:Ca + H2O = Ca(OH)2 + H2二、化学方程式配平练习题1. 将以下方程式配平:NaOH + H3PO4 = Na3PO4 + H2O2. 将以下方程式配平:C2H4 + O2 = CO2 + H2OHCl + NaOH = NaCl + H2O4. 将以下方程式配平:Fe2O3 + CO = Fe + CO2三、酸碱反应方程式配平练习题1. 将以下方程式配平:H2SO4 + KOH = K2SO4 + H2O2. 将以下方程式配平:HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O 3. 将以下方程式配平:HCl + Mg(OH)2 = MgCl2 + H2O4. 将以下方程式配平:H2SO4 + NaOH = Na2SO4 + H2O四、氧化还原反应方程式配平练习题1. 将以下方程式配平:Fe + HCl = FeCl3 + H22. 将以下方程式配平:MnO2 + HCl = MnCl2 + H2O + Cl2KMnO4 + HCl = KCl + MnCl2 + H2O + Cl24. 将以下方程式配平:KI + Cl2 = KCl + I2以上是一些初三方程式配平练习题,希望能帮助学生们更好地理解和掌握方程式的配平技巧和方法。
通过不断练习,学生们可以提升自己的解题能力和思维逻辑,并为接下来的学习打下坚实的基础。
初三是一个关键的学习阶段,希望大家都能够充分发挥自己的潜力,取得优异的成绩!。
初中化学方程式练习试题

化学方程式的专项练习一、写出下列反应的化学方程式:1、镁在空气中燃烧:______________________ _____2、铁在氧气中燃烧:____________________ _______3、铜在空气中受热:______________ _____________4、铝在空气中燃烧:_________________ __________5、氢气中空气中燃烧:__________ _______________6、红磷在空气中燃烧:_______________ ___ ______7、硫粉在空气中燃烧:__________________ _______11、利用过氧化氢和二氧化锰的混合物制氧气:____________________________12、水在直流电的作用下分解:___________________________________________13、加热氯酸钾:_______________________________________________________14、加热高锰酸钾:____________________________________________________二、配平下列化学方程式:(一) 最小公倍数法:1、 Al + O2—— Al2O32、 Al + Fe3O4—— Fe + Al2O33、 Fe + O2—— Fe3O44、 Al + MnO2—— Mn + Al2O35、 N2 + H2—— NH36、 Al + H2SO4—— Al2(SO4)3 + H2(二) 观察法:1、 CO + Fe2O3 —— Fe + CO22、 C + Fe2O3—— Fe + CO23、 CO + Fe3O4 —— Fe + CO24、 C + Fe3O4—— Fe + CO25、 H2 + Fe2O3—— Fe + H2O6、 H2 + Fe3O4—— Fe + H2O10、H2+ WO3——W + H2O 11、CO + O2——CO212、 Fe + H2O—— H2 + Fe3O4 13、 Al(OH)3+ HCl —— AlCl3 + H2O(三) 奇数配偶法:1、 FeS2 + O2 —— Fe2O3 + SO22、 C2H2 + O2——CO2+ H2O3、 C + Fe2O3—— Fe + CO24、 MnO2 + HCl—— MnCl2 + Cl2 + H2O5、 Cl2 + Ca(OH)2—— CaCl2 + Ca(ClO)2 + H2O(四) 归一法:1、 C2H2 + O2——CO2 + H2O2、C6H6 + O2—— CO2 + H2O3、 C22H46 + O2——CO2 + H2O4、 NH3 + Cl2 —— NH4Cl + N25、 As2O3+ Zn + HCl——AsH3+ ZnCl2+ H2O6、C X H Y+ O2——CO2+ H2O三、题型变化:1、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
初三化学方程式配平练习题

初三化学方程式配平练习题在化学学习中,理解和掌握方程式配平是非常重要的一部分。
在配平过程中,我们需要根据反应物和生成物的原子个数以及被配平的元素的价态,来平衡反应方程式。
今天,我们将进行一些初三化学方程式配平的练习题,帮助大家加深对这一概念的理解。
1. 配平氧化还原反应方程式a) 氯气(Cl₂)与钠(Na)反应生成氯化钠(NaCl)。
Cl₂ + Na → NaClb) 氧化亚铁(FeO)加热得到金属铁(Fe)和氧气(O₂)。
2FeO + heat → 2Fe + O₂c) 硫化氢(H₂S)与氧气(O₂)反应生成水(H₂O)和二氧化硫(SO₂)。
2H₂S + 3O₂ → 2H₂O + 2SO₂2. 配平酸碱反应方程式a) 硝酸(HNO₃)与氢氧化钠(NaOH)反应生成氯化钠(NaNO₃)和水(H₂O)。
HNO₃ + NaOH → NaNO₃ + H₂Ob) 硫酸(H₂SO₄)与氢氧化铝(Al(OH)₃)反应生成硫酸铝(Al₂(SO₄)₃)和水(H₂O)。
H₂SO₄ + Al(OH)₃ → Al₂(SO₄)₃ + H₂Oc) 碳酸钠(Na₂CO₃)与盐酸(HCl)反应生成氯化钠(NaCl)、水(H₂O)和二氧化碳(CO₂)。
Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂3. 配平燃烧反应方程式a) 甲烷(CH₄)燃烧生成二氧化碳(CO₂)和水(H₂O)。
CH₄ + 2O₂ → CO₂ + 2H₂Ob) 乙烯(C₂H₄)燃烧生成二氧化碳(CO₂)和水(H₂O)。
C₂H₄ + 3O₂ → 2CO₂ + 2H₂Oc) 丙烷(C₃H₈)燃烧生成二氧化碳(CO₂)和水(H₂O)。
C₃H₈ + 5O₂→ 3CO₂ + 4H₂O通过以上练习题,我们可以更好地理解方程式的配平过程。
在配平方程式时,我们需要注意确保原子数目平衡、电荷平衡以及物质种类平衡。
同时,我们还可以根据反应的实际情况进行配平,比如酸碱反应中需要配平氢和氢氧根离子的个数。
(完整版)初三化学方程式全练习及答案

初三化学方程式全练习一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃=2. 铁在氧气中燃烧:3Fe + 2O2 点燃=3. 铜在空气中受热:2Cu + O2 加热=4. 铝在空气中燃烧:4Al + 3O2 点燃=5. 氢气中空气中燃烧:2H2 + O2 点燃=6. 红磷在空气中燃烧:4P + 5O2 点燃=7. 硫粉在空气中燃烧:S + O2 点燃=8. 碳在氧气中充分燃烧:C + O2 点燃=9. 碳在氧气中不充分燃烧:2C + O2 点燃=(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃=11. 甲烷在空气中燃烧:CH4 + 2O2 点燃=12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃=二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电=14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热=15. 加热氯酸钾(有少量的二氧化锰):2KClO3 =16. 加热高锰酸钾:2KMnO4 加热=17. 碳酸不稳定而分解:H2CO3 ===18. 高温煅烧石灰石:CaCO3 高温=三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热=20. 木炭还原氧化铜:C+ 2CuO 高温=21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温=22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温=23. 一氧化碳还原氧化铜:CO+ CuO 加热=24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温=25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温=四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸--------盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 =27. 铁和稀硫酸Fe + H2SO4 =28. 镁和稀硫酸Mg + H2SO4 =29. 铝和稀硫酸2Al +3H2SO4 =30. 锌和稀盐酸Zn + 2HCl ===31. 铁和稀盐酸Fe + 2HCl ===32. 镁和稀盐酸Mg+ 2HCl ===33. 铝和稀盐酸2Al + 6HCl ==(2)金属单质+ 盐(溶液)-------另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 ===35. 锌和硫酸铜溶液反应:Zn + CuSO4 ===36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 ===(3)碱性氧化物+酸--------盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ===38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 ===39. 氧化铜和稀盐酸反应:CuO + 2HCl ====40. 氧化铜和稀硫酸反应:CuO + H2SO4 ====41. 氧化镁和稀硫酸反应:MgO + H2SO4 ====42. 氧化钙和稀盐酸反应:CaO + 2HCl ====(4)酸性氧化物+碱--------盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== (5)酸+ 碱--------盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ====49. 盐酸和氢氧化钾反应:HCl + KOH ====50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ====51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ====52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ====53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ====54.硫酸和烧碱反应:H2SO4 + 2NaOH ====55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ====56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ====57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3====58. 硝酸和烧碱反应:HNO3+ NaOH ====(6)酸+ 盐--------另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === 62.盐酸和硝酸银溶液反应:HCl + AgNO3 ===63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 ===64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== (7)碱+ 盐--------另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ====67.氢氧化钠与氯化镁:2NaOH + MgCl2 ====68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ====69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 ===(8)盐+ 盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ====71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ====五.其它反应:1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)NaOH+CO2== NaOH+SO2==NaOH+SO3== Ca(OH)2+CO2==2.三种还原剂(H2 、、C 、O2 )跟氧化物反应H2+CuO (置换反应)CO+CuOCO+Fe2O3C+CuO (置换反应)C+CO2(化合反应)3.实验室制取三种气体(常用方法)KMnO4KClO3Zn+ HCl== Zn+ H2SO4==CaCO3+HCl==4.盐分解Cu2(OH)2CO3CaCO3KMnO4KClO35.三种有机物燃烧CH4+ O2 C2H5OH+O2CH3OH+O2初三化学方程式全练习答案一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸--------盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液)-------另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸--------盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱--------盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸+ 碱--------盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐--------另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+ 盐--------另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐+ 盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4?5H2O 加热CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O。
初三化学所有方程式

初三化学所有方程式以下是初三化学所有方程式:
1. 酸碱反应方程式:
酸 + 碱→ 盐 + 水
例如:
HCl + NaOH → NaCl + H2O
2. 酸与金属反应方程式:
酸 + 金属→ 相应的盐 + 氢气
例如:
2HCl + Zn → ZnCl2 + H2
3. 碱与金属反应方程式:
碱 + 金属→ 相应的盐 + 氢气
例如:
2NaOH + 2Al → 2NaAlO2 + H2
4. 酸与碳酸盐反应方程式:
酸 + 碳酸盐→ 相应的盐 + 二氧化碳 + 水例如:
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O 5. 酸与碱性氧化物反应方程式:
酸 + 碱性氧化物→ 相应的盐 + 水
例如:
HNO3 + NaOH → NaNO3 + H2O
6. 酸性氧化物与碱反应方程式:
酸性氧化物 + 碱→ 相应的盐 + 水
例如:
SO2 + 2NaOH → Na2SO3 + H2O
7. 氧化还原反应方程式:
氧化剂 + 还原剂→ 氧化的物质 + 还原的物质
例如:
H2 + Cl2 → 2HCl
8. 燃烧反应方程式:
燃料 + 氧气→ 二氧化碳 + 水
例如:
C3H8 + 5O2 → 3CO2 + 4H2O
以上是初三化学所有方程式。
通过这些方程式,学生们可以更好地理解化学反应的本质,并且更加深入地了解化学反应的原理和规律。
初 三 化 学 反 应 方 程 式

九年级化学反应方程式(上册考试)班级_____________ 姓名____________一、实验室制取氧气1、加热氯酸钾和二氧化锰的混合物制取氧气:___________________2、双氧水与二氧化锰混合制取氧气:__________________________3、加热高锰酸钾制取氧气:二、制取二氧化碳1.实验室制取二氧化碳:2.工业制取二氧化碳:3.检验二氧化碳:三、实验室制取氢气:四、氧气的化学性质1、镁在空气中燃烧:______________________2、铁在氧气中燃烧:_______________________3、氢气在空气中燃烧:_____________________4、红磷在空气中燃烧:_______________________5、硫粉在空气中燃烧:_______________________6、铝在空气中燃烧:7、铜在空气中受热:8、甲烷在空气中燃烧:9、乙醇在空气中燃烧:五、水的化学性质1、水的电解:2、水和二氧化碳反应(二氧化碳通入紫色石蕊试液):______________3、水与生石灰(CaO)反应:_________________________六、碳的化学性质1、常温下稳定性2、可燃性充分燃烧_________________________________不充分燃烧___________________________________3、还原性碳还原氧化铜:___________________________碳还原三氧化二铁:碳还原二氧化碳:七、二氧化碳化学性质1、不支持燃烧,不能燃烧2、与水反应___________________________________碳酸不稳定分解:3、与氢氧化钙反应___________________________________八、一氧化碳化学性质1、可燃性:2、有毒3、还原性:一氧化碳还原三氧化二铁:一氧化碳还原氧化铜:九、其他1、碳酸钠和稀盐酸:2、铁和硫酸铜:3、氧化汞受热分解:4、氢气还原氧化铜:。
初三化学方程式配平练习题及答案

初三(九年级)化学方程式配平练习题一化学方程式的基础知识:1化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5 (2) C + O2点燃CO(3)Al + O2点燃Al2O3 (4)Fe + O2点燃Fe3O4(5) Mg + O2点燃MgO (6)H2O2MnO2 H2O + O2↑(7)H2O 通电H2↑+ O2↑(8) H2+ O2点燃H2O2观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH - Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 - Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10)CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6某物质W在氧气中充分燃烧后,生成了4.4克CO2和3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学培优(九)
化学反应方程式
1、关于化学方程式 的描述正确的是·············( ) A .甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B .1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C .1个CH 4分子和2个O 2分子在点燃条件下,生成1个CO 2分子和2个H 2O 分子
D .1 g CH 4和2 g O 2在点燃条件下,生成1 g CO 2和2 g H 2O 2、小明同学从 中获得以下信息:
①该反应反应物是硫和氧气; ②反应发生条件是点燃; ③反应前后元素种类和原子个数不变; ④反应前后分子总数保持不变; ⑤参加反应的硫和氧气的质量比为2:1.
其中正确的信息是···································( ) A .①②④⑤ B .①②③ C .④⑤ D .①②③⑤ 3、密闭容器内有A 、B 、C 、D 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
下列说法正确的是································( ) A .物质C 一定是化合物,物质D 可能是单质 B .反应后密闭容器中A 的质量为19.7g
C .反应过程中,物质B 与物质
D 变化的质量比为87:36
D .若A 与C 的相对分子质量比为197:158,则反应中A 与C 的化学计量数比为1:2 4、在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:
下列说法正确的是·······························( ) A .甲物质全部反应完 B .该反应为分解反应C .参加反应的丙物质的质量为20g D .x 为79 5、高铁酸钾(K 2FeO 4)是一种新型、高效的多功能水处理剂,受热时发生如下反应:
,则a 、R 分别是···················( )
A .4FeO
B .2Fe 2O 3
C .3Fe 2O 3
D .1Fe 3O 4
6、在一个密闭容器中放入X 、Y 、Z 、Q 四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错误的是··················( )
A .物质Z 可能是该反应的催化剂
B .反应后物质X 的质量为15g
C .反应中Y 、Q 的质量比为6:5
D .物质Y 一定是单质
7、某密闭容器中有X 、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物
质的质量如下表.根据表中信息,判断下列说法正确的是············( )
A .该反应为置换反应
B .X 中一定含有碳、氢两种元素
C .表中“待测”值为5
D .反应生成的CO 2和H 2O 的质量比为45:36
8、氨气(NH 3)是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水.它在化学
工业中有着广泛的用途,如制化肥、制纯碱等.近年来,人们还利用氨来治理环境污染. (1)氨分子中,氮原子和氢原子的个数之比为 .
(2)在细菌的作用下,用氨来出来含甲醇(CH 3OH )的工业废水,使其变为CO 2和N 2等物质,从
而清除它对环境的污染.反应的化学方程式为:6NH 3+5CH 3OH+12O 2=5CO 2+3N 2+19X ,其中X 物质的化学式是 .
(3)化学肥料是农作物生长的一种营养元素,工业上常用氨气和酸等物质生产铵态氮肥.写出
氨气与硫酸反应生成硫酸铵的化学方程式 . 9、结合质量守恒定律回答以下问题.
(1)化学反应中一定发生改变的是 .
A .元素的种类
B .物质的种类
C .原子的数目
D .分子的数目
E .分子的种类
F .原子的质量 (2)燃料偏二甲肼(化学式为C 2H 8N 2)常作为运载火箭的推进剂,其燃烧的化学方程式可表示为C 2H 8N 2+2N 2O 4═3X+4H 2O+2CO 2.则X 的化学式为 .
(3)关于下列微观图示所表示的化学变化说法错误的是 .
A .图中表示两种单质和两种氧化物
B .反应物和生成物均含有有毒气体
C .生成物中单质与化合物的质量比为7:22
D .各反应物和生成物的分子个数比为1:1:1:1
E .该反应不属于置换反应
(4)将a g 氯酸钾和b g 二氧化锰混合放入大试管中加热至完全分解,测得生成 c g 氯化钾固体,则生成氧气的质量为 g .
10、在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为
28,则B的相对分子质量是··························()A.16 B.32 C.64 D.96
11、有下列化学方程式:A+3B2=2C+2D,若参加反应的A的质量为7克,参加反应的B2的质量为
24克,生成D的质量为9克,C的相对分子质量为44,则B的相对原子质量为···()A.16 B.20 C.32 D.36
12、两份质量相等的碳,一份与足量氧气完全反应生成二氧化碳,另一份与氧气反应全部生成一
氧化碳.则前者与后者消耗氧气的质量比为··················()A.3:4 B.3:8 C.2:1 D.1:2
13、某同学实验时,用氢气将16克氧化铜完全还原成铜.该同学实验中,实际要消耗氢气的质
量是····································()A.0.4克B.大于0.4克C.0.3克D.0.2克
14、氧化铜和木炭粉的混合物25克,加热一段时间后,冷却,称量剩余固体的质量是20.6克.被
还原的氧化铜的质量是····························()A.16克B.4.4克C.25克D.12克
15、在实验室里加热30g氯酸钾(KClO
3
)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g.请计算:
(1)生成氧气的质量为 g;
(2)原混合物中氯酸钾的质量.16、黄铜是铜、锌合金.为测定某黄铜中铜的质量分数,现取20g该样品粉碎,加入适量稀硫酸,恰好完全反应,生成氢气0.2g(Zn+H
2
SO
4
═ZnSO
4
+H
2
↑).计算:(注:铜不与稀硫酸反应)(1)黄铜样品中锌的质量.
(2)黄铜样品中铜的质量分数.
17、广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO
3
的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:
(1)CaCO
3
的相对分子质量
(2)该石灰石样品中CaCO
3
的质量分数。
