气体气态、液态体积换算
液氧单位换算.
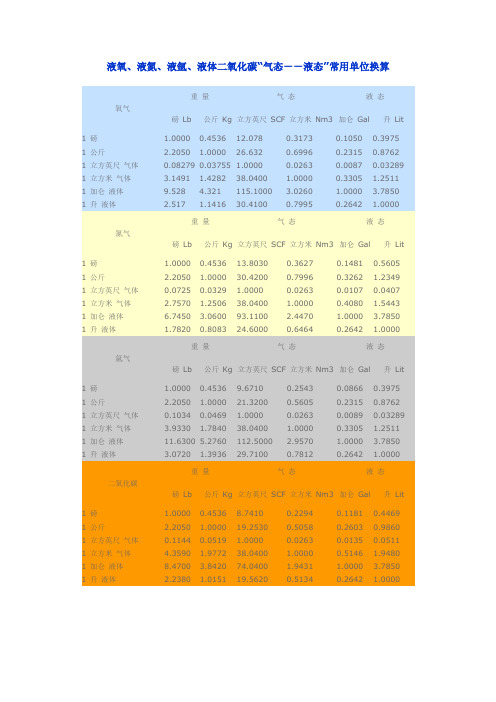
液氧、液氮、液氩、液体二氧化碳“气态--液态”常用单位换算重量气态液态氧气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 12.078 0.3173 0.1050 0.3975 1 公斤 2.2050 1.0000 26.632 0.6996 0.2315 0.8762 1 立方英尺气体0.08279 0.03755 1.0000 0.0263 0.0087 0.03289 1 立方米气体 3.1491 1.4282 38.0400 1.0000 0.3305 1.2511 1 加仑液体9.528 4.321 115.1000 3.0260 1.0000 3.7850 1 升液体 2.517 1.1416 30.4100 0.7995 0.2642 1.0000重量气态液态氮气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 13.8030 0.3627 0.1481 0.5605 1 公斤 2.2050 1.0000 30.4200 0.7996 0.3262 1.2349 1 立方英尺气体0.0725 0.0329 1.0000 0.0263 0.0107 0.0407 1 立方米气体 2.7570 1.2506 38.0400 1.0000 0.4080 1.5443 1 加仑液体 6.7450 3.0600 93.1100 2.4470 1.0000 3.7850 1 升液体 1.7820 0.8083 24.6000 0.6464 0.2642 1.0000重量气态液态氩气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 9.6710 0.2543 0.0866 0.3975 1 公斤 2.2050 1.0000 21.3200 0.5605 0.2315 0.8762 1 立方英尺气体0.1034 0.0469 1.0000 0.0263 0.0089 0.03289 1 立方米气体 3.9330 1.7840 38.0400 1.0000 0.3305 1.2511 1 加仑液体11.6300 5.2760 112.5000 2.9570 1.0000 3.7850 1 升液体 3.0720 1.3936 29.7100 0.7812 0.2642 1.0000重量气态液态二氧化碳磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 8.7410 0.2294 0.1181 0.4469 1 公斤 2.2050 1.0000 19.2530 0.5058 0.2603 0.9860 1 立方英尺气体0.1144 0.0519 1.0000 0.0263 0.0135 0.0511 1 立方米气体 4.3590 1.9772 38.0400 1.0000 0.5146 1.9480 1 加仑液体8.4700 3.8420 74.0400 1.9431 1.0000 3.7850 1 升液体 2.2380 1.0151 19.5620 0.5134 0.2642 1.0000参考以上得出以下:氧气1立方米气态=1.25升液态=0.00125立方米液态1升液态=0.001立方米液态=0.80立方米气态所以:1立方米液态=800立方米气态二氧化碳1立方米气态=1.95升液态=0.00195立方米液态1升液态=0.001立方米液态=0.51立方米气态所以:1立方米液态=510立方米气态以上纯属本人查找资料再加以计算得出,准确性不敢保证,仅供参考。
气体换算成标准状况体积

气体换算成标准状况体积摘要:一、气体换算背景二、标准状况的定义三、气体体积换算公式四、实际应用与意义正文:气体换算成标准状况体积,通常是指将某种气体在非标准状况下的体积,转换为该气体在标准状况下的体积。
这一过程涉及到气体的物质量和温度、压强等参数,需要运用相应的物理化学知识进行计算。
首先,我们需要了解什么是标准状况。
在国际标准下,标准状况是指温度为0 摄氏度(273.15 开尔文),压强为1 个标准大气压(约为101.325 千帕)的状态。
在这种条件下,1 摩尔任何气体的体积为22.4 升。
气体体积换算公式为:V1/T1 = V2/T2,其中V1和T1分别代表非标准状况下的气体体积和温度,V2和T2则代表标准状况下的气体体积和温度。
通过这个公式,我们可以将非标准状况下的气体体积转换为标准状况下的体积。
实际应用中,气体换算成标准状况体积的意义主要体现在以下几个方面:1.为科学研究提供便利:在实验室中,研究者需要对气体的体积进行精确测量。
将气体体积换算成标准状况下的体积,有助于比较不同实验条件下的气体体积,便于数据分析。
2.工业生产优化:在工业生产过程中,气体体积的测量和控制对于生产效率和产品质量具有重要意义。
将气体体积换算成标准状况下的体积,有助于优化生产过程,提高资源利用率。
3.环境监测与分析:在大气污染、温室气体排放等环境问题研究中,需要对气体体积进行监测和分析。
将气体体积换算成标准状况下的体积,有助于更准确地评估环境问题,为政策制定提供科学依据。
总之,气体换算成标准状况体积是一个在科学研究、工业生产、环境监测等领域具有广泛应用价值的课题。
LNG单位换算表

LNG的物理性质LNG是液化天然气(liquefied natural gas)的英文缩写,主要成分是甲烷。
LNG无色、无味、无毒且无腐蚀性,其体积约为同量气态天然气体积的1/625,密度约为水的45%。
●LNG密度:0.425-0.46kg/L●沸点:-162℃●气化后密度:0.6-0.7kg/m3●高热值:41.5-45.3MJ/m3●气液体积比:625:1●辛烷值:130●储存温度:-160~-120℃●操作压力:0~1.0MPaLNG计量单位换算表:以其产生热值的角度来考虑:1L(柴油)≈1.1㎥(天然气); 1.33L(柴油)≈1.47㎥(天然气);1kg(LNG)≈1.47㎥(天然气); 1.33L(柴油)≈1kg(LNG)1L(汽油)≈0.9㎥(天然气); 1.63L(汽油)≈1.47㎥(天然气);1.63L(汽油)≈1kg(LNG)LNG在液态与气态时的单位换算:LNG液体状态气体状态T(吨)KG(公斤)㎥(立方米)L(升) ㎥(立方米)1T(吨)=* 1000 2.19 2190 1470 1KG(公斤)= 0.001 * 0.00219 2.19 1.47 1㎥(立方米)= 0.456 456 * 1000 * 1L(升)= 0.000456 0.456 0.001 * 0.6250.68 0.0016 1.6 1 LNG汽车常用车载瓶换算表:(一般有效容积为额定的90%)可装LNG体积(L)可装LNG重量(kg)标准状况下气体体积(m3)1L 1 0.425 0.62 275L车载瓶247.5 105 153 335L车载瓶301.5 128 187 375L车载瓶337.5 128 187 450L车载瓶405.0 172 251。
天然气,一立方米,是指气态还是液态?

天然⽓,⼀⽴⽅⽶,是指⽓态还是液态?关于天然⽓体积的⼏个概念漫谈天然⽓在⽇常使⽤过程中,有三种形式,即:液化天然⽓(LNG)、压缩天然⽓(CNG)、管道天然⽓(NG);平时交流时使⽤的:⼀⽴⽅⽶,⼀般是指⽓态;同时是指该⽓体在标准状态下的体积。
包括压缩天然⽓。
液化天然⽓由于是以液态状态存在的,平时⼀般交流时使⽤的:⼀公⽄(kg)或者⼀吨(T)。
⼀、⽓体体积与标准状态⽓体分⼦之间的间距是很⼤的,所以它们之间的作⽤⼒很弱,不管把⽓体放到多⼤的体积的容积中,⽓体总是可以充满整个容器所以容器的体积就是⽓体的体积,当然随着体积的改变⽓压也是要改变的。
为了表征⽓体的体积就得引进标准状态下的⽓体体积这个概念。
关于⽓体体积和质量的计算⽅法,牵涉的知识太多,理想⽓体状态⽅程是基础 由 pV=nRT 得 pV=mRT/M 得出 m= pVM/RT=(p×V×M)÷【8.314×(273.15+t℃)】 m 质量 单位Kg p ⽓体压强 单位Pa V ⽓体体积 单位m M ⽓体摩尔质量 t ⽓体温度 单位℃标况下天然⽓⽴⽅,1 Nm³ 就是20摄⽒度,⼀个⼤⽓压下的 1个⽴⽅。
⼆、商业活动中⽓体体积的交易⽐如说⼀台撬车⽔容积为18⽴⽅⽶,实际加⽓可以到3000-4000⽅⽓。
这⾥⽓体被压缩到18⽴⽅的容器⾥⾯了,但是压⼒到了200公⽄左右,释放后可以到3000-4000N ⽴⽅。
如果分的仔细点,⽴⽅⽶就是⼯况下的计量,⽐如以上例⼦的,加压到200公⽄左右,天然⽓只有18⽴⽅⽶了。
⼯况和标况的换算是根据PV= nRT ⽓体⽅程来换算的。
三、对于液化天然⽓讨论体积时要⽤到⽓化率的概念,也就是⽓化后标准状态下的体积。
液氧_换算工作表
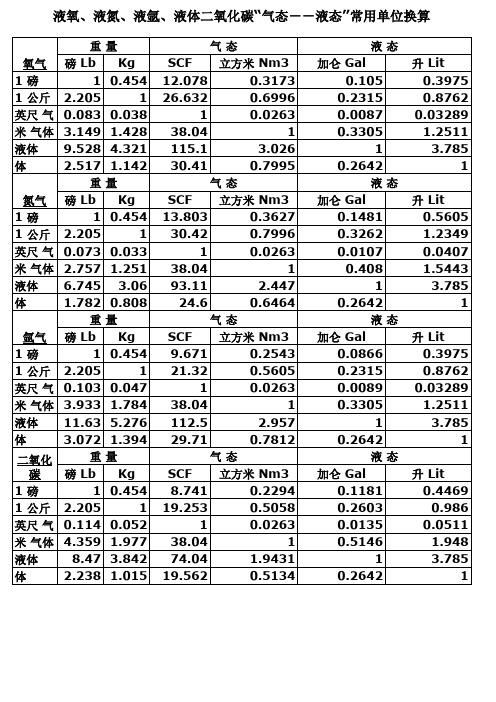
重 量公斤 立方英尺 气 态 氧气 磅 Lb Kg SCF 立方米 Nm3 1磅 1 0.454 12.078 0.3173 1 公斤 2.205 1 26.632 0.6996 立方 英尺 气 0.083 0.038 1 0.0263 1 立方 米 加仑 3.149 1.428 38.04 1 1 气体 液体 115.1 3.026 1 升 液 9.528 4.321 体 2.517 1.142 30.41 0.7995 重 量公斤 立方英尺 气 态 氮气 磅 Lb Kg SCF 立方米 Nm3 1磅 1 0.454 13.803 0.3627 公斤 1 30.42 0.7996 1 立方 2.205 英尺 气 1 0.0263 1 立方 0.073 0.033 米 加仑 2.757 1.251 38.04 1 1 气体 液体 液 6.745 3.06 93.11 2.447 1升 体 1.782 0.808 24.6 0.6464 重 量公斤 立方英尺 气 态 氩气 1磅 公斤 1 立方 英尺 气 1 立方 米 加仑 1 气体 液体 液 1升 体 二氧化 碳 1磅 1 公斤 立方 英尺 气 1 立方 米 加仑 1 气体 液体 1升液 体 磅 Lb 1 2.205 0.103 3.933 11.63 3.072 重 磅 Lb 1 2.205 0.114 4.359 8.47 2.238 Kg SCF 立方米 Nm3 0.454 9.671 0.2543 1 21.32 0.5605 0.047 1 0.0263 1.784 38.04 1 5.276 112.5 2.957 1.394 29.71 0.7812 量公斤 立方英尺 气 态 Kg SCF 立方米 Nm3 0.454 8.741 0.2294 1 19.253 0.5058 0.052 1 0.0263 1.977 38.04 1 3.842 74.04 1.9431 1.015 19.562 0.5134 液态 加仑 Gal 0.105 0.2315 0.0087 0.3305 1 0.2642 液态 加仑 Gal 0.1481 0.3262 0.0107 0.408 1 0.2642 液态 加仑 Gal 0.0866 0.2315 0.0089 0.3305 1 0.2642 液态 加仑 Gal 0.1181 0.2603 0.0135 0.5146 1 0.2642 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1 升 Lit 0.5605 1.2349 0.0407 1.5443 3.785 1 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1 升 Lit 0.4469 0.986 0.0511 1.948 3.785 1
气体的状态计算和理想气体定律

气体的状态计算和理想气体定律一、气体的状态计算1.气体的基本状态参数–压力(P):气体对容器壁的垂直压力,单位为帕斯卡(Pa)–体积(V):气体占据的空间大小,单位为立方米(m³)–温度(T):气体分子的平均动能大小,单位为开尔文(K)–物质的量(n):气体中分子数目的多少,单位为摩尔(mol)2.气体的状态方程–理想气体状态方程:PV = nRT•P:气体压强•V:气体体积•n:气体的物质的量•R:理想气体常数,8.314 J/(mol·K)•T:气体的绝对温度3.气体状态变化计算–等压变化:PV/T = 常数–等容变化:P/T = 常数–等温变化:PV = 常数二、理想气体定律1.玻意耳定律(Boyle’s Law)–一定量的气体在恒温条件下,压强与体积成反比,即PV = 常数。
2.查理定律(Charles’s Law)–一定量的气体在恒压条件下,体积与温度成正比,即V/T = 常数。
3.盖·吕萨克定律(Gay-Lussac’s Law)–一定量的气体在恒容条件下,压强与温度成正比,即P/T = 常数。
4.理想气体状态方程( combines laws)–PV/T = 常数,这是由玻意耳定律、查理定律和盖·吕萨克定律组合而成的。
5.理想气体的概念–理想气体是一种理想化的物理模型,假设气体分子之间无相互作用力,体积可以忽略不计,气体分子运动的速率分布符合麦克斯韦-玻尔兹曼分布。
三、实际气体与理想气体的区别1.实际气体:在现实生活中存在的气体,受到分子间相互作用力的影响,体积不能忽略不计。
2.理想气体:是一种理想化的物理模型,假设气体分子之间无相互作用力,体积可以忽略不计。
四、气体的饱和蒸汽压与相变1.饱和蒸汽压:在一定温度下,液体与其饱和蒸汽之间达到动态平衡时的蒸汽压强。
2.相变:气体与液体、固体之间的相互转化。
如水的沸腾(液态→气态)和凝固(液态→固态)。
初中化学气体的压强与体积变化的数值计算方法

初中化学气体的压强与体积变化的数值计算方法化学中,气体是一种常见的物质状态。
在研究气体行为时,我们经常需要计算气体的压强和体积的变化。
这篇文章将介绍初中化学中气体的压强与体积变化的数值计算方法。
一、气体的压强变化计算方法气体的压强是指气体分子对容器壁的冲击力,单位通常使用帕斯卡(Pa)或者标准大气压(atm)。
计算气体的压强变化涉及到以下公式:1. 理想气体状态方程:PV = nRT其中,P为气体的压强(单位为Pa或者atm),V为气体的体积(单位为升),n为气体的摩尔数(单位为摩尔),R为气体常数(单位为J/mol·K或者L·atm/mol·K),T为气体的绝对温度(单位为开尔文)。
2. 气压差产生的压强变化:ΔP = ρgh其中,ΔP为压强的变化量(单位为Pa或者atm),ρ为液体的密度(单位为千克/立方米或者gram/升),g为重力加速度(单位为米/秒²或者厘米/秒²),h为液体的高度(单位为米或者厘米)。
二、气体的体积变化计算方法气体的体积变化通常涉及到以下公式:1. 气体体积与摩尔数的关系:V/n = V₁/n₁ = V₂/n₂其中,V为气体的体积(单位为升),n为气体的摩尔数(单位为摩尔),V₁和n₁为初始状态下的体积和摩尔数,V₂和n₂为最终状态下的体积和摩尔数。
2. 理想气体体积与温度的关系:V₁/T₁ = V₂/T₂其中,V为气体的体积(单位为升),T为气体的绝对温度(单位为开尔文),V₁和T₁为初始状态下的体积和温度,V₂和T₂为最终状态下的体积和温度。
三、案例分析现在我们通过一个简单的案例来应用上述的计算方法。
假设一个气体在初始状态下的体积为2 L,摩尔数为0.02 mol,在温度为300 K下,求气体在最终状态下的压强和体积。
根据理想气体状态方程PV = nRT,我们可以先计算气体的压强:P = nRT/V= (0.02 mol)(8.31 J/mol·K)(300 K)/(2 L)= 249.3 J/L≈ 249.3 Pa接下来,我们可以利用理想气体体积与温度的关系计算气体的体积变化:V₁/T₁ = V₂/T₂(2 L)/(300 K) = V₂/(350 K)解方程得到:V₂ = 2 L × (350 K)/(300 K)≈ 2.33 L综上所述,初始体积为2 L,摩尔数为0.02 mol的气体,在温度为300 K下,最终的压强约为249.3 Pa,最终的体积约为2.33 L。
气体气态液态体积换算

气体气态液态体积换算 The following text is amended on 12 November 2020.理想气体状态方程(克拉伯龙方程):标准状态是指0℃(273K),1atm= kPa的状态下。
V=nRTV:标准状态下的气体体积;n:气体的摩尔量;R:气体常量、比例系数;molKT:绝对温度;273KP:标准大气压;V=nRT=n273/或V=nRT=n273/1另可以简便计算:V=V0ρMV:标准状态下的气体体积;V0:气体液态体积;ρ:液化气体的相对密度;M:分子量。
氮的标准沸点是-195.8℃,液体密度(-195.8℃),1m3液氮可汽化成氮气1*(808/28)*= 标立二氧化碳液体密度(-79℃),1m3液态二氧化碳可汽化成二氧化碳1*(1560/)*=794 标立氯的标准沸点是-34℃,液体密度, 1m 3液氯可汽化成氯气 1*(1470/)*= 标立液态氧气体体积膨胀计算在标准状态下0℃,,1摩尔气体占有22.4升体积,根据液态气体的相对密度,由下式可计算出它们气化后膨胀的体积:4.221000⨯⨯⨯=Md v V oo V — 膨胀后的体积(升) v o — 液态气体的体积(升) d o — 液态气体的相对密度(水=1) M — 液态气体的分子量将液氧的有关数据代入上式,由d o =,M=32得oo oo v v Md v V 7984.2210003214.14.221000=⨯⨯⨯=⨯⨯⨯=即液氧若发生泄漏则会迅速气化,其膨胀体积为原液态体积为798倍。
b. 液氧爆破能量模拟计算:液氧处于过热状态时,液态介质迅速大量蒸发,使容器受到很高压力的冲击,产生暴沸或扩展为BLEVE 爆炸,其爆破能量是介质在爆破前后的熵、焓的函数。
1)计算过程(1)容器爆破能量计算公式E L=[(i1-i2)-(s1-s2)T b]m式中:E L——过热状态下液体的爆破能量 KJ;i1——爆破前饱和液体的焓 KJ/kg;i2——在大气压力下饱和液体的焓 KJ/kg;s1——爆破前饱和液体的熵KJ/(kg·k);s2——在大气压力下饱和液体的熵KJ/(kg·k);m——饱和液体的质量 kg;T b——介质在大气压下的沸点 k(2)30m3液氧储罐的爆破能量本项目液氧贮存在1个容积为30m3/的储罐内,液氧最大储存量为34290kg,液氧沸点;假设事故状态下储罐内液氧的的温度为95K,则爆破能量:E= [ -将爆破能量换算成TNT能量q,1kg TNT平均爆炸能量为4500kJ/kg,故q=E/4500=1186091/4500=264 (kg)(4)求出爆炸的模拟比α即得α=3=×(264)1/3=(5)查得各种伤害、破坏下的超压值表5-4 冲击波超压对人体及建筑物伤害破坏作用表(6)求出在1000kg TNT爆炸试验中的相当距离R0根据相关数据查得:Δp=时 R0=56;Δp=时 R0=43;Δp=时 R0=32;Δp=时 R0=23;Δp=时 R0=17;(7)求出发生爆炸时各类伤害半径R1=R0×α=56×≈35.8m;R2=R0×α=43×≈27.5m;R3=R0×α=32×≈20.5m;R4=R0×α=23×≈14.7m;R5=R0×α=17×≈10.9m;2)事故后果预测小结按照单罐物理性爆炸事故后果预测,如果一台30m3的低温液氧储罐爆炸,其各类伤害、损失半径见表5-5。
氮气液氮氧气液氧等气体体积换算关系表

1.0000 0.4536 8.7410
0.2294
0.1181 0.4469
2.2050 1.0000 19.2530
0.5058
0.2603 0.9860
0.1144 0.0519 1.0000
0.0263
0.0135 0.0511
4.3590 1.9772 38.0400
1.0000
0.5146 1.9480
氮气
1磅 1 公斤 1 立方英尺 气体 1 立方米 气体 1 加仑 液体 1 升 液体
重量
气态
液态
磅 Lb 公斤 Kg
立方英尺 SCF
立方米 Nm3 加仑 Gal
升 Lit
1.0000 0.4536 13.8030
0.3627
0.1481 0.5605
2.2050 1.0000 30.4200
0.7996
2.9810
1.0000 3.7850
0.1560 0.0708 29.9900
0.7881
0.2642 1.0000
二氧化碳
1磅 1 公斤 1 立方英尺 气体 1 立方米 气体 1 加仑 液体 1 升 液体
液化天然气
1升
重量
气态
液态
磅 Lb 公斤 Kg
立方英尺 SCF
立方米 Nm3 加仑 Gal
升 Lit
0.3262 1.2349
0.0725 0.0329 1.0000
0.0263
0.0107 0.0407
2.7570 1.2506 38.0400
1.0000
0.4080 1.5443
6.7450 3.0600 93.1100
2.4470
液氧_换算工作表
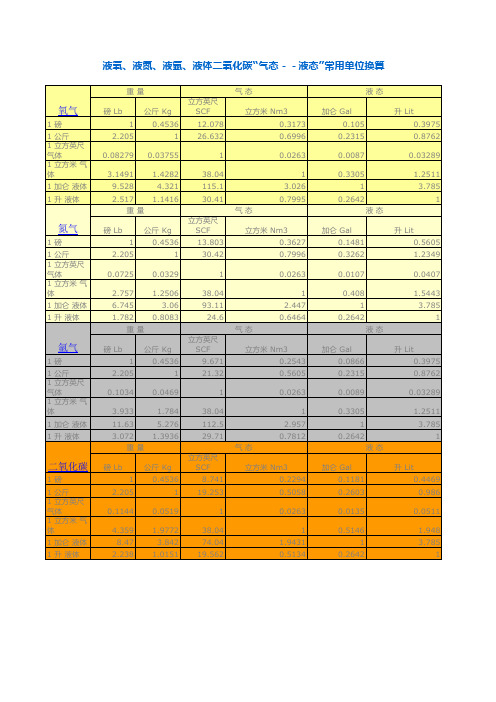
公斤 Kg 0.4536
氩气
1磅 1 公斤 1 立方英尺 气体 1 立方米 气 体 1 加仑 液体 1 升 液体
磅 Lb 1 2.205 0.1034 3.933 11.63
公斤 Kg 0.4536
3.072 重量 磅 Lb 1 2.205 0.1144 4.359 8.47 2.238
二氧化碳
1磅 1 公斤 1 立方英尺 气体 1 立方米 气 体 1 加仑 液体 1 升 液体
氧气
1磅 1 公斤 1 立方英尺 气体 1 立方米 气 体 1 加仑 液体 1 升 液体
磅 Lb 1 2.205 0.08279 3.1491 9.528
公斤 Kg 0.4536
2.517 重量 磅 Lb 1 2.205 0.0725 2.75 1 立方英尺 气体 1 立方米 气 体 1 加仑 液体 1 升 液体
公斤 Kg 0.4536
液氧、液氮、液氩、液体二氧化碳“气态--液态”常用单位换算
重量 气态 立方英尺 SCF 12.078 26.632 1 38.04 115.1 30.41 气态 立方英尺 SCF 13.803 30.42 1 38.04 93.11 24.6 气态 立方英尺 SCF 9.671 21.32 1 38.04 112.5 29.71 气态 立方英尺 SCF 8.741 19.253 1 38.04 74.04 19.562 1 0.0519 1.9772 3.842 1.0151 立方米 Nm3 0.2294 0.5058 0.0263 1 1.9431 0.5134 加仑 Gal 0.1181 0.2603 0.0135 0.5146 1 0.2642 1 0.0469 1.784 5.276 1.3936 立方米 Nm3 0.2543 0.5605 0.0263 1 2.957 0.7812 加仑 Gal 0.0866 0.2315 0.0089 0.3305 1 0.2642 液态 升 Lit 0.4469 0.986 0.0511 1.948 3.785 1 1 0.0329 1.2506 3.06 0.8083 立方米 Nm3 0.3627 0.7996 0.0263 1 2.447 0.6464 加仑 Gal 0.1481 0.3262 0.0107 0.408 1 0.2642 液态 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1 1 0.03755 1.4282 4.321 1.1416 立方米 Nm3 0.3173 0.6996 0.0263 1 3.026 0.7995 加仑 Gal 0.105 0.2315 0.0087 0.3305 1 0.2642 液态 升 Lit 0.5605 1.2349 0.0407 1.5443 3.785 1 液态 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1
二氧化碳液态到气态的体积比

二氧化碳液态到气态的体积比
二氧化碳液态转变为气态时,体积会急剧增大。
根据气体状态方程PV=RT,其中P为气体的压力,V为气体的体积,R为气体常数,T为气体的温度。
对于液态的二氧化碳,它处于较高的压力和低的温度下,分子之间间距较小,体积相对较小。
当二氧化碳液态转变为气态时,其压力减小,温度升高,分子之间间距增大,体积急剧增大。
一般情况下,当液态二氧化碳转变为气态时,体积会呈现几百倍到几千倍的增大。
具体的体积比取决于液态的压力和温度,同时也与所处的环境条件有关。
二氧化碳液态到气态的体积比

二氧化碳液态到气态的体积比二氧化碳是一种常见的化学物质,化学式为CO2,由一分子碳原子和两分子氧原子组成。
二氧化碳在常温常压下是无色无味的气体,常见于大气中的0.04%。
然而,在特定的条件下,二氧化碳可以变成液态或固态。
要讨论二氧化碳液态到气态的体积比,我们首先需要了解二氧化碳的相变规律。
相变是指物质由一种物态转变为另一种物态的过程。
对于二氧化碳来说,它在标准环境下(常温25℃、常压1大气压)下的相变规律如下:在常温常压下,二氧化碳处于气态。
当温度下降至-78.5℃时,二氧化碳会发生凝固,变成固态。
而当温度上升至31.1℃时,二氧化碳会发生汽化,变成气态。
因此,二氧化碳的液态存在于-78.5℃至31.1℃之间。
在正常的大气压下,当二氧化碳从液态变为气态时,它会经历以下过程。
首先,二氧化碳液体会受到热量的加热,温度逐渐上升。
当温度达到二氧化碳的临界温度时,液态的二氧化碳转变为临界状态的气态。
在临界状态下,液态和气态没有明显的区别,它们的密度相等,体积也相等。
因此,在临界温度以下,液态二氧化碳的体积比气态二氧化碳大。
当温度继续升高,超过二氧化碳的临界温度时,液态二氧化碳不再存在,二氧化碳直接从固态转变为气态,这个过程叫做升华。
在升华过程中,固态二氧化碳直接跳过液态,转变为气态,没有液态存在。
在这个温度和压力条件下,液态二氧化碳的体积比气态二氧化碳小。
值得注意的是,随着温度和压力的变化,二氧化碳的固态、液态和气态之间的相互转变将发生变化。
例如,在低于标准环境压强的条件下,二氧化碳可直接从固态转变为气态,而不经过液态。
此外,二氧化碳的体积比还可以通过其他因素来影响。
例如,当二氧化碳受到压力约束时,其体积会相应减小。
这是由于压力会增加分子之间的相互作用力,使分子更加靠近,从而减小体积。
这种关系被Boyle定律描述,即压强与体积成反比,温度保持不变。
总之,二氧化碳的液态到气态的体积比受到温度、压力和相变状态等因素的影响。
气态氮气与液态氮气转换系数

气态氮气与液态氮气转换系数氮气在常温下分为气态和液态两种状态,气态氮气是指氮气以气体形式存在,处于大气压力下,常温下氮气为气体态。
液态氮气指的是将气态氮气冷却至低于氮气的临界温度(-146)时,氮气会发生相变,由气态变为液态。
气态氮气与液态氮气之间的相变由一定的转换系数描述,转换系数是指在单位体积和单位时间内气态氮气转变为液态氮气的比率。
具体来说,转换系数表示了单位时间内由气态氮气转变为液态氮气的量。
然而,转换系数受到诸多因素的影响,主要包括温度、压力和气液界面积等。
温度是影响相变的最重要的因素之一,温度越低,氮气从气态到液态的转化速率就越快。
压力也是影响相变的因素之一,增加氮气的压力可以促进气态氮气向液态氮气的转化。
气液界面积也会影响转换系数,界面积越大,气态氮气向液态氮气的转化速率就越快。
在工业生产中,常用的气态氮气与液态氮气转换系数是2:1。
这意味着在单位时间内气态氮气转变为液态氮气的量是气态氮气量的两倍。
这个转换系数是根据实际生产经验得出的,经过实践证明在这个转换系数下,可以获得较高的产量和较高的效率。
气态氮气与液态氮气的相互转换在许多领域有广泛的应用。
在工业上,液态氮气常用于冷冻、冷却、凝固和气体的输送等方面。
在科学研究领域,液态氮气被用于实验室的冷冻保存、超导材料的制备和保护性气氛的提供等。
总结起来,气态氮气与液态氮气之间的转换系数是指在单位体积和单位时间内气态氮气转变为液态氮气的比率。
在工业生产中常用的转换系数是2:1,即单位时间内气态氮气转变为液态氮气的量是气态氮气量的两倍。
转换系数受到温度、压力和气液界面积等因素的影响。
气态氮气与液态氮气的转换在工业和科学研究中有着广泛的应用。
最后,需要指出的是,转换系数的具体数值还会受到不同实际条件和设备的影响,在具体生产中需要根据实际情况进行调整。
二氧化碳液态到气态的体积比

二氧化碳液态到气态的体积比引言二氧化碳(CO2)是一种常见的无色气体,广泛存在于大气中、地下和海洋中。
它在自然界中的存在形式包括液态和气态。
当二氧化碳从液态转变为气态时,其体积会发生变化。
本文将探讨二氧化碳从液态到气态的体积比,并对其原因进行解释。
二氧化碳的性质作为一种三原子分子,二氧化碳具有特殊的物理和化学性质。
在常温常压下,二氧化碳是一种无色、无味、不可燃的气体。
它具有高溶解度和稳定性,并且容易被压缩成液态。
液态与气态之间的转变当二氧化碳处于足够低的温度(-78.5°C)和足够高的压力(5.1大气压)下时,它会转变为液态。
这个温度和压力被称为临界点,超过这个点后就无法保持液态状态。
当液态二氧化碳受热或减压时,它会转变为气态。
这个过程被称为汽化。
二氧化碳的汽化过程是一个吸热过程,需要耗费能量。
在液态到气态的转变中,二氧化碳的体积会增大。
体积比的计算要计算二氧化碳从液态到气态的体积比,我们需要知道液态和气态之间的密度差异。
根据理想气体状态方程(PV = nRT),我们可以推导出以下公式:V_gas = V_liq * (ρ_liq / ρ_gas)其中,V_gas表示气体体积,V_liq表示液体体积,ρ_liq表示液体密度,ρ_gas表示气体密度。
据统计数据显示,在常温下(25°C),液态二氧化碳的密度约为1.562 g/cm³,而相同条件下的气态二氧化碳密度约为0.00198 g/cm³。
将这些数值带入上述公式中,我们可以得到:V_gas = V_liq * (1.562 / 0.00198)通过简单计算可得到,V_gas ≈ 790 V_liq因此,二氧化碳从液态到气态时的体积比约为790:1。
原因解释二氧化碳从液态到气态的体积比较大的主要原因是其分子结构和相互作用力的改变。
在液态状态下,二氧化碳分子之间存在较强的吸引力,分子间距较小。
当液态二氧化碳受热或减压时,分子之间的吸引力减弱,使得分子更容易运动并扩散到更大的空间中,从而导致体积增大。
气体的标准体积换算公式

气体的标准体积换算公式
气体体积计算公式:Vm=V/n,其中V为物质体积,n为物质的量(单位mol)
气体是指无形状有体积的可压缩和膨胀的流体。
气体是物质的一个态。
气体与液体一样是流体:它可以流动,可变形。
与液体不同的是气体气体分子间距离很大,可以被压缩膨胀。
假如没有限制(容器或力场)的话,气体可以膨胀,其体积不受限制。
气态物质的原子或分子相互之间可以自由运动。
气态物质的原子或分子的动能比较高。
气体形态可过通其体积、温度和其压强所影响。
这几项要素构成了多项气体定律,而三者之间又可以互相影响。
基本含义
气体有实际气体和理想气体之分。
理想气体被假设为气体分子之间没有相互作用力,气体分子自身没有体积,当实际气体压力不大。
分子之间的平均距离很大,气体分子本身的体积可以忽略不计,温度又不低,导致分子的平均动能较大,分子之间的吸引力相比之下可以忽略不计,实际气体的行为就十分接近理想气体的行为,可当作理想气体来处理。
以下内容中讨论的全部为理想气体,但不应忘记,实际气体与之有差别,用理想气体讨论得到的结论只适用于压力不高,温度不低的实际气体。
常用气体单位换算
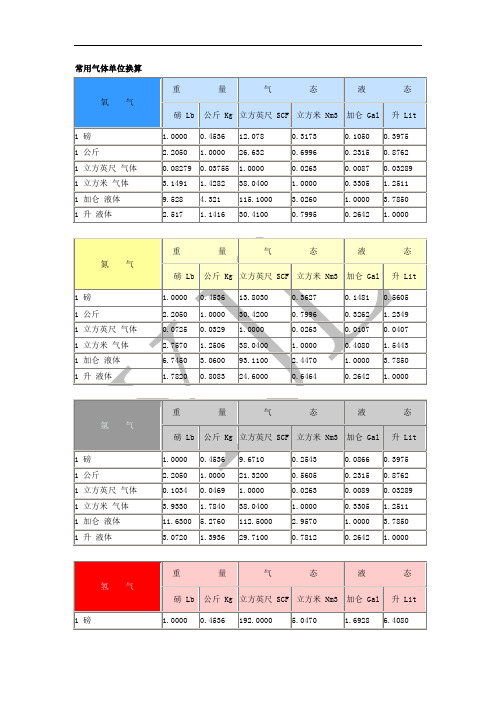
氮 气
重 量
气 态
液 态
磅 Lb
公斤 Kg
立方英尺 SCF
立方米 Nm3
加仑 Gal
升 Lit
1 磅
1.0000
0.4536
13.8030
0.3627
0.1481
0.5605
1 公斤
2.2050
1.0000
30.4200
0.7996
0.3262
1.2349
1 立方英尺 气体
0.0725
0.0329
氢 气
重 量
气 态
液 态
磅 Lb
公斤 Kg
ቤተ መጻሕፍቲ ባይዱ立方英尺 SCF
立方米 Nm3
加仑 Gal
升 Lit
1 磅
1.0000
0.4536
192.0000
5.0470
1.6928
6.4080
1 公斤
2.2050
1.0000
423.3000
11.1260
3.7330
14.1280
1 立方英尺 气体
0.0052
0.0024
1.0000
0.0263
0.0088
0.0334
1 立方米 气体
0.1982
0.0899
38.0400
1.0000
0.3355
1.2699
1 加仑 液体
0.5906
0.2679
113.4100
2.9810
1.0000
3.7850
1 升液体
0.1560
0.0708
29.9900
0.7881
0.2642
二氧化碳液态到气态的体积比

二氧化碳液态到气态的体积比
(实用版)
目录
1.二氧化碳的物理性质
2.液态二氧化碳的体积
3.气态二氧化碳的体积
4.液态到气态的体积比
正文
一、二氧化碳的物理性质
二氧化碳(CO2)是一种常见的无色气体,在常温常压下呈现为气态。
然而,当温度降低到 -78.5 摄氏度以下时,二氧化碳会变成液态。
当温度继续降低到 -194.35 摄氏度以下时,二氧化碳会变成固态,也称为干冰。
二、液态二氧化碳的体积
液态二氧化碳的体积受到温度和压力的影响。
在常温常压下,液态二氧化碳的密度约为 1.98 g/cm。
随着温度的升高,液态二氧化碳的体积会膨胀。
当液态二氧化碳的温度升高到-78.5摄氏度时,它会开始转变为气态,此时体积会有显著的增加。
三、气态二氧化碳的体积
气态二氧化碳的体积主要受到温度和压力的影响。
在常温常压下,气态二氧化碳的密度约为 1.98 kg/m。
随着温度的升高,气态二氧化碳的体积也会膨胀。
当温度达到-194.35摄氏度时,气态二氧化碳会变成固态,此时体积会有显著的减小。
四、液态到气态的体积比
液态二氧化碳转化为气态二氧化碳时,体积会发生显著的变化。
在常温常压下,液态二氧化碳的体积约为气态二氧化碳的 1/500。
这意味着,当液态二氧化碳转化为气态二氧化碳时,体积会增加约 500 倍。
这种体积变化在实际应用中有很多重要作用,如制冷系统、灭火设备等。
总之,二氧化碳在液态和气态之间的转换伴随着显著的体积变化。
氮气的气液比

氮气的气液比
氮气是一种常见的气体,其化学式为N2。
在常温常压下,氮气是一种无色无味的气体,但在低温下,它会凝结成液态。
氮气的气液比是指在标准温度压力下,氮气的液态体积与气态体积的比值。
根据理想气体状态方程,气体体积与压力呈反比例关系,即
PV=nRT。
在标准温度压力下,氮气的压力为1 atm,温度为273 K,摩尔质量为28 g/mol。
因此,氮气的气液比可以通过以下公式计算:气液比 = V液 / V气 = (n液 x RT) / (n气 x RT) = n液 / n 气
其中,V液和V气分别表示氮气的液态体积和气态体积,n液和n气分别表示氮气的液态摩尔数和气态摩尔数,R为理想气体常数,T 为温度。
根据氮气的物理性质,可以得出其气液比大约为1/700。
也就是说,氮气在液态下的体积只有气态下的1/700。
这是因为在液态下,氮气分子之间的距离更近,分子密度更大,导致液态氮气的分子体积更小。
氮气的气液比对于许多工业和实验应用都非常重要。
例如,在液氮冷冻过程中,需要知道氮气的气液比来计算液态氮气的容器大小和气体泄露的风险。
此外,氮气的气液比还可以用于计算氮气在气相和液相之间的相变热和气体压缩过程中的体积变化。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理想气体状态方程(克拉伯龙方程):
标准状态是指0℃(273K),1atm=101.3 kPa的状态下。
V=nRT
V:标准状态下的气体体积;
n:气体的摩尔量;
R:气体常量、比例系数;8.31441J/mol•K
T:绝对温度;273K
P:标准大气压;101.3kPa
V=nRT=n•8.31441•273/101.3
或V=nRT=n•0.082•273/1
另可以简便计算:V=V0•ρ•22.4/M
V:标准状态下的气体体积;
V0:气体液态体积;
ρ:液化气体的相对密度;
M:分子量。
氮的标准沸点是-195.8℃,液体密度0.808(-195.8℃),1m3液氮可汽化成氮气
1*(808/28)*22.4=646.4 标立
二氧化碳液体密度1.56(-79℃),
1m3液态二氧化碳可汽化成二氧化碳
1*(1560/44.01)*22.4=794 标立
氯的标准沸点是-34℃,液体密度1.47, 1m 3液氯可汽化成氯气
1*(1470/70.9)*22.4=464.4 标立
液态氧气体体积膨胀计算
在标准状态下0℃,0.1MPa ,1摩尔气体占有22.4升体积,根据液态气体的相对密度,由下式可计算出它们气化后膨胀的体积:
4.221000⨯⨯⨯=
M
d v V o
o V — 膨胀后的体积(升) v o — 液态气体的体积(升) d o — 液态气体的相对密度(水=1) M — 液态气体的分子量
将液氧的有关数据代入上式,由d o =1.14,M=32得
o
o o
o v v M
d v V 7984.22100032
14.14.221000=⨯⨯⨯=⨯⨯⨯=
即液氧若发生泄漏则会迅速气化,其膨胀体积为原液态体积为798倍。
b. 液氧爆破能量模拟计算:
液氧处于过热状态时,液态介质迅速大量蒸发,使容器受到很高压力的冲击,产生暴沸或扩展为BLEVE 爆炸,其爆破能量是介质在爆破前后的熵、焓的函数。
1)计算过程
(1)容器爆破能量计算公式 E L =[(i 1-i 2)-(s 1-s 2)T b ]m
式中:E L ——过热状态下液体的爆破能量 KJ ;
i1——爆破前饱和液体的焓KJ/kg;
i2——在大气压力下饱和液体的焓KJ/kg;
s1——爆破前饱和液体的熵KJ/(kg·k);
s2——在大气压力下饱和液体的熵KJ/(kg·k);
m——饱和液体的质量kg;
T b——介质在大气压下的沸点k
(2)30m3液氧储罐的爆破能量
本项目液氧贮存在1个容积为30m3/1.84Mpa的储罐内,液氧最大储存量为34290kg,液氧沸点90.188K;假设事故状态下储罐内液氧的的温度为95K,则爆破能量:
E= [ (167.2-125.4) -(1.73-1.65)×90.188]×34290=1186091KJ
(3)将爆破能量换算成TNT能量q,1kg TNT平均爆炸能量为4500kJ/kg,故q=E/4500=1186091/4500=264 (kg)
(4)求出爆炸的模拟比α
即得α=0.1q1/3=0.1×(264)1/3=0.64
(5)查得各种伤害、破坏下的超压值
表5-4 冲击波超压对人体及建筑物伤害破坏作用表
(6)求出在1000kg TNT爆炸试验中的相当距离R0
根据相关数据查得:
Δp=0.02时R0=56;
Δp=0.03时R0=43;
Δp=0.05时R0=32;
Δp=0.10时R0=23;
Δp=0.20时R0=17;
(7)求出发生爆炸时各类伤害半径
R1=R0×α=56×0.64≈35.8m;
R2=R0×α=43×0.64≈27.5m;
R3=R0×α=32×0.64≈20.5m;
R4=R0×α=23×0.64≈14.7m;
R5=R0×α=17×0.64≈10.9m;
2)事故后果预测小结
按照单罐物理性爆炸事故后果预测,如果一台30m3的低温液氧储罐爆炸,其各类伤害、损失半径见表5-5。
表5-5 冲击波超压对人体及建筑物伤害破坏作用半径表
综上,液氧若发生泄漏则会迅速气化,其膨胀体积为原液态体积为798倍;发生爆炸(30m3液氧)的冲击波超压破坏作用数据见表4-6。
计算可见,如氧罐发生物理爆炸,对50米外的丙烷气站人员及设备不会造成太大的影响。
