各类有机物性质一览表
有机物性质归纳

一.烃的结构与化学性质类别通式官能团烷C n H2n+2(n≥ 1)————烃烯C n H2n(n≥2)烃〔单烯烃〕炔C n H2n-2(n≥ 2)代表物分子结构结点由 C、H 构成,碳碳之间为单键连接成CH4链状,任何结构的〔 Mr :16〕所有原子不可能共面!①链状〔可以带支链〕CH2=CH2(Mr :28〕②有CH3— CH=CH2③分子中与碳碳双〔 Mr :42〕键相连的所有原子在同一个平面上①、链状〔可以带H— C≡ C—H〔Mr:支链〕②有主要化学性质1.光照下的卤代;2.裂化;3.不使酸性 KMnO4溶液或溴水褪色; 4.可燃1、加成:X2、H2、HX、HCN2、加聚:一般条件催化剂〔△〕。
3.易被氧化。
与 O2〔条件:PbCl2、CuCl2、加压、加热〕反响生成 CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:黑烟〔炔类是.浓黑烟〕..1、加成:X2、H2、HX、HCN 2、聚合 : 一般条件催化剂。
〔△〕3.易被氧化。
与 HO2〔条件:HgSO 〕反应生成4烃〔单〕—C≡C—26〕—C≡C—③、分子成直线型CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:浓黑烟〔烯类..是黑烟〕.苯及n 2n-6(n≥ 6)C H同系〔不包括萘————物等〕(Mr : 78〕或甲苯①、六元环。
②、一个分子只有一个苯环,侧链为烷基。
③、 12 个原子共面1、取代:与 Br2在Fe〔实际是Fe3+〕做催化剂生成溴苯。
2、加成:与H2〔 Ni 催化〕环己烷;与Cl2〔紫外线〕生成“六六六〞。
3典型反响:卤代、硝化。
二.烃的衍生物的结构与化学性质类别通式一卤代烃:卤代R—X烃多元饱和卤代烃:Cn H2n+2-m X m一元醇:R—OH醇饱和多元醇:C n H2n+2O m醚R—O—R′酚醛酮羧酸酯官能团卤原子—X醇羟基—OH醚键酚羟基—OH醛基羰基羧基酯基代表物C2H5Br(Mr : 109〕CH3OH(Mr : 32〕C2 H5 OH(M r : 46〕C2H5O C2H5(M r : 74〕(M r : 94〕HCHO(M r : 30〕(M r : 44〕(M r : 58〕(M r : 60〕HCOOCH3(M r : 60〕(M r : 88〕分子结构结点主要化学性质卤素原子直接与烃基 1.与 NaOH 水溶液共热发生取结合代反响生成醇β-碳上要有氢原子才 2.与 NaOH 醇溶液共热发生消能发生消去反响去反响生成烯羟基直接与链烃基结1.跟活泼金属反响产生 H22.跟卤化氢或浓氢卤酸反响生合, O—H 及 C—O 均成卤代烃有极性。
常见有机物的性质与应用

常见有机物的性质与应用有机物是以碳元素为基础构建的化合物,广泛存在于自然界和人工合成中。
它们具有丰富多样的性质和广泛的应用。
本文将介绍一些常见的有机物性质及其在各领域中的应用。
一、醇类化合物醇是一类中性、水溶性的有机化合物,其分子中含有羟基(-OH)。
醇的性质主要取决于碳链长度和羟基位置,因此不同类型的醇具有不同的性质和应用。
丙二醇(C3H8O2)是一种常见的醇类有机物。
由于其双羟基结构,丙二醇表现出良好的溶解性和稳定性,在化妆品、医药和食品等领域得到广泛应用。
例如,丙二醇可用作皮肤保湿剂、药物辅料和食品添加剂等。
二、醛类化合物醛是一类含有羰基(>C=O)的有机化合物,一般以-CHO为基础表示。
醛具有一定的还原性和活性,可发生各种有机反应。
甲醛(CH2O)是一种简单的醛类有机物。
由于其低毒性和良好的稳定性,甲醛被广泛应用于纸浆制造、染料合成和防腐剂等方面。
此外,甲醛还可以用于制备化肥和塑料等产品。
三、酮类化合物酮是一类含有羰基的有机化合物,其羰基结构位于碳链内部。
酮的物理、化学性质取决于碳链长度和酮基位置。
丙酮(C3H6O)是一种常见的酮类有机物。
丙酮具有良好的溶解性和挥发性,广泛应用于溶剂、表面活性剂和染料中。
此外,丙酮还可用于合成农药、医药和塑料等领域。
四、酸类化合物酸是一类含有羧基(-COOH)的有机化合物,其分子中的羧基可释放出氢离子形成氢离子。
酸的性质主要取决于羧基的取代和酸解离程度。
乙酸(CH3COOH)是一种常见的酸类有机物。
乙酸广泛应用于化学工业、制药和食品工业中。
例如,乙酸可用作溶剂、防腐剂和食品酸味剂等。
五、酯类化合物酯是一类含有酯基(-COO-)的有机化合物,其由酸和醇反应生成。
酯的性质受其碳链长度和酯基取代的影响。
乙酸乙酯(C4H8O2)是一种常见的酯类有机物。
乙酸乙酯具有良好的溶解性和挥发性,在溶剂、涂料和香水等方面得到广泛应用。
六、醚类化合物醚是一类含有氧原子连接两个碳链的有机化合物。
高中化学有机物知识点

高中化学有机物知识点有机代表物质的物理性质1. 状态固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下)气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷液态:油状: 硝基苯、溴乙烷、乙酸乙酯、油酸粘稠状: 石油、乙二醇、丙三醇2. 气味无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味)稍有气味:乙烯特殊气味:苯及同系物、萘、石油、苯酚刺激性:甲醛、甲酸、乙酸、乙醛甜味:乙二醇、丙三醇、蔗糖、葡萄糖香味:乙醇、低级酯苦杏仁味:硝基苯3. 颜色白色:葡萄糖、多糖淡黄色:TNT、不纯的硝基苯黑色或深棕色:石油4. 密度比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃5. 挥发性:乙醇、乙醛、乙酸6. 升华性:萘、蒽7. 水溶性:不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4能溶:苯酚(0℃时是微溶)微溶:乙炔、苯甲酸易溶:甲醛、乙酸、乙二醇、苯磺酸与水混溶:乙醇、苯酚(70℃以上) 、乙醛、甲酸、丙三醇有机物之间的类别异构关系1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃;2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃;3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚;4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮;5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯;6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚;如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚.7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.能发生取代反应的物质1. 烷烃与卤素单质: 卤素单质蒸汽(如不能为溴水)。
有机物的物理性质

有机物的物理性质
一、状态:
1、烷烃1-4气体5-16液体17以上固体
2、烯烃2-4气体5-18液体19以上固体
3、炔烃2-4气体5-15液体16以上固体
4、单环芳烃全为液体
5、卤代烃,气体:
氟甲烷、氟乙烷、氟丙烷
氯四烷、氯乙烷
溴甲烷
其余均为液体
6、醇:
1-4个碳流动性液体
5-12碳油状液体
12以上为固体
7、酚
一般为固体,苯酚为无色针状晶体
少数烷基酚为液体
8、醛
甲醛为气体
低级醛为液体
苯乙醛为固体
9、低级羧酸与酯为液体
二、密度
1、气态有机物的相对分子质量大于29时,密度比空气大;
2、液态有机物密度比水小的有烃(烷、烯、炔、芳香烃)、低级酯、一氯代烃、乙醇、乙醛等;
3、密度比水大的有硝基苯、溴苯、四氯化碳、氯仿、溴代烃、乙二醇、丙三醇等。
4、烷、烯、炔等烃类同系物相对密度随着分子内碳原子数的增加的而增大;一氯代烷的相对密度随着碳原子数的增加而减小。
(完整版)有机物的化学性质(终极最全版)

《有机化学基础》总结(二)——有机物的化学性质一、断键部位小结——预测官能团的性质和反应类型1、双键(C=C,C=O)、三键2、极性键:极性键极性越强越易断(共价键的极性)3、不同基团的相互影响(官能团相邻碳上的氢)二、有机物的化学性质(一)烷烃1、取代反应:注意:(室温下,在暗处不发生反应,但不能用强光直接照射,否则会发生爆炸)。
②反应物:纯卤素单质气体,如甲烷通入溴水中不反应。
③反应不会停留在某一步,因此产物是5种物质的混合物。
1 mol H被取代,需要1mol Cl2,认为1个Cl2分子能取代2个H原子是一个常见的错误。
2、氧化反应:在空气中燃烧:()n2n+2222C H+O nCO+n+1H O3n+12−−−→点燃3、裂化反应:注意:环烷烃的化学性质与烷烃相似。
(二)烯烃1、加成反应:烯烃可与H2、X2、HX、H2O等发生加成反应,如:反应物与烯烃R—CH=CH2反应的方程式溴水,卤素单质(X2)R—CH=CH2+Br2—→R—CHBr—CH2Br(常温下使溴水褪色)氢气(H2)R—CH=CH2+H2∆−−−−→催化剂R—CH2—CH3水(H2O)R—CH=CH2+H—OH−−−−−→催化剂加热,加压R—CH—CH3或R—CH2—CH2OH氯化氢(HCl)R—CH=CH2+HCl∆−−−−→催化剂R—CH—CH3或R—CH2—CH2Cl氰化氢(HCN)R—CH=CH2+HCN∆−−−−→催化剂R—CH—CH3或R—CH2—CH2CNOHClCN2、氧化反应(1)将烯烃通入酸性高锰酸钾溶液中会使溶液的颜色变浅直至消失。
5CH 2=CH 2+12KMnO 4+18H 2SO 4→10CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 注意:分离甲烷和乙烯不用酸性KMnO 4。
分离甲烷和乙烯不用酸性KMnO 4拓展:烯烃与KMnO 4的反应:在中性或碱性的高锰酸钾溶液中, 烯烃被氧化成二元醇,高锰酸钾被还原成MnO 2。
各类有机物性质一览表

各类有机物性质一览表有机物是由碳和氢等元素组成的化学物质,其性质多种多样。
本文将为您提供一份各类有机物性质的一览表,帮助您更好地了解和掌握有机化学的知识。
一、烃类烃类是由碳和氢组成的有机化合物,包括烷烃、烯烃和炔烃三类。
1. 烷烃(Alkanes):- 物理性质:a) 烷烃一般为无色气体或液体,随碳链增长而升高沸点和融点。
b) 烷烃的密度较小,常用比重瓶法测定。
- 化学性质:a) 烷烃可以发生取代反应,如卤代烷生成取代产物。
b) 在适当条件下,烷烃还可以发生燃烧反应,生成二氧化碳和水。
2. 烯烃(Alkenes):- 物理性质:a) 烯烃常见的是无色气体或液体,在室温下存在。
b) 烯烃的密度通常较小。
- 化学性质:a) 烯烃可以进行加成反应,如与溴水生成溴代烷。
b) 烯烃还可以进行聚合反应,生成高分子化合物。
3. 炔烃(Alkynes):- 物理性质:a) 炔烃一般为无色气体或液体。
b) 炔烃的密度相对较小。
- 化学性质:a) 炔烃可以进行加成反应,如与溴水生成溴代炔烃。
b) 炔烃可以和水反应生成醛和酮。
二、醇类醇是含有羟基(—OH)的有机化合物。
1. 一元醇(Monohydroxy Alcohols):- 物理性质:a) 一元醇常见的是无色液体。
b) 醇的氢键使其具有比醚、酮和醛有更高的沸点。
- 化学性质:a) 一元醇可以发生酯化反应,生成酯类化合物。
2. 二元醇(Polyhydroxy Alcohols):- 物理性质:a) 二元醇一般为无色液体。
b) 二元醇的水溶液具有较高的粘度。
- 化学性质:a) 二元醇可以发生糖化反应,生成糖类化合物。
三、酮类酮是含有羰基(C=O)的有机化合物。
1. 简单酮(Simple Ketones):- 物理性质:a) 简单酮常为无色液体。
b) 酮的沸点较相应的醇和醚高。
- 化学性质:a) 简单酮可以发生还原反应,生成相应的醇。
2. 糖酮(Sugar Ketones):- 物理性质:a) 糖酮常为无色或白色固体。
常见无机物有机物性质归纳
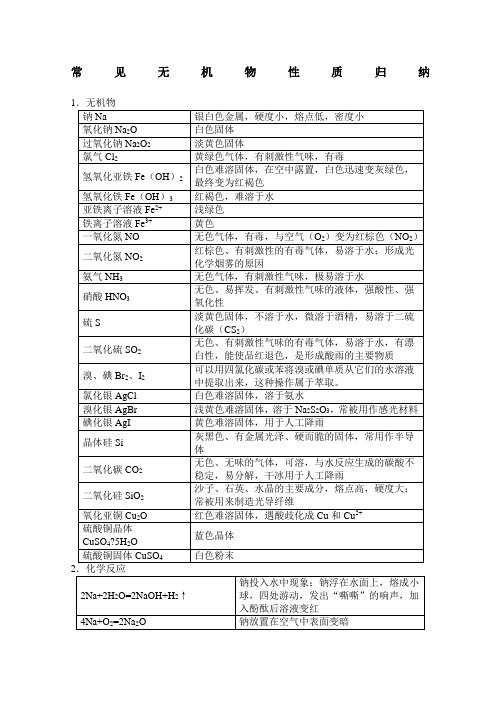
常见无机物性质归纳2Na+O 2 △Na 2O 2钠燃烧,产生黄色火焰,生成淡黄色固体 2Na 2O 2+2H 2O=4NaOH+O 2↑ 2Na 2O 2+2CO 2=2Na 2CO 3+O 2 过氧化钠可作为呼吸面具和潜水艇里氧气的来源 2Na+Cl 2点燃2NaCl冒白烟 2Fe+3Cl 2点燃2FeCl 3 产生棕黄色的烟 Cu+Cl 2点燃CuCl 2 产生棕色的烟 H 2+Cl 2点燃2HCl产生苍白色火焰Cl 2+H 2O=HCl+HClO HClO 不稳定,有强氧化性,可做漂白剂,Cl 2可用作漂白剂(Cl 2不能使干燥的红纸条退色)Cl 2+2NaOH=NaCl+NaClO+H 2O 制漂白精Cl 2+2CaOH=CaCl 2+Ca (ClO )2+H 2O工业制漂白粉,漂白粉的成分CaCl 2和Ca (ClO )2,有效成分为Ca (ClO )2 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3白色沉淀迅速变成灰绿色,最后变成红褐色Fe 3++3SCN -=Fe(SCN)3红色溶液,可用KSCN 、NH 4SCN 溶液检验Fe 3+Fe+2H +=Fe 2++H 2↑ Fe 具有还原性 2Fe 3++Fe=3Fe 2+ Fe 3+具有氧化性 Fe 2++Zn=Fe+Zn 2+2Fe 2++Cl 2=2Fe 3++2Cl -Fe2+既有氧化性又有还原性Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑NaHCO 3+HCl=NaCl+H 2O+CO 2↑ NaHCO 3+NaOH=Na 2CO 3+H 2O2NaHCO 3 △Na 2CO 3+H 2O+CO 2↑N 2+O 22NON 2+3H 2催化剂高温高压 2NH 3使空气中游离态的氮转化为含氮化合物叫做氮的固定(固氮) 2NO+O 2=2NO 23NO 2+H 2O=2HNO 3+NO NH 3+H 2O=NH 3·H 2O NH 3·H 2O NH 4++OH - NH 3·H 2O 呈弱碱性,氨水能使酚酞溶液变红 NH 3+HCl=NH 4Cl 产生白烟4NH 3+5O 2 催化剂△4NO+6H 2ONH 4HCO 3△NH 3↑+H 2O+CO 2↑NH 4Cl△NH 3↑+HCl ↑NH 4++OH -△NH 3↑+H 2O (用于检验铵根离子) 2NH 4Cl+Ca(OH)2 △CaCl 2+2NH 3↑+2H 2O 实验室制氨气,用湿润的红色石蕊试纸检验氨气是否收集满4HNO 34NO 2↑+O 2↑+2H 2O为了防止硝酸见光分解,一般将它保存在棕色试剂瓶里,不能用胶塞Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 常温下,浓硝酸可使铁、铝钝化受热或见光放电有机物具有相同分子式而结构不同的两种化合物互为同分异构体(如正丁烷和异丁烷)。
有机物物理性质

有机物物理性质归类一密度烃的密度一般随碳原子数的增多而增大;一氯代烃的相对密度随着碳原子数的增加而减小。
注意:1.通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。
2.通常液态有机物与水相比:密度比水小:烃,酯,一氯代烃,一元醇,醛,酮,高级脂肪酸等密度比水大:硝基苯,溴代烃,二氯(或以上)代烃,乙二醇,丙三醇等二状态[常温常压(1个大气压、20℃左右)]由于有机物大都为大分子(相对无机物来说),所以有机物分子间引力较大,因此一般情况下呈液态和固态,只有少部分小分子的有机物呈气态支链越多,熔沸点越低1.随着分子中碳原子数的增多,烃由气态经液态到固态。
分子中含有1~4个碳原子的轻一般为气态,5~16个碳原子的烃一般为液态,17个以上的为固态。
如通常状况下CH4、C4H8呈气态,苯及苯的同系物一般呈液态,大多数呈固态。
2.醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。
3.醛类通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。
4.酯类通常状况下一般分子中碳原子数较少的酯呈液态,其余都呈固态。
5.苯酚及其同系物由于含有_OH,且苯环相对分子质量较大,故通常状况下此类物质呈固态。
常见物质(1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃)氟里昂(CCl2F2,沸点为-29.8℃)氯乙烯(CH2==CHCl,沸点为-13.9℃)甲醛(HCHO,沸点为-21℃)氯乙烷(CH3CH2Cl,沸点为12.3℃)一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
有机化合物的重要物理性质归纳

有机化合物的重要物理性质归纳有机物一般不易溶于水,而易溶于有机溶剂,这是因为有机物分子大多数是非极性分子或弱极性分子,含有憎水基。
根据“相似相溶”原理,水是极性分子,只有当某有机物分子中含有亲水基团时,则该有机物就可能溶于水。
亲水基一般包括:-OH、-CHO、COOH等;憎水基一般包括:-R、-NO2、-X、-COOR等。
1. 能溶于水的有机物:易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
① 小分子醇:CH3OH、C2H5OH、CH2OHCH2OH、甘油等;② 小分子醛:HCHO、CH3CHO、CH3CH2CHO等;③ 小分子羧酸:HCOOH、CH3COOH、CH3CH2COOH等;④ 低糖:葡萄糖(C6H12O6)、果糖(C6H12O6)、蔗糖(C12H22O11);⑤ 氨基酸:CH3CH(NH2)COOH等。
一般来说,低级醇、低级醛、低级酸,单糖和二糖水溶性好,即亲水基占得比重相对较大,憎水基占得比重相对较小,故能溶于水。
2. 不易溶于水的有机物:难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
① 烷、稀、炔、芳香烃等烃类均不溶于水,因为其分子内不含极性基团;② 卤代烃:CH3Cl、CHCl3、CCl4、CH3CH2Br、等均不溶于水;③ 硝基化合物:硝基苯、TNT等;④ 酯:CH3COOC2H5、油脂等;⑤ 醚:CH3OCH3、C2H5OC2H5等;⑥ 大分子化合物或高分子化合物:如高级脂肪酸、塑料、橡胶、纤维等。
一般来说,液态烃、一氯代烃、苯及其同系物、酯类物质不溶于水且密度比水小;硝基苯、溴苯、四氯化碳、氯仿、溴代烃、碘代烃不溶于水且密度比水大。
3. 有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中的相反:如乙醇是由较小憎水基团-C2H5和亲水基团-OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以必定也溶于四氯化碳等有机溶剂中。
有机物性质

甲苯无色澄清液体。
有苯样气味。
有强折光性。
能与乙醇、乙醚、丙酮、氯仿、二硫化碳和冰乙酸混溶,极微溶于水。
相对密度0.866。
凝固点-95℃。
沸点110.6℃。
折光率 1.4967。
闪点(闭杯)4.4℃。
易燃。
蒸气能与空气形成爆炸性混合物,爆炸极限1.2%~7.0%(体积)。
低毒,半数致死量(大鼠,经口)5000mg/kg。
高浓度气体有麻醉性。
有刺激性。
四氢呋喃四氢呋喃是一类杂环有机化合物。
它是强的极性醚类之一,在化学反应和萃取时用做一种中等极性的溶剂。
无色易挥发液体,有类似乙醚的气味。
溶于水、乙醇、乙醚、丙酮、苯等多数有机溶剂。
熔点-108.4℃沸点65-66℃密度0.8892(20℃)折射率1.4050自燃点610 ℃相对蒸汽密度2.5饱和蒸汽压15.20kPa(15℃)临界压力5.19MPa临界温度268℃与空气混合可爆;在空气中能形成可爆的过氧化物,遇明火、高温、氧化剂易燃; 燃烧产生刺激烟雾。
四氢呋喃是一个杂环有机化合物。
属于醚类,是芳香族化合物呋喃的完全氢化产物。
在化学反应和萃取时用做一种中等极性的非质子溶剂。
四氢呋喃室温时与水能部分混溶,部分不法试剂商就是利用这一点对四氢呋喃试剂兑水牟取暴利。
四氢呋喃在储存时容易变成过氧化物。
因此,商用的四氢呋喃经常是用BHT,即2,6-二叔丁基对甲酚来防止氧化。
四氢呋喃可以通过氢氧化钠置于密封瓶中存放在暗处保存。
乙醇乙醇是一种有机物,俗称酒精,结构简式CH₃CH₂OH或C₂H₅OH,分子式C₂H₆O,相对分子质量为46,是带有一个羟基的饱和一元醇。
乙醇在常温、常压下是一种易燃、易挥发的无色透明液体,无毒,浓度低可饮用;具有特殊香味,并略带刺激;微甘,并伴有刺激的辛辣滋味。
乙醇液体密度是0.789×10³kg/m³(20℃) ,乙醇气体密度为1.59kg/m³,沸点是78.3℃,熔点是-114.1℃;易燃,其蒸气能与空气形成爆炸性混合物,能与水以任意比互溶。
相关有机物性质表

1.MDEA刺激性物品2.DEA3.TEA刺激性物品4.DETA腐蚀性物品5.PZ腐蚀性物品6.MEA乙醇胺性质7.AEEA羟乙基乙二胺性质羟乙基乙二胺用途与合成方法8.AMPAMP的性质名称AMP(2-氨基-2-甲基-1-丙醇)分子C4H11NO式相对89.14分子质量熔30-31℃点沸165℃点蒸气<1 mm Hg ( 25 °C)压水溶能与水混溶,能溶于醇解性闪点153 °F密0.934g/mL at 25 °C度外白色结晶或无色粘稠液体观毒性半数致死量(大鼠,经口)2.90G/kG±0.14G/kG。
有刺激性。
危险Xi,F(刺激,易燃)性标志AMP的分子结构与C02反应方程吸收CO2的效果价格450元/250ml9.AEP名称AEP(N-乙基哌嗪)分子C6H14N2式相对114.19分子质量熔-60 °C点沸157 °C点蒸气0.05mmHg压水溶易溶于水、醇类等溶剂解性闪点110 °F密0.899 g/mL at 25 °C度外无色透明液体,有强烈胺味,在高温下易氧化而变色,观毒性中毒,与空气混合可能爆炸,有腐蚀性分子结构吸收CO2的效果价格355元/500ml10.SG名称SG(甘氨酸钠)分子NH2CH2COONa式相对97.04887分子质量熔197~201oC点沸347oC at 760mmHg点蒸气5.55E-05mmHg at 25oC压水溶吸湿性,易溶于水。
解性闪点163.7oC密1.014g/cm3度外白色或浅黄色结晶性粉末观SG的结构吸收CO2的效果价格588元/100g 11 TETA12 TBEE(可单独或与MDEA复配使用)13 DIPA。
初三化学有机化合物与它们的性质

初三化学有机化合物与它们的性质化学是我们生活中非常重要且广泛应用的一门科学。
其中,有机化合物是研究的重要内容之一。
它们是由碳元素与氢元素以及其他非金属元素构成的化合物,其在自然界与人类的生活中扮演着重要角色。
本文将介绍一些常见的有机化合物及其性质。
一、醇类化合物醇是一类含有羟基(-OH)的有机化合物。
它们可以通过碳酸酯的水解得到。
举例来说,乙醇(C2H6O)是最简单的醇类化合物。
醇类化合物常用作溶剂、消毒剂以及在医药领域中的应用。
醇类化合物的性质取决于其碳骨架的长度和官能团的位置。
一般来说,醇的物理性质与其分子量有关,分子量越大,沸点和溶解度越高。
纯醇类化合物通常无色,但会受到氧化而变色。
二、醛和酮类化合物醛和酮是具有羰基(-C=O)的有机化合物。
它们的差别在于羰基的位置。
醛中,羰基位于碳链的末端,而酮中则位于碳链的中间。
最简单的醛是甲醛(HCHO),最简单的酮是丙酮(CH3COCH3)。
醛和酮常用作溶剂、防腐剂以及某些合成反应的催化剂。
它们的物理性质与醇类化合物相似,但有一些差异。
醛和酮的沸点要高于相应的醇,这是由于碳链中的羰基给分子带来了额外的极性。
三、酸类化合物酸类化合物是具有羧基(-COOH)的有机化合物。
它们通常有酸性,并可以与碱反应生成盐和水。
最简单的有机酸是甲酸(HCOOH)。
酸类化合物在生物体内起着重要的作用,如进化、代谢和信号传递等。
此外,它们还被广泛用作工业上的催化剂、试剂和溶剂。
酸类化合物的物理性质因其结构和碳链长度而异,但总体来说,它们具有较高的沸点和溶解度。
四、酯类化合物酯是一类由羧酸和醇反应生成的有机化合物。
酯分子中的羧酸部分与醇分子中的羟基反应形成酯的酯键。
最简单的酯是甲酸甲酯(HCOOCH3)。
酯类化合物具有水合度低、挥发性强的特点,因此广泛应用于食品香料、溶剂和润滑油等领域。
五、烃类化合物烃是由碳和氢元素组成的有机化合物,不含其他元素。
根据碳原子间的连接方式,烃可分为饱和烃和不饱和烃两类。
有机物物理性质表
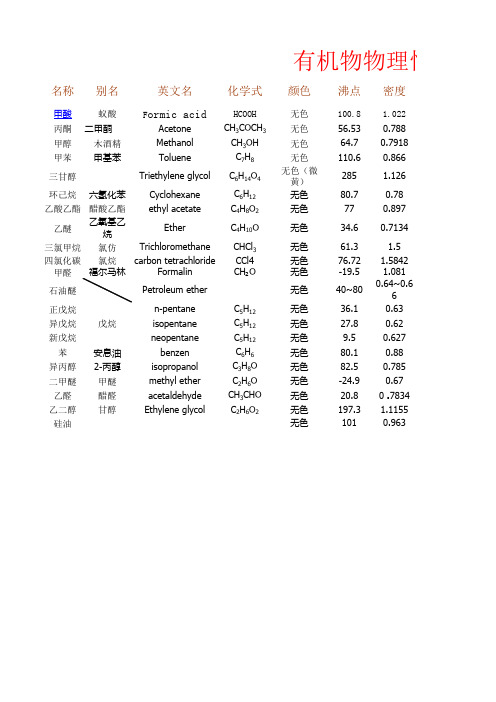
名称别名英文名化学式颜色沸点密度甲酸蚁酸F ormic acidHCOOH 无色100.8 1.022丙酮二甲酮Acetone CH 3COCH 3无色56.530.788甲醇木酒精Methanol CH 3OH 无色64.70.7918甲苯甲基苯Toluene C 7H 8无色110.60.866三甘醇Triethylene glycol C 6H 14O 4无色(微黄)285 1.126环己烷六氢化苯Cyclohexane C 6H 12无色80.70.78乙酸乙酯醋酸乙酯ethyl acetateC 4H 8O 2无色770.897乙醚乙氧基乙烷EtherC 4H 10O 无色34.60.7134三氯甲烷氯仿Trichloromethane CHCl 3无色61.3 1.5四氯化碳氯烷carbon tetrachloride CCl4无色76.72 1.5842甲醛Formalin CH ₂O 无色-19.5 1.081石油醚Petroleum ether 无色40~800.64~0.66正戊烷n-pentane C 5H 12无色36.10.63异戊烷isopentane C 5H 12无色27.80.62新戊烷neopentane C 5H 12无色9.50.627苯安息油benzen C 6H 6无色80.10.88异丙醇2-丙醇isopropanol C 3H 8O 无色82.50.785二甲醚甲醚methyl ether C 2H 6O 无色-24.90.67乙醛醋醛acetaldehyde CH 3CHO 无色20.80 .7834乙二醇甘醇Ethylene glycolC 2H 6O 2无色197.3 1.1155硅油无色1010.963有机物物理性质戊烷溶解性可燃性挥发性毒性易易易√易易易√易易易√微易易√低毒易易不√易易易√低毒微易易√低毒微易易√不不易√不不易√易易易√不易易√微易易√不易易√不易易√不易易√易易易√微易易√易易√易易√不可不无理性质表备注1无臭,粘稠,低毒,不溶于醚类戊烷、己烷混合物。
有机化合物的物理性质表

1.3390
-30.4
74.1
1.437920
C2H5OH,(C2H5)2O,CHCl3
CH2ClCHCl2
1,1,2-三氯乙烷
133.40
1.4397
-36.5
113.8
1.471420
C2H5OH,(C2H5)2O,C6H6
CHCl2CHCl21,1,2,2-四氯乙烷
167.85
1.5953
有机化合物的性质
Properties of Organic Compounds
有机化合物的一般性质
General Properties of Organic Compounds
下 表给出了有机化合物常用的物理常数。其中以分子式中碳原子的数目多少为序排列。表中符号说明如下。
Mr——相对分子质量;
ρ——密度,单位为g/ml。除 注明者外,均指在20.0℃状态下。其上角标若有其他数值,则表示在该温度下测得的密度;
45.08
0.68040
-93.0
7.4
1.35017
H2O,C2H5OH,(C2H5)2O
C2H5NH2乙胺
45.08
0.6829
-81.0
16.6
1.366320
H2O,C2H5OH,(C2H5)2O
H2NCH2CH2SH
2-氨基乙硫醇
77.14
-
99.0~100.0
-
-
H2O,C2H5OH
H2NCH2CH2OH
1.447220
H2O,C2H5OH,CH3COCH3
HCONHNH2甲酰肼
60.06
-
54.0
-
-
各类有机物的化学性质

有机化学中的高考热点问题系列一有机物的化学性质一.分类小结烷烃:取代(条件:纯卤素;光照)烯烃、炔烃:⑴加成(H2、卤素、卤化氢、水)⑵氧化:能使KMnO4酸性溶液褪色⑶加聚苯:⑴加成(H2),⑵取代(硝酸、卤素)苯的同系物:⑴加成(H2),⑵取代(硝酸、卤素)、⑶氧化(能使KMnO4酸性溶液褪色)卤代烃:⑴水解(条件:碱的水溶液、加热)⑵消去(条件:碱的醇溶液,加热)醇:⑴取代反应①与活泼金属反应②酯化反应③分子间脱水⑵催化氧化⑶消去反应酚:⑴氧化反应(能被KMnO4氧化)⑵与溴水取代⑶显色反应醛:⑴氧化反应(KMnO4溶液、O2、银氨溶液、新制的Cu(OH)2)⑵加成反应(H2)羧酸:⑴酸性⑵酯化反应酯:水解反应(酸性或碱性条件都可以)典型例题解析1.分子式为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是A.该有机物不能发生取代反应,但能发生加成反应B.该有机物不能是酸性的高锰酸钾溶液褪色,但能使溴水褪色C.该有机物分子中的所有原子可能在同一平面上D.该有机物的一溴代物最多有6种同分异构体2.从甜橙的芳香油中可分离得到如下结构的化合物现在试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu (OH )2,能与该化合物中所有官能团都发生反应的试剂有A .①②B .②③C .③④D .①④3.乙酸橙花酯是一种食用香料,结构如右图所示。
下列关于该物质的说法有① 该化合物属于羧酸类;② 该化合物的分子式为C 12H 18O 2 ③ 一定条件下,1mol 该化合物可与2 mol H 2发生反应④ 该化合物能发生的反应类型有: 加成、取代、氧化、酯化⑤ 该化合物不能有属于酚类的同分异构体。
其中正确的是A .①④B .②③C .④⑤D .③⑤4.迷迭香酸是从蜂花属植物中提取 得到的酸性物质,其结构如图。
下列叙述正确的是 A .迷迭香酸属于芳香烃 B .1mol 迷迭香酸最多能和 9mol 氢气发生加成反应 C .迷迭香酸可以发生水解反应、取代反应和酯化反应D .1mol 迷迭香酸最多能和含5mol NaOH 的水溶液完全反应5.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基 净化剂。
40有机物的分类及性质

有机物的分类及性质§烷烃(通式: C n H2n+2)1. 结构特征: 以碳原子为中心,氢原子为顶点的正四面体结构,分子中的C-H 键为极性键,键强度相同,碳碳单键能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大3) 碳原子个数相等时,支链越多,熔沸点越低§烯烃(通式: C n H2n)1. 结构特征: 含有碳碳双键,所连原子和双键处于同一平面,属于不饱和烃, 碳碳双键不能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳碳双键个数越多,熔沸点越低3) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§炔烃(通式: C n H2n-2)1. 结构特征: 含有碳碳三键,所连原子和双键处于同一直线、同一平面,属于不饱和烃, 碳碳三键不能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳碳三键个数越多,熔沸点越低3) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§苯(C6H6)1. 结构特征: 环状,6个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键(不含有双键)2. 物理性质:1) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§苯的同系物(通式: C n H2n-6)1. 结构特征: 碳原子上的氢被一个或多个卤素原子取代2. 物理性质:1) 不溶于水,密度比水小2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§酚(通式: C n H2n-6O m)1. 结构特征: 苯环上直接连有酚羟基2. 物理性质:1) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§卤代烃(通式: C n H2n+2-m X m)1. 结构特征: 碳原子上连有卤素原子2. 物理性质:1) 除少数为气体外,大多为液体或固体(CH3Cl、CH3CH2Cl、CH3Br 为气体)2) 不溶于水,可溶于大多数有机溶剂3) ρ(溴代烃)> ρ(水)> ρ(氯代烃)4) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§醇(通式: C n H2n+2O m)1. 结构特征: 碳原子上连有醇羟基2. 物理性质:1) 碳原子数目相同的醇,-OH 数目越多,沸点越高2) –OH数目相同的醇,碳原子个数越多,沸点越大§醛(通式: C n H2n O m)1. 结构特征: 碳原子上连有醛基2. 物理性质:1) 绝大部分溶于水2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§羧酸(通式: C n H2n O2m)1. 结构特征: 碳原子上连有羧基2. 物理性质:1) 碳原子个数越多,溶解性越小(例如: 硬脂酸为沉淀)2) 碳原子个数越多,熔沸点越高3) 碳原子个数相等时,支链越多,熔沸点越低§酯(通式: C n H2n O2m)1. 结构特征: 酯基两端连有其他基团2. 物理性质:1) 密度一般小于水,并难容于水,易溶于有机溶剂2) 低级酯一般是具有芳香味的液体3) 碳原子个数越多,熔沸点越高4) 碳原子个数相等时,支链越多,熔沸点越低5) 酯的熔沸点比相应的酸低(和氢键有关)。
有机物化学性质总结

有机物化学性质总结一、烷烃1、在光照条件下,可与卤素单质发生取代反应....HX X X H C n n +−→−+++12n n 222H C 光2、在空气或氧气中点燃,发生氧化反应....。
烷烃燃烧通式为: O H n O n H C n n 22222)1(nCO213++−−→−+++点燃二、 烯烃1、氧化反应a. 乙烯易燃烧,燃烧时火焰明亮并伴有黑烟。
O 2H CO2322222+−−→−+=点燃O CHCH※ 注意:①点燃前需验纯。
②当温度高于100摄氏度时,乙烯燃烧前后的气体体积不变。
b. 乙烯能使酸性KMnO 4溶液褪色,因此可用酸性KMnO 4溶液鉴别4CH 和42H C ,但不能用KMnO 4溶液除去乙烯,因为与其反应时有2CO 生成。
2、加成反应乙烯能跟溴水、卤素单质)(X 2、氢气、水、卤化氢、氰化氢等在适宜的条件下发生加成反应。
r r r CHCHB CH B CH B 22222—−→−+=(常温下使溴水褪色)因此可用溴水鉴别4CH 和42H C 。
(用溴水可除甲烷中混有的乙烯) 3、加聚反应三、苯1、取代反应a. 与2Br 反应在3FeBr 催化作用下,苯与溴反应生成溴苯,说明苯具有烷烃的性质。
溴苯的密度比谁大,化学方程式为 。
b.与3HNO 反应(硝化反应)。
.在浓42SO H 作用下,苯在50℃—60℃时与浓硝酸反应,化学方程式为 。
浓硫酸的作用是催化剂和吸水剂。
反应在水浴中进行。
c.磺化反应:2、加成反应(苯又能与22C l H 或分别在催化作用下发生加成反应,说明苯具有烯烃的性质)。
3、氧化反应①苯在空气中燃烧发出明亮的带有浓烟的火焰。
O 6H CO 1215222266+−−→−+点燃O H C②苯不能使酸性4O KM n 溶液褪色;也不能使溴水褪色,但苯能将溴从溴水中萃取出来。
由此可知苯在化学性质上与烯烃有很大差别。
四、苯的同系物1、都能燃烧..,燃烧时发出明亮的带浓烟的火焰,其燃烧通式为:C n H 2n-6+233-n O 2−−→−点燃nCO 2+(n-3)H 2O 2、都能与卤素单质(X 2)、硝酸、硫酸等发生取代反应.... 3、都能与氢气等发生加成反应....4、苯的同系物与苯在化学性质上的不同之处:a.由于侧链对苯环的影响,使苯的同系物的苯环上氢原子的活性增强,发生的取代反应有所不同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
^
各类有机物主要性质一览表
;
:
补充说明:
1、有机物的水溶性与分子中羟基所占的比例有关,分子大羟基个数少就难溶。
2、除卤代烃不能或不易燃烧外,其它大都可以燃烧。
3、具有羟基的能与金属钠反应生成氢气(醚、醛、酮、酯不能),酚羟基、羧基还能与NaOH、Na2CO3反应(醇一般不能)、羧基还能与NaOH反应放出CO2气体(醇、酚不能)。
4、能使溴水褪色的有机物:含碳碳双键或碳碳叁键(加成)、酚类(取代)、醛类(氧化)。
5、能被酸性高锰酸钾氧化的有机物:含碳碳双键或碳碳叁键、酚类、醛类,以及苯的同系物、醇类等。
6、能发生银镜反应的有机物:含醛基(醛类、甲酸、甲酸酯、葡萄糖等)
7、能与新制氢氧化铜反应的有机物:含醛基(醛类、甲酸、甲酸酯、葡萄糖等)。
此外羧酸能与氢氧化铜发生中和反应,多羟基化合物(如甘油和葡萄糖)能与新制氢氧化铜生成绛蓝色物质。
》
—。
