各类有机物性质一览表
有机物性质归纳

一.烃的结构与化学性质类别通式官能团烷C n H2n+2(n≥ 1)————烃烯C n H2n(n≥2)烃〔单烯烃〕炔C n H2n-2(n≥ 2)代表物分子结构结点由 C、H 构成,碳碳之间为单键连接成CH4链状,任何结构的〔 Mr :16〕所有原子不可能共面!①链状〔可以带支链〕CH2=CH2(Mr :28〕②有CH3— CH=CH2③分子中与碳碳双〔 Mr :42〕键相连的所有原子在同一个平面上①、链状〔可以带H— C≡ C—H〔Mr:支链〕②有主要化学性质1.光照下的卤代;2.裂化;3.不使酸性 KMnO4溶液或溴水褪色; 4.可燃1、加成:X2、H2、HX、HCN2、加聚:一般条件催化剂〔△〕。
3.易被氧化。
与 O2〔条件:PbCl2、CuCl2、加压、加热〕反响生成 CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:黑烟〔炔类是.浓黑烟〕..1、加成:X2、H2、HX、HCN 2、聚合 : 一般条件催化剂。
〔△〕3.易被氧化。
与 HO2〔条件:HgSO 〕反应生成4烃〔单〕—C≡C—26〕—C≡C—③、分子成直线型CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:浓黑烟〔烯类..是黑烟〕.苯及n 2n-6(n≥ 6)C H同系〔不包括萘————物等〕(Mr : 78〕或甲苯①、六元环。
②、一个分子只有一个苯环,侧链为烷基。
③、 12 个原子共面1、取代:与 Br2在Fe〔实际是Fe3+〕做催化剂生成溴苯。
2、加成:与H2〔 Ni 催化〕环己烷;与Cl2〔紫外线〕生成“六六六〞。
3典型反响:卤代、硝化。
二.烃的衍生物的结构与化学性质类别通式一卤代烃:卤代R—X烃多元饱和卤代烃:Cn H2n+2-m X m一元醇:R—OH醇饱和多元醇:C n H2n+2O m醚R—O—R′酚醛酮羧酸酯官能团卤原子—X醇羟基—OH醚键酚羟基—OH醛基羰基羧基酯基代表物C2H5Br(Mr : 109〕CH3OH(Mr : 32〕C2 H5 OH(M r : 46〕C2H5O C2H5(M r : 74〕(M r : 94〕HCHO(M r : 30〕(M r : 44〕(M r : 58〕(M r : 60〕HCOOCH3(M r : 60〕(M r : 88〕分子结构结点主要化学性质卤素原子直接与烃基 1.与 NaOH 水溶液共热发生取结合代反响生成醇β-碳上要有氢原子才 2.与 NaOH 醇溶液共热发生消能发生消去反响去反响生成烯羟基直接与链烃基结1.跟活泼金属反响产生 H22.跟卤化氢或浓氢卤酸反响生合, O—H 及 C—O 均成卤代烃有极性。
有机物物理性质表
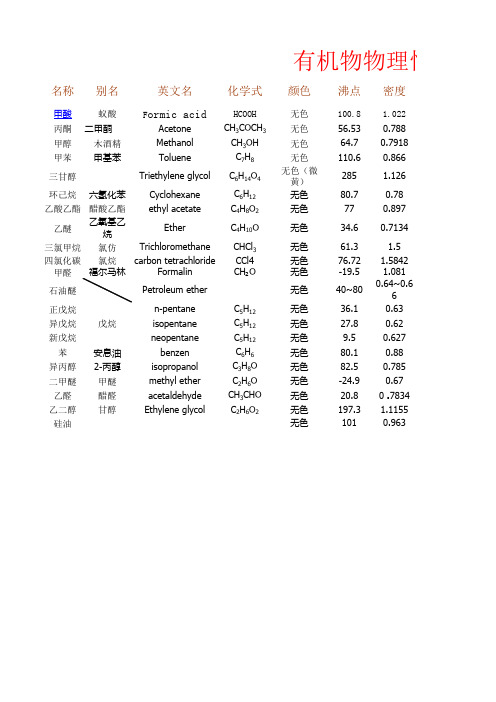
名称别名英文名化学式颜色沸点密度甲酸蚁酸F ormic acidHCOOH 无色100.8 1.022丙酮二甲酮Acetone CH 3COCH 3无色56.530.788甲醇木酒精Methanol CH 3OH 无色64.70.7918甲苯甲基苯Toluene C 7H 8无色110.60.866三甘醇Triethylene glycol C 6H 14O 4无色(微黄)285 1.126环己烷六氢化苯Cyclohexane C 6H 12无色80.70.78乙酸乙酯醋酸乙酯ethyl acetateC 4H 8O 2无色770.897乙醚乙氧基乙烷EtherC 4H 10O 无色34.60.7134三氯甲烷氯仿Trichloromethane CHCl 3无色61.3 1.5四氯化碳氯烷carbon tetrachloride CCl4无色76.72 1.5842甲醛Formalin CH ₂O 无色-19.5 1.081石油醚Petroleum ether 无色40~800.64~0.66正戊烷n-pentane C 5H 12无色36.10.63异戊烷isopentane C 5H 12无色27.80.62新戊烷neopentane C 5H 12无色9.50.627苯安息油benzen C 6H 6无色80.10.88异丙醇2-丙醇isopropanol C 3H 8O 无色82.50.785二甲醚甲醚methyl ether C 2H 6O 无色-24.90.67乙醛醋醛acetaldehyde CH 3CHO 无色20.80 .7834乙二醇甘醇Ethylene glycolC 2H 6O 2无色197.3 1.1155硅油无色1010.963有机物物理性质戊烷溶解性可燃性挥发性毒性易易易√易易易√易易易√微易易√低毒易易不√易易易√低毒微易易√低毒微易易√不不易√不不易√易易易√不易易√微易易√不易易√不易易√不易易√易易易√微易易√易易√易易√不可不无理性质表备注1无臭,粘稠,低毒,不溶于醚类戊烷、己烷混合物。
化学有机物知识点整理

化学有机物知识点整理有机物的知识点是高考必考的内容,除了选择题,还有一道有机专题的填空题,所以要准确记忆有机物官能团的性质,还要重视实验哦~有机代表物质的物理性质1. 状态固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下)气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷液态:油状: 硝基苯、溴乙烷、乙酸乙酯、油酸粘稠状: 石油、乙二醇、丙三醇2. 气味无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味)稍有气味:乙烯特殊气味:苯及同系物、萘、石油、苯酚刺激性:甲醛、甲酸、乙酸、乙醛甜味:乙二醇、丙三醇、蔗糖、葡萄糖香味:乙醇、低级酯苦杏仁味:硝基苯3. 颜色白色:葡萄糖、多糖淡黄色:TNT、不纯的硝基苯黑色或深棕色:石油4. 密度比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃5. 挥发性:乙醇、乙醛、乙酸6. 升华性:萘、蒽7. 水溶性:不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4能溶:苯酚(0℃时是微溶)微溶:乙炔、苯甲酸易溶:甲醛、乙酸、乙二醇、苯磺酸与水混溶:乙醇、苯酚(70℃以上) 、乙醛、甲酸、丙三醇有机物之间的类别异构关系1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃;2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃;3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚;4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮;5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯;6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚;如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚.7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.能发生取代反应的物质1. 烷烃与卤素单质: 卤素单质蒸汽(如不能为溴水)。
高中化学有机物知识点

高中化学有机物知识点有机代表物质的物理性质1. 状态固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下)气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷液态:油状: 硝基苯、溴乙烷、乙酸乙酯、油酸粘稠状: 石油、乙二醇、丙三醇2. 气味无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味)稍有气味:乙烯特殊气味:苯及同系物、萘、石油、苯酚刺激性:甲醛、甲酸、乙酸、乙醛甜味:乙二醇、丙三醇、蔗糖、葡萄糖香味:乙醇、低级酯苦杏仁味:硝基苯3. 颜色白色:葡萄糖、多糖淡黄色:TNT、不纯的硝基苯黑色或深棕色:石油4. 密度比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃5. 挥发性:乙醇、乙醛、乙酸6. 升华性:萘、蒽7. 水溶性:不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4能溶:苯酚(0℃时是微溶)微溶:乙炔、苯甲酸易溶:甲醛、乙酸、乙二醇、苯磺酸与水混溶:乙醇、苯酚(70℃以上) 、乙醛、甲酸、丙三醇有机物之间的类别异构关系1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃;2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃;3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚;4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮;5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯;6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚;如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚.7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.能发生取代反应的物质1. 烷烃与卤素单质: 卤素单质蒸汽(如不能为溴水)。
有机物的物理性质

有机物的物理性质
一、状态:
1、烷烃1-4气体5-16液体17以上固体
2、烯烃2-4气体5-18液体19以上固体
3、炔烃2-4气体5-15液体16以上固体
4、单环芳烃全为液体
5、卤代烃,气体:
氟甲烷、氟乙烷、氟丙烷
氯四烷、氯乙烷
溴甲烷
其余均为液体
6、醇:
1-4个碳流动性液体
5-12碳油状液体
12以上为固体
7、酚
一般为固体,苯酚为无色针状晶体
少数烷基酚为液体
8、醛
甲醛为气体
低级醛为液体
苯乙醛为固体
9、低级羧酸与酯为液体
二、密度
1、气态有机物的相对分子质量大于29时,密度比空气大;
2、液态有机物密度比水小的有烃(烷、烯、炔、芳香烃)、低级酯、一氯代烃、乙醇、乙醛等;
3、密度比水大的有硝基苯、溴苯、四氯化碳、氯仿、溴代烃、乙二醇、丙三醇等。
4、烷、烯、炔等烃类同系物相对密度随着分子内碳原子数的增加的而增大;一氯代烷的相对密度随着碳原子数的增加而减小。
有机物物理性质

有机物物理性质 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN1 有机物物理性质归类一密度烃的密度一般随碳原子数的增多而增大;一氯代烃的相对密度随着碳原子数的增加而减小。
注意:1.通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。
2.通常液态有机物与水相比:密度比水小:烃,酯,一氯代烃,一元醇,醛,酮,高级脂肪酸等密度比水大:硝基苯,溴代烃,二氯(或以上)代烃,乙二醇,丙三醇等二状态[常温常压(1个大气压、20℃左右)]由于有机物大都为大分子(相对无机物来说),所以有机物分子间引力较大,因此一般情况下呈液态和固态,只有少部分小分子的有机物呈气态支链越多,熔沸点越低1.随着分子中碳原子数的增多,烃由气态经液态到固态。
分子中含有1~4个碳原子的轻一般为气态,5~16个碳原子的烃一般为液态,17个以上的为固态。
如通常状况下CH4、C4H8呈气态,苯及苯的同系物一般呈液态,大多数呈固态。
2.醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。
3.醛类通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。
4.酯类通常状况下一般分子中碳原子数较少的酯呈液态,其余都呈固态。
5.苯酚及其同系物由于含有_OH,且苯环相对分子质量较大,故通常状况下此类物质呈固态。
常见物质(1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃)氟里昂(CCl2F2,沸点为-29.8℃)氯乙烯(CH2==CHCl,沸点为-13.9℃)甲醛(HCHO,沸点为-21℃)氯乙烷(CH3CH2Cl,沸点为12.3℃)一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
常见有机化合物及其性质

常见有机化合物及其性质有机化合物是指由碳元素和氢元素等有机基团构成的化合物。
它们是地球上存在最为丰富的一类化合物,广泛存在于自然界中的各种生物体内,并且在我们的日常生活中起着重要的作用。
本文将介绍一些常见的有机化合物及其性质。
一、醇类醇是由羟基(-OH)取代碳链上的氢而形成的化合物。
常见的醇有甲醇、乙醇、丙醇等。
它们是无色、具有刺激性气味的液体,在常温下易挥发。
醇具有溶解性强、与水混溶,并且能与大部分有机物发生反应的特点。
二、酚类酚是由苯环上的一个或多个氢原子被羟基(-OH)取代而形成的化合物。
常见的酚有苯酚、萘酚等。
酚具有特殊的芳香味,并且能溶于水。
它们在化学反应中表现出的性质活泼,易与氧气发生氧化反应。
三、酮类酮是由羰基(C=O)连接的两个碳原子和两个有机基团组成的化合物。
常见的酮有乙酮、丙酮等。
酮具有无色或浅黄色的液体,可溶于水。
酮是可以用作有机合成中的重要原料,具有较好的溶解性和化学稳定性。
四、醛类醛是由羰基(C=O)连接一个碳原子和一个氢原子或有机基团而形成的化合物。
常见的醛有甲醛、乙醛等。
醛在常温下为无色气体或液体,有刺激性味道。
醛具有较好的挥发性,易与氧气发生氧化反应,并且可以进行加成反应。
五、酸类酸是由一个或多个羧基(-COOH)取代碳链上的氢而形成的化合物。
常见的酸有甲酸、乙酸等。
酸具有酸味,可与碱发生中和反应。
酸的强弱与羧基的取代程度、溶解度和键的稳定性有关。
六、酯类酯是由羧基和醇基通过缩合反应形成的化合物。
常见的酯有乙酸乙酯、甲酸乙酯等。
酯具有芳香味且挥发性较大,可溶于醇和醚。
酯的性质较稳定,常用作香料和溶剂。
七、醚类醚是由两个有机基团通过氧原子连接而成的化合物。
常见的醚有乙醚、二甲醚等。
醚是无色液体,可溶于有机溶剂,对水不溶。
醚具有较好的挥发性和溶解性,是一种常用的溶剂。
以上仅介绍了一些常见的有机化合物及其性质。
每种有机化合物都有其独特的结构和化学性质,它们在不同的应用领域发挥着重要的作用。
各类有机物的结构和性质

→ CHCl3+ HCl 氯仿 光照 CHCl3+ Cl2 → CCl4+ HCl
光照
CCl4:正四面体,经常用作萃取剂,萃取溴,溶液为 正四面体 经常用作萃取剂,萃取溴, 橙红色,萃取碘,溶液为紫红色,密度比水大。 橙红色,萃取碘,溶液为紫红色,密度比水大。
烯烃
CnH2n
1、结构特点: 、结构特点: 碳碳双键、链状、 碳碳双键、链状、不饱和 2、官能团: 碳碳双键 、官能团: 3、代表物: 乙烯 、代表物: 4、特征反应: 、特征反应: 加成: 和卤素单质、卤化氢气体、氢气、 (1)加成: 和卤素单质、卤化氢气体、氢气、水加成 CH2=CH2 + Br2 CH2BrCH2Br 1,2二溴乙烷 1,2二溴乙烷 溴水或溴的四氯化碳溶液 溶液褪色
练习
实验室用下图所示装置制取乙烯。 实验室用下图所示装置制取乙烯。
仪器A的名称: (1)仪器A的名称: 圆底烧瓶 (2)A装置中主要反应的 A 化学方程式是: 化学方程式是: B 仪器B中的试剂是: (3)仪器B中的试剂是: NaOH溶液 NaOH溶液 装入药品前,应检查装置的气密性。 (4)装入药品前,应检查装置的气密性。检查该套 装置气密性的操作是: 装置气密性的操作是: 将导管末端放入水中,加热烧瓶,导管口有气泡产生, 将导管末端放入水中,加热烧瓶,导管口有气泡产生, 停止加热,导管口形成一段水柱,说明气密性良好。 停止加热,导管口形成一段水柱,说明气密性良好。
点燃 点燃
nCO2 + (n+1) H2O
nCO2 + nH2O
点燃
O2
nCO2 + (n-1) H2O - O2
点燃
苯的同系物: 苯的同系物: nH2n-6 + C -
各类有机物性质一览表

各类有机物性质一览表有机物是由碳和氢等元素组成的化学物质,其性质多种多样。
本文将为您提供一份各类有机物性质的一览表,帮助您更好地了解和掌握有机化学的知识。
一、烃类烃类是由碳和氢组成的有机化合物,包括烷烃、烯烃和炔烃三类。
1. 烷烃(Alkanes):- 物理性质:a) 烷烃一般为无色气体或液体,随碳链增长而升高沸点和融点。
b) 烷烃的密度较小,常用比重瓶法测定。
- 化学性质:a) 烷烃可以发生取代反应,如卤代烷生成取代产物。
b) 在适当条件下,烷烃还可以发生燃烧反应,生成二氧化碳和水。
2. 烯烃(Alkenes):- 物理性质:a) 烯烃常见的是无色气体或液体,在室温下存在。
b) 烯烃的密度通常较小。
- 化学性质:a) 烯烃可以进行加成反应,如与溴水生成溴代烷。
b) 烯烃还可以进行聚合反应,生成高分子化合物。
3. 炔烃(Alkynes):- 物理性质:a) 炔烃一般为无色气体或液体。
b) 炔烃的密度相对较小。
- 化学性质:a) 炔烃可以进行加成反应,如与溴水生成溴代炔烃。
b) 炔烃可以和水反应生成醛和酮。
二、醇类醇是含有羟基(—OH)的有机化合物。
1. 一元醇(Monohydroxy Alcohols):- 物理性质:a) 一元醇常见的是无色液体。
b) 醇的氢键使其具有比醚、酮和醛有更高的沸点。
- 化学性质:a) 一元醇可以发生酯化反应,生成酯类化合物。
2. 二元醇(Polyhydroxy Alcohols):- 物理性质:a) 二元醇一般为无色液体。
b) 二元醇的水溶液具有较高的粘度。
- 化学性质:a) 二元醇可以发生糖化反应,生成糖类化合物。
三、酮类酮是含有羰基(C=O)的有机化合物。
1. 简单酮(Simple Ketones):- 物理性质:a) 简单酮常为无色液体。
b) 酮的沸点较相应的醇和醚高。
- 化学性质:a) 简单酮可以发生还原反应,生成相应的醇。
2. 糖酮(Sugar Ketones):- 物理性质:a) 糖酮常为无色或白色固体。
有机化合物的物理性质表

CH3COCH3
CH3CH3乙烷
30.07
-
-183.3
-88.6
-
C6H6
C2H5SH 乙硫醇
62.13
0.8391
-144.4
35.0
1.431020
C2H5OH,3CH2OH 乙醇
46.07
0.7893
-117.3
78.5
1.361120
Cl3CCH2OH
2,2,2-三氯乙醇
149.40
-
19.0
-
1.486120
C2H5OH,(C2H5)2O
Br3CCH2OH
2,2,2-三溴乙醇
282.76
-
81.0
-
-
C2H5OH,(C2H5)2O,C6H6
ClCH2COOH 氯乙酸
94.50
-
63.0
187.8
-
H2O,C2H5OH,(C2H5)2O,
80.51
1.2003
-67.5
128.0
1.441920
H2O,C2H5OH
BrCH2CH2OH 2-溴乙醇
124.97
1.7629
-
-
1.491520
H2O,C2H5OH,(C2H5)2O
CH3CONH2乙酰胺
59.07
0.998685
82.3
221.2
1.427878
H2O,C2H5OH
CH3CH═NOH乙醛肟
45.08
0.68040
-93.0
7.4
1.35017
H2O,C2H5OH,(C2H5)2O
C2H5NH2乙胺
常见无机物有机物性质归纳
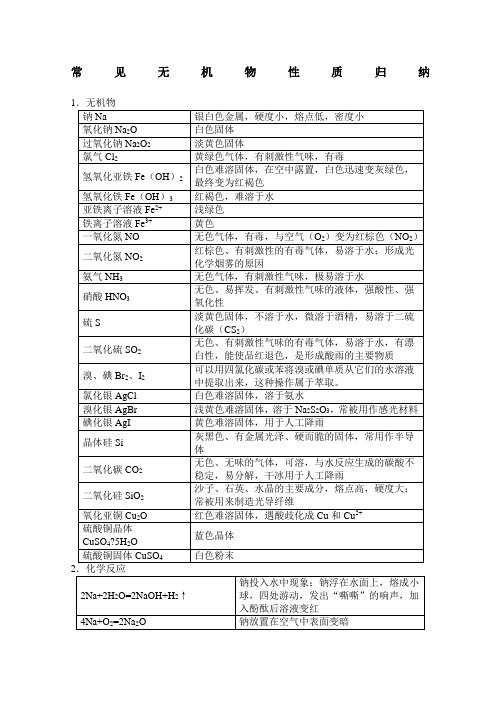
常见无机物性质归纳2Na+O 2 △Na 2O 2钠燃烧,产生黄色火焰,生成淡黄色固体 2Na 2O 2+2H 2O=4NaOH+O 2↑ 2Na 2O 2+2CO 2=2Na 2CO 3+O 2 过氧化钠可作为呼吸面具和潜水艇里氧气的来源 2Na+Cl 2点燃2NaCl冒白烟 2Fe+3Cl 2点燃2FeCl 3 产生棕黄色的烟 Cu+Cl 2点燃CuCl 2 产生棕色的烟 H 2+Cl 2点燃2HCl产生苍白色火焰Cl 2+H 2O=HCl+HClO HClO 不稳定,有强氧化性,可做漂白剂,Cl 2可用作漂白剂(Cl 2不能使干燥的红纸条退色)Cl 2+2NaOH=NaCl+NaClO+H 2O 制漂白精Cl 2+2CaOH=CaCl 2+Ca (ClO )2+H 2O工业制漂白粉,漂白粉的成分CaCl 2和Ca (ClO )2,有效成分为Ca (ClO )2 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3白色沉淀迅速变成灰绿色,最后变成红褐色Fe 3++3SCN -=Fe(SCN)3红色溶液,可用KSCN 、NH 4SCN 溶液检验Fe 3+Fe+2H +=Fe 2++H 2↑ Fe 具有还原性 2Fe 3++Fe=3Fe 2+ Fe 3+具有氧化性 Fe 2++Zn=Fe+Zn 2+2Fe 2++Cl 2=2Fe 3++2Cl -Fe2+既有氧化性又有还原性Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑NaHCO 3+HCl=NaCl+H 2O+CO 2↑ NaHCO 3+NaOH=Na 2CO 3+H 2O2NaHCO 3 △Na 2CO 3+H 2O+CO 2↑N 2+O 22NON 2+3H 2催化剂高温高压 2NH 3使空气中游离态的氮转化为含氮化合物叫做氮的固定(固氮) 2NO+O 2=2NO 23NO 2+H 2O=2HNO 3+NO NH 3+H 2O=NH 3·H 2O NH 3·H 2O NH 4++OH - NH 3·H 2O 呈弱碱性,氨水能使酚酞溶液变红 NH 3+HCl=NH 4Cl 产生白烟4NH 3+5O 2 催化剂△4NO+6H 2ONH 4HCO 3△NH 3↑+H 2O+CO 2↑NH 4Cl△NH 3↑+HCl ↑NH 4++OH -△NH 3↑+H 2O (用于检验铵根离子) 2NH 4Cl+Ca(OH)2 △CaCl 2+2NH 3↑+2H 2O 实验室制氨气,用湿润的红色石蕊试纸检验氨气是否收集满4HNO 34NO 2↑+O 2↑+2H 2O为了防止硝酸见光分解,一般将它保存在棕色试剂瓶里,不能用胶塞Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 常温下,浓硝酸可使铁、铝钝化受热或见光放电有机物具有相同分子式而结构不同的两种化合物互为同分异构体(如正丁烷和异丁烷)。
40有机物的分类及性质

有机物的分类及性质§烷烃(通式: C n H2n+2)1. 结构特征: 以碳原子为中心,氢原子为顶点的正四面体结构,分子中的C-H 键为极性键,键强度相同,碳碳单键能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大3) 碳原子个数相等时,支链越多,熔沸点越低§烯烃(通式: C n H2n)1. 结构特征: 含有碳碳双键,所连原子和双键处于同一平面,属于不饱和烃, 碳碳双键不能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳碳双键个数越多,熔沸点越低3) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§炔烃(通式: C n H2n-2)1. 结构特征: 含有碳碳三键,所连原子和双键处于同一直线、同一平面,属于不饱和烃, 碳碳三键不能自由旋转2. 物理性质:1) 不溶于水,密度比水小2) 碳碳三键个数越多,熔沸点越低3) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§苯(C6H6)1. 结构特征: 环状,6个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键(不含有双键)2. 物理性质:1) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§苯的同系物(通式: C n H2n-6)1. 结构特征: 碳原子上的氢被一个或多个卤素原子取代2. 物理性质:1) 不溶于水,密度比水小2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§酚(通式: C n H2n-6O m)1. 结构特征: 苯环上直接连有酚羟基2. 物理性质:1) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§卤代烃(通式: C n H2n+2-m X m)1. 结构特征: 碳原子上连有卤素原子2. 物理性质:1) 除少数为气体外,大多为液体或固体(CH3Cl、CH3CH2Cl、CH3Br 为气体)2) 不溶于水,可溶于大多数有机溶剂3) ρ(溴代烃)> ρ(水)> ρ(氯代烃)4) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§醇(通式: C n H2n+2O m)1. 结构特征: 碳原子上连有醇羟基2. 物理性质:1) 碳原子数目相同的醇,-OH 数目越多,沸点越高2) –OH数目相同的醇,碳原子个数越多,沸点越大§醛(通式: C n H2n O m)1. 结构特征: 碳原子上连有醛基2. 物理性质:1) 绝大部分溶于水2) 碳原子个数越多,熔沸点越高,相对密度逐渐增大§羧酸(通式: C n H2n O2m)1. 结构特征: 碳原子上连有羧基2. 物理性质:1) 碳原子个数越多,溶解性越小(例如: 硬脂酸为沉淀)2) 碳原子个数越多,熔沸点越高3) 碳原子个数相等时,支链越多,熔沸点越低§酯(通式: C n H2n O2m)1. 结构特征: 酯基两端连有其他基团2. 物理性质:1) 密度一般小于水,并难容于水,易溶于有机溶剂2) 低级酯一般是具有芳香味的液体3) 碳原子个数越多,熔沸点越高4) 碳原子个数相等时,支链越多,熔沸点越低5) 酯的熔沸点比相应的酸低(和氢键有关)。
有机化合物的物理性质表

1.3390
-30.4
74.1
1.437920
C2H5OH,(C2H5)2O,CHCl3
CH2ClCHCl2
1,1,2-三氯乙烷
133.40
1.4397
-36.5
113.8
1.471420
C2H5OH,(C2H5)2O,C6H6
CHCl2CHCl21,1,2,2-四氯乙烷
167.85
1.5953
有机化合物的性质
Properties of Organic Compounds
有机化合物的一般性质
General Properties of Organic Compounds
下 表给出了有机化合物常用的物理常数。其中以分子式中碳原子的数目多少为序排列。表中符号说明如下。
Mr——相对分子质量;
ρ——密度,单位为g/ml。除 注明者外,均指在20.0℃状态下。其上角标若有其他数值,则表示在该温度下测得的密度;
45.08
0.68040
-93.0
7.4
1.35017
H2O,C2H5OH,(C2H5)2O
C2H5NH2乙胺
45.08
0.6829
-81.0
16.6
1.366320
H2O,C2H5OH,(C2H5)2O
H2NCH2CH2SH
2-氨基乙硫醇
77.14
-
99.0~100.0
-
-
H2O,C2H5OH
H2NCH2CH2OH
1.447220
H2O,C2H5OH,CH3COCH3
HCONHNH2甲酰肼
60.06
-
54.0
-
-
有机物的结构与性质

有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 化学性质:①取代反应(与卤素单质、在光照条件下) , ,……。
②燃烧 ③热裂解 (2)烯烃:A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C) 化学性质:①加成反应(与X 2、H 2、HX 、H 2O 等)②加聚反应(与自身、其他烯烃) ③燃烧 (3)炔烃:A) 官能团:—C≡C— ;通式:C n H 2n —2(n ≥2)B) 结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
C) 化学性质:(略) (4)苯及苯的同系物:A) 通式:C n H 2n —6(n ≥6);代表物:B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C 原子和6个H 原子共平面。
C)化学性质:①取代反应(与液溴、HNO 3、H 2SO 4等)CH 4 + Cl2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O 点燃CH 4C + 2H 2高温 隔绝空气C=CCH 2=CH 2 + HXCH 3CH 2X 催化剂CH 2=CH 2 + 3O 22CO 2 + 2H 2O点燃n CH 2=CH 2 CH 2—CH CH 2=CH 2催化剂加热、加压CH 2=CH 2 + Br 2BrCH 2CH 2BrCCl 4 原子:—X原子团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等化学键: 、—C ≡C — C=C 官能团+ Br 2+ HBr ↑Br Fe 或FeBr 3+ HNO 3+ H 2ONO 2 浓H 2SO 4 60℃②加成反应(与H 2)(5)醇类:A) 官能团:—OH (醇羟基); 代表物: CH 3CH 2OH 、HOCH 2CH 2OHB) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
有机化合物的重要物理性质归纳

有机化合物的重要物理性质归纳有机物一般不易溶于水,而易溶于有机溶剂,这是因为有机物分子大多数是非极性分子或弱极性分子,含有憎水基。
根据“相似相溶”原理,水是极性分子,只有当某有机物分子中含有亲水基团时,则该有机物就可能溶于水。
亲水基一般包括:-OH、-CHO、COOH等;憎水基一般包括:-R、-NO2、-X、-COOR等。
1. 能溶于水的有机物:易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
① 小分子醇:CH3OH、C2H5OH、CH2OHCH2OH、甘油等;② 小分子醛:HCHO、CH3CHO、CH3CH2CHO等;③ 小分子羧酸:HCOOH、CH3COOH、CH3CH2COOH等;④ 低糖:葡萄糖(C6H12O6)、果糖(C6H12O6)、蔗糖(C12H22O11);⑤ 氨基酸:CH3CH(NH2)COOH等。
一般来说,低级醇、低级醛、低级酸,单糖和二糖水溶性好,即亲水基占得比重相对较大,憎水基占得比重相对较小,故能溶于水。
2. 不易溶于水的有机物:难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
① 烷、稀、炔、芳香烃等烃类均不溶于水,因为其分子内不含极性基团;② 卤代烃:CH3Cl、CHCl3、CCl4、CH3CH2Br、等均不溶于水;③ 硝基化合物:硝基苯、TNT等;④ 酯:CH3COOC2H5、油脂等;⑤ 醚:CH3OCH3、C2H5OC2H5等;⑥ 大分子化合物或高分子化合物:如高级脂肪酸、塑料、橡胶、纤维等。
一般来说,液态烃、一氯代烃、苯及其同系物、酯类物质不溶于水且密度比水小;硝基苯、溴苯、四氯化碳、氯仿、溴代烃、碘代烃不溶于水且密度比水大。
3. 有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中的相反:如乙醇是由较小憎水基团-C2H5和亲水基团-OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以必定也溶于四氯化碳等有机溶剂中。
常见有机物的性质

常见有机物的性质乙二胺四醋酸二钠 Disodium Edetate [C10H14N2Na2O8·2H2O=372.24]本品为白色结晶性粉末。
在水中溶解,在乙醇中极微溶解。
乙氧基黄叱精 Ethoxychrysoidine Hydrochloride [C14H16N4O·HCl=292.77]本品为深红棕色或黑褐色粉末。
在水或乙醇中溶解。
乙腈 Acetonitrile [CH3CN=41.05]本品为无色透明液体;微有醚样臭气;易燃。
与水或乙醇能任意混合。
乙酰丙酮 Acetylacetone [CH3COCH2COCH3=100.12]本品为无色或淡黄色液体;微有丙酮和乙酸的臭气;易燃。
与水、乙醇、乙醚或氯仿能任意混合。
乙酰苯胺 Acetanilide [C8H9NO=135.16]本品为有光泽的鳞片结晶,有时成白色粉末。
微有灼烧味。
约在95℃挥发。
在乙醇、氯仿、丙酮和热水中易溶,在水中微溶,在石油醚中几乎不溶。
乙酰氯 Acetyl Chloride [CH3COCl=78.50]本品为无色液体;有刺激性臭气;能发烟,易燃;对皮肤及黏膜有强刺激性;遇水或乙醇引起剧烈分解。
在氯仿、乙醚、苯、石油醚或冰醋酸中溶解。
N-乙酰-L-酪氨酸乙酯 N-Acetyl-L-tyrosine Ethyl Ester [C13H17NO4=251.28]本品为白色粉末。
生化试剂,供糜蛋白酶效价测定用。
乙醇 Ethanol [C2H5OH=46.07]本品为无色透明液体;易挥发,易燃。
与水、乙醚或苯能任意混合。
乙醚 Ether [C2H5OC2H5=74.12]本品为无色透明液体;具有麻而甜涩的刺激味,易挥发,易燃;有麻醉性;遇光或久置空气中可被氧化成过氧化物。
沸点为34.6℃。
乙醛 Acetaldehyde [CH3CHO=44.05]本品为无色液体;有窒息性臭气;易挥发;易燃;易氧化成醋酸;久贮可聚合使液体产生浑浊或沉淀现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各类有机物主要性质一览表
补充说明:
1、有机物的水溶性与分子中羟基所占的比例有关,分子大羟基个数少就难溶。
2、除卤代烃不能或不易燃烧外,其它大都可以燃烧。
3、具有羟基的能与金属钠反应生成氢气(醚、醛、酮、酯不能),酚羟基、羧基还能与NaOH、Na2CO3反应(醇一般不能)、羧基还能与NaOH反应放出CO2气体(醇、酚不能)。
4、能使溴水褪色的有机物:含碳碳双键或碳碳叁键(加成)、酚类(取代)、醛类(氧化)。
5、能被酸性高锰酸钾氧化的有机物:含碳碳双键或碳碳叁键、酚类、醛类,以及苯的同系物、醇类等。
6、能发生银镜反应的有机物:含醛基(醛类、甲酸、甲酸酯、葡萄糖等)
7、能与新制氢氧化铜反应的有机物:含醛基(醛类、甲酸、甲酸酯、葡萄糖等)。
此外羧酸能与氢氧化铜发生中和反应,多羟基化合物(如甘油和葡萄糖)能与新制氢氧化铜
生成绛蓝色物质。
