(完整版)(完美版)高中有机化学方程式总结(3),推荐文档
(完美版)高中有机化学方程式总结

(完美版)高中有机化学方程式总结一、烃1、甲烷烷烃通式:CnH2n-2点燃(1)氧化反应甲烷的燃烧:CH4+2O2 CO2+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
光(2)取代反应光一氯甲烷:CH4+Cl2 CH3Cl+HCl光二氯甲烷:CH3Cl+Cl2 CH2Cl2+HCl光三氯甲烷:CH2Cl2+Cl2 CHCl3+HCl (CHCl3又叫氯仿)图1 乙烯的制取四氯化碳:CHCl3+Cl2CCl4+HCl浓硫酸170℃2、乙烯乙烯的制取:CH3CH2OH H2C=CH2↑+H2O烯烃通式:CnH2n 高温(1)氧化反应乙烯的燃烧:H2C=CH2+3O22CO2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应催化剂△与溴水加成:H2C=CH2+Br2 CH2BrCHBr2与氢气加成:HCCH+H2 H2C=CH2催化剂△Cl与氯化氢加成:HCCH+HCl CH2=CHCl CH2Br①苯与溴反应+Br2 +HBr (溴苯)②硝化反应NO2 +H2O (硝基苯)+3H2 催化剂△(3)加成反应(环己烷)。
5、甲苯点燃(1)氧化反应甲苯的燃烧:C7H8+9O27CO2+4H2O 甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
CH3|+3HNO3 浓硫酸O2NNO2|NO2+3H2O(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃RX键有极性,易断裂1、取代反应:与NaOH溶液发生取代反应,生成醇;2、消去反应:与强碱的醇溶液共热,生成烯烃。
醇RO键和OOH与链烃基直接相连1、与钠反应,生成醇钠并放出氢气;2、氧化反应:O2:生成CO2和H2O;氧化剂:生成乙醛;3、脱水反应:140℃:乙醚;170℃:乙烯;4、酯化反应。
高中有机化学方程式总结

高中有机化学方程式总结一、烷烃比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。
(1)氧化反应——可燃性C n H 2n +2+3n +12 O 2――→点燃 n CO 2+(n +1)H 2O 。
(2)取代反应——特征反应CH 3CH 3+Cl 2――→光 CH 3CH 2Cl +HCl 。
二、烯烃 (1)氧化反应①烯烃能使酸性高锰酸钾溶液褪色,常用于的检验;②可燃性:单烯烃燃烧的通式为C n H 2n +3n 2 O 2――→点燃 n CO 2+n H 2O 。
(2)加成反应烯烃可与X 2、HX(X 表示卤素原子)、H 2、H 2O 等在一定条件下发生加成反应。
例如:(3)加聚反应丙烯生成聚丙烯:n CH 3CH===CH 2――→催化剂 。
三、.二烯烃的加成反应:如1,3-丁二烯。
1,3-丁二烯与溴发生加成反应时,有以下两种方式:(1)1,2-加成:CH 2==CH—CH==CH 2+Br 2→CH 2==CH—CHBr—CH 2Br 。
(2)1,4-加成:CH 2==CH—CH==CH 2+Br 2→CH 2Br—CH==CH—CH 2Br 。
四、苯的化学性质五、苯的同系物苯的同系物与苯的化学性质相似,但由于苯环与烷基的相互作用,使苯的同系物的化学性质与苯又有所不同。
(1)氧化反应①苯的同系物均能燃烧,:C n H 2n -6+3n -32 O 2――→点燃 n CO 2+(n -3)H 2O 。
②苯的某些同系物中,如果侧链烃基与苯环直接相连的碳原子上有氢原子,侧链烃基能被酸性KMnO 4溶液氧化(苯环使烃基活化):应用:常用于区别苯和苯的同系物。
(2)取代反应(以甲苯为例)甲基使苯环上与甲基处于邻、对位的氢原子活化而易被取代。
①卤代+Br 2――→FeBr 3;+Cl 2――→光。
②硝化。
生成的三硝基甲苯的系统命名为2,4,6-三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体, (3)加成反应六、卤代烃 (1)取代反应C 2H 5Br +NaOH ――→水△ C 2H 5OH +NaBr (2)消去反应(消除反应)CH 3CH 2Br +NaOH ――→乙醇△ CH 2===CH 2↑+NaBr +H 2O__ 七、乙醇的化学性质八、苯酚的酸性①实验探究苯酚的酸性②苯酚的酸性与碳酸、碳酸氢根离子的比较所以酸性:H 2CO 3(2)苯环上的取代反应(3)显色反应苯酚与FeCl 3溶液作用显紫色,利用这一反应可以检验苯酚的存在。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n -2(1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HClCH4 C +2H 2(3)裂化反应C 16H 34 C 8H 18 + C 8H 162.乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n(1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH n(氢加氢多)丙烯的加成CH 2=CH -CH 3+HBrCH 2-CH -CH 3 主要产物| |H BrCH 2-CH -CH 3| |Br H点燃 光 光 光 光 浓硫酸 170℃高温 催化剂 △ 2-CH 2 图1 乙烯的制取 图2 乙炔的制取高温 高温 催化剂加热3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应 乙炔的燃烧:HC ≡CH+5O 24CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHCHBr=CHBr+Br 2CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯 苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl4+HCl乙烯的制取:CH 3CH 2OHH 2C=CH 2↑+H 2O 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH3与氯化氢加成: H 2C=CH 2+HClCH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CHn乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2与溴水加成:HC ≡CH+Br 2 HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯 ①苯与溴反应(溴苯)②硝化反应+HO —NO 2 +H 2O(硝基苯)(3)加成反应(环己烷)。
(2)取代反应光 光光催化剂 △2-CH 2催化剂 △ Br 2—CHClCH=CH +Br +HBr Br浓H 2SO 4 60℃ —NO2+3H CH 3 | +3HNO 3 浓硫酸 O2N — CH 3|—NO 2 |NO 2+3H 2O6.溴乙烷:(1)取代反应溴乙烷的水解:C 2H 5—Br+H 2O C 2H 5—OH+HBr(2)消去反应 溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O7.乙醇(1)与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH3CH 2ONa+H 2↑(乙醇钠)(2)氧化反应 乙醇的燃烧:2CH 3CH 2OH+O 2 2CH3CHO+2H 2O (乙醛) (3)消去反应 乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
(完整版)高中有机化学方程式归纳
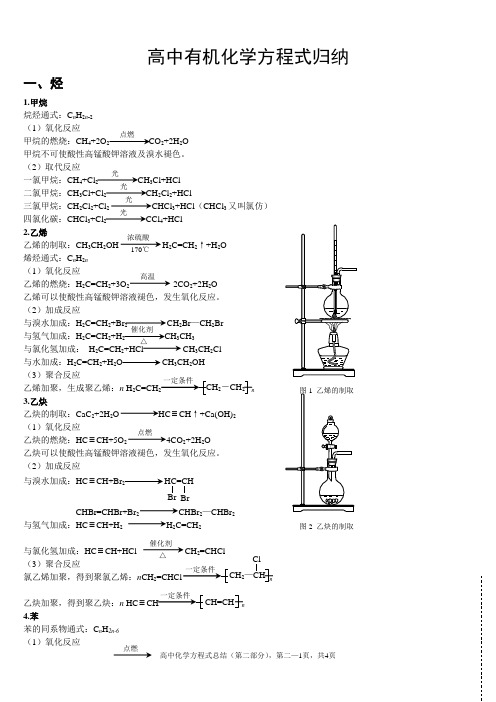
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完美版)高中有机化学方程式总结

一、烃 1.甲烷烷烃通式:CnH2n-2 (1)氧化反应甲烷的燃烧:CH点燃4+2O22+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH+Cl光4二氯甲烷:CHCl+Cl 光3Cl+HCl322Cl2+HCl三氯甲烷:CH 光2Cl2+Cl2 CHCl3+HCl(CHCl3四氯化碳:CHCl 光又叫氯仿)3+Cl4+HCl2.乙烯浓硫酸乙烯的制取:CH3CH2OH 170℃ H2C=CH2↑+H2O 烯烃通式:CnH2n (1)氧化反应高温乙烯的燃烧:H2C=CH2+3O2乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
2CO2+2H2O (2)加成反应与溴水加成:HC=CH22+BrCH2Br—CH与氢气加成:H 催化剂 2Br2C=CH2+H3CH3与氯化氢加成: H△2C=CH2 CH3CH2Cl 与水加成:H2C=CH2+H2CH3CH2(3)聚合反应OH乙烯加聚,生成聚乙烯:n H2C=CH 2 - CH n3.乙炔乙炔的制取:CaC+2H22CH↑+Ca(OH)2 (1)氧化反应点燃乙炔的燃烧:HC CH+5O2 4CO2+2H2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC CH+Br2BrCHBr=CHBr+Br2 CHBr2—CHBr2与氢气加成:HC CH+H2 H2C=CH2 图2 乙炔的制取催化剂与氯化氢加成:HC CH+HCl △CH2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH22 — n乙炔加聚,得到聚乙炔:n HC n4.苯苯的同系物通式:CnH2n-6 (1)氧化反应苯的燃烧:2C点燃6H6+15O2(2)取代反应12CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
①苯与溴反应Br +Br +HBr(溴苯)②硝化反应浓H2SO4 NO2+HO—NO2 60 ℃ +H2O(硝基苯)(3)加成反应+3H (环己烷)。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结

高中有机化学方程式总结Last revised by LE LE in 2021高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n 乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH 2 n 3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2点燃光光 光 光 浓硫酸170℃ 点燃催化剂△催化剂加热加压 催化剂CH 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n-2("氧化反应 点燃 甲烷的燃烧: CH 4+2O 2CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 一氯甲烷: 二氯甲烷: 三氯甲烷: 四氯化碳:2. 乙烯一定条件 乙炔加聚,得到聚乙炔: nHC 三CH n4.苯苯的同系物通式:C n H 2n-6 (1) 氧化反应点燃 苯光 CH 4+CI 2CH 3CI 光HCICH 3CI+CI 2CH 2C 光+HCICH 2CI 2+CI 2 飞 CHCI 3+HCI (CHCI 3 又叫氯仿) CHCI 3+CI 2CCI 4+HCI >浓硫酸乙烯的制取:CH 3CH 2OHH^C_CH^f +H 2O 烯烃通式:C n H 2n(1 )氧化反应高温乙烯的燃烧: H 2C_CH 2+3O 22CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2) 加成反应与溴水加成: H 2C_CH 2+Br 2(CH 化剂一CH 2Br 与氢气加成:H 2C_CH 2+H 2 CH 30H 3 * 与氯化氢加成:H 2C_CH 2+HCICH 3CH 2CI与水加成:H 2C_CH 2+H 2OCH 3CH 2OH(3)聚合反应一定条件乙烯加聚,生成聚乙烯:nH 2C_CH 2n -----------------3. 乙炔乙炔的制取:CaC 2+2H 2O -点燃 CH 2 — CH 2 I■*HC 三 CH f +Ca(0H )2乙炔的燃烧:HC =CH+5O 2 -------------------------- 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:HC 三CH+B 「2HC_CH »Br与氢气加成:CHBr_CHBr+Br 2HC =CH+H 2H 2C_CH 2BrCHBr 2— CHB 「2催化剂 与氯化氢加成:HC 三CH+HCI (3)聚合反应氯乙烯加聚,得到聚氯乙烯:△H 2_CHCInCH 2_CHClCl一定条件 -CH 2—CH_nCH_CH 一12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(word完整版)高中有机化学方程式总结(绝对全),推荐文档

一、取代反应光照”1. CH 4 + CI 2 ■ CH 3CI + HCI光照 2. CH 3CI + CI 2 --------------- CH 2CI 2 + HCI光昭3. CH 2CI + CI 2 照• CHCI 3 + HCI光照 4. CHCI 3 + CI 2 ------------ * CCI 4+ HCI [0 +亟壬©T 少+脑广 22. 二 + HO -NO 2 浓硫酸• ― NO 2 +H 20 23. <O> + HO -S03H 一 °」^^—SO 3H+H 2O催化剂 CH 3 25. CH 3 +3HO - NO 2 -------------------- r丫 +3H 2O 戈 O 2N —(T\\NO 2 ⑥V NO 2H 2O 28. CH 3CH 2Br + NaOH -------- CH 3CH 2OH + NaBr 二、加成反应 8. CH 2 = CH 2 + Br 2 ------------- C H z Br —CH z Br催化剂 9. CH 2 = CH 2 + H 2O -------• CH 3CH 2OH 10. CH 2 = CH 2 + HBr 催化剂,CH 3— CH 2Br催化剂 11. CH 2 = CH 2 + H 2 催:剂■ CH 3—CH 315. CH 三 CH + Br 2 ------------ C HBr = CHBr16. CHBr = CHBr+ Br 2 ------------- C HBr 2- CHBr 2催化剂17. CH 三 CH + HCI 催:剂'H 2C = CHCI33.C 2H 5OH+C 2H 5OH -浓硫酸、C 2H 5OC 2H 5+H 2O+3HBr37. +3Br 2140 C三、加聚反应 12. nCH 2 = CH 2 催化剂.[CH 2— CH 2 ] n催化剂13. nCH 2=CH-CH=CH 2 = [CH 2-CH=CH-CH 才 n18. nCH 2 = CH -------- - [ CH 2-CH ] nCl Cl四、消去反应醇 木29. CH 3CH 2Br+ NaOH △ CH 2 = CH 2 T + NaBr +H 2O32. CH 3CH 2OH 浓硫酸 CH 2 = CH 2 t + H 2O170C五、置换反应30. 2CH 3CH 2OH+2Na -------- 2CH 3CH 2ONa + H 2 t42. 2CH 3COOH+2Na 一 2CH 3COONa+H 2 t六、氧化反应39. 2CH 3CHO + O 2 催△剂• 2CH 3COOH△40. CH 3CHO+2Ag(NH 3)2OH —' CH 3COONH 4+2Ag J +3NH 3+H 2O41CH 3CHO+2C U (OH) 2 CH 3COOH+CU 2O J +2H 2O31.2CH 3CH 2OH+O 2 催化剂 - 2CH 3CHO + 2H 2O24. — + 3H 2 催化剂 △ 38. CH 3CHO + H 2催化剂 △ CH 3CH 2OH七、复分解反应34.、_. OH+NaOH - - — ONa+H 2O36.<§>~ONa+H 2O+CO —<§>0H+ NaHCO 343.2CH 3COOH+Na 2CO 3_- 2CH 3COONa+H 2O+CO 2T44. CH 3COOH+NaHCO 3~CH 3COONa+H 2O+CO 2 f45. CH 3COOH + NaOH — CH s COONa + H 2O46. 2CH 3COOH + Cu(OH) 2 —(CH 3COO) 2Cu + 2H 2O八、酯化反应48. CH 3COOCH 2CH 3+NaO 卄 CH 3COONa+CH 3CH 2OH十、缩聚反应 49. nOHCH 2CH 2COO H R 十OCH 2CH 2C 口 +H 2O高中有机化学知识点总结1 .需水浴加热的反应有:(1 )、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5 )、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100 C 的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大 落,有利于反应的进行。
(完整版)(完美版)高中有机化学方程式总结分解

高中有机化学方程式总结1.甲烷烷煌通式:C n H 2 n-2 (1)氧化反应点燃甲烷的燃烧: CH 4+2O 2 ―PO 2+2H 2O 甲烷不可使酸性高镒酸钾溶液及滨水褪色。
(2)取代反应*一氯甲烷:CH 4+C12 -------------- CH 3C1+HC1 一 光 二氯甲烷:CH 3C1+C1 2 ------------ --- --- ^CH 2c12+HC1一光三氯甲烷:CH 2c12+C12 - ...................... > CHC13+HC1 (CHC13 又叫氯仿) 四氯化碳:CHCl 3+CI 2------------------------------------------------------------------- ^CCl 4+HCl2 .乙烯乙烯的制取:CH 3CH 20H 烯煌通式:C n H 2n(1)氧化反应 高温乙烯的燃烧: H 2C=CH 2+302 ----------------------- 2CO 2+2H 2O乙烯可以使酸性高镒酸钾溶液褪色,发生氧化反应。
(2)加成反应H 2C=CH 2+Br 2—-―—>CH 2Br —CH 2Br 催化剂H 2C=CH 2+H 2 CH 3CH 3H 2C=CH 2+HCl ----------- » CH 3CH 2CI与水加成:H 2C=CH 2+H 2O-------------- > CH 3CH 20H (3)聚合反应 一定条件__乙烯加聚,生成聚乙烯: n H 2C=CH 2 ----------------- ►1C H2—CH1-n3 .乙快乙快的制取:CaC 2+2H 20 --------------- >HC CH T+Ca(0H )2 (1)氧化反应点燃乙快的燃烧:HC CH+5O2——--"4CO2+2H2O 乙快可以使酸性高镒酸钾溶液褪色,发生氧化反应。
高中有机化学方程式总结模板.doc

高中有机化学方程式总结一、烃1. 甲烷烷烃通式: C n H 2n-2( 1)氧化反应点燃甲烷的燃烧: CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
( 2)取代反应光一氯甲烷: CH 4+Cl 23Cl+HClCH二氯甲烷: CH 3Cl+Cl 2光2Cl 2+HClCH三氯甲烷: CHCl +Cl光+HCl ( CHCl 又叫氯仿) 2光CHCl2233四氯化碳: CHCl 3+Cl 2 CCl4+HCl2. 乙烯浓硫酸乙烯的制取: CHCHOHC=CH ↑ +HOH32170℃ 222烯烃通式: C n H 2n( 1)氧化反应点燃乙烯的燃烧: H C=CH+3O+2H O2CO22222乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
( 2)加成反应与溴水加成: H 2C=CH 2+Br 2 CH 2Br — CH 2Br与氢气加成: H C=CH+H 催化剂CHCH222△3 3H 2C=CH 2+HCl催化剂3CH 2Cl与氯化氢加成:CH△与水加成: H 2C=CH+HO催化剂CHOHCH2 2加热加压 3 2( 3)聚合反应催化剂乙烯加聚,生成聚乙烯:n H C=CHCH - CH222 n23. 乙炔乙炔的制取: CaC 2+2H 2OHCCH ↑ +Ca(OH)2( 1)氧化反应点燃乙炔的燃烧: HCCH+5O+2H O4CO222乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
( 2)加成反应 与溴水加成: HC CH+BrHC=CH2BrBr2CHBr22CHBr=CHBr+Br— CHBr与氢气加成: HC CH+H催化剂C=CHH2△22与氯化氢加成: HC CH+HCl催化剂=CHClCH△2Cl( 3)聚合反应催化剂2CH 2— CH n氯乙烯加聚,得到聚氯乙烯:n CH=CHCln HC CH 催化剂CH=CH n乙炔加聚,得到聚乙炔:4. 苯苯的同系物通式:n 2n-6C H( 1)氧化反应图 1 乙烯的制取图 2 乙炔的制取点燃苯的燃烧: 2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完美版)高中有机化学方程式总结
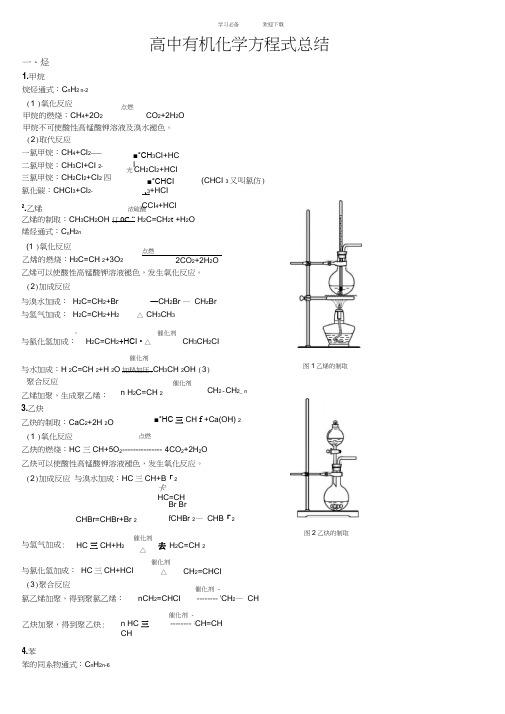
高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2 n -2 (1 )氧化反应 点燃 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 一氯甲烷:CH 4+CI 2——二氯甲烷:CH 3CI+CI 2-三氯甲烷:CH 2CI 2+CI 2 四氯化碳:CHCI 3+CI 2- ■*CH 3CI+HCI 光CH 2CI 2+HCI ■*CHCI 3+HCI亠CCI 4+HCI (CHCI 3又叫氯仿)2.乙烯浓硫酸 乙烯的制取:CH 3CH 2OH 仃0C “ H 2C=CH 2t +H 2O烯烃通式:C n H 2n (1 )氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 点燃 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成: H 2C=CH 2+Br —CH 2Br — CH z Br 与氢气加成: H 2C=CH 2+H 2 △ CH 3CH 3 、 催化剂 与氯化氢加成: H 2C=CH 2+HCI • △ CH 3CH 2CI图1乙烯的制取催化剂与水加成:H 2C=CH 2+H 2O 加热加压.CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯: 3.乙炔 乙炔的制取:CaC 2+2H 2O (1 )氧化反应n H 2C=CH 2 点燃 催化剂 CH 2-CH 2_ n ■*HC 三 CH f +Ca(OH) 2 乙炔的燃烧:HC 三CH+5O 2 --------------- 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:HC 三CH+B 「2 卡 HC=CHCHBr=CHBr+Br 2Br Br fCHBr 2— CHB 「2 图2乙炔的制取与氢气加成: HC 三CH+H 2 催化剂△ 去 H 2C=CH 2与氯化氢加成: HC 三CH+HCI (3)聚合反应 氯乙烯加聚,得到聚氯乙烯: 催化剂 △ CH 2=CHCI nCH 2=CHCI 催化剂 - -------- 'CH 2— CH 乙炔加聚,得到聚乙炔: n HC 三 CH 催化剂 - -------- ;CH=CH 4.苯苯的同系物通式:C n H 2n-6(1)氧化反应片燉点燃苯的燃烧:2C 6H 6+15O 2 I2CO 2+6H 2O苯不能使溴水和酸性高锰酸钾溶液褪色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中有机化学方程式总结
一、烃1.甲烷
烷烃通式:C n H 2n -2(1)氧化反应
甲烷的燃烧:CH 4+2O
2+2H
2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(
2)取代反应
一氯甲烷:CH 4
+Cl 3Cl+HCl
二氯甲烷:CH 3
Cl+Cl
2
Cl 2
+HCl
三氯甲烷:CH 2Cl
2+Cl 3+HCl (CHCl 3又叫氯仿)
四氯化碳:CHCl 3+Cl 4+HCl 2.乙烯
乙烯的制取:CH 3CH 22C=CH 2↑+H 2O
烯烃通式:C n H 2n (1)氧化反应
乙烯的燃烧:H 2C=CH 2+3O 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应
与溴水加成:H 2C=CH 22Br —CH 2Br
与氢气加成:H 2C=CH 2+H 3CH 3
与氯化氢加成: H 2C=CH 2CH 3CH 2Cl 与水加成:H 2C=CH 2+H 23CH 2OH (3)聚合反应
乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔
乙炔的制取:CaC 2+2H 2
CH ↑+Ca(OH)2≡(1)氧化反应
乙炔的燃烧:HC CH+5O 2+2H 2O ≡乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应
与溴水加成:HC CH+Br
HC=CH ≡
Br CHBr=CHBr+Br
2—CHBr 2
与氢气加成:HC CH+H 22C=CH
2
≡与氯化氢加成:HC
2=CHCl
≡(3)聚合反应
氯乙烯加聚,得到聚氯乙烯:n CH 2n
乙炔加聚,得到聚乙炔:n HC n ≡4.苯
苯的同系物通式:C n H 2n-6(1)氧化反应
苯的燃烧:2C 6H 6+15O 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
2-CH 2 图2 乙炔的制取
Br
2—CH
Cl
(2)取代反应①苯与溴反应
(溴苯)
②硝化反应
+HO —NO
+H 2O
(硝基苯)
(3)加成反应
(环己烷)。
5.甲苯
(1)氧化反应
甲苯的燃烧:C 7H 8+9O 2
2+4H 2O
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT ),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:
+Br +HBr
Br NO 2
+3H CH 3|+3HNO 2
N —CH 3|
—NO 2|NO 2
+3H 2
O
6.溴乙烷:(1)取代反应
溴乙烷的水解:C 2H 5—Br+H 2
C 2H 5
—OH+HBr
(2)消去反应
溴乙烷与
NaOH 溶液反应:CH 3CH 22=CH 2↑+NaBr+H 2O
7.乙醇
(1)与钠反应
乙醇与钠反应:2CH 3CH 23CH 2
ONa+H 2↑(乙醇钠)(2)氧化反应
乙醇的燃烧:2CH 3CH 2OH+O 23CHO+2H 2O (乙醛)
(3)消去反应
乙醇在浓硫酸做催化剂的条件下,加热到
170℃生成乙烯。
注意:该反应加热到140℃时,乙醇
进行另一种脱水方式,生成乙醚。
2C 2H 52H 5—O —C 2H 5+H 2O
(乙醚)8.苯酚
苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点43℃,水中溶解度不大,易溶于有机溶剂。
苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性
(苯酚钠)
苯酚钠与
CO 2反应:
+CO 2+H 2+NaHCO 3
(2)取代反应
+3Br ↓+3HBr (三溴苯酚)(3)显色反应
苯酚能和FeCl 3溶液反应,使溶液呈紫色。
9.乙醛
乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
(1)加成反应乙醛与氢气反应:CH 3—C —H+H 3CH 2OH
(2)氧化反应乙醛与氧气反应:2CH 3—C —H+O 3COOH (乙酸)
乙醛的银镜反应:
CH 3CHO +2Ag(NH 3)23COONH 4+2Ag+3NH 3+H 2O (乙酸铵)注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH 3)2OH (氢氧化二氨合银),
这是一种弱氧化剂,可以氧化乙醛,生成Ag 。
有关制备的方程式:Ag ++NH 3·H 2O===AgOH ↓++
4
NH AgOH+2NH 3·H 2O===[Ag(NH 3)2]++OH -+2H 2O
乙醛还原氢氧化铜:CH 3CHO+2Cu(OH)2CH 3COOH+Cu 2O↓+2H 2O
—OH +H 2
O
ONa —ONa OH
—OH —Br Br —OH |
Br |
O ||O ||
10.乙酸
(1)乙酸的酸性
乙酸的电离:CH 3COOH CH 3COO -+H +
(2)酯化反应
CH 3—C —OH+C 2H 5—
OH CH 3—C —OC 2H 5+H 2O (乙酸乙酯)
注意:酸和醇起作用,生成酯和水的反应叫做酯化反应。
11.乙酸乙酯
乙酸乙酯是一种带有香味的物色油状液体。
(1)水解反应
CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH (2)中和反应
CH 3COOC 2H 53COONa+C 2H 5OH
附加:烃的衍生物的转化
O ||
浓硫酸
△
无机酸。
