每天一个人名反应--Jacobsen-Katsuki环氧化反应
jacobsen 不对称环氧化反应的最新进展

图6 卟啉环的结构图
有效模拟物可在温和的条件下活化分 子氧, 从而实现烯烃的环氧化。 4个 meso和8个β位都可以引入手性 基团,形成手性金属卟啉(图6)。
8
手性salen催化剂的研究进展
• 1990 年, Jacobsen 和 Katsuki报道了含手性碳
jacobsen 不对称环氧 化反应的最新进展
报告人
1
jacobsen 不对称环氧化反应的最新进展
1.生物酶催化的非官能化 烯烃不对称环氧化反应
2.手性salen催化剂的研 究进展
2
生物酶催化的非官能化烯烃不对称环氧化反应
1.氧化酶细胞色素P450
salen络合物是一个与氧化酶细胞色素P450有关的仿生试剂。
图 7 非对称手性 Mn(salen)化合物的催化剂 4
图 8
非对称手性 Mn(salen)化合物的催化剂 5
11
手性salen催化剂的研究进展
1997 年, Hashihayata 用非手性的 salen Mn(Ⅲ)催 化剂(图 9), 加入助催化剂4-PPNO 时催化烯烃环氧 化反应, 得到了较好的产率。
的催化效果及对映选择性。
•
1993 年, Katsuki第二代手性催化剂 (图 6), 催化顺式烯烃时, 取得了 86%~91%的 ee 值。
图 5
Katsuki 催化剂 2
图 6
Katsuki 第二代手性催化剂 3
10
手性salen催化剂的研究进展
20 世纪 90 年代中后期 Kureshy 与Kim报道了一系列的非对称手性 Mn(salen) 化合物的催化剂(图 7、图 8), 并用于烯烃的环氧化反 应.打开了不对称 Schiff 碱化合物合成的新局面. 这种方法很容易获得不同的立体效应与电子效应, 而这 两点是 salen 配合物之所以拥有很好催化性能的重要 因素.
有机化学人名反应总结

有机化学人名反应总结有机化学人名反应是指以某位有机化学家的名字命名的有机合成反应。
这些反应通常是由这些化学家发现或者改进的,它们在有机合成领域发挥着重要的作用。
下面将对一些有机化学人名反应进行总结和介绍。
首先,我们来介绍迈克尔加成反应。
这是由阿尔贝托·迈克尔发现的一种重要的有机合成反应。
它是一种以亚硝基化合物和α,β-不饱和化合物为底物,在碱性条件下进行的加成反应。
迈克尔加成反应是合成β-羰基化合物的重要方法,具有广泛的应用价值。
其次,我们介绍格宾反应。
这是由埃米尔·格宾发现的一种重要的有机合成反应。
格宾反应是一种重要的酰胺合成方法,它可以将酰胺和醛或酮底物进行缩合反应,生成含有酰胺结构的产物。
这种反应在药物合成和天然产物合成中得到了广泛的应用。
接下来,我们介绍斯瓦茨反应。
这是由卡尔·巴尔特洛米·斯瓦茨发现的一种重要的有机合成反应。
斯瓦茨反应是一种重要的烷基化反应,它可以将卤代烷和金属硫醇底物进行反应,生成硫醚化合物。
这种反应在有机合成中具有广泛的应用,可以用于合成各种烷基化产物。
最后,我们介绍斯内普反应。
这是由维克托·斯内普发现的一种重要的有机合成反应。
斯内普反应是一种重要的芳香族硝基化反应,它可以将芳香烃和硝酸酯底物进行反应,生成硝基芳香烃。
这种反应在农药和染料合成中具有广泛的应用。
总的来说,有机化学人名反应在有机合成领域发挥着重要的作用,为有机化学家们的贡献致以崇高的敬意。
这些反应不仅在学术研究中具有重要的意义,也在药物合成、材料合成和化工生产中得到了广泛的应用。
希望通过对这些反应的总结和介绍,能够增进对有机合成领域的了解,促进有机化学研究的发展和应用。
有机化学人名反应

有机化学人名反应
1. Friedel-Crafts反应:由Charles Friedel和James Crafts于1877年首次报道的一种重要的有机化学反应。
2. Grignard反应:法国化学家Victor Grignard于1900年发现的一种有机合成反应。
3. Wolff-Kishner还原反应:德国化学家Kurt Heinrich Wolff和美国化学家Morris Kishner于1913年和1919年分别发现的一种有机还原反应。
4. Birch还原反应:澳大利亚化学家Arthur John Birch于1944年发现的一种有机化学反应。
5. Cannizzaro反应:意大利化学家Stanislao Cannizzaro于1853年发现的一种有机化学反应。
6. Gabriel重氮化反应:德国化学家Siegmund Gabriel于1887年发现的一种有机化学反应。
7. Wurtz反应:法国化学家Charles Adolphe Wurtz于1855年发现的一种有机化学反应。
8. Fries重排反应:德国化学家Karl Fries于1887年发现的一种有机化学反应。
9. Hofmann消去反应:德国化学家August Wilhelm von
Hofmann于1865年发现的一种有机化学反应。
10. Robinson环加成反应:英国化学家Robert Robinson于1925年发现的一种有机化学反应。
人名反应——精选推荐

氧化还原:氧化:Baeyer-Villiger氧化酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢Corey-Kim 氧化醇在NCS/DMF作用后,碱处理氧化成醛酮Criegee邻二醇裂解邻二醇由Pb(OAc)4氧化成羰基化合物Criegee臭氧化烯烃臭氧化后水解成醛酮Dakin反应对羟基苯甲醛由碱性H2O2氧化成对二酚Dess-Martin过碘酸酯氧化仲醇由过碘酸酯氧化成酮Fleming氧化硅烷经过酸化,过酸盐氧化,水解以后形成醇Hooker氧化2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变Moffatt氧化(Pfitzner-Moffatt)氧化用DCC和DMSO氧化醇,形成醛酮Oppenauer氧化烷氧基催化的仲醇氧化成醛酮Riley氧化活泼亚甲基(羰基α位等)被SeO2氧化成酮Rubottom氧化烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化Sarett氧化CrO3。
Py络合物氧化醇成醛酮Swern氧化用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物Tamao-Kumada氧化烷基氟硅烷被KF,H2O2,KHCO3氧化成醇Wacker氧化Pd催化剂下,烯烃氧化成酮还原:Barton-McCombie去氧反应从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自由基开裂发生醇的去氧作用Birch 还原苯环由Na单质合液胺条件下形成环内二烯烃带供电子基团的苯环:双键连接取代基带吸电子基团的苯环,取代基在烯丙位Brown硼氢化烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇Cannizzaro歧化碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸Clemmensen还原用锌汞齐和氯化氢将醛酮还原为亚甲基化合物Corey-Bakshi-Shibata(CBS)还原酮在手性恶唑硼烷催化下的立体选择性还原Gribble吲哚还原用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决Gribble二芳基酮还原用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原Luche还原烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇McFadyen-Stevens还原酰基苯磺酰肼用碱处理成醛Meerwein-Ponndorf-Verley还原用Al(OPr’)3/Pr’OH体系将酮还原为醇Midland还原用B-3-α-蒎烯-9-BBN对酮进行不对称还原Noyori不对称氢化羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原Rosenmund还原用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇Wolff-Kishner-黄鸣龙还原用碱性肼将羰基还原为亚甲基成烯反应:Boord反应β-卤代烷氧基与Zn作用生成烯烃Chugaev消除黄原酸酯热消除成烯Cope消除胺的氧化物热消除成烯烃Corey-Winter olefin烯烃合成邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯Doering-LaFlamme丙二烯合成烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯Horner-Wadsworth-Emmons反应从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多Julia-Lythgoe成烯反应从砜合醛生成(E)-烯烃Peterson成烯反应从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应Ramberg-Backlund烯烃合成Α-卤代砜用碱处理生成烯烃Witting反应羰基用膦叶立德变成烯烃Zaitsev消除E2消除带来更多取代的烯烃偶联反应:Cadiot-Chodkiewicz偶联从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联从硫酰胺和烷基卤生成烯胺Glaser偶联Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F-或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联)Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应芳基碘代物在Cu存在下的自偶联反应Wurtz反应烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合酯在碱催化下缩合为β-酮酯Corey-Fuchs反应醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合分子内的Claisen缩合Evans aldol反应用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成)氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化)胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成)Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应芳香醛和乙酐反应合成肉桂酸Prins反应烯烃酸性条件下对于甲醛的加成反应Reformatsky反应有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应)从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
有机人名反应Excel版
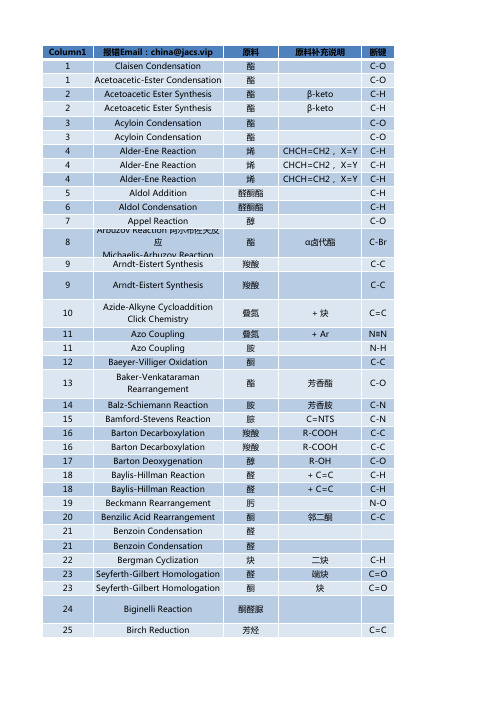
酮
EWGCH2CN
C-H
90
Glaser Coupling
炔
C-H
91
Griesbaum Coozonolysis
肟
酮
C=N
92
Grignard Reaction
卤代物
C-X
93
Olefin Metathesis Grubbs Reaction
烯
烯
C=C
94
Haloform Reaction
酮
MeCO
酯
羧酸
羧酸
叠氮
叠氮 胺 酮
酯
胺 腙 羧酸 羧酸 醇 醛 醛 肟 酮 醛 醛 炔 醛 酮
酮醛脲
芳烃
原料补充说明
β-keto β-keto
CHCH=CH2, X=Y CHCH=CH2, X=Y CHCH=CH2, X=Y
断键 C-O C-O C-H C-H C-O C-O C-H C-H C-H C-H C-H C-O
22
Bergman Cyclization
23
Seyferth-Gilbert Homologation
23
Seyferth-Gilbert Homologation
24
Biginelli Reaction
25
Birch Reduction
原料 酯 酯 酯 酯 酯 酯 烯 烯 烯 醛酮酯 醛酮酯 醇
酰胺
ArCCNHCOR
C=O
27
Blaise Reaction
腈
R-CN+卤代酯
C≡N
27
Blaise Reaction
腈
R-CN+卤代酯
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger 氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化: 醇在NCS/DMF 作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4 氧化成羰基化合物4.Criegee臭氧化: 烯烃臭氧化后水解成醛酮5.Dakin 反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin 过碘酸酯氧化: 仲醇由过碘酸酯氧化成酮7. Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8. Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4 氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt 氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO 氧化醇,形成醛酮10.Oppenauer氧化: 烷氧基催化的仲醇氧化成醛酮11. Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12. Rubottom氧化:烯醇硅烷经过m-CPBA 和K2CO3处理后α-羟基化13.Sarett 氧化: CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N 淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada 氧化:烷基氟硅烷被KF,H2O2,KHCO3 氧化成醇16.Wacker 氧化: Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie 去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na 单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro 歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble 吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN 在冰醋酸当中还原吲哚双键可以解决8.Gribble 二芳基酮还原:用NaBH4 在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9. Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley 还原:用Al(OPr')3/Pr 'O体H 系将酮还原为醇12.Midland 还原:用B-3-α-蒎烯-9-BBN 对酮进行不对称还原13. Noyori 不对称氢化:羰基在Ru(II)BINAP 络合物催化下发生不对称氢化还原14. Rosenmund还原:用BaSO4/毒化Pd 催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn 作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin 烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme 丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons 反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting 反应简单的多7.Julia-Lythgoe 成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α - 硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting 反应9.Ramberg-Backlund 烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting 反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联: 芳基炔合成,同Cadiot-Chodkiewicz 偶联Eglinton 反应:终端炔烃在化学计量 (常常过量) Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联: Cu 催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck 反应: Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck 反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck 反应Hiyama 交叉偶联反应:Pb 催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF 催化剂存在下发生的交叉偶联反应Kumada 交叉偶联( Kharasch交叉偶联) :Ni 和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd 催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4 产生的Ti(0) 处理得到双键,反应是一个单电子过程Negishi交叉偶联: Pd催化的有机Zn 和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应: Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille 偶联: Pd催化的有机Sn 和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki 偶联: Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann 反应:芳基碘代物在Cu 存在下的自偶联反应Wurtz 反应:烷基卤经Na或Mg 金属处理后形成碳碳单键Ymada 偶联试剂: 用二乙基氰基磷酸酯(EtO)2PO-CN 活化羧酸缩合反应:Aldol 缩合: 羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn 反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应: 羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合: 酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi 处理生成终端炔烃Darzen 缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann 缩合:分子内的Claisen缩合Evans aldol反应: 用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe 缩合(2-吡啶酮合成): 氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry 硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch 加成反应:过渡金属催化的CXCl3 对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich 缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael 加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama 醇醛缩合:Lewis 酸催化下的醛和硅基烯醇醚之间的Aldol 缩合Nozaki-Hiyama-KIshi 反应:Cr-Ni 双金属催化下的烯基卤对于醛的氧化还原加成Pechmann 缩合(香豆素合成):Lewis 酸促进的酸和β-酮酯缩合成为香豆素Perkin 反应:芳香醛和乙酐反应合成肉桂酸Prins 反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann 反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser 对Witting 反应的修正:不稳定的叶立德和醛发生的Witting 反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter 反应(Michael-Stetter 反应):从醛和α ,β-不饱和酮可以得到1,4-二羰基衍生物。
人名命名的化学反应

人名命名的化学反应
以下是一些以人名命名的化学反应的例子:
1. 阿尔多利反应(Aldol reaction),以俄国化学家阿尔多利(Aldol)的名字命名,描述了碳-碳键的形成,是有机合成中常用的反应之一。
2. 伯克利-哈特利反应(Berkeley-Hartley reaction),以美国化学家伯克利(Berkeley)和哈特利(Hartley)的名字命名,用于合成含有苯环的化合物。
3. 格里格纳德反应(Grignard reaction),以法国化学家格里格纳德(Grignard)的名字命名,该反应用于合成碳-碳键和碳-金属键,是有机合成中的重要工具。
4. 巴尔-温克勒反应(Balz-Schiemann reaction),以德国化学家巴尔(Balz)和温克勒(Schiemann)的名字命名,用于合成芳香胺的重要反应。
5. 诺贝尔反应(Nobel reaction),以瑞典化学家诺贝尔
(Nobel)的名字命名,描述了硝基化合物的还原反应。
这些人名命名的化学反应代表了不同领域中科学家的贡献,通过命名反应来纪念他们的工作。
这些反应在化学研究和有机合成中发挥着重要的作用,并且持续影响着化学领域的发展。
有机化学人名反应

Acetoacetic Ester CondensationAcetoacetic Ester SynthesisAcyloin CondensationAlder-Ene ReactionAldol AdditionAldol CondensationAppel ReactionArbuzov ReactionArndt-Eistert SynthesisAzide-Alkyne 1,3-Dipolar CycloadditionAzo CouplingbBaeyer-Villiger OxidationBaker-Venkataraman RearrangementBalz-Schiemann ReactionBamford-Stevens ReactionBarton DecarboxylationBarton-McCombie Reaction (Barton Desoxygenation) Baylis-Hillman ReactionBeckmann RearrangementBenzilic Acid RearrangementBenzoin CondensationBergman CyclizationBestmann-Ohira ReagentBiginelli ReactionBirch ReductionBischler-Napieralski ReactionBlaise ReactionBlanc ReactionBohlmann-Rahtz Pyridine SynthesisBoronic Acid Mannich ReactionBouveault-Blanc ReductionBrook RearrangementBrown HydroborationBucherer-Bergs ReactionBuchwald-Hartwig Cross Coupling Reaction cCadiot-Chodkiewicz CouplingCannizzaro Oxidation ReductionCBS ReductionChan-Lam CouplingClaisen CondensationClaisen RearrangementClemmensen ReductionClick ChemistryCollins ReagentCope EliminationCope RearrangementConia-Ene ReactionCorey-Bakshi-Shibata Reduction Corey-Chaykovsky Reaction Corey-Fuchs ReactionCorey-Kim OxidationCorey-Seebach ReactionCorey-Suggs ReagentCorey-Winter Olefin Synthesis Coumarin SynthesisCriegee Mechanism for Ozonolysis Cross MetathesisCurtius Rearrangement (Reaction) dDakin ReactionDarzens CondensationDarzens ReactionDelépine ReactionDess-Martin Oxidation DiazotisationDieckmann CondensationDiels-Alder Reaction1,3-Dipolar Cycloaddition Directed ortho Metalation Doebner ModificationeEglinton ReactionEne ReactionEnyne MetathesisEpoxidationEschweiler-Clarke ReactionEster PyrolysisEsterificationfFavorskii ReactionFinkelstein ReactionFischer EsterificationFischer Indole SynthesisFleming-Tamao OxidationFriedel-Crafts AcylationFriedel-Crafts AlkylationFriedlaender SynthesisFries RearrangementFukuyama CouplingFukuyama ReductiongGabriel SynthesisGewald ReactionGlaser CouplingGriesbaum CoozonolysisGrignard ReactionGrubbs ReactionhHaloform ReactionHantzsch Dihydropyridine Synthesis (Pyridine Synthesis) Hay CouplingHeck ReactionHell-Volhard-Zelinsky ReactionHenry ReactionHiyama CouplingHiyama-Denmark CouplingHofmann EliminationHofmann's RuleHorner-Wadsworth-Emmons ReactionHosomi-Sakurai ReactionHuisgen CycloadditionHunsdiecker ReactionHydroborationiIreland-Claisen RearrangementItsuno-Corey ReductionIwanow Reaction (Reagent)jJacobsen EpoxidationJacobsen-Katsuki EpoxidationJocic ReactionJohnson-Corey-Chaykovsky ReactionJones OxidationJulia-Lythgoe OlefinationJulia-Kocienski OlefinationkKabachnik-Fields ReactionKindler ReactionKnoevenagel CondensationKochi ReactionKolbe ElectrolysisKolbe Nitrile SynthesisKolbe-Schmitt ReactionKulinkovich ReactionKulinkovich-de Meijere ReactionKulinkovich-Szymoniak ReactionKumada CouplinglLawesson's ReagentLeuckart Thiophenol ReactionLuche ReductionmMalonic Ester SynthesisMannich ReactionMarkovnikov's RuleMcMurry ReactionMeerwein-Ponndorf-Verley ReductionMyers' Modification of the Ramberg-Bäcklund Reaction Myers-Saito CyclizationMichael AdditionMichaelis-Arbuzov ReactionMitsunobu ReactionMiyaura Borylation ReactionModified Julia OlefinationMukaiyama Aldol AdditionnNazarov CyclizationNef ReactionNegishi CouplingNewman-Kwart RearrangementNitroaldol ReactionNozaki-Hiyama CouplingNucleophilic Substitution (S N1 / S N2)oOhira-Bestmann ReagentOlefin MetathesisOppenauer OxidationOverman RearrangementOxy-Cope RearrangementOzonolysispPaal-Knorr Furan SynthesisPaal-Knorr Pyrrole SynthesisPaal-Knorr Thiophene SynthesisPaterno-Büchi ReactionPauson-Khand ReactionPechmann CondensationPetasis ReactionPeterson OlefinationPinacol Coupling ReactionPinacol RearrangementPinner ReactionPrévost ReactionPrilezhaev ReactionPrins ReactionPschorr ReactionqrRamberg-Bäcklund Reaction Reformatsky ReactionRing Closing MetathesisRing Opening Metathesis (Polymerization) Ritter ReactionRobinson AnnulationRosenmund ReductionRosenmund-von Braun Reaction Rubottom OxidationsSakurai ReactionSandmeyer ReactionSaytzeff's RuleSchiemann ReactionSchlosser ModificationSchmidt ReactionSchotten-Baumann ReactionSeebach UmpolungSeyferth-Gilbert HomologationSarett ReagentShapiro ReactionSharpless AminohydroxylationSharpless DihydroxylationSharpless EpoxidationShi EpoxidationSimmons-Smith ReactionSonogashira CouplingStaudinger CycloadditionStaudinger ReactionStaudinger SynthesisSteglich EsterificationStetter ReactionStille CouplingStrecker SynthesisSuzuki CouplingSwern OxidationtTamao-Kumada OxidationTebbe OlefinationTishchenko ReactionTsuji-Trost ReactionTrost AllylationuUgi ReactionUllmann ReactionUpjohn DihydroxylationvVan Leusen Imidazole Synthesis Van Leusen Oxazole Synthesis Van Leusen ReactionVicarious Nucleophilic Substitution Vilsmeier ReactionwWacker-Tsuji OxidationWeinreb Ketone Synthesis Wenker SynthesisWillgerodt-Kindler Reaction Williamson SynthesisWittig-Horner ReactionWittig Reaction[1,2]-Wittig Rearrangement[2,3]-Wittig RearrangementWohl-Ziegler ReactionWolff-Kishner ReductionWolff RearrangementWoodward cis-Hydroxylation Woodward ReactionWurtz ReactionWurtz-Fittig ReactionxyYamaguchi Esterification。
烯烃的不对称氧化反应

• (2)可靠性:
虽然大的R取代基是不利的,但对于 大多数烯丙醇,反应都能成功;
19
Sharpless环氧化反应的特点:
• (3)高光学纯度:
一般>90% d.e.,通常 > 95% d.e. ; • (4)对底物中的手性中心相对不敏感: 在已带有手性中心的烯丙醇底物中,手 性钛—酒石酸酯催化剂具有足够强的非对映 面优先性,能够克服手性烯烃底物所固有的 非对映面优先性的影响。
B,C均为抗高血压药
36
手性酮催化烯烃不对称环氧化——Shi 不对称环氧反应
自Cusci报道二氧杂环丙烷可以快速的对烯烃发生不对称环氧化后, 该领域研究倍受重视。大约2000年时,Shi等报道了基于D-果糖的 手性酮A用于非官能团化烯烃的不对称氧化。使得在该领域的研究 有了真正意义上的突破。于是该类反应也被称为Shi不对称环氧化。
•
应用过氧叔丁醇(t-BuOOH,TBHP) 为氧供体,四乙氧基钛 [Ti(OPri)4] 和酒石 酸二烷基酯( DET ,常用的是酒石酸二 乙酯)为催化剂,使各种烯丙伯醇衍生 物发生不对称过氧化。
•
化学产 率 为 70-90% ,光 学产 率 大于 90%。
10
Sharpless环氧化反应机理
11
3
烯烃与过氧酸反应中的立体化学
环氧化反应是顺式加成,所以所得产物构型与原料一致
4
烯烃与过氧酸反应中的立体化学
由于甲基有位阻,所以位阻小的反应快,大的反应慢。
5
Sharpless环氧化反应
•
烯丙醇及其衍生物在钛酸酯参与下的 不对称环氧化反应称为Sharpless环氧化 反应,简称为AE反应(asymmetric epoxidation) 。 1980年,由Sharpless K.B. 等研究发 现。
有机人名反应大全.

索引:Arbuzov反应Arndt-Eister反应Baeyer-Villiger 氧化Beckmann 重排Birch 还原Bischler-Napieralski 合成法Bouveault-Blanc还原Bucherer 反应Cannizzaro 反应Chichibabin 反应Claisen 酯缩合反应Claisen-Schmidt 反应Clemmensen 还原Combes 合成法Cope 重排Cope 消除反应Curtius 反应Dakin 反应Darzens 反应Demjanov 重排Dieckmann 缩合反应Elbs 反应Eschweiler-Clarke 反应Favorskii 反应Favorskii 重排Friedel-Crafts烷基化反应Friedel-Crafts酰基化反应Fries 重排Gabriel 合成法Gattermann 反应Gattermann-Koch 反应Gomberg-Bachmann 反应Hantzsch 合成法Haworth 反应Hell-V olhard-Zelinski 反应Hinsberg 反应Hofmann 烷基化Hofmann 消除反应Hofmann 重排(降解)Houben-Hoesch 反应Hunsdiecker 反应Kiliani 氰化增碳法Knoevenagel 反应Knorr 反应Koble 反应Koble-Schmitt 反应Leuckart 反应Lossen反应Mannich 反应Meerwein-Ponndorf 反应Meerwein-Ponndorf 反应Michael 加成反应Norrish I和II 型裂解反应Oppenauer 氧化Paal-Knorr 反应Pictet-Spengler 合成法Pschorr 反应Reformatsky 反应Reimer-Tiemann 反应Reppe 合成法Robinson 缩环反应Rosenmund 还原Ruff 递降反应Sandmeyer 反应Schiemann 反应Schmidt反应Skraup 合成法Sommelet-Hauser 反应Stephen 还原Stevens 重排Strecker 氨基酸合成法Tiffeneau-Demjanov 重排Ullmann反应Vilsmeier 反应Wagner-Meerwein 重排Wacker 反应Williamson 合成法Wittig 反应Wittig-Horner 反应Wohl 递降反应Wolff-Kishner-黄鸣龙反应Yurév 反应Zeisel 甲氧基测定法Arbuzov(加成)反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
有机人名反应读音

人名反应读音*斜体表示有对应读音,红色表示无法查找到读音Acetoacetic Ester Synthesis/,æsɪtəuə'sitɪk/ /'estə/ /'sɪnθəsɪs/Acyloin Condensation/’æsilɔɪn/ /kɒnden'seɪʃn/Alder (Ene) Reaction (Hydro-Allyl Addition)/'ɑːldə/ (i:n) (haɪdrə-'æləl)Aldol Reaction/’ældɔːl/Alkene (Olefin) Metathesis./’ælki:n; æl’ki:n/ (‘ɔləfin) /mə'tæθəsɪs;me'tæθəsɪs/Alkyne Metathesis/æl’kain; ‘ælkain/Amadori Reaction/Rearrangement/ʌmɑː’dɔːri/Arbuzov Reaction (Michaelis-Arbuzov Reaction)/’ɑːbʊzɔv/ /mi’keilis/Arndt-Eistert Homologation/Synthesis /ɑːnt-‘aistæpt/ (德语音译) /hɔmɔlə’geiʃn/Aza-Claisen Rearrangement(3-Aza-Cope Rearrangement)/,æzə‘klaisən/Aza-Cope Rearrangement/,æzə‘kəup/Aza-Wittig Reaction/,æzə‘witi:ʃ/ (德语音译) Aza-[2,3]-Wittig Rearrangement Baeyer-Villiger Oxidation/Rearrangement/baiə’viligə/ (德语听起来像’filigəu)Baker-Venkataraman Rearrangement /'beɪkə venkʌ’tærəmən/Baldwin’s Rules/Guidelines forRing-Closing Reactions/bɔːldwən/Balz-Schiemann Reaction (Schiemann Reaction)/’bælz/ /’ʃi:mən/ (德语音译)Bamford-Stevens-Shapiro Olefination /’bæmfɔr d/ /’sti:vəns/ /ʃi’pi:rəu/ /ɔləfə’neiʃn/Barbier Coupling Reaction/bɑːr’bi:ə/Bartoli Indole synthesis/ bɑː’toli/ /indɔl/Barton Nitrite Ester Reaction/bɑːrtən/ /’naitrait/Barton Radical Decarboxylation Reaction/bɑːrtən/ /’rædɪkl/ /,dikɑːbɔksi’leiʃn/Barton-McCombie Radical Deoxygenation Reaction/mə’kʌmbi/ /di’ɔksɪdʒə'neɪʃn/Baylis-Hillman Reaction/beilis/ / hɪlmən/Beckmann Rearrangement/bekmən/Benzilic Acid Rearrangement/ben’zilik/Benzoin and Retro-Benzoin Condensation/’benzəʊɪn/ /retrə/Bergman Cycloaromatization Reaction /’bə:gmən/ /,saiklə’ærəmətai’zeiʃn/Biginelli ReactionBirch Reduction/bə:tʃ/Bischler-Napieralski Isoquinoline Synthesis/aisə'kwɪnəlɪːn/Brook Rearrangement/bru:k/Brown Hydroboration Reaction/braun/ /haidrəbɔ’reiʃn/Buchner Method of Ring Expansion (Buchner Reaction)/buhnə:/ (德语音译)Buchwald-Hartwig Cross-Coupling /’bʌkwɔld/ (德语听起来像/’buhwaiət/) /’hɑːtwig/ (德语听起来像/’hetwiʃ/)Burgess Dehydration Reaction/’bə:rdʒəs/ /dihai’dreiʃn/Cannizzaro Reaction/’kʌni,zɑːrɔ/ (意大利语音译)Carroll Rearrangement (Kimel-Cope Rearrangement)/’kærəul/ Castro-Stephens Coupling/’kæstrəu ‘sti:vəns/Chichibabin Amination Reaction (Chichibabin Reaction)/æmi’neiʃn/Chugaev Elimination Reaction (Xanthate Ester Pyrolysis)/ælimi’neiʃn/ /’zænθeit/ /paɪ'rɑlɪsɪs/Ciamician-Dennstedt Rearrangement /’tʃaimitʃʌn/ (意大利语音译)Claisen Condensation/Claisen Reaction/‘klaisən/Claisen RearrangementClaisen-Ireland Rearrangement/’aiə:lənd/Clemmensen Reduction/’klæmənsən/Combes Quinoline Synthesis/kuːms/ /'kwɪnəlɪːn/Cope Elimination / Cope Reaction Cope RearrangementCorey-Bakshi-Shibata Reduction (CBS Reduction)/’kɔri/ /’bækʃi/ /’ʃibʌtʌ/Corey-Chaykovsky Epoxidation and Cyclopropanation/’kɔri/ /’tʃaikɔvski/ /epɔ:ksi’deiʃn//saiklə,prəupə’neiʃn/Corey-Fuchs Alkyne Synthesis/fju:ks/Corey-Kim Oxidation/kim/Corey-Nicolaou Macrolactonization /ni’kɔhləu/ /,mækrəu,lektənai’zeiʃn/Corey-Winter Olefination/’wintər/ /ɔləfi’neiʃn/Cornforth Rearrangement/kɔrn’fɔrθ/Criegee Oxidation/’krigi:/Curtius Rearrangement./’kətiəs/Dakin Oxidation./’deikin/Dakin-West Reaction/’deikin/ /west/Danheiser Benzannulation/den’heisə/ /,benzænjʊ’leɪʃn/Danheiser Cyclopentene Annulation/,saiklə’pentin/ /ænjʊ’leɪʃn/Danishefsky’s Diene Cycloaddition/saikləə’diʃn/Darzens Glycidic Ester Condensation /’dɑːrzəns/ /glai’sidic/ /kɔndenˈseɪʃn/Davis' Oxaziridine Oxidations/’deivis/ /ɔk’sæziridin/De Mayo Cycloaddition (Enone-Alkene [2+2] Photocycloaddition)/di ‘maijəu/ /’i:nəun/ /’ælkin/ /fəutəu’saikləə’diʃn/ Demjanov Rearrangement and Tiffeneau-Demjanov RearrangementDess-Martin Oxidation./des’ma:rtin/Dieckmann Condensation/’di:kmən/Diels-Alder Cycloaddition/’di:ls/ /'ɑːldə/Dienone-Phenol Rearrangement/dai’i:nəun/ /’finɔl/Dimroth Rearrangement/’di:mrɔθ/Doering-LaFlamme Allene Synthesis /’during/ /ə’lin/Dötz Benzannulation Reaction/,benzænjʊ’leɪʃn/Enders SAMP/RAMP Hydrazone Alkylation./’ændəs/ /sæmp/ /ræmp/ /’haidrezəun//ælkə’leiʃn/Enyne Metathesis./’en,ain/Eschenmoser Methenylation/mæθənə’leiʃn/Eschenmoser-Claisen RearrangementEschenmoser-Tanabe Fragmentation/’tɑːnɑbi/ /‚frægmen'teɪʃn/Eschweiler-Clarke Methylation (Reductive Alkylation)/’æʃwailə/ /klɑːrk//meθə’leiʃn//rɪ'dʌktɪv/ /ælkə’leiʃnEvans Aldol Reaction/ævəns/ /’eldɔl/Favorskii and Homo-Favorskii Rearrangement/fæ’vɔski:/ /,həʊməʊfæ’vɔski/Feist-Bénary Furan Synthesis./faist/ /’bænəri/ /’fju(ə)ren/Ferrier Reaction/Rearrangement. /’færiə/Finkelstein Reaction./’fi:nkstain/Fischer Indole Synthesis/’fi:ʃə/ /’indɔl/Fleming-Tamao Oxidation/flemiŋ/Friedel-Crafts Acylation/’fri:dəl/ /kræfts/ /esə’leiʃn/Friedel-Crafts Alkylation/’fri:dəl/ /kræfts/ /ælkə’leiʃn/Fries-, Photo-Fries, and Anionic Ortho-Fries Rearrangement./fri:s/ /fəutəu’fri:s/ /enai’ɔnik//ɔθə’fri:s/Gabriel Synthesis/’geibri:əl/Gattermann and Gattermann-Koch Formylation/’gætəmən/ /’gætəmən/ /kəuk/ (德语/kɔh/)Glaser Coupling/’glɑːsə/ Grignard Reaction/’griniɑː/Grob Fragmentation/grɔbp/Hajos-Parrish Reaction/pæriʃ/Hantzsch Dihydropyridine Synthesis/hʌntz/ /daihaidrə’pi:ridin/Heck Reaction/hek/Heine Reaction/hainə/Hell-Volhard-Zelinsky Reaction/he/ /fɔlhɑːd/ /zelinski/ (前两个为德语,后一个为俄语,音译)Henry Reaction/’henrɪ/Hetero Diels-Alder Cycloaddition (HDA) /hetərə/ /’di:ls/ /'ɑːldə/Hofmann Elimination/’hɔfmən/Hofmann-Löffler-Freytag Reaction (Remote Functionalization)/lɔflə/ /’fraitʌg/Hofmann Rearrangement/’hɔfmən/ /‚rɪːəreɪndʒmənt/Horner-Wadsworth-Emmons Olefination/’hɔ:nər/ /’wɔ:dzwəθ/ /’æmɔns/Horner-Wadsworth-EmmonsOlefination –Still-Gennari Modification/stɪl/ /dʒi’nɑːri/ /'mɑdɪfɪ'keɪʃn/Houben-Hoesch Reaction/Synthesis. /’hubən/ /hɔ:tʃ/Hunsdiecker ReactionJacobsen Hydrolytic Kinetic Resolution /’jeikəubsən/ /haidrə’litic/ /kai’netic//‚rezə'luːʃn/Jacobsen-Katsuki Epoxidation/’kætʃuki/Japp-Klingemann Reaction/jep/ /’kliŋgmən/ (德语音译)Johnson-Claisen Rearrangement./ˈdʒɔːnsən/Jones Oxidation/Oxidation of Alcohols by Chromium Reagents/ˈdʒəuns/ /'ælkəhɒl/ / 'krəʊmjəm/Julia-Lythgoe Olefination/ˈdʒuːlɪə/ /’li:θgəu/Kagan-Molander SamariumDiiodide-Mediated Coupling/’kægən/ /mɔ’lʌndə/ /sə’mæriəm//dai’aɪədaɪd/ /'miːdɪeɪtid/Kahne Glycosidation/kein/ /glaikəsai’deiʃn/Keck Asymmetric Allylation/kek/ /æsɪ'metrɪk/ /ælə’leiʃn/Keck MacrolactonizationKeck Radical Allylation.Knoevenagel Condensation/’knəuv,nɔgi/ (德语音译) Knorr Pyrrole Synthesis/(k)nɔr/ /’pirəul/Koenigs-Knorr Glycosidation /’ku:nis/ /(k)nɔr/Kolbe-Schmitt Reaction/kɔlb/ /ʃmit/Kornblum Oxidation./’kɔrnbləm/Krapcho Dealkoxycarbonylation (Krapcho reaction)/’kræptʃɔ/ /di’ælkɔksi,ka:bənə’leiʃn/Kröhnke Pyridine Synthesis/krɔnk/Kulinkovich Reaction/ku’linkɔvitʃ/Kumada Cross-Coupling/kumʌdʌ/Larock Indole Synthesis./’lærɔk/Ley Oxidation ./lei/Lieben Haloform Reaction./’li:bən/ /’hæləfɔrm/Lossen Rearrangement/’lɔ:sən/Luche Reduction/luk/Madelung Indole Synthesis /’mʌdəlu:ŋ/Malonic Ester Synthes is./mə’lɔ:nik/Mannich Reaction/’meni:tʃ/McMurry Coupling./mæk’muri/Meerwein Arylation./’mi:əwain/ /æri’leiʃn/Meerwein-Ponndorf-Verley Reduction /’pɔ:ndɔf/ /’vəli:/Meisenheimer Rearrangement/maisən’haimə/Meyer-Schuster and Rupe Rearrangement/’maiə/ /’ʃu:stə/ /ru:p/Michael Addition Reaction/’maikəl/Midland Alpine Borane Reduction /’midlənd/ /'ælpaɪn/ /’bɔrein/Minisci Reaction/’miniʃi/Mislow-Evans Rearrangement/’mi:sləu/ /evəns/Mitsunobu Reaction ../mitʃu’nəubu/Miyaura Boration ./mi’jɔrə/Mukaiyama Aldol Reaction/mukai’jʌmʌ/Myers Asymmetric Alkylation./’maiəs/Nagata Hydrocyanation/haidrə’saiəneiʃn/Nazarov Cyclization ./’na:zʌrɔv/ /saiclə’zeiʃn/Neber Rearrangement/’nebər/Nef Reaction ./nef/Negishi Cross-Coupling/’negiʃi/Nenitzescu Indole SynthesisNicholas Reaction/ˈnɪkələs/Noyori Asymmetric Hydrogenation./nɔ’jɔri/Nozaki-Hiyama-Kishi Reaction/’nɔzeki/ /hi’jʌmʌ/ /kiʃi/Oppenauer Oxidation ../əupə’nɔ:ə/Overman Rearrangement/'əʊvəmən/Oxy-Cope Rearrangement and Anionic Oxy-Cope Rearrangement../'ɔksɪ/Paal-Knorr Furan Synthesis/pa:l/ /(k)nɔr/ /’fju(ə)ren/Paal-Knorr Pyrrole Synthesis/pa:l/ /(k)nɔr/ /’pirəul/Passerini Multicomponent Reaction/pʌ’sirini/ (意大利语音译) /,mʌltɪkəmˋpəunənt/Paterno-Büchi Reaction/’pʌteənɔ/ /buʃi/Pauson-Khand Reaction/’pɔ:sən/ /kænd/Payne Rearrangement ./pein/Perkin Reaction.../’pə:rkin/Petasis Boronic Acid-Mannich Reaction/’pætəsis/Petasis-Ferrier Rearrangement Peterson Olefination./ˈpiːtərsən/Pfitzner-Moffatt Oxidation/’fitznə/ /’mɔ:fet/Pictet-Spengler Tetrahydroisoquinoline Synthesis/’piktet/ /’ʃpeŋlə//‚tetrə’haidrɔisəu'kwɪnəlɪːn/Pinacol and Semipinacol Rearrangement ../’pi:nəkɔl/ /semi’pi:nəkɔl/Pinner Reaction../ˈpɪnə(r)/Pinnick Oxidation/’pi:nik/Polonovski Reaction./pɔlɔ’nɔvski/Pomeranz-Fritsch Reaction./’pɔ:mərenz/ /’fri:tʃ/Prévost Reaction/’preivɔ/ (法语音译)Prilezhaev Reaction Prins Reaction/’prins/Prins-Pinacol Rearrangement/’prins/ /’pi:nəkɔl/Pummerer Rearrangement/’pu:mərə/Quasi-Favorskii Rearrangement ... /ˈkweɪzaɪ/ /fe’vɔ:ski/Ramberg-Bӓcklund Rearrangement.. /’ræmbəg/ /’bæklund/Reformatsky Reaction./rifɔ’mætski/Regitz Diazo Transfer/’reigitz/ /dai’æzəu/Reimer-Tiemann Reaction ../’raimə/ /’taimən/Riley Selenium Dioxide Oxidation . /’raili:/ / sɪ'lɪːnɪəm/ /dai’ɔksaid/Ritter Reaction/’ri:tə/Robinson Annulation/ˈrɑːbənsən/Roush Asymmetric Allylation/rəuʃ/Rubottom Oxidation/ruˈbɔtəm/Saegusa OxidationSakurai Allylation./’sʌku:rʌi/ (日语音译)Sandmeyer Reaction/’sændmeiə/Schmidt Reaction ../ʃmit/Schotten-Baumann Reaction/’ʃɔtən/ /’baumən/Schwartz Hydrozirconation/’ʃɔ:rtz/ /haidrəzəkəu’neiʃn/Seyferth-Gilbert Homologation/’seifəθ/ /’gɪlbət/ /hɔməulə’geiʃn/Sharpless Asymmetric Aminohydroxylation/’ʃa:pləs/ /,əminəuhai’drɔksi’leiʃn/Sharpless Asymmetric Dihydroxylation /,daihai’drɔksi’leiʃn/Sharpless Asymmetric Epoxidation/epɔksi’deiʃn/Shi Asymmetric EpoxidationSimmons-Smith Cyclopropanation /’saiməns/ /smi:θ/ /,saikləprəupə’neiʃn/Skraup and Doebner-Miller Quinoline Synthesis./’milə/Smiles RearrangementSmith-Tietze Multicomponent Dithiane Linchpin Coupling/’ti:zə/ /dai’θain/ /'lɪntʃpɪn/Snieckus Directed Ortho Metalation./metə’leiʃn/Sommelet-Hauser Rearrangement . /’sɔ:məlit/ /’hausər/ Sonogashira Cross-CouplingStaudinger Ketene Cycloaddition/’ʃtaudiŋer/ /’ki:tin/Staudinger ReactionStephen Aldehyde Synthesis (Stephen Reduction)./ˈstiːvn/ /ˈældəhaɪd/Stetter Reaction/’stetə/Stevens Rearrangement/ˈstiːvn s/Stille Carbonylative Cross-Coupling /’sti:lə/ /ka:r’bonələtiv/Stille Cross-Coupling(Migita-Kosugi-Stille Coupling)/mədʒitə/Stille-Kelly Coupling/ˈkeli/Stobbe Condensation/’ʃtɔbi/Stork Enamine Synthesis/’stɔ:k/ /’enəmin/Strecker Reaction/’strækə/Suzuk i Cross-Coupling(Suzuki-Miyaura Cross-Coupling)/sʊzʊki/ /mi’jɔrə/Swern Oxidation/swən/Takai-Utimoto Olefination (TakaiReaction)/tʌ’kai/Tebbe Olefination/Petasis-Tebbe Olefination/’tebi/ /’pætəsis/Tishchenko ReactionTsuji-Trost Reaction/Allylation/tsudʒi/ /tɔ:st/Tsuji-Wilkinson Decarbonylation Reaction ./’wilkinsən/Ugi Multicomponent Reaction/ju: dʒi/Ullmann Biaryl Ether and Biaryl Amine Synthesis/Condensation../u:lmən/ /bai’erəl/Ullmann Reaction/Coupling/Biaryl SynthesisVilsmeier-Haack Formylation/hʌk/Vinylcyclopropane-Cyclopentene Rearrangement/vainl,saiklə’prəupein/von Pechman Reaction/vɔn ‘pekmən/Wack er Oxidatio n/’wekər/Wagner-Meerwein Rearrangement /’wægnə/ /’mi:əwain/Weinreb Ketone Synthesis/‘wainreb/Wharton Fragmentation /ˈwɔːtən/Wharton Olefin Synthesis (Wharton Transposition)Williamson Ether Synthesis/’wi:lliəmsən/Wittig Reaction/‘witi:ʃ/Wittig Reaction - Schlosser Modification/ʃ’lɔsər/ (德语音译)Wittig-[1,2]- and [2,3]-Rearrangement.. Wohl-Ziegler Bromination/wɔl/ /’zi:glə/(德语音译)Wolff Rearrangement/wɔ:f/Wolff-Kishner Reduction/’ki ʃnər/Wurtz Coupling/wu:tz/Yamaguchi Macrolactonization/’jʌmʌgutʃ i/ (日语音译)*本列表部分读音不保证准确。
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
不对称环氧化

不对称环氧化:
S h a r pless体系(仅对烯丙醇类底物有效)
分子筛存在下,钛酸四异丙酯(Ti(OiPr)4):酒石酸二乙酯(DET)(D或L)用量,,TBHP(叔丁基过氧化氢)。
手性Salen催化体系(催化顺式烯烃环氧化较高选择性):Salen-Mn(III)催化剂,NaClO水溶液、H2O2,亚碘酰苯,
Jacobsen 催化剂
Katsuki 催化剂
手性酮催化体系:
KHSO5为氧化剂,与手性酮原位生成dioxirane,后者可进行不对成环氧化烯烃,
手性金属卟啉催化体系:
负载手性催化体系:
不成熟方法:
手性亚胺盐催化剂
聚氨基酸催化剂
手性季铵盐催化剂
唐除痴周正洪《不对称反应概论》
《不对称催化反应.。
有机人名反应讲解

有机人名反应讲解有机人名反应是一种基于人名命名的有机化学反应,通常是由某个化学家或科学家首次发现和提出的。
这些反应在有机化学中非常重要,因为它们是构建复杂有机分子的重要工具。
以下是一些著名的有机人名反应的讲解:1. 付克(傅瑞德尔)反应 (Friedel-Crafts Reaction):这是一个在路易斯酸(如氯化铝)催化下,在芳香烃中引入卤素和硝基等基团的过程。
这个反应由法国化学家查尔斯·傅瑞德尔和美国化学家詹姆斯·E·克雷夫特在19世纪末和20世纪初发现。
2. 珀金反应 (Perkin Reaction):这是一个由英国化学家威廉·珀金在19世纪末发现的反应,涉及芳香醛和酸酐在酸催化下缩合生成酯,并伴随有烯烃的生成。
3. 沃尔夫-凯惜纳-梅尔斯反应 (Wolff-Kishner-Mellor Reaction):这个反应由德国化学家卡尔·沃尔夫、美国化学家赫尔曼·梅尔斯和英国化学家约翰·凯惜纳在20世纪初发现。
它涉及将醛或酮的羰基转化为醇或烃的过程,通常使用氢氰酸和硫酸作为反应试剂。
4. 布特列洛夫反应 (Butlerov Reaction):这是由俄国化学家亚历山大·布特列洛夫在19世纪末发现的反应,涉及将醛或酮与醇在酸催化下缩合,生成环状酯的反应。
5. 迪尔斯-阿尔德反应 (Diels-Alder Reaction):这是一个由德国化学家奥托·迪尔斯和英国化学家罗纳德·奥多·阿尔德在20世纪初发现的反应,涉及共轭二烯烃和烯酮之间的环加成反应,生成一个四环化合物。
6. 霍夫曼消除反应 (Hofmann Elimination):这是由德国化学家阿道夫·霍夫曼在19世纪末发现的反应,涉及季铵碱加热时消除氢氧化铵的反应,生成烯烃。
7. 柏金反应 (Perkin Reaction):这个反应类似于珀金反应,但使用了不同的酸酐和酚类化合物作为反应物,生成相应的酯和酮类化合物。
氧化环化反应

氧化环化反应
氧化环化反应是化学中构建分子骨架的重要手段,在化学合成中,环化成键一般涉及手性控制、效率低、环境污染等问题,而酶能在比较温和的条件下立体选择性的催化成键反应,因此高效催化成键成环反应的酶展示出巨大应用潜力,举例如下:
1.Prilezhaev反应。
烯烃被过氧酸环氧化得到环氧乙烷的反应被称为
Prilezhaev反应,应用最广的氧化剂是mCPBA,另外单邻苯二甲酸镁、DDO和过氧乙酸也经常被用于此反应。
2.史氏不对称环氧化反应。
反式二取代的烯烃或三取代的烯烃在果糖衍生的
手性酮催化下利用Oxone作为氧化剂进行不对称环氧化的反应。
3.Sharpless不对称环氧化反应。
叔丁基过氧化氢,钛酸四异丙酯和单一构型
的酒石酸二乙酯对烯丙醇进行对映选择性的环氧化的反应。
4.Jacobsen-Katsuki环氧化反应。
利用手性(salen)Mn(III)催化剂催化下氧化烯
烃不对称合成环氧化物的反应被称为Jacobsen-Katsuki环氧化反应。
烯烃的不对称氧化反应

作者:刘江
1
目录
•烯烃与过氧酸反应生成的环氧化物 •Sharpless不对称环氧环反应 •Jacobsen不对称环氧环反应 •Shi不对称环氧环反应
2
烯烃与过氧酸反应生成的环氧化物机理
从机理上可以看出,过酸上的正电性越高反应越易进行, 如F3COOOH就比CH3COOOH易进行。双键上电子云密度越高 越易进行。
手性酮A的制作方法
37
Shi 不对称环氧反应基本过程
Oxone (商品名): 过氧硫酸氢钾制剂(2KHSO5 K2SO4) A: 二氧杂环丙烷 (dioxirane)为催化剂
38
Shi 不对称环氧反应机理
催化循环
39
Shi 不对称环氧反应机理
以丙酮为例,从丙 酮开始到终产物
40
Shi 不对称环氧反应机理
• (2)可靠性:
虽然大的R取代基是不利的,但对于 大多数烯丙醇,反应都能成功;
22
Sharpless环氧化反应的特点: • (1)简易性: 所有的反应组份都是廉价的,并且 是商品化的;
• (2)可靠性:
虽然大的R取代基是不利的,但对于 大多数烯丙醇,反应都能成功;
23
Sharpless环氧化反应举例
20
Sharpless环氧化反应的特点:
• (5)产物的绝对构型可以预见:
对潜手性烯丙醇衍生物而言,迄今对 于图所示的规律尚未见有例外。 • (6)2,3-环氧醇作为中间体的多用性: 新的选择性转化扩大了该反应的实用 性和意义。
21
Sharpless环氧化反应的特点: • (1)简易性: 所有的反应组份都是廉价的,并且 是商品化的;
15
Sharpless环氧化反应举例
每周一个人名反应(一)

每周一个人名反应(一)在有机合成中,如果想要构建不对称中心,一种方法是采用诱导基团,但是,这种方法常常耗费多于一当量的手性试剂,这对于应用昂贵的手性试剂的反应,将极大的提高使用成本。
直到180年,Sharpless小组首先发表了关于高价锇催化的不对称双羟基化反应。
最早应用的l-2-(2-薄荷基)吡啶配体并不尽如人意,ee值仅有3~18%;后来的研究发现,使用金鸡纳碱衍生物二氢奎宁乙酸酯(下图右边的两个)作为配体,ee值可以达到94%。
以NMO作为辅助氧化剂的机理如下,包括一个高ee值的催化循环和一个低ee值的催化循环。
首先发生四氧化锇和烯烃的环加成,另外,反应也有可能先发生2+2环加成,再发生一步扩环历程,得到中间体2。
但是,只有特定的取向可以结合,这也是为什么配体决定反应的面选择性,这将在下文更详尽的阐述。
对于反应的具体机理,Corey和Sharpless提出了两种机理。
我们先来看看Corey的机理:和四氧化锇配位的手性配体,结合形成一个手性袋。
这种手性U 型结合袋可以使底物获得有利的范德华作用。
其中,甲氧基喹啉基团充当“墙壁”,1,2-二嗪化合物作为底。
从而,底物烯烃为了进入口袋,必须采取特定的取向。
箭头所指的是三级胺的孤对电子,这个孤对电子和四氧化锇的中心结合,从而固定催化剂的取向。
由于底物具有C2对称性,因此这两个三级胺的孤对电子是完全等价的。
下面我们来看看Sharpless机理:在形成锇氧杂四元环中间体的过程中,烯烃取代基和配体的芳杂环之间的范德华相互作用,直接决定了烯烃氧化的面选择性。
下面我们来通过一个例子看一下Sharpless不对称双羟化的双重选择性:在不对称化合物中,还可以进行不对称拆分,在下面的例子中,反应的相对速率达到62倍!由此可见,这种动力学拆分是十分高效的。
由于二茂铁可以看作是一种基团(姑且将其认为是一个手性导向基团),就算不用不对称试剂,也会出现四种化合物。
当然,这样得到的是一对对映体混合物,如果要得到单一的氧化产物,可以拆分再分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
每天一个人名反应--Jacobsen-Katsuki环氧化反应Z-烯烃在Mn(Ⅲ)-salen催化下的不对称环氧化反应。
反应机理
协同的氧转移(cis-环氧化物)
经自由基中间体的氧转移(trans-环氧化物)
经锰的氧化物中间体的氧转移(cis-环氧化物)
反应实例
参考文献
1. (a) Baudin, J. B.; Hareau,G.; Julia, S. A.; Ruel, O. Tetrahedron Lett. 1991, 32,
1175-1178. (b) Baudin,J. B.; Hareau, G.; Julia, S. A.; Ruel, O. Bull. Soc. Chim. Fr.
1993, 130, 336 357.(c) Baudin, J. B.; Hareau, G.; Julia, S. A.; Loene, R.; Ruel, O.
Bull. Soc. Chim.Fr. 1993, 130, 856 878. (d) Blakemore, P. R.; Cole, W. J.;
Kocienski, P. J.; Morely, A. Synlett1998, 26 28.
2. Charette, A. B.; Lebel, H. J. Am. Chem.Soc. 1996, 118, 10327 10328.
3. Blakemore, P. R.; Kocienski,P. J.; Morley, A.; Muir, K. J. Chem. Soc., Perkin Trans.
1 1999, 955 968.
4. Williams, D. R.; Brooks, D.A.; Berliner, M. A. J. Am. Chem. Soc. 1999, 121,
4924 4925.
5. Kocienski, P. J.; Bell, A.;Blakemore, P. R. Synlett 2000, 365 36
6.
6. Liu, P.; Jacobsen, E. N. J.Am. Chem. Soc. 2001, 123, 10772 10773.
7. Charette, A. B.;Berthelette, C.; St-Martin, D. Tetrahedron
Lett. 2001, 42,5149–5153.
8. Alonso, D. A.; Najera, C.;Varea, M. Tetrahedron Lett. 2004, 45, 573–577.
9. Alonso, D. A.; Fuensanta,M.; Najera, C.; Varea, M. J. Org. Chem. 2005, 70, 6404.
10. Rong, F. Julia–Lythgoeolefination. In Name Reactions for Homologations-Part I; Li,
J. J., Ed.; Wiley: Hoboken, NJ,2009, pp 447 473. (Review).
11. Davies, S. G.; Fletcher, A.M.; Foster, E. M.; Lee, J. A.; Roberts, P. M.; Thomson, J.
E. J. Org. Chem. 2013,78, 2500–2510.
本文来自 Name Reactions:A Collection of Detailed Mechanisms
and Synthetic Applications--Fifth Edition,有机人名反应——机理及应用第四版。
