江苏专用2019届高考化学二轮复习压轴题热点练6晶胞的有关计算
压轴题06 热重曲线与相关计算-(原卷版)-高考化学压轴题专项训练(江苏专用)
压轴题06热重曲线与相关计算热重曲线类试题能综合考察学生分析图像的能力、获取信息的能力、数据处理的等能力,具有一定的信度与区分度,是近几年江苏高考对于化学计算的重要考查形式,热重曲线与相关计算分析仍然是2023年江苏高考考查的必考重点难点。
常见考点是图像分析,涉及热重过程中相关计算等,所以要求考生了解题型的知识点及要领,对于常考的模型要求有充分的认知。
热重曲线与相关计算考查某温度范围内的成分(化学式)、某温度范围内的化学反应、确定某样品的组成计算样品中某成份的质量分数等、因此建立证据推理和模型认知,注意对平衡移动原理的应用与把握。
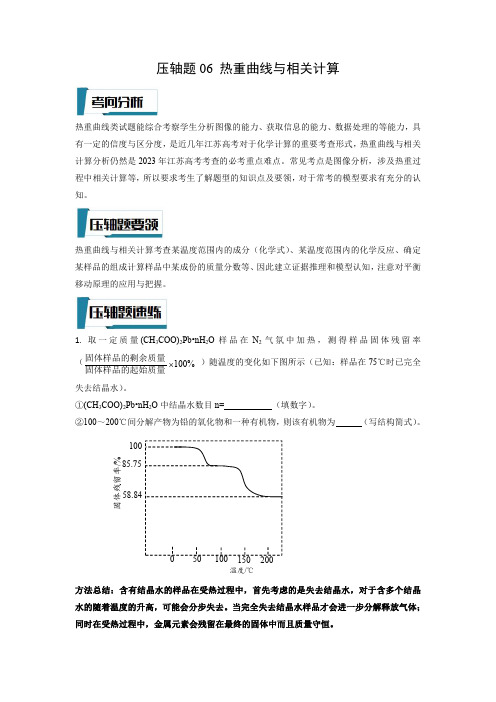
1.取一定质量(CH 3COO)2Pb•nH 2O 样品在N 2气氛中加热,测得样品固体残留率(%100 固体样品的起始质量固体样品的剩余质量)随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
①(CH 3COO)2Pb•nH 2O 中结晶水数目n=(填数字)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为(写结构简式)。
方法总结:含有结晶水的样品在受热过程中,首先考虑的是失去结晶水,对于含多个结晶水的随着温度的升高,可能会分步失去。
当完全失去结晶水样品才会进一步分解释放气体;同时在受热过程中,金属元素会残留在最终的固体中而且质量守恒。
58.8485.75020010015050100固体残留率/%温度/℃2.Co(OH)2在空气中加热时,固体残留率随温度的变化如下图所示。
已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为。
(填化学式);则从120℃开始分解到290℃这段过程所发生的总反应方程式为。
方法总结:由热重曲线考查方程式的书写,首先要确定温度变化前的物质(反应物)和温度变化后的物质(生成物)。
通过曲线中变化的数值计算出生成物与反应物的式量差,结合元素守恒推测出挥发出的物质(另外的生成物);有时还要结合氧化还原反应的知识对方程式进行补充与配平。
2019年高考化学二轮复习同步精选对点训练:晶胞的计算(含解析)
2019年高考化学二轮复习同步精选对点训练:晶胞的计算(含解析)1.如图,石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为( )A. 2B. 3C. 4D. 62.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、⊗—Z。
其对应的化学式不正确的是( )3.某晶体中含有A,B,C三种元素,其排列方式如图所示,晶体中A,B,C的原子个数之比依次为()A. 1∶3∶1B. 2∶3∶1C. 8∶6∶1D. 4∶3∶14.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )A. ZXY3B. ZX2Y 6C. ZX4Y 8D. ZX8Y 125.氢是重要而洁净的能源。
要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。
化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为()A. LaNi5B. LaNiC. La14Ni24D. La7Ni126.已知某晶体由X、Y、Z三种元素组成的,其晶胞如图所示,则X、Y、Z三种元素的原子个数之比正确的是( )A. 1:3:1B. 2:6:1C. 4:8:1D. 8:1:17.某离子化合物的晶胞如图所示。
阳离子位于晶胞的中心,阴离子位于晶胞的8个顶点上,则该离子化合物阴、阳离子的个数比为 (A. 1∶8B. 1∶C. 1∶2D. 1∶18.最近发现了一种由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面的原子是M原子,棱中心和体心的原子是N原子,它的分子式为( )A. M4N 4B. MNC. M14N 13D.条件不够,无法写出9.科学家发现钇钡铜氧化合物在90 K时具有超导性,若该化合物的结构如图所示,则该化合物的化学式可能是 ( )A. YBa2Cu3O8。
江苏专用2019届高考化学二轮复习压轴题热点练6晶胞的有关计算

热点6 晶胞的有关计算1.某晶体的晶胞结构如图所示。
X(•)位于立方体顶点,Y()位于立方体中心。
试分析:(1)晶体中每一个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式是____________。
(2)晶体中在每个X周围与它最近且距离相等的X共有________个。
(3)晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为_______。
答案(1)4 8 XY2(或Y2X) (2)12 (3)109°28′解析(1)同时吸引的微粒个数即指在某微粒周围距离最近的其他种类的微粒个数,观察图可知,Y位于立方体的体心,X位于立方体的顶点,每个Y同时吸引着4个X,而每个X 同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,X、Y的个数比为1∶2,所以化学式为XY2或Y2X。
(2)晶体中每个X周围与它最接近的X之间的距离应为如图所示立方体的面对角线。
位置关系分别在此X的上层、下层和同一层,每层均有4个,共有12个。
(3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知该夹角为109°28′。
2.(1)单质O有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________;O和Na的氢化物所属的晶体类型分别为________和________。
(2)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
列式表示Al单质的密度____________g·cm-3(不必计算出结果)。
答案(1)O3O3相对分子质量较大,范德华力大分子晶体离子晶体(2)124×276.02×1023×(0.405×10-7)3解析(1)O元素形成O2和O3两种同素异形体,固态时均形成分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O3的沸点高于O2。
高考化学晶胞的相关计算专项训练知识点及练习题附解析

高考化学晶胞的相关计算专项训练知识点及练习题附解析一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
晶胞的相关计算专项训练知识点-+典型题及解析

晶胞的相关计算专项训练知识点-+典型题及解析一、晶胞的相关计算1.元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。
X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是()A.该晶体属于原子晶体B.X2+的配位数为8,Y2-的配位数为4C.与每个Y2-距离最近且相等的Y2-共有12个D.该晶体的熔点比氧化锌高2.根据下列结构示意图,判断下列说法中正确的是A.在CsCl晶体中,距Cs+最近的Cl-有6个B.在CaF2晶体中,Ca2+周围距离最近的F-有4个C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个3.钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成的反应过程:回答下列问题:(1)I原子价电子排布式为___________,其能量最高的能层是___________(填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________。
(3) 中碳原子的杂化方式为___________。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________。
②NH3的空间构型为___________。
③1 mol [Zn(NH3)4]Cl2中含有___________mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________。
(6)金属钯的堆积方式如图所示:①该晶胞中原子的空间利用率为___________(用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________(列出计算表达式)g·cm-3。
2019届高考化学二轮复习压轴题热点练6晶胞的有关计算(含答案)

热点6 晶胞的有关计算1.某晶体的晶胞结构如图所示。
X(•)位于立方体顶点,Y位于立方体中心。
试分析:(1)晶体中每一个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式是____________。
(2)晶体中在每个X周围与它最近且距离相等的X共有________个。
(3)晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为_______。
答案(1)4 8 XY2(或Y2X) (2)12 (3)109°28′解析(1)同时吸引的微粒个数即指在某微粒周围距离最近的其他种类的微粒个数,观察图可知,Y位于立方体的体心,X位于立方体的顶点,每个Y同时吸引着4个X,而每个X 同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,X、Y的个数比为1∶2,所以化学式为XY2或Y2X。
(2)晶体中每个X周围与它最接近的X之间的距离应为如图所示立方体的面对角线。
位置关系分别在此X的上层、下层和同一层,每层均有4个,共有12个。
(3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知该夹角为109°28′。
2.(1)单质O有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________;O和Na的氢化物所属的晶体类型分别为________和________。
(2)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
列式表示Al单质的密度____________g·cm-3(不必计算出结果)。
答案(1)O3O3相对分子质量较大,范德华力大分子晶体离子晶体(2)124×276.02×1023×(0.405×10-7)3解析(1)O元素形成O2和O3两种同素异形体,固态时均形成分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O3的沸点高于O2。
新高考化学晶胞的相关计算专项训练之知识梳理与训练附解析

新高考化学晶胞的相关计算专项训练之知识梳理与训练附解析晶胞是晶体中最基本的单位,是指由一组原子、离子或分子组成的空间结构。
晶胞的形状和大小决定了晶体的物理化学性质。
在新高考化学中,对于晶胞的相关计算是考查晶体结构和晶胞参数的基本知识点。
下面对晶胞的相关计算进行梳理,并附上相应训练题目和解析。
1.晶体的晶胞概念及特点:晶体的晶胞是晶体的最小周期性构造单元。
晶胞具有以下特点:-晶胞是一种具有尺度的空间格子,具有一定的几何形状。
-晶胞是晶体中的原子、离子或分子的排列规律。
-晶胞可以由晶胞参数描述,如晶胞的边长、角度等。
2.简单立方晶体的晶胞参数计算:简单立方晶体的晶胞参数包括晶胞边长和晶胞角度,计算公式如下:-晶胞边长a=2r-晶胞角度α=β=γ=90°训练题目:物质为简单立方结构,已知晶体中的原子半径r=1.26Å,求该晶胞的晶胞参数。
解析:根据公式得,晶胞边长a=2r=2×1.26Å=2.52Å。
晶胞角度α=β=γ=90°。
3.体心立方晶体的晶胞参数计算:体心立方晶体的晶胞参数包括晶胞边长和晶胞角度,计算公式如下:-晶胞边长a=4r/√3-晶胞角度α=β=γ=90°训练题目:物质为体心立方结构,已知晶体中的原子半径r=1.34Å,求该晶胞的晶胞参数。
解析:根据公式得,晶胞边长a=4r/√3=4×1.34Å/√3≈3.09Å。
晶胞角度α=β=γ=90°。
4.面心立方晶体的晶胞参数计算:面心立方晶体的晶胞参数包括晶胞边长和晶胞角度,计算公式如下:-晶胞边长a=2r√2-晶胞角度α=β=γ=90°训练题目:物质为面心立方结构,已知晶体中的原子半径r=1.58Å,求该晶胞的晶胞参数。
解析:根据公式得,晶胞边长a=2r√2=2×1.58Å√2≈4.46Å。
高考化学二轮复习-晶胞的相关计算

2
4 3
rT3i
a3
4
4 3
rO3
100%
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
考一考
1、FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量 为M4, M阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 _N_A__(a__1_0_7 _)3__g·cm−3;晶胞中Fe2+位于所形成的正八面体的体心,
德16罗0 常数的值,列式表示氧化钛晶体的密度: (a 10__7_)3___N_A_g/cm3。(Ti的相对原子质量为48, O的相
对原子质量为16)
• 若Ti和O的原子半径分别为rTi nm 和rO nm,则在该氧
化物晶体中离子的空间利用率为 _________________(用含rTi 、rO的式子表示)。
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
我再试一试
• 钛的一种氧化物是优良的颜料,该氧化物的晶胞结构 如右图所示。
• 该氧化物的化学式为__T__iO__2__;在晶胞中Ti原子的配 位数为__6______,若晶胞边长为a nm,NA为阿伏加
3 a2 c) 4
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
作业:
• 课后练习
2020届高 考化学 二轮复 习- 晶 胞的相 关计算( 共12张 PPT)
高考化学中“晶胞的相关计算专项训练”的类型分析及解析

高考化学中“晶胞的相关计算专项训练”的类型分析及解析一、晶胞的相关计算1.2Mg Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。
下列叙述错误的是()A.Si的配位数为8B.紧邻的两个Mg原子的距离为0.635 2nmC.紧邻的两个Si原子间的距离为20.6352⨯nmD.2Mg Si的密度计算式为()337A76g cm0.63510N--⋅⨯2.2020年,自修复材料、自适应材料、新型传感材料等智能材料技术将大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu在元素周期表中位于_____区,M层中核外电子能量最高的电子云在空间有_____个伸展方向。
C、N、O第一电离能由大到小的顺序为_____________(2)氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:还原石墨烯中碳原子的杂化形式是______,上图中氧化石墨烯转化为还原石墨烯时,1号C 与其相邻 C原子间键能的变化是_____________(填“变大”、“变小”或“不变”),二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________(3)砷化硼是近期受到广泛关注一种III—V半导体材料。
砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);(,,0);(,0,);(0,,);……As:(,,);(,,);(,,);(,,)请在图中画出砷化硼晶胞的俯视图...........___________,已知晶体密度为dg/cm3,As半径为a pm,假设As、B原子相切,则B原子的半径为_________pm(写计算表达式)。
3.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
高二化学晶胞的相关计算专项训练知识点及练习题附解析

高二化学晶胞的相关计算专项训练知识点及练习题附解析一、晶胞的相关计算1.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
该合金储氢后,H2与 Ni 的物质的量之比为___________。
②Mg2NiH4 是一种储氢的金属氢化物。
在 Mg2NiH4晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。
Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。
晶体的密度为ρg·cm-3,N A表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 N A的代数式表示)。
3.锌及锌的化合物应用广泛。
例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:(1)基态Zn2+ 的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
新高考化学高考化学压轴题 晶胞的相关计算专项训练分类精编及答案

新高考化学高考化学压轴题 晶胞的相关计算专项训练分类精编及答案一、晶胞的相关计算1.2Mg Si 具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm 。
下列叙述错误的是( )A .Si 的配位数为8B .紧邻的两个Mg 原子的距离为0.6352nmC .紧邻的两个Si 原子间的距离为20.6352⨯nm D .2Mg Si 的密度计算式为()337A 76g cm 0.63510N --⋅⨯2.已知某离子晶体的晶胞示意图如图所示,其摩尔质量为Mg/mol ,阿伏加德罗常数的值为N A ,晶体的密度为dg/cm 3下列说法中正确的是A .晶体晶胞中阴、阳离子的个数都为1B .晶体中阴、阳离子的配位数都是4C .该晶胞可能是NaCl 的晶胞D .该晶体中两个距离最近的阳离子的核间距为4M/(N A d)cm3.氮及其化合物有许多用途。
回答下列问题:(1)基态Mn 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)3NCl 的沸点(71℃)比HCN 的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,3NCl 、2NH -、2NO -三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
(4)4Mn N (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm 。
该氮化锰的密度为-3g cm (列出计算式)。
________________________________________________________4.铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热点6 晶胞的有关计算1.某晶体的晶胞结构如图所示。
X (•)位于立方体顶点,Y位于立方体中心。
试分析:(1)晶体中每一个Y 同时吸引着________个X ,每个X 同时吸引着________个Y ,该晶体的化学式是____________。
(2)晶体中在每个X 周围与它最近且距离相等的X 共有________个。
(3)晶体中距离最近的2个X 分别与1个Y 形成的两条线的夹角为_______。
答案 (1)4 8 XY 2(或Y 2X) (2)12 (3)109°28′解析 (1)同时吸引的微粒个数即指在某微粒周围距离最近的其他种类的微粒个数,观察图可知,Y 位于立方体的体心,X 位于立方体的顶点,每个Y 同时吸引着4个X ,而每个X 同时被8个立方体共用,每个立方体的体心都有1个Y ,所以每个X 同时吸引着8个Y ,X 、Y 的个数比为1∶2,所以化学式为XY 2或Y 2X 。
(2)晶体中每个X 周围与它最接近的X 之间的距离应为如图所示立方体的面对角线。
位置关系分别在此X 的上层、下层和同一层,每层均有4个,共有12个。
(3)若将4个X 连接,构成1个正四面体,Y 位于正四面体的中心,可联系CH 4的键角,知该夹角为109°28′。
2.(1)单质O 有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________;O 和Na 的氢化物所属的晶体类型分别为________和________。
(2)Al 单质为面心立方晶体,其晶胞参数a =0.405 nm ,晶胞中铝原子的配位数为________。
列式表示Al 单质的密度____________g·cm -3(不必计算出结果)。
答案 (1)O 3 O 3相对分子质量较大,范德华力大 分子晶体 离子晶体 (2)124×276.02×1023×(0.405×10-7)3解析 (1)O 元素形成O 2和O 3两种同素异形体,固态时均形成分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O 3的沸点高于O 2。
O 元素形成的氢化物有H 2O 和H 2O 2,二者均能形成分子晶体。
Na 元素形成的氢化物为NaH ,属于离子晶体。
(2)面心立方晶胞中粒子的配位数是12。
一个铝晶胞中含有的铝原子数为8×18+6×12=4(个),一个晶胞的质量为46.02×1023×27 g ,再利用密度与质量、晶胞参数a 的关系即可求出密度,计算中要注意1 nm =10-7cm 。
3.氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
(1)ZnO 是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。
不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为____________,某种ZnO 晶体的晶胞如图1所示,O 2-的配位数为________。
(2)图2是氮化镓的晶胞模型。
其中镓原子的杂化方式为________杂化,N 、Ga 原子之间存在配位键,该配位键中提供电子对的原子是____________。
氮化镓为立方晶胞,晶胞边长为a pm ,若氮化镓的密度为ρ g ·cm -3,则氮化镓晶胞边长的表达式a =________pm(设N A 表示阿伏加德罗常数的值)。
答案 (1) 8(2)sp 3N3168N A ·ρ×1010解析 (1)锌提供空轨道,OH -中的O 提供孤电子对,形成配位键,结构示意图是:或,离子晶体配位数,是周围最近的异性离子的个数,即O 2-最近的Zn 2+有8个。
(2)根据晶胞,镓有4个共价键,因此镓的杂化类型为sp 3,形成配位键,金属提供空轨道,非金属提供孤电子对,因此提供电子对的原子是N ;根据晶胞的结构,Ga 的个数为8×18+1=2,N 原子的个数为1+4×14=2,晶胞的质量为2×84N A g ,设晶胞的边长为a pm ,晶胞的体积为(a ×10-10)3cm 3,根据密度的定义,即a =3168N A ·ρ×1010pm 。
4.根据晶胞结构示意图,计算晶胞的边长或密度。
(1)N 和Cu 元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为________。
该化合物的相对分子质量为M ,N A 为阿伏加德罗常数的值。
若该晶胞的边长为a pm ,则该晶体的密度是________g ·pm -3。
(2)S 与Cu 形成化合物晶体的晶胞如图所示。
已知该晶体的密度为a g ·cm -3,则该晶胞的体积为________cm 3(N A 表示阿伏加德罗常数的值)。
答案 (1)Cu 3NM N A a 3 (2)384aN A解析 (1)该晶胞中N 原子个数=8×18=1,Cu 原子个数=12×14=3,所以其化学式为Cu 3N ,晶胞的边长为a pm ,其体积为a 3 pm 3,密度=MN A V =M N A a3 g ·pm -3。
(2)该晶胞含Cu :8×18+6×12=4,S 原子个数为4,因此化学式为CuS ,晶胞体积V =mρ=4×(64+32)N A ×ρ=384aN Acm 3。
5.O 和Na 能够形成化合物F ,其晶胞结构如图所示,晶胞参数a =0.566 nm ,F 的化学式为__________;晶胞中O 原子的配位数为________;列式计算晶体F 的密度__________________________________(单位为g·cm -3)。
答案 Na 2O 84×62 g ·mol -1(0.566×10-7 cm )3×6.02×1023 mol-1≈2.27 g ·cm -3解析 由示意图可知:小黑球8个全部在晶胞内部,大灰球数有8×18+6×12=4个。
根据钠和氧的化合价,可知大灰球代表氧原子,小黑球代表钠原子。
则该物质的化学式为Na 2O ,且一个晶胞中有4个Na 2O 。
根据密度公式ρ=m V =4×62 g ·mol -1(0.566×10-7 cm )3×6.02×1023 mol-1≈2.27 g ·cm -3。
6.硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为________;若该晶胞密度为ρ g ·cm -3,硒化锌的摩尔质量为M g ·mol -1。
N A 代表阿伏加德罗常数,则晶胞参数a 为________pm 。
答案 434M N A ρ×1010解析 根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×18+6×12=4,含有锌原子数为4,根据ρ=m V =4MN A V ,所以V =4M ρN A ,则晶胞的参数a =34M N A ρ cm =34M N A ρ×1010pm 。
7.某镍白铜合金的立方晶胞结构如图所示。
(1)晶胞中铜原子与镍原子的数量比为________________。
(2)若合金的密度为d g ·cm -3,晶胞参数a =______________nm 。
答案 (1)3∶1 (2)32516.02×1023×d×107解析 (1)晶胞中含Cu 原子数为12×6=3,含Ni 原子数为18×8=1,两者数量比为3∶1。
(2)由题意可得:d =3×64+59(a ×10-7)3×6.02×1023,解得a =32516.02×1023×d×107nm 。
8.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答下列问题:(1)GaF 3的熔点高于1000 ℃,GaCl 3的熔点为77.9 ℃,其原因是___________ ______________________________________________。
(2)GaAs 的熔点为1238 ℃,密度为ρ g ·cm -3,其晶胞结构如图所示。
该晶体的类型为____________,Ga 与As 以________键键合。
Ga 和As 的摩尔质量分别为M Ga g ·mol -1和M As g ·mol -1,原子半径分别为r Ga pm 和r As pm ,阿伏加德罗常数值为N A ,则GaAs 晶胞中原子的体积占晶胞体积的百分率为___________。
答案 (1)GaF 3为离子晶体,GaCl 3为分子晶体(2)原子晶体 共价 4π×10-30N A ρ(r 3Ga +r 3As )3(M Ga +M As )×100%解析 (1)GaF 3、GaCl 3的熔点相差较大,是因为晶体类型不同,GaF 3熔点高,为离子晶体,而GaCl 3的熔点低,为分子晶体。
(2)GaAs 为原子晶体,Ga 和As 之间以共价键键合。
该晶胞中原子个数:Ga 为4个,As 为8×18+6×12=4个,晶胞中原子所占体积为43π(r 3Ga +r 3As )×4 pm 3;则GaAs 晶胞中原子的体积占晶胞体积的百分率为43π(r 3Ga +r 3As )×4×10-304(M Ga +M As )ρ×N A×100%=4π×10-30N A ρ(r 3Ga +r 3As )3(M Ga +M As )×100%。
