2019-2020年高考化学一轮总复习第五章物质结构元素周期律第16讲原子结构原子核外电子排布课件
高考化学一轮总复习课件第五单元 物质结构 元素周期律 (共430张PPT)

考情 周期表的结构、元素周期律及其应用、元素“位—构—性”三者的关系、化学 回顾 键及元素化合物等。题型以选择题和推断题为主 课时 本单元内容共 3 讲, 课堂讲解可安排 3~4 课时的时间 安排
第1讲 原 子 结 构
一、原子结构 1.原子的构成
2.原子中各粒子之间的数量关系
1.任何微粒中, 质量数=质子数+中子数, 但质子数与电子数不一 定相等, 如阴、阳离子中。 2.有质子的微粒不一定有中子, 如 1H; 有质子的微粒不一定有电 子, 如 H+。 3.质子数相同的微粒不一定属于同一种元素, 如 F 与 OH-。 4.核外电子数相同的微粒, 其质子数不一定相同, 如 Al3+和 Na+、
( 3) 阳离子: 质子数=核外电子数+离子所带电荷数。 ( 4) 阴离子: 质子数=核外电子数-离子所带电荷数。 3.熟记常见的 10e-粒子和 18e-粒子
+ 10e-粒子: Ne、 HF、 H2O、 NH3、 CH4、 Na+、 Mg2+、 Al3+、 N������������ 、 H3O+、
+ F-等, N������������ 与 OH-等。
二、核素 1.元素: 具有相同⑧ 2.核素: 具有一定数目⑩ 用符号 3.同位素 概念: 互称为同位素。 相同而 不同的同一种元素的不同 表示。 即⑨ 和一定数目 的同一类原子的总称。 的一种原子。可
特征: ( 1) 具有相同存在形态的同位素, 化学性质几乎完全相同。 ( 2) 天然存在的同一元素各核素所占的原子百分数一般不变。
。
( 3) 电子式着重描述原子构成的物质中最外层电子的成键情况。 如: · ������ ·。
高考化学一轮复习 第5章 物质结构 元素周期律 第16讲 原子结构课件 鲁科版.ppt

解析答案
思维模型
求一定质量的某物质中微粒数的答题模板 物 质 的 质 量 ―÷―摩―尔―质―量―来―自―质―量―数 ―→ 物 质 的 量 ―――×―一―个―分―子―或―离―子―中―含―某―粒―子―个―数――→ 指 定 粒 子 的 物 质 的 量 ―×―N→A 粒子数
考点一 原子构成
1
知识梳理
1.构成原子的微粒及作用
质子Z个——决定元素的种类
原子(AZX原子核中子[A-Z个]
在质子数确定后 决定 原子 种类
同位素
核外电子Z个——最外层电子数决定元素的化学 性质
答案
2.微粒之间的关系 (1)原子中:质子数(Z)=核电荷数= 核外电子。数 (2)质量数(A)=质子数(Z)+ 中子数(N) 。 (3)阳离子的核外电子数=质子数- 阳离。子所带的电荷数 (4)阴离子的核外电子数=质子数+阴。离子所带的电荷数
答案
2
解题探究
1234
题组一 有关微粒组成的概念辨析 1.从宏观方面看物质是由元素组成的,从微观方面看物质是由 粒子构成的。下列有关说法不正确的是( ) A.元素原子的多样性是由构成原子的质子和中子数目引起的 B.元素的化学性质主要取决于元素原子的最外层电子数 C.只由一种分子构成的物质一定是纯净物 D.质子数等于电子数的微粒,可能是一种分子和一种离子
答案
描述原子核的结构。
例:
(2)原子结构示意图着重描述核外电子排布情况。 例:
(3)电子式着重描述原子构成的物质中最外层电子的成键情况。 例:
深度思考
正误判断,正确的划“√”,错误的划“×” (1)34S原子核内中子数为16( × ) (2)2H+核外电子数为2( × ) (3)1H128 O的摩尔质量为20 g·mol-1( √ ) (4)13C和15N核内中子数相差1( √ ) (5)H3O+和OH-中具有相同的质子数和电子数( × ) (6)O22-和S2-具有相同的质子数和电子数( √ )
2020高考化学复习专题之物质结构和元素周期律

物质结构、元素周期律(一)原子结构1.原子(A Z X)中有质子(带正电):Z个,中子(不显电性):(A—Z)个,电子(带负电):Z个。
2.原子中各微粒间的关系:①A=N+Z(A:质量数,N:中子数,Z:质量数)②Z=核电荷数=核外电子数=原子序数③M Z ≈ M N≈1836 M eˉ(质量关系)3.原子中各微粒的作用(1)原子核几乎集中源自的全部质量,但其体积却占整个体积的千亿分之一。
其中质子、中子通过强烈的相互作用集合在一起,使原子核十分“坚固”,在化学反应时不会发生变化。
另外原子核中蕴含着巨大的能量——原子能(即核能)。
(2)质子带一个单位正电荷。
质量为1.6726×10-27kg,相对质量1.007。
质子数决定元素的种类。
(3)中子不带电荷。
质量为1.6748×10-27kg,相对质量1.008。
中子数决定同位素的种类。
(4)电子带1个单位负电荷。
质量很小,约为11836×1.6726×10-27kg。
与原子的化学性质密切相关,特别是最外层电数数及排布决定了原子的化学性质。
4.原子核外电子排布规律(1)能量最低原理:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即依次:K→L→M→N→O→P→Q顺序排列。
(2)各电子层最多容纳电子数为2n2个,即K层2个,L层8个,M层18个,N层32个等。
(3)最外层电子数不超过8个,次外层不超过18个,倒数第三层不超过32个【注意】以上三条规律是相互联系的,不能孤立理解其中某条。
如M层不是最外层时,其电子数最多为18个,当其是最外层时,其中的电子数最多为8个。
(二)元素周期律、元素周期表1.原子序数:人们按电荷数由小到大给元素编号,这种编号叫原子序数。
(原子序数=质子数=核电荷数)2.元素周期律:元素的性质随着原子序数的递增而呈周期性变化,这一规律叫做元素周期律。
具体内容如下:随着原子序数的递增,①原子核外电子层排布的周期性变化:最外层电子数从1→8个的周期性变化。
新编高考化学一轮精选题库【第5章】物质结构、元素周期律(含答案)

新编高考化学备考资料第五章章末检测(时间:100分钟,满分:100分)第Ⅰ卷(选择题,共42分)一、单项选择题(本题包括7个小题,每小题2分,共14分)1.下列有关叙述正确的是( )A.H、D、T具有相同的质子数,是氢元素的三种同位素B.OH-与H3O+组成元素相同,所含质子数相同C.结构示意图为和两种粒子为同一种元素D.元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据2.(2011·杭州调研)元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )A.同周期的主族元素中,ⅦA族元素的原子半径最小B.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素C.室温条件下,0族元素的单质都是气体D.ⅥA元素的原子,其半径越大,越容易得到电子3.某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。
下列有关元素X的说法中,不正确的是( )A.元素X的原子核内质子数为(2a2-1)B.元素X形成的单质既能作氧化剂又能作还原剂C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)D.由元素X形成的某些化合物,可能具有杀菌消毒的作用4.下列叙述正确的是( )A.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1∶2B.离子化合物中一定不含共价键C.某主族元素的最高价含氧酸为H n RO m,则其气态氢化物一般是H2m-n RD.元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等5.下列有关物质结构中的说法正确的是( )A.78 g Na2O2晶体中所含阴、阳离子个数均为2N AB.1.5 g CH+3中含有的电子数为N AC.3.4 g氨气中含有0.6N A个N—H键D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构6.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。
高中化学第16讲 元素周期律和元素周期表(精讲)-2022年一轮复习讲练测(解析版)

第五章物质结构元素周期律第16讲元素周期律和元素周期表(精讲)【考情分析】本讲内容是本章的核心,在高考中占有很重要的地位。
从几种常见的短周期元素出发,考查元素及其化合物的性质、元素在周期表中的位置与性质的关系等知识。
常以选择题、推断题形式出现。
主要考查方式为以元素化合物知识为载体,结合物质的性质、性质的递变规律、定性推断、规律总结与运用等设置相关问题情境,通过图表、文字或相关数据分析等推断同主族、同周期元素性质的递变规律,或以陌生元素在元素周期表中的位置,推断其可能具有的性质等,对考生的化学素养、知识与能力水平进行考查,而联系元素周期律、元素周期表与元素化合物之间的桥梁就是“位—构—性”的三角关系。
【核心素养分析】1.宏观辨识与微观探析:从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念,能从宏观和微观相结合的视角分析元素周期律的递变性。
2.证据推理与模型认知:具有证据意识,基于实验现象和事实对物质的组成、结构及其变化分析得出元素周期律;基于元素周期律理解元素周期表的编排方法,能运用元素周期表揭示元素周期律。
3.科学探究与创新意识:发现和提出有探索价值的原子结构与性质的问题,如核外电子排布、元素的特殊性等,面对异常现象敢于提出自己的见解。
【网络构建】【知识梳理】智能点一元素周期表的结构1.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
2.编排原则(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
3.元素周期表的结构(1)结构元素周期表⎩⎪⎪⎨⎪⎪⎧周期(7个)⎩⎨⎧短周期⎩⎪⎨⎪⎧ 第一、二、三周期元素种数分别为2、8、8种长周期⎩⎪⎨⎪⎧ 第四、五、六、七周期元素种数分别为18、18、32、32(排满时)种族(16个)⎩⎪⎨⎪⎧主族:由短周期和长周期共同构成,共7个副族:完全由长周期元素构成,共7个第Ⅷ族:第8、9、10共3个纵行0族:第18纵行【特别提醒】①碱金属元素位于ⅠA 族,氢元素不属于碱金属元素。
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
2019版高考化学一轮复习第5章物质结构元素周期律第16讲原子结构化学键课件鲁科版

(3)微粒符号周围数字的含义
(4)两种相对原子质量 ①原子(即核素)的相对原子质量 一个原子(即核素)的质量与 12C 质量的112的比值。 ②元素的相对原子质量 是按该元素各种天然同位素原子所占的原子百分比算出的平 均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
2.元素、核素、同位素 (1)元素、核素、同位素的比较
③O2 和 O3 互为同素异形体 ④2428Ti 和5202Ti 的质量数不同,属于两种元素 ⑤实际存在的11H、21H、31H、H+和 H2,是氢的五种核素 ⑥11H2、21H2、31H2 互为同位素 ⑦稀土元素16424Sm 与15620Sm 是同一种核素 A.①⑥ B.②④ C.⑤⑦ D.①③
[练后归纳] 规避同位素、同素异形体概念理解的易错点 同位素研究的对象是原子,同位素的“同位”是指一种元素的 几种核素在元素周期表中占同一个位置,即质子数相同,中子 数不同;同素异形体研究的对象是单质,同素异形体的“同 素”是指元素的种类相同。
题组二 分子或离子中微粒数目关系的判断与计算 4.某元素的一个原子形成的离子可表示为baXn-,下列说法正确 的是( ) A.baXn-含有的中子数为 a+b B.baXn-含有的电子数为 a-n C.X 原子的质量数为 a+b+n D.1 个 X 原子的质量约为6.02×b 1023 g
题组一 概念辨析 1.(2017·长春月考)假如第 117 号元素符号暂时定为 Up,下列 关于211973Up 和211974Up 的说法正确的是( ) A.211973Up 和211974Up 是两种元素 B.211973Up 和121974Up 互为同位素 C.211973Up 和211974Up 质子数不同、中子数相同 D.211973Up 和211974Up 质量数相同、电子数不同
2019版高考化学一轮复习第五章物质结构元素周期律5.1原子结构化学键课件

【思维诊断】 (正确的打“√”,错误的打“×”) (1)质子数相同的微粒一定属于同一种元素。 ( 提示:×。如Ne和H2O质子数都是10。
)
(2)35Cl2与37Cl2互为同位素。 ( ) 提示:×。 35Cl2与37Cl2属于单质。
(3 U和 U是同位素,核反应属于化学变化 238 235 提示:×。核反应不属于化学变化。
2.元素、核素、同位素: (1)“三素”概念的辨析。
质子数
质子
中子
质子 中子
(2)同位素的“六同三不同”。
质子 核电荷
核外电子种重要的核素及其应用。
核素
235 92
U
14 6 __
C
2 1
H
3 1
H
18 8
O
用途 核燃 料
用于考古断 代
氢弹 制_____
示踪原 子
92 92
(
)
(4)18O2和16O2是两种不同的原子 ( 提示:×。18O2和16O2都是氧气分子。
)
(5)13C与C60互为同素异形体。 提示:×。13C是原子,而C60是分子。
(
)
(6)一种单质中可能含有多种核素,如O2中含16O、17O、 18O三种核素 ( ) 提示:√。只要是氧元素的物质,均含16O、17O、18O 三种核素。
1
H18 2O
D16 2O
2.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H组成HmX分子。在a g HmX中所含质子的物质的量是 ( ) A. (A-N+m) mol B. (A-N) mol C. (A-N) mol D. (A-N+m)mol
a Am a A a Am a A
2020年高考化学一轮复习:物质结构、元素周期律
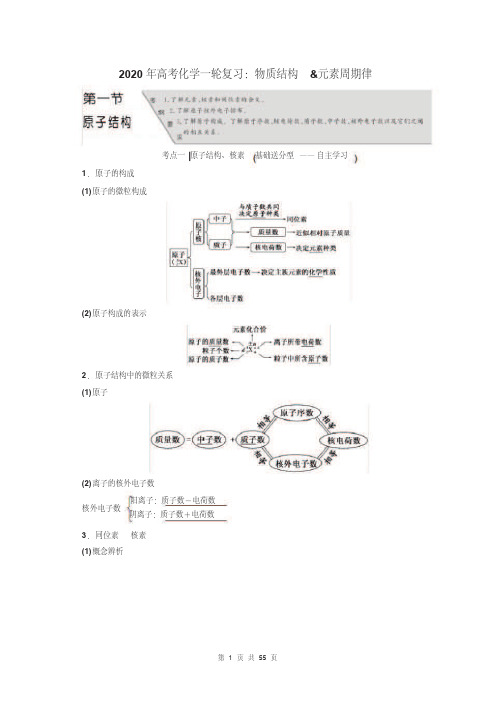
1. 原子的构成 (1) 原子的微粒构成
考点一 |原子结构、核素 基础送分型 —— 自主学习
(2) 原子构成的表示
2. 原子结构中的微粒关系 (1) 原子
(2) 离子的核外电子数 阳离子:质子数-电荷数
核外电子数 阴离子:质子数+电荷数
3. 同位素 核素 (1) 概念辨析
O
的相对分子质量相同
解析: 选 C 同种元素形成的不同单质称为同素异形体。
[探规寻律 ]
“同位素 ” 的特点
(1)在元素周期表中处于同一位置一般使用同一元素符号。但如氕、氘、氚在周期表中都处于
同一位置,氢的同位素一般可用不同的符号来表示,如
11H
、
D(
2 1
解析: 选 D A.元素符号左下角表示的是原子核内的质子数,原子核内的质子数等于该元素
的原子序数,所以该元素的原子序数是
116,正确。 B.在原子符号的左上角表示的是该元素原子的
质量数,质量数就是质子数与中子数的和,所以该原子的中子数是
293- 116= 177,正确。 C. 对于
元素的原子来说,原子核内的质子数等于原子核外的电子数,等于元素的原子序数,所以该原子的
A. 23984Pu
与
238 92
U
的质子数不同,不能互为同位素,错误;
B.23984 Pu
与
239 94
Pu
均是核
第 3 页 共 55 页
素,不是单质,不能互为同素异形体,错误;
C.
238
94Pu
与
238
92 U
的质子数不同,属于不同的元素,不可
能具有完全相同的化学性质,错误;
2020年高考化学知识点详解大全 第四部分 物质结构与元素周期律 第16讲 原子结构与性质

第16讲 原子结构与性质考点1 原子结构1、原子的构成中子N (不带电荷)(核素) 原子核质子Z (带正电荷) → 元素符号原子结构 决定原子呈电中性 电子数(Z 个)体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图2、三个基本关系(1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中)(2)电性关系:①原子中:质子数=核电荷数=核外电子数②阳离子中:质子数>核外电子数 或 质子数=核外电子数+电荷数③阴离子中:质子数<核外电子数 或 质子数=核外电子数-电荷数(3)质量关系:质量数 = 质子数 + 中子数[例1](2020·茂名一模)一定量的锎(98252Cf )是有用的中子源,1mg (98252Cf )每秒约放出2. 34xl99个中子,在医学上常用作治疗恶性肿瘤的中子源。
下列有关锎的说法错误的是( )A.98252Cf 原子中,中子数为154B.98252Cf 原子中,质子数为98C.98252Cf 原子中,电子数为 98D.锎元素的相对原子质量为252[解析]98252Cf 原子核外有98个电子,核内有98个质子,154个中子,质量数为252。
[答案]D[规律总结]抓住公式质量数(A )=质子数(Z )+中子数(N ),可迅速解决原子和离子中质子数和中子数的关系。
考点2 原子核外电子排布规律 决定 X)(A Z[例2](2020·广州二模·理基)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层上只有一个电子,下列说法正确的是()A.X可能是第二周期的非金属元素 B.X可能是第三周期的金属元素C.Y可能与X同主族 D.Y一定是金属元素[解析]根据题意,因“X原子的最外层电子数是次外层电子数的一半”,故X可能为Li 或Si,又“Y位于X的前一周期,且最外层上只有一个电子”,故若X为Li,则Y为H;若X为Si,则Y为Li 。
高三化学总复习练习:第五章 物质结构 元素周期律5-16

5—16[A层基础练]1.(2018·安徽合肥期末)最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS).下列有关14C的叙述正确的是()A.14C与C60中普通碳原子的化学性质不同B.14C与14N含的中子数相同C.14C是C60的同素异形体D.14C与12C互为同位素【解析】14C与C60中普通碳原子,为同种元素的原子,其化学性质相同,A错误;14C的中子数为14-6=8,14N的中子数为14-7=7,B错误;14C是原子,不是单质,与C60不是同素异形体,C 错误;14C与12C的质子数均为6,中子数分别为8、6,二者互为同位素,D正确。
【答案】D2.(2018·长沙模拟)下列属于同位素的一组是()A.O2、O3B.Na2O、Na2O2C.错误!K、错误!Ca D.H、D、T【解析】同位素是具有相同质子数不同中子数的同一元素的不同核素。
同位素是核素不是单质、不是化合物,A选项是单质、B选项是化合物,所以A、B错误;C选项是不同种元素的原子,所以C错误;D选项是同种元素的不同原子,所以D正确。
【答案】D3.(2018·东莞模拟)某元素原子R的原子核外有16个电子,质量数为34,则原子核里的中子数为()A.32 B.20C.16 D.18【解析】某元素原子R的原子核外有16个电子,所以质子数=核外电子数=16,中子数=质量数-质子数=34-16=18。
【答案】D4.YBa2Cu8O x(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于错误!Y的说法不正确的是()A.属于金属元素B.质子数与中子数之差为50C.原子的核外电子数是39D。
错误!Y和错误!Y是两种不同的核素【解析】8939Y的质子数为39,中子数为89-39=50,质子数与中子数之差为11。
【答案】B5.(2018·兰州模拟)下列微粒中,其最外层与最内层的电子数之和等于次外层电子数的是()A.S B.MgC.Cl D.Be【解析】硫原子核外电子排布为:2、8、6,符合最外层与最内层的电子数之和等于次外层电子数,故选A。
高三化学一轮复习 第五章 物质结构 元素周期律本章体系构建课件
基础专题整合
(3)无色 红色 无色:在过氧化钠溶液中滴加酚酞试剂;在密闭 系统中将氨气通入到酚酞稀溶液中,然后再加热。
(4)红色 无色 红色:在密闭系统中将二氧化硫通入到品红溶液 中,然后再加热。
2.紫色变化 (1)紫色 无色:将还原性的气体(如二氧化硫、硫化氢等)通入到高锰 酸钾溶液中;将具有不饱和键的气态烃(如乙烯、乙炔等)通入到高锰酸钾溶 液中;酸性高锰酸钾溶液长期放置;中性高锰酸钾溶液中滴加亚硫酸盐(如 K2SO3 等)。 (2)紫色溶液:苯酚和氯化铁溶液反应生成配合离子而显紫色(检验苯酚 存在的特征反应)。 3.红褐色沉淀:Fe3++3OH- Fe(OH)3↓。 4.红棕色气体:溴蒸气、二氧化氮。
基础专题整合
5.黄色现象
(1)黄色沉淀:AgI、AgBr(较 AgI 的黄色浅)、Ag3PO4、溶液中硫的生成 等。
(2)黄色溶液:FeCl3 溶液、碘水、工业盐酸(含 Fe3+,纯盐酸无色)、浓硝 酸(含 NO2,纯硝酸无色)、硝基苯(含 NO2,纯硝基苯无色)、FeSO4 在空气中 放置、KI 在空气中放置等。
(4)白烟(细小的固体颗粒):①NH3+HCl 2P2O5。
NH4Cl(s);②4P+5O2
基础专题整合
8.苍白色火焰:氢气在氯气中燃烧的火焰颜色(特征反应)。 9.黑色沉淀:Ag2S、PbS、Ag2O(略带棕色)等。 10.蓝色 (1)蓝色溶液:①硫酸铜溶液;②碘和淀粉(特征反应,用于检验碘或淀粉 的存在)等。 (2)蓝色沉淀:氢氧化铜、碱式碳酸铜在溶液中的生成等。 (3)蓝色火焰:一氧化碳在空气中燃烧为蓝色火焰、硫化氢及氢气在空 气中燃烧则为淡蓝色火焰等。 11.绿色溶液:氯化铜溶液、氯化镍溶液等。 12.白色絮状沉淀→灰绿色沉淀→红褐色沉淀:Fe2+→Fe(OH)2(被氧气 氧化)→Fe(OH)3。 13.焰色反应:黄色:钠;紫色:钾(透过蓝色钴玻璃);砖红色:钙;绿色:铜;黄 绿色:钡;紫红色:锂。
2019版高考化学一轮复习第五单元物质结构元素周期律5.1原子结构化学键课件

确定依据 质子数相同
质子数、中子数共同 质子数相同
确定
中子数不同
考点一
考点二
考பைடு நூலகம்三
基础梳理 考点突破
3.四种“质量”的比较
类 别定 义
实例
原子质量
原子的相 对原子质量
某元素的一个原子的真实 质量
一个原子的质量与一个
12
6C
原子质量的 1 的比值
12
根据元素的各种天然同位
一个
16 8
O
原子的质量是
2.657×10-26 kg
A.14C与C60中普通碳原子的化学性质不同 B.14C与14N含的中子数相同
C.14C是C60的同素异形体
关闭
14CD与.14CC与60 中12C普互通为碳同原位子素,为同种元素的原子,其化学性质相同,A
错误;14C 的中子数为 14-6=8,14N 的中子数为 14-7=7,B 错误;14C
是原子,不是单质,与 C60 不是同素异形体,C 错误;14C 与 12C 的质
14 6
C
与
16 8
O;也可能具有相同的质量数,如
14
6C
与
14 7
N;也可能质子数、中子数、质量数均不相同,如
1
1H
与
126C。
(4)同位素:“位”即核素的位置相同,在元素周期表中占同一个位
置。
考点一
考点二
考点三
基础梳理 考点突破
跟踪训练
1.中国计量科学研究所研制的NIM5铯原子喷泉钟,2 000万年误
X
������ ������
±
中各数字的含义
基础梳理 考点突破
-1
高考化学一轮复习第五章物质结构元素周期律第16讲原子结构讲义

第五章 物质结构 元素周期律第16讲 原子结构[考纲要求] 1.了解元素、核素和同位素的含义。
2.了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
考点一 原子的构成及其微粒间的数量关系1.原子的构成原子⎩⎪⎪⎨⎪⎪⎧原子核⎩⎨⎧质子⎩⎪⎨⎪⎧ ①每个质子带一个单位正电荷②相对质量约为1中子⎩⎪⎨⎪⎧ ①中子不带电②相对质量约为1核外电子⎩⎪⎨⎪⎧①围绕原子核做高速运动②每个电子带一个单位负电荷③相对质量为一个质子中子的11 8362.原子结构中的微粒关系(1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.元素符号周围数字的意义4. 同位素、核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
1.判断正误,正确的打“√”,错误的打“×” (1)任何原子都由质子、中子、电子构成。
( ) (2)34S 原子核内中子数为16。
( )(3)12C 、13C 、14C 表示三种不同的元素。
( )(4)质子数为17、中子数为20的氯原子:2017Cl 。
(2015·高考江苏卷,2A)( )(5)H 3O +和OH -中具有相同的质子数和电子数。
( )(6)O 2-2和S 2-具有相同的质子数和电子数。
( )(7)核聚变如21H +31H ―→42He +10n ,因为有新微粒生成,所以该变化是化学变化。
( ) 答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)×2.某元素形成的离子为b a X n -,则: (1)b a X n -含有的中子数为________。
(2)b a X n -含有的电子数为________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解析:29348Pu 与29328U 的质子数不同,不是同位素,A 错误;29348Pu 与29349Pu 互称同位素,最外层电子数相同,因 为不是单质所以不是同素异形体,B 错误、D 正确;29348Pu 与29328U 中电子数不同,最外层电子数也不同,化学性质不 同,C 错误。
答案:D
4.(2016·海口模拟)金属钛对人体体液无毒且有惰性,
(6) 同 种 元 素 的 原 子 均 有 相 同 的 质 子 数 和 中 子 数 。 ()
答案:(1)√ (2)× (3)× (4)× (5)× (6)×
题组一 原子中各种微粒数目之间的相互关系
1.(2016·冀州模拟)中国科学技术名词审定委员会已
确定第 116 号元素 Lv 的名称为鉝。关于211963Lv 的叙述错误
所以
a
g
HmX
中所含质子的物质的量为 a (A-N+ A+m
m)mol。
答案:A
题组二 同位素、核素的概念辨析
3.“玉兔”号月球车用29348Pu 作为热源材料。下列关 于29348Pu 的说法正确的是( )
A.29348Pu 与29328U 互为同位素 B.29348Pu 与29349Pu 互为同素异形体 C.29348Pu 与29328U 具有完全相同的化学性质 D.29348Pu 与29349Pu 具有相同的最外层电子数
解析:A 项二者质量数不同,C 项中子数不同,属于 不同核素,D 项质子数相同,互称同位素。
答案:B
抓住描述对象突破“四同”判断 (1)同位素——同种元素原子,如 11H、21H; (2)同素异形体——非金属单质,如 O2、O3; (3) 同 系 物 —— 有 机 化 合 物 , 如 CH3CH3 、 CH3CH2CH3;
答案:B
4.已知 A、B、C、D 是中学化学中 常见的四种不同粒子,它们之间存在如图 所示的转化关系(反应条件已经略去):
(1)如果 A、B、C、D 均是 10 电子的粒子,请写出 A 的化学式 A______________,A 和 B 反应生成 C、D 的离 子方程式为___________________________________。
题组一 原子核外电子的排布规律及其应用
1.两种元素原子 X 和 Y,X 原子的 M 层比 Y 原子 的 M 层少 3 个电子,Y 原子的 L 层电子数恰好是 X 原子 L 层电子数的两倍,则 X、Y 分别是。( )
A.硅原子和钠原子 B.硼原子和氮原子 C.氮原子和碳原子 D.碳原子和铝原子
解析:由于 Y 原子的 M 层电子比 X 原子的 M 层电 子多 3 个电子,说明 Y 的 M 层电子数至少有 3 个,那么 Y 的 L 层必定有 8 个电子,则 X 的 L 层只有 4 个电子, M 层无电子。由此推出 Y 的核外电子总数为 13,X 的核 外电子总数为 6。所以 X、Y 的核电荷数分别是 6 和 13, 即为碳原子和铝原子。
解析:A 原子的 L 层电子数与 K、M 层电子数之和 相等,所以 A 的核电荷数为 2×8=16,A 为硫元素。D 原子的 K、L 层电子数之和等于电子总数的一半,所以 D 原子的核电荷数是(2+8)×2=20,D 为钙元素。根据核 电荷数依次增大,它们的离子的电子层数相同且最外层电 子数均为 8,可以判断出 B 为氯元素,C 为钾元素。
遍自己写的笔记,既可以起到复习的作用,又可以检查笔记中的遗漏和错误。遗漏之处要补全,错别字要纠正,过于潦草的字要写清楚。同时,将自己 对讲课内容的理解、自己的收获和感想,用自己的话写在笔记本的空白处。这样,可以使笔记变的更加完整、充实。 • 三、课后“静思2分钟”大有学问 • 我们还要注意课后的及时思考。利用课间休息时间,在心中快速把刚才上课时刚讲过的一些关键思路理一遍,把老师讲解的题目从题意到解答整个过 程详细审视一遍,这样,不仅可以加深知识的理解和记忆,还可以轻而易举地掌握一些关键的解题技巧。所以,2分钟的课后静思等于同一学科知识的 课后复习30分钟。
答案:D
2.A、B、C、D 4 种元素的核电荷数依次增大,它 们的离子的电子层数相同且最外层电子数均为 8。A 原子 的 L 层电子数与 K、M 层电子数之和相等,D 原子的 K、 L 层电子数之和等于电子总数的一半。则 4 种元素的元素 符 号 依 次 是 A________ , B________ , C________ , D________。
(1)在氮原子中,质子数为 7 而中子数不一定为 7。 ()
(2)中子数为 20 的氯原子表示为2107Cl。( ) (3)29325U 和29328U 是中子数不同,质子数相同的同种核 素。( ) (4)14C 可用于文物的年代鉴定,14C 与 12C 互为同素 异形体。( )
(5)第ⅠA 族元素铯的两种同位素 137Cs 比 133Cs 多 4 个质子。( )
• 一、释疑难 • 对课堂上老师讲到的内容自己想不通卡壳的问题,应该在课堂上标出来,下课时,在老师还未离开教室的时候,要主动请老师讲解清楚。如果老师已
经离开教室,也可以向同学请教,及时消除疑难问题。做到当堂知识,当堂解决。 • 二、补笔记 • 上课时,如果有些东西没有记下来,不要因为惦记着漏了的笔记而影响记下面的内容,可以在笔记本上留下一定的空间。下课后,再从头到尾阅读一
(4)同分异构体——一般有机化合物,如正戊烷、新 戊烷。
考点二 原子核外电子的排布规律 1.电子层的表示方法及能量变化
由低到高
2.核外电子的排布规律
3.原子结构示意图
原子核
核电荷数
电子层 层内电子数
[易错警示]——判断正误
(1)硫离子的结构示ቤተ መጻሕፍቲ ባይዱ图:
。( )
(2)钾的原子结构示意图为:
。( )
(2)同位素的特征。 ①相同存在形态的同位素,化学性质几乎完全相同, 物理性质不同。 ②天然存在的同一元素各核素所占的原子百分数一 般不变。
(3)常见的重要核素及其应用。
核素 29325U 用途 核燃料
164 C 用于 考古 断代
21H 31H 制氢弹
188 O
示踪 原子
[易错警示]——判断正误
卷Ⅰ:T12 卷Ⅱ:T9
2014
—
考点一 原子结构 1.原子的构成
2.等量关系
(1)质量数(A)=质子数(Z)+中子数(N) (2)原子:质子数=原子序数=核电荷数=核外电子 数 (3)阳离子:质子数=核外电子数+电荷数 (4)阴离子:质子数=核外电子数—电荷数
3.同位素 核素 (1)概念辨析。
2019/7/20
最新中小学教学课件
thank
you!
2019/7/20
最新中小学教学课件
能与肌肉和骨骼生长在一起,有“生物金属”之称。下 列有关2428Ti 和5202Ti 的说法中正确的是( )
A.4282Ti 和5202Ti 的质量数相同,互称为同位素 B.4282Ti 和5202Ti 的质子数相同,互称为同位素 C.4282Ti 和5202Ti 的质子数相同,是同一种核素 D.4282Ti 和5202Ti 核外电子数相同,中子数不同,不能互 称为同位素
(2)如果 A、C 均是 18e-粒子,B、D 均是 10e-粒子, 写出 C 的电子式______________。
答
案
:
(1)NH
+
4
(
或
HF)
NH
+
4
+
OH
-
===NH3
↑
+
H2O(或 HF+OH-===F-+H2O)
编后语
• 常常可见到这样的同学,他们在下课前几分钟就开始看表、收拾课本文具,下课铃一响,就迫不及待地“逃离”教室。实际上,每节课刚下课时的几分 钟是我们对上课内容查漏补缺的好时机。善于学习的同学往往懂得抓好课后的“黄金两分钟”。那么,课后的“黄金时间”可以用来做什么呢?
的是( )
A.原子序数 116
B.中子数 177
C.核外电子数 116 D.相对原子质量 293
解析:A 项,元素符号左下角表示的是原子核内的质 子数,原子核内的质子数等于该元素的原子序数,所以该 元素的原子序数是 116,正确。B 项,在原子符号的左上 角表示的是该元素原子的质量数,质量数就是质子数与中 子数的和,所以该原子的中子数是 293-116=177,正确。 C 项,对于元素的原子来说,
个中子,它与 1H 原子组成 HmX 分子,在 a g HmX 中所 含质子的物质的量是( )
A.A+a m(A-N+m)mol B.Aa(A-N)mol
C.A+a m(A-N)mol
D.Aa (A-N+m)mol
解析:X 原子的质子数为(A-N),一个 HmX 中所含的
质子数为(A-N+m),HmX 的摩尔质量为(A+m)g·mol-1,
原子核内的质子数等于原子核外的电子数,等于元素 的原子序数,所以该原子的原子核外电子数是 116,正确。 D 项,293 只表示该元素的一种原子的质量数,由于不知 道该元素有几种原子,各种原子的含量是多少,因此不能 确定该元素的相对原子质量,错误。
答案:D
2.某元素的一种同位素 X 的原子质量数为 A,含 N
(3)原子核外 M 层电子数是 L 层电子数的一半的元素
是硅。( )
(4)原子核最外层电子数为 2 的短周期元素仅有 Be 和
Mg。( )
(5)最外层电子数是次外层电子数 3 倍的元素是氧。 ()
(6)内层电子总数是最外层电子数 2 倍的短周期元素 是磷。( )
答案:(1)× (2)× (3)√ (4)× (5)√ (6)×
第五章 物质结构 元素 周期律
第 16 讲 原子结构 原子 核外电子排布
新课标考纲展示
1.了解元素、核素和同位素的含 义。 2.了解原子的构成。了解原子序 数、核电荷数、质子数、中子数、 核外电子数以及它们之间的相互 关系。 3.了解原子核外电子排布规律。
