无菌检验原始记录
消毒监测表面微生物检验原始记录
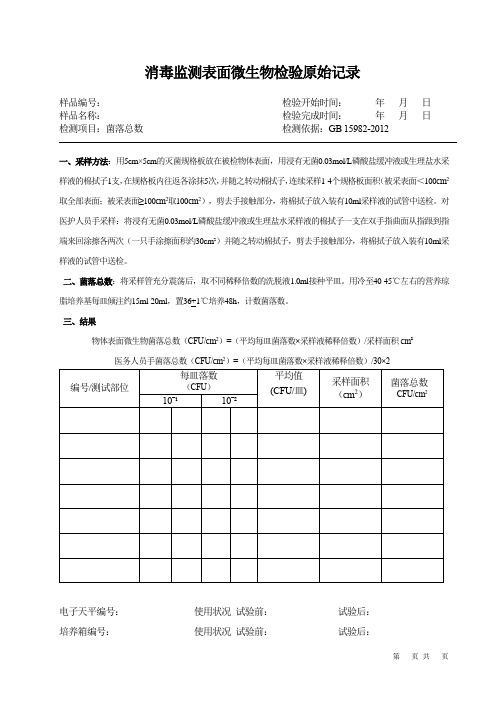
消毒监测表面微生物检验原始记录
样品编号:检验开始时间:年月日
样品名称:检验完成时间:年月日
检测项目:菌落总数检测依据:GB 15982-2012
一、采样方法:用5cm×5cm的灭菌规格板放在被检物体表面,用浸有无菌0.03mol/L磷酸盐缓冲液或生理盐水采样液的棉拭子1支,在规格板内往返各涂抹5次,并随之转动棉拭子,连续采样1-4个规格板面积(被采表面<100cm2取全部表面;被采表面≥100cm2取100cm2),剪去手接触部分,将棉拭子放入装有10ml采样液的试管中送检。
对医护人员手采样:将浸有无菌0.03mol/L磷酸盐缓冲液或生理盐水采样液的棉拭子一支在双手指曲面从指跟到指端来回涂擦各两次(一只手涂擦面积约30cm²)并随之转动棉拭子,剪去手接触部分,将棉拭子放入装有10ml采样液的试管中送检。
二、菌落总数:将采样管充分震荡后,取不同稀释倍数的洗脱液1.0ml接种平皿。
用冷至40-45℃左右的营养琼脂培养基每皿倾注约15ml-20ml,置36+1℃培养48h,计数菌落数。
三、结果
物体表面微生物菌落总数(CFU/cm2)=(平均每皿菌落数×采样液稀释倍数)/采样面积cm²医务人员手菌落总数(CFU/cm2)=(平均每皿菌落数×采样液稀释倍数)/30×2
电子天平编号:使用状况试验前:试验后:
培养箱编号:使用状况试验前:试验后:
检测人:校核人:审核人:。
《无菌检验原始记录》
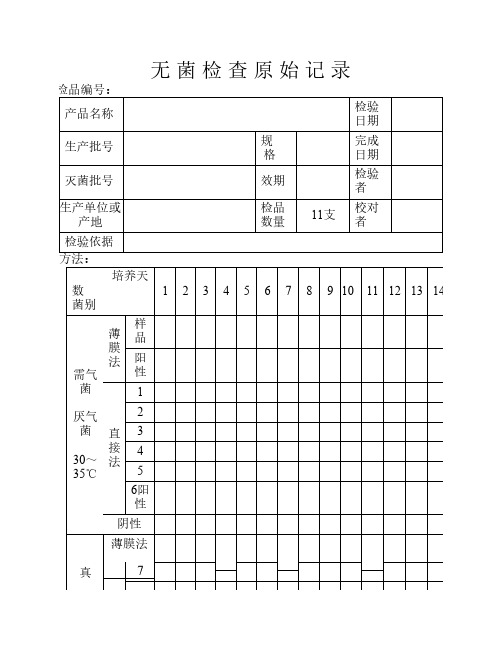
培养天
数
菌别
1234567891011121314
需气菌
厌气菌
30~35℃薄
膜
法
样
品
阳
性
直
接
法
1
2
3
4
5
6阳
性阴性
真薄膜法
7
无菌检查原始记录
检品编号:
产品名称检验日期
生产批号规
格
完成
日期
灭菌批号效期检验者
生产单位或
产地检品
数量
11支
校对
者
检验依据方法:
菌 23~28℃
直接法8 9 10 11
阴性
培养基: 硫乙醇酸盐流体培养基 配制批号:
改良马丁培养基 配制批号:
稀释液、冲洗液:□ 0.1%蛋白胨水溶液 □ PH7.0氯化钠-蛋白胨缓冲液 □ 0.9%无菌氯化钠溶液
配制批号:
对照菌:
取上述对照菌新鲜培养物1ml ,用9ml0.9%无菌氯化钠溶液10倍系列稀
释,取稀释液1ml 作为对照用菌液。
第 代培养物,稀释级别 计数结果
CFU/ml
设备编号: 隔水式恒温培养箱: 霉菌培养箱: 集菌仪:
无菌室菌落培养(30~35℃)
碟号时间123(应≤1CFU/平板)24小时菌落
数 结果:
符合 □
不符合 □
48小时菌落
数 平均菌落数
检验结果
无菌检查结果判断:□符合规定□不符合规定。
无菌检验原始记录
3.供试品:细菌检测管;将5个供试品在无菌操作环境下,每个包装用50-100ml无菌0.9%生理盐水分别冲洗样品的内壁和外表,收集冲洗液于无菌容器中,用放有无菌过滤膜的无油真空泵过滤抽取冲洗液,然后将过滤膜取出接种置硫乙醇酸盐流体培养基。
5.阴性对照管:空白硫乙醇酸盐流体培养基和改良马丁培养基。
6.将接种好后硫乙醇酸盐流体培养基置30~35℃,改良马丁马丁培养基置23~28℃,培养14天观察结果。
结果记录
培养基灵敏度:
空白对照
无菌检查:
日期
供试管
阳性对照管
阴性对照管
备注:
成品检验报告:
结论:
(盖章)
检验人:复核人:
无菌检验原始记录
样品名称
样品批号
检验数量
样品数量
检验日期
灭菌批号
检验项目
无菌
方法(薄膜过滤法)
1.培养基的制备:硫乙醇酸盐流体培养基、改良马丁培养基完全溶解后置于高压蒸汽锅121℃,30min灭菌。将灭菌后培养基做灵敏度检查。
2.培养基的灵敏度检查:硫乙醇酸盐流体培养基;将生孢梭菌、枯草芽孢杆菌各2支接种置硫乙醇酸盐流体培养基同时做空白对照1支,置30~35℃培养3天,观察结果。
真菌检测管;将5个供试品在无菌操作环境下,每个包装用50-100ml无菌0.9%生理盐水分别冲洗样品的内壁和外表,收集冲洗液于无菌容器中,用放有无菌过滤膜的无油真空泵过滤抽取冲洗液,然后将过滤膜取出接种置改良马丁培养基。
4.阳性对照管:在阳性间的无菌操作环境下,将对应的阳性菌5个接种置硫乙醇酸盐流体培养基和改良马丁培养基。
无菌检查原始记录019
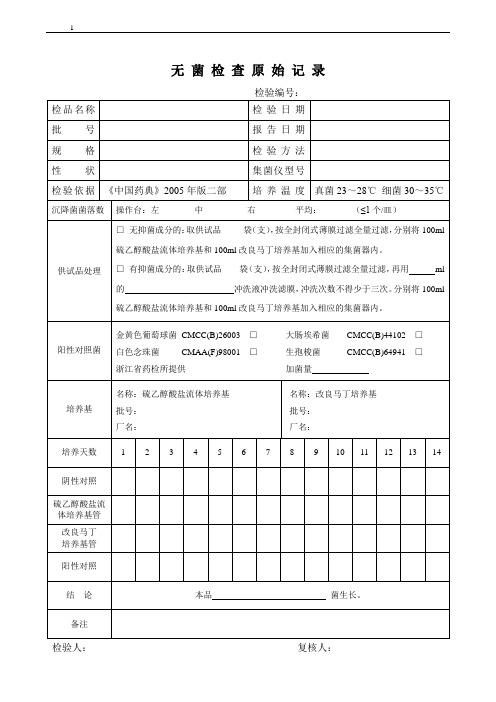
生孢梭菌CMCC(B)64941□
加菌量
培养基
名称:硫乙醇酸盐流体培养基
批号:
厂名:
名称:改良马丁培养基
批号:
厂名:
培养天数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
阴性对照
硫乙醇酸盐流体培养基管
改良马丁
培养基管
阳性对照
结论
本品菌生长。
备注
检验人:复核人:
无菌检查原始记录
检验编号:
检品名称
检验日期
批号
报告日期
规格
检验方法
性状
集菌仪型号
检验依据
《中国药典》2005年版二部
培养温度
真菌23~28℃细菌30~35℃
沉降菌菌落数
操作台:左_____中_____右_____平均:_____(≤1个/皿)
供试品处理
□无抑菌成分的:取供试品_____袋(支),按全封闭式薄膜过滤全量过滤,分别将100ml硫乙醇酸盐流体培养基和100ml改良马丁培养基加入相应的集菌器内。
□有抑菌成分的:取供试品____袋(支),按全封闭式薄膜过滤全量过滤,再用ml的冲洗液冲洗滤膜,冲洗次数不得少于三次。分别将100ml硫乙醇酸盐流体培养基和100ml改良马丁培养基加入相应的集菌器内。
阳性对照菌
金黄色葡萄球菌CMCC001□
浙江省药检所提供
无菌检验记录

4.取真菌培养基管,其中1管接种白色念珠菌液ml,另1管加ml0.9%无菌氯化钠溶液 Nhomakorabea空白对照。
5.轻轻摇动,使供试品与培养基混合。需气菌、厌气菌培养基管置30-35℃培养、真菌培养基管置20-25℃培养,培养14天。
培养基预培养:
需气菌、厌气菌培养基:月日时至月日时
日期:
备注
“+”表示长菌,“-”表示不长菌,“±”表示可疑长菌。
检验人:复核人:
霉菌培养基:月日时至月日时
洁净台菌
落数
培养皿号
1#
2#
3#
48h菌落数
平均菌落数
检验结果
培养基名称
需气菌、厌气菌培养基
霉菌培养基
培养温度
30~35℃
20~25℃
管号
金黄色葡萄球菌
1
2
3
4
阴性
对照
白色念珠菌
1
2
阴性
对照
检
验
结
果
1天
2天
3天
4天
5天
6天
7天
8天
9天
10天
11天
12天
13天
14天
检验结论
供试品管均澄清,或虽显浑浊但经确认无菌生长,判定供试品符合规定;若供试品管中任何一管显浑浊并确认有菌生长,判供试品不符合规定,除非能充分证明实验结果无效,即生长的微生物非供试品所含。
xxxx有限公司
xxxxx无菌检验记录
试样名称
规格型号
生产批号
灭菌批号
检验依据
检验日期
供试液制备
取6套xxxxx在无菌条件下分别注入9.0ml 0.9%无菌氯化钠溶液,振摇数次,将所得溶液混合均匀制得共试品。
《无菌检验原始记录》

《无菌检验原始记录》
日期:YYYY年MM月DD日
实验目的:通过进行无菌检验,检测样品是否受到外源性微生物污染。
实验材料:
1.无菌培养基
2.无菌试管
3.无菌匀液棒
4.无菌平板
5.微生物荧光灯
6.净化工作台
实验步骤:
1.将样品取出,在净化工作台上进行操作。
2.取一支无菌试管,将培养基倒入试管中约1/4满。
3. 用无菌匀液棒沾取样品约0.1ml,并迅速划线于无菌培养基上。
4.取另一支无菌试管,使用同样的方法将培养基倒入试管中,作为对
照组。
5.将培养基涂布在无菌平板上,旋转均匀。
6.将培养基固化后,将平板放置于微生物荧光灯下观察,并记录菌落
的出现情况。
7.对照组同样进行观察,用于比对差异结果。
实验结果:
对照组观察结果:未观察到任何菌落的生长。
样品观察结果:观察到部分菌落的生长。
实验分析与讨论:
根据实验结果,对照组未观察到任何菌落的生长,说明实验的无菌操作得到了有效执行。
而样品中观察到了部分菌落的生长,表明样品中存在微生物的外源性污染。
实验结论:
根据实验结果,样品中观察到了部分菌落的生长,表明样品受到了外源性微生物污染。
为了确保样品的质量和安全性,在进一步的研究中,需要采取相应措施降低污染源,并加强无菌操作的执行。
无菌检查记录

无菌检查记录一、背景介绍无菌检查是医疗机构中重要的质量控制措施之一,用于确保手术和其他无菌操作过程中的器械、设备和环境的无菌状态。
本文将详细介绍无菌检查记录的标准格式及其内容要求。
二、无菌检查记录标准格式无菌检查记录应按照以下标准格式进行填写:1. 日期:记录无菌检查的日期,格式为年-月-日。
2. 检查人员:填写进行无菌检查的人员姓名。
3. 检查项目:列出进行无菌检查的项目,如手术器械、手术室环境等。
4. 检查结果:填写无菌检查的结果,包括阳性或者阴性。
5. 检查方法:说明无菌检查所采用的方法和标准,如菌落计数法、生物指示器法等。
6. 备注:可填写对无菌检查结果的补充说明或者其他相关信息。
三、无菌检查记录内容要求无菌检查记录应包含以下内容:1. 日期:记录无菌检查的具体日期,以便追溯和核对。
2. 检查人员:填写进行无菌检查的人员姓名,以确保责任明确。
3. 检查项目:列出进行无菌检查的具体项目,如手术器械、手术室环境等,以便确定检查范围。
4. 检查结果:准确记录无菌检查的结果,包括阳性或者阴性。
阳性表示有细菌或者其他微生物存在,阴性表示无细菌或者其他微生物存在。
5. 检查方法:清晰说明无菌检查所采用的方法和标准,以确保检查的科学性和准确性。
例如,菌落计数法可用于检查空气中的微生物数量,生物指示器法可用于检查灭菌器的灭菌效果。
6. 备注:可填写对无菌检查结果的补充说明或者其他相关信息,如异常情况的处理措施等。
四、示例日期:2022年1月5日检查人员:张三检查项目:手术器械检查结果:阴性检查方法:使用菌落计数法进行检查,按照标准程序进行操作,结果显示无细菌生长。
备注:手术器械经过正确的清洗和灭菌程序,无菌检查结果符合要求。
日期:2022年1月5日检查人员:李四检查项目:手术室环境检查结果:阳性检查方法:使用生物指示器法进行检查,按照标准程序进行操作,结果显示有细菌生长。
备注:手术室环境存在细菌污染,需要进行进一步的清洁和消毒操作。
无菌检验、观察记录
阳性对照试验情况
菌种1
菌种名称:金黄色葡萄球菌(26003)
菌种批号:培养温度:30~35℃培养时间:72h
菌种2
菌种名称:白色念珠菌(98001)
菌种批号:培养温度:20~25℃培养时间:72h
检验者:
检验日期:
复核者:
无菌检查原始记录
2.无菌检验观察记录
培养
时间(天)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
供试品
FTM
TSB
阴性对照
FTM
TSB
阳性对照
FTM
/
TSB
/
观 察 者
无菌检验观察情况:“-”表示阴性;“+”表示阳性
检验结果:
┄┄┄┄┄┄ 以下空白 ┄┄┄┄┄┄
检 验 者:复 核 者:
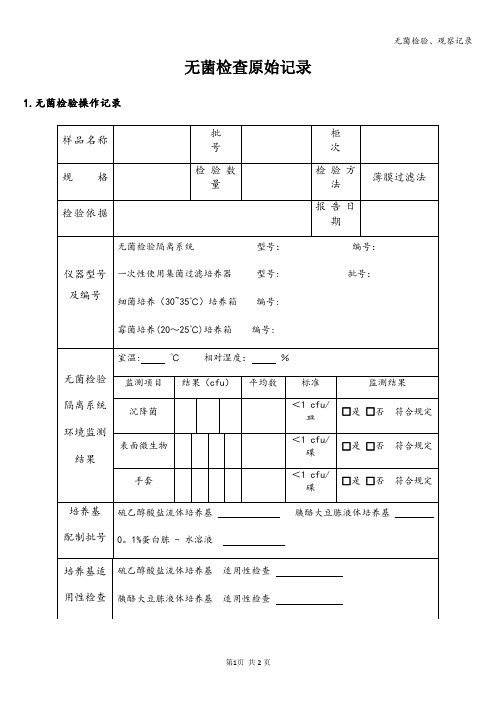
检验日期:复核日期:监测来自目结果(cfu)平均数
标准
监测结果
沉降菌
<1 cfu/皿
□是□否符合规定
表面微生物
<1 cfu/碟
□是□否符合规定
手套
<1 cfu/碟
□是□否符合规定
培养基
配制批号
硫乙醇酸盐流体培养基胰酪大豆胨液体培养基
0。1%蛋白胨 - 水溶液
培养基适用性检查
硫乙醇酸盐流体培养基 适用性检查
胰酪大豆胨液体培养基 适用性检查
供试品的无菌检查:取支(瓶),□直接过滤□加入适量0。1%蛋白胨—水溶液的无菌容器中,混匀,立即过滤。1个集菌器加入100ml硫乙醇酸盐流体培养基(以下简称FTM)另1个集菌器加入100ml胰酪大豆胨液体培养基(以下简称TSB)。将上述接种供试品后的培养基容器分别按各培养基规定的温度培养14天。
商业无菌检验原始记录

对照样品
待检样品A
待检样品B
2
进行标记和记录;
温度(℃)
3
观察外包装;
时间(天)
4
保温前称重;
原始重量(g)
5
每个批次取一个样于2-5℃冰箱保存;
培养后重量(g)
6
其余样品在36±1℃下保温10天;
□有泄漏□无泄漏
7
保温后称重;
微生物染色镜检(显微镜视野内微生物数量)
8
对比保温前后重量看是否有气体泄漏;
食品商业无菌检验原始记录表
样品名称
样品编号
检验项目
商业无菌
检验日期
检验地点
□BSL-2实验室□洁净ຫໍສະໝຸດ 验室检验依据判定依据
检验仪器
□生化培养箱□均质器□pH计
□生物安全柜□超净台□显微镜
□冰 箱□电子天平□冰 箱
检验试剂
含4%碘的乙醇溶液、结晶紫染色液、二甲苯、无菌生理盐水等。
检验程序
商业无菌检验
1
准备样品;
9
开启并留样;
10
进行感官检查;
□微生物有显著增殖 □微生物无显著增殖
11
测定pH,取冰箱内样品测pH对照;
pH
测
定
第一次测定
12
涂片染色镜检;
第二次测定
13
分析记录;
算术平均值
14
报告。
□pH有显著差异□pH无显著差异
待检样品感官检查
温度(℃)
相对湿度(%RH)
结果
报告
检验员:审核员:
商业无菌检验原始记录表

商业无菌检验原始记录表
: 第*天)
保温时间: 至
ห้องสมุดไป่ตู้
报告日期: 年 月 日
重量测定(克)
pH值测定
保温 保温
感官检查 涂片镜检 接种培养
10 保温前 保温后 |△M| 前 后 |△pH|
品测试2次,取平均值填写记录。 常则说明。
检测:
日期:
年月日
密封性检 验
结果判定
备注
商业无菌检验
序号
检测日期: 样品名称
年月日
样品编号 1
保温温度: 样品保温期间检查记录(第*天)
23 45 6 7 8 9
备注: 1、检测依据GB4789.26-2013
2、保温前的PH值以同时取样的另1罐样品测定值为准。PH值同一个样品测试2次,取平均值填 3、样品保温期间检查记录、感官检查、涂片镜检:√表示正常,若异常则说明。 4、结果判定:√表示符合商业无菌,×表示不符合商业无菌 复核:
无菌检查记录

无菌检查记录一、任务背景无菌检查是医疗机构中非常重要的环节,用于确保手术器械和手术环境的无菌状态,以减少手术感染的风险。
本文将详细介绍无菌检查记录的标准格式和内容要求。
二、无菌检查记录的标准格式无菌检查记录应按照以下标准格式进行填写:1. 检查日期:记录无菌检查的日期,格式为年-月-日。
2. 检查人员:记录进行无菌检查的人员姓名或者工号。
3. 检查项目:列出进行无菌检查的项目,如手术器械、手术包、手术台等。
4. 检查结果:记录无菌检查的结果,包括合格和不合格两种情况。
5. 不合格原因:如果检查结果为不合格,需详细说明不合格的原因。
可以包括器械残留物、包装破损、污染等。
6. 处理措施:针对不合格的情况,记录采取的处理措施,如更换器械、更换包装等。
7. 处理人员:记录进行处理的人员姓名或者工号。
三、无菌检查记录的内容要求无菌检查记录应包含以下内容:1. 检查日期:准确记录无菌检查的日期,以便后续追溯和查询。
2. 检查人员:记录进行无菌检查的人员,确保检查人员的资质和经验。
3. 检查项目:明确列出进行无菌检查的项目,包括手术器械、手术包、手术台等。
4. 检查结果:准确记录无菌检查的结果,标明合格或者不合格。
5. 不合格原因:如果检查结果为不合格,需详细说明不合格的原因,以便进行后续处理和改进。
6. 处理措施:记录针对不合格情况所采取的处理措施,确保问题得到及时解决。
7. 处理人员:记录进行处理的人员,确保责任的明确和追溯。
四、示例检查日期:2022-01-01检查人员:张三检查项目:手术器械检查结果:合格不合格原因:无处理措施:无处理人员:无检查日期:2022-01-02检查人员:李四检查项目:手术包检查结果:不合格不合格原因:包装破损处理措施:更换包装处理人员:王五检查日期:2022-01-03检查人员:张三检查项目:手术台检查结果:合格不合格原因:无处理措施:无处理人员:无以上是一些示例的无菌检查记录,仅供参考。
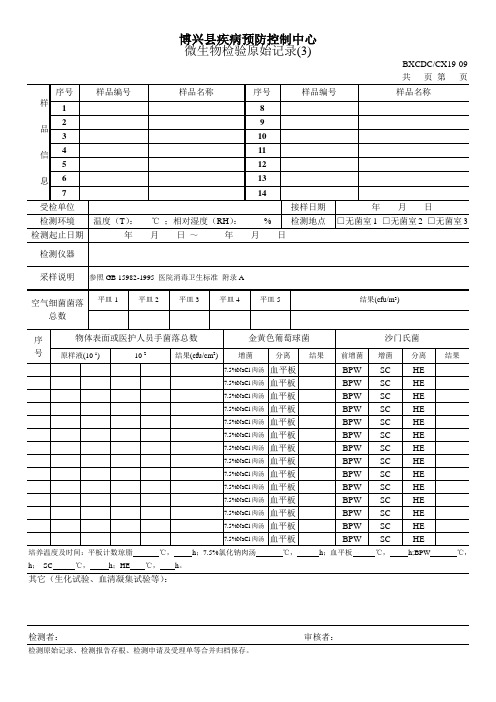
微生物检验原始记录(医院消毒)
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
采样说明
参照GB 15982-1995医院消毒卫生标准附录A
空气细菌菌落总数
平皿1
平皿2
平皿3
平皿4
平皿5
结果(cfu/m3)
序
号
物体表面或医护人员手菌落总数
金黄色葡萄球菌
沙门氏菌
原样液(10-1)
10-2
结果(cfu/cm2)
增菌
分离
结果
前增菌
增菌
分离
结果
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
其它(生化试验、血清凝集试验等):
检测者:审核者:Байду номын сангаас
检测原始记录、检测报告存根、检测申请及受理单等合并归档保存。
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
《无菌检验原始记录》资料

无菌检验原始记录资料1. 引言本文档为《无菌检验原始记录》资料的详细记录和分析。
无菌检验是指在无菌条件下对物品进行检验,以确定其中是否存在细菌或其他微生物的方法。
本次无菌检验涉及的物品包括药品、医疗器械、食品等。
本文档将提供检验过程的详细记录,并分析结果以评估物品的无菌性能。
2. 检验对象及目的2.1 检验对象本次无菌检验的对象为医疗器械A。
2.2 检验目的检验医疗器械A是否符合无菌要求,以评估其无菌性能。
3. 检验方法3.1 前期准备•清洁工作台:使用消毒剂对工作台进行彻底清洁,并进行适当灭菌处理。
•检验器具:收集所需的各种无菌器具,如培养皿、无菌填料等。
•培养基:准备适当的培养基。
3.2 检验步骤1.将医疗器械A放置在清洁工作台上,检查其外部是否有明显污染。
2.使用消毒液对医疗器械A进行清洁,消毒时间为10分钟。
3.将清洁后的医疗器械A放入无菌培养皿中。
4.将培养皿密封并标记,以便后续分析。
5.将培养皿放入适当的培养基中,培养时间为24小时。
6.培养结束后,观察培养皿中是否有细菌生长。
7.根据细菌生长情况,评估医疗器械A的无菌性能。
4. 实验结果经过24小时的培养,观察到培养皿中无任何细菌生长。
因此,医疗器械A符合无菌要求,具有较好的无菌性能。
5. 结论和建议根据本次无菌检验的结果,可以得出以下结论和建议:1.医疗器械A通过了无菌检验,满足无菌要求。
2.建议继续保持对医疗器械A的无菌条件管理,并进行定期检验,以确保其无菌性能。
6. 参考文献1.无菌检验技术规范,国家药典委员会、中国食品与药品监督管理局。
2.WHO《无菌技术指南》。
本文档详细记录了《无菌检验原始记录》的实验步骤、检验结果以及结论和建议。
通过本次检验,我们可以对医疗器械A的无菌性能进行初步评估,并提出后续管理建议,以确保其安全使用。
微生物检验原始记录范本

2.大肠杆菌
接种2~3个稀释度各2的平皿,每皿1ml检样或稀释样,注入46℃平板计数琼脂约15ml,凝固,℃培养h(时分~时分)。
选择接种3个稀释度
10
x
1
x
0.1x
0.01x
0.001x
稀释度
10-
10-
所选稀释度平均值
空白对照
稀释液对照
乳糖胆盐发酵管经36℃h
(时 分~时分)后产气管数
菌落数
转 种 在 伊 红 美 蓝 琼 脂 平 板上36℃h,革兰氏蓝色发酵管经36℃h(时分~时 分)后产气管数
计算 方法
所选稀释度的平均菌落数( )X稀释倍数( )=
根据证实为大肠菌群阳性的管数,查大肠菌群(MPN)检索表,MPN值为=
ห้องสมุดไป่ตู้3.霉菌和酵母计数
选择接种3个稀释度,平行接种2个平皿,每皿1ml检样或稀释样;注入46℃孟加拉红琼脂约15ml,凝固,26℃培养=d( / :~/ : );空白对照菌数灭菌水对照菌数=
样品处理:1.□以无菌操作将检样25注入225ml灭菌□磷酸盐缓冲液或□生理盐水或□蒸馏水中均质或混匀,□用灭菌吸管吸取检样1ml注入9ml灭菌稀释液中充分振摇,做成1:10的均匀稀释样;2. □用灭菌吸管吸取1:10稀释样1ml注入9ml灭菌稀释液中,混匀做成1:100稀释样;3. □同样方法做成10倍递增稀释样。
稀释度
10-
10-
所选稀释度平均值
□霉菌菌落数
计算方法
所选稀释度平均菌落数()X稀释倍数( )=
□霉菌菌落数
计算方法
所选稀释度平均菌落数()X稀释倍数( )=
检验菌落总数大肠菌群霉菌 酵母
结果:cfu/MPN/100计数cfu/计数cfu/
食品生产经营企业商业无菌检验原始记录式样
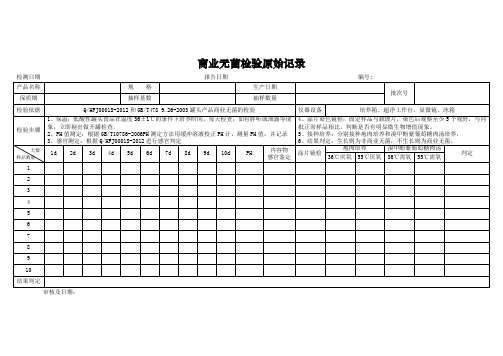
检测日期
报告日期
编号:
产品名称
规 格
生产日期
批次号
保质期
抽样基数
抽样数量
检验依据
Q/HFJ0001S-2012和GB/T478 9.26-2003罐头产品商业无菌的检验
仪器设备
培养箱、超净工作台、显微镜、冰箱
检验步骤
1、保温:低酸性罐头食品在温度36±1℃的条件下培养时间,每天检查,如有胖听或泄露等现象,立即剔出做开罐检查。
2、PH值测定:根据GB/T10786-2006PH测定方法用缓冲溶液校正PH计,测量PH值,并记录
3、感官测定:根据Q/HFJ0001S-2012进行感官判定
4、涂片染色镜检:固定样品与载玻片,染色后观察至少5个视野,与同批正常样品相比,判断是否有明显微生物增值现象。
5、接种培养:分别接种疱肉培养和溴甲酚紫葡萄糖肉汤培养,
6、结果判定:生长则为非商业无菌,不生长则为商业无菌。
天数
样品数量
1d
2d
3d
4d
5d
6d容物
感官鉴定
涂片镜检
疱肉培养
溴甲酚紫葡萄糖肉汤
判定
36℃厌氧
55℃厌氧
36℃需氧
55℃需氧
1
2
3
4
5
6
7
8
9
10
结果判定
检验人员: 核验人员:
审核及日期:
注射液的无菌检查原始记录.

注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:洁净室动态测定∑= CFU/皿(规定100级∑≤1 CFU/皿)符合规定室温℃相对湿度 %细菌培养箱:真菌培养箱:压力蒸汽灭菌器:培养基名称:硫乙醇酸盐流体培养基(1)硫乙醇酸盐流体培养基(2)改良马丁培养基阳性对照菌:金黄色葡萄球菌 [CMCC(B)26 003] 生孢梭菌 [CMCC(B)64 941] 白色念珠菌[CMCC(F)98 001] 大肠埃希菌 [CMCC(B)44 102]注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:基本信息【药品名称】通用名称:头孢呋肟商品名称:西力欣、明可欣、达力新英文名称:汉语拼音:xilixin【成份】头孢呋辛酯化学名称为:(6R,7R)-7-[2-呋喃基(甲氧亚氨基)乙酰氨基]-3-氨基甲酰氧甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,1-乙酰氧基乙酯【性状】本品为白色胶囊形薄膜衣片。
【作用类别】【规格】 250mg/片 125mg/片适应症头孢呋辛酯适用于敏感细菌造成的感染的治疗。
- 下呼吸道感染:如急性支气管炎及慢性支气管炎急性发作和肺炎。
- 上呼吸道感染:包括耳、鼻、咽喉感染,如中耳炎、鼻窦炎、扁桃体炎及咽炎。
- 生殖泌尿道感染:如肾盂肾炎,膀胱炎和尿道炎。
- 皮肤及软组织感染:如疖病,脓皮病和脓疱病。
治疗成人和12岁以上儿童的早期莱姆病,以及其后对晚期莱姆病的预防。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
真菌检测管;将5个供试品在无菌操作环境下,每个包装用50-100ml无菌0.9%生理盐水分别冲洗样品的内壁和外表,收集冲洗液于无菌容器中,用放有无菌过滤膜的无油真空泵过滤抽取冲洗液,然后将过滤膜取出接种置改良马丁培养基。
4.阳性对照管:在阳性间的无菌操作环境下,将对应的阳性菌5个接种置硫乙醇酸盐流体培养基和改良马丁培养基。
同时做空白对照1支,置30~35℃培养3天,观察结果。
改良马丁培养基:将白色念株菌和黑曲霉各2支接种置改良马丁培养基,同时做空白对照1支,置23~28℃培养5天,观察结果。
3.供试品:细菌检测管;将5个供试品在无菌操作环境下,每个包装用50-100ml无菌0.9%生理盐水分别冲洗样品的内壁和外表,收集冲洗液于无菌容器中,用放有无菌过滤膜的无油真空泵过滤抽取冲洗液,然后将过滤膜取出接种置硫乙醇酸盐流体培养基。
5.阴性对照管:空白硫乙醇酸盐流体培养基和改良马丁培养基。
6.将接种好后硫乙醇酸盐流体培养基置30~35℃,改良马丁马丁培养基置23~28℃,培养14天观察结果
结果记录
培养基灵敏度:
日期
硫乙醇酸盐流体培养基
改良马丁培养基
空白对照
无菌检查:
日期
供试管
阳性对照管
阴性对照管
备注
成品检验报告:
结论 (盖 章)
xxxxxxxx有限公司编号:QR824-57
无菌检验原始记录
NO. :
样品名称
样品批号
检验数量
样品数量
检验日期
灭菌批号
检验项目
无菌
方法(薄膜过滤法)
1.培养基的制备:硫乙醇酸盐流体培养基、改良马丁培养基完全溶解后置于高压蒸汽锅121℃,30min灭菌。将灭菌后培养基做灵敏度检查。
2.培养基的灵敏度检查:硫乙醇酸盐流体培养基;将生பைடு நூலகம்梭菌、枯草芽孢杆菌各2支接种置硫乙醇酸盐流体培养基
