siRNA细胞转染实验操作指南
siRNA说明书

siRNA说明书产品以冻⼲粉的形式,常温运输。
收到产品后,请于-20 C?-80 'C保存,冻⼲粉可以稳定保存⼀年。
使⽤前请瞬时离⼼,⽤RNase-freeH 2O或者灭菌ddH20,配制成20gM储存液,分装保存,避免反复冻融(尽量不超过5次)。
表120 gM储存液的配置参考使⽤前须知为避免外界因素(包括酶,极端pH或者温度条件等)导致产品降解,所有操作请严格遵循RNA操作规则。
实验过程中,产品最好于冰上放置,使⽤完毕后请于-20 C~-80 C⼩⼼保存。
细胞实验⽅法为了降低细胞密度、试剂⽤量,转染效率等因素导致的孔间差异,保证实验可靠性和可重复性,⼀般建议:a. 转染实验中每个转染样品⾄少设置3个以上复孔;b. 接种细胞时,每孔接种的细胞数量尽量保持⼀致,并且细胞在各孔的表⾯平均分布。
1. 转染浓度:siRNA产品最佳⼯作浓度因不同的细胞类型及研究⽬的⽽异。
推荐初始转染浓度为50nM,转染后检测时间为24?72h。
最佳转染效率⼀般通过设置时间曲线和浓度梯度进⾏优化,优化的范围建议为5~100nM。
2. 转染步骤:以Iipofectamine2000(简称Iipo2000)转染siRNA于24孔板,转染浓度为50nM为例,其他规格容器转染请参考表2。
1)转染前⼀天,接种适当数量的细胞⾄细胞培养板中,每孔中加⼊不含抗⽣素的培养基,使转染时的细胞密度能够达到30~50%(不同细胞⽣长速度不⼀样,因此,接种细胞的数量需要根据细胞培养的经验)。
注意: 转染时,细胞密度是影响转染效率的关键因素之⼀,细胞⽣长过度会削弱细胞活⼒,降低细胞的转染效率。
2)对于每个转染样品,请按以下步骤准备siRNA-Iipo2000混合液:a. 稀释siRNA :⽤50 g 不含⾎清培养基Opti-MEM I (v1)稀释g I20 gM siRNA储存液,轻轻混匀,室温孵育5min ;b. 稀释Iipo2000 :⽤50 g不含⾎清培养基Opti-MEM I (v1)稀释1 g Ilipo2000,轻轻混匀并室温孵育5min ;c. 将a与b轻轻混匀,室温孵育20min(溶液可能会有浑浊,但不会影响转染)。
细胞sirna转染操作流程

细胞sirna转染操作流程细胞siRNA转染操作流程一、引言细胞siRNA转染是一种常用的基因沉默技术,通过引入特异性小干扰RNA(siRNA)分子进入细胞内,靶向沉默特定基因,从而研究该基因的功能和调控机制。
本文将介绍细胞siRNA转染的操作流程。
二、准备工作1. 获得目标基因的siRNA序列。
2. 确定需要转染的细胞类型。
3. 准备细胞培养所需的培养基和细胞培养器具。
三、细胞处理1. 将需要转染的细胞分散在培养基中,使细胞密度达到适宜的浓度。
2. 将细胞悬液均匀地分配到培养皿或培养板中。
3. 放置细胞在恒温培养箱中,使其在37摄氏度、5% CO2的条件下培养。
四、siRNA转染1. 将合成的siRNA溶解在无菌去离子水中,得到一定浓度的siRNA 溶液。
2. 向siRNA溶液中加入相应的转染试剂,如Lipofectamine 2000。
注意按照厂家提供的操作步骤和比例进行加入。
3. 轻轻混合siRNA溶液和转染试剂,静置15-30分钟,使其形成siRNA转染复合物。
4. 将转染复合物滴加到细胞培养皿或培养板中,轻轻摇晃培养皿或培养板,使转染复合物均匀分布。
5. 放置细胞在恒温培养箱中继续培养。
五、培养细胞1. 继续在37摄氏度、5% CO2的条件下培养细胞,观察细胞的形态变化。
2. 根据实验需要,可以在转染后一定时间点进行进一步的实验操作,如蛋白质检测、基因表达分析等。
六、细胞收集1. 根据实验需要,可以在转染后一定时间点收集细胞。
2. 用PBS缓冲液洗涤细胞,去除培养基和转染试剂。
3. 用细胞裂解缓冲液裂解细胞,得到细胞裂解液。
七、实验分析根据实验需要,可以对细胞裂解液进行进一步的实验分析,如Western blot、RT-qPCR等。
八、结果分析根据实验结果,可以分析目标基因的表达水平和功能,从而深入研究其调控机制。
九、总结细胞siRNA转染是一种重要的基因沉默技术,可以帮助研究者深入了解基因的功能和调控机制。
siRNA 使用说明

siRNA 使用说明siRNA 使用说明一、简介siRNA(small interfering RNA,小干扰RNA)是一种短双链RNA分子,能够特异性地靶向靶标基因的mRNA,从而抑制基因的表达。
本文档旨在提供有关siRNA的使用说明,包括实验准备、转染方法、验证转染效果等内容。
二、实验准备1、设计siRNA序列:根据目标基因序列,使用专业软件设计siRNA序列,确保合适的靶向位点和抑制效果。
2、合成siRNA:选取可靠的siRNA合成公司,按照其提供的合成方案进行合成,并确保纯度和浓度的准确性。
3、存储siRNA:将合成好的siRNA按照要求进行冻干或溶解保存,避免反复冻融对siRNA的影响。
三、细胞培养1、细胞系选择:选择适合的细胞系进行实验,一般常用的细胞系有HEK-293、HeLa、CHO等。
2、培养条件:按照细胞系的要求,配置好适合的培养基,并添加适当的血清和抗生素。
3、培养状态:维持细胞在良好的状态下生长,保持培养皿内细胞的完整和无菌。
四、siRNA转染1、转染试剂选择:根据不同细胞系的特点,选择适合的转染试剂,如RNMAX、Lipofectamine等。
2、转染条件优化:通过实验室预实验,优化转染试剂的用量、培养时间和上清液收集时间等参数。
3、转染操作步骤:a:将siRNA转染试剂溶解于无血清的培养基中,按照转染试剂说明书的推荐比例进行稀释。
b:将稀释后的转染试剂静置15-30分钟,直至形成转染试剂- siRNA复合物。
c:将复合物滴加到细胞培养皿中,保持培养皿在37°C的培养箱中进行适当的培养时间。
d:收集转染后的上清液,进行进一步的实验。
五、转染效果验证1、Real-time PCR:使用逆转录酶和合适的引物进行实时荧光定量PCR,检测目标基因表达水平的变化。
2、Western blot:通过Western blot实验检测目标蛋白的表达水平是否下调。
3、免疫荧光染色:利用免疫荧光染色技术观察目标蛋白在细胞中的表达情况。
细胞sirna转染操作流程

细胞sirna转染操作流程细胞siRNA转染是一种常见的实验操作,用于沉默特定基因的表达。
下面我将从多个角度全面地介绍细胞siRNA转染的操作流程。
1. 实验准备:a. 准备所需的细胞培养基、细胞培养皿、siRNA转染试剂(如Lipofectamine™ RNAiMAX等)、siRNA、目的基因的控制siRNA、PBS等。
b. 在转染前,需要将细胞培养至适当的密度,确保细胞处于良好的生长状态。
2. siRNA转染操作流程:a. 将需要转染的细胞计数并分配至培养皿中,使得在转染时细胞密度达到合适的水平。
b. 在一个离心管中混合适量的siRNA转染试剂和无血清培养基,轻轻振荡混合,并静置15分钟。
c. 将siRNA转染试剂混合物滴加到含有细胞的培养皿中,轻轻摇晃培养皿使转染试剂均匀分布。
d. 将细胞培养皿放回培养箱中,根据试剂的要求进行培养,通常在转染后的24-72小时内进行下一步实验。
3. 转染后处理:a. 根据实验需求,在转染后的适当时间点进行细胞的取样或者其他实验操作。
b. 如果需要进行长期实验或者观察,可以在转染后适当时间内更换培养基。
c. 对于不同的细胞系和siRNA转染试剂,最佳的转染条件可能会有所不同,因此需要根据实验要求进行优化。
总的来说,细胞siRNA转染是一个常用的实验技术,通过沉默特定基因的表达,可以帮助研究人员探索基因功能和细胞信号通路。
在进行操作时,需要严格按照试剂的说明书和实验要求进行操作,并且根据具体情况进行优化,以确保实验结果的准确性和可靠性。
希望这些信息能够帮助到你。
用LIPO3000向细胞中转染siRNA

用LIPO3000向PK-15细胞中转染siRNA
以24孔板为例。
1 转染前一天细胞消化计数,之后细胞在0.5 ml不含双抗的完全培养基中正常生长。
2 细胞的密度为30%-50%适宜。
(注意:根据转染后细胞检测时间的长短决定细胞密度,如果转然后需要很长时间去检测,则细胞密度适当降低,以避免细胞过度生长导致存活性降低。
)
3 第二天(24到36小时)每孔转染方式如下:
A 将20 pmol siRNA溶于150 微升Opti-MEM无血清培养基中。
B 将1 微升lipo2000溶于150 微升Opti-MEM无血清培养基中,混匀室温放置
5 min。
C 将A、B混合放置5 min。
4 转染期间,将24孔板中的培养基换成无血清培养基,每孔400 微升。
将C管Mix加入到每孔中,6小时后换成有血清培养基。
细胞sirna转染操作流程

细胞sirna转染操作流程细胞siRNA转染操作流程一、引言近年来,细胞siRNA转染技术在生物医学领域中得到了广泛的应用。
该技术通过靶向靶标基因的mRNA,使用小干扰RNA (siRNA) 来沉默特定基因的表达,从而研究基因功能及其在疾病中的作用。
本文旨在介绍细胞siRNA转染的操作流程。
二、实验材料和设备1. 细胞培养基:含有适当的营养物质和补充物的培养基。
2. 细胞培养器具:细胞培养板、离心管、培养皿等。
3. siRNA转染试剂:包括转染试剂和转染缓冲液。
4. 离心机5. 显微镜6. 实验室安全设备:如实验室无菌操作台、手套、护目镜等。
三、细胞处理1. 培养细胞:将所要研究的细胞株在适宜的培养条件下培养至合适的生长状态。
2. 细胞传代:当细胞达到足够密度时,使用适当的方法将细胞传代到新的培养皿中,以保持细胞的生长状态。
四、siRNA转染操作1. 转染试剂配制:按照转染试剂说明书的要求,将转染试剂稀释至适宜的浓度。
2. 转染试剂与siRNA混合:将所需转染试剂与合适浓度的siRNA混合,使其充分结合。
3. 细胞转染:将混合好的转染试剂和siRNA溶液滴加到培养皿中的细胞上。
4. 转染时间:根据实验需要,确定转染时间,并在转染后的适当时间点进行下一步实验操作。
5. 细胞处理:根据实验目的,对转染后的细胞进行相应的处理,如培养、药物处理等。
6. 细胞观察:使用显微镜观察转染细胞的形态变化、细胞数量等。
五、结果分析1. 蛋白检测:使用Western blot或免疫荧光技术检测转染后的细胞中目标蛋白的表达情况。
2. mRNA检测:使用RT-PCR或原位杂交等技术检测转染后的细胞中目标基因的mRNA水平。
3. 细胞功能分析:根据实验需要,进行细胞增殖、凋亡、迁移等功能分析实验。
六、讨论与展望细胞siRNA转染技术是一种有效的基因沉默方法,可以用于研究基因功能和疾病机制。
然而,该技术仍面临一些挑战,如选择合适的siRNA序列、提高转染效率等。
sirna转染实验步骤及实验要点

sirna转染实验步骤及实验要点siRNA转染实验步骤如下:1.细胞接种:提前一天将细胞种植在24孔板中,以转染时细胞汇合度在30%左右为宜,转染前全培养基总量为0.45ml。
2.转染过程:•取0.67μg (50pmol) 的siRNA,加入一定量无血清稀释液,充分混匀,制成RNA稀释液,终体积为25μl。
注意:无血清稀释液建议采用OPTI-MEM、无血清DMEM或1640。
•取1μl的EntransterTM-R4000,然后加入24μl无血清稀释液体,充分混匀,制成EntransterTM-R4000稀释液,终体积为25μl。
室温静置5分钟。
•将EntransterTM-R4000稀释液和RNA稀释液充分混合(可用振荡器振荡或用加样器吹吸10次以上)混合,室温静置15分钟。
转染复合物制备完成。
•将50μl转染复合物滴加到有0.45ml全培养基(可含10%血清和抗生素)的细胞上,前后移动培养皿,混合均匀。
注意:对本试剂,采用含血清的全培养基有助于提升转染效率。
•转染后6小时观察细胞状态,如状态良好可不必更换培养基,继续培养24-96小时得到结果。
3.观察和检测:根据具体实验需求,可以在转染后的不同时间点观察细胞状态、检测基因表达、蛋白质表达等。
实验要点:1.细胞接种密度要适宜,一般在30%左右汇合度较好。
2.无血清稀释液的选择对于siRNA的稳定性和转染效率至关重要。
建议采用OPTI-MEM、无血清DMEM或1640等品牌。
3.在制备转染复合物时,要保证各个步骤的混合均匀,避免产生气泡。
4.在将转染复合物加入细胞时,要保证细胞的生存环境,避免对细胞造成损伤。
5.在转染后的观察和检测中,要注意保证实验结果的准确性和可靠性。
以上信息仅供参考,建议查阅专业文献获取更准确的信息。
siRNA细胞培养步骤

悬浮细胞的siRNA转染操作步骤悬浮细胞的siRNA转染操作步骤,以24孔板siRNA转染为例方法/步骤1. 11.提前1天细胞种植采用对数生长期的悬浮细胞,数量为常规培养细胞数的1/3进行转染实验。
如某细胞常规培养的细胞数是6×105,那么就用2×105的细胞进行转染。
END方法/步骤21. 12.转染过程⑴取0.67ug(50pmol)的siRNA,加入一定量无血清稀释液,充分混匀,制成RNA稀释液,终体积为25μl。
注意:无血清稀释液建议采用OPTI-MEM、无血清DMEM或1640。
2. 2⑵取1ul的EntransterTM-R4000,然后加入24ul无血清稀释液体,充分混匀,制成EntransterTM-R4000稀释液,终体积为25μl。
室温静置5分钟。
3. 3⑶将EntransterTM-R4000稀释液和RNA稀释液充分混合(可用振荡器振荡或用加样器吹吸10次以上)混合,室温静置15分钟。
转染复合物制备完成。
4. 4⑷将50μl转染复合物滴加到有0.45ml全培养基(可含10%血清和抗生素)的细胞上,前后移动培养皿,混合均匀。
5. 5⑸转染后6小时观察细胞状态,如状态良好可不必更换培养基,继续培养24-96小时得到结果。
END注意事项∙siRNA转染后,继续培养24-72小时在mRNA水平得到结果,继续培养24-96小时在蛋白水平得到结果。
mRNA转染后,根据需要在24小时后得到结果。
∙在部分实验室,由于血清和培养条件等差异,转染后镜下培养基中可能出现少量黑点状沉淀,为转染试剂和血清中蛋白结合产物,不影响转染结果和细胞状态,可通过换液除去。
jetPRIME转染siRNA说明书

JetPRIME转染试剂转染siRNA简易说明书
第0天:细胞接种
第一天:转染
在有血清存在的情况下转染,
使用JetPRIME缓冲液
以6孔板为例
在1.5mL或0.5mL的EP管中加入200 ^L勺JetPRIME缓冲液,然后加入20卩M(1.1卩L)的siRNA,旋涡10s后离心(或者用移液器吹打5次混匀);
加入4^L的JetPRIME试剂,旋涡10s后离心(或者用移液器吹打5次混匀);
室温孵育10mi n;
将转染复合物加入到要转染的含血清的培养基中;
必要时,转染后4h更换细胞培养基;
孵育24-48h,检测转染效率。
注:siRNA enhancer 的应用:
在转染复合物加入到所需转染的细胞中后,加入培养基体积的1/1000体积的siRNA
en ha ncer其他步骤与以前一致;
在6h或4h更换培养基时,也需要加入相应体积的siRNA enhancer(培养基体积的1/1000)。
jetPRIME 转染siRNA说明书
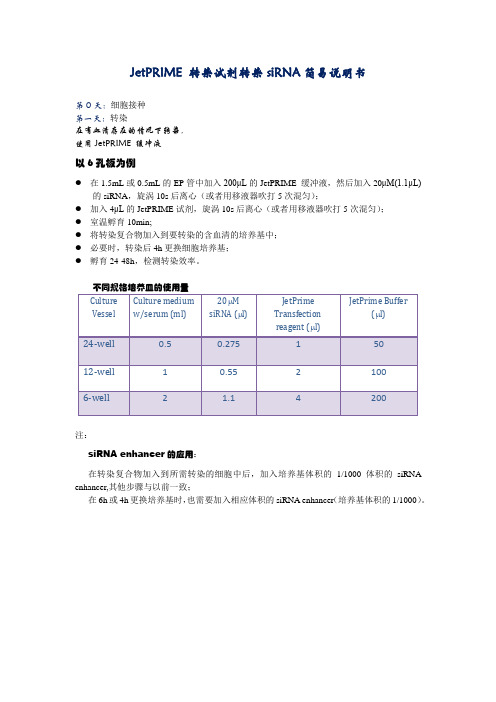
JetPRIME 转染试剂转染siRNA简易说明书
第0天:细胞接种
第一天:转染
在有血清存在的情况下转染,
使用JetPRIME缓冲液
以6孔板为例
●在1.5mL或0.5mL的EP管中加入200μL的JetPRIME 缓冲液,然后加入20μM(1.1μL)
的siRNA,旋涡10s后离心(或者用移液器吹打5次混匀);
●加入4μL的JetPRIME试剂,旋涡10s后离心(或者用移液器吹打5次混匀);
●室温孵育10min;
●将转染复合物加入到要转染的含血清的培养基中;
●必要时,转染后4h更换细胞培养基;
●孵育24-48h,检测转染效率。
不同规格培养皿的使用量
注:
siRNA enhancer的应用:
在转染复合物加入到所需转染的细胞中后,加入培养基体积的1/1000体积的siRNA enhancer,其他步骤与以前一致;
在6h或4h更换培养基时,也需要加入相应体积的siRNA enhancer(培养基体积的1/1000)。
siRNA转染方案

siRNA转染方案-向六孔板的每个孔种植2 x 10^5个细胞,每孔加入2ml不含抗生素的培养基注意:这个方案是针对六孔板中的一个孔,根据孔或皿的大小决定细胞和试剂的量。
-在含有CO2的37° C孵箱中培养细胞至60-80%融合。
这大概需要18—24小时。
注意:健康和不完全融合的细胞对于成功转染试验是必要的。
建议转染前一天要确保细胞存活。
-准备以下溶液:溶液A:每次转染,稀释2-8 μl siRNA duplex(例如0.25-1μg 或20-80pmol siRNA)至100 μl siRNA 转染基sc-36868溶液B:每次转染,稀释2-8 μl siRNA转染试剂sc-29528至100 μl siRNA转染基sc-36868。
6 μl siRNA 转染试剂可达高峰反应注意:不要向siRNA转染基sc-36868内添加血清和抗生素注意:最佳siRNA转染使用量对于不同目标蛋白是不同的,需通过实验来决定注意:如果需要低浓度siRNA,可用siRNA稀释缓冲液sc-29527稀释注意:尽管siRNA 转染试剂sc-29528对很多细胞系都是高效的,但可能不适用于所有细胞-直接将溶液A加入溶液B,然后用吸管上下轻柔吹打,室温下孵育15-45分钟-用2ml siRNA转染基sc-36868清洗细胞一次,吸出转染基立即进入下一步骤-每次转染,向溶液A和溶液B混合液中加入0.8ml转染基。
轻柔混合后用混合液覆盖冲洗过的细胞-将细胞放在含CO2的37℃孵箱孵育5-7小时注意:有些细胞可能需要长时转染。
然而长时血清饥饿可能会导致细胞分离或凋亡。
注意:结合了荧光素的对照siRNA只能在含CO2的37℃孵箱孵育5-7小时,孵育结束后利用荧光显微镜检测-加入1ml两倍血清浓度和抗生素浓度的正常培养基(2x正常培养基),不要移除转染混合液。
如果有细胞毒性,移除转染混合液,用1x正常培养基替代-将这些细胞再孵育18-24小时-吸出培养基,用新鲜1x正常培养基取代-加入新鲜培养基24-72小时后利用合适的方案检测细胞注意:在siRNA试验中应该设立对照。
siRNA 使用说明

siRNA 使用说明siRNA 使用说明1.介绍siRNA(小干扰RNA)是一种能够特异性沉默靶基因表达的双链RNA分子。
本文档旨在提供关于siRNA的详细使用说明,包括实验前准备、实验步骤和数据分析等内容。
2.实验前准备2.1 选择siRNA:选择适合的siRNA靶向靶基因。
可以通过文献研究或生物信息学预测来确定siRNA的序列。
2.2 siRNA合成与纯化:合成和纯化siRNA应该由可靠的供应商进行。
确保合成的siRNA纯度高且无附加污染物。
2.3 细胞培养:选用适当的细胞系,并且按照常规细胞培养方法将其培养在适宜的培养基中。
3.实验步骤3.1 载体转染:将siRNA与特定的转染试剂混合,并按照转染试剂的说明书将其转染入细胞中。
注意控制组设置。
3.2 RNA干扰效率检测:根据靶基因的表达情况选择适当的方法检测siRNA的干扰效果,如定量PCR或Western blot等。
3.3 功能检测:根据实验需要,选择适当的功能检测方法,如细胞增殖、凋亡、迁移或侵袭等。
4.数据分析4.1 干扰效果分析:对实验结果进行统计学分析,比较siRNA处理组和对照组之间的差异,并计算干扰效果的百分比。
4.2 功能检测结果分析:对功能检测结果进行统计学分析,比较siRNA处理组和对照组之间的差异,并进一步解释其生物学意义。
5.附件本文档涉及的附件包括实验记录表、数据分析表和相应的图表。
请在需要时参考附加的文件。
6.法律名词及注释6.1 siRNA:小干扰RNA,一种双链RNA分子,用于特异性沉默靶基因表达。
6.2 RNA干扰:通过siRNA分子的特异性结合和降解,抑制靶基因的转录和翻译过程。
6.3 转染:将外源DNA或RNA导入靶细胞以实现外源基因的表达或干扰基因的沉默。
6.4 培养基:一种用于细胞培养的含有营养物质和生长因子的液体或固体培养基质。
7.结束语感谢您阅读本siRNA使用说明,希望本文档能帮助您顺利进行siRNA实验。
细胞sirna转染操作流程

细胞sirna转染操作流程细胞siRNA转染操作流程一、引言细胞siRNA转染是一种常用的实验技术,用于研究基因功能和调控机制。
siRNA是一种短小的RNA分子,可以通过特定的转染方法送入细胞内,从而实现对特定基因的沉默。
本文将详细介绍细胞siRNA转染的操作流程。
二、实验前的准备1. 准备所需材料:包括细胞培养基、细胞培养器具、siRNA转染试剂、转染缓冲液等。
2. 培养细胞:将目标细胞培养至对数生长期,并确保细胞状态良好。
三、细胞siRNA转染操作流程1. 细胞处理a. 将细胞分装至培养皿中,使其达到适当的细胞密度。
b. 按照转染试剂的说明书,制备合适的转染混合液。
2. 转染操作a. 将转染混合液缓慢滴加至培养皿中,使其均匀分布在细胞上。
b. 轻轻摇晃培养皿,使转染混合液与细胞充分接触。
c. 将培养皿放回培养箱中,继续培养。
3. 转染后的处理a. 根据实验设计,确定转染后的时间点。
b. 在规定的时间点,进行下一步实验操作,如蛋白质表达分析、细胞功能研究等。
四、结果分析与讨论根据实验设计和细胞siRNA转染的目的,对实验结果进行分析和讨论。
可以通过Western blot、实时荧光定量PCR等技术手段来验证基因沉默效果,并进一步研究其对细胞功能的影响。
五、实验注意事项1. 选择适当的转染试剂和转染缓冲液,确保转染效率和细胞存活率。
2. 控制转染试剂的用量,避免过度转染导致细胞毒性。
3. 严格按照实验设计和操作流程进行实验,减少操作误差。
4. 注意实验室安全,遵守相关实验操作规范。
六、结论细胞siRNA转染是一种重要的实验技术,可以用于研究基因功能和调控机制。
通过合理的实验设计和操作流程,可以实现对特定基因的沉默,并进一步研究其对细胞功能的影响。
希望本文介绍的细胞siRNA转染操作流程能对相关研究工作者提供参考和指导。
siRNA转染 Protocol

siRNA转染实验是一种常用的基因沉默技术,其基本原理是通过将小干扰RNA(siRNA)引入细胞,从而在翻译水平上抑制特定基因的表达。
以下是siRNA转染的实验原理、所需试剂和耗材、实验仪器、准备工作、实验方法、注意事项、常见问题及解决方法。
一、实验原理siRNA是一种21-23个核苷酸长的双链RNA,它与靶基因的mRNA 序列互补,通过碱基配对原则与mRNA结合,抑制基因表达。
siRNA 转染实验是通过将siRNA转入细胞内,利用细胞内自然存在的RNA 干扰机制,在转录后水平抑制基因表达。
这种技术具有高效性、特异性和可逆性等特点,被广泛应用于基因功能研究、药物筛选和疾病治疗等领域。
二、所需试剂和耗材1.试剂:o siRNA:针对特定基因的siRNA分子。
o转染试剂:如Lipofectamine、JetPrime等,用于将siRNA转入细胞。
o培养基:如DMEM、F12等,用于细胞培养。
o血清:如胎牛血清,提供细胞生长所需的营养物质。
o抗生素:如青霉素、链霉素等,用于防止细胞污染。
2.耗材:o细胞培养瓶、板:用于细胞培养。
o离心管:用于离心和分离细胞。
o移液器及枪头:用于精确加样。
o过滤器:用于过滤溶液中的杂质。
o无菌水:用于稀释和配制溶液。
三、实验仪器1.实验室搅拌器:用于混合溶液。
2.高速冷冻离心机:用于离心和分离细胞。
3.水浴锅:用于加热溶液。
4.无菌工作台或超净工作台:用于进行无菌操作。
5.分光光度计:用于测量细胞生长状况和转染效率。
6.荧光显微镜:用于观察细胞转染后荧光蛋白的表达情况。
7.CO2培养箱:提供细胞培养所需的气体环境。
8.显微镜:观察细胞的生长状态和siRNA转染后的细胞变化。
9.细胞计数板或细胞计数仪:用于细胞计数,确定细胞的密度和生长状态。
10.酶标仪或多功能读板仪:用于检测细胞因子的浓度。
四、实验准备工作1.确认细胞系和siRNA:实验前要明确所使用的细胞系以及针对的目标基因。
SiRNA转染protocol

siRNA转染SOP1.细胞种板:24孔板中以5x105 细胞/孔密度进行接种(6孔板或96孔板接种密度进行相应调整),接种孔数根据具体实验方案进行确定,接种后置于37℃,5%CO2培养箱中培养12h-16h;2.细胞生长融合度达85-90%后即可准备进行siRNA转染,实验每组设置3个复孔,siRNA以Nuclease-Free Water稀释至储存液浓度(浓度按照说明书指示,通常为20 μM);3.根据siRNA终浓度进行溶液配制(以下溶液配制以50 nM为siRNA最终浓度,24孔板中终液体体积为500 μl为例),溶液1配制:每孔1.25 μl siRNA储存液以无血清无双抗培养基稀释至25 μl,按此比例依照孔数进行扩大,将最终液体进行充分混匀;溶液2配制:每孔2 μl Lipo 2000转染试剂(可用其他替代,用量参照说明书推荐或自行优化)以无血清无双抗培养基稀释到25 μl,按此比例依照孔数进行扩大,将最终液体进行充分混匀;上述2种溶液混匀后分别室温静置5 min;4.将溶液1滴加至溶液2中并进行充分混合(每孔为50 μl),室温静置20-30 min;5.此期间可将细胞从培养箱中取出,弃去培养基,用PBS进行清洗3次,末次清洗干净后将所有液体小心吸出,尽量不要有残留;6.静置完成后,将上述混合液滴加进去24孔板中,每孔50 μl,注意滴加不要过快,以防冲起细胞,滴加完成后每孔加入450 μl无血清无双抗培养基,充分混匀,将板放入37℃,5%CO2培养箱中培养6 h;7.6 h后取出24孔板,弃去培养基,加入预热的含10%FBS的无双抗培养基1 ml,37℃,5%CO2培养箱中培养;8.24-48 h后弃去培养基,每孔以100 μl胰酶进行冲洗后弃去胰酶,放入培养箱中进行消化,具体时间以具体细胞为准,消化完全后加入500 μl 完全培养基终止消化并充分将细胞吹起吹匀,将细胞液吸至1.5 ml离心管中并做好标记,再向孔内加入500 μl培养基进行充分吹打,确认细胞完全洗下后将其吸至离心管中;9.常温6000 rpm离心5min,充分弃去上清,尽量吸干,将细胞沉淀置于-80℃冰箱备后续实验使用。
siRNA 使用说明(两篇)

引言概述:siRNA(小干扰RNA)是一种小分子RNA片段,具有靶向特异性和高效沉默靶基因的能力。
本文将详细介绍siRNA的使用说明,主要包括siRNA的设计、转染方法、转染效率的评估、靶基因沉默效果的验证以及操作注意事项。
通过本文的阐述,用户能够更好地了解和掌握siRNA的使用方法,从而实现对目标基因表达的特异沉默。
正文内容:一、siRNA的设计1.确定靶基因:首先需要明确自己要沉默的目标基因,可以通过文献调研、数据库查询等方式确定目标基因。
2.设计siRNA序列:根据目标基因的序列信息,可以使用在线工具或者软件进行siRNA序列的设计。
siRNA的设计需要满足一定的规则,如目标序列的选择、GC含量、二次结构等方面的考虑。
二、siRNA的转染方法1.载体选择:siRNA可以通过多种载体转染到细胞内,如质粒转染、病毒载体转染等。
根据实验需要和细胞特性,选择适合的转染载体。
2.转染试剂:根据实验需要,选择适合的转染试剂,如化学转染试剂、电穿孔法等。
3.转染条件优化:对于每个细胞系和siRNA,转染条件需要进行优化,包括转染试剂浓度、转染时间、细胞密度等。
三、siRNA转染效率的评估1.转染效率的检测:可以通过荧光探针标记siRNA,利用荧光显微镜观察转染效率。
2.实时荧光定量PCR:通过检测靶基因mRNA的降解情况,来评估siRNA的沉默效果。
3.Westernblot:通过检测靶基因蛋白的表达水平,来评估siRNA的沉默效果。
四、靶基因沉默效果的验证1.实时荧光定量PCR:通过检测靶基因mRNA的降解情况,可以验证siRNA的沉默效果。
2.Westernblot:通过检测靶基因蛋白的表达水平,来验证siRNA的沉默效果。
3.功能实验:通过观察细胞的表型变化、增殖能力的变化等方面,来验证siRNA的沉默效果。
五、操作注意事项1.siRNA的保存:应在20°C下保存,避免反复冻融。
2.转染前的细胞处理:细胞的状态和密度对转染效率有影响,应注意细胞的处理方法和细胞密度的选择。
用LIPO3000向细胞中转染siRNA

用LIPO3000向PK-15细胞中转染siRNA
以24孔板为例。
1 转染前一天细胞消化计数,之后细胞在0.5 ml不含双抗的完全培养基中正常生长。
2 细胞的密度为30%-50%适宜。
(注意:根据转染后细胞检测时间的长短决定细胞密度,如果转然后需要很长时间去检测,则细胞密度适当降低,以避免细胞过度生长导致存活性降低。
)
3 第二天(24到36小时)每孔转染方式如下:
A 将20 pmol siRNA溶于150 微升Opti-MEM无血清培养基中。
B 将1 微升lipo2000溶于150 微升Opti-MEM无血清培养基中,混匀室温放置
5 min。
C 将A、B混合放置5 min。
4 转染期间,将24孔板中的培养基换成无血清培养基,每孔400 微升。
将C管Mix加入到每孔中,6小时后换成有血清培养基。
jetPRIME 转染siRNA说明书

JetPRIME 转染试剂转染siRNA简易说明书
第0天:细胞接种
第一天:转染
在有血清存在的情况下转染,
使用JetPRIME缓冲液
以6孔板为例
●在1.5mL或0.5mL的EP管中加入200μL的JetPRIME 缓冲液,然后加入20μM(1.1μL)
的siRNA,旋涡10s后离心(或者用移液器吹打5次混匀);
●加入4μL的JetPRIME试剂,旋涡10s后离心(或者用移液器吹打5次混匀);
●室温孵育10min;
●将转染复合物加入到要转染的含血清的培养基中;
●必要时,转染后4h更换细胞培养基;
●孵育24-48h,检测转染效率。
不同规格培养皿的使用量
注:
siRNA enhancer的应用:
在转染复合物加入到所需转染的细胞中后,加入培养基体积的1/1000体积的siRNA enhancer,其他步骤与以前一致;
在6h或4h更换培养基时,也需要加入相应体积的siRNA enhancer(培养基体积的1/1000)。
siRNA的转染

siRNA的转染将制备好的siRNA, siRNA表达载体或表达框架转染至真核细胞中的办法主要有以下几种: (1) 阳离子脂质体试剂在优化条件下,将阳离子脂质体试剂加入水中,可以形成极小的(大小约100-400nm)单层脂质体。
这些脂质体带正电,可以靠静电作用结合到DNA的磷酸骨架上,以及带负电的细胞膜表面。
用法阳离子脂质体试剂,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA一阳离子脂质体复合物。
被俘获的DNA就会被导入培养的细胞。
(2) 磷酸钙共沉淀将氯化钙、RNA/DNA和磷酸缓冲液混合,沉淀形成包含RNA 且微小的不溶的磷酸钙颗粒。
磷酸钙-RNA/DNA复合物黏附到细胞膜,并通过胞饮进入目的细胞的细胞质。
沉淀物的大小和质量对于磷酸钙转染的胜利至关重要。
在试验中用法的每种试剂都必需当心校准,保证质量,由于甚至偏离最优条件非常之一个pH都会导致磷酸钙转染的失败。
(3)电穿孔法电穿孔通过将细胞裸露在短暂的高场强电脉冲中转导分子。
将细胞悬浮液置于电场中会诱导沿细胞膜的电压差异,据认为这种电压差异会导致细胞膜临时穿孔。
电脉冲和场强的优化对于胜利的转染十分重要,由于过高的场强和过长的电脉冲时光会不行逆地损害细胞膜而裂解细胞。
普通胜利的电穿孔过程都陪同高水平(50%或更高)的毒性。
(4) DEAE-葡聚糖和polybrene带正电的DEAE-葡聚糖或polybrene多聚体复合物和带负电的DNA分子使得DNA可以结合在细胞表面。
通过用法DMSO或甘油获得的渗透休克,将DNA复合体导人细胞。
两种试剂都已胜利用于转染。
DEAE-葡聚糖仅限于瞬时转染。
(5)机械法转染技术也包括用法机械的办法,比如显微注射和基因枪(biolistic particle)。
显微注射用法一根细针头将DNA, RNA或蛋白质挺直转入细胞质或细胞核。
基因枪用法高压microprojectile将大分子导入细胞。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
siRNA细胞转染实验操作指南
siRNA产品的最佳工作浓度、转染后检测时间因不同的细胞类型和研究目的而异。
一般推荐的siRNA工作浓度为50nM,检测时间为转染后24~72h。
可以通过设置时间梯度和浓度梯度进行组合实验来选择最优的siRNA工作浓度和检测时间。
由于siRNA过量会对细胞产生毒性,实验建议的siRNA 工作浓度优化的范围为5~100nM。
下面以Lipofectamine 2000转染24孔板的293T细胞为例,选取50nM的siRNA工作浓度,介绍siRNA转染细胞的操作步骤。
若使用其他的转染试剂,请参照对应的产品说明书进行操作。
1.在转染前一天,按1×105~5×105个/孔的量将细胞接种于不含抗生素的完全培养基中,使次日转染时细胞融合度30-50%为宜。
接种时尽量
保证每孔细胞的接种数量一致,使细胞均匀地平铺在生长表面。
注意:降低转染时的细胞密度可延长转染和收样的时间间隔,避免细胞过度生长对实验结果造成影响。
可根据细胞特性和实验目的等,调整接种时的细胞密度。
2.每个待转染的细胞样品(每个培养孔),按以下体系配置转染所需的siRNA-Lipofectamine 2000复合物:
(1)配制稀释液A:取25pmol siRNA于50ul Opti-MEM无血清培养基中稀释,轻轻混匀。
(*siRNA的用量计算参照表1)
(2)配制稀释液B:使用前先将Lipofectamine 2000轻轻混匀,取出1ul于50ul Opti-MEM无血清培养基中稀释,轻轻混匀,室温下孵育5分钟。
注意孵育时间不能超过25min。
(3)孵育完成后,将稀释液A与B轻轻混匀得到siRNA-Lipofectamine 2000复合物,在室温下孵育20分钟。
此时溶液可能会浑浊,属于正常现象。
表1 不同细胞培养板siRNA 转染用量参考表
3.将孵育好的siRNA-Lipofectamine 2000复合物分别加到对应的细胞孔中,轻轻混匀。
注意:转染前无需更换新鲜培养基,直接将复合物加到原细胞培养基中即可。
如有需要,也可根据情况更换培养基优化该步骤。
4.如果需要进行其他特殊处理,如加药等,可在此时进行。
5.将细胞培养板置于37℃的CO2培养箱中培养24-72h。
具体培养时间根据细胞生长特性、实验目的进行调整。
注意:加入siRNA-Lipofectamine 2000复合物后一般无需更换培养基,但若脂质体类转染试剂对细胞毒性较大,可根据细胞的状态,在转染4-6小时后更换培养基。
6.进行后续总RNA提取、蛋白提取、细胞活性分析等实验。
