12年有机金属化学(2)
金属有机化学-2

_ X W C NR2
X W C NR2 _
配体RC不仅可与一个金属形成三重键,也可与三个金属原 子形成三个单键,以此在过渡金属原子簇中形成三重桥基 基团,μ3-alkylidyne。 12.5 金属羰基配合物 过渡金属羰基配合物属所知最早的有机金属化合物 中的一类。它们是合成其它低价金属配合物,特别是原子 簇的常用原料。羰基配体不仅可被许许多多其它配体所取 代,而且未被取代的羰基还能稳定化合物分子
M M
O C M
μ3
M
二重桥联 doubly bridging
三重桥联 triply bridging
CO作为双桥基配体十分常见,特别是在多核原子簇化合物 中;它们几乎总伴随着金属-金属键而出现:
O C M C O C O M O C M M
CO桥常成对出现,并能与非桥联模式处于动态平衡之中。 例如,Co2(CO)8的溶液至少含有两种异构体:
1. DMPE Ta Br Br C H 2. 2Na/Hg P P Ta C H CMe3
CMe3
3. Hexa(t−butoxy)ditungsten在温和的反应条件下,与炔烃 发生金属化反应,也可得到过渡金属炔基配合物:
(t−BuO)3W≡W(t−BuO)3 + RC≡CR
⎯→ ⎯
2 (t−BuO)W≡C−R R = 烷基
12.5.1 1.
制备,结构和性质 金属+CO Ni + 4CO Fe + 5CO
⎯1bar, 25° C→ ⎯⎯ ⎯
Ni(CO)4 ⎯100bar, 150⎯→ Fe(CO)5 ⎯⎯⎯C °
2.
金属盐+还原剂+CO
3 4
H PO VCl3 + 3Na + 6CO ⎯diglyme→[Na(diglyme)2]+[V(CO)6] − ⎯⎯→ ⎯⎯ ⎯
中考化学专题112 有机合成材料(第02期)-2018年中考化学试题分项版解析汇编(解析版)

一、选择题目1.【2018年甘肃省白银市、平凉山】下列生活用品使用的材料属于有机合成材料的是()A.塑料保鲜膜 B.纯棉毛巾C.真丝围巾 D.不锈钢锅【答案】A【解析】A.塑料属于有机高分子合成材料; B.棉花属于天然材料;C.真丝属于天然材料; D.不锈钢是合金,属于金属材料。
故选A。
2.【2018年浙江省温州市】“柴、米、油、盐”是厨房常备用品其主要成分属于无机物的是A.柴(纤维素) B.米(淀粉) C.油(脂肪) D.盐(氯化钠)【答案】D【解析】属于无机物的是盐(氯化钠),柴(纤维素)、米(淀粉)、油(脂肪)均属于有机物。
故选D。
3.【2018年重庆市B】下列物质的分类正确的是()A.葡萄糖——有机物 B.氯酸钾——氧化物 C.纯碱——碱 D.液氧——混合物【答案】A4.【2018年山东省菏泽市】化学知识有助于我们正确认识、理智选择、科学生活。
下列说法不正确的是A.合理使用农药和化肥,既可以降低对环境的污染,又利于人体健康B.去超市购物,使用布袋代替塑料袋C.生活中常用的塑料、纤维、合金、玻璃都是有机合成材料D.农作物一般适宜在pH=7或接近7的土壤中生存,常用熟石灰改良酸性土壤【答案】C【解析】A、合理使用农药和化肥,既可以降低对环境的污染,又能防止农药和化肥残留,利于人体健康,故选项说法正确;B、去超市购物,使用布袋代替塑料袋,能减少白色污染,故选项说法正确;C、生活中常用的塑料属于有机合成材料,纤维可能是合成纤维,也可能是天然纤维,合金属于金属材料,玻璃属于无机非金属材料,故选项说法错误;D、农作物一般适宜在pH=7或接近7的土壤中生存,熟石灰显碱性,常用熟石灰改良酸性土壤,故选项说法正确。
故选C。
学科#网5.【2018年浙江省绍兴市】青山绿水就是金山银山,捡拾垃圾是有助于减少环境污染的一种简单方法。
以下是小敏在江边捡拾的垃圾,不属于有机物的是A.塑料瓶 B.泡沫饭盒C.易拉罐 D.垃圾袋【答案】C6.【2018年云南省昆明市】下列属于天然有机高分子材料的是()A.合成橡胶 B.合成纤维 C.塑料 D.棉花【答案】D【解析】A、合成橡胶属于三大合成有机高分子材料之一,错误;B、合成纤维属于三大合成有机高分子材料之一,错误;C、塑料属于三大合成有机高分子材料之一,错误;D、棉花属于天然有机高分子材料,正确。
2020年高考化学之考前抓大题12 有机化学基础(二)(选修)(解析版)

大题12 有机化学基础(二)(选修)1.化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。
其合成路线如下:回答下列问题:(1)I中含氧官能团的名称为___________________。
(2)由B生成C的化学方程式为_______________________________。
(3)由E和F反应生成D的反应类型为_______,由G和H反应生成I的反应类型为______。
(4)仅以D为单体合成高分子化合物的化学方程式为_________________ 。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。
写出两种符合要求的X的结构简式_______________。
(6)参照本题信息,试写出以1-丁烯为原料制取的合成路线流程图(无机原料任选)__________ 。
合成路线流程图示例如下:【答案】(1)羟基酯基(2)(3)加成反应取代反应(4)(5)(6)CH2=CHCH2CH3CH2=CHCHBrCH3CH2=CHCH(OH)CH3【解析】(1)根据有机物I的结构简式可知,其含氧官能团羟基、酯基;正确答案:羟基、酯基。
(2)根据有机物C发生氧化反应变为羧酸,结合有机物D的分子式可知,D的结构简式为CH2=CH-COOH,有机物C是溴代烃发生取代反应产生,因此有机物C为醇,结构简式为CH2=CH-CH2OH,所以有机物B 结构简式为CH2=CH-CH2Br,因此由B生成C的反应为取代反应,化学方程式为;正确答案:。
(3)有机物E为乙炔,与甲酸发生加成反应生成(D)CH2=CH-COOH;根据有机物I的结构简式可知,由G和H反应生成I的反应类型为取代反应;正确答案:加成反应;取代反应。
(4)根据以上分析可知,有机物D的结构简式为CH2=CH-COOH,可以发生加聚反应,生成高分子,化学方程式为;正确答案:。
金属有机化学(2)

具有9个低能量的成键分子轨道(6个σ轨道和3 个π轨道)可以填充18个电子。
RuⅡ
FeⅡ Cr0 CoⅢ ReⅤ
4 2
7 8
戴帽八面体 四方反椎
[Mo(CO)4Cl3]- MoⅡ
化合物中比较常见的是四配位和六配位化合物,绝大多数是六 配位化合物,正八面体的高度对称性,使得分子轨道之间的能 量降低,增加了六配位的正八面体络合物的稳定性。
四、络合物的配位数和几何构型
1. 四配位络合物
t1u σ对称 eg π对称 t2g eg t1u a1g
a1g
18电子规则可以预测络合物的结构和稳定性。 RhH(CO)(PPh3)3 NVE=9+1+2+2×3=18 稳定 Co(CO)4 NVE=9+2×4=17 不稳定
Co2(CO)8 HCo(CO)4 NVE=9+2×4+1=18 有一些化合物16电子也稳定:
atomic number)
很早以前,N.V.Sidgwick提出了一个经验规 则: 稳定的过渡金属有机络合物中,金属的电子 数与配位体提供的电子数总和与本周期中的 惰性气体的电子数相同。
例如: Ni(CO)4 Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
有机化学(2)智慧树知到答案章节测试2023年山东师范大学

第一章测试1.下列化合物能发生碘仿反应的是()。
A:异丙醇B:3-戊烷C:2-甲基丁醛D:丙醇答案:A2.下列羰基化合物对HCN加成反应速度最快的是()。
A:乙醛B:苯乙酮C:苯甲醛D:2-氯乙醛答案:D3.保护羰基常用的反应是()。
A:氧化反应B:缩醛反应C:还原反应D:羟醛缩合答案:B4.醛和酮都能和2,4-二硝基苯肼反应产生固体,此方法可用来检验醛、酮的存在。
()A:对B:错答案:A5.格氏试剂(有机镁化物)与甲醛作用可制备伯醇。
A:错B:对答案:B第二章测试1.三氯乙酸的酸性大于乙酸,主要是由于氯的()的影响()。
A:共轭效应B:吸电子诱导效应C:空间效应D:给电子诱导效应答案:B2.下列化合物中,能发生银镜反应的是()。
A:乙酸甲酯B:甲酸C:乙酸乙酯答案:B3.羧酸具有明显酸性的主要原因是()。
A:COOH的-I效应B:P-π共轭效应C:σ-π超共轭效应D:空间效应答案:B4.脂肪族饱和二元酸两个羧基间的距离越大Ka1与Ka2之间的差值越小()A:错B:对答案:A5.酰氯与重氮甲烷反应生成α-重氮酮,α-重氮酮经Woff重排,水解后生成羧酸。
A:错B:对答案:B第三章测试1.四种化合物:A、苯胺B、对硝基苯胺C、间硝基苯胺D、邻硝基苯胺,它们的碱性由强到弱排列正确的是()。
A:B>A>D>CB:A>C>B>DC:A>B>C>DD:B>D>C>A答案:C2.下列反应过程中,生成碳正离子中间体的反应是()。
A:Diels-Alder 反应B:芳环上的亲核取代反应C:烯烃的催化加氢D:芳环上的亲电取代反应答案:D3.能与亚硝酸作用生成难溶于水的黄色油状物—N-亚硝基胺化合物的是()。
A:乙基胺B:二甲基卞基胺C:N,N-二甲基甲酰胺D:六氢吡啶答案:D4.Hoffmann消去反应的特点是生成双键碳上烷基较多的烯()A:错答案:A5.能将伯、仲、叔胺分离开的试剂为苯磺酰氯的氢氧化钠溶液。
A:错B:对答案:B第四章测试1.硫醇R-S-H、硫酚Ar-S-H、硫醚R-S-R中的硫-碳σ键和硫-氢键是()。
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
有机化学实验(二)_洛阳师范学院中国大学mooc课后章节答案期末考试题库2023年

有机化学实验(二)_洛阳师范学院中国大学mooc课后章节答案期末考试题库2023年1.柱色谱不需要用哪种仪器答案:分水器2.由正丁醇合成正丁醚的实验是通过什么关键装置来提高产品产率的?答案:分水器3.在正丁醚的精制过程中,先后用水、50%硫酸、水洗涤,最后用氯化钙干燥,各步的目的论述错误的是:答案:最后水洗是为了除去正丁醇4.关于减压蒸馏,下列说法错误的是答案:减压蒸馏完毕,应先通大气,再停止加热,然后关真空泵、冷却水5.用邻苯二甲酸酐和正丁醇反应制备邻苯二甲酸二丁酯的实验中,反应结束后,用5%碳酸钠溶液洗涤的作用是答案:除去反应体系中的酸6.用高锰酸钾氧化环己醇为己二酸时,产生的棕色沉淀是答案:二氧化锰7.安息香缩合反应中NaCN或VB1催化反应的本质是催化剂具有答案:亲核性8.乙酰乙酸乙酯制备实验中,反应启动快慢主要与什么有关答案:乙酸乙酯中乙醇的含量9.促使呋喃甲醛歧化反应发生的条件是答案:浓碱10.使用乙醚萃取分离呋喃甲醇与呋喃甲酸盐时,下列说法错误的是答案:萃取完毕,醚层可用无水氯化钙、硫酸镁、硫酸钠等干燥11.色谱法可用来做以下哪些工作?答案:分离混合物鉴定化合物跟踪反应提纯化合物12.由环己醇制备环己酮的实验中,反应结束后用水蒸气蒸馏提取产物环己酮,这是因为答案:环己酮在100°C左右有一定的蒸气压环己酮不与水反应环己酮几乎不溶于水13.减压蒸馏适用于下列哪些情况?答案:在常压蒸馏时未达沸点即已受热分解、氧化或聚合的物质沸点较高(150 ℃以上)的物质14.在邻苯二甲酸二丁酯的制备实验中用到了过量的正丁醇,其作用是答案:反应原料溶剂带水剂15.使用VB1作催化剂催化安息香缩合反应时,哪些因素影响反应的产率?答案:加料和反应过程的温度VB1的质量反应的pH值苯甲醛的质量16.乙酰乙酸乙酯的制备实验中,要求答案:装置干燥回流时加干燥管试剂无水17.使用金属钠时应当注意答案:要戴手套操作,不可用手接触切钠完毕,用具要放入乙醇中以除去残留的钠切钠的用具无水切下不用的钠放回原瓶中18.用乙酸酐和水杨酸制备阿司匹林的实验中,乙酸酐的作用是答案:酰化试剂溶剂19.适合重结晶用的溶剂应符合以下哪些条件答案:被提纯的有机物应易溶于热溶剂中,而在冷溶剂中几乎不溶沸点适中与被提纯的有机物不起化学反应对杂质的溶解度应很大或很小20.有关色谱法的说法正确的是:答案:色谱法包括薄层色谱、柱色谱和纸色谱薄层色谱可以用来跟踪反应进程薄层色谱适用于分离少量样品21.浓硫酸是正丁醇脱水制备正丁醚的催化剂,所以加入的量越多越好。
有机金属化学(二)05
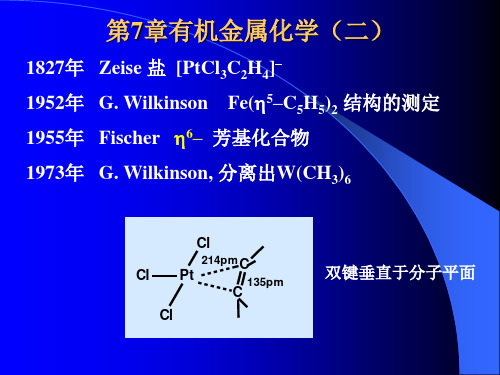
卡宾(Schrock)配合物(高氧化态) C亲核 卡宾(Schrock)配合物(高氧化态) C亲核 配合物
Carbyne配合物 配合物
Carbyne配合物 配合物
讨论: 讨论:
1. 烯丙基配合物 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数 的结构和总价电子计数, 金属原子间是否存在M–M键 ? 键 金属原子间是否存在 对比 [Pt(CO)Cl2]2和[Mn(CO)4Cl]2
一. 常见的有机配体和齿合度 常见的有机配体和齿合度
提供M的 提供 的 电子数 1 2 2(4) 2 齿合度 η1 η2 η2 η1 配体 烷基(H, X) 烷基 烯烃(CH2=CH2) 烯烃 炔烃(CH≡CH) ≡ 炔烃
M C
M-L的结Байду номын сангаас 的结构
M
CR3
C
M
C
C
亚烷基(carbene) 亚烷基
M
H H CH4 H H NH3 H H H H H OH2 FH H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) “Building Bridges between Inorganic and Organic Chemistry”
Angew. Chemie. Vol 21, 10(1982)711-724
Ti
(深绿色固体 深绿色固体) 深绿色固体
含茂基的弯曲夹心(bent-sandwich )化合物 含茂基的弯曲夹心 化合物
4. 环戊二烯基 羰基化合物 环戊二烯基–羰基化合物
Fe(CO)5+2 C5H6(二聚体 → Fe2(η5–C5H5)2(CO)4 + CO + H2 二聚体) 二聚体 η V(η5–C5H5)2 +CO → V(η5–C5H5)(CO)4 η η
有机金属化学

(四)金属有机化学和无机化学
(Ph3P)2PdMe2与 (Ph3P)4Pd性质类似 RSi(OR)3与Si(OR)4性质类似
金属有机化学与不含碳-金属键的络合物化 学重叠,与无机化学重叠
金属有机化学是介于无机化学和有机化 学之间的边缘学科。
(五)有些含M-C键的化合物不属于 金属有机化合物
1983年,K. G.Bergman和
W.A.G.Graham在金属络合物和烷烃的 分子间反应中观察到了C—H键活化,再次掀 起金属有机化学的热潮
三、金属有机化合物分类
(一)按中心金属元素在周期表中的位置: 主族金属有机化合物
包括IA,IIA,IIIA,IVA,VA族及IIB族的金属与准金属
随后,很多化学家对砷、锑、锡、汞的 元素有机化合物进行过不少研究工作。
我国的化学家于20世纪五六十年代,制备了 许多锑化合物,用于治疗血吸虫病和黑热病。 为了减低锑化合物的毒性,还合成了一些新 的有机锑化合物。
其他,如锡有机物作为杀菌剂,汞有机物作 为消毒剂,“顺铂”做为抗癌药物等
(二)金属有机化合物的工业直接应用
四乙基铅:汽油的抗震剂,有机锡化合物:高分子
聚合物的稳定剂和聚烯烃、橡胶等的防老剂等
硅酮聚合物:橡胶、塑料、涂料、粘合剂、润滑剂等, 可用作火箭、高速飞机等领域中耐油、耐高温或低温 的特种材料。
其他元素有机聚合物,包括高分子金属络合物,可用 作胶粘剂、阻燃剂、催化剂等。
金属有机聚合物在粘流态拉丝或制成其他形状,然后 高温裂解,可制得特定形状的陶瓷材料。用这种方法 已合成出有机碳硅烷--碳化硅纤维。
1917年,W.Schlenk从有机汞试剂出发,合成了烷
基锂试剂,并发展了金属有机化学实验中常用的 Schlenk 系列玻璃仪器及其相关操作
金属有机化学

有机金属化学是现代化学发展最迅速的领域之一,是无机化 学、配位化学和有机化学形成的交叉学科。100多年前制备的 Zeise盐(分子式为Na[PtCl3(C2H4)]),是人们在有机金属化学领域 迈出的第一大步。本世纪初,由W. Hieber所发展起来的过渡金 属羰基化合物, 进一步推动了有机金属化学的发展。五十年代 初,G. Pansan等合成出第一个环戊二烯类金属化合物—二茂 铁;随后,E. O. Fischer测定和描述了二茂铁的结构,即由上下 两个平行的环戊二烯与一个铁原子配位而形成的夹心结构。
1981 年 R. West 合成出含有稳定双键的化合物:(1,3,5−Me3C6H2)4Si2。
1981 年
Nobel 奖授予 R. Hoffmann 和 K. Fukui 以表彰它们在无机、有机、有机 金属化合物分子结构及其反应活性分子轨道理论处理上的成就,即等瓣 相似理论(isolobal analogies)。
1922年 T. Midgley和T. A. Boyd首先将Pb(C2H5)4作为抗震剂添 加到汽油中,促进了汽车工业的发展,同时也埋下了环境污 染的隐患。
1928年 W. Hieber系统地研究了过渡金属羰基化合物,奠定了 羰基化合物化学的基础。
1929年 F. A. Panth通过PbR4的热分解来获取有机自由基。
1909年 P. Ehrlich,化疗法的创始人,获Nobel奖
1917年 W. Schlenk制备了各种有机锂化合物,并发展了无水 无氧操作技术—Schlenk技术。
2 Li + R2Hg2 ⎯⎯→ LiR + Hg 2 EtLi + Me2Hg2 ⎯⎯→ MeLi + Et2Hg
1919年 F. Hein研究了CrCl3与PhMgBr的反应,得到了一种未 知的化合物。后来这种未知物测定为具有Sandwich结构 的化合物。
金属有机化合物

Fe(C2 H5 )2 Fe+ 2C2 H5 4 Fe 3O2 2 Fe2O3
400 C以上
2 RCH 2OOH+ Fe 2O3 2 RC H O+ 2 FeO+ 2 H 2O+ O 2 .4 FeO+ O 2 2 Fe 2O3
10
• 1951 英 T.J.Kaely 和 P.J.Pauson 与 美 ler 分 别 独 立 地 发 现 了 二 茂 铁 Fe(C5H5)2 , 第 二 年 G.Wilkinson 和 R.B.Woodward 等人提出了二茂铁的夹心 式结构(全新),从此,人们才对这类化合物 产生了兴趣。至今,在这类化合物中发现 了许多新结构、新键型,以及不同于经典 有机化学反应机理的新反应。
缺电子化合物 [Al(CH3)3] 2、[LiMe] 2、[BeMe2]x 熔沸点低、有挥发性(与分子量有关)
22
23
24
[LiMe]4
25
(3)含有π键的有机金属化合物 过渡金属与含π键的配体形成的 π配体 (定域 C2H4、 C2H2 ) (离域 C5H5、 C6H6 )
Zieglar试剂 包括烷基铝(R3Al), 烷基卤化铝(R2AlX,RAlX2),
烷基氢化铝( R2AlH,RAlH2 ),
烷基烷氧化铝( R2AlOR’,), 芳基铝、以及含N、S、P等有机铝。
9
④ 1951 合成夹心结构二茂铁 火箭燃料添加剂
RCH3 (烃) + O2 RCH2OOH(过氧化物)
11
⑤ 有机锡:二烷基锡: 聚氯乙烯和橡胶的稳定剂;
三烃基锡羧酸酯的3种可能的结构
可像C,4配位,有空d ,可5、6配位 C-Sn键易断,不对称,催化、助催化。 烯丙基锡与羧基化合物不对称加成。
金属有机化学复习题
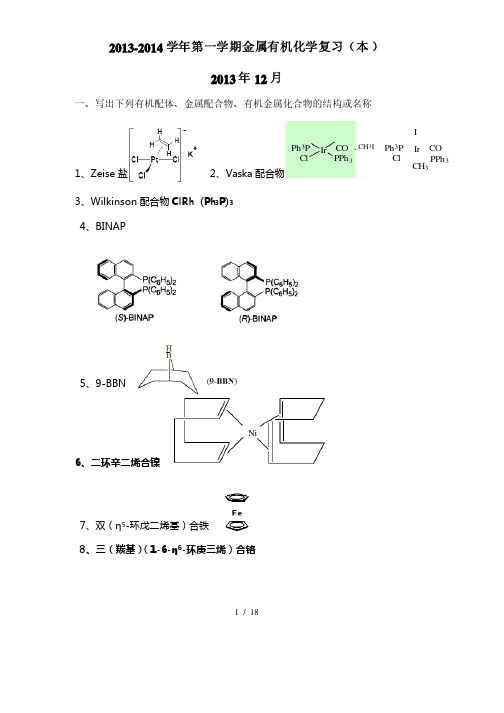
2013-2014学年第一学期金属有机化学复习(本)2013年12月一、写出下列有机配体、金属配合物、有机金属化合物的结构或名称1、Zeise盐2、Vaska配合物Ph3P IrClCOPPh3Ph3P IrClCOPPh3CH3ICH3I3、Wilkinson配合物ClRh (Ph3P)34、BINAP5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-1-6-ηη6-环庚三烯)合铬1 / 18HHCrCOCOCO9、Ni(COD)21010、、RhCl(PPh3)3 Wilkinson配合物、η5- CpMn(CO)31111、ηCO))51212、、Fe Fe((CO13、MoH4(PPh3)4、η5- Cp2Zr(CH3)21414、η1515、、Et2AlCl 二乙基氯化铝二、解释下列各名词二、解释下列各名词1、金属有机化合物、金属有机化合物 含有金属-碳键(含有金属-碳键(M-C M-C M-C)的化合物定义为金属有机化合物)的化合物定义为金属有机化合物2、过渡金属有机化合物、过渡金属有机化合物 含有过渡金属-碳键(M-C )的化合物, 过渡金属含有d 电子,在(n-1)d, ns, np 原子构型中原子构型中,,(n-1)d 轨道能级与ns 接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN 电子规则电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数5、环状多烯π-金属配合物6、高自旋配合物成对能(P )大于分裂能(△)的配合物, 当P >△时>△时, , 因电子成对需要的能量高能量高, , 电子将尽量以单电子排布分占不同的轨道电子将尽量以单电子排布分占不同的轨道, , 取高自旋状态。
《金属有机化学》作业

《金属有机化学》作业一选择题1.最早的哪个金属有机化合物是1827年由丹麦药剂师Zeise合成的。
()A. (CH3)4TiB. K[Pt(C2H4)Cl3]C. (CH3)2HgD. CH3MgCl2.二茂铁(C5H5)2Fe属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物3.烯烃和B—H键的加成遵循以下哪个规则?()A. Markovnikov规则B. 反Markovnikov规则C. Zaitsev规则D. 反Zaitsev规则4.下列有关烷基铝说法不正确的是()A.烷基铝化合物是缺电子化合物B.烷基铝化合物一般是强的Lewis酸C.当三烷基铝的烷基为烷氧基所取代后,烷基铝化合物的反应性即降低。
D.从烷基铝和烯烃的反应能得到有很长链的烷基的化合物5.Ni(CO)4的几何构型是()A.正四面体型 B. 正方锥型 C.八面体型 D. 三角锥型6.Si—C键的反应性一般比C—C键的反应性为()A. 大B. 小C. 相等D. 不确定7.下列采用sp3杂化轨道成键的是()A. Cr(CO)6B. Fe(CO)5C. Ni(CO)4D. [Ag(CN)2]-8.Fred属于下列哪类配合物?()A. 混合配体羰基金属配合物B. 单核全羰基金属配合物C. 双核羰基金属配合物D. 原子簇配合物9.炔烃配体配合物中炔配体提供给金属的电子数是()A.4B.3C.2D.110.下列不属于类环戊二烯基配体的是()A. B. C. D.11.IA族金属的烷基物和芳基物的活性正确的是()A. Li-R<Na-R<K-R<Rb-R<Cs-RB. Li-R<K-R<Na-R<Rb-R<Cs-RC. Cs-R<Rb-R<K-R<Na-R<Li-RD. Cs-R<Rb-R<Na-R<K-R<Li-R12.Ni(CO)4属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物13.铝氢化物中最重要的是氢化铝锂,LiAlH4是重要的()A.还原剂 B. 氧化剂C. 催化剂D.脱水剂14.Fe(CO)5的几何构型是( )A. 正四面体型B. 正方锥型C. 三角锥型D. 八面体型15.Si —C 键的反应性一般比C —C 键的反应性为( )。
12 有机化学试题

12 有机化学试题xx年硕士研究生入学考试试题考试科目代码:621 考试科目名称:有机化学河南科技大学一、用系统法命名下列化合物(10个小题,每题1分,共10分)CH31. (CH3)3N+(CH3)2CH2C(CH3)(CH3)二、单项选择题(20个小题,每题1分,共40分)1. 下列化合物与溴反应最易开环的是:A. 甲基环丙烷B. 甲基环丁烷C. 甲基环戊烷D. 甲基环己烷 2. 下列化合物水解反应活性最小的是:A. 乙酸乙酯B. 乙酸酐C. 乙酰氯D. 乙酰胺 3. 下列化合物碱性最强的是:A. 三乙胺B. 二乙胺C. 苯胺D. 四甲基氢氧化铵 4. 下列烯烃催化氢化反应相对速率最小的是:A. 2,3-二甲基-2-丁烯B. 丙烯C. 异丁烯D. 2-甲基-2-丁烯 5. 下列离子具有芳香性的是:6. 反式1-甲基-4-叔丁基的优势构象是:Me 第1页7. 下列酯类化合物水解速率最大的是:A. 对硝基苯甲酸乙酯B. 对甲氧基苯甲酸乙酯C. 对甲基苯甲酸乙酯D. 苯甲酸乙酯 8. 下列化合物能发生碘仿反应但不与饱和亚硫酸钠饱和溶液反应的是: A. 丙酮 B. 环己酮 C. 苯乙酮 D. 乙醛 9. 下列化合物酸性相对最强的是:A. 对羟基苯甲酸B. 对硝基苯甲酸C. 对甲氧基苯甲酸D. 对甲基苯甲酸 10. 下列化合物与Tollens试剂反应而不与Fehling试剂反应的是: A. 丙醛 B. 丁醛 C. 苯甲醛 D. 乙醛 11. 蛋氨酸的等电点pI = , 其在pH = 是存在形式为: A. 中性分子 B. 偶极离子 C. 正离子 D. 负离子 12. 下列化合物在碳酸钠溶液中水解反应活性最大的是:A. 对甲基氯苯B. 对甲氧基溴苯C. 对硝基氯苯D. 对氨基氯苯 13. 用于鉴别胺类化合物所用的试剂是:A. 兴斯堡试剂B. 卢卡斯试剂C. 斐林试剂D.托伦试剂 14. 下列基团属于邻、对位定位基但其电子效应使苯环电子云密度降低的是: A. –CHO B. –NO2 C. –NH2 D. –Cl 15. 下列化合物与碘化钠的丙酮溶液反应速率最小的是:A. 1-氯丁烷B. 2-氯丁烷C. 2-甲基-1-氯丙烷D. 2-甲基-2-氯丙烷 16.下列碳水化合物无变旋现象的是: A. 葡萄糖 B. 果糖 C. 蔗糖 D. 麦芽糖 17.下列化合物发生亲电取代反应速率最大的是:A. 呋喃B. 噻吩C. 吡咯D. 苯 18. 下列化合物发生亲核加成反应活性最大的是:A. 乙醛B. 三氟乙醛C. 丙酮D. 苯乙酮19. 下列化合物具有手性的是:第2页20. 下列溴化物在绝对无水乙醚中能形成稳定格氏试剂的是:A. 3-溴丙醇B. 3-溴丙烷C. 3-溴丙炔D. 4-溴-2-丁酮三、完成下列反应式(共40个空,共40分;有立体构型者请写出其立体构型)1.(1)2.(3)H2,Lindlar25℃Br2, CCl4-20℃CH3CCCCH3CHNa, NH3(l)-78℃CH3OHKOH (2) (4)CO2CH3CO2CH3(9)CH2=(5)C2H5BrAlCl34.(8)+H(6)=CHCH3H+(7)KMnO4, H+(10)CH3CH3OBrNaI丙酮(11)8.(12)CH3OHH2SO4 (13)=, V2O5CH2Cl2(14)AgNO3, (15)(16)NaCN(17)H2O, H+(18)NH3(19)Br2NaOH(20)NO211. (22) (21)FeHClCHO12.(24) + (25)HCHO浓 NaOHO2, V2O5 (23) CH3CHO稀NaOH(26)稀NaOH(29)(30) (27)C2H5ONaCH3(CH2)3COCl(28)浓NaOHCH3OH无水HCl(31)CH3INaCO3(32)HCl, H2O(33)(34)+Cl-+OH NaOH(35) 第3页OCH=°COH(36)(37)25°CAlCl3(38)HNO3H2SO4(39)(40)四、用化学方法鉴别下列各组化合物(3个小题,每题3分,共9分)1. 环丙烷,环己烷,环己烯, 1,3-环己二烯;2. 1-丁醇,2-丁醇,叔丁醇,苯酚; 3. 乙醛,乙醇,丙酮,苯甲醛。
金属有机化学:第五章 膦配体 (2)

Ligand
H3PO4
P(CF3)3 PPh3
PEt3 NaPPh2 PMePh2
PPr3 PMe2Et PMe3 P(CN)3
PH3 KPH2
Chemical Shift (ppm)
0 (reference)
-2 -6
-20 -24 -28 -33 -50 -62 -135 -238 -255
• 膦配体的空间位阻也可以在很大的范围内变化(从很小到非 常大)
• 多种多样的鳌合膦配体(双齿、三齿、四齿、五齿、六齿等 )可与金属中心形成特定的立体配位模式(顺式、桥联、面 式、桥联&鳌合等)
三齿 面式配位 类似蝎型Tp配体
四齿 桥联两金属中心 每个金属处鳌合
• PR3配体中R基团的电负性逐渐增大(C < N < O < F),R基 团中用来与P原子成键的轨道能量逐渐降低,则:
PCl3
PMe3
HOMO 能量
-8.36 eV
-6.23 eV
3)TiCl4金属中心为d0电子构型,只能接受电子,不能与配体 形成有效的反馈p键。因此预计TiCl4(PMe3)能稳定存在,而 PCl3不能和TiCl4形成配位键。
TiCl4(PMe3)
TiCl4 --- PCl3
结论:在通过比较化学键键长来说明化学键的强弱时, 必须注意用于比较的化学键具有相似成键方式。
则ci(tBu) = 0
R -OEt -OMe -H -OPh -C6F5 -Cl
-F -CF3
ci(cm-1)
6.8 7.7 8.3 9.7 11.2 14.8 18.2 19.6
问题: 将下列膦配体按给电子能力从强到弱的顺序排列
金属有机化学2过渡金属络合物的性质
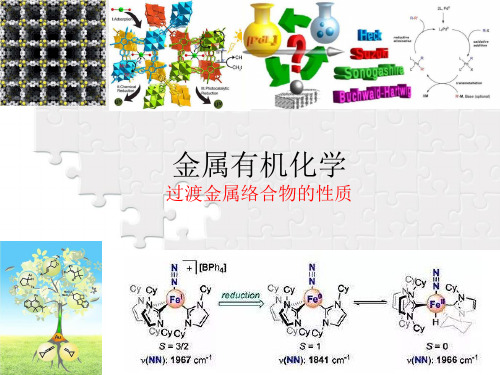
化合物
CH2=CH2 K[Pt(CH2=CH2)Cl3] [Pt(CH2=CH2)Cl2]2 反式[Pt(C2H4)(NH3)Cl2] 反式[Pt(C2H4)(NH3)Br2] [Pd(C2H4)Cl2]2 K[Pd(C2H4)Cl3] [Ag(C2H4)]+ [(C2H4)Mn(CO)3]+AlCl4[(C2H4)Fe(C5H5)(CO)2]+ [(C2H4)Mo(C5H5)(CO)3]+ [(C2H4)W(C5H5)(CO)3]+
很早以前,N.V.Sidgwick提出了一个经验规则: 稳定的过渡金属有机络合物中,金属的电子数与配位体提供的 电子数总和与本周期中的惰性气体的电子数相同。 例如: Ni(CO)4
Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
这种成键的结果,使烯烃的π轨道中电子云密度 降低,而烯烃的反键轨道π*中电子云密度增加, 意味着烯烃键的削弱,或活化。这可从键长数据 看出,正常的C-C双键键长为1.34Å ,而在烯烃 的过渡金属络合物中,烯烃的键长为1.40-1.47 Å ,说明此双键已具有某些单键的性质,即被活 化了。
烯烃-过渡金属络合物红外光谱数据
M
CO
❖ 实验表明这些络合物C-O键比CO中的C-O键长,红外光谱伸 缩振动频率变小,说明被配位的CO中C-O键被削弱,M-C键 键长要比正常单键短。
V(CO)6- Cr(CO)6 Mn(CO)6+ Fe(CO)5
IR(cm-1)
第五章_金属有机化学-2

5.6 过渡金属有机化合物的基元反应
过渡金属有机化合物的化学性质非常复杂,但随着 人们认识的不断深化,已将众多的过渡金属有机配合物 的化学性质归纳为若干基元反应,它们也构成了配位催 化反应机理的基本框架。按照它们反应的类别,可以分 为若干个基元反应。
30
过渡金属有机化合物的基元反应
25
b) 金属相同 1. R(Et)-M < Me-M < Ph-M < CF3-M
2. 烷 基 - 金 属 配 合 物 中 , 不 同 烷 基 其 稳 定 性 不 同 : 伯碳> 仲碳> 叔碳;
3. 对称性好的金属有机化合物稳定性大于对称性差的金属 有机化合物。 4. 金 属 - 碳 键 中 碳 的 电 负 性 越 强 , 如 杂 化 轨 道 中 S 成 分 越 多 或 碳 上 连 有 提 高 碳 的 电 负 性 的 基 团 , M-C 键 的 稳定性就增加。
烯烃或炔烃可以通过插入金属与氢或金属与碳之间 的键中或取代某个配体而生成新的配位化合物。这是制
备金属-烷基化合物的重要方法之一。
(多两个碳原子)
M-X
+ C
C
M
C
C
X
X通常是H或烷基; M可以是所有的金属,特别是硼、铝、硅和过渡金属。
12
工业上制备烷基铝的主要方法:
Al + 3/2H2 + 3C2H4 Et3Al
N2 Cl
+
-
HgCl HgCl2
Cu
+
COCl
COMn(CO)5 NaMn(CO) 5
- CO
Mn(CO)5
+
20
6. 碳环键合
绝大多数四碳键合的配位体是用四碳键配位体如丁 二烯、 1,3- 环己二烯等与金属有机化合物直接反应,取
金属有机化学1金属有机化合物的定义

RCH 2CH2CHO+RCH 3CCHO
• 这一反应应称之为氢甲酰化反应,但在工业 界常称作Oxo反应,这是起初误以为是氧化 反应,故称为“Oxonation”或Oxo反应。由这 一过程产生的醇,已习惯地称作Oxo醇。这 个反应是第一个均相催化工业应用的例子。
1951年鲍森(Pauson)和米勒(Miller)分别发现了二茂 铁Fe(C5H5)2。 次年威金森(Wilkinson)等确定了它具有夹 心面包式分子结构及新的化学键理论,激起了化 学家对过渡金属有机化合物研究的热情,大大推动 了过渡金属有机化合物的发展。
• 有机锂与格氏试剂的最大不同之处在于溶剂。 有机锂可以在惰性溶剂,如戊烷,石油醚等 烷烃中制备,而格氏试剂不溶于烃类溶剂, 只有少数能在这类溶剂中制备。
1931年:W Hieber制备了第一个过渡金属 氢化物H2Fe(CO)4
1938年:德国鲁尔化学公司Rolen发现Oxo 法:
Co or Rh RCH=CH2+CO+H2
金属有机化学
金属有机化合物的定义
一.金属有机化合物的定义与基本概念
中文:金属有机化合物 (常用) 有机金属化合物 : 台、港、日用此名称
英文:Organometallic compounds Organometallics
定义:分子中含有一个或多个金属-碳键(δ键或
π键)的化合物。
1)含M-C -金属有机化合物
1963年他们分享了诺贝尔化学奖。
1954年维蒂希(G.Wittig)发现磷叶立德 与羰基化合物反应生成结构确定的烯烃。
1956年布朗(H.C.Brown)发现了烯烃的 硼氢化反应。 1979年布朗与维蒂希分享诺贝尔化学奖。
1958年齐格勒的学生维尔克(Wilke)发 现镍配合物催化丁二烯的环齐聚反应并第 一次通过分离鉴定反应活性物种来确定反 应机理。他还发现了[CpMo(CO)3]2金属之 间存在共价键,为过渡金属原子簇合物奠 定了基础。
金属有机化学

1953-5年齐格勒(K.Ziegler)发现 TiCl4/Et3Al体系在低压催化乙烯聚合反应。 纳塔(G.Natta)将此体系用于丙烯或二 烯烃聚合催化剂,得到等规聚合物。他 们的工作开创了现代聚烯烃工业的新纪 元,同时有力地推动了金属有机化学的 发展。
宝库。现在人们称镁有机化合物为格林雅试 剂(Grignard Reagent)。镁有机化合物同有机 化合物的反应称为格林雅反应(Grignard Reaction)。为此,1912年他获得诺贝尔化学 奖。这是第一个获诺贝尔奖的金属有机化学 家。
1922年:T.Midgley T.A. Boyd Pd(C2H5)4作为汽 油中的抗震剂。
1891年:L.Mond和M.Berthelot,Fe(CO)5 的合成
Fe + CO 250。C 压
Fe(CO)5
1899年法国化学家巴比尔(P.Barbier)和格林雅 (V. Grignard)在研究锌有机化合物基础上, 发 现了镁有机化合物RMgX并将它用于有机合 成。由于他及以后百余年各国化学家的努力, 形成了用镁有机化合物进行有机合成的巨大
近50年以来,金属有机化学发展极为迅 速,已逐渐成为介于无机化学,有机化 学,结构化学,量子化学,催化科学, 物理有机,高分子化学,立体化学等学 科的内容广泛的边缘学科,成为当前化 学领域的最热门领域和最前沿学科。
1827年:丹麦化学家(药剂师)W.C.Zeise制得了 世界上第一个金属有机化合物,称之为Zeise盐。 当时人们不知道它是什么结构,后来才知道,这 是铂和乙烯的配合物K[Pt(CH2=CH2)Cl3]。这个化 合物长期以来未被人们注意。
金属有机化学 NO.2基元反应

(3) 烯烃的 C-H 键
OR
RuH2L4 + 2 H2C
CH3 COOR
27
28
PPh3
(H3C)2CHCOOR + L
OL Ru
CH3
29
LH H
30 (L = PPh3)
(4) 醛的 C-H 键
RH +
Rh(CO)ClL2 33
RhClL3 +L-L
RhClL2 31
RCHO
RRh(CO)(H)L2Cl
C M
C
Dewar-Chatt-Duncanson Model
表 1 一些烯烃─过渡金属络合物的红外光谱
化合物
CH2=CH2 K[Pt(CH2=CH2)Cl3] [Pt(CH2=CH2)Cl3]2 反式[Pt(C2H4)(NH3)Cl2] 反式[Pt(C2H2)(NH3)Br2] Pd[(C2H4)Cl2]2 K[[[[[A(((CCCC[2gP222H(dHHHC4(444C)2)))WHMFM2H4e()noC(4]C(()+2CCCH2HO2l53H)5])()55C(])C+(OCAO)Ol3)C]2)+]l3-++4
第二讲 基元反应
Elementary Reactions in Organometallic Chemistry
RX + Mg
RMgX
氧 化 加 成 (Oxidative addition)
RMgX +
R1
=O
R2
R1
R1 C
O
R MgX
插 入 反 应 ( Insertion )
非 机 理,乃 是 帮 助 理 解 及 预 测 反 应 产 物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe(5–C5H5)2 (或FeCp2) 橘红色固体,抗磁性
溶于有机溶剂,和稀碱和酸不反应,性质稳定
m.p. 174 °C b.p. 249 °C
升华温度/ °C
压力/Pa
25
1
50
10
80
100
C5H5–与C6H6类似,与亲电试剂反应
常用的茂基是Cp*, 即 C5Me5–
Fe(5–C5H5)2
C
O C 215pm C 双键垂直于分子平面 151pm Ir C CN Br P C P
C CN
n–
齿合度(hapticity of ligand),多齿 配体
n表示配体的配位原子数 例如:(5–C5H5)2Fe
n–
桥连的配体(bridging ligand)
n表示桥连金属的原子数, (2– 可写为 – ) Fe3(CO)10(–CO)2 ,M6(CO)12(3–CO)4
Neutral Positive Negative Ligand L 1 0 2 Alky, aryl, hydride, halide (x)
2
3
2
4
Ethylene, monoolefin, CO, phosphane etc. -allyl,enyl,cyclopropenyl Diolefin
Ph Ph3P 103
0
C Pt C 39
0
140
0
132pm Ph
Ph3P
炔烃(PhCCPh)配合物(Ph3P)2Pt (PhCCPh) 的结构
CR2 RC CR2 M
R2 C M CR CR2
3
1
烯丙基配合物的两种结构形式
二. 环戊二烯基(cyclopentadienyl)配合物
1. 二茂铁 (Ferrocene)
电子的分子内分割必须保证络合物电荷总数保持
不变。
中心金属电子计算实例:双环戊二烯铁或茂铁
Di(cyclopentadienyl)iron or ferrocene Fe(C5H5)2: 2(C5H5-) 12e Fe2+ 6e ----------------18e or 2(C5H5.) 10e Fe0 8e ----------------18e
第7章 有机金属化学(二)
多齿 配体(不饱和烃)配位的有机金属化合物
1827年 Zeise 盐 [PtCl3C2H4]– 1952年 G. Wilkinson Fe(5–C5H5)2 结构的测定
发音 eta
1955年 E. O. Fischer 6–芳基化合物
N Cl Cl Cl Pt
214pm C 135pm
SIM: (COT)ErCp*
单分子磁体
单个分子可能表现出与磁体类似的行为! “分子磁性”是一个多学科交叉的前沿领域。 如何设计并合成具有特定磁性质的分子?
基础:理解分子的组成和结构与性质的关系!!
比如,单离子/单分子/单链磁体 离子和分子的对称性---单轴各向异性 关系? 控制合成?
Fe
A metal-metal bond contribute one electron to count on each metal 一个金属-金属键算每一个金 属贡献一个电子
Decacarbonyldimanganese Mn2(CO)10: 十羰基二锰
CO OC OC Mn CO
CO
OC Mn OC
苯
M
CH2
C
CH
R
CH2
M
M
M
M
M
LM, 给体, 形成键
M L, 受体 , 形成反馈键
烯烃和d区金属的成键示意图
Ph + -2 Ph
-
+
-2
Ph
2e
6e
10e
( 6 –C7H8)Mo(CO)3
( 4–C7H8) Fe(CO)3
配体, C=C基本 上为双键
M-C成键,C-C 为 单键,R为强吸电子 基团(如CN),形成 metallocycles
一个桥羰基配体的电子对向每个桥联的金属贡献
一个电子
Noncarbonyldiiron Fe2(CO)9: 九羰基二铁 O C Fe C O O C Fe CO CO 3(CO) 6e 3(-CO) 3e Fe0 8e Fe-Fe 1e ---------------18e
OC OC OC
CO
Common ligands and their electron counts
FeCl2+ NaC5H5(THF, 苯) Fe(5–C5H5)2
2) C5H6 + FeCl2 .4H2O(DMF) + KOH(s)
Fe(5–C5H5)2 3) C5H6 + FeCl2 + NEt2H Fe(5–C5H5)2
反应
与亲电试剂反应, 例芳基上的乙酰化反应:
COCH3
(5–C5H5)2 Ti (CO)2 *(5–C5H5) V(CO)4 (5–C5H5)2M2(CO)6 (5–C5H5)2M2(-CO)4
(Ti, Zr, Hf) ( 四腿钢琴凳结构) ( M=Cr, Mo, W ) ( M=Cr, Mo )
(18e) (18e) (18e) (16e ?) (18e) (18e)
CO CO CO
5(CO) 10e Mn0 7e Mn-Mn 1e --------------18e
The electron pair of a bridging carbonyl ligand donates one electron to each of the bridged metals:
19 non-H atoms
O Dy
+ KCl +
Dy
K
O
Soxhlet in THF
O Dy O Cl
NaCp*
Dy
(COT)ErCp*
S.-D. Jiang, B.-W. Wang, H.-L. Sun, Z.-M. Wang, S. Gao, J. Am. Chem. Soc. 2011, 133, 4730.
4. 环戊二烯基–羰基化合物
Fe(CO)5+2 C5H6(二聚体) Fe2(5–C5H5)2(CO)4 + CO + H2 V(5–C5H5)2 +CO V(5–C5H5)(CO)4
O OC Fe C O C Fe CO
Fe2(5–C5H5)2(-CO)2 (CO)2
Fe-Fe键长:2.534Å
supplied by the ligands equals 18.
当金属d电子加上配体提供电子的总数为18时,
热力学稳定的过渡金属有机化合物即可形成。
The metal formally attains the electron configuration of the next higher noble gas [18 VE rule, also paraphrased as ―inert gas rule‖, ―effective atomic number (EAN) rule‖]
金属形式上得到下一个更高一级贵重气体的电子 构型 [18价电子规则,也释意为“惰性气体规则
”、“有效原子数(EAN)规则”]
The intramolecular partition of electrons has to ensure that the total complex charge remains unchanged.
M(5–C5H5)2 价电子数
V 15
Cr 16
Mn 17
Fe 18
Co 19
Ni 20
Fe(5–C5H5)2为抗磁性, 其他茂金属为顺磁性
茂金属的分子轨道图
D5h
D5d 相似
茂金属的前线分子轨道
若干茂金属的结构性质
配合物 (C5H5)2V (C5H5)2Cr (C5H5)2Mn (C5H5)2Fe (C5H5)2Co (C5H5)2Ni 价电子组态 未成对 电子 3 2 1 0 1 2 磁性 顺 顺 顺 反 顺 顺 D(M – C5H5) /kj.mol–1 69.9 76.1 / 84.2 80.1 75.4
4 3 4
环庚三烯(C7H8) 环辛四烯(C8H8)
M
M
环辛四烯(C8H8) 环丙烯基(C3H3) 降冰片烯(C7H8)
M
M
M
3 3,1 4 4 5, 3, 1
6
1 3 , 1 4 4 5, 3, 1
6
次烷基(carbine) -烯丙基(allyl) C3H5 1,3-丁二烯 C4H6 环丁二烯 C4H4 环戊二烯基 C5H5
Fe
+
COCH3 CH3COCl
Fe
CH3COCl
AlCl3
Fe
COCH3
与丁基锂的反应: Cp环上的H被 Li 取代
Li LiBu + Fe
Fe
+ C4H10
2. 茂金属 ( metallocene) 金属茂
茂金属的合成:
MXn+NaC5H5(THF or DMF) M(5–C5H5)2
Fluxional ferrocene 转动势垒低,~ 3.8kJ.mol–1
固态:交错型 D5d 气相:重叠型 D5h 室温时不规则,低温为D5
Common Types of Cp complexes:
Examples: Metallocenes
合成方法: C5H6 C5H5–
1) C5H6(二聚体) + Na (THF) C5H5– + Na+ + H2
